- Accueil
- volume 13 (2009)
- numéro 1
- Détermination de la région d'excrétion des substances rhizogènes chez Lumbricus terrestris L.
Visualisation(s): 2023 (9 ULiège)
Téléchargement(s): 221 (1 ULiège)
Détermination de la région d'excrétion des substances rhizogènes chez Lumbricus terrestris L.

Notes de la rédaction
Reçu le 23 juillet 2007, accepté le 6 mai 2008
Résumé
La section de Lumbricus terrestris L. au niveau du 40e métamère, basée sur l'examen de la répartition des différents orifices excréteurs sur sa surface corporelle, a permis de déterminer les régions du corps réellement impliquées dans la production de substances rhizogènes. Les analyses spectrophotométriques et les tests biologiques effectués sur Phaseolus vulgaris L. à partir des extraits des parties antérieures et postérieures du ver ont révélé que ces deux parties interviennent dans la production des composés indoliques. Cette production serait cependant plus importante au niveau de la partie postérieure du ver s'étalant du 40e métamère jusqu'au pygidium. Ce résultat laisse supposer que seuls les orifices excréteurs communs à tous les métamères sont impliqués dans cette production. Les analyses chromatographiques et spectrophotométriques effectuées à partir des empreintes dorsales et ventrales des excrétions cutanées, récoltées directement sur des plaques chromatographiques à partir de vers de terre vivants, ont révélé la présence des composés indoliques basiques sur toute la longueur du ver, particulièrement au niveau des empreintes des orifices excréteurs cœlomiques et urinaires.
Abstract
Determination of rhizogenous excretion area at Lumbricus terrestris L. The partition of the Lumbricus terrestris L., after the observation of different excretory orifices on its bodily surface at the 40th segment allowed to determine the body parts actually involved in the production of rhizogenous substances. Spectrophotometric analysis and biological tests conducted on Phaseolus vulgaris L. from worm's anterior and posterior extracts parts revealed that both parts participate in the production of indol-derived substances. However, this production may be more important at the level of the worm's posterior parts. It is therefore hypothesized that only those excretory orifices commun to all segments are involved in this production. Chromatographic and spectrophotometric analysis conducted on living worms from their dorsal and ventral prints of cutaneous excretions extracted directly from chromatographic plates, revealed the presence of basic indol-derived substances throughout the length of the worm, particularly at the level of coelomic and urinary excretory orifices.
Table des matières
1. Introduction
1Le rôle des vers de terre dans l'amélioration de la fertilité des sols n'est plus à démontrer. En effet, ces animaux en perpétuel déplacement dans la rhizosphère assurent l'aération et le brassage du sol. L'effet positif des vers de terre sur la production végétale est en partie expliqué par leur relation très étroite avec le système racinaire des plantes (Bouché et al., 1986 ; Hameed et al., 1993 ; Boersma et al., 1994 ; Parkin et al., 1994). Des études ont montré l'action positive des vers de terre sur la formation de microagrégats nécessaires à la stabilisation du carbone du sol ainsi qu'à la réduction des phénomènes de l'érosion par l'intensification de la percolation des eaux (Ge et al., 2001 ; Le Bayon et al., 2001 ; Scullion et al., 2002 ; Bossuyt et al., 2005 ; Pulleman et al., 2005). Les résultats d'autres chercheurs suggèrent que d'importantes communautés microbiennes, indispensables à la fertilité des sols, sont étroitement associées au tube digestif et aux organes excréteurs des vers (Stephen et al., 1994 ; Alphei et al., 1996). Ces microorganismes semblent jouer un rôle dans la dégradation des protéines et interviennent dans le cycle de l'azote (Furlong et al., 2002 ; Schramm et al., 2003 ; Horn et al., 2003 ; 2005 ; 2006a ; 2006b ; Davidson et al., 2006). Des composés organiques présentant des propriétés hormonales sur la croissance des plantes ont été mis en évidence dans les fèces de différentes espèces de vers de terre (Musscolo et al., 1999). Enfin, des substances rhizogènes ont été détectées et identifiées par notre laboratoire (El Harti et al., 2001a ; 2001b). Il s'agit de composés indoliques libérés dans les excrétions des vers et dont les effets sont similaires à ceux de l'acide indole acétique (AIA), phytohormone propre aux végétaux qui stimule la néoformation racinaire (rhizogénèse). La détection de ces composés à effet rhizogène a été facilitée par leurs propriétés physiques de fluorescence et d'absorbance en UV ainsi que par leurs propriétés biologiques caractéristiques.
2Le présent travail constitue le prolongement de nos investigations précédentes (El Harti et al., 2001a ; 2001b). Nous tenterons dans un premier temps de délimiter la région du corps de Lumbricus terrestris L. réellement impliquée dans la production des composés indoliques rhizogènes. Cette délimitation est effectuée par section du ver en deux parties. La section du ver à partir du 40e métamère a été déterminée après l'étude minutieuse de son anatomie externe. Nous tenterons de détecter les composés indoliques rhizogènes en comparant les spectres d'absorbance en UV des extraits méthanoliques des parties antérieures et postérieures du ver avec celui d'une solution méthanolique d'acide indole acétique (AIA), phytohormone de croissance, utilisée ici comme témoin. Egalement, nous testerons séparément l'effet rhizogène des deux régions du ver sur des plantules de haricot (Phaseolus vulgaris L.). Dans un deuxième temps, nous tenterons de délimiter la surface corporelle du ver dont les orifices sont directement impliqués dans cette production. Pour atteindre cet objectif, nous avons mis au point un protocole expérimental très adapté permettant la récolte, à partir de vers de terre vivants, des empreintes des excrétions cutanées sur des plaques chromatographiques. Des analyses chromatographiques et spectrophotométriques en UV ont été par la suite réalisées.
2. Matériel et méthodes
2.1. Délimitation des régions productrices de substances rhizogènes chez Lumbricus terrestris
3Principes. L'examen de la surface du corps du ver, de la tête au pygidium en passant par le soma, fait apparaitre plusieurs pores ou orifices d'excrétion susceptibles d'intervenir dans le cheminement des acides indoles produits par le ver. Ainsi, en dehors de la tête et du pygidium qui portent respectivement les orifices buccal et anal, c'est le soma qui porte le plus grand nombre d'orifices d'excrétion. Chaque métamère du soma possède une paire de néphridiopores, ou pores urinaires, sur sa partie ventrale à l'exception des trois premiers proches de l'orifice buccal et du dernier métamère entourant l'orifice anal. Aussi, chaque métamère du soma possède un pore cœlomique permettant l'évacuation du liquide cœlomique. La cuticule enrobant tous les métamères est perforée par de nombreux petits pores en relation avec les glandes épidermiques à l'origine du mucus de lubrification du ver. Dans le tiers antérieur du ver, on peut observer d'autres types d'orifices en relation avec l'activité reproductrice du ver : les orifices de la spermathèque (2 paires) et les 2 orifices sexuels mâles.
4Compte tenu de ces observations, on peut d'ores et déjà distinguer une partie antérieure (PA) du ver allant de la tête au 37e métamère dans laquelle on retrouve tous les orifices déjà cités, sauf bien entendu l'orifice anal et une partie postérieure (PP) du ver s'étalant du 38e métamère au pygidium. Dans cette dernière région, en plus de l'orifice anal, on retrouve uniquement les orifices communs à tous les métamères : pores urinaires, pores cœlomiques et micropores épidermiques. Nous vérifierons par spectrophotométrie la présence des composés indoliques dans les deux parties du corps des vers. Egalement, nous testerons leurs effets respectifs sur la stimulation de la rhizogénèse chez P. vulgaris.
5Protocole expérimental. Un lot de vers de terre a été récolté dans la subéraie de la Mamora au nord de Rabat (Maroc). Ces vers de terre sont préalablement tués au formol puis lavés à l'eau désionisée. On sectionne successivement les spécimens en deux parties au niveau du 40e métamère. Le poids frais total des parties antérieures ainsi que celui des parties postérieures est équilibré à 22 g, provenant d'environ une vingtaine de vers adultes. Ce poids frais est suffisant pour obtenir la quantité de composés indoliques rhizogènes nécessaire aux tests biologiques de la rhizogénèse (El Harti et al., 2001a ; 2001b). L'extraction des substances rhizogènes à partir des parties antérieures des vers est réalisée par macération dans 4 bains successifs de méthanol. Chaque bain de 50 ml dure 24 h. Les 4 macérats sont ensuite mélangés puis évaporés au rotavapeur à 40 °C. Le résidu sec obtenu est récupéré dans 20 ml de méthanol. On respectera la même procédure dans l'extraction des substances rhizogènes à partir des parties postérieures. Les deux extraits méthanoliques (2 x 20 ml) ainsi obtenus constitueront les solutions de départ de nos expériences. Une partie de chaque extrait méthanolique (1,5 ml) sera utilisée dans les examens spectrophotométriques, le reste sera utilisé lors des tests biologiques de la rhizogénèse.
6Examens spectrophotométriques. L'absorbance sous UV (200 à 400 nm) est réalisée à partir d'1 ml de chaque extrait méthanolique. On comparera les spectres d'absorbance avec ceux obtenus à partir d'une solution méthanolique d'AIA et à partir d'une solution d'extrait méthanolique total de vers (PA + PP) reconstituée par le mélange à volume égal (0,5 ml) des extraits méthanoliques des parties antérieures et postérieures. L'analyse spectrophotométrique en UV est réalisée sur un spectrophotomètre de type Varian techtron réglé à : 10 nm.mn-1 (Scanrate) ; 2,0 nm (Slit) ; 50 cm.H-1 (chart speed) ; 200 mv/FS (span).
7Tests biologiques (effet rhizogène) :
8Préparation des milieux de culture : les 18 ml d'extrait restant provenant respectivement des parties antérieures (PA) et postérieures (PP) sont réévaporés au rotavapeur (40 °C) et les résidus secs repris séparément dans 200 ml de milieu Hoagland à pH neutre (Hoagland et al., 1938). Les solutions ainsi obtenues constitueront les solutions mères. L'étude de l'effet de ces deux solutions mères sur la rhizogénèse de P. vulgaris est réalisée après dilutions successives dans le milieu Hoagland à pH neutre. Le protocole de préparation de la série de milieux PA (PA1,..., PA6) est représenté au tableau 1. Les milieux PP (PP1,..., PP6) ont été préparés selon le même protocole. Les milieux PA1 et PP1 sont considérés comme témoins puisqu'ils sont dépourvus d'extraits de ver.
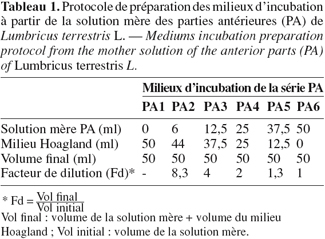
9Préparation des plantules : des graines de P. vulgaris sont mises à germer sur cuvettes de sable pendant 2 semaines à 22 °C. Au stade deux feuilles, on sélectionne les plantules les plus homogènes desquelles on élimine, à l'aide d'une lame de rasoir, les sources potentielles d'auxine (AIA) endogène. On commence par éliminer l'apex à 0,5 cm au-dessus de la zone d'insertion des deux premières feuilles, puis les cotylédons. Au moment de l'incubation, on élimine les racines par section de l'hypocotyle à 4 cm au-dessous de la zone d'insertion des cotylédons. Les plantules (6 par milieu) sont enfin plongées sur une hauteur de 4 cm dans les milieux d'incubation respectifs. Tous les milieux sont protégés de la lumière par du papier aluminium.
10Analyse statistique : l'estimation de la rhizogénèse sera limitée ici au comptage du nombre moyen de racines néoformées par plantule après 14 jours d'incubation dans les milieux respectifs. L'analyse statistique des résultats est réalisée à l'aide du logiciel SAS. La comparaison précise des traitements entre eux fait appel à la variance et aux méthodes de comparaison multiple des moyennes. Le test de Dunnett est adopté pour comparer l'effet des différents traitements par rapport aux milieux d'incubation témoins.
2.2. Délimitation de la surface corporelle productrice des composés indoliques rhizogènes
11Principes. Le principe de cette expérience consiste à récolter directement les excrétions cutanées d'un ver de terre vivant placé entre 2 plaques chromatographiques, l'une contre la face ventrale du ver (plaque inférieure), l'autre contre sa face dorsale (plaque supérieure). Les excrétions cutanées laissent sur les plaques respectives les empreintes ventrales et dorsales de la métamérie du corps, nettement visibles par leur fluorescence sous lampe UV à 366 nm. On étudiera le comportement chromatographique de ces empreintes par rapport à l'extrait total de vers. Egalement, on étudiera l'absorbance entre 300 et 200 nm des produits fluorescents aux RF nuls dans le système de solvant CA dont la composition est indiquée plus loin.
12Protocole expérimental. La réalisation de cette expérience nécessite 6 vers de terre adultes de poids moyen et 12 plaques chromatographiques, soit 2 plaques par spécimen. La procédure suivante est respectée pour les 6 séries :
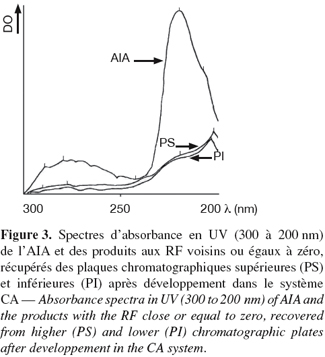
13Une 1re plaque chromatographique (plaque inférieure) est protégée par une feuille en plastique fin et rigide. Le plastique, de dimension légèrement supérieure à celle de la plaque, devrait empêcher provisoirement le contact entre la face ventrale du ver et la plaque chromatographique. On dépose sur le plastique une plaque de carton de même dimension que les plaques chromatographiques (10/10). L'épaisseur du carton ne doit pas dépasser la moitié du diamètre d'un ver de terre de taille moyenne, soit 2 à 3 mm d'épaisseur. A 3 cm de la base de la plaque cartonnée, on découpe horizontalement l'emplacement d'un ver de terre adulte de taille moyenne. C'est dans cet emplacement que sera étalé le ver de terre vivant, préalablement lavé à l'eau désionisée et séché sur papier filtre. Après avoir placé le ver, on recouvre l'ensemble par une 2e feuille en plastique identique à la première. Cette dernière devrait empêcher provisoirement le contact entre la face dorsale du ver qui fait légèrement saillie du carton et la 2e plaque chromatographique (plaque supérieure) que l'on déposera en dernier lieu, en juxtaposition avec l'ensemble. On retire doucement et simultanément les 2 feuilles en plastique de façon à ce que les faces ventrale et dorsale du ver entrent en contact respectivement avec les plaques chromatographiques inférieure et supérieure. On laisse le ver de terre en « sandwich » entre les 2 plaques pendant 5 à 10 min avant de retirer successivement la plaque supérieure, puis le ver de terre, le carton et la plaque inférieure. Les 2 plaques chromatographiques sont rapidement séchées. On vérifie sous UV (366 nm) l'émission de fluorescence des empreintes laissées par les excrétions cutanées dorsales et ventrales à 3 cm de la base des plaques. Dans les deux premières séries de l'expérience, on utilise des plaques de commerce (G60-SIF, 254 nm) de dimensions 10/10. Ce genre de plaques offre la possibilité de l'application des réactifs de Prochazka (Hais et al., 1958) dans la première série et Dragendorff modifié (Munier, 1951 ; 1953 ; Randerath, 1971) dans la deuxième série. Ces réactifs sont d'excellents révélateurs des alcaloïdes et des composés indoliques basiques à neutres. On étudiera les caractéristiques chromatographiques des empreintes dorsales et ventrales par rapport à l'extrait total de vers après développement chromatographique dans le système CA composé de chloroforme et d'acide acétique (96 %) aux proportions 95/5 (v/v) (Stahl et al., 1961). Ces plaques de commerce, utilisées ici seulement comme témoin pour comparaison, ne permettent pas la récupération des produits aux RF nuls car elles contiennent une substance fluorescente à 254 nm (SIF) qui interfère avec les composés indoliques fluorescents produits par le ver. C'est pour cette raison que, dans les quatre séries suivantes, on utilise des plaques préparatives à base de silice (Kiesel Gel G60) et d'amidon de riz (Remy products NV) aux proportions 15/1 dans 60 ml d'eau distillée chaude. A cette proportion, l'amidon consolide davantage la silice qui, employée seule, s'effrite facilement au moindre contact du ver de terre vivant avec la plaque. Des essais préliminaires ont montré qu'à cette proportion, l'introduction de l'amidon ne modifie pratiquement pas les RF des produits déjà calculés sur plaques de commerce ou sur plaques préparatives à base de silice seule. Ces plaques préparatives à base de silice et d'amidon ont permis la récupération des produits aux RF nuls après développement dans le système CA. Rappelons que c'est dans ce groupe de produits qu'ont été détectés des dérivés indoliques basiques à neutres (El Harti et al., 2001b). Les produits aux RF nuls provenant respectivement de l'ensemble des plaques préparatives supérieures (4) et inférieures (4) sont regroupés séparément puis solubilisés par macération de quelques heures dans du méthanol. Après filtration sur laine de verre, les filtrats sont évaporés au rotavapeur (40 °C) et les résidus secs respectifs sont repris chacun dans 1 ml de méthanol. On étudiera les spectres d'absorbance des 2 solutions entre 300 et 200 nm. On comparera ces spectres avec celui d'une solution méthanolique d'AIA.
3. Résultats
3.1. Analyse des spectres d'absorbance
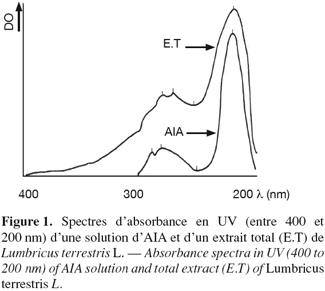
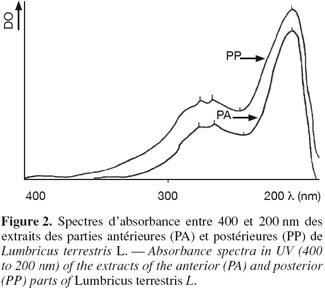
14Les spectres d'absorbances, réalisés en UV à partir d'une solution méthanolique d'AIA et de l'extrait total de vers, font apparaître des similitudes des profils d'absorbance entre 200 et 400 nm (Figure 1). Le spectre d'absorbance de l'AIA présente 3 pics d'absorbance caractéristiques à 290 nm, 281 nm et 221 nm avec une dépression importante à 245 nm. Le spectre de l'extrait total de vers présente également 3 pics d'absorbance à 281 nm, 272 nm et 219 nm. La dépression se situe à 254 nm. D'une manière générale, les zones d'absorbance des deux spectres se recouvrent assez bien en dépit des quelques différences structurales entre l'AIA et les dérivés indoliques détectés dans l'extrait de vers (El Harti et al., 2001b). La figure 2 représente les spectres d'absorbance, entre 400 et 200 nm, des extraits méthanoliques des parties antérieures (PA) et postérieures (PP) des vers. Les spectres en question sont d'une part identiques entre eux et d'autre part identiques à celui de l'extrait méthanolique total de vers. Les 3 spectres recouvrent celui obtenu à partir de la solution d'AIA.
3.2. Tests de la rhizogénèse
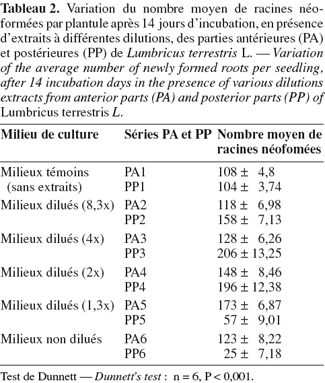
15Les tests biologiques réalisés respectivement à partir des extraits provenant des parties postérieures (PP) et antérieures (PA) de vers font apparaitre les résultats indiqués dans le tableau 2. Dans les 2 cas, on assiste à une stimulation de la rhizogénèse qui se traduit par l'augmentation du nombre moyen de racines néoformées par plantule après 14 jours d'incubation. Le nombre de racines augmente au fur et à mesure que la concentration en extraits augmente. Quand le facteur de dilution des milieux d'incubation est inférieur à 2, ce nombre diminue sensiblement, particulièrement dans les milieux à base d'extrait provenant des parties postérieures des vers. L'analyse de la variance montre que l'effet des traitements PA et PP est très hautement significatif (P < 0,001) par comparaison aux milieux témoins dépourvus d'extraits (PA1 et PP1). L'effet rhizogène de l'extrait des parties postérieures est supérieur à celui obtenu à partir de l'extrait des parties antérieures. En effet, la moyenne maximale des racines néoformées est obtenue en milieu PP3 dilué 4 fois alors qu'en présence des milieux provenant des parties antérieures, la moyenne maximale est atteinte en milieu PA5 dilué 1,3 fois seulement, soit une différence de dilution de 2,7 fois. On peut donc conclure que les milieux constitués à partir des parties postérieures contiendraient 2,7 fois plus de composés indoliques rhizogènes que les milieux provenant des parties antérieures. L'inhibition racinaire accompagnée d'effets toxiques constatée dans les milieux les plus concentrés (dilution faible) apparait plus rapidement dans les milieux d'extrait des parties postérieures (milieu PP5 dilué 1,3 fois) que dans les milieux d'extrait des parties antérieures (milieu PA6 non dilué). Rappelons au passage que l'AIA administré à forte dose (10-2 g.l-1) provoque une inhibition de la néoformation des racines avec des indices de toxicité similaires (El Harti et al., 2001a).
3.3. Analyse des empreintes des vers
16L'étude du comportement chromatographique des empreintes des excrétions cutanées dorsales (plaques supérieures) et ventrales (plaques inférieures) de L. terrestris fait apparaitre des similitudes dans les profils chromatographiques entre les plaques supérieure et inférieure. En effet, dans le système CA, les empreintes fluorescentes de la métamérie qui marquent l'emplacement initial du ver à 3 cm de la base des plaques migrent de la même façon. On voit apparaitre exactement les mêmes produits fluorescents (RF = 0,00 ; 0,22 ; 0,63) que ceux séparés dans le même système (CA) à partir de l'extrait total de vers (El Harti et al., 2001b). L'application du réactif de Prochazka (1re série de plaques) et de Dragendorff (2e série de plaques) donne des réactions positives uniquement au niveau des produits au RF nul dans le système CA, comme c'est d'ailleurs le cas à partir de l'extrait total de vers (El Harti et al., 2001b). Ces réactions apparaissent sous forme de points minuscules de couleur rouge brique à marron tout au long de la métamérie fluorescente des empreintes dorsales et ventrales. Dans la plaque supérieure, on voit apparaitre un seul point minuscule par empreinte dorsale de chaque métamère qui correspondrait à l'empreinte du pore cœlomique. Dans la plaque inférieure apparaissent deux points minuscules par empreinte ventrale de chaque métamère. Ces deux points correspondraient aux deux néphridiopores ventraux. L'étude des spectres d'absorbance en UV des produits aux RF nuls, récupérés séparément des plaques préparatives inférieures (4) et supérieures (4) provenant des dernières séries d'expériences (3e, 4e, 5e et 6e) a donné les résultats exposés dans la figure 3. L'absorbance entre 300 à 200 nm est identique pour les 2 groupes de produits. Les spectres obtenus se confondent largement, même s'ils sont légèrement décalés de quelques nanomètres dans la zone comprise entre 200 et 210 nm. Comme pour l'extrait méthanolique total de vers (Figure 1), on distingue deux zones d'absorbance majeures. La 1re moins importante se situe entre 300 et 250 nm ; la 2e plus importante se situe entre 240 et 220 nm. Une dépression séparant les deux zones d'absorbance se situe à 245 nm. Les pics des deux zones d'absorbance se situent respectivement à 290, 281, 221 et 205 nm. D'une manière générale, les zones d'absorbance des deux spectres recouvrent assez bien celles de l'AIA utilisé comme témoin. Aussi, elles recouvrent celles enregistrées à partir de l'extrait total de vers, même si certains pics de faible absorbance sont à peine visibles à 290 et 281 nm. Cette faible absorbance serait liée à la faible concentration des composés indoliques aux RF nuls, récupérés des deux plaques à partir des seules empreintes cutanées.
4. Discussion
17Nos connaissances sur l'anatomie de L. terrestris nous ont permis de considérer une partie antérieure du ver allant de la tête jusqu'au 39e métamère et incluant le clitellum, et une partie postérieure allant du 40e métamère jusqu'au pygidium. Les extraits méthanoliques des parties antérieures et postérieures des vers montrent des spectres d'absorbance en UV similaires à celui d'une solution méthanolique d'AIA. Ils sont également similaires à celui de l'extrait méthanolique total. Les quatre spectres présentent cependant des intensités d'absorbance différentes malgré des facteurs de dilution équivalents. En effet, l'extrait des parties postérieures de vers présente, sur toutes les longueurs d'ondes, des absorbances supérieures à celles enregistrées à partir de l'extrait des parties antérieures et de l'extrait total de vers. Sachant que l'extrait total de vers a été reconstitué par le mélange à volume égal des extraits des parties postérieures et antérieures, on peut penser que la quantité de composés indoliques, plus importante dans les parties postérieures qu'antérieures, a été diluée dans l'extrait total de vers suite à ce mélange. Les tests biologiques de la rhizogénèse réalisés sur P. vulgaris confirment d'ailleurs ce résultat. Ainsi, pour le même facteur de dilution, l'effet rhizogène de l'extrait des parties postérieures est nettement supérieur à celui obtenu à partir de l'extrait des parties antérieures. Cet effet est également supérieur à celui enregistré par notre laboratoire à partir de l'extrait brut total de vers (El Harti et al., 2001b). Les effets toxiques et inhibiteurs sur la rhizogénèse, caractéristiques d'un excès de composés indoliques, sont également plus importants dans les milieux concentrés en extraits des parties postérieures. D'ailleurs, ces effets similaires à ceux enregistrés par notre laboratoire en présence d'un excès d'AIA (El Harti et al., 2001a) sont également plus intenses que ceux observés dans les milieux concentrés en extrait brut total de vers (El Harti et al., 2001b).
18Compte tenu de ces résultats complémentaires, obtenus aussi bien par les tests biologiques que par les analyses spectrophotométriques, on peut conclure que l'excrétion des dérivés indoliques par L. terrestris se ferait sur toute la longueur du corps du ver avec cependant une production plus importante au niveau des parties postérieures. Partant de ces résultats et de nos connaissances sur l'anatomie externe des vers, on peut supposer dans un premier temps que les substances rhizogènes seraient produites au niveau des orifices communs à tous les métamères, à savoir les pores urinaires, les pores cœlomiques ou les micropores épidermiques. Ce résultat permettrait d'écarter l'implication des orifices liés à la reproduction se trouvant uniquement dans la partie antérieure du ver. Par ailleurs, l'analyse chromatographique et spectrophotométrique des empreintes des secrétions cutanées laissées sur les plaques chromatographiques par les vers de terre vivants apporte des informations concordantes et complémentaires aux précédentes. La production de composés indoliques se ferait donc sur toute la longueur des vers, aussi bien sur la face dorsale que ventrale du corps. Les composés indoliques neutres à basiques aux RF nuls ont été mis en évidence uniquement au niveau des empreintes des orifices cœlomiques dorsaux et au niveau des empreintes des orifices urinaires ventraux. Les micropores épidermiques ne seraient donc pas impliqués dans cette production et leur rôle se limiterait à la production du mucus de lubrification du ver (Grassé, 1961). Ainsi, la production des substances rhizogènes par L. terrestris ne serait donc pas limitée aux fèces seulement (Muscolo et al., 1999) mais se ferait également sur toute la surface corporelle du ver.
19L. terrestris est un ver anécique en perpétuel déplacement dans la rhizosphère. Ce déplacement contribue à l'amélioration de la fertilité du sol par son aération et le brassage de ses constituants d'une part, et par la stimulation des processus de minéralisation et d'humification d'autre part. Il apporte également des substances rhizogènes qui peuvent être considérées comme des fertilisants naturels. Ainsi, la stimulation de la rhizogénèse pourrait expliquer en partie l'amélioration de la production végétale, après introduction raisonnée de vers de terre, dans des sols initialement pauvres ou fragiles tels que les polders (Rhee, 1969a ; 1969b ; Marinissen, 1994). En outre, cette production de composés indoliques par les vers de terre permettrait à ces derniers de contribuer à la stimulation de la production des racines qui seront utilisées comme abris humides nécessaires à leur épanouissement. Ces racines, une fois mortes, constitueraient également une source de nourriture très convoitée par les lumbricidae (Ferrière, 1980 ; Cortez et al., 1992).
Bibliographie
Alphei J., Bonkowski M. & Scheu S., 1996. Protozoa nematoda and lumbricidae in the rhizosphere of Hordelymus europaeus (poaceae). Faunal interaction response of microorganisms and effects on plant growth. Oecologia, 106, 111-112.
Boersma O.H. & Kooistra M.J., 1994. Difference in soil structure of silt loam typic fluvagents under various agricultural management practices. Agric. Ecosystem Environ., 51(1-2), 21-42.
Bossuyt H., Six J. & Hendrix P.F., 2005. Protection of soil carbon by microaggregates within earthworm casts. Soil Biol. Biochem., 37(2), 251-258.
Bouché M.B. & Ferrière G., 1986. Cinétique de l'assimilation de l'azote d'origine lombricienne par une végétation prairiale non perturbée. C. R. Acad. Sci., Ser. III, Sci. Vie, 302, 75-80.
Cortez J. & Bouché M.B., 1992. Do earthworms eat living roots? Soil Biol. Biochem, 24(9), 913-915.
Davidson S.K. & Stahl D.A., 2006. Transmission of nephridial bacteria of the earthworm Eisenia fetida. Appl. Environ. Microbiol., 72(1), 769-775.
El Harti A., Saghi M., Molina J.A.E. & Teller G., 2001a. Production d'une substance rhizogène à effet similaire à celui de l'acide indole acétique par le ver de terre Lumbricus terrestris. Can. J. Zool., 79, 1911-1920.
El Harti A., Saghi M., Molina J.A.E. & Teller G., 2001b. Production de composés indoliques rhizogènes par le ver de terre Lumbricus terrestris. Can. J. Zool., 79, 1921-1932.
Ferrière G., 1980. Fonctions des lombriciens. VII. Une méthode d'analyse de la matière organique végétale ingérée. Pedobiologia, 20, 263-273.
Furlong M.A., Singleton D.R., Coleman D.C. & Whitman W.B., 2002. Molecular and culture-based analyses of prokaryotic communities from an agricultural soil and the burrows and casts of the earthworm Lumbriscus rubellus. Appl. Environ. Microbiol., 68(3), 1265-1279.
Ge F. et al., 2001. Water stability of earthworm casts in manure-and inorganic-fertilizer amended agroecosystems influenced by age and depth. Pedobiologia, 45(1), 12-26.
Grassé P.P., 1961. Traité de zoologie. Anatomie, systématique, biologie. Tome V. Fascicule I. Paris : Editions Masson et Cie.
Hais I.M. & Macek K., 1958. Handbuch der Papier Chromatographie. Jena, Germany: Gustav Fischer Verlag.
Hameed R., Cortez J. & Bouché M.B., 1993. Biostimulation of Lolium perenne L. growth with nitrogen excreted by Lumbriscus terrestris L. Flow measurement in the laboratory. Soil Biol. Biochem., 26, 483-493.
Hoagland D.R. & Arnon D.I., 1938. The water culture method for growing plants without soil. California Agric. Exp. Stn Circ., 347.
Horn M.A., Schramm A. & Drake L.D., 2003. The earthworm gut: an ideal habitat for ingested N2O-producing microorganisms. Appl. Environ. Microbiol., 69(3), 1662-1669.
Horn M.A. et al., 2005. Dechloromonas denitrificans sp. Nov., Flavobacterium denitrificans sp. Nov., Paenibacillus anaericanus sp. Nov. and Paenibacillus terrae strain MH72, N2O-producing bacteria isolated from the gut of the earthworm Aporrectodea caliginosa. Int. J. Syst. Evol. Microbiol., 55, 1255-1265.
Horn M.A. et al., 2006a. In vivo emission of dinitrogen by earthworms via denitrifying bacteria in the gut. Appl. Environ. Microbiol., 72(2), 1013-1018.
Horn M.A., Drake H.L. & Schramm A., 2006b. Nitrous oxide reductase genes (nosZ) of denitrifying microbial populations in soil and the earthworm gut are phylogenetically similar. Appl. Environ. Microbiol., 72(2), 1019-1026.
Le Bayon R.C. & Binet F., 2001. Earthworm surface casts affect soil erosion by runoff water and phosphorus transfer in a temperate maize crop. Pedobiologia, 45(5), 430-442.
Marinissen J.C.X., 1994. Earthworm populations and stability of soil structure in a silt loam soil of a recently reclaimed polder in The Netherlands. Agric. Ecosystems Environ., 51(1-2), 75-87.
Munier R., 1951. Paper partition microchromatigraphy of alkaloids and various biological nitrogenous bases. IV. Separation of some derivatives of nicotinic acid and tryptophan. Bull. Soc. Chim. Biol., 33(7), 857-861.
Munier R., 1953. Separation of alkaloids from their N-oxides by paper chromatography. Bull. Soc. Chim. Biol., 35(10), 1225-1291.
Muscolo A., Bovalo F., Gionfiddo F. & Nardi S., 1999. Earthworm humic matter produces auxin-like effects on Daucus carota cell growth and nitrate metabolism. Soil Biol. Biochem., 31, 1303-1311.
Parkin T.B. & Berry E.C., 1994. Nitrogen transformation associated with earthworms casts. Soil Biol. Biochem., 26, 1233-1238.
Pulleman M.M. et al., 2005. Earthworms and management affect organic matter incorporation and microaggregate formation in agricultural soils. Appl. Soil Ecol., 29(1), 1-15.
Randerath K., 1971. Alcaloïdes, amines et autres composés basiques dans la chromatographie sur couches minces. 2e éd. Paris : Gauthier Villars, 87-109.
Rhee J.A. & Van, 1969a. Inoculation of earthworms in a newly drained polder. Pedobiologia, 9(1-2), 128-132.
Rhee J.A. & Van, 1969b. Development of earthworm populations in polder soils. Pedobiologia, 9(1-2), 133-140.
Schramm A. et al., 2003. Acidovorax-like symbionts in the nephridia of earthworms. Environ. Microbiol., 5(9), 804-809.
Scullion J., Neale S. & Philipps L., 2002. Comparisons of earthworm populations and cast properties in conventional and organic arable rotations. Soil Use Manage., 18(S1), 293-300.
Stahl E. & Kaldewey H., 1961. Spurenanalyse physiologisch aktiver, einfacher Indolderivate. Hoppe-seyler's. Z. Physiol. Chem., 323, 182-191.
Stephens P.M., Davoren C.W., Ryder M.H. & Double B.M., 1994. Influence of the earthworm Aporrectodea trapezoides (Lumbricidae) on the colonization of alfalfa (Medicago sativa L.) roots by Rhizobium meliloti L5-30R and the survival of R. meliloti L5-30R in soil. Biol. Fertil. Soils, 18, 63-70.
Pour citer cet article
A propos de : Abdellatif El Harti
Ecole Normale Supérieure (ENS). Laboratoire de Biologie végétale et Biochimie. Avenue Med Belhassan El Ouazani. Takaddoum. BP 5118. MA-Rabat (Maroc). E-mail : elharti.abdel@yahoo.fr
A propos de : Mohamed Raouane
Ecole Normale Supérieure (ENS). Laboratoire de Biologie végétale et Biochimie. Avenue Med Belhassan El Ouazani. Takaddoum. BP 5118. MA-Rabat (Maroc).





