- Accueil
- N° 208 (mai 2023)
- Aperçu sur la connaissance actuelle de la flore vasculaire de la région de Filfila (Nord-est algérien)
Visualisation(s): 2059 (41 ULiège)
Téléchargement(s): 92 (0 ULiège)
Aperçu sur la connaissance actuelle de la flore vasculaire de la région de Filfila (Nord-est algérien)

Document(s) associé(s)
Version PDF originaleRésumé
Cette étude concerne les plantes vasculaires nouvellement signalées dans la région de Filfila (Nord-Est algérien). Au total vingt taxons indigènes et cinq xénophytes sont nouvellement décrits dans cette région. Ces nouvelles données chorologiques soulignent l'importance de la conservation de la région d’étude et de la préservation de la biodiversité globale de l’Algérie.
Abstract
This study concerns newly reported vascular plants in the region of Filfila (North-East Algeria). A total of twenty native taxa and five xenophytes are newly described from this region. These new chorological data underline the importance of the conservation of the study region and the preservation of the overall biodiversity of Algeria.
Table des matières
1________________________________________________________
21Département de Biologie, faculté des Sciences, Université Badji Mokhtar Annaba, Algérie, 23000. Courriels : tarek_hamel@yahoo.fr; slim23000@hotmail.fr; boulemtafesamir@yahoo.fr
32Université Badji Mokhtar, 12 rue Hassi Beida, Annaba, Algérie, 23000. Courriel :
53Direction Générale des Forêts (DGF), Skikda, Algérie, 21000. Courriel :
74Laboratoire Agriculture et Fonctionnement des Ecosystèmes, Faculté des Sciences de la Nature et de la Vie, Université Chadli Bendjedid, BP 73, 36000 El Tarf, Algérie. Courriels :
8b_lamiadz94@yahoo.fr ; telailia-salah@univ-eltarf.dz
INTRODUCTION
9De par l’importance de sa biodiversité, le bassin méditerranéen est l’un des 34 « Hotspots de Biodiversité » répartis à travers le monde (Médail & Myers, 2004). Cette région présente une grande richesse spécifique, un fort taux d’endémisme et des menaces anthropiques grandissantes (Myers, 1988; 1999 ; Myers et al., 2000).
10En Algérie, Quézel & Santa (1962) ont distingué divers secteurs et sous-secteurs biogéographiques basés sur leur composition floristique. La Numidie est l’un d’entre eux et fait également partie d’un point chaud de biodiversité reconnu au sein du Hotspot méditerranéen (Véla & Benhouhou, 2007).
11Dans ce présent travail, nous proposons des informations, en particulier biogéographiques, pour 25 espèces (20 espèces spontanées et 5 espèces xénophytes) mentionnées pour la première fois en Numidie occidentale (région de Filfila, Nord-Est algérien). Ainsi, nous venons mettre à jour leur répartition et donner des précisions relatives aux nouvelles stations d’après des explorations de plus de dix ans.
MATÉRIEL ET MÉTHODES
12La présente étude se base sur un ensemble de prospections botaniques des falaises, des dunes maritimes et du massif forestier de Filfila réalisées depuis 2000. Il concerne pour l’essentiel la côte de Filfila (plage Kef Fatima, 2ème rocher Guerbes, plage Saint Louis, et l’embouchure d’Oued Leksob), son cordon dunaire avec ses milieux humides (agglomération de Filfila, Oued Leksob, Oued Righa et Bouzaaroura) et le massif forestier avec ses ripisylves (Carrière de Filfila, Col Besbes, Lemnadjer, Dem El Begrat, Oued Saboun et Oued de Marbouba) (Fig. 1; Tab. 1).
13Les caractéristiques physiographiques principales (coordonnées géographiques et altitude) sont synthétisées dans le tableau 1. La nomenclature retenue est celle de l’African Plant Database (APD, 2022). L’identification du matériel récolté s’appuie sur la flore d’Algérie (Quézel & Santa, 1962-1963), la flore de Maire (1952-1987) et la flore d’Italie (Pignatti, 1982). Ces espèces nouvelles pour la Numidie occidentale (plus précisément non citées dans le sous-secteur K3 par Quézel & Santa, 1962, 1963) seront abordées une par une aux points de vue écologique et taxonomique.
14Tab. 1. Liste des localités échantillonnées avec la bibliographie
correspondante
|
N° |
Localité |
Latitude et longitude |
Altitude (m) |
Données bibliogra-phiques |
|
1 |
2ème rocher Guerbes |
36°55'3"N ; 7°9'48"E |
7 |
(Saci et al., 2022) |
|
2 |
Agglomération de Filfila |
36°54'8"N; 7°2'56"E |
26 |
— |
|
3 |
Bouzaaroura |
36°53'30"N; 7°1'47"E |
68 |
— |
|
4 |
Carrière de Filfila |
36°53'10"N; 7°5'7"E |
124 |
— |
|
5 |
Col Besbes |
36°52'48"N; 7°7'9"E |
377 |
— |
|
6 |
Dem El Begrat |
36°51'49"N; 7°12'40"E |
85 |
— |
|
7 |
Embouchure d’Oued Leksob |
36°54'1"N; 7° 2'8"E |
5 |
(Saci et al., 2022) |
|
8 |
Lemnadjer |
36°53'50"N; 7°8'35"E |
121 |
— |
|
9 |
Oued de Marbouba |
36°53'22"N; 7°5'33"E |
182 |
— |
|
10 |
Oued Leksob |
36°53'60"N; 7°2'10"E |
12 |
(Hamel et al., 2020a; Saci et al., 2021) |
|
11 |
Oued Righa |
36°53'48"N; 7°3'54"E |
54 |
— |
|
12 |
Oued Saboun |
36°54'25"N; 7°7'12"E |
25 |
(Hamel et al., 2020b) |
|
13 |
Plage Kef Fatima |
36°56'32"N; 7°12'7"E |
18 |
(Saci et al., 2022) |
|
14 |
Plage Saint Louis |
36°54'27"N; 7°7'13"E |
7 |
— |
|
15 |
Plage Sofia |
36°54'37"N; 7°8'30"E |
17 |
— |
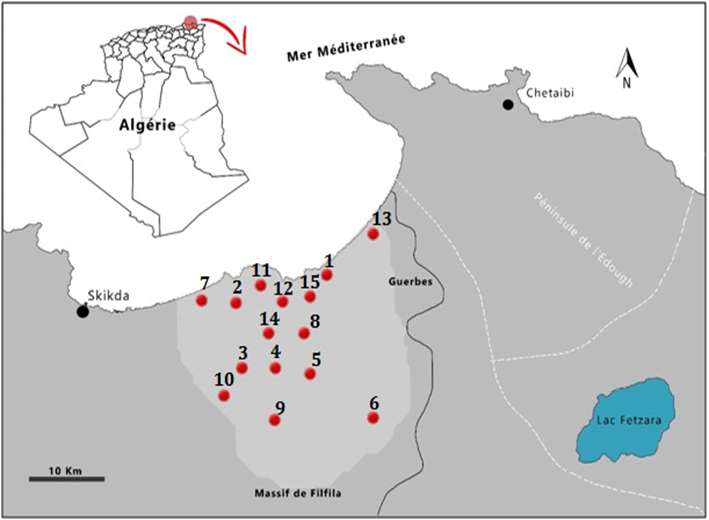
15 Fig. 1. Localisation des stations d’observation
RÉSULTATS
16Nos explorations botaniques dans la région de Filfila, nous ont permis de découvrir de nouvelles stations pour 25 taxons (20 taxons spontanés et 5 taxons xénophytes), dont deux nouveaux pour l’Algérie (Allium porrum L. subsp. polyanthum (Schult. & Schult. f.) Jauzein & J.-M. Tison et Scrophularia frutescens L.) et un nouveau pour l’Afrique du Nord Leucojum aestivum L. subsp. pulchellum (Salisb.) Briq.) (Tab. 2). Les taxons que nous avons identifiés restent globalement rares (c’est le cas pour 17 espèces) dans la région et la majorité d’entre eux n’ont été rencontrés qu’une seule fois.




DISCUSSION
17Vingt taxons peuvent être considérés comme nouveaux pour le sous-secteur Numidie (au sens de Quézel & Santa 1962). Toutes ces nouvelles observations confirment que la région de Filfila peut constituer une mini-zone importante pour les plantes (ZIP), bien individualisée, créant ainsi un continuum géographique et écologique avec la ZIP de Guerbès déjà identifiée plus au sud (Benhouhou et al., 2018, Hamel et al., 2020 a & b).
18En termes de biogéographie, deux espèces ont été nouvellement observées dans cette partie de la Numidie (Leucojum aestivum L. subsp. pulchellum (Salisb.) Briq. et Tuberaria acuminata (Viv.) Grosser). La présence de ces taxons s’explique par les anciennes connexions entre le Tell algérien et la Tyrrhénie (Quézel, 1964). De nouvelles localités de deux endémiques algériennes (Drimia anthericoides (Poir.) Véla & de Bélair et Limonium fradinianum (Pomel) Erben).
19Trois espèces endémiques algéro-tunisiennes (Andryala nigricans Poir., Bunium crassifolium (Batt.) Batt. et Convolvulus durandoi Pomel) ont été recensées dans la région de Filfila. La présence de ces espèces, endémiques frontalières, et qui sont rares selon Quézel & Santa (1963), ne concorde ni avec «des zones d’hyperendémisme spécialisé» puisque leur aire de répartition est relativement large, ni avec de «vastes zones biogéographiques où les espèces endémiques sont localement peu rares voire abondantes» (sensu Véla & Benhouhou, 2007) puisqu’elles sont rares.
20Un seul taxon endémique de l’Afrique du Nord-Ouest (Algérie, Tunisie et Maroc) (Bellis prostrata Pomel) est signalé dans cette étude. Selon Quézel (1964), cette ressemblance de l’endémisme entre les pays est le résultat de leur histoire commune générant une unité biogéographique très homogène. A l’exception de cinq nouveaux taxons xénophytes (Amaranthus viridis L., Anredera cordifolia (Ten.) Steenis, Bidens aurea (Aiton) Sherff, Ibicella lutea (Lindl.) Van Eselt. et Senecio angulatus L. f.), la totalité des espèces nouvelles découvertes dans la région d’étude sont des plantes spontanées, dont neuf espèces sont d’origine méditerranéenne, une d’origine tropicale, une subcosmopolite et une ibéro-maghrébine.
21Sur le plan de leur distribution, trois plantes (Convolvulus durandoi Pomel, Drimia anthericoides (Poir.) Véla & de Bélair et Scrophularia frutescens L.) ont été observées dans une aire restreinte (occurrence entre 100 km² et 5000 km²). Quant aux deux endémiques ponctuelles Leucojum aestivum L. subsp. pulchellum (Salisb.) Briq. et Tuberaria acuminata (Viv.) Grosser, sont présentes dans une aire commune de moins de 100 km² (Yahi et al., 2012, Hamel et al., 2020a, Saci et al., 2021).
22La flore étudiée compte 17 espèces rares sensu Quézel & Santa (1962-1963). Sur l’ensemble des taxons observés, trois sont inscrits sur la liste rouge de l'UICN (2022), tandis que quatre espèces sont protégées par le Décret exécutif n°12-03, des espèces végétales non cultivées protégées en Algérie (JORA, 2012).
23Allium porrum L. subsp. polyanthum (Schult. & Schult. f.) Jauzein & J.-M. Tison (Fig. 2a, b)
24Contrairement à la vraie sous espèce porrum, ce taxon possède des étamines ne dépassant pas 1,5 fois la longueur du périanthe à l’extension maximale. Son pollen est subparfait à absent avec tous les degrés d’avortement possibles (Jauzein & Tison, 2005).
25Le poireau des vignes est connu au Maroc et en Tunisie (Dobignard & Chatelain, 2010). En Algérie, la plante n’est pas citée dans les anciennes flores (Battandier & Trabut, 1884; Battandier & Trabut, 1895; Battandier, 1910, 1919). Toutefois, Maire (1958 : 253) inclut deux variétés pour Allium rotundum L. subsp. eu-rotundum: les var. typicum et var. polyanthum. Cependant Quézel & Santa (1962 : 213) signalent un seul taxon (A. rotundum L. subsp. multiflorum (Desf.) Rouy) pour Oran (Nord-Ouest algérien). La présence de deux localités maghrébines (Maroc et Tunisie) suggère plutôt un statut d’autochtone pour cette espèce en Algérie.
26Ce taxon est peu commun en Numidie occidentale, il a été recensé sur le petit escarpement rocheux de la carrière de Filfila et sur quelques placages terricoles au pied de rochers situés sur la croupe sud-orientale du Col Besbes (Hamel T., obs. pers., mai 2020).
27Anchusa aggregata Lehm. (Fig. 2c)
28Il s’agit d’une petite Borraginacée annuelle à inflorescence en cyme très contractée et presque capituliforme. Cette buglosse semble rare en Algérie puisqu’une seule localité est connue (cf. Quézel & Santa, 1963), mais elle a pu passer inaperçue. Les deux stations de Filfila sont nouvelles (Saci A., Hamel T. & de Bélair G., obs. pers., février 2020), et l’espèce a été découverte en petites populations sur les sables maritimes et sous le couvert de maquis à genévrier (Juniperus phoenicea L.) et filaire (Phillyrea latifolia L.). Une station moins importante a également été repérée à la plage Jeanne d’Arc (E. Véla, obs. pers. 17-03-2006).
29Andryala cossyrensis Guss. (Fig. 2d)
30Cette plante tomenteuse mais de couleur verte est proche d’Andryala integrifolia L. avec laquelle elle peut se confondre. Sa distribution en Algérie est toutefois restreinte à trois secteurs biogéographiques (K2, H et SC) où elle est rare. Dans les deux sites d’observation, l’espèce est assez répandue sur les dunes plus ou moins humides et en lisière de maquis.
31Les travaux de Ferreira et al. (2015) montrent que A. integrifolia, A. laxiflora, A. arenaria, A. cossyrensis et A. dentata ne forment pas un groupe monophylétique et que l'évaluation de ces trois derniers au niveau sous-spécifique proposée par certains auteurs (Emberger & Maire, 1941; Pignatti, 1982) n'est pas acceptable. A. cossyrensis présente une répartition dans le Nord-Ouest de l'Afrique, en Sicile et à Pantelleria.
32Andryala nigricans Poir. (Fig. 2e)
33Sur le plan biogéographique, Andryala nigricans est un taxon endémique algéro-tunisien, à aire de distribution mondiale très restreinte (Dobignard & Chatelain, 2011). Historiquement, ce taxon a été signalé par Desfontaines à La Calle et par Pomel à Kamart en Tunisie (Battandier & Trabut, 1888). De même, Quézel & Santa (1963) signalent ce taxon à l’extrême Est algérien autours de Bône, Cap Rosa et La Calle. En revanche aucune autre station n’a pu être découverte plus à l’ouest de la péninsule de l’Edough (cf. Quézel & Santa, 1963). Dans notre région d'étude, la population de l’espèce observée est très réduite, elle s’élève à cinq pieds isolés avec une faible régénération à cause de la fréquentation de la plage Sofia durant la période estivale.
34La présence de ce taxon, protégé à l’échelle nationale (cf. J.O.R.A, 2012), implique donc une surveillance et une protection actives de la part des chargés de la dynamique des populations et de l’état de conservation de leur habitat.
35Anthemis maritima L. subsp. maritima (Fig. 2f)
36Ce taxon méditerranéen est noté comme assez commun sur les sables littoraux de petite et grande Kabylie (Quézel & Santa, 1963), mais pas au–delà. Il est pourtant bien dispersé en Numidie, sur des substrats sableux, graveleux ou encore rocheux (schistes, molasses) avec lithosol sablonneux (Boulemtafes et al., 2018, Hamel et al., 2022). Dans la région de Filfila, il a été vu sur les falaises maritimes de Sofia et la plage Saint Louis où il semble assez commun. Toutefois, cette observation semble nouvelle pour le littoral numidien (Hamel et al., 2013; Boulemtafes et al., 2018; Hamel et al., 2022).
37Antirrhinum tortuosum Bosc ex Vent. (Fig. 2g)
38La présence d’Antirrhinum tortuosum [= A. majus L. subsp. tortuosum (Bosc.) Rouy] ne semble jamais avoir été notée ni en Numidie orientale, ni dans les Kabylies ou dans le Centre algérien (Quézel & Santa, 1963). Ce taxon est bien présent en Numidie occidentale puisqu’il a été observé en 2008 sur la corniche littorale de Stora (Skikda) (Véla, 2008). Ce muflier est fréquemment planté dans les jardins privés en raison de ses qualités ornementales et de sa rusticité, ce qui pourrait expliquer ses observations récentes.
39Bellis prostrata Pomel (Fig. 2.h)
40La nouvelle station à Oued Leksob étend l’aire de distribution de cette espèce, puisqu’elle n’était jusque-là connue que dans les mares de La Calle et Senhadja (Pomel, 1875; Maire, 1936; Quézel & Santa, 1963). Cette station semble la première à vocation forestière en Afrique du Nord, alors que cette espèce est relativement constante dans les habitats humides des plaines (Rhazi et al., 2010). La population observée peut être estimée à une dizaine de pieds installés sur un sol très humide.
41Bunium crassifolium (Batt.) Batt. (Fig. 2.i)
42Taxon intéressant sur le plan biogéographique, le Bunium crassifolium est une espèce endémique à distribution Nord-Est algérienne, avec une localité à Korbous en Tunisie. Selon Quézel & Santa (1963), l’espèce est très rare en Algérie orientale, sur les roches calcaires de Cap de Garde et La Calle. S’il est rare sur les falaises calcaires plus ou moins humides où plusieurs stations ont été recensées à la péninsule de l’Edough (Hamel, 2013; Hamel et al., 2013), il semble très rare en petite Kabylie (K2) puisqu’une seule autre localité est connue à Jijel (Khennouf et al., 2018). La chorologie de ce taxon méconnu, en limite nord-occidentale de distribution, mériterait d’être précisée.
43Convolvulus durandoi Pomel (Fig. 2.j)
44Il semble que ce taxon endémique algéro-tunisien n’ait jamais été observé en dehors de ses stations classiques: La Calle sur le secteur K3, Djebel Ouach sur le secteur Cl du Tell constantinois et Mitidja dans le sous-secteur Al - Algérois-littoral. On peut émettre l’hypothèse que l’espèce est visiblement passée inaperçue ou probablement a été confondue avec une des formes de Convolvolus arvensis L. . Sa présence dans la région d’étude n’a jamais été clairement affirmée jusqu’à ce jour (cf. Battandier & Trabut, 1888; Quézel & Santa, 1963). Ce taxon critique est évalué quasi menacé, il est noté dans plusieurs localités peu explorées entre l’Algérie et la Tunisie (Véla et al., 2018).
45Nous confirmons donc ici l’existence de cette espèce dans le maquis bas à Quercus suber L. et Olea europaea L. de Dem El Begrat avec au moins plusieurs dizaines d’individus. La découverte de cette nouvelle station dans le massif forestier de Filfila dénote manifestement un manque de prospections historiques de cette région.
46Dactyloctenium aegyptium (L.) Willd. (Fig. 2.k)
47Cette Poacée annuelle à inflorescence automnale a été vue sur les dunes de Bouzaaroura où elle semble très rare. Cette observation semble nouvelle pour la Numidie occidentale, Maire (1953) et Quézel & Santa (1962) ne la mentionnant que de l’extrémité nord-est de l’Algérie, à La Calle et au Sahara septentrional dans les oasis de Touggourt et El Goléa. La distribution et le statut de rareté de cette psammophile restent à préciser dans le Nord-Est algérien. Notons qu’à El Kala et Filfila, on signale la présence d’un important peuplement de Dactyloctenium aegyptium (L.) Willd. dans les grandes pelouses arénacées un peu humides. Cette plante mériterait un suivi régulier de sa population.
48Drimia anthericoides (Poir.) Véla & de Bélair (Fig. 2.l)
49Cette endémique du Nord-Est algérien avec des localités restreintes semble nouvelle pour la région de Filfila (cf. Véla et al., 2016; Véla & de Bélair, 2017). Il s’agit d’un taxon critique considéré dans les anciennes flores comme une variété d’Urginea maritima (L.) Baker (cf. Maire, 1958; Quézel & Santa, 1962). Néanmoins, il se distingue des autres espèces/variétés de Charybdis maritima (L.) Speta [=Urginea maritima (L.) Baker] par de nombreux caractères des fleurs, fruits, bulbes, feuilles et par son niveau de ploïdie (Véla et al., 2016). Une révision des stations de Drimia/Charybdis/Urginea du côté tunisien serait profitable afin de rechercher la présence de cette espèce.
50Ce taxon est évalué en danger sur la liste rouge de l’UICN (Véla & de Bélair, 2017). La station d’observation se trouve sur des terres privées, elle est donc potentiellement menacée par l’agriculture, le piétinement modéré et l'érosion due au pâturage, et l'expansion des pistes (ou entretien) où les plantes sont arrachées.
51Echinophora spinosa L. (Fig. 2.m)
52Ce taxon psammophile est considéré très rare en Algérie (Quézel & Santa, 1963). Il a été signalé par Battandier (1888-1890) comme disparu du territoire national après le signalement de Desfontaines (1798). Il a été redécouvert à Beni Bélaid (K2) avec une population très restreinte et en association avec Achillea maritima (L.) Ehrend. et Y. P. Guo (de Bélair & Samraoui, 2000; Bouldjedri et al., 2011; Khennouf et al., 2018), puis revu en K3 sur les sables maritimes d’Oued El Gueb (Hamel et al., 2013; Boulemtafes et al., 2018). Il a également été recensé sur les dunes maritimes d’Oued Righa en septembre 2022 par A. Saci, où il semble très rare puisque seulement cinq pieds sont observés.
53Leucojum aestivum L. subsp. pulchellum (Salisb.) Briq. (Fig. 2.n)
54Nous avions précédemment annoncé la présence de ce taxon comme nouveau pour l’Algérie, à partir de récoltes effectuées dans l’aulnaie de Oued Leksob, mais il avait déjà été recensé par Maire (1959) comme ornemental en Algérie, avant d’être tombé dans l’oubli. L’espèce a été découverte en janvier 2021 par A. Saci (Saci et al., 2021). Il s’agit de la seule localité connue en Afrique du Nord de ce taxon hygrophile, qui se maintient localement depuis sa première signalisation; cette Amaryllidacée serait à rechercher activement dans les lacs tourbeux de Guerbès-Senhadja.
55En revanche, cette découverte est importante car elle illustre le lien biogéographique entre le Nord-Est algérien et le bloc corso-sarde et/ou l’ensemble insulaire tyrrhénien (Pavon & Véla, 2011; Hamel & Boulemtafes, 2017a; Médail & Véla, 2020; Hamel et al., 2020a).
56Limonium fradinianum (Pomel) Erben (Fig. 2.o)
57Malgré les mises au point nomenclaturales de Greuter & Raus (1987), les saladelles d’Algérie demeurent confuses sur le plan taxonomique et mal connues sur le plan chorologique, ce qui rend difficile à la fois leur identification mais aussi l’estimation de leur valeur patrimoniale.
58Dans la région de Filfila, le Limonium fradinianum croit le long des côtes rocheuses, sur les falaises, les rochers et replats rocailleux, préféren-tiellement sur silice. Ce taxon héliophile et halorésistant est répandu dans divers points en Numidie. Il est signalé comme endémique algérien (Boulemtafes et al., 2018, Hamel et al., 2022). Il semble dans ce cas que son absence de mention dans le secteur K3 par Quézel & Santa (1963) soit entièrement la conséquence de la faible prospection historique du littoral oriental.
59Lonas annua (L.) Vines & Druce (Fig. 2.p)
60Cette espèce a été observée dans le maquis de Lemnadjer en septembre 2018, puis une seconde localité a été trouvée sur un maquis haut du Col Besbes en mai 2019. Elle est présente en nombre très réduit d’individus dans des milieux ouverts. Il semble qu’elle n’ait jamais été observée auparavant sur le secteur numidien (cf. Quézel & Santa, 1963).
61Plantago crassifolia Forsk. (Fig. 2.q)
62Ce taxon méditerranéen est lié aux ripisylves ou fourrés thermophiles temporairement humides bordant les marais ou les arrières-plages. Ce plantain à feuilles grasses est curieusement très rare en Algérie où il est limité à La Rassauta et Reghaïa dans le sous-secteur littoral algérois (cf. Quézel & Santa, 1963). L’espèce est nouvelle pour la Numidie occidentale et elle existe en petites et assez rares populations dans les marais littoraux salés d’Annaba et El Kala (G. de Bélair, obs. pers. 1978-2009). Il est donc nécessaire de prospecter les embouchures d’oueds et les fissures des rochers soumises aux brumes maritimes de la Numidie pour tenter de préciser la distribution et l’étendue de cette intéressante espèce halophile.
63Pteris vittata L. (Fig. 2.r)
64C’est une fougère subcosmopolite liée aux ripisylves ou aux ravins humides du littoral et des montagnes. La ptéride à longues feuilles est curieusement très rare en Algérie où elle est limitée à la petite Kabylie (K2), l’Atlas Tellien (A2) et les Andalouses (O1) (Quézel & Santa, 1962). Elle a été découverte à la plage Saint Louis en hiver 2016 où elle semble très rare et localisée. Toutefois, la présence de nombreux ruisseaux difficiles d’accès, nous laisse penser que d’autres populations de ladite fougère peuvent exister au niveau des contreforts de Filfila demeurés inexplorés sur le plan botanique (Hamel et al., 2020b).
65Scrophularia frutescens L. (Fig. 2.s)
66Il s’agit d’une espèce ibéro-maghrébine à distribution limitée en Europe au Sud de l’Espagne et récemment observée sur la côte du Portugal (Site web Inaturalist, observations inédites). Sa distribution en Afrique du Nord était considérée comme restreinte au Maroc où elle est très rare puisque seules deux localités sont citées dans la Flore pratique du Maroc par Fennane et al. (2007). En Algérie, les dunes maritimes de Filfila constituent l’unique localité nationale et elle mérite à ce titre un suivi et une conservation prioritaires. Toutefois, cette scrophulaire participe à l’individualisation de la communauté végétale psammophile d’un grand intérêt écologique pour la fixation des dunes mobiles (Saci et al., 2022).
67Tuberaria acuminata (Viv.) Grosser (Fig. 2.t)
68Cette endémique subtyrrhénienne est limitée à l'Italie, la Tunisie et l'Algérie, où elle semble très localisée (Quézel & Santa, 1963; Pignatti, 1982; Dobignard & Chatelain, 2011; Hamel & Boulemtafes, 2017a; Hamel et al., 2020a). Il convient de noter que ce taxon, au sens strict, n’a jamais été signalé en Algérie en dehors de la péninsule de l’Edough. Dans la station découverte à Oued Leksob, la population de Tuberaria acuminata se compose de plus d’une dizaine de pieds (en touffe) et s’étale sur au moins 5m2. Bien qu’absente des listes UICN, à l’échelle de l’Algérie l’existence de seulement deux stations pour cette espèce, dont celle découverte ici qui est menacée par l’urbanisation anarchique, pourrait mériter un statut de vulnérable voire en danger (cf. Saci et al., 2021).
69Ziziphus lotus (L.) Lam.
70La présence de ce taxon dans toute l’Algérie est connue de longue date (Battandier, 1888). Quézel & Santa (1963) rapportent qu’il est présent dans tout le pays sauf sur le Tell algéro-constantinois dont fait partie la Numidie. Néanmoins, il est bien présent en Numidie puisqu’il a été noté dans plusieurs travaux sur la flore vasculaire de ce territoire (cf. de Bélair, 1990; Hamel, 2013; Fetnaci et al., 2019; Hamel et al., 2019).
71Ce jujubier est fréquemment observé dans les maquis à oléo-lentisque de la région d’étude en raison de son aspect épineux difficilement pâturé par le bétail. De même, l’espèce est commune sur les plaines d’Annaba, en nombre important soit sous forme de touffes soit de pieds isolés (Fetnaci et al., 2019).
72TAXONS XÉNOPHYTES NOUVEAUX POUR LA RÉGION DE FILFILA
73Amaranthus viridis L. (Fig. 3.a)
74Selon Dobignard & Chatelain (2011), la distribution générale de ce taxon en Algérie reste encore lacunaire, bien que sa présence soit confirmée dans plusieurs pays de l’Afrique du Nord (cf. Fennane & Ibn Tattou, 2005; Boulos et al., 2010).
75Ce taxon a fait l’objet d’une récente découverte le 28 mai 2020 sur les bords de chemins de l’agglomération d’Annaba (G. de Bélair, obs. pers. 2020). Sa présence a, par la suite, été confirmée dans l’agglomération de Filfila lors d’une exploration en juillet 2020 (A. Saci, obs. pers.). Ce taxon ne figure pas dans les travaux d’inventaire sur la flore de l’Algérie (Maire, 1952-1987; Quézel & Santa, 1962-1963) et sa présence en Algérie pourrait être récente, et il est probable que de nouvelles populations soient trouvées dans les années à venir.
76Anredera cordifolia (Ten.) Steenis (Fig. 3.b)
77La liane de Madère a été introduite en tant que plante d’ornement dans de nombreux pays où elle est devenue envahissante notamment en Australie, Afrique du Sud, Nouvelle Zélande et Hawaï (Weber, 2017). En Afrique du Nord, sa présence comme plante d’ornement a été rapportée par Maire (1962) sans indication précise des pays dans lesquels elle a été cultivée. Plus récemment, la plante est rapportée naturalisée au Maroc (Uotila, 2009) alors qu’en Algérie elle n’a pas été signalée naturalisée par Quézel & Santa (1962-1963) ou Dobignard & Chatelain (2011). Sakhraoui et al. (2019), l’ont observée pour la première fois en Algérie, à la limite Ouest de la wilaya de Skikda. Notre observation a été faite dans l’Oued de Marbouba à l’Est de la wilaya de Skikda, où la plante occupe une surface plus importante et y est représentée par une population plus dense que dans sa première station nationale. Les arbres proliférant sur place lui servent de tuteurs. Cette espèce devrait être surveillée pour éviter qu’elle ne devienne envahissante avérée dans les prochaines années.
78Bidens aurea (Aiton) Sherff (Fig. 3.c)
79Cette Astéracée n’est pas citée dans l’index de Dobignard & Chatelain (2011). De même, aucune flore ou catalogue d’Algérie (Battandier, 1888-1890; Battandier & Trabut, 1905; Maire, 1952-1987; Quézel & Santa, 1962-1963), ni même de Tunisie (Pottier-Alapetite, 1979-1981; Le Floc’h et al., 2010) n’ont signalé ce taxon. Au Maroc, la plante est considérée comme naturalisée (Valdés et al., 2002; Ibn Tattou & Fennane, 2008). En dehors de son aire naturelle américaine, cette espèce est souvent considérée comme échappée de culture (Gillett, 1975). Elle est nouvellement décrite en Algérie par Sakhraoui (2021) dans la région de Skikda, puis observée par Bellili et al. (2022) dans les espaces verts du campus universitaire de Sidi Amar à Annaba.
80Nous l’avons recensée à Oued Righa en octobre 2020, dans un fossé humide peu végétalisé et bien exposé. L’habitat est dominé par Tamarix cf. gallica L., accompagné d’autres plantes vivaces comme Mentha suaveolens Ehrh. et Arundo donax L., tandis que les espèces annuelles sont plus nombreuses : ex. Poa trivialis L., Bellis annua L., Erigeron canadensis L., Raphanus raphanistrum L. subsp. raphanistrum, Trifolium campestre Schreb., Ranunculus sardous Crantz, Echium plantagineum L. et Rubus ulmifolius Schott.
81Ibicella lutea (Lindl.) Van Eselt. (Fig. 3.d)
82Cette Martyniaceae qui ne figure pas dans la nouvelle flore de l’Algérie de Quézel & Santa (1962-1963), a fait l’objet d’une découverte pour la flore nationale (Dobignard & Chatelain, 2013). La première mention de cette espèce dans le pays remonte à 1910 par Gubb (1913), mais sans précision de localité ni d’écologie. En Tunisie, elle se développe dans les vallées humides, mais desséchées en été, au nord-ouest du pays, sur les sols alluviaux relativement pauvres en matière organique (El Mokni et al., 2012). De nos jours, plusieurs stations ont été découvertes en Algérie (Belkassam et al., 2020). Nous avons pu récemment confirmer une population d’une vingtaine de pieds dans un champ de cultures abandonné sur le cordon dunaire d’Oued Leksob.
83Senecio angulatus L. f. (Fig. 3.e)
84Ce taxon a été longtemps confondu avec Senecio mikanioides Walp (Dellucchi et al., 2016). Sa présence a été confirmée sur le territoire algérien dans plusieurs régions du centre et du nord-est algérien où il vient s’ajouter au groupe des plantes invasives (Miara et al., 2018). Le Séneçon anguleux est aussi présent en Lybie où il a été cultivé à grande échelle (Greuter, 2006). En Tunisie, El Mokni & Iamonico (2018) rapportent sa présence à Monastir, Bizerte et Jendouba (Fernana-Aîn Draham).
85En septembre 2019 nous avons pu confirmer sa présence à Oued Righa près de l’agglomération de Filfila où il arrive à fermer une grande partie de cet habitat.
CONCLUSION
86Cette contribution confirme l'importance du patrimoine floristique de la Numidie occidentale notamment la région de Filfila aussi bien sur le plan taxonomique que chorologique. En effet, pas moins de 25 espèces (20 spontanées et 5 xénophytes) sont nouvellement signalées dans la région de Filfila. Cette région représente un refuge actuel majeur pour la biodiversité floristique en Algérie avec de nombreuses espèces d’intérêt biogéographique. Cette région subit de très forts impacts depuis des décennies (incendies, ouverture de carrières, pâturage, urbanisation anarchique …).
87Au regard de ses originalités, la région de Filfila représente donc bien une mini-ZIP locale (sensu Benhouhou et al., 2018) pour la flore vasculaire à l’échelle de l’Algérie.
88Donc, il est nécessaire de développer sans tarder une politique ambitieuse de valorisation et de préservation de ce capital biologique unique avec les démarches suivantes :
89- Tout d’abord, une prospection approfondie des parties orientales peu accessibles de la région de Filfila, afin d’établir une liste floristique complète de la région.
90- Une analyse démographique des végétaux les plus rares et/ou les plus emblématiques (endémiques restreintes) afin d’établir une évaluation de la liste rouge de l’UICN.
91- La création de nouvelles aires protégées au moins pour les taxons patrimoniaux et le renforcement de la législation nationale existante.
REMERCIEMENTS
92 Les auteurs remercient Monsieur Tayar Billel pour son aide précieuse sur le terrain.
RÉFÉRENCES
93APD, 2022. African Plants Database. Genève : Conservatoire et Jardin botaniques de la Ville de Genève; Pretoria (SA): South African, South African National Biodiversity Institute.
94http://www.ville-ge.ch/musinfo/bd/cjb/africa
95Battandier, J. A. & Trabut L., 1884. Flore d’Alger et catalogue des plantes d’Algérie. Edit. Adolphe Jourdan, Libraire-éditeur de l’école de Médecine (Alger), 16 + 211 pp.
96Battandier, J. A., 1888-1890. Flore de l’Algérie : ancienne flore d’Alger transformée: Dicotylédones. A. Edit. Adolphe Jourdan, Libraire-éditeur de l’école de Médecine (Alger), 11 + 825 + 29 pp.
97Battandier, J. A. & Trabut, L., 1895. Flore de l’Algérie et catalogue des plantes du Maroc: Monocotylédones. Edit. Adolphe Jourdan, Libraire-éditeur de l’école de Médecine (Alger), 256 pp.
98Battandier, J. A., 1910. Flore de l’Algérie : Supplément aux phanérogames. Édit. P. Klincksieck (Paris) et Imprimerie agricole et commerciale (Alger), 90 + 3 pp.
99Battandier, J. A., 1919. Contribution à la flore atlantique. Édit. Librairie Klincksieck, L’Homme successeur, Paris, 95 pp.
100Belkassam, A., Rebbas, K., Chelghoum, H., Ait Hammou, M. & Miara, M. D., 2020. Découverte d’Ibicella lutea(Lindl.) Van Eselt en Algérie. Bulletin de la Société Royale des Sciences de Liège 89 : 85-90.
101Bellili, A. M., Meddad-Hamza, A., Babali, B., Belabed-Zediri, H., Belabed, A. I. & Hamel, T., 2022. Une première investigation sur la flore horticole de la région de Annaba (Nord-Est algérien): Biodiversité et intérêt socio-écologique. Flora Mediterranea 32: 117-129. doi.org/10.7320/FlMedit32.117
102Benhouhou, S., Yahi, N. & Véla, E., 2018. Algeria (chapter 3 "Key Biodiversity Areas (KBAs) for plants in the Mediterranean region"), UICN: 53-60.
103Blanca, G., Cabezudo, B., Cueto, M., Lopez C. F. & Torres, C. M., 2009. Flora Vascular de Andalucía Oriental 1-4. – Sevilla. Edit. Consejería de Medio Ambiente. Junta de Andalucía, 436 pp, 504 pp, 472 pp,436 pp.
104Bouldjedri, M., de Bélair, G., Mayache, B. & Muller, S. D., 2011. Menaces et conservation des zones humides d’Afrique du Nord : le cas du site Ramsar de Beni Bélaid (NE algérien). Comptes Rendus Biologies 16 : 78–94. doi.org/10.1016/j.crvi.2011.06.009
105Boulemtafes, A., Hamel, T., de Bélair, G. & Véla, E., 2018. Nouvelles données sur la distribution et l’écologie de seize taxons végétaux du littoral de la péninsule de l’Edough (Nord–Est algérien). Bulletin de la Société Linnéenne de Provence 69: 59-76.
106Boulos, L., Le Floc'h, E., Véla, E., 2010. Catalogue synonymique commenté de la flore de Tunisie. Ministère de l’Environnement et du Développement Durable, Tunisie, 509 pp.
107de Bélair, G. & Samraoui, B., 2000. L’écocomplexe des zones humides de Béni–Bélaid: Un projet de réserve naturelle. Sciences et Technologies 14 : 115–124.
108Dellucchi, G., Bayon, N. D. & Hurrell, J. A., 2016. Senecio angulatus (Asteraceae, Senecioneae) naturalizada en la Argentina. Boletín de la Sociedad Argentina de Botánica 51 (1) : 169-177.
109doi.org/10.31055/1851.2372.v51.n1.14486
110Dobignard, A. & Chatelain, C., 2010-2013. Index synonymique de la flore d’Afrique du Nord (5 vol.). Conservatoire et jardins botaniques éd., Genève. 458 pp, 428 pp, 449 pp, 431 pp, 465 pp.
111El Mokni, R., Hamdi, N., de Bélair, G. & El Aouni, M. H., 2012. Découverte d’Ibicella lutea (Lindl.) Van Eselt. (Martyniaceae) en Kroumirie (Nord-Ouest de la Tunisie). Poiretia 4 : 1-6.
112El Mokni, R. & Iamonico, D., 2018. Three new records of Senecioneae (Asteraceae) for the allochthonous Tunisian flora: occurrence and taxonomic notes. Flora Mediterranea 28: 385-392. doi.org/10.7320/FlMedit28.385
113Emberger, L. & Maire, R., 1941. Catalogue des plantes du Maroc (Spermaphytes et Ptéridophytes). Alger, Minerva. Vol. IV, supplément aux volumes I-III, 915-1181.
114Fennane, M. & Ibn Tattou, M., 2005. Flore vasculaire du Maroc. Inventaire et chorologie.Travaux de l'Institut Scientifique, Université Mohammed V, Rabat. Série Botanique 37: 483 pp.
115Fennane, M., Ibn Tattou, M., Ouyahya, A. & El Oualidi, J., 2007. Flore pratique du Maroc - Volume 2 - Angiospermae (Leguminosae - Lentibulariaceae). Institut Scientifique, Université Mohammed V - Agdal, Rabat, 652 pp.
116Fetnaci, I., Beddiar, A. & Hamel, T., 2019. Le lac Fetzara (Nord-Est algérien): Biodiversité floristique et menaces potentielles. Flora Mediterranea 29: 227-245. doi.org/10.7320/FlMedit29.227
117Ferreira, M.-Z., Zahradníček, J., Kadlecová, J., de Sequeira, M. M., Chrtek, J. & Fehrer, J., 2015. Tracing the evolutionary history of the little-known Mediterranean-Macaronesian genus Andryala (Asteraceae) by multigene sequencing. Taxon 64 (3): 535-551. doi.org/10.12705/643.10
118Gillett, G.-W., 1975. The diversity and history of Polynesian Bidens section Campylotheca. Harold L. Lyon Arboretum. Lecture 6: 1-32.
119Greuter, W., 2006. Compositae (pro parte majore). In: Compositae. Euro+Med Plantbase - the information resource for Euro-Mediterranean plant diversity. From : https://ww2.bgbm.org/EuroPlusMed/PTaxonDetail.asp?NameId=14103&PTRefFk=7000000
120Greuter, W. & Raus, T.-H., 1987. Med-Checklist Notulae, 14. Willdenowia 16: 439-452.
121Gubb, A.S., 1913. La flore algérienne: naturelle et acquise. Edit. Adolphe Jordan, Alger, 32 + 275 pp.
122Hamel, T., Seridi, R., de Bélair, G., Slimani, A. R. & Babali, B., 2013. Flore vasculaire rare et endémique de la péninsule de l’Edough (Nord–Est algérien). Synthèse: Revue des Sciences et de la Technologie 26: 65–74.
123Hamel, T., 2013. Contribution à l’étude de l’endémisme chez les végétaux vasculaires dans la péninsule de l’Edough (Nord-Est algérien). Thèse de Doctorat, université Badji Mokhtar Annaba, Algérie, 238 pp.
124Hamel, T. & Boulemtafes, A., 2017a. Découverte d’une endémique tyrrhénienne Soleirolia soleirolii (Urticaceae) en Algérie (Afrique du Nord). Flora Mediterranea 27: 185–193. doi.org/10.7320/FlMedit27.185
125Hamel, T. & Boulemtafes, A., 2017b. Nouvelle station de Sixalix farinosa (Coss.) Greuter et Burdet dans la péninsule de l’Edough (Nord–Est algérien). Bulletin de la Société Linnéenne de Provence 68: 93-100.
126Hamel, T., Bellili, A. M., Meddad-Hamza, A. & Boulemtafes, A., 2019. Nouvelle contribution à l’étude de la flore mellifère et caractérisation pollinique de miels de la Numidie (Nord-Est algérien). Livestock Research for Rural Development 31: 1-10.
127Hamel, T., Saci, A. & de Bélair, G., 2020a. Redécouverte d’un subendémique tyrrhénien, Tuberaria acuminata (Viv.) Grosser, en Numidie (Nord – Est algérien). Bulletin de la Société Linnéenne de Provence 71: 243-248.
128Hamel, T., de Bélair, G., Slimani, A. R., Boutabia, L. & Telailia, S., 2020b. Nouvelle station de Pteris vittata L. (Pteridaceae) en Numidie (Algérie orientale). Acta Botanica Malacitana 45: 1–4. doi.org/10.24310/abm.v45i0.5744
129Hamel, T., de Bélair, G., Slimani, AR., & Meddad-Hamza, A., 2021. De nouvelles données sur l’état critique d’Erica numidica (Maire) Romo & Borat. En Numidie (Algérie orientale). Lejeunia 205 : 1-16.
130doi.org/10.25518/0457-4184.2416 Voir:https://popups.uliege.be/0457-4184/index.php?id=2416
131Hamel, T., Hidalgo Triana, N., Meddad-Hamza, A., Boulemtafes, A., Souilah, N., de Bélair, G. & Salvo Tierra, A. E., 2022. Analysis of taxonomic distinctness and priority conservation areas as a basis for heritage enhancement of floristic diversity: the case of the ‘hotspot’ of the islands of Numidia (North-Eastern Algeria). Mediterranean Botany 43:1-24. doi.org/10.5209/mbot.81125
132Jauzein, P. & Tison, J.-M., 2005. Le complexe d'Allium ampeloprasum L. en France, Lejeunia 178 : 1-28.
133Voir : https://popups.uliege.be/0457-4184/index.php?id=2440
134J.O.R.A., 2012. Décret exécutif du 18 janvier 2012, complétant la liste des espèces végétales non cultivées et protégées. (Eds) Journal officiel de la république algérienne, n° 3-12/12 du 18-01-2012. 12–38.
135Khennouf, H., Chefrour, A., Corcket, E., Alard, D. & Véla, E., 2018. La végétation dunaire du littoral de Jijel (Algérie): proposition d’une nouvelle zone importante pour les plantes. Revue d’Écologie (Terre et Vie) 73(3): 344–361.
136Maire, R., 1936. Contribution à l’étude de la flore de l’Afrique du Nord. Bulletin de la Société d’Histoire Naturelle de l’Afrique du Nord. 27: 231-237.
137Maire, R., 1952-1987. Flore de l’Afrique du Nord (Maroc, Algérie, Tunisie, Tripolitaine, Cyrénaïque et Sahara). 16 vols, Lechevalier, Paris.
138Médail, F. & Myers, N., 2004. Mediterranean Basin. (pp.144-147). In: Mittermeier, R. A., Robles, Gil P., Hoffmann, M., Pilgrim, J., Brooks, T., Mittermeier, C. G., Lamoreux, J. & da Fonseca G. A. B. (eds.). Hotspots revisited: Earth’s biologically richest and most endangered terrestrial ecoregions. CEMEX (Monterrey), Conservation International (Washington) & Agrupación Sierra Madre (Mexico), 392 pp.
139Médail, F. & Véla, E., 2020. Flore et végétation vasculaires de l'archipel de Zembra (Tunisie nord-orientale). Note naturaliste PIM, Marseille.67 pp.
140Miara, M. D., Boutabia, L., Telailia, L. & Véla, E., 2018. Apparition de Senecio angulatus (Asteraceae) en Algérie. Flora Mediterranea 28: 111-118. doi.org/10.7320/FlMedit28.111
141Myers, N., 1988. Threatened biotas: Hotspots in tropical forests. Environmentalist 8: 178-208. doi.org/10.1007/BF02240252
142Myers, N., 1999. The biodiversity challenge: Expanded hotspots analysis. Environmentalist 10: 243-256. doi.org/10.1007/BF02239720
143Myers, N., Mittermeier, R A, Mittermeier, C.G., Da Fonseca, G A. & Kent, J., 2000. Biodiversity hotspots for conservation priorities. Nature 403 : 853–858. doi.org/10.1038/35002501
144Pavon, D. & Véla, E., 2011. Espèces nouvelles pour la Tunisie observées sur les petites îles de la côte septentrionale (archipels de la Galite et de Zembra, îlots de Bizerte). Flora Mediterranea 21:273–286.
145Pignatti, S., 1982. (reprint 1997). Flora d’Italia. Édit. Edagricole, Bologna, 4 vol.
146Pomel, A., 1875. Nouveaux matériaux pour la flore atlantique. Fascicule 2. Bulletin de la Société des Sciences Physiques, Naturelles et Climatologiques de l’Algérie, 134 pp.
147Pottier–Alapetite, M., 1979-1981. Flore de la Tunisie, angiospermes - dicotylédones : 1 (apétales–dialypétales), 2 (gamopétales). Édit. Imprimerie officielle de la République tunisienne, 1195 pp.
148Quézel, P. & Santa, S., 1962-1963. Nouvelle flore de l’Algérie et des régions désertiques méridionales. Editions du CNRS, Paris, 2 volumes,1170 pp.
149Quézel, P., 1964. L’endémisme dans la flore de l’Algérie. Compte rendu des séances de la Société de biogéographie 361:137-149.
150Rhazi, L., Muller, S. D., Rhazi, M., Grillas, P., Ibn Tattou, M., Saber, E. R., Tellal, M., Bouahim, S., Amami, B., Loutfi, M., Daoud-Bouattour, A., Ben Saad-Limam, I., Ghrabi-Gammar, Z., de Bélair, G. & Garcia, N., 2010. Bellis prostrata Pomel (Asteraceae), a new species for Morocco. Acta Botanica Malicitana 35: 207-211.
151doi.org/10.24310/abm.v35i0.2887
152Saci, A., Boussaada, Z., Hamel, T. & de Bélair, G., 2021. Première observation d’une endémique tyrrhénienne (Leucojum aestivum subsp. pulchellum, Amaryllidaceae) sur le continent africain (Algérie). Flora Mediterranea 31: 123-128. doi.org/10.7320/FlMedit31.123
153Saci, A., Hamel, T., Slimani, A. R. & de Bélair, G., 2022. Confirmation de la présence de Scrophularia frutescens L. (Scrophulariaceae) en Numidie occidentale (Nord-Est algérien). Bulletin de la Société Royale des Sciences de Liège 91(1): 1-10.
154Voir: https://popups.uliege.be/0037-9565/index.php?id=10769
155Sakhraoui, N., Metallaoui, S. & Chefrour, A., 2019. Naturalisation d’Anredera cordifolia (Basellaceae) en Algérie. Flora Mediterranea 29: 159-162. doi.org/10.7320/FlMedit29.159
156Sakhraoui, N., 2021. Bidens aurea (Asteraceae), un nouvel ajout à la flore exotique d’Algérie. Flora Mediterranea 31: 153-157. doi.org/10.7320/FlMedit31.153
157UICN., 2022. Liste rouge de l'UICN des espèces menacées. Version 2022-1. http://www.iucnredlist.org
158Uotila, P., 2009. Basellaceae. – In: Euro+Med Plantbase - the information resource for Euro- Mediterranean plant diversity. published at https://ww2.bgbm.org/EuroPlusMed/PTaxonDetail.asp?NameId=47683&PTRefFk=7300000
159Valdes, B., Rejdali, M., Achhal, D., El Kadmiri, A., Jury, J. L. & Montserrat, J. M., 2002. Catalogue des plantes vasculaires du Nord du Maroc, incluant des clés d’identification, 2. ‒ Madrid.
160Véla, E. & Benhouhou, S., 2007. Évaluation d’un nouveau point chaud de biodiversité végétale dans le bassin méditerranéen (Afrique du Nord). Compte Rendus de Biologies 330:589–605. doi.org/10.1016/j.crvi.2007.04.006
161Véla, E., 2008. Mission exploratoire à Skikda. Petites iles de Méditerranée 08. Conservatoire de l’espace littoral et des rivages lacustres, Aix-en-Provence. 14 pp.
162Véla, E., de Bélair, G., Rosato, M. & Rossello, J., 2016. Taxonomic remarks on Scilla anthericoides Poir. (Asparagaceae, Scilloideae), a neglected species from Algeria. Phytotaxa 288(2): 154–160.
163doi.org/10.11646/phytotaxa.288.2.5
164Véla, E. & de Bélair, G., 2017. Charybdis anthericoides. The IUCN Red List of Threatened Species 2017. e.T111272454A111273406.
165Véla, E., de Bélair, G. & El Mokni, R., 2018. Convolvulus durandoi. The IUCN Red List of Threatened Species 2018. e.T164267A117847337.
166Weber, E., 2017. Invasive plant species of the world: A reference guide to environmental weeds, 2e ed. ‒ CABI Publishing, Wallingford UK, 543 pp.
167Yahi, N., Véla, E., Benhouhou, S., de Bélair, G. & Gharzouli, R., 2012. Identifying Important Plants Areas (Key Biodiversity Areas for Plants) in northern Algeria. Journal of Threatened Taxa, 4: 2753-2765. doi.org/10.11609/JoTT.o2998.2753-65


168a b


169c d
Fig. 2. a, b. Allium porrum subsp. polyanthum, c. Anchusa aggregata,
d. Andryala cossyrensis.


170e f


171g h
Fig. 2. e. Andryala nigricans, f. Anthemis maritima subsp. maritima,
g. Antirrhinum tortuosum, h. Bellis prostrata.


172i j


173k l
Fig. 2. i. Bunium crassifolium, j. Convolvulus durandoi, k. Dactyloctenium aegyptium, l. Drimia anthericoides.


174m n


175o p
Fig. 2. m. Echinophora spinosa, n. Leucojum aestivum subsp. pulchellum, o. Limonium fradinianum, p. Lonas annua.


176q r


177s t
Fig. 2. q. Plantago crassifolia, r. Pteris vittata, s. Scrophularia frutescens, t. Tuberaria acuminata.


178a b


179c d

180e
Fig. 3. Taxons néophytes observés dans la région d’étude, a. Amaranthus viridis, b. Anredera cordifolia, c. Bidens aurea, d. Ibicella lutea,
e. Senecio angulatus.

Publication supportée par le
Fonds National de la Recherche Scientifique de Belgique.
|
|
|
|
|
Manuscrit « camera ready » réalisé par le cadre APE de la Société Botanique de Liège (Ministère de la Région Wallonne réf. NM2373). |
Les activités de la Société Botanique de Liège sont soutenues par la Province de Liège. |