Effets du froid sur les stades précoces de développement du maïs (Zea mays L.) (synthèse bibliographique)
Reçu le 15 janvier 2014, accepté le 4 décembre 2014
Résumé
Introduction. Le maïs est une plante présentant une grande importance économique. Malgré son origine tropicale et sa grande sensibilité aux basses températures, elle est aujourd’hui cultivée dans une large gamme de latitudes. Afin de conserver des rendements compétitifs, de nombreuses adaptations génétiques et culturales ont dû être mises en place.
Littérature. La réponse des plantes aux stress environnementaux tels que la sècheresse ou le froid a été largement étudiée. Cet article résume les avancées et les connaissances actuelles concernant les effets des températures froides non gélives sur les plantes de maïs, depuis la germination jusqu’à la transition florale. Le froid modifie la phénologie de la plante mais aussi sa productivité générale, notamment par son impact négatif sur la photosynthèse. La croissance est affectée et des stress secondaires osmotique et oxydatif affectent les processus cellulaires.
Conclusion. Une meilleure connaissance des effets du froid permet d’envisager des stratégies d’amélioration de la tolérance des plantes par diverses approches physiologiques, génétiques ou moléculaires.
Abstract
Effects of cold temperatures on the early stages of maize (Zea mays L.). A review
Introduction. Maize is a crop of great economical importance. Despite its tropical origin and its high sensitivity to low temperatures, maize is now cultivated in a wide range of latitudes. To maintain competitive yields, many genetic and agricultural adaptations have been implemented.
Literature. Plant responses to environmental stresses such as drought or cold have been extensively studied. This article reviews the progress and current knowledge regarding the effects of non-freezing cold temperatures on maize plants, from germination to floral transition. During the early stages of development, cold alters plant phenology and productivity, mainly because of its negative impact on photosynthesis. Plant growth is affected and secondary osmotic and oxidative stresses induce cell damage.
Conclusion. A better understanding of the effects of cold will allow the development of new strategies for improving plant tolerance through the use of various physiological, genetic and molecular approaches.
1. Introduction
1Les changements climatiques constatés à l’échelle planétaire se manifestent principalement par une hausse des températures moyennes et une perturbation du régime des précipitations. Pour l’agriculture, ces modifications appellent à de nouvelles stratégies, tant dans le choix que dans la mise en place des cultures. Une stratégie d’esquive consiste à avancer les semis de manière à éviter la sècheresse estivale. En France, par exemple, la date moyenne de semis pour le maïs a été avancée de 15 jours en 30ans (Lorgeou et al., 2011). Cette pratique peut cependant exposer les plantes à des températures froides en début de saison et ainsi handicaper leur croissance. Paradoxalement, le réchauffement climatique nécessite donc la sélection de variétés tolérantes au froid à des stades jeunes. Le maïs, Zea mays L., domestiqué à partir de l’ancêtre téosinte au Mexique, est en effet particulièrement sensible à la température, même si son expansion vers les régions tempérées a occasionné une adaptation progressive à des températures plus basses. Des températures inférieures à 5 °C provoquent des dommages structurels et des nécroses irréversibles ; des températures inférieures à 15 °C réduisent significativement l’activité photosynthétique et la croissance (Miedema, 1982). Une meilleure tolérance au froid permettrait donc d’étendre la culture vers des latitudes plus élevées et d’utiliser des génotypes au cycle de développement plus long.
2Le maïs étant cultivé pour la production de grains ou de fourrage, les critères de tolérance au froid concernent aussi bien le développement de la plante (phénologie) que l’accumulation de biomasse. Le stade auquel le froid survient est donc critique de même que son intensité et sa durée, autant de variables expérimentales qui, ajoutées à l’interaction génotype x environnement, justifient une littérature très abondante sur le sujet. Afin d’intégrer correctement l’ensemble des résultats obtenus dans des conditions environnementales très différentes, il est donc nécessaire de définir des types de traitements, comme proposé dans des revues récentes (Marocco et al., 2005 ; Leipner et al., 2009). Une première distinction est basée sur la gamme des températures subies. La température de 15 °C est fréquemment considérée comme le seuil en-deçà duquel la plante de maïs se trouve en conditions de stress, c’est-à-dire dans un état physiologique qui réduit les performances de fonctions vitales (Leipner et al., 2009). Un stress « modéré » désigne une période de froid à 10-15 °C, tandis qu’un stress « sévère » survient à 2-10 °C. Il faut préciser que cette classification est basée sur les effets du froid survenant à la lumière et dont les mécanismes sont intimement liés aux processus photosynthétiques. Une seconde composante du stress est sa durée : un stress modéré de longue durée ou un stress sévère de courte durée induisent dans les plantes des mécanismes de protection communs qui leur permettent de tolérer le froid, voire de s’acclimater pour supporter des conditions encore plus défavorables (Leipner et al., 2009). Par contre, un stress sévère de longue durée occasionne des dégâts cellulaires qui peuvent être irréversibles. Les effets du froid peuvent donc être décrits dans le sens d’une contrainte croissante sur les fonctions vitales.
3De nombreuses études ont été consacrées à l’identification des mécanismes physiologiques de réponse et de tolérance du maïs au froid ; elles constituent le socle de connaissances qui permettent actuellement la recherche de marqueurs de tolérance utiles à la sélection. Cette synthèse aborde donc successivement les études classiques, limitées aux stades de développement précoce du maïs jusqu’à la transition florale, et leur exploitation dans un but d’amélioration génétique.
2. Effets du froid sur la phénologie
2.1. De la germination à l’acquisition de l’autotrophie
4La germination du maïs nécessite une température minimale de 6 °C (Miedema, 1982). L’embryon qui reprend sa croissance contient 4 ou 5 feuilles « embryonnaires » qui se développent en utilisant les réserves de l’albumen. Cette phase de croissance hétérotrophe est particulièrement importante car elle coïncide avec l’implantation de la culture, durant laquelle la vigueur des jeunes plantes conditionne le taux de recouvrement du sol, la compétition vis-à-vis des adventices, de même que la sensibilité aux pathogènes. Le passage à l’autotrophie survient entre les stades 3 et 5 feuilles visibles. Ces stades précoces sont très sensibles au froid (Greaves, 1996) qui peut compromettre l’activation des processus photosynthétiques, le métabolisme général et le fonctionnement des méristèmes. La température critique est alors celle du sol plutôt que celle de l’air (Stone et al., 1999). Durant sa phase végétative, la plante de maïs présente en effet un port caractéristique en rosette, de sorte que le méristème de tige se trouve juste sous la surface du sol. Le ralentissement de croissance des plantules exposées au froid est dû à la fois à la fonctionnalité diminuée des racines et à un impact direct sur le fonctionnement du méristème de tige et la croissance des feuilles. En effet, lorsque seules les racines sont exposées au froid, le ralentissement de croissance est nettement plus faible que si la zone comprenant le méristème de tige est exposée à la même température (Engels, 1994). Des plantules présentant une racine primaire plus longue et ramifiée conservent de meilleures performances photosynthétiques au froid (Hund et al., 2007).
5Le ralentissement de croissance des racines limite l’acquisition des éléments minéraux, ce qui peut occasionner des carences minérales et le flétrissement des feuilles (Engels, 1994). Des chloroses ou des nécroses peuvent aussi être observées suite à un stress oxydatif dans les feuilles ; ces problèmes peuvent aller jusqu’à la mort de la plantule en cas de stress sévère persistant pendant la croissance hétérotrophe (Prasad et al., 1994). Il a été montré cependant que si le froid est modéré et transitoire, la biomasse finale de la plante est peu affectée par les effets d’un stress précoce, suggérant la mise en place de mécanismes de compensation lors des étapes ultérieures du développement (Leipner et al., 2008a).
2.2. La phase végétative et la transition florale
6Bien que le maïs soit à l’origine une plante de jours courts, les variétés actuellement cultivées dans les régions tempérées ont été sélectionnées pour leur capacité à fleurir de façon « autonome », indépendamment de la photopériode. Le nombre total de feuilles initiées avant la transition florale a un très fort déterminisme génétique, de sorte qu’il est fréquemment utilisé pour classer les génotypes entre « tardifs » et « précoces » (Périlleux et al., 2011). Ce caractère ne varie pas avec la température, de sorte que le moment de la transition florale peut être calculé à partir de la relation linéaire qui existe entre la vitesse de développement – souvent exprimée par la vitesse d’apparition des feuilles (index phyllochronique) – et la température (Tollenaar et al., 1979). Les échelles de temps thermique exprimé en degrés·jour cumulent le temps passé entre une température minimale de croissance (6-10 °C, selon les auteurs) et un maximum (30-35 °C). L’échelle plus récente proposée par Parent et al. (2010) calcule le temps équivalent à 20 °C, sur base d’une pondération des taux de croissance mesurés dans une gamme de 6-36 °C.
7Une étroite fenêtre temporelle de sensibilité à l’environnement semble cependant persister, juste avant la transition florale, durant laquelle la photopériode et la température peuvent accélérer le processus (Tollenaar et al., 1983). En l’occurrence, des jours courts ou des températures sous-optimales (de l’ordre de 15 °C) réduisent le nombre final de feuilles, ce qui signifie que la floraison survient à un âge physiologique plus précoce. Au niveau de la morphogenèse des inflorescences, le froid (< 10 °C) survenant aux environs de la transition florale peut, selon les génotypes, diminuer le nombre de ramifications de la panicule (Bechoux et al., 2000) et induire l’avortement de l’épi primaire remplacé par une languette foliacée (Lejeune et al., 1996).
3. Effets du froid sur la productivité
8La productivité des plantes cultivées est fréquemment exprimée par l’efficacité de conversion de la radiation interceptée en biomasse (foliaire et racinaire) ou RUE (radiation use efficiency). Les plantes en C4 comme le maïs se caractérisent par des performances particulièrement élevées, liées à leur capacité de fixer davantage de CO2 et de réduire la photorespiration pour convertir une plus grande proportion des radiations en assimilats.
3.1. Accumulation de biomasse
9Selon le stade auquel il survient, le froid peut provoquer une réduction de la biomasse totale de la plante de maïs, en limitant principalement la biomasse aérienne (Louarn et al., 2008). En conséquence, la surface d’interception lumineuse est limitée, ce qui amplifie encore l’effet néfaste du froid sur la production de biomasse. La biomasse racinaire est également affectée, mais moins que celle de la partie aérienne, de sorte que le rapport shoot/root diminue (Hund et al., 2007). Ce déséquilibre pourrait provenir de la moindre translocation depuis les racines vers les tiges des éléments nutritifs et hormones qu’elles fournissent normalement et qui sont nécessaires à la photosynthèse et à la croissance des feuilles (Imran et al., 2013). Il ne semble pas y avoir d’association génétique entre l’architecture du système racinaire et la capacité d’accumulation de biomasse aérienne par les plantes exposées au froid (Hund et al., 2004).
3.2. Croissance des feuilles
10Une période de froid a un effet variable sur la croissance d’une feuille selon le stade auquel elle y est exposée. Il est donc utile de rappeler qu’au stade de primordium, la croissance de la feuille est homogène, toutes les cellules étant mitotiquement actives. Elle est ensuite répartie sur deux zones : la partie proximale où la prolifération cellulaire perdure et la partie apicale où les cellules se divisent moins mais s’allongent. L’élongation de la feuille se déroule dans les 80 mm de sa base, avec une zone d’activité maximale à 35 mm (Muller et al., 2001). Le taux d’élongation d’une feuille apparait donc exponentiel lorsque sa taille est inférieure à 80 mm et linéaire une fois que cette zone d’élongation est formée.
11Les feuilles qui suivent celle qui émerge du cornet foliaire au moment du froid sont les plus affectées (Louarn et al., 2008) et le sont transitoirement ou irréversiblement. En effet, si le froid survient pendant la phase exponentielle de croissance, celle-ci est fortement ralentie pendant le stress, mais la durée de la phase linéaire qui suit est allongée, de sorte que la taille finale de la feuille n’est pas réduite (Louarn et al., 2010). Cet effet de compensation dépend de la taille du cornet qui semble jouer un rôle « tampon ». Par contre, si la feuille est dans sa phase linéaire de croissance lorsqu’elle perçoit le froid, la durée de cette phase diminue et la taille finale est irréversiblement réduite (Louarn et al., 2010). Le froid affecte autant la division cellulaire et l’élongation cellulaire, de sorte que la coordination entre ces processus n’est pas modifiée (Parent et al., 2010). Il semble, par contre, que lorsqu’il est limité à la période nocturne, le froid affecte uniquement l’activité du méristème basal des feuilles (Rymen et al., 2007).
3.3. Assimilation de CO2
12Les cellules exposées au froid doivent faire face à deux problèmes principaux : la baisse de la fluidité des membranes, qui peut affecter leur intégrité et les échanges qui s’y déroulent, et le ralentissement des réactions enzymatiques de la photosynthèse qui limite la capacité de dissipation de l’énergie lumineuse absorbée et augmente ainsi le risque de photoinhibition.
13Réactions enzymatiques. Chez les plantes en C4 comme le maïs, les étapes de fixation du CO2 atmosphérique et sa réduction en triose phosphate dans le cycle de Calvin se déroulent dans des assises cellulaires différentes de la feuille (Figure 1). La température optimale pour l’assimilation photosynthétique du CO2 chez le maïs se situe entre 30 °C et 40 °C ; toutes les études s’intéressant à l’effet du froid chez cette espèce montrent une baisse importante de l’assimilation du CO2 (Long et al., 2013). Les courbes d’assimilation à CO2 ambiant et intensité lumineuse (PPFD) variable montrent que l’assimilation maximale (Asat ; plateau de la courbe) est réduite par le froid. Le rendement quantique de l’assimilation (ФCO2 ; pente initiale de la courbe) n’est le plus souvent pas affecté, sauf dans les expériences où les conditions induisent une photoinhibition.
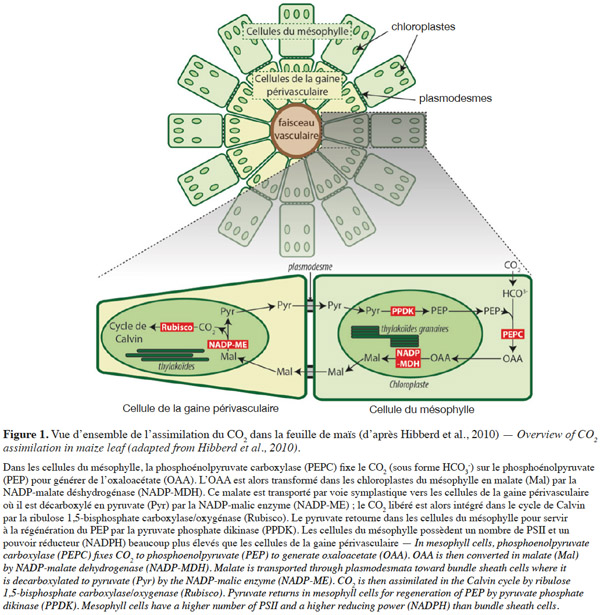
14En lumière saturante, la réponse à la concentration interne en CO2 montre que le froid provoque une réduction de l’efficacité de carboxylation (CE ; pente initiale de la courbe) qui reflète l’activité de la phosphoénolpyruvate carboxylase (PEPC). L’assimilation maximale est fortement réduite (de l’ordre de 80 % à 14 °C, comparativement à 25 °C) ; elle témoigne d’une diminution d’activité de la pyruvate phosphate dikinase (PPDK) qui régénère le PEP et de la ribulose 1,5-bisphosphate carboxylase/oxygénase (Rubisco). Ces baisses d’activité enzymatique sont corrélées à une diminution de l’abondance des protéines, mais la PEPC diminue peu comparativement aux deux autres (Naidu et al., 2003). La diminution de l’abondance de la Rubisco est corrélée à celle de sa grande sous-unité, encodée par le génome chloroplastique (Naidu et al., 2003). Le froid semble en effet provoquer un déséquilibre entre la disponibilité des protéines d’origine nucléaire ou chloroplastique, qui se reflète également dans la composition en protéines des photosystèmes (Nie et al., 1991). Le contrôle s’exercerait davantage au niveau post-traductionnel (stabilité et/ou dégradation des protéines) qu’au niveau transcriptionnel. La diminution de l’abondance de la Rubisco est en partie compensée par une augmentation de son activation à la lumière (Kingston-Smith et al., 1997).
15Le froid restreint également les échanges symplastiques entre les cellules du mésophylle et celles de la gaine périvasculaire qui sont indispensables au métabolisme C4 (Figure 1). Ceci pourrait être dû à la fermeture ou à l’obstruction des plasmodesmes par un polysaccharide, la callose et par une protéine, la calréticuline (Bilska et al., 2010). Des génotypes qui ont davantage de plasmodesmes entre les cellules de la gaine périvasculaire et les cellules du mésophylle sont ainsi plus tolérants au froid (Sowiński et al., 2003).
16Réactions photochimiques. Dans les feuilles de maïs qui se développent à température ambiante, la coordination entre le transport d’électrons et l’assimilation du CO2 est très robuste, de sorte que les rendements quantiques de la photochimie du photosystème II (ФPSII) et de l’assimilation du CO2 (ФCO2) sont étroitement corrélés dans une large gamme de conditions (Edwards et al., 1993). Cependant, lorsque les plantes se développent au froid, la diminution de l’assimilation du CO2 provoque la baisse d’utilisation du NADPH et de l’ATP, ce qui entraine la saturation de la chaine de transport des électrons et l’accumulation de protons dans la lumière des thylakoïdes. Le ФPSII diminue : l’énergie lumineuse est moins transformée en énergie chimique (qP, photochemical quenching) car la forme réduite de l’accepteur QA s’accumule (Fracheboud et al., 1999). Les centres réactionnels sont donc bloqués (en position dite « fermée ») et la dissipation de l’énergie par des processus non photochimiques (NPQ, non-photochemical quenching) augmente (Leipner et al., 1997). La dissipation de l’énergie sous forme de chaleur peut se faire via le cycle des xanthophylles, qui est stimulé par le froid (Caffarri et al., 2005).
17Le froid occasionne également des altérations structurelles au niveau du PSII, comme en témoigne une diminution du rendement quantique maximum du PSII, mesuré par le rapport Fv/Fm (Fracheboud et al., 1999). Cette « photoinhibition » est surtout observée lorsque le froid survient en même temps que de fortes intensités lumineuses. La cause majeure en est l’altération de la protéine D1 du centre réactionnel, dont l’abondance décroît fortement (Nie et al., 1991 ; Kingston-Smith et al., 1999). Le turnover de la protéine D1 est compromis au froid, de sorte que les molécules endommagées ne sont pas remplacées. Les antennes collectrices associées au PSII (LHCII) sont également affectées dans leur composition protéique, mais moins que les centres réactionnels (RC), de sorte que le rapport LHCII/RC augmente au froid (Nie et al., 1991 ; Caffarri et al., 2005). Une modification qualitative au sein du LHCII est la phosphorylation de la protéine CP29 induite par le froid. Cette modification pourrait favoriser la migration latérale de CP29 des granas aux thylakoïdes interganaires dans les cellules de mésophylle, entrainant la dislocation des complexes LHCII/RC (Chen et al., 2013). Ce mécanisme viserait à diminuer le transfert d’énergie entre les LHCII et le RC ; il expliquerait la différence de tolérance au froid entre certains génotypes de maïs et semble spécifique aux monocotylées.
18Les dégâts occasionnés par le froid aux photosystèmes se manifestent par une chlorose, c’est-à-dire par une diminution de la teneur en chlorophylles des feuilles. Le rapport chlorophylle a/b diminue et cela, de manière rapidement réversible dès la fin de la période de stress. La modification du rapport chlorophylle a/b serait due à la modification de l’abondance relative des antennes LHCII (où se trouve la chlorophylle b), par rapport aux RC (Nie et al., 1991 ; Caffarri et al., 2005).
19Le froid occasionne également l’accumulation de pigments non photosynthétiques qui font office de filtre pour les photosystèmes en excès d’énergie ; il s’agit d’anthocyanes vacuolaires qui provoquent le rougissement des feuilles (Pietrini et al., 2002).
20Les symptômes de chlorose et l’efficacité du PSII (mesures du ФPSII et Fv/Fm) sont fréquemment utilisés pour quantifier l’impact du froid sur le maïs et comparer le degré de tolérance de différents génotypes (Fracheboud et al., 1999). Ils permettent également d’identifier les organes/tissus les plus endommagés par le stress (Leipner et al., 2009).
3.4. Stress secondaires induits par le froid
21Le froid induit un stress hydrique en provoquant une chute rapide de la conductance hydraulique racinaire. Cet effet est le résultat d’une augmentation de la viscosité de l’eau et de l’altération des membranes cellulaires qui perturbent le transport radial symplastique de l’eau dans les racines. La transpiration diminue également lors d’un transfert au froid, mais insuffisamment pour pallier la baisse d’absorption de l’eau par les racines, de sorte que la teneur en eau et le potentiel hydrique diminuent dans toute la plante, qui présente des symptômes de flétrissement. La régulation ultérieure de l’ouverture des stomates et de l’absorption de l’eau par les racines permet une récupération partielle ou totale, selon les génotypes (Melkonian et al., 2004). L’activation des aquaporines serait impliquée dans l’étape de récupération ; la quantité et le degré de phosphorylation de ces protéines augmentent en effet après un stress froid, mais cette réponse ne peut pallier des dégâts membranaires trop importants (Aroca et al., 2005).
22Lorsque les plantes sont exposées au froid, la saturation de la chaine de transporteurs d’électrons provoque l’utilisation d’autres « puits d’électrons », notamment de l’O2 dans la réaction de Mehler, au niveau du PSI, qui produit l’anion superoxide O2-, une forme très réactive de l’oxygène (ROS, Reactive Oxygen Species). Le froid occasionne aussi l’accumulation de ROS par l’activation de la NADPH oxydase. Les ROS provoquent des dommages cellulaires ou « stress oxydatif », notamment via la peroxydation des lipides membranaires. Ces dégâts sont le plus souvent mesurés par le contenu en malondialdéhyde, un sous-produit de l’oxydation des lipides, qui augmente dans des plantes de maïs exposées à un stress par le froid (Fryer et al., 1998).
23Les plantes disposent d’un métabolisme antioxydant efficace pour éliminer les ROS et détoxifier les cellules ; ce système est induit par les ROS eux-mêmes qui déclenchent une voie de signalisation (Guan et al., 2000). La forte sensibilité du maïs au stress oxydatif est associée à la compartimentation du métabolisme antioxydant : de même que les enzymes de la photosynthèse, les antioxydants sont différentiellement répartis entre les cellules du mésophylle et de la gaine périvasculaire (Figure 2). Les échanges intercellulaires étant fortement diminués lors d’un stress par le froid, le recyclage des antioxydants est compromis et les cellules de la gaine périvasculaire subissent davantage de dommages oxydants irréversibles que les cellules du mésophylle (Foyer et al., 2002).

4. Moyens envisagés pour augmenter la tolérance au froid
24La connaissance des mécanismes par lesquels les plantes tolèrent le froid permet, d’une part, d’envisager différentes méthodes de protection et, d’autre part, de définir des critères pertinents pour évaluer la sévérité d’un stress et comparer/sélectionner des génotypes. Ces développements ont pour but commun d’améliorer la tolérance des génotypes cultivés, que cela soit par des traitements physiologiques, des outils moléculaires, ou des programmes de sélection basés sur des marqueurs génétiques.
4.1. Approche physiologique
25Chez de nombreuses espèces, les plantes qui subissent un premier stress (ou « pré-stress ») par le froid résistent mieux à un second et tolèrent des températures plus basses. Cet « endurcissement » ou « acclimatation » témoigne de ce que des mécanismes de tolérance mis en place lors du premier stress perdurent ou sont induits plus rapidement lors d’un second stress. Ainsi, des plantes de maïs s’étant développées à des températures froides modérées résistent mieux que des plantes cultivées à 25 °C, à un stress froid plus sévère qui induit une photoinhibition ; cette meilleure tolérance est associée à une dissipation plus rapide de l’énergie excédentaire, à l’accumulation dans les feuilles de xanthophylles et d’antioxydants (GSH et α-tocophérol) (Leipner et al., 1997).
26Une meilleure tolérance au froid peut aussi résulter d’une acclimatation à un autre stress abiotique ou biotique. Par exemple, des plantes de maïs acclimatées à la sècheresse résistent mieux au froid que des plantes non acclimatées (Pérez de Juan et al., 1997). De plus, des traitements exogènes visant à protéger des plantes de la sècheresse ou de la salinité, qui ont pour point commun d’induire au niveau cellulaire un stress hydrique, permettent d’augmenter leur tolérance au froid (Theocharis et al., 2012).
27La comparaison de génotypes présentant des degrés de tolérance au froid différents a également permis de rechercher des corrélations entre ce trait phénotypique et d’autres caractères, biochimiques ou physiologiques, qui pourraient à la fois servir d’indicateurs et constituer des critères de sélection. L’interprétation des résultats n’est cependant pas toujours aisée car l’activation constitutive d’un mécanisme de tolérance peut soit indiquer une réelle tolérance, soit au contraire résulter de la nécessité de pallier une plus grande sensibilité. Par exemple, le fait que des génotypes tolérants contiennent moins de zéaxanthine que des génotypes plus sensibles peut être interprété par un moindre besoin de dissiper l’énergie (Fracheboud et al., 2002). La teneur en antioxydants n’est pas non plus clairement corrélée au degré de tolérance (Kingston-Smith et al., 1999). Cependant, plusieurs travaux mettent en évidence qu’une capacité accrue de synthèse de GSH et de sa régénération par l’activité GR augmentent la protection des plantes de maïs vis-à-vis du froid en maintenant un rapport GSH/GSSG élevé (Kocsy et al., 2001).
28L’accumulation d’acide abscissique (ABA) durant le stress froid a été montrée par de nombreux auteurs (Melkonian et al., 2004). Les génotypes tolérants sont capables d’accumuler plus d’ABA et de manière plus rapide que les génotypes sensibles. De plus, une application exogène d’ABA avant le froid permet l’acclimatation des plantes en stabilisant le statut hydrique via la réduction de la transpiration (fermeture des stomates) et l’augmentation du flux d’eau dans les racines (Aroca et al., 2003). L’ABA permet aussi d’accentuer la réponse au stress oxydatif: il induit l’expression des gènes du système antioxydant, la synthèse des protéines qu’ils encodent et augmente l’activité des enzymes antioxydantes.
4.2. Approche moléculaire
29Le clonage d’enzymes impliquées dans des voies métaboliques affectées par le froid permettrait d’en modifier l’activité pour augmenter la tolérance des plantes. Dans cette perspective, Kingston-Smith et al. (2000) ont surexprimé une SOD de tabac dans des plantes de maïs dans le but de les rendre plus tolérantes au stress oxydatif secondaire provoqué par les basses températures. Bien que l’activité SOD et le métabolisme antioxydant soient significativement augmentés chez les plantes transformées, leur tolérance au froid n’est pas différente des plantes non transformées. Curieusement, le confinement spatial de l’activité SOD dans les cellules de la gaine périvasculaire est observé chez les plantes transgéniques, ce qui suggère une compartimentation obligatoire du métabolisme antioxydant chez le maïs.
30Les enzymes du métabolisme photosynthétique pourraient également être limitantes pour l’expression de la tolérance au froid. Leipner et al. (2008b) ont par exemple observé qu’une variété de maïs tolérante au froid contient une activité malate déshydrogénase (MDH) plus importante qu’une variété sensible. D’autre part, certaines plantes C4 sont mieux adaptées au froid que le maïs. Ainsi le Miscanthus présente une productivité nettement supérieure à celle du maïs car il tolère mieux les températures basses ; cette meilleure performance est associée à une plus grande richesse en PPDK et en Rubisco. L’abondance de ces protéines ne baisse pas au froid (Naidu et al., 2003) et des mécanismes de compensation sont mis en place pour stimuler la synthèse des protéines du PSII telles que D1 et CP29, alors que toutes ces protéines diminuent chez le maïs (Spence et al., 2014).
31Une autre voie viserait à activer la voie de signalisation du froid de manière constitutive pour mettre en place des mécanismes de tolérance, de manière similaire à une acclimatation. D’importants progrès dans la connaissance des mécanismes moléculaires de la réponse au froid ont été réalisés chez Arabidopsis thaliana, notamment à partir d’études transcriptomiques, où une batterie de gènes COR (cold regulated genes) sont induits (Knight et al., 2012). Une partie de ceux-ci, contenant un domaine CRT/DRE (C-repeat/dehydration responsive element) dans leur promoteur sont activés par des facteurs de transcription CBF/DREB (C-repeat binding factor/dehydration responsive element binding), eux-mêmes régulés au niveau transcriptionnel par ICE (inducer of CBF expression). La protéine ICE1 est synthétisée de manière constitutive, mais son abondance est régulée en fonction de la température ambiante par ubiquitination et sumoylation. Les protéines encodées par les gènes COR sont de natures diverses et visent à réduire les dommages occasionnés par le froid pour permettre à la plante de tolérer ce stress. On retrouve donc des protéines telles que COR15 qui stabilisent les membranes chloroplastiques, des enzymes qui augmentent la proportion de lipides membranaires insaturés, des enzymes de la biosynthèse d’osmolytes et des enzymes du métabolisme antioxydant.
32Un certain nombre de gènes faisant partie d’une cascade de signalisation de même type ont été isolés chez le maïs (Marocco et al., 2005). Le froid induit l’expression de ZmCDPK1, une kinase calcium-dépendante qui pourrait intervenir dans la voie de signalisation du froid et de plusieurs facteurs de transcription dont ZmDREB1A et ZmDREB2A (Nguyen et al., 2009). Des kinases telles que ZmMKK4 augmentent la tolérance au froid quand elles sont surexprimées chez Arabidopsis (Kong et al., 2011).
33Des analyses transcriptomiques globales ont par ailleurs mis en évidence que le froid modifie l’expression de nombreux gènes régulés par l’horloge biologique et induit, entre autres, des gènes impliqués dans la biosynthèse des anthocyanes, la modification des parois cellulaires, le métabolisme des acides aminés, des lipides et de la photosynthèse (Sobkowiak et al., 2014). Il est intéressant de noter que la réponse au froid ne s’exerce pas seulement comme une cascade de régulation transcriptionnelle : l’induction de mécanismes épigénétiques tels qu’une modification du degré de méthylation de l’ADN et des histones a également été observée (Hu et al., 2012).
4.3. Approche génétique
34La base génétique de la variation de tolérance au froid chez le maïs a également été étudiée par les approches QTL (Quantitative Trait Loci) et GWAS (Genome Wide Association Studies). Les résultats de ces études restent cependant difficiles à intégrer car les résultats varient de manière importante avec le matériel génétique, les conditions d’occurrence du stress (stade des plantes, température, durée, conditions de champ ou phytotrons) et les critères de tolérance mesurés. Par exemple, une classification de génotypes basée sur la résistance au froid pendant le stade précoce d’hétérotrophie ne donne pas le même résultat que pour la résistance au froid pendant le stade autotrophe (Brandolini et al., 2000) ; la résistance au froid pendant le stade précoce dépendrait davantage de caractères maternels via la qualité des grains et la quantité de réserves (Bhosale et al., 2007). De plus, le critère ultime de tolérance est souvent la biomasse finale des plantes qui, bien qu’essentielle pour juger de la valeur agronomique d’un génotype, est un trait à multiples composantes dont chacune peut répondre à des conditions environnementales variables (Greaves, 1996). Une difficulté supplémentaire survient chez le maïs dont les variétés cultivées sont des hybrides obtenus à partir de lignées fixées. Le comportement des hybrides n’est pas toujours extrapolable à partir des caractéristiques des lignées (Bhosale et al., 2007).
35Des caractères fréquemment utilisés pour le phénotypage des plantes et l’évaluation de leur tolérance au froid sont des symptômes physiologiques du stress, comme la chlorose, l’accumulation d’anthocyanes ou la baisse d’efficacité photosynthétique estimée par la réduction du rapport Fv/Fm (Giauffret et al., 2011). Plusieurs QTLs associés à ces caractères ont été identifiés, mais ils ne sont pas associés à la biomasse finale des plantes en champ, ce qui signifie que les caractères mesurés ne sont pas pertinents pour estimer la production de biomasse ou que celle-ci est davantage déterminée par les performances de croissance après le stress (Jompuk et al., 2005 ; Leipner et al., 2008a).
36En ce qui concerne la taille des feuilles, malgré un effet génétique net de l’impact du froid sur la vitesse d’élongation, la longueur finale est moins variable, indiquant à nouveau une capacité de récupération importante des plantes (Giauffret et al., 1995). Bien que Hund et al. (2004) observent la co-localisation de QTLs associés à la taille finale des feuilles et à la biomasse finale en conditions contrôlées, la même population cultivée en champ ne montre pas cette corrélation (Jompuk et al., 2005).
37Dans une étude récente de GWA menée conjointement en chambres contrôlées et en champs, Strigens et al. (2013) ont mis en évidence que les génotypes dont la tolérance au froid est associée au maintien d’une bonne performance photosynthétique adoptent un mode de croissance xéromorphe, caractérisé par une réduction de la surface foliaire spécifique (SLA, rapport entre la surface et la biomasse des feuilles) et de la biomasse finale des plantes. Au contraire, des génotypes dont la surface foliaire et la biomasse sont peu affectées par le froid compenseraient la réduction des réactions photochimiques par une meilleure capacité de fixation enzymatique du CO2. Il est évident qu’un corrolaire fondamental de ces différentes stratégies réside dans la tolérance relative des mêmes génotypes à la sècheresse, la conductance stomatique étant régulée inversément dans les deux types d’adaptations.
5. Conclusion
38Les connaissances physiologiques et moléculaires des mécanismes de tolérance au froid fournissent des outils utiles à la sélection génétique du maïs. Cependant, la grande complexité des mécanismes sous-jacents explique la difficulté d’en identifier des déterminants génétiques majeurs. De nombreux QTLs mineurs sont vraisemblablement impliqués et les techniques de génotypage à haut débit disponibles actuellement devraient considérablement accélérer l’identification de gènes candidats (Yan et al., 2011). De nombreuses questions subsistent cependant, comme l’optimisation des populations étudiées, les critères d’évaluation utilisés pour le phénotypage des plantes et les conditions expérimentales. Les expériences en champs sont particulièrement complexes vu l’occurrence simultanée de différents stress, abiotiques et biotiques, dont l’étude croisée constitue certainement un autre défi pour l’avenir (Mittler, 2006).
Remerciements
39Ce travail a été financé par une convention de recherche tripartite entre l’Université de Liège, l’INRA et Arvalis – Institut du Végétal dans le cadre du projet Thermomaïs.
Bibliographie
Aroca R. et al., 2003. Involvement of abscisic acid in leaf and root of maize (Zea mays L.) in avoiding chilling-induced water stress. Plant Sci., 165(3), 671-679.
Aroca R. et al., 2005. The role of aquaporins and membrane damage in chilling and hydrogen peroxide induced changes in the hydraulic conductance of maize roots. Plant Physiol., 137(1), 341-353.
Bechoux N., Bernier G. & Lejeune P., 2000. Environmental effects on the early stages of tassel morphogenesis in maize (Zea mays L.). Plant Cell Environ., 23(1), 91-98.
Bhosale S.U. et al., 2007. Chilling tolerance of central European maize lines and their factorial crosses. Ann. Bot., 100(6), 1315-1321.
Bilska A. & Sowiński P., 2010. Closure of plasmodesmata in maize (Zea mays) at low temperature: a new mechanism for inhibition of photosynthesis. Ann. Bot., 106(5), 675-686.
Brandolini A., Landi P., Monfredini G. & Tano F., 2000. Variation among Andean races of maize for cold tolerance during heterotrophic and early autotrophic growth. Euphytica, 111(1), 33-41.
Caffarri S. et al., 2005. Differential accumulation of Lhcb gene products in thylakoid membranes of Zea mays plants grown under contrasting light and temperature conditions. Proteomics, 5(3), 758-768.
Chen Y.E. et al., 2013. The significance of CP29 reversible phosphorylation in thylakoids of higher plants under environmental stresses. J. Exp. Bot., 64(5), 1167-1178.
Doulis A.G., Debian N., Kingston-Smith A.H. & Foyer C.H., 1997. Differential localization of antioxidants in maize leaves. Plant Physiol., 114(3), 1031-1037.
Edwards G.E. & Baker N.R., 1993. Can CO2 assimilation in maize leaves be predicted accurately from chlorophyll fluorescence analysis? Photosynth. Res., 37(2), 89-102.
Engels C., 1994. Effect of root and shoot meristem temperature on shoot to root dry matter partitioning and the internal concentrations of nitrogen and carbohydrates in maize and wheat. Ann. Bot., 73(2), 211-219.
Foyer C.H., Vanacker H., Gomez L.D. & Harbinson J., 2002. Regulation of photosynthesis and antioxidant metabolism in maize leaves at optimal and chilling temperatures: review. Plant Physiol. Biochem., 40(6-8), 659-668.
Fracheboud Y., Haldimann P., Leipner J. & Stamp P., 1999. Chlorophyll fluorescence as a selection tool for cold tolerance of photosynthesis in maize (Zea mays L.). J. Exp. Bot., 50(338), 1533-1540.
Fracheboud Y. et al., 2002. Identification of quantitative trait loci for cold-tolerance of photosynthesis in maize (Zea mays L.). J. Exp. Bot., 53(376), 1967-1977.
Fryer M.J. et al., 1998. Relationship between CO2 assimilation, photosynthetic electron transport, and active O2 metabolism in leaves of maize in the field during periods of low temperature. Plant Physiol., 116(2), 571-580.
Giauffret C., Bonhomme R. & Derieux M., 1995. Genotypic differences for temperature response of leaf appearance rate and leaf elongation rate in field-grown maize. Agronomie, 15(2), 123-137.
GiauffretC. & Foyer C.H., 2011. Effects of chilling temperatures on maize growth and biomass production. In: Prioul J.L., Thévenot C. & Molnar T., eds. Advances in maize. London: Society of Experimental Biology, 347-372.
Greaves J.A., 1996. Improving suboptimal temperature tolerance in maize - The search for variation. J. Exp. Bot., 47(296), 307-323.
Guan L.M., Zhao J. & Scandalios J.G., 2000. Cis-elements and trans-factors that regulate expression of the maize Cat1 antioxidant gene in response to ABA and osmotic stress: H2O2 is the likely intermediary signaling molecule for the response. Plant J., 22(2), 87-95.
Hibberd J.M. & Covshoff S., 2010. The regulation of gene expression required for C4 photosynthesis. Annu. Rev. Plant Biol., 61(1), 181-207.
Hu Y. et al., 2012. Cold stress selectively unsilences tandem repeats in heterochromatin associated with accumulation of H3K9ac. Plant Cell Environ., 35(12), 2130-2142.
Hund A. et al., 2004. QTL controlling root and shoot traits of maize seedlings under cold stress. Theor. Appl. Genet., 109(3), 618-629.
Hund A. et al., 2007. Root morphology and photosynthetic performance of maize inbred lines at low temperature. Eur. J. Agron., 27(1), 52-61.
Imran M., Mahmood A., Römheld V. & Neumann G., 2013. Nutrient seed priming improves seedling development of maize exposed to low root zone temperatures during early growth. Eur. J. Agron., 49(0), 141-148.
Jompuk C., Fracheboud Y., Stamp P. & Leipner J., 2005. Mapping of quantitative trait loci associated with chilling tolerance in maize (Zea mays L.) seedlings grown under field conditions. J. Exp. Bot., 56(414), 1153-1163.
Kingston-Smith A.H., Harbinson J., Williams J. & Foyer C.H., 1997. Effect of chilling on carbon assimilation, enzyme activation, and photosynthetic electron transport in the absence of photoinhibition in maize leaves. Plant Physiol., 114(3), 1039-1046.
Kingston-Smith A.H., Harbinson J. & Foyer C.H., 1999. Acclimation of photosynthesis, H2O2 content and antioxidants in maize (Zea mays) grown at sub-optimal temperatures. Plant Cell Environ., 22(9), 1071-1083.
Kingston-Smith A.H. & Foyer C.H., 2000. Overexpression of Mn-superoxide dismutase in maize leaves leads to increased monodehydroascorbate reductase, dehydroascorbate reductase and glutathione reductase activities. J. Exp. Bot., 51(352), 1867-1877.
Knight M.R. & Knight H., 2012. Low-temperature perception leading to gene expression and cold tolerance in higher plants. New Phytol., 195(4), 737-751.
Kocsy G. et al., 2001. Increasing the glutathione content in a chilling-sensitive maize genotype using safeners increased protection against chilling-induced injury. Plant Physiol., 127(3), 1147-1156.
Kong X. et al., 2011. ZmMKK4, a novel group C mitogen-activated protein kinase kinase in maize (Zea mays), confers salt and cold tolerance in transgenic Arabidopsis. Plant Cell Environ., 34(8), 1291-1303.
Leipner J., Fracheboud Y. & Stamp P., 1997. Acclimation by suboptimal growth temperature diminishes photooxidative damage in maize leaves. Plant Cell Environ., 20(3), 366-372.
Leipner J. et al., 2008a. QTL studies reveal little relevance of chilling-related seedling traits for yield in maize. Theor. Appl. Genet., 116(4), 555-562.
Leipner J. & Mayer E., 2008b. QTL mapping in maize seedlings reveals little relevance of C4 cycle enzymes and antioxidants for genotypic differences in chilling tolerance of photosynthesis. Maydica, 53(3-4), 269-277.
Leipner J. & Stamp P., 2009. Chilling stress in maize seedlings. In: Bennetzen J.L. & Hake S.C., eds. Handbook of maize: its biology. New York, USA: Springer, 291-310.
Lejeune P. & Bernier G., 1996. Effect of environment on the early steps of ear initiation in maize (Zea mays L.). Plant Cell Environ., 19(2), 217-224.
Long S.P. & Spence A.K., 2013. Toward cool C4 crops. Annu. Rev. Plant Biol., 64, 701-722.
Lorgeou J. & Prioul J.L., 2011. Agrophysiology: light interception, crop photosynthesis, mineral nutrition and crop managing. In: Prioul J.L., Thévenot C. & Molnar T., eds. Advances in maize. London: Society of Experimental Biology, 393-410.
Louarn G. et al., 2008. Relative contributions of light interception and radiation use efficiency to the reduction of maize productivity under cold temperatures. Funct. Plant Biol., 35(9-10), 885-899.
Louarn G., Andrieu B. & Giauffret C., 2010. A size-mediated effect can compensate for transient chilling stress affecting maize (Zea mays) leaf extension. New Phytol., 187(1), 106-118.
Marocco A., Lorenzoni C. & Fracheboud Y., 2005. Chilling stress in maize. Maydica, 50(3-4), 571-580.
Melkonian J., Yu L.X. & Setter T.L., 2004. Chilling responses of maize (Zea mays L.) seedlings: root hydraulic conductance, abscisic acid, and stomatal conductance. J. Exp. Bot., 55(403), 1751-1760.
Miedema P., 1982. The effects of low temperature on Zea mays. In: Brady N.C., ed. Advances in agronomy. New York, USA: Academic Press, 93-128.
Mittler R., 2006. Abiotic stress, the field environment and stress combination. Trends Plant Sci., 11(1), 15-19.
Muller B., Reymond M. & Tardieu F., 2001. The elongation rate at the base of a maize leaf shows an invariant pattern during both the steady-state elongation and the establishment of the elongation zone. J. Exp. Bot., 52(359), 1259-1268.
Naidu S.L. et al., 2003. Cold tolerance of C4 photosynthesis in Miscanthus x giganteus: adaptation in amounts and sequence of C4 photosynthetic enzymes. Plant Physiol., 132(3), 1688-1697.
Nguyen H.T., Leipner J., Stamp P. & Guerra-Peraza O., 2009. Low temperature stress in maize (Zea mays L.) induces genes involved in photosynthesis and signal transduction as studied by suppression subtractive hybridization. Plant Physiol. Biochem., 47(2), 116-122.
Nie G.Y. & Baker N.R., 1991. Modifications to thylakoid composition during development of maize leaves at low growth temperatures. Plant Physiol., 95(1), 184-191.
Parent B. et al., 2010. Modelling temperature-compensated physiological rates, based on the co-ordination of responses to temperature of developmental processes. J. Exp. Bot., 61(8), 2057-2069.
Pérez de Juan J., Irigoyen J.J. & Sanchez-Diaz M., 1997. Chilling of drought-hardened and non-hardened plants of different chilling-sensitive maize lines changes in water relations and ABA contents. Plant Sci., 122(1), 71-79.
Périlleux C., Colasanti J. & Irish E., 2011. Genetic control of flowering time in maize. In: Prioul J.L., Thévenot C. & Molnar T., eds. Advances in maize. London: Society for Experimental Biology, 121-140.
Pietrini F., Iannelli M.A. & Massacci A., 2002. Anthocyanin accumulation in the illuminated surface of maize leaves enhances protection from photo-inhibitory risks at low temperature, without further limitation to photosynthesis. Plant Cell Environ., 25(10), 1251-1259.
Prasad T.K., Anderson M.D., Martin B.A. & Stewart C.R., 1994. Evidence for chilling-induced oxidative stress in maize seedlings and a regulatory role for hydrogen peroxide. Plant Cell, 6(1), 65-74.
Rymen B. et al., 2007. Cold nights impair leaf growth and cell cycle progression in maize through transcriptional changes of cell cycle genes. Plant Physiol., 143(3), 1429-1438.
Sobkowiak A. et al., 2014. Genome-wide transcriptomic analysis of response to low temperature reveals candidate genes determining divergent cold-sensitivity of maize inbred lines. Plant Mol. Biol., 85(3), 317-331.
Sowiński P., Rudzińska-Langwald A. & Kobus P., 2003. Changes in plasmodesmata frequency in vascular bundles of maize seedling leaf induced by growth at sub-optimal temperatures in relation to photosynthesis and assimilate export. Environ. Exp. Bot., 50(2), 183-196.
Spence A.K. et al., 2014. Transcriptional responses indicate maintenance of photosynthetic proteins as key to the exceptional chilling tolerance of C4 photosynthesis in Miscanthus × giganteus. J. Exp. Bot., 65(13), 3737-3747.
Stone P.J., Sorensen I.B. & Jamieson P.D., 1999. Effect of soil temperature on phenology, canopy development, biomass and yield of maize in a cool-temperate climate. Field Crops Res., 63(2), 169-178.
Strigens A. et al., 2013. Association mapping for chilling tolerance in elite flint and dent maize inbred lines evaluated in growth chamber and field experiments. Plant Cell Environ., 36(10), 1871-1887.
Theocharis A., Clement C. & Barka E.A., 2012. Physiological and molecular changes in plants grown at low temperatures. Planta, 235(6), 1091-1105.
Tollenaar M., Daynard T.B. & Hunter R.B., 1979. Effect of temperature on rate of leaf appearance and flowering date in maize. Crop Sci., 19(3), 363-366.
Tollenaar M. & Hunter R.B., 1983. A photoperiod and temperature sensitive period for leaf number of maize. Crop Sci., 23(3), 457-460.
Yan J., Warburton M. & Crouch J., 2011. Association mapping for enhancing maize (Zea mays L.) genetic improvement. Crop Sci., 51(2), 433-449.
