- Accueil
- Volume 11 (2007)
- numéro 4
- Synthèse bibliographique : problématique de la jacinthe d’eau, Eichhornia crassipes, dans les régions tropicales et subtropicales du monde, notamment son éradication par la lutte biologique au moyen des phytopathogènes
Visualisation(s): 17647 (136 ULiège)
Téléchargement(s): 825 (10 ULiège)
Synthèse bibliographique : problématique de la jacinthe d’eau, Eichhornia crassipes, dans les régions tropicales et subtropicales du monde, notamment son éradication par la lutte biologique au moyen des phytopathogènes

Notes de la rédaction
Reçu le 1er décembre 2006, accepté le 23 mai 2007
Résumé
La jacinthe d’eau probablement originaire d’Amérique du Sud se développe actuellement entre les 35e parallèles nord et sud de la planète. Elle a été introduite dans plusieurs régions du monde comme plante ornementale, où elle est devenue plus tard l’une des plus dangereuses adventices aquatiques d’eau douce du monde. Son infestation peut être contrôlée par le biais de traitements physiques et chimiques. Cependant, ces techniques de lutte sont souvent coûteuses et dangereuses pour la santé humaine et l’environnement. D’autre part, à l’instar des législations occidentales, celles des pays en voie de développement sont de plus en plus restrictives sur les substances chimiques autorisées. Dès lors, un intérêt grandissant a été porté aux luttes alternatives parmi lesquelles la lutte biologique. Cette lutte au moyen d’insectes, de poissons et de mammifères contre la jacinthe pourrait être renforcée par l’application de mycoherbicides. Ces derniers sont en principe plus respectueux vis-à-vis de l’environnement et de la santé humaine et sembleraient constituer une alternative crédible supplémentaire pour une gestion durable de la jacinthe.
Abstract
Review: problems of the water hyacinth, Eichhornia crassipes, in the tropical and subtropical areas of the world, in particular its eradication using biological control method by means of plant pathogens. Water hyacinth, probably originating from South America, grows between 35th North and South parallels of the planet. It was introduced into several regions of the world as ornamental plant, where it became later one of the most dangerous world water weed. Its infestation can be controlled by physical and chemical treatments. However, these methods are expensive and dangerous for human health and environment. Moreover, following Western legislations example, those of developing countries are highly restrictive against authorised chemical molecules. Consequently, a growing interest was given to alternative solutions, such as biological control. That control using insects, fishes and mammiferes against water hyacinth could be strengthened with the application of mycoherbicides. These mycoherbicides are more respectful for environment and public health and seem to constitute an additional realistic alternative for water hyacinth durable management.
Table des matières
1. Introduction
1La jacinthe est une plante aquatique macrophyte flottante, se développant à la surface ou dans la boue des cours d’eau. Sa présence dans les régions infestées des pays tropicaux et subtropicaux a provoqué de graves conséquences économiques et écologiques (Ghabbour et al., 2004 ; Center et al., 2005). La plante, grâce à la hauteur et à la forte densité qu’elle peut atteindre, peut réduire la lumière et l’oxygène sous l’eau. Cette asphyxie de la vie sous-marine affecte l’équilibre de l’écosystème aquatique. Elle freine également le transport fluvial, la pêche et obstrue les prises d’eau des barrages hydroélectriques et des réseaux d’irrigation. Harley (1990) et Gutiérrez et al. (1994) ont rapporté qu’au regard de la capacité reproductrice de la jacinthe, de son adaptabilité, des conditions alimentaires et de sa résistance aux conditions défavorables, il est jusqu’à présent impossible de l’éradiquer une fois introduite dans une nouvelle zone. Bien que l’origine de l’infestation de la jacinthe à travers le monde (commencée au début du 20e siècle) soit connue, celle de son expansion actuelle est mal comprise. Durant les dix dernières années, sa propagation rapide en Afrique tropicale et subtropicale a provoqué des crises écologiques et hydro-agricoles. La gestion durable de l’infestation de la jacinthe s’est orientée vers la lutte biologique au moyen de ses ennemis naturels que sont les insectes et les phytopathogènes.
2. Systématique et description morphologique de la jacinthe
2La jacinthe d’eau est une monocotylédone herbacée vivace, elle appartient à la division des Magnoliophyta, classe des Liliopsida, subclasse des Commeinidae, super-ordre des Commelinanae, ordre des Pontederiales, famille des Pontederiaceae, genre Eichhornia, épithète spécifique : crassipes (Martius) Solms-Laubach (Qaisar et al., 2005). Il existe 6 autres espèces du genre Eichhornia (E. paniculata, E. paradoxa, E. heterosperma, E. diversifolia, E. venezuelensis, E. azurea), essentiellement néo-tropicales qui sont confinées en Amérique du Sud. Seule E. natans est endémique en Afrique (Sénégal, Egypte, Soudan, Nigeria, Madagascar et Mali) (Gopal, 1987 ; Dembélé, 1994 ; Diarra, 1997). La jacinthe, du point de vue morphologique, peut avoir une variabilité considérable dans la forme et la couleur de ses feuilles et de ses fleurs, aussi selon l’âge de la plante. Les fleurs sont bleuâtres pourpres, grandes et auto-fertiles. Les graines sont produites en grand nombre dans des capsules, chaque capsule pouvant contenir jusqu’à 300 graines. Les graines peuvent rester viables de 5 à 20 ans (Gopal, 1987). La feuille est vert brillant, les fleurs sont lilas, similaires à celles des orchidées (EPA, 1988). Le pétiole (5 cm de diamètre et 30-50 cm de longueur) est un flotteur dans les conditions ouvertes et fuselé dans les conditions de forte densité de la plante. Il est constitué de tissus lacunaires. Les bourgeons axillaires se développent en stolons dont résultent de nouvelles filiations de la plante (Figure 1) qui, à la longue, forment un tapis inextricable (natte) pouvant supporter le poids d’un homme (Figure 2) (Dagno, 2006). Le système racinaire de la jacinthe est fasciculé, bleu foncé ; il devient blanc quand il se développe dans l’obscurité. Il contient des colorants solubles comme l’anthocyanine, toxique pour les herbivores. De la racine aux fleurs, la jacinthe peut mesurer plus de 1,5 m (Center et al., 2005). L’inflorescence hétérostyle est constituée de 10 à 30 fleurs avec 6 pétales bleus-violets ou roses-violets dont le pistil est situé entre ou au-dessus de 2 groupes d’étamines. Le pétale supérieur porte une tache jaune d’or encadré par une ligne bleue (Figure 1).


3. Dispersion de la jacinthe à travers le monde
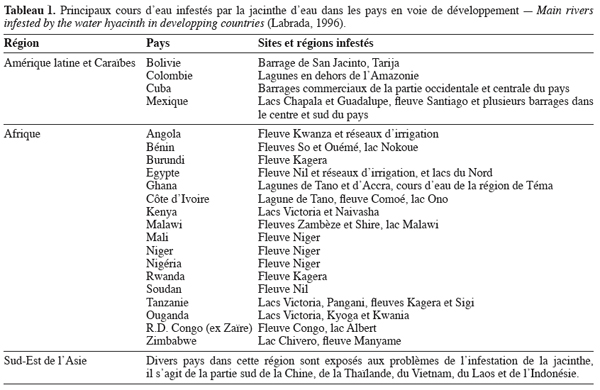
3L’ensemble de la zone d’Amérique du Sud est considéré comme région naturelle de la jacinthe (Center et al., 2002) et le Porto Rico serait son principal centre de dispersion (Gopal, 1987). Cependant, Barret et al. (1982) ont rapporté que la jacinthe serait originaire du bassin amazonien où elle vit en symbiose dans l’écosystème aquatique. Sa distribution adventive influencée par l’homme a été remarquable au début du 20e siècle. La dispersion a été orientée d’abord de l’Amérique du Sud vers celle du Nord dès le début du 19e siècle où plusieurs lacs et cours d’eau ont été infestés en Louisiane, Alabama, Californie, Floride et au Texas (Gopal, 1987). La progression de la jacinthe est faible dans les conditions de basses eaux, elle s’enracine dans la boue tandis qu’elle est très forte en période de crue où la plante flotte sur l’eau. C’est la période de dissémination et d’envahissement des réseaux hydrographiques. La figure 2 illustre l’envahissement des cours d’eau en Afrique commencé au début du 20e siècle (FAO, 2000 ; Ghabbour et al., 2004 ; El Zawahry et al., 2004). Le tableau 1 regroupe les principaux cours d’eau envahis par la jacinthe dans le Tiers-Monde.
4. Multiplication de la jacinthe
4La jacinthe est une plante pérenne à croissance indéterminée. L’intensité de croissance de la plante est déterminée soit par évaluation de la surface de l’eau couverte durant une période donnée, soit par évaluation de la densité ou du poids des plantes par unité de surface (EPA, 1988). Dans les sites naturels de la jacinthe, cette densité est relativement faible (10 kg.m-2 en poids frais), tandis que dans les régions d’infestation, elle atteint 60 kg.m-2 (Gopal, 1987). La croissance maximale de la jacinthe est observée à 20–30 °C et elle est inhibée à 8–15 °C (Stephenson et al., 1980). La jacinthe possède 2 modes de multiplication.
4.1. Multiplication asexuée ou végétative
5La multiplication de la jacinthe s’effectue principalement par voie végétative (filiations) et sa forte prolifération pourrait être expliquée par la « non inhibition » des bourgeons axillaires et l’absence d’ennemis naturels dans les zones envahies. Aussi les aménagements hydrauliques sur les cours d’eau favoriseraient également sa croissance (EPA, 1988). La propagation végétative est très importante dans les nouveaux sites d’infestation. Les nouvelles plantes sont produites à partir de l’élongation de stolons due à la division des méristèmes axillaires de la plante mère (Center et al., 2005). Les clones très fragiles restent fixés à la plante mère par le stolon puis se détachent sous la pression des courants d’eau, permettant à de nouveaux individus de coloniser d’autres zones (Wilson et al., 2005). Selon Babu et al. (2003), dix plants en 8 mois peuvent produire 655330 individus, soulignant ainsi le potentiel invasif de la plante. Holm et al. (1977) ont obtenu 30 clones à partir de 2 plantes mères en 23 jours. Le taux de croissance (ou la biomasse) de la jacinthe peut être déterminé par l’équation suivante : Nt = N0 Xt, où N0 est le nombre de plant au temps T0 et Nt le nombre de plants obtenus à la fin du temps T, X est le taux de croissance/jour (Gopal, 1987).
4.2. Multiplication sexuée ou par les semences
6Selon Gopal (1987), il est rare de trouver dans les zones d’introduction des graines sur la jacinthe. Gopal (1987) a rapporté que Parija (1934) a été le premier à observer des graines de la plante en Inde. Les graines ont été considérées comme le principal facteur de multiplication de la plante au Sri Lanka et la présence de fruits mûrs y a été observée entre mai et décembre (Gopal, 1987) et la floraison dure environ 15 jours (Center et al., 2002). Malgré une quantité élevée de graines produites (200–300), seulement un maximum de 34 graines sont viables par capsule (Wilson et al., 2005).
5. Obstacles créés par la jacinthe et coût de gestion
7La jacinthe cause de nombreux problèmes quand la prolifération rapide de sa natte couvre la surface des eaux douces. Ces problèmes sont d’ordre écologique, mais portent également sur la santé publique et l’agriculture (FAO, 2000). Aux USA, la plante est interdite d’importation en Arizona, en Floride et en Louisiane (Holm et al., 1977).
5.1. Obstacles pour le transport fluvial et les barrages hydro-électriques
8La jacinthe croît d’une manière très dense sur les canaux et les fleuves en formant un tapis vert supportant la marche d’un homme. Ce phénomène provoque des barrières à l’écoulement normal de l’eau, particulièrement grave lors des périodes de crue où on assiste à des inondations dues à l’affaissement des digues. L’accès aux ports et aux secteurs d’amarrage des bateaux est souvent bloqué par les nattes de la jacinthe. Celles-ci rendent également infranchissables les canaux et les fleuves. Les îlots formés par les touffes de la plante perturbent le transport sur le lac Victoria et plusieurs cours d’eau du Sud-Est de l’Asie. Le barrage Kariba sur le fleuve Zambèze en Zambie se trouve bloqué par les nattes de jacinthe réduisant considérablement son débit (Harley et al., 1997). Beaucoup de grands ouvrages hydro-électriques souffrent des effets néfastes de la présence de la jacinthe. Par exemple, les barrages Owen Falls de Ninja sur le lac Victoria et Kariba sur le fleuve Zambèze en Zambie sont bloqués par les nattes de la plante, entraînant ainsi des coupures fréquentes de la production d’électricité.
5.2. Augmentation de l’évapotranspiration des cours d’eau et formation d’un micro-habitat pour divers vecteurs de maladie
9Diverses études ont été effectuées pour établir le rapport entre les plantes aquatiques et le taux d’évapotranspiration comparé avec l’évaporation d’une surface libre des cours d’eau. La perte d’eau due à l’évapotranspiration est 1,8 fois supérieure à celle de la même surface sans infestation (Harley et al., 1997). L’écoulement d’eau dans le Nil pourrait être réduit jusqu’à un dixième en raison des pertes causées par la jacinthe dans le lac Victoria. Les maladies associées à la présence des mauvaises herbes aquatiques dans les pays tropicaux en voie de développement sont les causes majeures des problèmes de santé publique : la malaria, la bilharziose, la schistosomiase et la filariose lymphatique. Certaines espèces de larves de moustique prospèrent dans l’environnement créé par la présence de ces mauvaises herbes, ainsi une corrélation entre la bilharziose et la jacinthe d'eau a été établie. Le type brughian de la filariose, responsable de la filariose lymphatique en Afrique du Sud a été entièrement lié à la présence de la jacinthe.
5.3. Obstacles pour la pêche et réduction de la biodiversité aquatique
10L’accès aux sites de pêche est devenu difficile à cause de la forte présence des nattes de jacinthe. Des pertes ou des dommages en équipements de pêche résultant de l’enchevêtrement des filets et lignes dans le système racinaire ont occasionné moins de prise et souvent des pertes de vie (Harley et al., 1997). Ceci provoque de graves crises socio-économiques dans les régions où la population est fortement dépendante des activités de la pêche. Les pêcheurs du lac Victoria ont noté une augmentation de la température des cours d’eau envahis par la jacinthe et une forte diminution de la population de poisson. Ils se plaignent également de la recrudescence de la population de crocodiles et de serpents due à la présence de l’adventice (Harley et al., 1997). Dans les zones de prolifération, il est difficile pour d’autres plantes aquatiques de survivre. Ce phénomène provoque un déséquilibre dans le microsystème aquatique et les espèces dont l’existence est liée à l’écosystème en place, sont menacées d’extinction. Aussi, il se produit une détérioration de la qualité de l’eau, grave pour la population riveraine qui y recueille de l’eau pour boire et se laver.
5.4. Coûts de la gestion
11Il est difficile de quantifier l’impact économique dû à l’infestation de la jacinthe dans les pays en voie de développement. Cependant, il faut noter que cette infestation affecte plusieurs aspects de l’économie des pays infestés. Gopal (1987) a rapporté que la présence de la jacinthe a causé une perte annuelle de 65 à 75 millions $US dans les années 1940 en Louisiane. Selon Holm et al. (1977), cette perte a atteint les 43 millions $US en 1956 en Floride, au Mississipi, en Alabama et en Louisiane. La Floride a dépensé plus de 43 millions $US de 1980 à 1991 et depuis, dépense annuellement 3 millions $US dans la lutte contre la jacinthe (Mullin et al., 2000). Les coûts annuels pour la gestion de cette plante s’élèvent à 500000 $US en Californie (Mullin et al., 2000). Pour Fayad et al. (2001), ce sont 487 km2 de canaux d’irrigation et 151 km2 de lacs qui sont couverts par la jacinthe dans les différentes régions de l’Egypte, occasionnant une perte de 3,5 x 1012 m3 d’eau par an, quantité suffisante pour irriguer environ 432 km2 par an. Dembélé et al. (1997) ont rapporté l’infestation de plusieurs cours d’eau du fleuve Niger à partir de 1990 au Mali. Ainsi la région de Koulikoro, le District de Bamako, les mares de Sébougou, la zone de retenue du barrage de Markala, la marre de Molodo et les réseaux d’irrigation de l’office du Niger sont aujourd’hui sous la menace de ce fléau dont l’envahissement peut atteindre 71 à 100 % de la surface des cours d’eau de juin à octobre (Figure 2) (FAO, 1997). Cette infestation coûte au Mali 83334 à 100000 $US par an consentis au nettoyage des cours du fleuve (Dagno, 2006).
6. Moyens de lutte physique et chimique et valorisation
6.1. Lutte physique
12La lutte physique (mécanique et manuelle) contre la jacinthe fournit un meilleur contrôle à court terme à la prolifération de la plante (Pieterse et al., 1996). La méthode manuelle est coûteuse en main-d’œuvre et risquée pour les travailleurs (présence de crocodiles, d’hippopotames et de boas). Quant à la méthode mécanique, elle nécessite des équipements lourds pour la collecte des plants dans l’eau (Gutiérrez et al., 1996), leur transport sur la berge et leur acheminement vers un centre de traitement des déchets (Harley et al., 1997). Elle occasionne un investissement important que l’économie de plusieurs pays infestés ne peut guère supporter. En outre, la lutte physique contribuerait à la dispersion de la jacinthe à travers les fragments de la plante délaissés dans l’eau après le ramassage. Enfin, il est difficile d’utiliser ces engins dans les eaux profondes (Harley et al., 1997).
6.2. Lutte chimique
13Plusieurs herbicides sont efficaces contre la jacinthe et sont appliqués par traitement aérien ou terrestre. Cependant la capacité de translocation des molécules chimiques des stolons aux autres parties de la plante est un facteur limitant pour les herbicides. Les plants âgés seraient moins sensibles que les plus jeunes (Sculthorpe, 1985). La formulation « Rodéo » à base de glyphosate, un herbicide non sélectif, utilisée à 2 kg.ha-1 tue complètement la plante 3–8 semaines après application (Gopal, 1987 ; Gutiérrez et al., 1996). Elle est faiblement toxique pour les invertébrés aquatiques. Le 2,4-D (acide 2,4-dichlorophénoxyacétique) appliqué généralement par pulvérisation aérienne à 1 à 12 kg.ha-1 offre un contrôle efficace surtout lorsqu’il est appliqué pendant les périodes chaudes (Gopal, 1987). Il est faiblement à modérément toxique pour les oiseaux y compris les aquatiques. Par contre, sa formulation ester est toxique pour les poissons et les invertébrés aquatiques. Le sulfate et le chélate de cuivre, des herbicides non sélectifs, appliqués à 3,5.10-5 kg.ha-1 inhibent la croissance de E. crassipes utilisés à 1,03.10-5 kg.ha-1, les plants sont complètement anéantis (Gopal, 1987). Cependant, le sulfate et le chélate de cuivre peuvent être toxiques pour les poissons, en particulier les truites, quelques mammifères, les invertébrés aquatiques et les organismes du sol. Les inconvénients de la lutte chimique résident non seulement en la destruction de l’écosystème aquatique mais aussi aux effets néfastes des résidus des herbicides sur l’environnement et la santé de la population. Cette population recueille l’eau de boisson dans les cours d’eau (Harley et al., 1997). De plus, l’application à long terme des mêmes herbicides peut entraîner l’apparition d’une résistance chez la jacinthe d'eau (Babu et al., 2003).
6.3. Valorisation de la jacinthe comme moyen de lutte
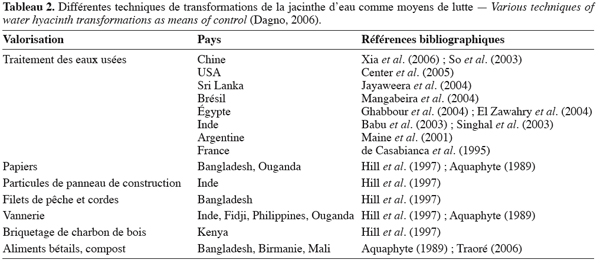
14Plusieurs tentatives de valorisation de la jacinthe sont en cours d’étude (Tableau 2). Jusqu’à présent, aucune de ces activités n’a réellement abouti à un développement industriel. De plus, il est important de signaler que les pays en voie de développement ne devraient pas encourager la propagation de la jacinthe pour des fins d’utilisation. Les intérêts de leur population seront sauvegardés en cherchant plutôt un contrôle efficace et à long terme de la plante que par sa valorisation (Gopal, 1987).
7. La lutte biologique au moyen des insectes, des poissons et des phytopathogènes
7.1. Usage des insectes
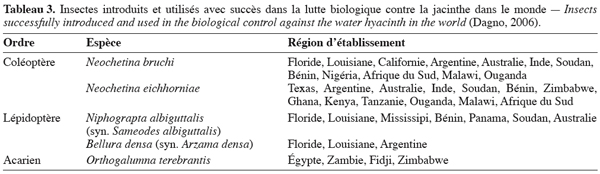
15La lutte biologique pourrait constituer une alternative intéressante à la lutte chimique. La lutte biologique contre la jacinthe s’est développée dans les années 1960 par l’importation d’insectes à partir du bassin amazonien du Brésil (Deloach et al., 1989). Cette lutte est basée sur l’utilisation des ennemis naturels de la plante dans le but de créer une pression permanente sur elle. Une centaine d’espèces d’insectes comprenant des Lépidoptères, Coléoptères, Hémiptères, Dermaptères et Orthoptères a été relevée sur la jacinthe (Gopal, 1987). Parmi celles-ci, une douzaine d’espèces s’est révélée capable de provoquer d’importants dommages foliaires dont 5 ont été utilisés avec succès dans la lutte biologique contre la jacinthe (Tableau 3). Actuellement, Neochetina spp. est largement utilisée avec succès dans des programmes de biocontrôle aux USA et dans d’autres parties du monde. Chen et al. (2005) ont rapporté une réduction de 53 % de la densité des plants, de 67 % de la hauteur des plants, de 29 % du nombre de feuilles par plant, de 41 % du diamètre des feuilles et de 65 % de la biomasse des plants grâce à l’application de Neochetina spp. en Chine. Ajuonu et al. (2003) ont observé une réduction de la biomasse de la jacinthe de 5 à 100 % avec Neochetina spp. de 1991 à 1993 sur les fleuves Oueme et Zou au Bénin.
7.2. Usage des poissons herbivores
16Les poissons herbivores tels que la carpe chinoise, Ctenopharyngo idella, ainsi que les carpes Tilapia melanopleura et T. mossambica se nourrissent de la jacinthe. La carpe chinoise est utilisée à travers les USA pour réduire la densité des plantes aquatiques dans les cours d’eau consacrés aux sports de pêche. Cependant, l’espèce se révèle non spécifique à la jacinthe (Gopal, 1987).
7.3. Usage des phytopathogènes
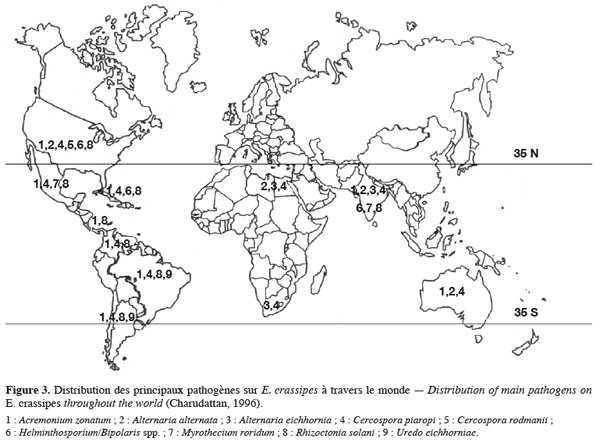
17Au cours de la seconde moitié du 20e siècle, l’application massive de spores des champignons pathogènes spécifiques comme bioherbicides a retenu l’attention des chercheurs. Des investigations ont été menées sur de nombreux microorganismes et d’autres sont en cours d’étude (Charudattan, 2001 ; Auld et al., 2003). L’hypothèse selon laquelle l’infestation par la jacinthe s’est propagée comme une « grippe » par absence d’ennemis naturels et dans les conditions de pollution des cours d’eau dans les régions infestées pourrait être formulée. Au fil de sa sédentarisation dans ces milieux, un certain nombre de microorganismes sont devenus pathogènes sur la plante. La figure 3 illustre ces pathogènes hautement virulents qui sévissent sur la jacinthe à travers le monde. Des études effectuées sur C. rodmanii, A. alternata et A. eichhorniae, ont montré des possibilités de contrôle efficace sur E. crassipes (Charudattan, 1996 ; Babu et al., 2003 ; Shabana, 2005). La littérature a rapporté le contrôle de plusieurs adventices par des bioherbicides à base de champignons phytopathogènes. Plusieurs études sont en cours pour évaluer les potentiels d’utilisations de A. eichhornia, A. alternata, Curvularia sp. , Fusarium sp. comme bioherbicides contre la jacinthe (Babu et al., 2003 ; Shabana, 2005 ; Dagno, 2006). Le potentiel d’application de cette lutte sera exploré en détails dans la suite de ce document.
8. Avancement du développement de bioherbicides contre la jacinthe et ses diverses étapes
18A l’heure actuelle, aucun bioherbicide contre la jacinthe n’est disponible dans le commerce, même si un produit ciblant la jacinthe, ABG 5003 (à base de C. rodmanii) a été enregistré auprès de l’EPA (Environmental Protection Agency) aux USA (Charudattan, 2001).
8.1. Etapes de développement d’un bioherbicide
19Les caractéristiques requises pour le développement d’un bioherbicide potentiel sont sa capacité de contrôle de l’adventice cible, ses effets inoffensifs sur l’écologie, ses capacités de croissance et de sporulation sur un milieu artificiel donc son aptitude à une production prolifique, sa virulence spécifique, son agressivité et sa stabilité génétique (Steven, 2005). Ainsi le développement d’un bioherbicide requiert 3 phases principales. La phase d’isolement commence par une collection du matériel végétal cible malade. La réalisation du postulat de Koch à partir de l’agent causal permet l’identification et la sélection du pathogène. La phase de sélection s’intéresse à l’étude écologique du pathogène, en établissant ses conditions optimales de sporulation, d’agressivité ainsi que l’évaluation de ses gammes d’hôtes potentiels. Les possibilités de culture du pathogène sur milieu artificiel, ainsi que sa conservation sur ce milieu à moyen et long terme font également partie de cette 2e phase et constituent un pré-requis pour l’application à grande échelle du bioherbicide. Cette phase comporte aussi l’étude des modes d’action de l’agent pathogène. La phase finale consiste à impliquer un collaborateur industriel pour la distribution et la commercialisation du produit fini (Figure 4).
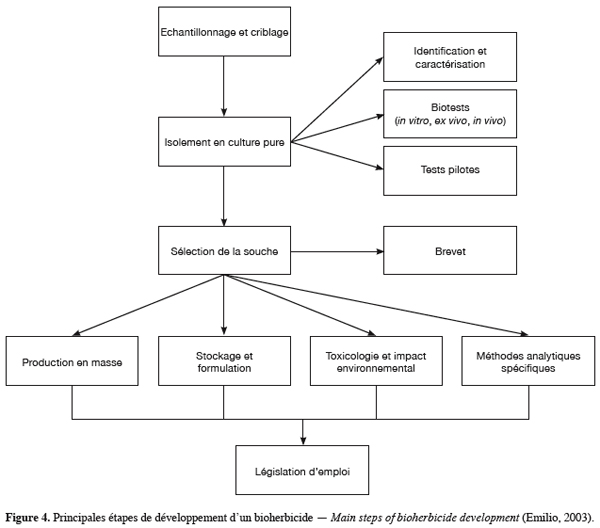
8.2. Isolement et sélection de microorganismes pathogènes sur la jacinthe
20Une prospection des microorganismes pathogènes de la jacinthe dans le bassin supérieur de l’Amazonie en Equateur et au Pérou a permis d’identifier 3 groupes de champignons (Deuteuromycotina, Ascomycotina et Basidiomycotyna) sur la plante (Evans et al., 2001). Parmi eux, onze pathogènes ont été étudiés par Charudattan (1996) et par Shabana (1997). Ils ont induit d’importantes lésions foliaires conduisant à la mort de la plante, se révélant ainsi être des agents prometteurs de contrôle biologique (Tableau 4).
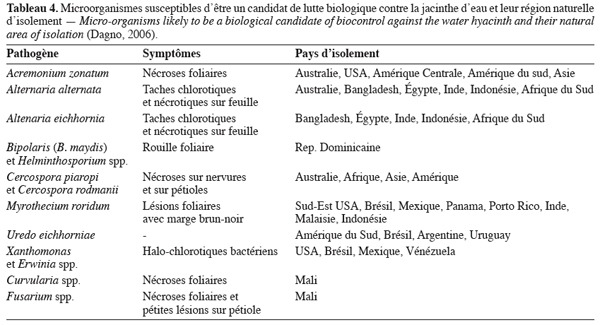
8.3. Efficacité des microorganismes en tant qu’agents potentiels de bioherbicide contre la jacinthe
21Des études de phytotoxicité ont été menées en conditions contrôlées et naturelles sur certains pathogènes isolés sur la jacinthe. La mort de la plante a été obtenue quelques semaines après pulvérisation avec Acremonium zonatum, Alternaria eichhornia et Cercospora rodmanii (Tableau 5). Des études supplémentaires doivent être envisagées pour évaluer le potentiel de contrôle des genres de Bipolaris, Drechslera, Fusarium et de bactéries sur la jacinthe (Shabana et al., 1997 ; Charudattan, 2001). Susha et al. (2002) et Praveena et al. (2004) ont rapporté l’efficacité de F. equiseti et F. pallidoroseum dans le contrôle de la jacinthe. En plus de cette dernière, F. pallidoroseum s’est révélée hautement pathogène pour 20 autres adventices dont Phyllanthus niruri, Cleome viscosa, Vernonia cinerea et Emilia sonchifolia où elle provoque une sévère défoliation. Shabana (2005) et Shabana et al. (2005) ont rapporté une efficacité de 100 % de A. eichhornia sur la jacinthe, 7 à 13 semaines après pulvérisation au champ. Selon Babu et al. (2003), un contrôle efficace de la jacinthe est obtenu avec Alternaria alternata. Les plants ont été pulvérisés avec une formulation de 106 conidies par ml et 10 % d’émulsion d’huile.
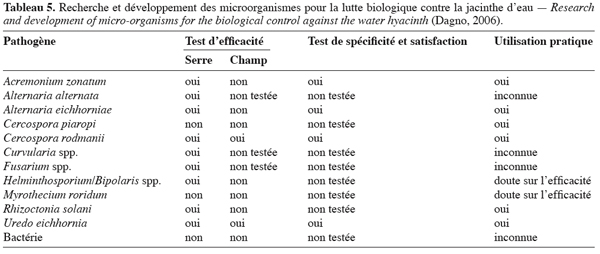
8.4. Mécanismes d’action du bioherbicide
22Les informations concernant les modes d’action du bioherbicide sur les plantes cibles sont actuellement parcellaires. Les modes d’action de A. eichhornia et de C. piaropi ont été décrits par Charudattan et al. (1982) et Shabana et al. (1997). Une fois sur E. crassipes, les spores germent, le mycélium pousse à la surface de la feuille avant d’y pénétrer à travers les stomates et les lenticelles. L’activité du pathogène induit une modification profonde de l’ultra-structure des chloroplastes, des nucléoles et des mitochondries cellulaires (Shabana et al., 1997). Certaines mycotoxines sécrétées, notamment la bostrycine et la déoxybostrycine, détruisent l’enveloppe des chloroplastes et favorisent l’hypertrophie des plastoglobules. L’enveloppe nucléaire dégénère avec précipitation des électrons des enveloppes mitochondriales cellulaires (Charudattan et al., 1982). Le mécanisme d’action est surtout basé sur la dégradation des hydrates de carbones (saccharose et les sucres réduits) de la plante par les pathogènes (Shabana et al., 1997). Selon Shabana et al. (2005), il se produit une augmentation du taux de phénol dans les feuilles après leur inoculation avec A. eichhornia (souche Ae5). Le phénol est stocké dans les tissus adaxiales, dans l’épiderme abaxiale et autour des vacuoles provoquant une hypertrophie des cellules.
8.5. Production et formulation
23Les conditions environnementales ont probablement un effet indésirable sur l’efficacité des bioherbicides. Pour compenser cette altération, plusieurs techniques de protection de l’agent de lutte biologique ont été proposées dans la littérature par Greaves et al. (1998) ; Boyetchko et al. (1999) et Daigle et al. (2002). La formulation solide consiste à la production du pathogène sur milieu solide (Boyette et al., 1993 ; Bourdôt et al., 1995 ; Grey et al., 1995 ; Vogelgsang et al., 1998 ; Morris et al., 1999) et à sa formulation en granule ou en poudre (Walker et al., 1983 ; Connick et al., 1991 ; Quimby et al., 1999). L’inconvénient de ce type de formulation est que l’efficacité de l’agent biologique reste liée aux facteurs environnementaux et la plupart des substances d’enrobages utilisées attirent les fourmis (Gracia et al., 1998). Elle est cependant bien adaptée contre les mauvaises herbes dans les pâturages, les prairies et dans les écosystèmes naturels (Auld et al., 2003). Quant à la formulation liquide, elle se réalise soit par utilisation des polymères en solution (Shabana et al., 1997 ; Chittick et al., 2001) soit par réalisation d’émulsion simple d’huile ou d’émulsion inverse d’huile dont le principe pour ce dernier est la formation d’une phase continue d’huile contenant des gouttelettes d’eau (Auld, 1993 ; Klein et al., 1995 ; Zhang et al., 1997). Elle permet de réduire l’évaporation d’eau dans le biopesticide (Quimby et al., 1988). La formulation liquide peut être réalisée aussi par formation du complexe WOW (Water in Oil in Water) qui consiste à disperser de fines gouttelettes d’huile contenant de l’eau dans une phase continue d’eau par émulsification de l’eau dans de l’huile puis dans de l’eau (Auld, 2002). Ainsi, la formulation obtenue contient des agents surfactants (lipophile, hydrophile, huile, eau) permettant la dispersion du pathogène soit en phase intérieure ou extérieure d’eau, soit dans les deux phases. Les bioherbicides peuvent avoir plusieurs types d’application, soit par pulvérisation de l’agent non formulé à travers de simples blessures provoquées sur la plante ou par pulvérisation de l’agent de lutte formulé dans un produit de protection.
9. Conclusion
24La jacinthe d'eau, grâce à ses capacités d’adaptation en dehors de sa région naturelle, est devenue un fléau dans les régions tropicales et subtropicales du monde. Sa présence dans les cours d’eau pose d’énormes problèmes écologiques, agricoles et de santé publique. Les luttes physique et chimique offrent un certain contrôle de l’infestation de la jacinthe. Cependant, la lutte physique manuelle nécessite beaucoup d’ouvriers qui peuvent être exposés aux animaux aquatiques dangereux. La lutte physique mécanique est, quant à elle, très coûteuse du fait de l’acquisition et l’utilisation du matériel de ramassage et de transport des plants de jacinthe vers le dépôt. Quant à la lutte chimique, les résidus des pesticides utilisés ont des effets néfastes sur la santé humaine et sur l’écosystème aquatique. Au regard de ces contraintes, un intérêt particulier doit être porté sur les méthodes alternatives de lutte plus respectueuses de l’environnement et de la santé humaine. Ainsi, la lutte biologique offre une alternative de choix pour circonscrire la prolifération anarchique de l’adventice. En effet, la lutte biologique au moyen des insectes, notamment du genre Neochetina, a donné des résultats encourageants dans certains pays. Cette méthode de lutte au moyen des insectes pourrait être renforcée par l’emploi de champignons phytopathogènes. L’utilisation des mycoherbicides pourrait contribuer à l’élaboration d’une méthode rationnelle pour une gestion durable de l’infestation de la jacinthe dans les régions tropicales et subtropicales du monde, notamment en Afrique.
25Remerciements
26Nos sincères remerciements vont à la Coopération Technique Belge (CTB) pour sa contribution au financement de ce travail.
Bibliographie
Ajuonu O., Schade V., Veltman B., Sedjro K., Neuenschwander P. (2003). Impact of the weevils Neochetina eichhorniae and N. bruchi (Coleoptera: Curculionidae) on water hyacinth, Eichhornia crassipes (Pontederiaceae), in Benin, West Africa. Afr. Entomol. 11 (2), p. 153–171.
Aquaphyte (1989). Centre des plantes aquatiques, Institut de l'alimentation et des sciences agricoles. Université de Floride. Gainsville, Floride, USA. Aquaphyte 9 (1).
Auld BA. (1993). Vegetable oil suspension emulsions reduce dew dependence of a mycoherbicide. Crop. Prot. 12, p. 477–479.
Auld BA. (2002). (Inventor) Bioherbicidal formulations. Australian Provisional Patent Application 2002952094. Canberra, IP Australia: Patent Office.
Auld BA., Shane H., Heather S. (2003). Advances in bioherbicide formulation. Weed Biol. Manag. 3, p. 61–67.
Babu RM., Sajeena A., Seetharaman K., (2003). Bioassay of the potentiality of Alternaria alternata (Fr.) Keissler as a bioherbicide to control water hyacinth and other aquatic weeds. Crop. Prot. 22, p. 1005–1013.
Barret SCH., Forno IW. (1982). Style morph distribution in new world populations of Eichhornia crassipes (Mart.) Solms-Laubach (water hyacinth). Aquatic Bot. 13, p. 299–306.
Bourdôt GW., Harvey IC., Hurrell GA., Saville DJ. (1995). Demographic and biomass production consequences of inundative treatment of Cirsium arvense with Sclerotinia Sclerotiorum. Biocontrol. Sci. Technol. 5, p. 11–25.
Boyetchko S., Pedersen E., Punja Z., Reddy M. (1999). Formulations of biopesticides. In Hall FR., Menn JJ. (eds). Methods in biotechnology. Vol.5. Biopesticides: use and delivery. Totowa, USA: Humana Press, p. 487–508.
Boyette CD., Quimby PCJR., Bryson CT., Egley GT., Fulgham FE. (1993). Biological control of hemp sesbania (Sesbania exaltata) under field conditions with Colletotrichum truncatum formulated in an invert emulsion. Weed Sci. 41, p. 497–500.
Center TD., Hill MP., Cordo H., Julien MH. (2002). Water hyacinth. In Van Driesche RG., Blossey B., Hoddle M. (eds). Biological control of invasive plants in the Eastern United States. Morgantown, WV, USA: US Forest Service, FHTET - 2002-04, p. 41–64.
Center TD., Pratt PD., Rayamajhi MB., Van TK., Franks SJ., Dray FAJr., Rebelo MT. (2005). Herbivory alters competitive interactions between two invasive aquatic plants. Biol. Control 33 (2), p. 173–185.
Charudattan R. (1996). Pathogens for biological control of water hyacinth. In Charudattan R., Labrada R., Center TD., Kelly-Begazo C. (eds). Strategies for water hyacinth control. A report of a panel of experts meeting, 11-14 September, 1995, Ford Lauderdale, Florida, USA. Rome : FAO, p. 90–97.
Charudattan R. (2001). Biological control of weeds by means of plant pathogens: Significance for integrated weed management in modern agro-ecology. Biocontrol 46, p. 229–260.
Charudattan R., Rao KV. (1982). Bostrycin and 4-deoxybostrycin: two nonspecific phytotoxins produced by Alternaria eichhornia. Appl. Environ. Microbiol. 43, p. 846–849.
Chen RX., Ye GY., Wang YJ., Gu BQ., Zhang CF., Ying XL., Shen J. (2005). The host specificity of water hyacinth weevils and their controlling effects against water hyacinth in Ningbo district. Acta Agric. Zhejiangensis 17 (2), p. 74–78.
Chittick AT., Auld BA. (2001). Polymers in bioherbicides formulation: Xanthium spinosum and Colletotrichum as a model system. Biocontrol Sci. Technol. 11, p. 691–702.
Connick WJJR., Boyette CD., McAlpine JR. (1991). Formulation of mycoherbicides using a pasta-like process. Biol. Control 1, p. 281–287.
Dagno K. (2006). Evaluation des microorganismes fongiques en tant qu’agents de lutte biologique contre Eichhornia crassipes (Martius) Solms-Laubach dans le bassin du fleuve Niger au Mali. DEA Doc. Sci. agron. Gembloux, Belgique : Gembloux Agricultural University – FUSAGx, 102 p.
Daigle DJ., Connick WJJR. (2002). Formulating mycoherbicides. In Osiewacz AD. (ed). The Mycota, X Industrial applications. Berlin: Springer-Verlag, p. 275–388.
De Casabianca ML., Laugier T. (1995). Eichhornia crassipes reproduction on petroliferous wastewaters: effects of salinity. Bioresour. Technol. 54, p. 39–43.
Deloach CJ., Cordo HA., Crouzel I.S. (1989). Control Biológico de Malezas. Buenos Aires, Argentina: El Ateneo, 266 p.
Dembélé B. (1994). La jacinthe d’eau, un fléau pour les cours d’eau au Mali ? Mali. CILSS, Sahel PV info. 63, p. 8.
Dembélé B., Diarra A. (1997). Projet d’appui à la lutte contre la jacinthe d’eau et autres plantes aquatiques au Mali. Mali. CILSS, Bulletin bimestriel de l’Institut du Sahel. Sahel IPM. 13, p. 3–10.
Diarra C. (1997). La jacinthe d’eau Eichhornia crassipes (Mart.) Solms, un danger pour les cours d’eau du Mali. Mali. CILSS, Bulletin bimestriel de l’Institut du Sahel. Sahel IPM. 13, p. 3.
El Zawahry MM., Kamel MM. (2004). Removal of azo and anthraquinone dyes from aqueous solutions by Eichhornia crassipes. Water Res. 38, p. 2967–2972.
Emilio M. (2003). Development, registration and commercialization of microbial pesticides for plant protection. Int. Microbiol. 6, p. 245–252.
EPA-US. (1988). Design manuel-constructed wetlands and aquatic systems for municipal wastewater treatment. Cincinnati, OH: U.S. Environmental Protection Agency. Office of Research and Development, 83. Report n°EPA/625/1-88/022.
Evans HC., Reeder RH. (2001). Fungi Associated with Eichhornia crassipes (Water Hyacinth) in the upper amazon basin and prospects for their use in Biological Control. In Julien MH., Hill MP., Center TD., Jianqing D. (eds). Biological and integrated control of water hyacinth, Eichhornia crassipes. Canberra, Australia: Australian Centre for International Agricultural Research. ACIAR Proceeding 102.
FAO (1997). Lutte intégrée contre la jacinthe d’eau et autres plantes aquatiques nuisibles. Rome : FAO: Document de Projet n° TCP/MLI 66/13 A.
FAO (2000). Water weeds management in West Africa/Ghana water bodies. Rome : FAO: Document de Projet n° TCP/RAF/0066.
Fayad YH., Ibrahim AA., El-Zoghbyet AA., Shalaby FF. (2001). Ongoing activities in the biological control of water hyacinth in Egypt. In Julien MH., Hill MP., Center TD., Jianqing D. (eds). Biological and integrated control of water hyacinth, Eichhornia crassipes. Canberra, Australia: Australian Centre for International Agricultural Research. ACIAR Proceeding 102.
Ghabbour EA., Davies D., Lam YY., Vozzella ME. (2004). Metal binding by humic acids isolated from water hyacinth plants (Eichhornia crassipes [Mart.] Solm-Laubach: Pontederiaceae) in the Nile Delta, Egypt. Environ. Pollut. 131, p. 445–451.
Gopal B. (1987). Water hyacinth. Amsterdam, The Netherlands: Elsevier, 471 p.
Gowanloch JN., Bajkov AD. (1948). Water hyacinth program. Louisiana Department of Wildlife and Fisheries. Biennial Report. 2, p. 66–124.
Gracia GJA., Fravel DR., Bailey BA., Hebbar PK. (1998). Dispersal of formulations of Fusarium oxysporum f.sp. erythroxyli and F. oxysporum f. sp. melonis by ants. Phytopathology 88, p. 185–189.
Greaves MP., Holloway PJ., Auld BA. (1998). Formulation of microbial herbicides. In Burges HD. (ed). Formulation of microbial biopesticides, beneficial microorganisms, nematodes and seed treatments. London: Kluwer Academic, p. 203–233.
Grey WE., Quimby PCJR., Mathre DE., Young JA. (1995). Potential for biological control of downy brome (Bromus tectorum) and medusahead (Taeniatherum caput-medusae) with crown and root rot fungi. Weed Technol. 9, p. 362–365.
Gutiérrez LE., Arreguín F., Huerto R., Saldaña P. (1994). Aquatic weed control. Int. J. Water Resour. Dev. 10, p. 291–312.
Gutiérrez LE., Huerto DR., Martínez JM. (1996). Water hyacinth problems in Mexico and practiced methods for control. In Charudattan R., Labrada R., Center TD., Kelly-Begazo C. (eds). Strategies for water hyacinth control. Report of a panel of experts meeting, 11-14 September, 1995. Fort Lauderdale, Floride, USA. Rome : FAO, p. 125–135.
Harley KLS. (1990). The role of biological control in the management of water hyacinth, Eichhornia crassipes. Biocontrol News Inf. 11, p. 11–22.
Harley KLS., Julien MH., Wright AD. (1997). Water hyacinth: A tropical world wide problem and methods for its control. Proceedings of the first meeting of the International Water Hyacinth Consortium, 18-19 March. Washington: World Bank.
Hill G., Waage J., Phiri G. (1997). The water hyacinth problem in tropical Africa, Proceedings of the first meeting of the International Water Hyacinth Consortium, 18–19 March. Washington: World Bank.
Holm LG., Plucknett DL., Pancho JV., Herberger JP. (1977). The world’s worst weeds: distribution and biology. Honolulu: University Press of Hawaï, 609 p.
Jayaweera MW., Kasturiarachchi JC. (2004). Removal of nitrogen and phosphorus from industrial wastewaters by phytoremediation using water hyacinth (Eichhornia crassipes (Mart.) Solms). Water Sci. Technol. 50 (6), p. 217–225.
Klein TA., Auld BA. (1995). Evaluation of Tween 20 and glycerol as additives to mycoherbicide suspensions applied to Bathurst burr. Plant Prot. 10, p. 14–16.
Labrada R. (1996). Status of water hyacinth in developping countries. In Strategies for water hyacinth control. Report of a panel of experts meeting 11–14 September, 1995. Fort Lauderdale, Florida, USA. Rome : FAO.
Maine MA., Duarte MV., Sune NL. (2001). Cadmium uptake by floating macrophyte. Water Res. 35 (11), p. 2629–2634.
Mangabeira PAO., Labejof L., Lampeti A., De Almeida AAF., Oliveira AH., Escaig F., Severo MIG., Silva da C., Saloes D., Mielke M., Lucena ER., Martinis MC., Santana KB., Gavrilov KL., Galle P., Levi SR. (2004). Accumulation of chromium in root tissues of Eichhornia crassipes (Mart.) Solms. in Cachoeira river-Brasil. Appl. Surf. Sci. 231–232, p. 497–501.
Morris MJ., Wood AR., Den BA. (1999). Plant pathogens and biological control of weeds in South Africa: a review of projects and progress during the last decade. In Olckers T., Hill MP. (eds.). Biological control of weeds in South Africa (1990–1998). African Entomology Memoir n° 1. Hatfield, USA: Entomological Society of Southern Africa, p. 129–137.
Mullin BH., Anderson LWJ., DiTomaso JM., Eplee RE., Getsinger KD. (2000). Invasive plant species. Ames, Iowa: Council for Agricultural Science and Technology, Issue Paper n° 13.
Pieterse AH., Mangane A., Traoré M., Van DG., Van RPJ. (1996). The water hyacinth problem in West Africa and proposals for control strategies in strategies for water hyacinth control. Report of a panel of experts meeting 11–14 September, 1995. Fort Lauderdale, Florida, USA. Rome : FAO.
Praveena R., Naseema A. (2004). Host range of Fusarium pallidoroseum, a potential biocontrol agent of water hyacinth. J. Tropic. Agric. 42 (1/2), p. 21–23.
Qaisar M., Zheng P., Siddiqi MR., Islam E., Azim MR., Yousaf H. (2005). Anatomical studies on water hyacinth (Eichhornia crassipes (Mart.) Solms) under the influence of textile waste water. J. Zhejiang Univ. 6B (10), p. 991–998.
Quimby PC Jr., Fulgham FE., Boyette CD., Connick WJ. (1988). An invert emulsion replaces dew in biocontrol of sicklepod-a preliminary study. In Hovde DA., Beestman GB. (eds). Pesticides, formulations and application systems. Philadelphia, USA: American Society for Testing and Materials, p. 264–270.
Quimby PC Jr., Zidack NK., Boyette CD., Grey WE. (1999). A simple method for stabilizing and granulating fungi. Biocontrol Sci. Technol. 9, p. 5–8.
Sculthorpe CD. (1985). The biology of aquatic vascular plants. Konigstein, Germany: Koeltz Scientific Books, 610 p.
Shabana YM. (2005). The use of oil emulsions for improvising the efficacy of Alternaria eichhorniae as a mycoherbicide for waterhyacinth (Eichhornia crassipes). Biol. Control 32 (1), p. 78–89.
Shabana YM., Mohamed ZA. (2005). Integrated control of water hyacinth with a mycoherbicide and a phenylpropanoid pathway inhibitor. Biocontrol Sci. Technol. 15 (7), p. 659–669.
Shabana YM., Zakaria Baka AM., Gamal AF. (1997). Alternaria eichhorniae, a biological control agent for water hyacinth: mycoherbicidal formulation and physiological and ultra-structural host responses. Eur. J. Plant Pathol. 103, p. 99–111.
Singhal V., Rai JPN. (2003). Biogas production from water hyacinth and channel grass used for phytoremediation of industrial effluents. Bioresour. Technol. 86, p. 221–225.
So LM., Chu LM., Wong PK. (2003). Microbial enhancement of Cu2+ removal capacity of Eichhornia crassipes (Mart.). Chemosphere 52, p. 1499–1503.
Stephenson M., Turner G., Pope P., Colt J., Knight A., Tchobanoglous G. (1980). The use and potential of aquatic species for wastewater treatment. California State Water Resour. Control Board 65.
Steven GH. (2005). Where are the bioherbicides? Weed Sci. 53 (3), p. 404–415.
Susha Thara S., Naseema A. (2002). Mass production of Fusarium species, potent biocontrol agents of water hyacinth. J. Mycol. Plant Patholog. 32 (1), p. 94–95.
Traoré HT. (2006). Un problème environnemental transformé en source de revenus, cas de la jacinthe d’eau douce en compost chez des jardiniers de Jarela, Bamako, Mali [en ligne]. Afrique-Gouvernance 2006. Disponible sur <http://www.afrique-gouvernance.net/fiches/dhp/fiche-dhp-188.html>. Consulté le 4/06/2006.
Van Driesche R., Blossey B., Hoddle M., Lyon S. (2002). Biological control of invasive plants in the Eastern United States. FHTET, Morgantown, WV, USA: US Forest Service, 413 p.
Vogelgsang S., Watson AK., DiTommaso A., Hurle K. (1998). Effect of the pre-emergence bioherbicide Phomopsis convolvulus on seedling and established plant growth of Convolvulus arvensis. Weed Res. 38, p. 175–182.
Walker HL., Connick WJJR. (1983). Sodium alginate for production and formulation of mycoherbicides. Weed Sci. 31, p. 333–338.
Wilson JR., Holst N., Rees M. (2005). Determinants and patterns of population growth in water hyacinth. Aquat. Bot. 81, p. 51–67.
Xia HL., Ma XJ. (2006). Phytoremediation of ethion by water hyacinth (Eichhornia crassipes) from water. Bioresour. Technol. 97 (8), p. 1050–1054.
Zhang W., Watson AK. (1997). Efficacy of Exserohilum monoceras for the control of Echinochloa species in rice (Oryza sativa). Weed Sci. 45, p. 144–150.
Pour citer cet article
A propos de : Karim Dagno
Gembloux Agricultural University – FUSAGx. Unité de Phytopathologie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Rachid Lahlali
Gembloux Agricultural University – FUSAGx. Unité de Phytopathologie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Damien Friel
Gembloux Agricultural University – FUSAGx. Unité de Phytopathologie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : Mohammed Bajji
Gembloux Agricultural University – FUSAGx. Unité de Phytopathologie. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
A propos de : M. Haïssam Jijakli
Gembloux Agricultural University – FUSAGx. Unité de Phytopathologie. Passage des Déportés, 2. B-5030 Gembloux (Belgique). E-mail : jijakli.h@fsagx.ac.be





