Essai de production de protéines d’organismes unicellulaires par des souches de levures à partir de résidus de tubercules de patate douce et d’igname
Centre de Recherche en Sciences Biologiques Alimentaires et Nutritionnelles. BP 7131. BF-Ouagadougou (Burkina Faso). E-mail : nouedraogo94@gmail.com
Centre de Recherche en Sciences Biologiques Alimentaires et Nutritionnelles. BP 7131. BF-Ouagadougou (Burkina Faso).
Centre de Recherche en Sciences Biologiques Alimentaires et Nutritionnelles. BP 7131. BF-Ouagadougou (Burkina Faso).
Centre de Recherche en Sciences Biologiques Alimentaires et Nutritionnelles. BP 7131. BF-Ouagadougou (Burkina Faso).
Centre de Recherche en Sciences Biologiques Alimentaires et Nutritionnelles. BP 7131. BF-Ouagadougou (Burkina Faso).
Reçu le 8 juin 2011, accepté le 9 mai 2012
Résumé
Cette étude décrit l’utilisation des résidus de tubercules de patate douce et d’igname comme substrat pour la production de protéines d’organismes unicellulaires au Burkina Faso. Deux souches de Saccharomyces cerevisiae et deux de Candida utilis ont été utilisées. Ces souches ont été sélectionnées en fonction de leur vitesse de croissance parmi 25 souches isolées dans ces résidus. La concentration optimum en glucose était de 22 mM, le pH optimum de 5 et la température maximale de 30 °C. Un taux spécifique de croissance maximal (μmax) de 0,24·h-1 et un rendement maximal de conversion de substrat (Yx/s) de 0,36 ont été observés respectivement avec les souches C. utilis NOY 14 et S. cerevisiae NOY 4. Les valeurs appréciables de µmax et de Yx/s ont été obtenues avec les faibles concentrations en glucose, 22 mM. Le taux de protéine de la biomasse est compris entre 40,4 % et 46,9 %.
Abstract
Single cell protein production test by yeast strains using tubers from sweet potato and yam residues. This study describes the use of the residues of tubers of sweet potato and yam for the production of single cell proteins in Burkina Faso. Two strains of Saccharomyces cerevisiae and two of Candida utilis were used. These strains were selected from 25 strains isolated in the residues according to their specific rate of maximum growth. The optimum concentration in glucose was 22 mM, the optimum pH 5 and the maximum temperature 30 °C. A specific rate of maximum growth of 0.24·h-1 and one output maximum of conversion of substrate of 0.36 were observed respectively with the strains C. utilis NOY 14 and S. cerevisiae NOY 4. The considerable values of µmax and Yx/s were obtained with the low concentrations of glucose (22 mM). The protein content of the biomass was between 40.4% and 46.9%.
1. Introduction
1L’agriculture et les industries agro-alimentaires rejettent quotidiennement des masses importantes de sous-produits généralement considérés comme source de pollution (De Felice et al., 1994). Ainsi, la récupération et la valorisation de ces sous-produits (résidus agro-alimentaires) à des fins alimentaires peuvent constituer une alternative intéressante : il s'agit de la production de protéines d'organismes unicellulaires. Les résidus agricoles présentent un intérêt particulier pour la production des protéines d’organismes unicellulaires (Badid et al., 2001), d’alcool et d’acides (Boudjelal et al., 2001) ; d’enzymes (Bousmaha et al., 2007). En effet, les protéines d’organismes unicellulaires sont très importantes dans l’alimentation humaine et assurent une sécurité alimentaire car elles sont mieux équilibrées en acides aminés indispensables que les protéines végétales et animales (Dilmi-Bouras, 1998) et contiennent une forte teneur en acides aminés essentiels (Badid et al., 2001). Au Burkina Faso, où les résidus agro-alimentaires sont disponibles abondamment, cette étude constitue une première ébauche pour leur valorisation comme protéines alimentaires et pour résoudre en même temps la pollution environnementale.
2Notre travail constitue une contribution à la valorisation des résidus de tubercules de patate douce et d’ignames par leur utilisation comme substrat de fermentation pour la production de biomasse levurienne dans des conditions optimisées afin de pallier d’une part à la malnutrition protéo-énergétique et d’autre part, dépolluer l’environnement.
2. Matériel et méthodes
2.1. Échantillonnage et préparation du matériel végétal
3Trente échantillons de résidus de patate douce et d’igname ont été prélevés dans trois régions du Burkina Faso, conditionnés dans des sacs et acheminés au laboratoire pour les analyses. Ces résidus ont été sèchés à l’étuve à 90 °C pendant 72 h jusqu’à l’obtention d’un poids constant et ont servi pour les essais de cultures et la détermination de la teneur en sucres totaux, en réducteurs et en protéines ; les autres paramètres ont été analysés sur les résidus frais.
2.2. Détermination des caractéristiques physico-chimiques des échantillons
4La physico-chimie a consisté à déterminer le pH, la matière sèche (méthode 925-10, AOAC, 1990), les cendres totales, les sucres totaux (Fox et al., 1991), les sucres réducteurs (Miller, 1958) et la teneur totale en azote (méthode de Kjeldahl, 7015, AOAC, 1990).
2.3. Isolement, caractérisation et identification des souches de levures
5Le milieu Sabouraud plus chloramphénicol liquide et solide a été utilisé pour l’isolement des souches. L’identification a été effectuée en utilisant des galeries API 20C AUX (Bio Mérieux) suivant les instructions du fabricant. Pour sélectionner les meilleures souches, une cinétique de croissance de 25 souches de levures a été suivie au spectrophotomètre à 600 nm pendant 24 h. Les vitesses maximales de croissance de ces souches ont été déterminées et utilisées pour sélectionner pour la suite de l’étude les quatre souches exprimant les valeurs les plus élevées.
2.4. Optimisation des milieux de cultures et de la croissance des souches
6Effet de la concentration en substrat sur la croissance. La croissance des souches de levures a été déterminée sur le milieu de culture préconisé par Konlani et al. (1996) à des concentrations en glucose variant de 5 à 45 mM. La croissance a été suivie à 600 nm pendant 24 h à l’aide d’un lecteur de plaque (spectrophotomètre) de type µquant (BioTek Instruments ; numéro de série 157904-USA) couplé à un ordinateur muni d’un logiciel KC Junior intégré.
7Effet du pH et de la température initiale. L’effet du pH a été testé sur milieu semi-synthétique aux pH suivants : 3 ; 4,5 ; 5 ; 5,5 ; 6 ; 7 et 8 ; l’incubation est réalisée en milieu liquide à 30 °C à 105 rpm pendant 24 h. L’ajustement du pH initial est réalisé à l’aide d’une solution de HCl 0,1 N et de NaOH (N/9).
8L’effet de la température sur la croissance des souches de levures isolées a été réalisé sur milieu semi-synthétique liquide à des températures de 20, 25, 30, 35, 40 et 45 °C. Le pH initial des cultures a été ajusté à 5 et l’incubation a été faite pendant 24 h à 105 rpm. La teneur en glucose dans le milieu synthétique utilisé pour déterminer l’effet du pH et de la température a été de 5 g·l-1.
2.5. Étude de la production de protéines d’organismes unicellulaires et évaluation de la biomasse
9Chaque souche est inoculée dans un ballon de 250 ml contenant 100 ml de milieu semi-synthétique. Dans le milieu, le glucose a été substitué par les résidus de tubercules (mélange de résidus de patate douce et d’igname) de manière à obtenir une concentration de 22 mM en sucres totaux. Le tout est incubé à 30 °C pendant 16 h et servira d’inoculum pour la fermentation batch. Le milieu de fermentation est celui préconisé par Konlani et al. (1996) dont la composition par litre est la suivante : di-hydrogéno-phosphate de potassium, 2 g ; di-sodium hydrogénophosphate, 0,75 g ; sulfate d’ammonium, 3 g ; sulfate de magnésium, 0,5 g ; extrait de levure, 3 g ; glucose, 4 g et Tween 80, 1 ml. Les paramètres physiologiques optimaux des souches ont été utilisés : le pH a été fixé à 5, la température à 30 °C et une concentration finale en sucres totaux de 22 mM a été utilisée en tenant compte de la teneur en sucres des résidus (environ 5 %). Ces milieux sont préparés dans des ballons de 1 l à raison de 675 ml par ballon. Un inoculum de 75 ml (10 % v/v) a été introduit dans les ballons et le processus de fermentation est déclenché (Ghaly et al., 2004). La fermentation a été effectuée à 150 rpm jusqu’à l’épuisement complet du substrat carboné (Konlani et al., 1996). À la fin de la fermentation, la biomasse a été évaluée par centrifugation de 200 ml de la culture à 10 000 x g pendant 30 min. Le culot est récupéré et lavé à l’eau, puis sèché à 105 °C pendant 24 h. Une courbe de référence des DO en fonction du poids sec de la biomasse a été établie (Dubois et al., 1956). Le glucose résiduel a été déterminé par la méthode colorimétrique utilisant le DNS (Konlani et al., 1996). La teneur en protéines de la biomasse a été déterminée par la méthode de Kjeldhal après centrifugation et sèchage dans une étuve à 105 °C jusqu’à un poids constant (AOAC, 1990).
3. Résultats et discussion
3.1. Caractéristiques physico-chimiques des résidus de patate douce et d’igname
10La composition des résidus de patate douce et d’igname est consignée dans le tableau 1. Les pourcentages en sucres totaux des résidus de patate douce sont de 5,32 ± 1,04 % et de 4,85 ± 0,13 % pour les ignames. Ces valeurs se situent dans l’intervalle de pourcentage trouvé par Amani et al. (2003). La teneur en sucres réducteurs des résidus de patate douce est égale à 2,93 ± 0,98 % et celle des résidus d’igname, 2,26 ± 0,77 %. Ces valeurs sont inférieures à celles mesurées dans des fruits tels que la banane, l’orange et l’ananas variant de 4 à 15 % (Akubor, 1996). Le pH des résidus de patate douce est de 5,5 ± 0,39.
3.2. Isolement, caractérisation et identification des souches de levures
11Au total, 25 souches de levures ont été isolées et purifiées à partir des résidus de tubercules. Quatre ont été sélectionnées pour la suite du travail sur base des paramètres de croissance. Ces quatre souches ont été identifiées et sont : Saccharomyces cerevisiae NOY 1, Candida utilis NOY 11, Candida utilis NOY 14, Saccharomyces cerevisiae NOY 4.
3.3. Optimisation des milieux de cultures et de la croissance des souches
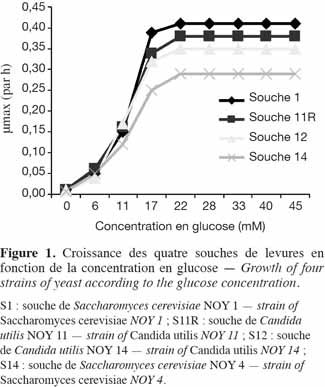
12Croissance des souches de levures en fonction de la concentration en substrat. La courbe de la figure 1 traduit le taux maximal de croissance des souches en fonction de la concentration du milieu en glucose. Le taux de croissance des quatre souches est proportionnel à la concentration en glucose du substrat pour les concentrations allant de 5 à 22 mM. À une concentration de 22 mM, la vitesse de croissance des souches est maximum. Les résultats obtenus au cours de cette étude sont en accord avec les travaux Lagzouli et al. (2007). Pour les concentrations inférieures à 22 mM, la croissance est moindre car la disponibilité du substrat est moindre. Pour les concentrations supérieures, la croissance reste constante. Elle n’est plus limitée par le substrat ; on note plutôt un phénomène de découplage énergétique entre la croissance et la production de métabolites (Guiraud et al., 1984). La variabilité de la croissance en fonction de la concentration en substrat pourrait s’expliquer par une saturation des récepteurs membranaires (Bousmaha et al., 2007), c'est-à-dire la disponibilité et l’efficacité des transporteurs membranaires du glucose au niveau des différentes souches.
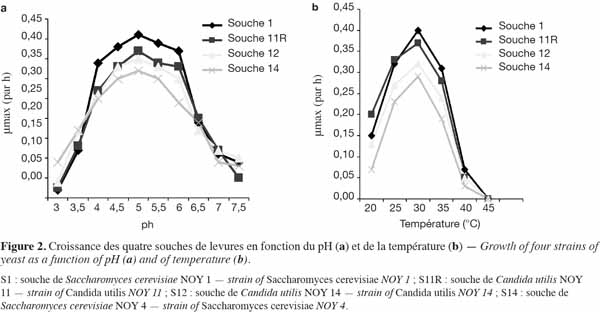
13Influence du pH et de la température sur la croissance des souches de levures. Les courbes de la figure 2 traduisent l’évolution du taux maximal de croissance des quatre souches en fonction du pH (a) et de la température (b) du milieu. Les quatre souches de levures étudiées ont un pH optimal de 5. La croissance reste minimale pour des valeurs de pH inférieures à 4 et supérieures à 6,5. Ces résultats sont en accord avec ceux présentés par Vega et al. (2007). La valeur du pH a un effet sur la solubilité des nutriments et sur la perméabilité de la membrane cellulaire (Martinez et al., 2003). Les quatre souches croissent dans un intervalle de température compris entre 25 et 35 °C avec un optimum à 30 °C. Dans cet intervalle, S. cerevisiae NOY 1 et C. utilis 11R montrent une croissance maximale par rapport aux autres souches. Ces valeurs sont semblables à celles obtenues par Lagzouli et al. (2007).
3.4. Évaluation de la biomasse
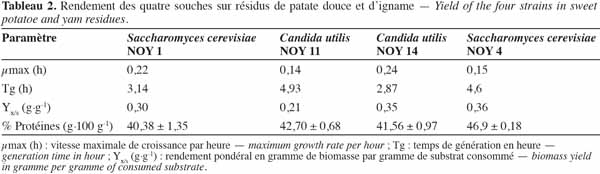
14Le travail précédent nous a permis de choisir la concentration de substrat, la température et le pH pour optimiser la fermentation. Après 24 h de fermentation, une dégradation remarquable des sucres est relevée. Ces résultats montrent que les souches se développent très bien sur les résidus qui constituent un substrat de choix pour la production de biomasse. Le rendement pondéral, le taux protéique, la vitesse maximale de croissance, le temps de génération ont été déterminés et consignés dans le tableau 2. Les rendements pondéraux vont de 21 % à 36 %. Saccharomyces cerevisiae NOY 4 possède le meilleur rendement en biomasse. Ces rendements se rapprochent de ceux trouvés par Konlani et al. (1996) qui sont de l’ordre de 33 % et 28 % pour Candida krusei et Saccharomyces sp. respectivement sur milieu glucosé et de l’ordre de 35 % et 26 % pour ces mêmes souches sur hydrolysat de sorgho. La biomasse la plus élevée a été obtenue avec C. utilis NOY 14. Saccharomyces cerevisiae NOY 4 possède un taux protéique supérieur aux trois autres souches. Nos résultats sont proches de ceux trouvés par Badid et al. (2001). Tenant compte de la biomasse formée, on obtient pour S. cerevisiae NOY 4 0,579 g·l-1 de protéines produites à partir des résidus. Cela correspond à peu près à un rendement par rapport au résidu consommé de 0,17. Le meilleur rendement atteint au cours de notre étude dans les résidus est de 0,36.
4. Conclusion
15Cette étude est pertinente car elle nous a permis de dresser une piste possible de valorisation des résidus de patate douce et d’igname et d’isoler des souches locales de levures adaptées à la métabolisation de ce polluant pouvant servir au procédé de production de biomasse. Il ressort de notre étude que les résidus de patate douce et d’igname demeurent un milieu favorable au développement des levures quand on l’enrichit de sels minéraux. La production de biomasse a été satisfaisante avec des rendements et un taux protéique acceptable. De ce fait, les résidus de ces tubercules, loin d’être uniquement des polluants pour l’environnement, pourront être utilisés pour produire de la biomasse. Cela pourra d’une part aider à lutter contre la malnutrition protéique et d’autre part, à dépolluer l’environnement.
Bibliographie
Akubor P.I., 1996. The suitability of African bush mango juice for wine production. Plant Foods Hum. Nutr., 49(3), 213-219.
Amani G.N. & Kamenan A., 2003. Potentialités nutritionnelles et technologie traditionnelle de transformation des denrées amylacées en Côte d’Ivoire. In : Brouwer I.D., Traoré A.S. & Trèche S., coord. Actes du 2e Atelier international : Voies alimentaires d’amélioration des situations nutritionnelles en Afrique de l’Ouest, 23-28 novembre 2003, Ouagadougou, Burkina Faso.
AOAC, 1990. Official methods of analysis. Vol. 2. 15e ed. Washington, DC, USA: Association of Official Analytical Chemists.
Badid N., Moussaoui A. & Belbraouet S., 2001. Production de protéines d’organismes unicellulaires cultivées sur Corn Steep Liquor et évaluation nutritionnelle de la biomasse. In : Numéro spécial : Biomasse : Production et Valorisation, Rev. Energ. Renouvelables, 11-28.
Boudjedal A. & Nancib N., 2001. Production d’acides lactiques par Lactobacillus rhamnosus sur milieu à base de jus de dattes. In : Numéro spécial : Biomasse : Production et Valorisation, Rev. Energ. Renouvelables, 41-46.
Bousmaha L., Elmoualdi L., Ouhssine M. & El Yachioui M., 2007. Souche de Candida guilliermondii isolée de la saumure de carotte productrice d’une β-fructofuranosidase extracellulaire. Bull. Soc. Pharm. Bordeaux, 146, 51-62.
De Felice B. & Scioli D., 1994. Use of crude whey by Kluyveromyces marxianus and by Yarrowia lipolytica to reduce pollution of effluents. Ann. Microbiol. Enzymol., 44, 65-71.
Dilmi-Bouras A., 1998. Les constituants alimentaires et leur rapport avec la santé. Alger : Ed. O.P.U.
Dubois M. et al., 1956. Colorimetric method for determination of sugars and related substances. Anal. Chem., 28(3), 350-356.
Fox J.D. & Robyt J.F., 1991. Miniaturization of three carbohydrate analysis using a microsample plate reader. Anal. Biochem., 195, 93-96.
Ghaly A.E. & Kamal M.A., 2004. Submerged yeast fermentation of acid cheese whey for protein production and pollution potential reduction. Water Res., 38(3), 631-644.
Guiraud P.J., Crelzy P. & Gli T., 1984. Analyse microbiologique dans l’industrie agro-alimentaire. Paris : Dunod, 53-61.
Konlani S. et al., 1996. Isolation and characterization of yeasts involved in sorghum beer production. Food Biotechnol., 10(1), 29-40.
Lagzouli M. et al., 2007. Optimisation de la croissance et de la production de glucoamylase extracellulaire par Candida guilliermondii. Bull. Soc. Pharm. Bordeaux, 146, 251-270.
Martinez E.A. et al., 2003. The influence of pH and dilution rate on continuous production of xylitol from sugarcane bagasse hemicellulosic hydrolysate by C. guillermondi. Proc. Biochem., 38, 1677-1683.
Miller G.L., 1958. Use of dinitrosalicylic acid reagent for determination of reducing sugar. Anal. Biochem., 195, 93-96.
Vega M.P., da Silva Leite R. & Cruz Lopes de Oliveira M.A., 2007. Mathematical modeling of single cell protein and ethanol production by Kluyveromyces cicerisporus fermentation on whey. In: Plesu V. & Agachi P.S., eds. 17th European symposium on computer aided process engineering-ESCAPE 17.
