Inventaire de l’entomofaune associée au basilic tropical (Ocimum gratissimum L., Lamiaceae) dans le Sud Bénin
Reçu le 20 novembre 2017, accepté le 11 janvier 2018.
Résumé
Le basilic tropical (Ocimum gratissimum L., Lamiaceae) est largement utilisé pour ses propriétés médicinales, thérapeutiques et biocides. Au Bénin, cette plante est également l’une des cultures maraîchères les plus consommées. Les producteurs font cependant face aux attaques d’une diversité de bioagresseurs dont de nombreuses espèces d’insectes. Lors de ce travail, nous avons évalué la diversité entomologique associée à cette production végétale, en réalisant des inventaires dans différents sites maraîchers du sud Bénin. Au total, 3108 insectes ont été collectés, appartenant à 52 familles reparties dans six ordres. Les familles les plus abondantes sont les Formicidae, les Megachilidae, les Halictidae, les Lygaeidae, les Pentatomidae, les Syrphidae, les Coccinellidae, les Chrysomelidae, les Acrididae et les Pyrgomorphidae. Au sein de cette communauté d’insectes, des ravageurs, des ennemis naturels et des pollinisateurs ont été rencontrés. L’intérêt de disposer d’une biodiversité importante d’ennemis naturels et de pollinisateurs dans une région à haute activité de production en basilic est discuté.
Abstract
Tropical basil (Ocimum gratissimum L., Lamiaceae) is widely used for its medicinal, therapeutic and biocide properties. In Benin, this plant is also one of the most consumed vegetable crops. However, producers face attacks from a variety of pests including many species of insects. During this work, we evaluated the entomological diversity associated with this crop production, by carrying out inventories at various vegetable sites in southern Benin. A total of 3108 insects were collected referring to 52 families divided into six orders. The most abundant families were Formicidae, Megachilidae, Halictidae, Lygaeidae, Pentatomidae, Syrphidae, Coccinellidae, Chrysomelidae, Acrididae, and Pyrgomorphidae. Within this insect community, pests, natural enemies, and pollinators have been encountered. The interests of having a significant biodiversity of natural enemies and pollinators in an area of high basil production activity is discussed.
Introduction
1Le basilic tropical (Ocimum gratissimum L.) est une plante aromatique de la famille des Lamiaceae (Orwa et al., 2009). Ses propriétés médicinales et thérapeutiques sont bien documentées (Prabhu et al., 2009 ; Kpètèhoto et al., 2017). Il est utilisé en médecine traditionnelle sous forme d’infusion ou de décoction pour traiter de nombreuses affections – diarrhés, douleurs abdominales, ulcères, maux de tête, vers intestinaux, diabète – (Orwa et al., 2009 ; Agbankpé et al., 2014). Les effets anti-inflammatoires et antimicrobiens des extraits de cette plante (extraits organiques, huiles essentielles ou composés organiques volatils) ont été démontrés à plusieurs reprises (Macdonald et al., 2010 ; Sessou et al., 2013; Ishiwu et al., 2014). Ces extraits possèdent également un important effet biocide (i.e. insecticide, répulsif, anti-appétant) sur divers bioagresseurs comme les vecteurs de paludisme (Kazembe & Chauruka, 2012 ; Chukwura & Iheukwumere, 2013), les ravageurs des denrées stockées (Kouninki et al., 2007 ; Ogendo et al., 2008) et des cultures au champ (Akantetou et al., 2011 ; Yarou et al., 2017 a et b).
2Outre ses vertus médicinales, thérapeutiques et biocides, le basilic tropical joue un rôle important dans l’alimentation en Afrique de l’Ouest (Agbankpé et al., 2014). Il peut constituer une source d’apport en protéines, fibres, sels minéraux et vitamines pour la population humaine (Efiong, 2014 ; Kpètèhoto et al., 2017). Au Bénin, le basilic tropical est présent sur presque tous les sites maraîchers et même dans les jardins de case tout au long de l’année (Achigan-Dako et al., 2010). Cette culture occupe la quatrième position en termes de consommation de légumes feuilles après l’aubergine gboma – Solanum macrocarpum L. (Solanaceae) – la vernonie – Vernonia amygdalina Del (Asteraceae) – et l’amarante – Amaranthus hybridus L. (Amaranthaceae) – (Kpètèhoto et al., 2017).
3Comme la plupart des cultures maraîchères, la production du basilic tropical est également confrontée aux attaques d’insectes ravageurs. À l’exception d’inventaires menés autour du puceron Aphis gossypii Glover (Hemiptera : Aphididae) (Sæthre et al., 2011), l’entomofaune de cette culture n’a pas été étudiée au Bénin.
4Pourtant, les producteurs locaux utilisent des produits phytosanitaires pour lutter contre une diversité de ravageurs, principalement non identifiés. Ce travail se propose de caractériser l’entomofaune associée au basilic tropical dans le sud du Bénin, afin d’apporter un premier aperçu des différentes familles d’insectes qui colonisent cette plante aromatique.
Matériel et méthodes
2.1. Sites de collecte
5L’étude a été réalisée sur des sites maraîchers (Togba : 6°26'58.46"N; 2°20'50.24"E – Comaes : 6°22'13,054"N, 2°23'28,45"E – Ouidah : 6°22'17,93"N, 2°4'34,77"E – Sème : 6°25'20,92", 2°35'56,70") localisés dans quatre communes situées dans le sud du Bénin (Figure 1). Cette zone bénéficie d’un climat subéquatorial avec deux saisons pluvieuses (mars à juillet et septembre à novembre) et deux saisons sèches (décembre à mars et juillet à septembre). Les températures quotidiennes varient de 26°C à 31°C avec une pluviométrie annuelle de 1200 mm en moyenne (INSAE, 2012). Le site de Togba situé près d’une zone marécageuse est caractérisé par des sols ferrugineux tropicaux (Biaou, 2006). Il s’étend sur une superficie de 1,5 ha. Celui de Ouidah est plutôt caractérisé par un sol ferralitique (Capo-Chichi, 2006) et s’étend sur une superficie d’environ 2,0 ha. Les sites de Comaes et de Sèmè sont situés en bordure de l’Océan Atlantique et caractérisés par une formation sableuse (Kora, 2006 ; Akomagni, 2006). Ils mesurent respectivement 4,0 ha et 2,5 ha.
6Ces sites ont été choisis car ils accueillent depuis longtemps de nombreuses parcelles de production de basilic tropical.
7Figure 1 : Carte de localisation des sites de collecte situés dans le sud du Bénin
2.2. Collecte et identification des insectes
8Les insectes ont été collectés pendant le mois de juin (grande saison des pluies) 2015 à l’aide de filets fauchoirs. Deux échantillonnages ont été effectués par site sur deux jours successifs. Les blocs échantillonnés étaient constitués de parcelles élémentaires de 10 m² en moyenne avec une densité de 25 plants au m². Chaque parcelle élémentaire a été fauchée sur son ensemble durant deux minutes en moyenne. Ainsi, ont été échantillonnés: un bloc de 25 parcelles (plantes en pleine croissance végétative) à Ouidah, un bloc de 30 parcelles (plantes en croissance végétative et en début d’inflorescence) à Togba, un bloc de 15 parcelles (plantes en croissance végétative et en début d’inflorescence) à Comaes et un bloc de quatre parcelles (plantes en pleine inflorescence) à Sèmè. Ces informations sur l’état phénologique des plantes échantillonnées permettront de faire le lien avec les différents groupes fonctionnels d’insectes qui seront observés.
9Les insectes collectés ont été conservés dans des flacons contenant une solution d’éthanol à 70%. Après tri et classification sur base de la morphologie externe, les insectes ont été identifiés au laboratoire jusqu’au niveau taxonomique de la famille à l’aide d’une loupe binoculaire. Plusieurs clés de systématiques entomologiques ont été utilisées pour l’identification (Delvare & Aberlenc,1989 ; Eardley et al., 2009 ; Chinery, 2012 ; Mignon et al., 2016). En complément des clés d’identification, des ouvrages techniques (Bordat & Arvanitakis, 2004 ; Poutouli et al., 2011) ont été utilisés afin de catégoriser les familles d’insectes en groupes fonctionnels.
10Des observations visuelles ont permis de notifier la présence des pucerons et des mouches blanches (Hemiptera : Aleyrodidae). Cependant, compte tenu de leur abondance très élevée, ils n’ont pas été intégrés pour l’analyse des données. Les cultures maraîchères (Tableau 1) se trouvant à proximité des parcelles échantillonnées ont été également recensées de manière systématique sur un rayon de 25 à 30 m en moyenne au niveau de chaque site afin de mettre en relation les familles d’insectes recensées sur le basilic tropical et sur ces autres cultures.
11Tableau 1 : Cultures maraîchères recensées sur les sites de collecte
12+ Présent ; - Absent ; *Cultures locales ou traditionnelles ; ** Cultures exotiques
|
Sites de collecte |
||||
|
Cultures |
Comaes |
Ouidah |
Sèmè |
Togba |
|
Amaranthus cruentus L. (Amaranthaceae)* |
- |
- |
+ |
+ |
|
Daucus carota L. (Apiaceae)** |
+ |
+ |
- |
- |
|
Vernonia amygdalina Delile (Asteraceae)* |
- |
+ |
+ |
+ |
|
Lactuca sativa L. (Asteraceae)** |
+ |
- |
- |
+ |
|
Brassica oleracea L. (Brassicaceae)** |
+ |
- |
- |
+ |
|
Abelmoschus esculentus L. (Malvaceae)* |
+ |
+ |
- |
- |
|
Lycopersicon esculentum Mill (Solanaceae)** |
- |
- |
+ |
+ |
|
Solanum macrocarpum L. (Solanaceae)* |
+ |
+ |
+ |
- |
|
Solanum melongena L. (Solanaceae)** |
- |
- |
- |
+ |
|
Capsicum frutescens L. (Solanaceae)* |
- |
- |
+ |
- |
2.3. Estimation de l’abondance relative et de la diversité des familles d’insectes

Résultats
3.1. Abondance globale des insectes
13Au total, 3108 insectes – Comaes (976 individus), Ouidah (544 individus), Sèmè (498 individus) et Togba (1090 individus) – ont été identifiés au niveau taxonomique de la famille. Ces insectes sont répartis dans six ordres : Hyménoptères (32%), Hémiptères (29%), Coléoptères (17%), Orthoptères (15%), Diptères (6%) et Mantoptères (1%). L’abondance relative de ces ordres pour chaque site est présentée à la Figure 2.
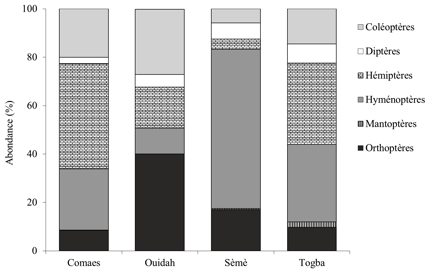
14Figure 2 : Abondance relative des différents Ordres d’insectes en fonction des sites
15À l’exception des Mantoptères (uniquement retrouvés sur le site de Togba), tous les autres Ordres d’insectes ont été recensés sur les quatre sites échantillonnés. Cependant, on observe une prédominance des Hémiptères (44%) à Comaes, des Orthoptères (42%) à Ouidah, des Hyménoptères (66%) à Sèmè, des Hémiptères (34%) et Hyménoptères (32%) à Togba.
3.2. Abondance relative et diversité des familles taxonomiques des insectes
16L’abondance relative des familles est présentée au Tableau 2. Mis à part les Aphididae et les Aleyrodidae (Hémiptères) qui n’ont pas été pris en compte dans ce tableau, 50 familles taxonomiques ont été identifiées et reparties dans les six ordres. Le plus grand nombre de familles (18) a été observé chez les Hyménoptères avec une prédominance des Formicidae, des Megachilidae, des Halictidae puis des Colletidae. Les Hémiptères viennent en seconde position avec 13 familles dont principalement des Lygaeidae, des Membracidae et des Pentatomidae. Les Diptères comptent sept familles avec une prédominance des Syrphidae et des Diopsidae. Les Coléoptères totalisent six familles parmi lesquelles les Coccinellidae et les Chrysomelidae sont les plus abondants.Les Acrididae, les Pyrgomorphidae et les Tettigoniidae sont les familles les plus importantes parmi les Orthoptères. Enfin, une seule famille (Mantidae) a été observée chez les Mantoptères.
17À l’exception de Togba, l’indice de Shannon est similaire pour Comaes, Ouidah et Sèmè (Figure 3). L’équitabilité est également la même pour tous les sites. Cependant, l’indice de Simpson’s varie légèrement entre les sites. Il est de 0,9 pour Comaes et Togba et de 0,7 pour Ouidah et Sèmè (Figure 3).
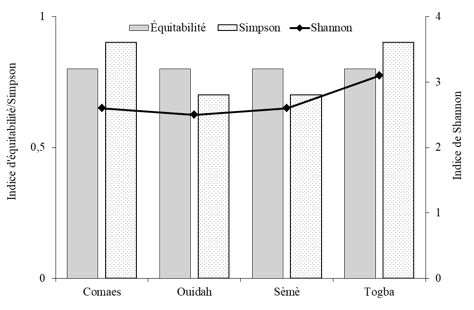
18Figure 3 : Indices de diversité pour les familles identifiées en fonction des sites
193.3. Répartition fonctionnelle des insectes
Les différentes familles identifiées pour l’ensemble des données sont réparties en six groupes fonctionnels dont : 45% de phytophages (23 familles)1, 22% de prédateurs (13 familles), 16% de pollinisateurs (six familles), 2% de parasitoïdes (quatre familles), 1% de parasites (une famille) et 14% d’autres d’insectes2 (cinq familles). L’abondance relative de ces groupes fonctionnels au niveau de chaque site d’échantillonnage est représentée à la Figure 4. À l’exception des parasites (uniquement observés à Togba), tous les autres groupes fonctionnels ont été observés sur les quatre sites. Les ravageurs phytophages restent les plus abondants à Comaes (55%) et Ouidah (70%). À Sèmè, on observe une abondance des pollinisateurs (36%) avec une présence assez marquée des prédateurs (23%). Par contre, à Togba, on remarque une abondance presque équilibrée entre les phytophages (36%) et les prédateurs (30%). 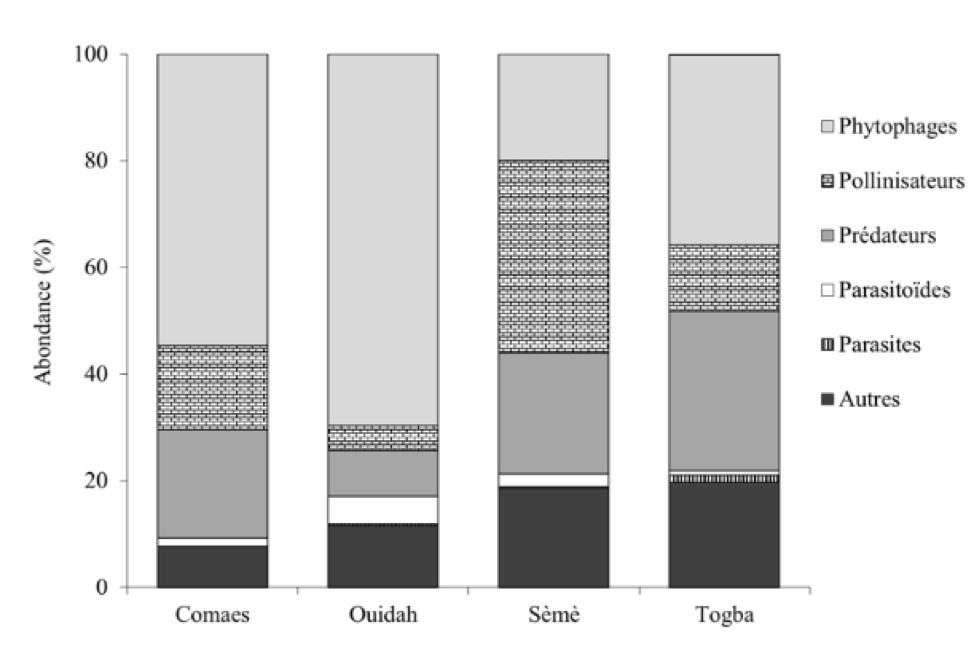
20Figure 4 : Diversité et abondance des groupes fonctionnels des insectes en fonction des sites
Discussion
21Les résultats de cette étude révèlent la présence de 52 familles d’insectes reparties dans six ordres que sont : les Hyménoptères, les Hémiptères, les Coléoptères, les Orthoptères, les Diptères et les Mantoptères. En termes d’ordre identifié, cette observation est similaire à celle de Banjo et al. (2006) effectuée sur le basilic tropical au Nigeria, à l’exception des Mantoptères qu’ils n’ont pas observés et des Lépidoptères qui n’ont pas été recensés lors de cet échantillonnage. Cependant, ils n’ont identifié que trois familles d’insectes (Formicidae, Muscidae, Aphididae) sur une longue période (juin à novembre) d’échantillonnage par observation directe des plants. Toutefois, il faut noter que la plupart des individus qu’ils ont collectés ont été classés comme non identifiés, ce qui justifie le faible nombre de familles identifiées. Au Brésil, Rando et al. (2014) ont par contre recensé sur le basilic tropical trois ordres d’insectes (Coléoptères, Hémiptères et Hyménoptères) au sein desquels ils ont mis en évidence 13 familles taxonomiques par observation directe des plants et sur une longue période d’échantillonnage également (juin 2008 à juillet 2009). Bien que notre méthode d’échantillonnage (fauchage) puisse éventuellement être discriminante pour certaines catégories d’insectes et sa durée limitée dans le temps, un nombre assez important de familles a été observé. Parmi les insectes identifiés, les Hyménoptères représentent l’ordre le plus abondant avec une forte proportion de Formicidae, ce qui corrobore les observations de Banjo et al. (2006). En effet, certaines espèces de ces fourmis peuvent vivre en symbiose avec les pucerons (Verheggen et al., 2009), ce qui explique la forte présence de ces dernières.
22L’indice de Shannon sur les familles d’insectes montre que les sites de Sèmè, Comaes et Ouidah, sont colonisés approximativement par le même nombre de familles d’insectes, qui est moins important que celui de Togba. Cependant, les indices d’équitabilité et de Simpson proche de l’unité indiquent respectivement une abondance assez équilibrée entre les familles recensées et des diversités assez importantes et similaires entre les sites. Cette situation pourrait s’expliquer par une probable conformité des pratiques culturales sur les quatre sites. Cependant, lorsqu’on se réfaire aux groupes fonctionnels, on s’aperçoit que l’état phénologique de la plante explique en partie l’abondance relative de certaines familles sur certains sites. En effet, à Ouidah, les plantes étaient en pleine croissance végétative, ce qui expliquerait l’importance des insectes phytophages avec une dominance des Orthoptères à l’exemple de Zonocerus variegatus L. (Pyrgomorphidae) considéré comme l’un des principaux ravageurs du basilic tropical au Nigéria selon Okin (2001) cité par Banjo et al. (2006). L’abondance plus faible des ravageurs phytophages, avec une distribution quasi équilibrée des autres groupes fonctionnels (pollinisateurs et prédateurs) excepté les parasitoïdes et parasites à Comaes et Togba peut se justifier par l’état mixte des cultures avec certains plants en inflorescence. Le nombre important des pollinisateurs à Sèmè et leur présence assez marquée à Comaes et à Togba indiquent clairement que ce groupe fonctionnel est attiré par la présence des fleurs comme le souligne une étude similaire effectuée au Brésil sur Ocimum selloi Benth (). Ainsi leur présence peut constituer un atout pour certaines cultures adjacentes à pollinisation entomophile dans le cadre de cultures associées et pourraient contribuer à l’amélioration des rendements de ces cultures par une meilleur pollinisation (Pereira et al., 2015). Toutefois, cela nécessite une bonne connaissance du cycle des cultures afin de synchroniser leur production. La présence des ennemis naturels (prédateurs, parasitoïdes et parasites) est partiellement liée à celle des ravageurs. Ils pourraient être aussi attirés par le caractère odoriférant du basilic tropical ou de la présence de fleurs car de nombreux prédateurs et parasitoïdes se nourrissent aussi de nectar et de pollen, représentant des ressources sucrées et protéinées (van Rijn & Wäckers, 2016 ; Gillespie et al., 2016). En effet, la présence de plantes aromatiques du même genre – Ocimum – au sein de cultures a permis d’augmenter la présence des insectes auxiliaires (Beizhou et al., 2011 ; Song et al., 2013). Cependant, le caractère attractif des composés organiques volatils du basilic tropical, ainsi que l’attractivité de ces fleurs pour les ennemis naturels, mérite d’être investigué en l’absence des ravageurs afin de séparer les effets.
23Il faut noter que l’entomofaune observée sur le basilic tropical peut être aussi influencée par la présence des cultures situées à proximité des parcelles échantillonnées. En effet, certaines espèces de différentes familles identifiées à l’exemple des Pentatomidae, Aleyrodidae et Chrysomelidae sont connues comme étant des ravageurs de l’une ou l’autre des cultures avoisinantes (Bordat & Arvanitakis, 2004 ). Cependant, en se référant aux observations de Schoeninger et al. (2011) etRando et al. (2014), on pourrait estimer que la plupart des familles observées ne sont pas liées à la présence de ces spéculations. Pour plus de précision, l’entomofaune du basilic tropical devrait être échantillonnée sur des parcelles isolées d’autres cultures afin d’écarter toute ambiguïté. Pour un inventaire plus exhaustif, le fauchage devrait être combiné avec d’autres méthodes de collecte comme les pièges jaunes à eau généralement utilisés dans les systèmes de cultures (Bosquée et al., 2014 ; Yattara et al., 2014) et des observations directes sur des plants individuels (Banjo et al., 2006 ; Rando et al., 2014). Il faudrait également échantillonner les parcelles à différents stades phénologiques de la plante et sur une longue période tout en prenant en compte les saisons et les différentes zones agroécologiques. Ce protocole d’échantillonnage permettrait d’établir une dynamique spatio-temporelle de colonisation du basilic tropical par les insectes. De plus, l’identification jusqu’au niveau taxonomique de l’espèce permettrait d’évaluer la diversité au sein même des familles et de statuer sur le rôle fonctionnel de chaque espèce.
Remerciements
24Ce travail entre dans le cadre du projet de thèse financé par le Projet Dream ACP du programme Erasmus Mundus. Nous tenons à remercier M. Léonel PKADONOU pour son aide dans l’échantillonnage des insectes sur le terrain. Nous remercions également les maraîchers qui nous ont permis de travailler sur leurs parcelles.
Bibliographie
Achigan-Dako E.G., Pasquini M.W., Assogba-Komlan F., N’danikou S., Dansi A. & Ambrose-Oji B., 2010. Traditional vegetables in Benin. INRAB/ CENAP. Cotonou, Bénin, 286 p.
Agbankpé A.J., Dougnon T.V., Bankole H.S., Yèhouénou B., Yedomonhan H. & Dougnon M.L.T.J., 2014. Etude ethnobotanique des légumes feuilles thérapeutiques utilisés dans le traitement des diarrhées au sud-Bénin (Afrique de l’Ouest). International Journal of Biological and Chemical Sciences, 8, 1784–1795.
Akantetou P.K., Koba K., Nenonene A.Y., Poutouli W.P. & Raynaud C., 2011. Evaluation du potentiel insecticide de l’huile essentielle de Ocimum canum Sims sur Aphis gossypii Glover (Homoptera : Aphididae) au Togo. International Journal of Biological and Chemical Sciences, 5, 1491–1500.
Akomagni L.A., 2006. Monographie de Cotonou. Afrique Conseil. https://www.ancb-benin.org/pdc-sdac-monographies/monographies_communales/Monographie de Cotonou.pdf 22/10/2017.
Banjo A., Lawal O. & Aina S., 2006. Insect diversity of two medicinal Labiatae in Southwestern Nigeria. Journal of Entomology, 3, 298–304.
Beizhou S., Jie Z., Jinghui H., Hongying W., Yun K. & Yuncong Y., 2011. Temporal dynamics of the arthropod community in pear orchards intercropped with aromatic plants. Pest Management Science, 67, 1107–1114.
Biaou C.F., 2006. Monographie de Abomey-Calavi. Afrique Conseil. http://www.ancb-benin.org/pdc-sdac-monographies/monographies_communales/MIONOGRAPHIE ECON DE LA COMMUNE DE ABOM CALAVI.pdf 22/10/2017.
Bordat D. & Arvanitakis L., 2004. Arthropodes des cultures légumières d’Afrique de l’Ouest, centrale, Mayotte et Réunion. Montpellier, France. CIRAD/FLHOR, 291p.
Bosquée E., Lopes T., Serteyn L., Chen J.L. & Francis F., 2014. Impacts d’une association culturale de pois et de pommes de terre sur les pucerons et auxiliaires aphidiphages en Chine. Entomologie Faunistique - Faunistic Entomology, 67, 97–104.
Capo-Chichi Y.J., 2006. Monographie de la commune de Ouidah. Afrique Conseil. http://www.ancb-benin.org/pdc-sdac-monographies/monographies_communales/Monographie de COUIDAH.pdf 22/10/2017.
Chinery M., 2012. Insectes de France et d’Europe occidentale. Guide nature. Edition Flammarion revue et augmentée, 320 p.
Chukwura E. & Iheukwumere I., 2013. Larvicidal activity of Ocimum gratissimum and Solenostemon monostachyus leaves on Anopheles gambiae. Journal of Scientific & Industrial Research, 72, 577–580.
Delvare G. & Aberlenc H., 1989. Les insectes d’Afrique et d’Amérique tropicale : clé de reconnaissance des familles d’insectes. Montpellier, CIRAD-GERDAT, 301 p.
Eardley C., Kuhlmann M. & Pauly A., 2009. Les genres et sous-genres d’abeilles de l’Afrique subsaharienne. Abc Taxa, 9, 144 p.
Efiong E.E., 2014. Phytochemical, proximate, vitamins and minerals composition of Ocimum gratissimum leaves. Journal of Physical and Chemical Sciences, 1, 1–5.
Gillespie M.A.K., Gurr G.M. & Wratten S.D., 2016. Beyond nectar provision: The other resource requirements of parasitoid biological control agents. Entomologia Experimentalis et Applicata, 159, 207–221.
INSAE (Institut National de la Statistique et d’analyse Economique), 2012. Annuaire statistique 2010. Cotonou, Bénin, 652 p.
Ishiwu C.N., Umenwanne C.P., Obiegbuna J. & Uchegbu N., 2014. Invitro assessment of anti bacterial effect of extracts of Ocimum gratissimum and Carica papaya leaves. International Journal of Applied Science and Technology, 4, 171–177.
Kazembe T. & Chauruka D., 2012. Mosquito repellence of Astrolochii hepii, Cymbopogoncitratus and Ocimum gratissimum extracts and mixtures. Bulletin of Environment, Pharmacology and Life Sciences, 1, 60–64.
Kora O., 2006. Monographie de la commune de Sèmè-Kpodji. Afrique Conseil. http://www.ancb-benin.org/pdc-sdac-monographies/monographies_communales/Monographie de Seme Podji.pdf. 22/10/2017.
Kouninki H., Ngamo L.S.T., Hance T. & Ngassoum M.B., 2007. Potential use of essential oils from local Cameroonian plants for the control of red flour weevil Tribolium castaneum (Herbst.) (Coleoptera : Tenebrionidae). African Journal of Food Agricultural Nutrition and Developement, 7, 1–15.
Kpètèhoto W.H., Hessou S., Dougnon V.T., Johnson R.C., Boni. G., Houéto E.E., Assogba F., Pognon E., Loko F., Boko M. & Gbénou J., 2017. Étude ethnobotanique, phytochimique et écotoxicologique de Ocimum gratissimum Linn (Lamiaceae) à Cotonou. Journal of Applied Biosciences, 109, 10609–10617.
Macdonald I.O., Oludare A.S. & Olabiyi A., 2010. Phytotoxic and anti-microbial activities of flavonoids in Ocimum gratissimum. Life Science Journal, 7, 45–48.
Magurran A.E., 2004. Measuring biological diversity. Blackwell Publishing: Oxford, 264 p.
Mignon J., Haubruge E. & Francis F., 2016. Clé d’identification des principales familles d’insectes d’Europe. Presses Agronomiques de Gembloux, 87 p.
Ogendo J.O., Kostyukovsky M., Ravid U., Matasyoh J.C., Deng A.L., Omolo E.O., Kariuki S.T. & Shaaya E., 2008. Bioactivity of Ocimum gratissimum L. oil and two of its constituents against five insect pests attacking stored food products. Journal of Stored Products Research, 44, 328–334.
Orwa C., Mutua A., Kindt R., Jamnadass R. & Simons A., 2009. Ocimum gratissimum L . Agroforestree Database 4.0, 1–5.
Pereira A.L.C., Taques T.C., Valim J.O.S., Madureira A.P. & Campos W.G., 2015. The management of bee communities by intercropping with flowering basil (Ocimum basilicum) enhances pollination and yield of bell pepper (Capsicum annuum). Journal of Insect Conservation, 19, 479–486.
Poutouli W., Silvie P. & Aberlenc H-P., 2011. Hétéroptères phytophages et prédateurs d’Afrique de l’Ouest. Quae, CTA, 79 p.
Prabhu K.S, Lobo R., Shirwaikar A.A. & Shirwaikar A., 2009. Ocimum gratissimum: A review of its chemical, pharmacological and ethnomedicinal properties. The Open Complementary Medicine Journal, 1, 1–15.
Rando J.S.S, Lima C.B. & Mishfeldt L.H., 2014. Monitoring of insects in clovebasil (Ocimum gratissimum L.). Revista Agro@mbiente on-Line, 8, 392–397.
van Rijn P.C.J. & Wäckers F.L., 2016. Nectar accessibility determines fitness, flower choice and abundance of hoverflies that provide natural pest control. Journal of Applied Ecology, 53, 925–933.
Sæthre M-G., Godonou I., Hofsvang T., Tepa-Yotto G. & James B., 2011. Aphids and their natural enemies in vegetable agroecosystems in Benin. International Journal of TropicalInsect Science, 31, 103–117.
Schoeninger K., Somavilla A. & Köhler A., 2011. Community of floral visiting insects of Ocimum selloi Benth (Lamiaceae) in Santa Cruz do Sul, Rio Grande do Sul, Brazil. Biotemas, 25, 55–63.
Sessou P., Farougou S., Ahounou S., Hounnankpon Y., Azokpota P., Youssao I. & Sohounhloue D., 2013. Comparative study of antifungal activities of six selected essential oils against fungal isolates from cheese wagashi in Benin. Pakistan Journal of Biological Sciences, 16, 1751–1757.
Song B., Tang G., Sang X., Zhang J., Yao Y. & Wiggins N., 2013. Intercropping with aromatic plants hindered the occurrence of Aphis citricola in an apple orchard system by shifting predator–prey abundances. Biocontrol Science and Technology, 23, 381–395.
Verheggen F., Diez L., Detrain C. & Haubruge E., 2009. Mutualisme pucerons-fourmis : étude des bénéfices retirés par les colonies d’Aphis fabae en milieu extérieur. Biotechnologie Agronomie Société et Environnement, 13, 1–22.
Yarou B.B., Assogba-Komlan F., Tossou E., Mensah A.C., Simon S., Verheggen F.J. & Francis F., 2017a. Efficacy of Basil-Cabbage intercropping to control insect pests in Benin, West Africa. Communications in agricultural and applied biological sciences, Ghent University, 82, 157-166.
Yarou B.B., Bawin T., Boullis A., Heukin S., Lognay G., Verheggen F.J. & Francis F., 2017b. Oviposition deterrent activity of basil plants and their essentials oils against Tuta absoluta (Lepidoptera: Gelechiidae). Environmental Science and Pollution Research, doi: 10.1007/s11356-017-9795-6.
Yattara A.A.A., Coulibaly A.K. & Francis F., 2014. Diversité et abondance des pucerons [Homoptera : Aphididae] et leur impact sur la dissémination des virus infectant la pomme de terre au Mali. Phytoprotection, 94, 1–7.
Notes
1 À ces familles phytophages s’ajoutent celles des Aphididae et des Aleyrodidae
2 Regroupe des insectes aux fonctions diversifiées sans impact agronomique direct ou non définis

