- Startpagina tijdschrift
- Volume 71 (2018)
- Distribution des Staphylinidae et Carabidae dans huit biotopes de la zone naturelle du Wachnet (Belgique, Waremme)
Weergave(s): 1037 (54 ULiège)
Download(s): 309 (11 ULiège)
Distribution des Staphylinidae et Carabidae dans huit biotopes de la zone naturelle du Wachnet (Belgique, Waremme)

Nota's van de redactie
Reçu le 27 octobre 2016, accepté le 18 février 2018
Résumé
Suite à l’aménagement d’une zone humide sur le site du Wachnet (Waremme, Liège) traversée par un cours d’eau, le Geer, cette étude vise à déterminer la diversité entomologique de ce site de 14 hectares dédiés à la nature. Les insectes ciblés sont les Carabidae et les Staphylinidae dans 8 biotopes. Il s’agit d’une zone de bois, une prairie sèche, une zone de haies récente près de cultures, une zone le long du Geer, une prairie humide, une mare, une zone tampon prairie vs champ et une roselière. Au cours de 5 mois de piégeage, du 01/05/2013 au 14/10/2013, 154 espèces de coléoptères ont été déterminées: 97 espèces de staphylins réparties en 47 genres et 57 espèces de Carabidae distribuées en 29 genres. Les indices de biodiversité ont révélé la diversité entomologique remarquable du site. Néanmoins, en regardant les abondances des différents taxa, on se rend compte que la majorité des taxons sont représentés par des populations faibles. Ceci relativise donc les résultats obtenus par les indices. Il n’y a pas d’espèces rares et toutes fréquentent des milieux perturbés (espèces de stratégie « r »).
Abstract
Following the management of a wetland on the Wachnet site (Waremme, Liège) crossed by a river (le Geer), the aims of the study was to determine the entomological diversity of this site of 14 hectares dedicated to nature. Target insects are the Carabidae and Staphylinidae in 8 biotopes. These ones are: a wood, a dry prairie, an area of recent hedges near crops, a pond, a grassland buffer zone vs field and a reed bed. During five months of trapping of 01/05/2013 to 10/14/2013, 154 beetle species were identified. 97 species of Staphylinidae distributed in 47 genera and 57 species of Carabidae distributed in 29 genera. Biodiversity indices revealed the remarkable entomological diversity of the site. However, when looking at the abundances of different taxa, we realize that the majority of taxa have small populations. This therefore relativize the beneficial results obtained by the indices. There are no rare species and all of them prefer disturbed areas (“r” strategy species).
Inhoudstafel
Introduction
1Les zones humides abritent une multitude d’organismes adaptés à ces milieux. Elles constituent des écotones entre les écosystèmes terrestres et aquatiques et sont, de ce fait, d’une grande importance pour l’Homme et la faune en général. Elles permettent une régulation du débit des cours d’eau par la restitution de l’eau accumulée en fonction des conditions climatiques (Petticrew & Kalff, 1992). Leur régression dans nos paysages engendre donc une moins bonne régulation naturelle du débit des rivières mais aussi une érosion sensible de la biodiversité (Denny, 1994).
2Située en Belgique, en Province de Liège, à Waremme, la zone naturelle du Wachnet (Figure 1)est traversée par le Geer, rivière malmenée et polluée depuis des décennies. Sur le site, des travaux d’aménagement ont été réalisés en 2006 et plus récemment en 2012. Ils ont eu comme conséquences de reconstituer divers biotopes humides et de rendre un caractère sauvage aux berges du Geer et ce, avec l’intervention du contrat rivière du Haut-Geer qui, depuis 2004, contribue à l’assainissement du cours d’eau.
3Afin de capturer des Carabidae et des Staphylinidae, des pièges de type pitfall trap ont été installés dans 8 biotopes (Figure 1). Les pièges ont été actifs du 01/05/2013 au 14/10/2013.
4Les Staphylinidae et les Carabidae faisant partie de la faune hémi-édaphiques ou circulante au sol, le choix des pitfall traps (piège de Barber ou piège-fosse) constitue une solution adaptée à leurs échantillonnages. Ces insectes, de par leurs statuts de prédateurs et colonisant la totalité des biotopes terrestres, sont de bons bioindicateurs (Bohac, 1999). C’est pourquoi, ces deux familles ont été sélectionnées pour évaluer la qualité biologique de la zone humide du Wachnet réaménagée suite au reméandrement du cours d’eau.
Matériel et méthodes
Description du site
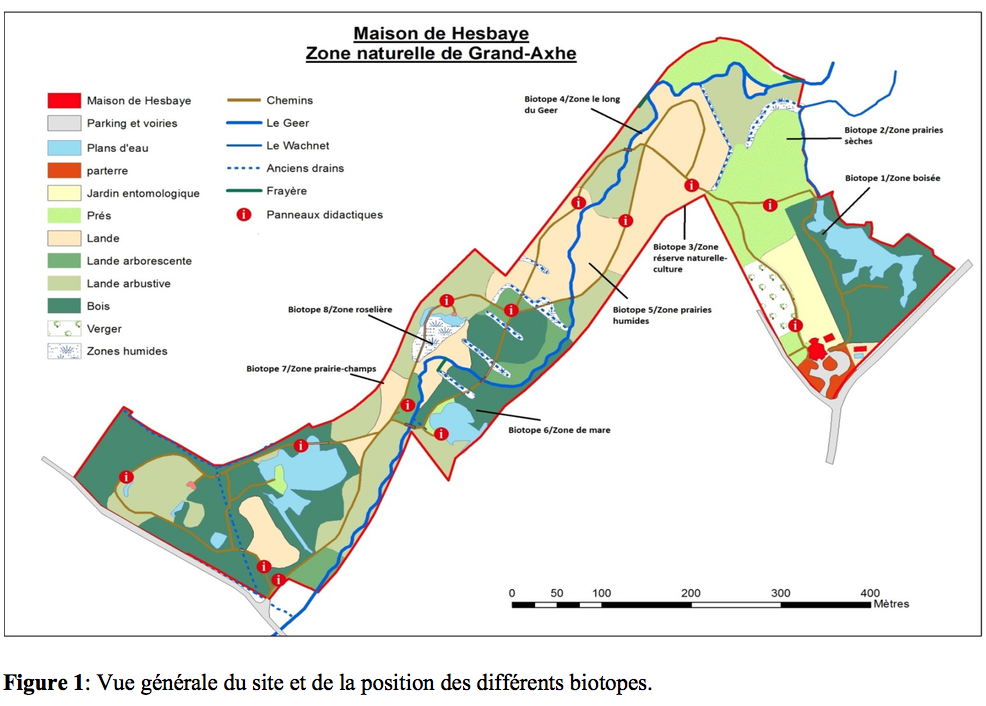
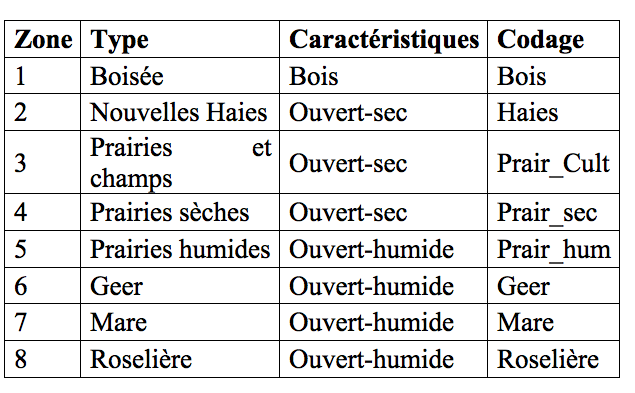
5Situé en province de Liège, la zone naturelle du Wachnet à Waremme est traversée par le Geer, rivière malmenée et polluée depuis des décennies. Des travaux d’aménagement ont été réalisés en 2006 et plus récemment en 2012. Ils ont contribué à la restauration de divers biotopes humides et ont rendu un caractère sauvage aux berges du Geer. Le site s’étend sur une superficie de 17 ha et présente une diversité de biotopes dont huit ont été investigués. Il s’agit de :
6Zone boisée: peuplée d’un mélange de feuillus (Acer pseudoplatanus L., 1753, A. platanoides L.,1753, Fraxinus excelsior L.,1753, Prunus avium (L.) L.,1755, Corylus avellana L.,1753, Sambucus nigra L.,1753 et de Rubus ideaus L.,1753). La strate herbacée est généralement constituée de Rubus fruticosus L.,1753, Hedera helix L.,1753, Geum urbanum L.,1753 ainsi que Galium odoratum Scope.,1771 Le biotope peut donc être qualifié de forêt sèche, possédant un point d’eau et possédant une importante couche humifère.
7Zone de nouvelles haies: zone tampon entre un milieu de culture et le site naturel, elle est composée d’essences indigènes dont Viburnum opulus L.,1753, Euonymus europaeus L.,1753, Corylus avellana L., Salix ssp. La culture adjacente était la carotte (Daucus carota subs sativus (Hoffm.) Schübl, Martens,1721).
8Zone de prairies et champs: même configuration réserve naturelle/culture mais pas de haie. Présence de quelques arbres dont Prunus avium L., Fraximus excelsior L., Crataegus ssp et d’espèces herbacées dont Dipsacus fullonum L,1753. et Cardus ssp.
9Zone de prairies sèches: une rangée de Populus ssp est présente en bordure. La végétation est composée de fleurs annuelles et vivaces mais en grande partie colonisée par Urtica dioica L,1753. et par Cirsium ssp.
10Zone de prairies humides: en plus de troncs d’arbres morts laissés sur place pour favoriser la biodiversité. Présence de Filipendula ulmaria (L.,1879)Maxim, de nombreuses Poaceae ainsi que plusieurs espèces de Cardus ssp. La végétation arbustive est composée de Salix alba L. et de Viburnum opulus L.
11Zone du Geer: présence de Salix alba L.,1753, S. aurita L.,1753, Typha latifolia L,1753. le long des berges et d’une strate herbacée composée de diverses Poaceae, Asteraceae (Bellis perennis L.,1753).
12Zone mare: en plus d’une mare artificielle, d’anciens fossés sont remplis d’eau stagnante. La terre y est fort humifère de par la présence de nombreux arbres morts ou vivants tels que Corylus avellana L., Salix aurita L. ainsi que Aesculus hippocastanum L.,1753 La strate herbacée est composée en grande partie d’Urtica dioica L. et de Geranium robertianum L.
13Zone de roselière: uniquement composée de Phragmites australis (Cav.) Trin. ex Steud.,1841 et de quelques Typha latifolia L.
14La disposition des pièges sur le site est présentée en Figure 1.
15Afin de faciliter la lecture, le codage suivant est utilisé dans la suite de l’article et dans les illustrations.
Méthode de collecte et calcul des indices de diversité
16Pour sept des huit biotopes, quatre pièges sont placés en ligne droite à une distance de 50 cm l’un de l’autre. Seul un biotope (zone de nouvelles haies) ne possède que 3 pièges placés comme cité précédemment. Les pièges sont installés de telle sorte que l’ouverture du pot coïncide parfaitement avec la surface du sol. Les pièges contiennent une solution d’eau savonneuse vinaigrée. Ils ont été relevés tous les quinze jours. Les individus récoltés sont triés et placés dans du Norvanol pour être ensuite déterminés.
17Les indices de diversité de Shannon, de Simpson et de Hill (1-Hill) ont été calculés (Magurran, 2004). L’utilisation de ces trois indices permet une vision plus large de la diversité. En effet, l’indice de Shannon est certes indépendant de la taille de l’échantillon, mais accorde plus d’importance aux espèces rares. L’indice de Simpson subit peu l’influence des espèces rares, mais est plus sensible aux taxa dominants. Enfin, l’indice de Hill (1-Hill) est une intégration des deux précédents et donc lisse les défauts et avantages de chacun (Magurran, 2004).
18Une analyse en coordonnée principale (ACoP) a été réalisée. Celle-ci permet une représentation graphique du jeu de données en utilisant une matrice de dissimilarité. Cette méthode de projection des observations est une transformation d’un espace à p dimensions avec p variables vers un espace à k dimensions (p<k). Cette transformation se fait en tentant de garder un maximum d’informations. Cela permet donc de représenter les jeux de données en deux ou trois dimensions, ce qui en simplifie grandement la lecture et l’interprétation (Borcard et al., 2011).

Résultats
Abondances de l’entomofaune étudiée
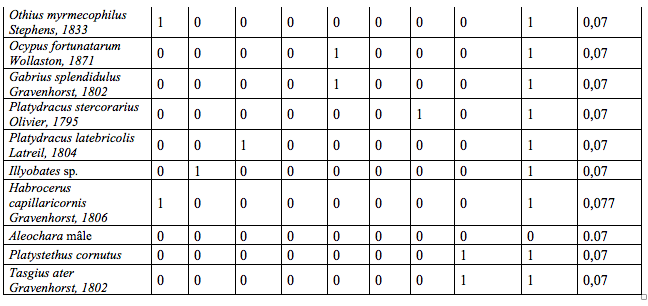
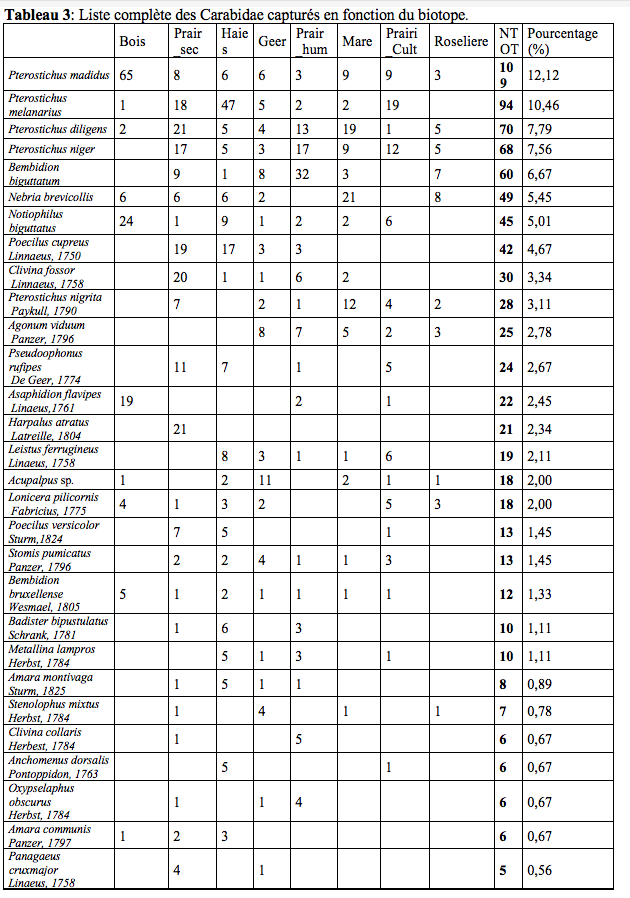
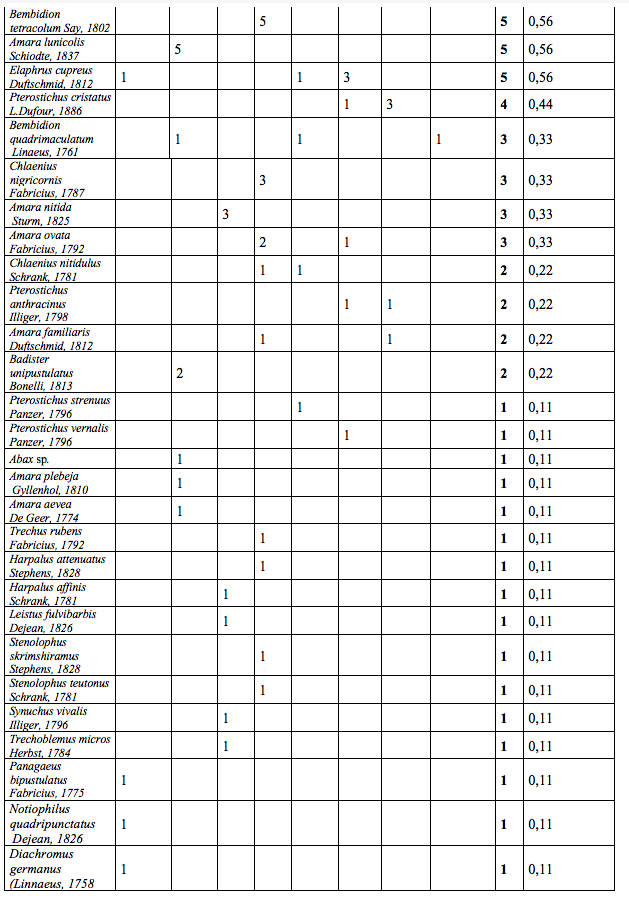
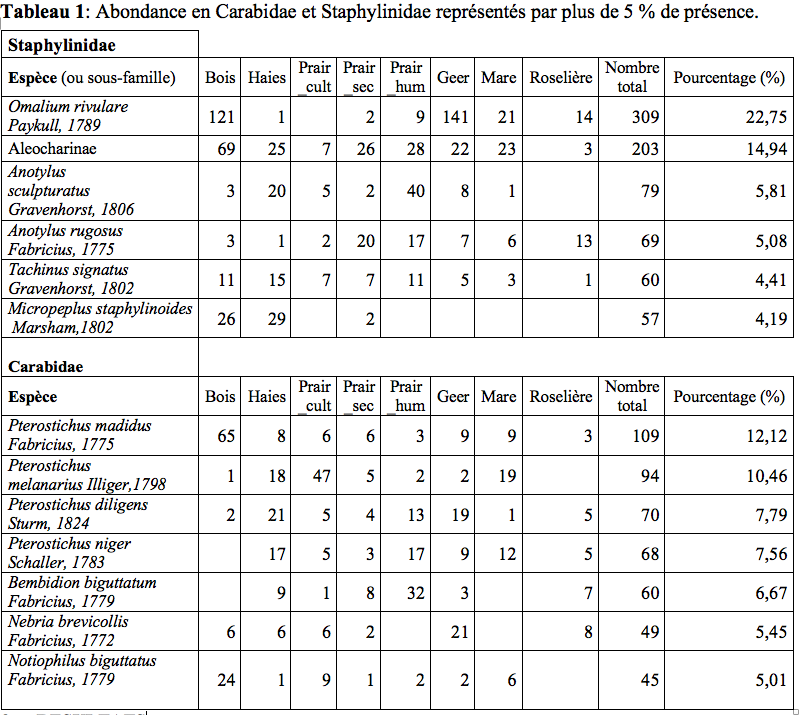
19Lors des piégeages, 97 espèces de Staphylinidae (Tableau 2) réparties en 47 genres (soit 10 % de la faune des Staphylinidae de Belgique (Bruge et al., 2001)) et 57 espèces de Carabidae (Tableau 3) réparties en 29 genres ont été observées. Ces résultats bruts sont à nuancer à l’aide des abondances de ces deux familles (Tableau 1). Un extrait ci-dessous (Tableau 1) reprend les espèces possédant une abondance de plus de 5 %.
Phénologie de l’entomofaune étudiée
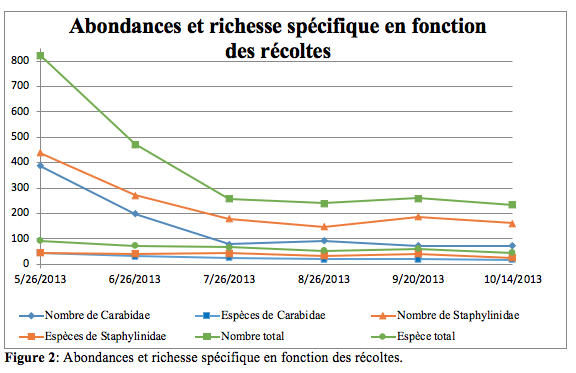
20Les évolutions de l’abondance et de la richesse spécifique des insectes, pour l’ensemble des biotopes, en fonction du temps, sont présentées en figure 2. Les abondances les plus importantes sont observées au début de la campagne de piégeage (26 mai) puis décroissent avant d’atteindre un seuil minimal (27 juillet). Les richesses spécifiques suivent également cette tendance qui est valable tant pour les Staphylinidae que pour les Carabidae. Une légère augmentation des captures en début d’automne est à peine perceptible.
Richesse spécifique de Carabidae et Staphylinidae
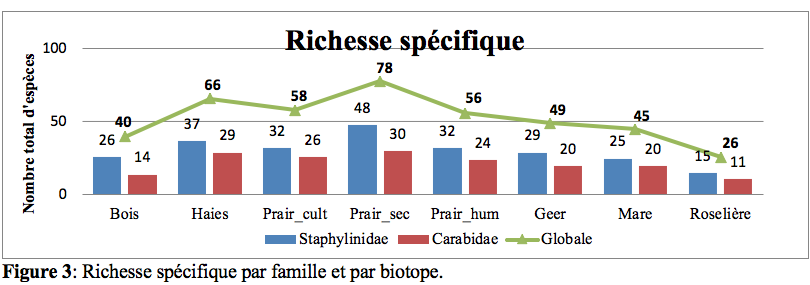
21Le nombre d’espèces (Figure 3) varie sensiblement d’un biotope à l’autre. La zone humide du Geer (biotope 4) se distingue par un nombre d’espèces tant en Carabidae qu’en
22Staphylinidae, plus important. Soit 48 espèces de Staphylinidae et 30 espèces de Carabidae. Les biotopes plus secs (le bois et la roselière (biotopes 1 et 8)) ont quant à eux une richesse en dessous de la moyenne. Avec pour la roselière 15 espèces de Staphylinidae et 11 en Carabidae.
23Pour tous les biotopes, la diversité en Staphylinidae est plus importante que celle des Carabidae avec en moyenne la présence de 34 espèces de Staphylinidae et 25 Carabidae.
Indices de diversité
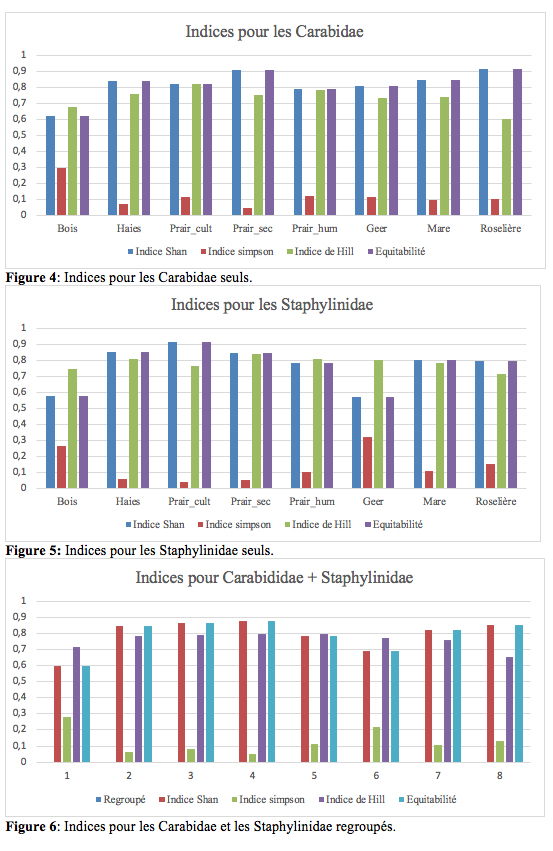
24Les indices de Shannon et de Hill sont proches de 1, représentant le maximum de diversité. Les indices de Simpson révèlent que la probabilité que deux individus sélectionnés au hasard appartiennent à la même espèce est faible. Il n’y a donc pas d’espèce dominante. L’équitabilité confirme les indices de Simpson. Ces résultats sont représentés dans les figures 4-6 suivantes.
Analyse en coordonnée principale
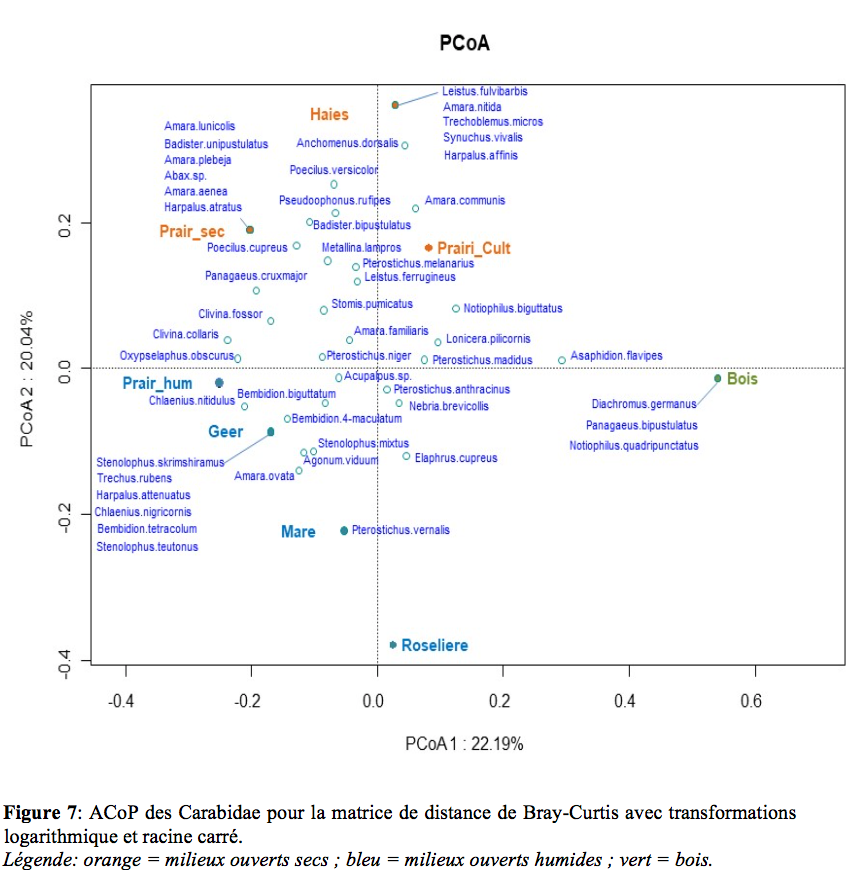
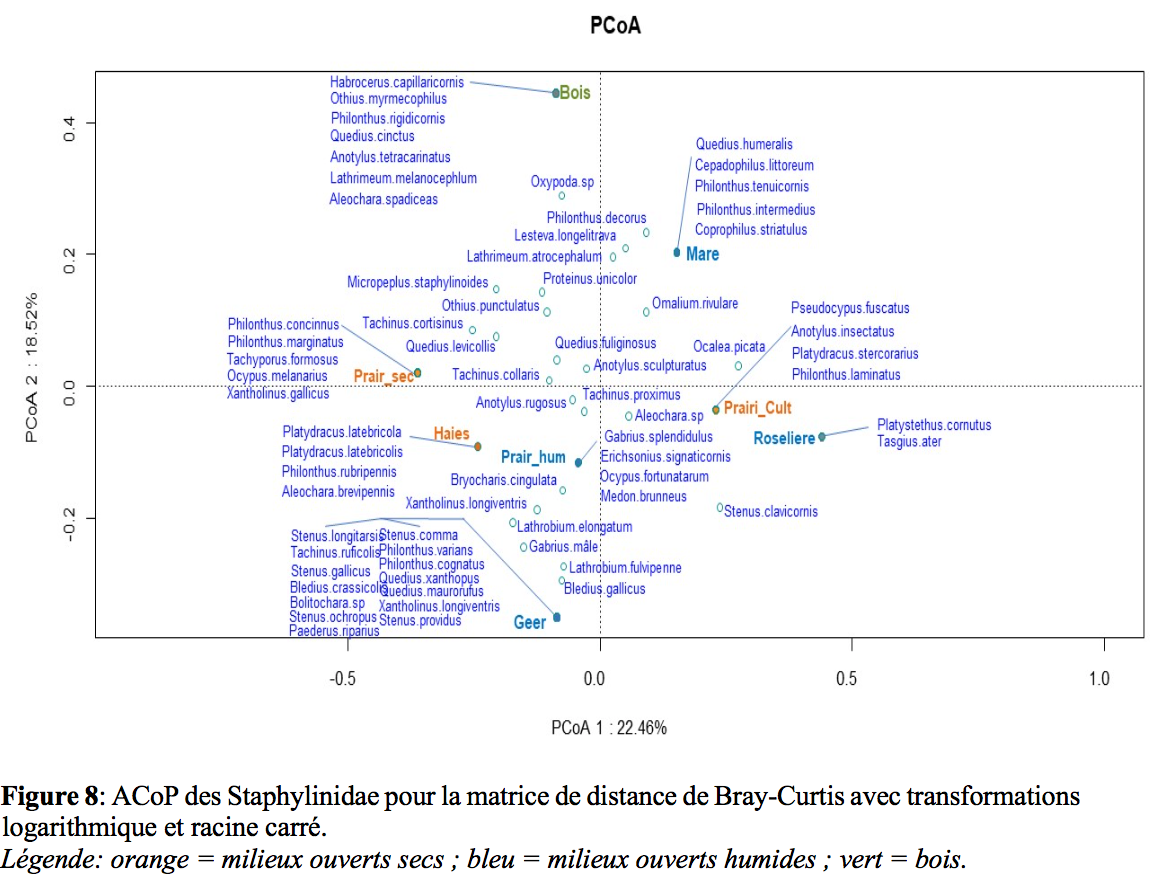
25Les analyses en coordonnées principales (Figure 7-8) permettent de distinguer trois catégories de milieu : en orange les milieux ouverts secs, en bleu les milieux ouverts humides et en vert le bois. L’ACoP des Carabidae montre moins d’espèces liées à un biotope précis que l’ACoP des Staphylinidae.
Discussion
26Tant pour les Staphylinidae que pour les Carabidae, une ou deux espèces seulement sont fortement représentées. Le reste des espèces est représenté par des populations beaucoup plus faibles, sans pour autant être des espèces rares. De plus, pour les espèces fortement présentes comme Omalium rivulare ou Pterostichus madidus, on remarque de grandes différences de présence en fonction des lieux de piégeage, malgré la petite taille de la réserve. En effet, elles sont fréquentes dans un voire deux lieux de capture mais beaucoup moins dans les autres stations. Malgré la proximité des différents biotopes, les différences d’abondances sont observables. On peut donc signaler l’importance et l’intérêt des travaux d’aménagement et de gestion menés aux cours des dernières années. Ils ont permis de créer une multitude de « biotopes » sur un petit espace. Il aurait été intéressant de comparer ces résultats à la situation avant travaux mais il n’y a pas de données disponibles.
27La première récolte (26/05/2013) est la plus importante, ensuite les abondances diminuent et se stabilisent à partir de la récolte du mois de juillet (26/07/2013). Ce phénomène est probablement dû au fait que la plupart des espèces ont une phénologie à reproduction printanière (pic d’abondance en début de saison). Pour les Carabidae, un très léger pic en août est aussi observé. Ce dernier se rencontre chez les Staphylinidae, mais avec un mois de retard. Dufrêne (1992) affirmait que «les espèces passant l’hiver à l’état adulte et ayant donc une reproduction printanière sont généralement liées aux milieux instables». On peut noter que les espèces récoltées préfèrent effectivement les milieux perturbés et peuvent être caractérisées d’espèces à stratégie r.
28À l’avenir, si le site ne subit plus d’aménagements importants, un équilibre pourrait stabiliser l’entomofaune étudiée. Les espèces adaptées aux milieux perturbés ou ouverts (espèces r) vont probablement laisser la place à d’autres cherchant des milieux plus stables et plus forestiers comme des espèces forestières (espèces K). Ainsi, les abondances des différentes espèces évoluent en fonction de la dynamique des différents milieux. Le pic d’abondance printanier pourrait diminuer au profit d’un pic automnal, avec des espèces qui passent plus l’hiver à l’état larvaire (Dufrêne, 1992), au moins dans les zones non soumises à des perturbations comme les inondations ou des activités de gestion. Des campagnes de piégeages dans les années à venir pourront confirmer ou infirmer ces hypothèses et, si changements il y a, elles permettront de décrire ceux-ci.
29La comparaison des différents indices de diversité (Figures 3-5) entre Carabidae et Staphylinidae montre les mêmes profils. Tous les indices s’accordent pour isoler le biotope « Geer » comme le plus original. Ensuite, les indices élevés rapprochent les biotopes prairies sèches et prairies humides suivis de près par les biotopes: haies, mare, prairie_cult. Le bois et la roselière sont les zones les moins riches en espèces.
30Une hypothèse pour les indices faibles de la zone boisée (code biotope) pourrait être que le milieu forestier est la zone ayant subi le moins de modifications. Ce milieu est donc moins fréquenté par les espèces plus présentes dans les autres biotopes des milieux perturbés. C’est aussi une zone peu diversifiée en taxa végétaux, avec une strate arbustive plus dense, sans bois mort et très fréquentée par le public. Ce milieu diffère en raison de sa stabilité par rapport au reste du site, ce qui se confirme en regardant la biologie des insectes observés. Ceux-ci sont connus pour avoir des mœurs forestières plus marquées.
31La roselière est un milieu peu favorable, tant pour les Staphylinidae que pour Carabidae. La roselière est tantôt en phase humide, tantôt en phase sèche. Les roseaux sont les seules plantes de ce milieu. On y trouve peu d’insectes (pucerons, collemboles…) et donc peu de prédateurs comme les Staphylinidae et les Carabidae.
32Pour expliquer la diversité du biotope « Geer «, des crues ont pu modifier l’aspect des berges. Ce biotope est donc rapidement passé d’un stade uniforme (créé par les travaux), à un stade hétérogène. En effet les crues ont modifié les berges, apporté des alluvions et du bois mort permettant d’offrir divers habitats. Durant les longues périodes de chaleur, l’eau du Geer permet de garder une certaine «fraîcheur». Les milieux rivulaires sont des écotones riches en micro-habitats et en nutriments, de nombreuses espèces profitent ainsi des algues, des diatomées (Bledius sp.) ou des branchages (végétaux abandonnés par la rivière).
33Pour les analyses en coordonnées principales, nous distinguons trois catégories: à savoir les zones ouvertes sèches, zones ouvertes humides et enfin le bois. Pour chaque biotope, un cortège d’espèces lui est spécifique.
Conclusions
34Ce travail est la première contribution à l’étude de la faune hémi-édaphique du site du Wachnet ; une seconde étude a eu lieu en 2016. Nous avons peu de recul et d’éléments pour émettre une analyse fine sur la qualité de ce milieu. Une nouvelle campagne de piégeage sur le site permettrait de mieux cerner le patron de la faune et son évolution.
35La dynamique des populations d’espèces du site est influencée par les bouleversements anthropiques du milieu. Lorsqu’on examine les tableaux des abondances des taxons, la majorité est peu abondante (moins de 10 individus). La diversité importante est construite sur des populations faibles sans pour autant que ces individus soient considérés comme espèces rares. En effet, les espèces retrouvées sur le site sont, dans leur majorité, très communes.
36Cette première étude révèle une bonne qualité de la biodiversité entomologique des Carabidae et Staphylinidae sur le site du Wachnet. Ces deux familles sont représentées par de nombreux prédateurs (avec quelques exceptions). Il est permis de penser qu’il existe une bonne diversité de leurs proies (collemboles, pucerons, diptères, …). Mais, le site du Wachnet reste pour autant une zone relativement dégradée. Nous sommes loin des riches réserves existant à d’autres endroits de la Belgique (pelouses calcaires par exemple).
37L’étude de la biologie des espèces présentes, ainsi que les hypothèses émises ci-dessus, permettent d’expliquer ce contraste entre qualité du milieu et diversité. Ce n’est pas que le site ne présente pas d’intérêt ! Bien au contraire. Il est important que des zones soient protégées et préservées de l’action de l’homme. Des réservoirs de diversité sont ainsi créés à partir desquels pourront s’étendre diverses populations animales ou végétales dans l’espoir d’améliorer des zones jouxtant la réserve (maillage écologiques).
Bibliographie
Bohac J., 1999. Staphylinid beetles as bioindicators. Agriculture, Ecosystems and Environment, 74, 357–372.
Borcard D., Gillet F., Legendre P., 2011. Numerical Ecology with R, Springer Verlag, New York, pp. 1–319.
Bruge H., Haghebaert G. & Drugmand D., 2001. Coleoptera Staphylinidae de Belgique et du Grand-Duché de Luxembourg. Catalogue commenté et éléments de biogéographie. Bulletin et annales de la Société royale belge d'Entomologie, 137, 139-172.
Denny P., 1994. Biodiversity and wetlands. Wetlands Ecology and Management, 3(1), 55-61.
Dufrêne M., 1992. Biogéographie et Écologie des Communautés de Carabidae en Wallonie. Dissertation doctorale, Université Catholique de Louvain, 194 p.
Frontier S., 1983. L'échantillonnage de la diversité spécifique. In: Stratégies d'échantillonnage en écologie. Ed. S. Frontier, Paris: Masson-Québec: Presses de l'Université Laval, Collection d’écologie 17, 416-436.
Magurran A.E., 2004. Measuring biological diversity. Malden, USA: Blackwell Science Ltd, 256 p.
Petticrew E.L. & Kalff J., 1992. Water Flow and Clay Retention in Submerged Macrophyte Beds. Canadian Journal of Fisheries and Aquatic Sciences, 49, 2483-2489.