- Home
- Volume 71 (2018)
- Rôle de la transmission des maladies dans le déclin des pollinisateurs – Synthèse bibliographique
View(s): 2089 (51 ULiège)
Download(s): 284 (11 ULiège)
Rôle de la transmission des maladies dans le déclin des pollinisateurs – Synthèse bibliographique

Editor's Notes
Reçu le 6 septembre 2017, accepté le 7 février 2018.
Résumé
L’appauvrissement de la biodiversité globale est devenu une préoccupation croissante pour notre société. Ce déclin, d’origine multifactorielle, de la diversité des organismes touche également la communauté des pollinisateurs qui assure la reproduction des plantes. Les pollinisateurs fournissent aussi un excellent service écosystémique à l'humanité, en particulier pour la sécurité alimentaire et le bien-être humain. La transmission de maladies intra- et interspécifique des pollinisateurs est un des facteurs du déclin de plus en plus étudié. L'objectif de cette revue est d’offrir une mise à jour des causes principales du déclin en se concentrant particulièrement sur l’impact de la transmission des maladies. Outre les effets synergiques de la dégradation du paysage, des pesticides, des changements climatiques et d’espèces invasives, une relation existe entre l’introduction de pollinisateurs domestiques dans de nouveaux milieux et l’émergence de nouvelles maladies. Via la globalisation des échanges commerciaux, certains agents pathogènes sont devenus des menaces importantes concernant la santé des pollinisateurs. Cependant, il subsiste encore des lacunes importantes dans la connaissance des mécanismes de transmission. Des avancées scientifiques et technologiques dans ce domaine permettraient aux autorités d’établir une réglementation sanitaire plus adaptée et ainsi contribuer à la sauvegarde à l’ensemble de la communauté des pollinisateurs.
Abstract
The loss of global biodiversity has become a growing concern for our society. This multifactorial decline also affects pollinator community that ensures plants reproduction in our environment. Pollinators also provide an excellent ecosystem service to humankind, especially for food security and human well-being. The transmission of intra- and interspecific pollinator diseases is considered as factor of pollinator decline which is increasingly studied. The purpose of this review is to provide an update of the main causes of decline, with a particular focus on the impact of disease transmission. In addition to the synergetic effects of landscape degradation, pesticides, climate changes and invasive species, a relationship exists between the introduction of commercial pollinators into new environments and the emergence of new diseases. Through globalization of commercial trades, some pathogens have become substantial threats to pollinators community health. However, there are still significant gaps in knowledge of transmission mechanisms. Scientific and technological advances in this area would enable the authorities to establish more appropriate health regulations and thereby contribute to the protection of pollinators diversity as a whole.
Table of content
Introduction
1La biodiversité influe directement sur la multifonctionnalité des écosystèmes et par conséquent sur les services dits « écosystémiques » assurés. En effet, l’appauvrissement global de la diversité et de l’abondance d’organismes dû à l’empreinte anthropique est devenu une réelle source d’inquiétude pour la société (Pimentel et al., 1997; Pereira et al., 2010; Cardinale et al., 2012; Naeem et al., 2012). Selon le rapport de la Plateforme Internationale sur la Biodiversité et les Services Ecosystémique (IPBES), les enjeux liés à la pollinisation et aux pollinisateurs se profilent comme une des problématiques environnementales les plus préoccupantes du 21ème siècle (Gilbert, 2014). Plus de 85 % des espèces végétales mondiales assurent leur reproduction sexuée grâce à la pollinisation animale (Ollerton et al., 2011). Au niveau agricole, 75 % de la diversité des cultures majoritaires dans le monde dépendent de la zoogamie des plantes à fleurs (Klein et al., 2007). On estime à 153 milliards d’euros par an le service écosystémique rendu par les pollinisateurs, ce qui représente 9,5 % de la production agricole mondiale en 2005 (Gallai et al., 2009). En Belgique, ce service rendu pour la production de denrées alimentaires équivaut à 252 millions d’euros en 2010 (Jacquemin et al., 2017).
2A l’instar des recherches déjà largement abordées liées à la dégradation des paysages naturels, à l’impact des pesticides ou encore des changements climatiques, il apparaît que l’influence des pathogènes joue également un rôle substantiel dans le déclin des pollinisateurs (Cox-Foster et al., 2007; Cameron et al., 2011). En effet, l’émergence et la propagation de nouvelles maladies peuvent avoir des effets désastreux que ce soit sur des espèces sauvages ou domestiquées (Arbetman et al., 2013; Goulson & Hughes, 2015). La transmission des maladies s’intensifie par une utilisation excessive d’espèces domestiquées pour répondre aux besoins de pollinisation de cultures entomogames. Cela peut créer des risques conséquents pour les communautés sauvages environnantes qui n’ont pas acquis naturellement de stratégies de défenses adaptées à ces nouvelles maladies (Daszak et al., 2000; Colla et al., 2006). Par ailleurs, les mécanismes biologiques responsables de la transmission des pathogènes sont encore difficilement appréhendés par le domaine scientifique, en particulier pour les voies interspécifiques. De ce fait, il subsiste beaucoup d’inconnues sur le cycle et la dynamique de propagation entre pollinisateurs économiquement utiles tels qu’Apis mellifera (L. 1758), Bombus terrestris (L. 1758), Megachile rotundata (Fabricius 1787)… et pollinisateurs sauvages (Fürst et al., 2014; Manley et al., 2015; Mcmahon et al., 2015).
3Dans un premier temps, cette synthèse bibliographique a pour but d’apporter une meilleure compréhension et de mettre en lumière les causes directes et indirectes ainsi que les enjeux actuels du déclin des pollinisateurs. Ensuite, l’impact de la transmission des maladies sera abordé plus en détails en se focalisant sur les abeilles et les facteurs qui sont susceptibles de favoriser cette transmission.
Généralités
Une diversité de pollinisateurs
4Les pollinisateurs sont majoritairement constitués d’insectes. Les plantes qui en sont tributaires sont dites « entomophiles ». Ce mode de pollinisation est prépondérant dans les régions tempérées (Ollerton et al., 2011). Quelques groupes ou familles de vertébrés tels que certaines espèces de chauve-souris et d’oiseaux (par exemple, les colibris) participent aussi à la pollinisation en particulier dans les régions tropicales (Kunz et al., 2011; Wolowski et al., 2013). Les insectes pollinisateurs appartiennent à quatre grands ordres : les Hyménoptères, les Diptères, les Lépidoptères et les Coléoptères (Sommaggio 1999; Branquart & Hemptinne, 2000; Vaissiere et al., 2005).
5Chez les Hyménoptères, les abeilles de la superfamille des Apoïdes (Apoidea) se présentent comme le groupe de transporteurs de pollen le plus performant (Michener, 2007). Depuis des centaines de millions d’années, les abeilles ont co-évolué avec les plantes à fleurs et ont joué un rôle déterminant dans leur diversification (Harder & Johnson, 2009; Gómez et al., 2015; Sauquet et al., 2017). Ainsi, les abeilles ont développé au fil du temps des adaptations biologiques les rendant plus efficaces. Par exemple, d’un point de vue morphologique, elles sont recouvertes de poils branchus, d’appendices spécialisés tels que des scopas ou encore de corbicules (par exemple chez l’abeille mellifère ou les bourdons sociaux) ce qui leur permet de maintenir et de transporter de grandes quantités de pollen (Falk, 2015). Au niveau comportemental, elles ont développé un régime alimentaire uniquement composé de pollen, de nectar et parfois d’huiles produites les rendant fidèles aux attraits floraux (Michener, 2007). Dans le monde, plus de 20 000 espèces d’abeilles sont distribuées en 7 familles (Michener, 2007; Danforth et al., 2013). En Europe, on compte 2 051 espèces (Rasmont et al., 2017) réparties en 77 genres dont plus de 376 espèces ont été répertoriées en Belgique (Rasmont et al., 1995). Dans cette diversité globale d’abeilles, une vingtaine d’espèces d’abeilles sociales ou solitaires ont été domestiquées à des fins de production agricole (Stout & Morales, 2009). La plus commune d’entre elles est A. mellifera, communément appelée abeille mellifère ou abeille domestique.
6La contribution à la pollinisation de la part des syrphes, des papillons ainsi que certaines espèces de fourmis, de guêpes et de coléoptères n’est pas négligeable par rapport aux abeilles. En effet, Rader et al. (2015) ont démontré que ces pollinisateurs étaient capables d’accomplir entre un quart et la moitié du nombre total de visites florales dans les systèmes agricoles. Ils permettent également d’améliorer la qualité et la quantité de fructification indépendamment du taux de visites effectuées par les abeilles (Garibaldi et al., 2013). En revanche, le transfert des grains de pollen à partir des étamines sur les stigmates récepteurs est moins efficace (Thorp, 2000).
Quelles sont les preuves du déclin des pollinisateurs ?
7Depuis la fin de la seconde guerre mondiale, tous les continents, excepté l’Antarctique, semblent être touchés par l’affaiblissement de la biodiversité des pollinisateurs. Ce déclin affecte généralement les populations de pollinisateurs sauvages (Allen-Wardell et al., 1998; Kearns et al., 1998; Warren et al., 2001; Donaldson, 2002; Biesmeijer et al., 2006; Oldroyd & Wongsiri, 2006; Goulson et al., 2008; Freitas et al., 2009; Forister et al., 2010; Cameron et al., 2011; Keil et al., 2011; Theisen-Jones & Bienefeld, 2016). Par ailleurs, d’autres études portées sur l’évolution de la diversité des pollinisateurs le long de gradients de perturbations environnementales telles que l’urbanisation (Fortel et al., 2014; Geslin et al., 2016), l’intensification agricole (Kennedy et al., 2013; Le Féon et al., 2013), etc. permettent d’appuyer l’hypothèse d’une généralisation de ce déclin.
8Concernant l’abeille domestique, certaines régions comme les USA ou l’Europe centrale sont également atteintes par des pertes considérables (Haubruge et al., 2006; Potts et al., 2010a; vanEngelsdorp et al., 2011). Cependant, le nombre mondial de colonies d’abeilles mellifères s’est intensifié de manière constante de 45 % sur les cinquante dernières années. Cet accroissement mondial est particulièrement entrainé par des régions qui dominent le marché mondial du miel tels que la Chine, la Turquie ou encore l’Argentine, ce qui outrepasse les pertes en colonies dans les autres régions plus touchées (Aizen & Harder, 2009a).
9Malgré les études réalisées, il demeure encore difficile de clairement percevoir l’amplitude géographique et l’intensité du déclin à cause d’un manque de données fiables ainsi que d’un manque d’experts taxonomiques des abeilles. De plus, il existe peu de méta-analyses s’intéressant de manière conjointe (i) à l’évolution de la biodiversité considérant tous les groupes taxonomiques de pollinisateurs, que ce soit en terme d’abondance ou de diversité spécifique ; (ii) à la phénologie des pollinisateurs (par exemple, abeilles printanières, abeilles estivales) ; (iii) sur des durées correspondant à plusieurs décennies (mais voir Biesmeijer et al., 2006 et Carvalheiro et al., 2013) ; (iv) à des méthodologies de recensement robustes et standardisées afin de pouvoir comparer les données parmi la diversité des études (Westphal et al., 2008). Les données recensant la diversité et surtout l’abondance des pollinisateurs restent éparses, excepté pour quelques groupes taxonomiques, ou régions géographiques (Freitas et al., 2009; Vanbergen, 2013; Nieto et al., 2014). A titre d’exemple, une liste rouge a été établie pour les abeilles sauvages d’Europe. Les auteurs de cette liste ont estimé que plus de 50 % des données relatives aux abeilles sauvages sont déficientes suite à un monitoring approfondi manquant (Nieto et al., 2014). La Grande-Bretagne, les Pays-Bas et la Belgique disposent malgré tout de bases de données adaptées permettant le suivi de la distribution des pollinisateurs au niveau spatial et temporel (Carvalheiro et al.,2013; Potts et al., 2015).
Les causes du déclin des pollinisateurs
10La communauté scientifique s’accorde pour dire que le déclin global des pollinisateurs est d’origine multifactorielle (Potts et al., 2010b ; Figure 1). En effet, plusieurs sources de perturbations interviennent de manière complexe au niveau spatio-temporelle et agissent en synergie (Vanbergen, 2013; Goulson et al,. 2015). A côté de l’influence des pesticides, des changements climatiques, du transfert des pathogènes et de l’introduction des espèces invasives, la cause principale dans la disparition des pollinisateurs semble être la dégradation des paysages (Brown & Paxton, 2009; Potts et al., 2010b).
Impact de la dégradation des paysages
11L’hétérogénéité du paysage façonne la biodiversité et les processus écologiques qui y sont associés (Wiens, 2002). L’importance fonctionnelle de l’hétérogénéité paysagère pour la biodiversité provient de différentes exigences écologiques des organismes en termes de sources d’alimentation et d’habitats (Fahrig et al., 2011). La sphère florale offre un éventail de ressources alimentaires tels que le pollen, le nectar ou certaines huiles produites par les fleurs nécessaires au cycle de vie des pollinisateurs et plus particulièrement aux abeilles (Falk, 2015; Vereecken et al., 2015; Vereecken, 2017). Ayant co-évolué de manière intime avec les abeilles (Gómez et al., 2015), les fleurs disposent également d’un éventail fascinant de stratégies d’attraction et d’adaptations biologiques. La couleur combinée à l’architecture florale (forme de la corolle, symétrie…), le bouquet d’odeurs attractives sont autant de traits fonctionnels responsables des relations mutualistes plantes-pollinisateurs (Fornoff et al., 2017). En effet, dans nos régions tempérées, ces ressources florales doivent être présentes en suffisance en fonction des besoins alimentaires (pour la progéniture et les adultes) et des périodes spécifiques de butinage, entre la fin de l’hiver pour les abeilles les plus précoces, Osmia cornuta (Latreille 1805), Bombus terrestris, et le début de l’automne pour les plus tardives, Colletes hederae (Schmidt & Westrich 1993).
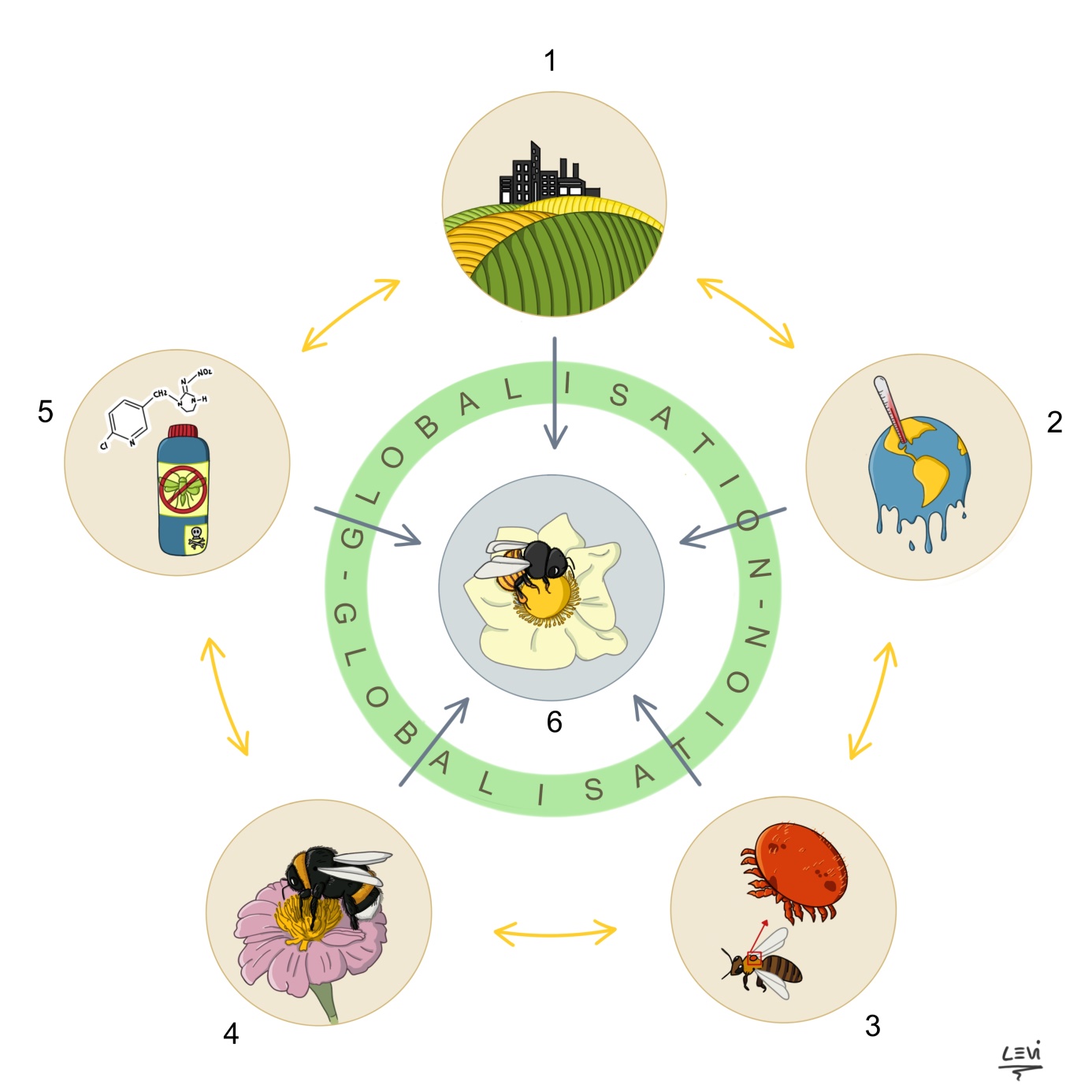 Figure 1: Graphique illustrant les interactions entre les différents facteurs du déclin des pollinisateurs.
Figure 1: Graphique illustrant les interactions entre les différents facteurs du déclin des pollinisateurs.
121. L’impact de la dégradation des paysages (intensification de l’agriculture, l’urbanisation) ; 2. L’impact des changements climatiques ; 3. L’impact de la transmission des maladies ; 4. L’impact de l’introduction d’espèces invasives ; 5. L’impact des pesticides ; 6. L’impact de la globalisation des échanges commerciaux favorise l’intensité des autres facteurs du déclin (1-5). Illustration réalisée par Carolina Levicek (https://carolinalevicek.tumblr.com ; dernière consultation le 09 Septembre 2017).
13D’autre part, la présence de sites de nidification ainsi que des matériaux (boue, pétales, feuilles…) adéquats pour son élaboration sont aussi importants que les ressources alimentaires disponibles (Potts et al., 2005; Michener, 2007). La plupart des espèces d’abeilles sont terricoles, elles nidifient dans le sol. Chaque espèce d’abeilles terricoles nécessite certaines caractéristiques pédologiques dans l’élaboration de son nid : taux de végétalisation, texture, humidité, pente du sol, présence de nids déjà formés… L’autre partie des espèces d’abeilles nichent dans des cavités en dehors du sol. Selon les espèces, elles ont besoin de coquilles d’escargot vides, des tiges sèches ou fraîches, des trous dans le bois, des anfractuosités dans des matériaux de construction… (Fortel et al., 2016; Vereecken, 2017). Par conséquent, une homogénéisation du paysage local induit inévitablement un appauvrissement de ces deux types de ressources (ressources florales et sites de nidification). Dans les paysages ruraux, une méta-analyse menée par Kennedy et al. (2013) a démontré que, selon un gradient d’intensification agricole, la richesse spécifique et l’abondance d’abeilles sauvages étaient plus élevées dans les exploitations agricoles ayant réduit leur utilisation d’intrants chimiques par rapport à ceux utilisant des pratiques agricoles conventionnelles. En effet, l’offre en habitats et ressources alimentaires est favorisée par une composition et configuration de milieux semi-naturels plus riches et plus complexes, en implantant par exemple des haies ou encore des prairies permanentes (Morandin & Kremen, 2013).
14Aussi, l’implantation croissante de cultures entomophiles à floraison massive (« Mass Flowering Crops ») peut provoquer des modifications spatiales et temporelles du paysage. L’exemple de monocultures de colza, Brassica napus (L. 1753), illustre ce phénomène d’homogénéisation paysagère (Holzschuh et al., 2011; Kovács-Hostyánszki et al., 2017). En effet, la durée de floraison des champs de colza offre des ressources abondantes en pollen et en nectar accessibles pour les pollinisateurs sur une période d’environ un mois. Cet énorme pic temporaire de ressources disponibles favorise les pollinisateurs généralistes et peut réarranger complètement les réseaux de pollinisation à l’échelle du paysage. La période de floraison du colza peut également défavoriser la reproduction des plantes voisines par une modification de l’activité de butinage des pollinisateurs partagés (Holzschuh et al., 2011, 2016; Kovács-Hostyánszki et al., 2013). Par exemple, l’étude de Holzschuh et al. (2011) a démontré que les populations de primevères officinales, Primula veris (L. 1753), plantes adjacentes aux cultures de colza, ont montré une réduction de 20 % de graines produites en raison d’une dilution des populations de bourdons (principaux pollinisateurs de la primevère officinale). De plus, certaines populations d’abeilles sauvages appartenant à la famille des Megachilidae ont été stimulées par des ressources florales et de nidification persistantes offertes par les habitats semi-naturels aux alentours des floraisons massives de colza. Diekotter et al. (2014) ont conclu que les cultures à floraison massives peuvent maintenir les communautés d’abeilles solitaires seulement si des habitats semi-naturels sont présents à proximité.
15Par ailleurs, l’urbanisation implique également des changements importants du paysage par une augmentation de surfaces imperméables et une diminution d’espaces verts (forêts, prairies, friches…). Les zones urbaines peuvent s’avérer être des refuges pour une communauté de pollinisateurs conséquente (Hall et al., 2017), mais seulement si ces zones ont une couverture suffisante en milieux naturels. Des études ont montré que l’abondance et la diversité d’abeilles sauvages diminuent en fonction de l’accroissement de l’urbanisation (exemple dans Ahrné et al., 2009; Fortel et al., 2014).
Impact des pesticides
16La combinaison entre le degré d’exposition et le degré de toxicité d’un pesticide constitue le principal risque pour les pollinisateurs. Ce dernier dépend de la capacité de l’individu ou de l’espèce à détoxifier ces composés, de ses habitudes écologiques (préférence florale, fréquence de butinage), de la nature chimique des molécules actives, des pratiques agricoles et des interactions avec d’autres facteurs de stress tels qu’une diminution de ressources florales ou l’émergence de pathogènes (Vanbergen, 2013; Goulson et al., 2015; Collison et al., 2016).
17De plus, l’évaluation de l’exposition réelle sur le terrain est compliquée car elle dépend de l’écologie et des comportements de butinage en fonction d’espèces de pollinisateurs considérés dans divers contextes paysagers. Les effets sub-létaux sur des insectes ciblés individuellement peuvent s’intensifier notamment au sein des colonies et des populations d’abeilles (domestiques et sauvages), particulièrement sur le long terme (Fairbrother et al., 2014; Woodcock et al., 2016). Le potentiel synergique et les effets « cocktails » de mélanges de pesticides sur les communautés de pollinisateurs demeurent largement non connus. De plus, la plupart des études sur des effets sub-létaux de ces pesticides ont principalement été réalisées sur peu d’espèces de pollinisateurs et sur une faible gamme de composés chimiques (Heimbach et al., 2017). A titre d’exemples, les cas des néonicotinoïdes et des sulfoximines sont abordées ci-dessous.
18Ces dernières années, les effets directs des pesticides sur les abeilles, particulièrement les insecticides, ont attiré l’attention simultanée des scientifiques, des politiques et du grand public. Les néonicotinoïdes représentent une classe de composés chimiques systémiques utilisés notamment pour l’enrobage de semences dans la lutte contre des insectes ravageurs généralement de type piqueur-suceur (pucerons, thrips…). Les néonicotinoïdes ciblent le système nerveux central des insectes visés et peuvent dès lors potentiellement influencer la santé des pollinisateurs (Henry et al., 2012; Whitehorn et al., 2012) et impacter le service écosystémique de pollinisation (Stanley et al., 2015). En effet, les molécules neurotoxiques présentes peuvent se concentrer dans le nectar et le pollen (Blacquière et al., 2012) et causer ainsi des dommages irréversibles au niveau du système nerveux des abeilles exposées ce qui provoquent des désorientations spatiales lors de périodes de butinage (Gill et al., 2012; Fischer et al., 2014; Gill & Raine, 2014). Les néonicotinoïdes peuvent également perturber les phases de reproduction et d’hivernage des populations d’abeilles touchées (Rundlöf et al., 2015; Fauser et al., 2017).
19Par ailleurs, les sulfoximines représentent une classe récente d’insecticides neurotoxiques agissant sur les récepteurs nicotiniques. Un des membres de cette famille d’insecticides est le sulfoxaflor (Sparks et al., 2013) qui remplace notamment les néonicotinoïdes contre les ravageurs piqueurs-suceurs de cultures depuis que des cas de résistance à ces derniers sont apparus (Bass et al., 2015). De plus, ces composés chimiques ont potentiellement des effets sub-létaux similaires aux néonicotinoïdes (Rundlöf et al., 2015) risquant également d’impacter une diversité considérable d’insectes et d’agroécosystèmes (Simon-Delso et al., 2015; Brown et al., 2016). L’impact de cette famille de composés chimiques ne sera sans doute évalué précisément qu’après plusieurs années d’utilisation, ce qui laisse une marge élevée d’effets négatifs potentiels sur la biodiversité des pollinisateurs. Ils sont donc suspectés de pouvoir contribuer à l’intensification du déclin des pollinisateurs (Brown et al., 2016).
Impact des changements climatiques
20De nos jours, les effets progressifs des changements climatiques sont de mieux en mieux quantifiés et modélisés à travers le monde. Par conséquent, la compréhension de leurs impacts sur la pollinisation et les pollinisateurs est mieux interprétée et a fortement évolué (Settele et al., 2016). L’accroissement de la fréquence, de la magnitude, et de l’intensité de certains événements climatiques extrêmes (canicules ou périodes de sécheresse) risquent d’accélérer le déclin des pollinisateurs (Brown et al., 2016). Il devient évident que de tels phénomènes climatiques mèneraient rapidement à des extinctions de plantes sauvages et de pollinisateurs associés (Rasmont & Iserbyt, 2012; Oliver et al., 2015). Ainsi, il serait intéressant d’élargir nos connaissances dans ce domaine, surtout concernant l’importance relative des événements climatiques extrêmes afin d’améliorer la gestion d’habitats dépendant de la pollinisation animale. En effet, les communautés de pollinisateurs sont liées de manière intrinsèque à la distribution spatio-temporelle des ressources florales (Potts et al., 2003, 2006; Kremen et al., 2007). Les changements climatiques ont donc le potentiel de restructurer ou de simplifier les réseaux d’interactions plantes-pollinisateurs (Schweiger et al., 2010).
21La température joue un rôle prépondérant dans la croissance des insectes et des plantes. Les changements climatiques peuvent alors induire des divergences temporelles entre la floraison et l’émergence des pollinisateurs associés (Hegland et al., 2009). Par exemple, une méta-analyse de Parmesan (2007) a démontré que l’émergence ou l’arrivée d’espèces migratoires de papillons de jour a manifesté un avancement temporel trois fois plus rapide que les premières floraisons de la strate herbacée. Il y a donc un risque que ce découplage phénologique donne lieu à des réductions dans la disponibilité des ressources florales pour les pollinisateurs et dans le même temps une réduction de la pollinisation des plantes hôtes associées. Toutefois, ces considérations doivent prendre en compte que la structure des relations plantes-pollinisateurs est fortement résiliente : (i) il existe une asymétrie d’interaction entre les spécialistes et les généralistes, les pollinisateurs spécialistes visiteraient des plantes généralistes et vice-versa (Bascompte et al., 2003; Fontaine et al., 2011) et (ii) le généralisme (polylectisme) des pollinisateurs est plus largement répandu que le spécialisme (oligo-, monolectisme) dans les interactions avec les plantes à fleurs (Memmott et al., 2004; Petanidou et al., 2008). Les pollinisateurs généralistes sont donc plus facilement capables de s’adapter aux variations de la composition florale que les pollinisateurs spécialistes lesquels risquent davantage d’être impactés par les modifications climatiques (Roberts et al., 2011).
22Entre autres, les changements climatiques ont la capacité de restreindre ou d’étendre les aires de répartition des espèces. Les pollinisateurs ayant une capacité de migration plus faible auront tendance à voir leur aire de distribution s’amoindrir mais pour certaines espèces capables de suivre la cadence des changements climatiques, leur territoire pourrait s’agrandir (Thomas et al., 2006). Des prédictions climatiques sont déjà disponibles concernant les distributions spatio-temporelles de bourdons en Europe et en Amérique du Nord et des papillons de jour européens (Settele et al., 2008; Kerr et al., 2015; Rasmont et al., 2015).
23L’écologie chimique florale intervient également dans les relations plantes-pollinisateurs à travers des bouquets d’odeurs complexes associés à du nectar et du pollen. Les variations de température et l’élévation de la concentration du dioxyde de carbone atmosphérique auraient un impact sur l’écologie chimique des plantes et la composition du nectar et du pollen produits (Griffin et al., 2009; Farré-Armengol et al., 2014; Parachnowitsch & Manson, 2015). Par exemple, des papillons se nourrissant de nectar avec de grandes concentrations en acides aminés déposent plus d’œufs et augmentent ainsi leur fitness que ceux qui ont prélevé du nectar en concentration moins riche en acides aminés (Mevi-Schutz & Erhardt, 2005). Hoover et al. (2012) ont également conclu que les effets conjoints de l’accroissement en CO2 atmosphérique et des températures pouvaient affecter la morphologie, la phénologie ainsi que la composition en nectar de la fleur, ce qui modifie son attractivité vis-à-vis des pollinisateurs. Cette thématique de recherche demeure encore peu explorée et des investigations scientifiques sont en cours.
Impact de l’introduction d’espèces invasives
24Les effets écologiques d’espèces invasives sur les pollinisateurs natifs restent complexes et encore mal définis. Mais ceux-ci peuvent être importants sous certaines circonstances écologiques et biogéographiques (Graystock et al., 2016). L’invasion ou l’introduction d’espèces végétales ou animales peut agir à différentes échelles trophiques et ainsi altérer les réseaux indigènes d’interactions plantes-pollinisateurs. La présence de ces nouvelles espèces dans un milieu offre également de nouveaux risques d’émergence et de propagation d’agents pathogènes des espèces exotiques vers les espèces natives.
25Certaines plantes invasives entomophiles sont facilement intégrées dans les réseaux d’interactions plantes-pollinisateurs du milieu et deviennent des sources additionnelles de nectar et de pollen pour les pollinisateurs indigènes (Aizen et al., 2008; Stout & Morales, 2009). En général, ces plantes exotiques offrent une certaine protection face aux pénuries de nectar et de pollen sous des conditions climatiques changeantes (Schweiger et al., 2010). En Europe, une proportion conséquente de plantes invasives est constitué de plantes ornementales (Lambdon et al., 2008) avec une longue floraison, ce qui peut éventuellement étendre les périodes de butinage de nos pollinisateurs (Aizen et al., 2008). Les effets positifs des plantes invasives restent limités aux pollinisateurs généralistes plus résilients face aux changements floraux (Traveset & Richardson, 2006). Cependant, dans certains cas, l’intégration de plantes exotiques dans un nouvel écosystème peut dominer les interactions plantes-pollinisateurs et avoir un impact néfaste sur les communautés florales indigènes en diminuant leur densité et leur diversité (Pyšek et al., 2012; Traveset & Richardson, 2014).
26L’utilisation de pollinisateurs pour assurer la pollinisation des cultures entomophiles et augmenter les rendements et la qualité des produits (amandes, pêches, tomates…) est devenu au fil du temps de plus en plus commun (Velthuis & Doorn, 2006; Aizen et al., 2009; Garibaldi et al., 2016). En effet, de nombreuses colonies d’abeilles mellifères ont également été introduites massivement dans les écosystèmes agricoles et naturels pour le service écosystémique de pollinisation et la production de miel (Moritz et al., 2005; Freitas et al., 2009; Graystock et al., 2016). Cependant, certaines études montrent que l’augmentation de la densité de ruches d’abeilles domestiques peut changer la préférence florale de certains bourdons sauvages (Forup & Memmott, 2005; Walther-Hellwig et al., 2006) ou encore diminuer l’abondance des pollinisateurs sauvages présents (Lindström et al., 2016). Selon une méta-analyse de la littérature réalisée par Mallinger et al. (2017), les effets de l’empreinte environnementale des abeilles mellifères sont principalement négatifs sur les abeilles sauvages que ce soit via la compétition des ressources florales ou encore via la transmission des maladies (voir point suivant).
27La domestication et l’élevage intensif de nouvelles espèces pollinisatrices est également en plein essor dans des cultures plus particulières où ces espèces sont plus efficaces et mieux adaptées qu’A. mellifera (Thorp, 2000). Ainsi, certaines espèces de bourdons, comme le bourdon terrestre, B. terrestris, pour l’Europe ou encore le bourdon fébrile, Bombus impatiens (Cresson 1863), pour l’Amérique du Nord, sont particulièrement utilisées en cultures maraîchères, notamment pour la culture sous serres de tomates, Solanum lycopersicum (L. 1753). En 2006, l’estimation annuelle mondiale de la valeur des cultures de tomates pollinisées par ces bourdons représentait 12 milliards d’euros (Velthuis & Doorn, 2006). M. rotundata, une abeille solitaire appartenant à la famille des Megachilidae, a complètement transformé la culture de la luzerne, Medicago sativa (L. 1753), aux USA (Pitts-Singer, 2008). Cette abeille a permis de tripler la production de graines grâce à une grande facilité d’élevage, de mise en place sur le terrain et une parfaite synchronie d’émergence avec le début de la floraison de la luzerne cultivée (Pitts-Singer & Cane, 2011).
L’impact des pathogènes et de leur transmission
28La dynamique des maladies et leurs modes de transmission ont des impacts négatifs au niveau de l’individu, des colonies, des populations et des communautés des pollinisateurs. Les parasites et agents pathogènes possèdent des cycles de vie qui leur sont propres. Ces agents pathogènes peuvent devenir problématiques lors de phénomènes de surpopulation, de domestication et d’introduction dans des nouveaux milieux (Cameron et al., 2011; Graystock et al., 2016; Geslin et al., 2017).
29Durant les années 2006-2007 et 2007-2008, les USA ont, par exemple, connu des pertes considérables et inexpliquées de colonies d’abeilles mellifères. En l’absence de causes connues, ce syndrome fut appelé « Colony Collapse Disorder » (vanEngelsdorp et al., 2009). Alors que les populations de Varroa destructor (Anderson & Trueman, 2000) et Nosema ceranae (Fries et al., 1996) étaient insuffisantes pour provoquer le déclin d’une colonie d’abeilles mellifères, il semblerait que les colonies atteintes de ce syndrome montraient une plus grande prévalence et relation positive avec des concentrations élevées de pathogènes (principalement des virus) par rapport à d’autres colonies faibles non atteinte du CCD et à des colonies saines. Une combinaison de ces différents pathogènes, dont la majeure partie serait véhiculée par V. destructor,serait potentiellement responsable de ce type de syndrome (Cornman et al., 2012).
30Autre exemple, Cameron et ses collègues(2016) ont démontré qu’en examinant des spécimens de bourdons provenant des collections de différents musées nord-américains, la prévalence de Nosema bombi (Fantham & Porter 1914), une microsporidie pathogène spécifique au groupe des bourdons, a augmenté significativement ces 20 dernières années. Même s’il n’y a aucune certitude concernant l’origine des souches du pathogène, il semblerait que l’accroissement de la prévalence du pathogène des espèces de bourdons en déclin coïncide avec la domestication d’espèces de bourdons européens aux USA, dans le milieu des années 90. Cette relation temporelle entre l’arrivéedes espèces commerciales de Bombus (Latreille 1802) et le début de l’accroissement du pathogène dans les populations sauvages serait une cause importante du déclin des populations de bourdons sauvages en Amérique du Nord (Brown, 2017).
Diversité des pathogènes
31Les pollinisateurs souffrent naturellement d’un éventail assez large de parasites, parasitoïdes et d’agents pathogènes comprenant des acariens, des insectes, des protozoaires, des nématodes, des champignons, des bactéries ou encore des virus (Genersch, 2010; Core et al., 2012; McMenamin & Genersch, 2015; Schwarz et al., 2015). Par son intérêt agronomique en tant que facteur de production (Klein et al., 2007) ainsi que son omniprésence géographique (Aizen & Harder, 2009b), l’abeille mellifère est l’organisme le mieux décrit et caractérisé au niveau de sa pathosphère en particulier dans le domaine viral par rapport aux bourdons et autres pollinisateurs sauvages (Tehel et al., 2016). Afin de démontrer cette diversité, nous évoquerons deux classes de pathogènes ayant un impact considérable sur les abeilles : les virus et les microsporidies.
32La plupart des virus de l’abeille mellifère, dont 24 ont été comptabilisés à ce jour (McMenamin & Genersch, 2015), sont des virus composés d’un ARN monobrin positif (de Miranda et al., 2011). Lorsque l’infection est trop importante, c’est-à-dire une intense réplication du virus entraînant la mort des cellules infectées, il résulte des dommages importants au niveau des tissus ciblés. Cela implique une réduction de vie des individus infectés à cause de dysfonctionnements du comportement animal comme une désorientation spatiale ou encore une activité de butinage amoindrie (de Miranda et al., 2011; Benaets et al., 2017). Certains symptômes deviennent également visibles comme dans le cas du « Deformed Wing Virus » (DWV), le virus des ailes déformées, chez A. mellifera et B. terrestris (Genersch et al., 2006; Möckel et al., 2011). A partir du moment où ces maladies deviennent épidémiques, on observera des pertes élevées d’individus et donc une diminution drastique du nombre de colonies, domestiques ou sauvages. D’autres virus sont également répandus chez l’abeille mellifère provoquant divers symptômes tels que le virus du couvain sacciforme (« Sacbrood Virus » ; SBV), le virus des cellules royales noires (« Black Queen Cell Virus » ; BQCV), le virus de la paralysie aigüe (« Acute Bee Paralysis Virus » ; ABPV)… (Bailey & Ball, 1991; de Miranda et al., 2011). La plupart de ces virus sont transmis verticalement et horizontalement dans les colonies d’abeilles mellifères par un acarien ectoparasite, originaire d’Asie, V. destructor. Par son rôle de vecteur mécanique et d’activateur biologique de virus, ce parasite est considéré comme étant la plus grande menace du monde apicole (Anderson & Trueman, 2000; Navajas, 2010; Rosenkranz et al., 2010; McMenamin & Genersch, 2015).
33Au départ des études menées, les maladies virales n’apparaissent pas comme étant une cause significative de pertes de colonies car ces dernières, une fois infectées, sont capables de récupérer leur état normal grâce à des comportements naturels et aptitudes immunitaires comme le toilettage, la capacité de déplacer des larves parasitées et/ou infectées (comportement hygiénique), mais aussi des réponses antivirales spécifiques (Evans & Spivak, 2010; Brutscher et al., 2015; Doublet et al., 2017). Des pratiques de « bonne gestion apicole » permettent de limiter l’infection des virus au niveau de l’individu ou de la colonie. Un contrôle efficace et opportun des vecteurs de virus (V. destructor…), une rotation adéquate des cadres, des règles sanitaires respectées… réduisent efficacement les populations de parasites et ainsi la concentration des virus associés (de Miranda et al., 2011). En outre, de telles maladies virales peuvent être partagées et transmises à partir et vers des pollinisateurs sauvages (Fürst et al., 2014; Tehel et al., 2016; Bailes et al., 2018). Ravoet et al. (2014) ont signalé les virus BQCV et DWV chez des espèces d’abeilles solitaires, Andrena vaga (Panzer 1799), Heriades truncorum (L. 1758), Osmia bicornis (L. 1758) et Osmia cornuta, collectées près de ruches d’abeilles mellifères infectées. Ce résultat suggère que les colonies d’abeilles domestiques peuvent représenter une source importante de pathogènes pour les autres pollinisateurs (Manley et al., 2015).
34A côté des maladies virales, les microsporidies sont des champignons parasites intracellulaires (Keeling, 2009) qui sont incapables de produire de l’ATP via la phosphorylation oxydative (Aliferis et al., 2012). Afin de réaliser son cycle, ce groupe de champignons eucaryotes unicellulaires dépend obligatoirement d’une cellule hôte. Les pathogènes du genre Nosema (Nägeli 1857) sont des parasites du tractus digestif des abeilles, transmis en général par la voie orale-fécale. L’infection se déroule par l’ingestion de spores viables qui germent ensuite au milieu du tube digestif de l’insecte hôte et infecte les cellules épithéliales. Après l’infection et la réplication à l’intérieur des cellules du tissu ciblé, les microsporidies produisent des spores solides expulsées dans l’environnement extérieur via les fèces. Les spores ont ainsi l’opportunité d’infecter un nouvel individu (Higes et al.,2010; Gisder et al., 2011).
35A l’instar de V. destructor, N. ceranae est un parasite originaire de l’abeille asiatique, Apis cerana (Fabricius 1793). Ce champignon a certainement changé d’hôte durant le développement de l’activité apicole dans les régions du Sud-Est asiatique et s’est propagé à travers le monde suite à la mondialisation de l’abeille mellifère (Klee et al., 2007; Paxton et al., 2007). Présente dans de nombreuses régions du globe, N. ceranae est devenue au fil du temps l’espèce de microsporidies la plus commune infectant l’abeille mellifère (Fries et al., 2006; Higes et al., 2007; Huang et al., 2007; Chen & Huang, 2010). En effet, un monitoring de la microflore intestinale de l’abeille mellifère via une approche métagénomique (Cox-foster et al., 2007) ainsi qu’une étude épidémiologique descriptive (vanEngelsdorp et al., 2009) ont montré que les phénomènes de co-infections entre Nosema apis (Zander 1907) et N. ceranae ainsi que la prévalence de cette dernière par rapport à N. apis étaient plus élevées dans les colonies atteintes du CCD que dans les colonies saines. La nosémose (de type C) causée par N. ceranae est dans un premier temps asymptomatique puis devient soudainement capable de décimer l’entièreté des colonies (phénomène d’effondrement) lorsque la reine n’est plus capable de remplacer les abeilles adultes mortes par la ponte de nouveaux individus. Les dégâts les plus importants ont été enregistrés en Espagne où le parasite a eu un effet conséquent sur la santé des colonies d’abeilles mellifères (Higes et al., 2008, 2009, 2010). Ce parasite affecte également de manière négative la durée de vie, l’immunité, la physiologie, le métabolisme et les capacités de butinage de son nouvel hôte A. mellifera (Paxton et al., 2007; Higes et al., 2008; Antúnez et al., 2009; Mayack & Naug, 2009; Naug & Gibbs, 2009). N. ceranae a également été isolée sur différentes espèces de bourdons communs au Royaume-Unis, et est capable d’infecter de manière létale B. terrestris (Graystock et al., 2013; Fürst et al., 2014).
Diversité de voies de transmissions
36Une modalité de transmission détermine le pouvoir d’émergence et de propagation de parasites et/ou de maladies. Généralement, les pathogènes appartenant aux voies directes de propagation se transmettent au niveau intraspécifique : entre individus de la même colonie via un contact physique (trophallaxie, communication chimique, pillage…) ou sexuel. Alors que les voies indirectes de transmissions de pathogènes utilisent des moyens intermédiaires comme le partage de ressources ou les vecteurs biologiques (par exemple, l’ectoparasite V. destructor). Ces types de routes indirectes ouvrent plus d’opportunités à l’exposition et la transmission de pathogènes d’espèces différentes (Manley et al., 2015). Etant donné le peu de connaissances sur les mécanismes de transmission, la liste des possibilités d’échange est non-exhaustive. La partie suivante décrira les voies de transmissions principales relatées dans la littérature scientifique chez les pollinisateurs ainsi que les facteurs d’origines biologiques et humaines qui contribuent à renforcer ces transferts de pathogènes.
37Au niveau intraspécifique, la transmission verticale des maladies à partir des individus adultes vers leurs descendants est généralement sexuelle. Lors des périodes d’accouplement, la transmission de pathogènes, appelée aussi transmission vénérienne, peut s’effectuer entre les mâles porteurs de spermatozoïdes et les femelles fondatrices (reines dans le cas des abeilles mellifères). Les événements d’accouplement chez A. mellifera entre la reine et les faux bourdons sont des voies royales pour la transmission et la propagation de pathogènes et de parasites entre colonies. En effet, une reine peut réaliser plus d’une douzaine d’accouplements avec des mâles, provenant de colonies avoisinantes parfois distantes de plus de 5 kilomètres, autour de ce qu’on nomme les zones d’agrégation de faux bourdons (« Drone Congregation Areas » ; DCA) ou encore zones d’accouplement (Galindo-Cardonaa et al., 2012; Tarpy et al., 2015). Les pathogènes peuvent aussi être transférés de la femelle à sa progéniture lors de la production des œufs, fécondés ou non. Ce type de transmission s’appelle la transmission transovarienne. De ce fait, il n’est pas surprenant qu’une myriade de virus se retrouvent dans les ovaires (Chen et al., 2006; Gauthier et al., 2011), dans les vésicules séminales et le sperme (Yue et al., 2011) où ils peuvent être accumulés à d’énormes concentrations (Fievet et al., 2006) pour une transmission très efficace (Yue et al., 2007; de Miranda & Fries, 2008).
38La plupart des virus sont transmis entre abeilles adultes par contact (Bailey et al., 1983; Bailey & Ball, 1991), probablement via des blessures au niveau du tégument. Ces processus de transmission se déroulent plus facilement lors d’événements de surpopulation, de confinement forcé (climat froid ou transport sur de longue distance), d’agression ou de vol (de Miranda et al., 2011; Manley et al., 2015). De plus, les sites de nidifications offrent des occasions propices pour le parasitisme des larves et le parasitisme social. Cela peut engendrer des transmissions interspécifiques de pathogènes entre hôtes et parasites. Il existe une minorité d’espèces d’abeilles qui sont qualifiées d’espèces clepto-parasites ou encore abeilles coucous. Ces abeilles pondent leur progéniture dans des nids d’autres espèces d’abeilles-hôtes et laissent à ces dernières le soin de nourrir leurs larves. Par exemple, le sous-genre d’abeilles coucous Psithyrus (Lepeletier 1832) chez les bourdons, la reine parasite utilise les ouvrières adultes de l’espèce hôte pour élever sa progéniture (Lhomme, 2009; Lhomme et al., 2012). Enfin, le phénomène de dérive, bien connus chez les abeilles mellifères (exemple dans Chapman et al., 2010) mais moins chez d’autres espèces (O’ Connor et al., 2013), participent également aux échanges de pathogènes. Ce phénomène correspond à une erreur d’orientation où des individus vont « dériver » dans des nids/colonies voisines. Pour l’abeille mellifère, cette dérive est intensifiée par le nombre et la proximité de colonies présentes dans un rucher. Par exemple, des ouvrières contaminées vont rentrer après une séquence de butinage dans une colonie voisine.
39Indirectement, le partage, le vol ou le transfert de ressources (alimentaires ou structures de nidification) permettent facilement la dispersion de pathogènes au sein de l’espèce et entre espèces. Par exemple, certaines espèces de bourdons, B. terrestris et Bombus pascuorum (Scopoli 1763), ainsi que des guêpes prédatrices, Vespa vulgaris (L. 1758), ont été infectées par le virus des ailes déformées (DWV) après avoir dérobé les produits alimentaires ou occupé d’anciennes colonies d’abeilles mellifères infectées (Genersch et al., 2006; Evison et al., 2012). Aussi, une variété de virus a été détectée dans une série de provisions telles que le pollen, le miel ou encore la gelée royale (Shen et al., 2005; Singh et al., 2010). Ainsi, le pollen, le nectar et les surfaces florales agissent en tant que plateformes intéressantes dans la dynamique de transfert de pathogènes au niveau des réseaux mutualistes plantes-pollinisateurs (Graystock et al., 2015). Cependant, l’épidémiologie et les voies de transmission de pathogènes par le biais de ressources florales entre différents pollinisateurs demeurent encore assez mal caractérisées (Mcart et al., 2014). A ce jour, seulement une dizaine d’études se sont intéressées à la transmission florale de pathogènes originaires d’abeilles. Et, la plupart de ces études ne l’ont pas prouvé expérimentalement (mais voir Durrer & Schmid-Hempel, 1994 et Graystock et al., 2015), mais l’ont suggéré de manière indirecte à la vue des résultats (Singh et al., 2010 ; Mcart et al., 2014). La voie de transmission de pathogènes qui est suggérée et décrite est la voie orale-fécale. Les fèces contaminées par le trypanosome parasite, Crithidia bombi (Lipa & Triggiani 1980) sont déposées au niveau des ressources florales (pollen, nectar). Le pathogène peut ensuite se transmettre au niveau intra- ou interspécifique des individus du genre Bombus par l’ingestion de nectar et de pollen contaminé (Durrer & Schmid-Hempel, 1994).
40Jusqu’à présent, les moyens de transmission horizontale de V. destructor phorétiques n’étaient connus que lors d’événements d’essaimage, de pillage, de vol ou encore de dérive d’individus d’une colonie voisine (Rosenkranz et al., 2010). Une étude récente décrit le rôle essentiel des fleurs concernant la facilité des individus V. destructor phorétiques à se déplacer d’une abeille mellifère à une autre (Peck et al., 2016). Comme l’abeille domestique, les espèces de bourdons sont également associées à des ectoparasites. En l’occurrence, Locustacarus buchneri (Stammer 1951), un acarien infectant les trachées respiratoires de différentes espèces de bourdons hôtes (Yoneda et al., 2008). D’autres acariens en phase phorétique agissent en tant que vecteurs de pathogènes et offrent des possibilités de transfert sur d’autres individus de la même espèce ou non (Schwarz & Huck, 1997).
41Enfin, la transmission par le vent est une voie indirecte assez mal caractérisée (de Miranda et al., 2011). A notre connaissance, la seule information disponible concerne le « Cloudy Wing Virus » (CWV), virus responsable d’ailes opaques chez les abeilles mellifères adultes, qui serait capable de se propager entre des abeilles adultes maintenues dans des cages séparées (Carreck et al., 2010).
Facteurs favorisant la transmission des maladies
42En termes d’exposition à des pathogènes potentiels, l’importance de la densité de population présente ainsi que la prévalence de ses individus sur de grandes régions géographiques facilitent les voies de transmissions de maladies vers de nouveaux hôtes. C’est ainsi que des espèces commerciales comme A. mellifera et B. terrestris, réparties sur 4 continents et dans certaines régions à des densités de populations élevées (Graystock et al., 2016), facilitent grandement la propagation directe et indirecte de pathogènes (Chen & Huang, 2010; Wilfert et al., 2016). Le type de pathogène et la proximité phylogénétique des hôtes sont également des facteurs clés qui déterminent la gamme d’hôtes potentiels pouvant être infectés (Woolhouse et al.,2005; Longdon et al., 2011). De plus, les virus à ARN ont une grande capacité à pouvoir changer et s’adapter à de nouveaux hôtes suite à leur haut taux de mutation génétique et leur grande capacité de réplication. Par exemple, l’arrivée de V. destructor dans l’archipel d’Hawaï a changé la prévalence, la concentration et la diversité du virus des ailes déformées (DWV) des colonies de l’abeille mellifère déjà présentes. Sur certaines îles, après seulement 3 ans d’exposition au nouvel acarien parasite, les souches de virus les plus adaptées pour la transmission se sont maintenues sur l’archipel (Martin et al., 2012).
43Néanmoins, une détection d’un pathogène ne signifie pas réplication de celui-ci et donc infection chez l’individu hôte. Il est possible qu’un pathogène puisse garder une forme latente sans avoir la capacité de se répliquer. En effet, une large panoplie d’insectes a été contrôlée positive à toute une série de virus originaires de l’abeille mellifère (Ravoet et al., 2014; Dolezal et al., 2016; Schoonvaere et al., 2016) sans avoir d’impact négatif au niveau de leur santé. Même si, un pathogène porté passivement par un hôte alternatif peut rester infectieux pour son hôte d’origine ou encore d’autres hôtes potentiels (Graystock et al., 2016).
44Au niveau comportementale, la trophallaxie, l’épouillage de congénères, l’élevage du couvain sont autant de caractéristiques sociales qui peuvent favoriser les échanges de pathogènes en augmentant les interactions entre individus par rapport à un mode de vie solitaire (Cremer et al., 2007).
45Aussi, la morphologie et l’écologie florale auraient également une large influence dans les transferts de pathogènes. L’architecture des fleurs influe sur la probabilité de dépôt et de transmission de fèces infectées. Des composés antimicrobiens, l’écologie chimique florale ou l’exposition aux ultraviolets jouent également un rôle dans l’établissement et la transmission d’un pathogène vers un nouvel individu hôte (Fouks & Lattorf, 2011; Mcart et al., 2014; Koch et al., 2017). Par exemple, la complexité architecturale des fleurs peut réduire les taux de transmission entre C. bombi et B. terrestris (Durrer & Schmid-Hempel, 1994).
46Sans surprises, la globalisation de l’industrie de la pollinisation a grandement ouvert les portes et offert des opportunités biologiques et géographiques à toute une série de pathogènes et de maladies de se propager et se transmettre à de nouveaux hôtes. Les méthodes intensives d’élevage d’espèces commerciales (principalement A. mellifera et B. terrestris) favorisent l’infection et l’exposition à de nouveaux pathogènes. Le pollen, source de protéines et de vitamines, collecté à partir de colonies d’abeilles mellifères peut être contaminé par une série de virus (Singh et al., 2010). Ainsi, l’ approvisionnement en pollen représente un risque sanitaire majeur à destination de l’élevage d’espèces commerciales (Graystock et al., 2016).
47La défense immunitaire face aux pathogènes nécessite un coût élevé pour l’organisme (Moret & Schmid-Hempel, 2000). Les pressions environnementales, telles que des sources de pollen et de nectar manquantes ou encore le contact avec des pesticides, affaiblissent drastiquement les défenses immunitaires des organismes (Goulson & Hughes, 2015; Simon-Delso et al., 2015; Collison et al., 2016; Annoscia et al., 2017). Les seuils d’émergence des pathogènes étant diminués, les pollinisateurs sont dès lors plus facilement touchés par les infections potentielles (Vanbergen, 2013).
Impact de la globalisation des échanges commerciaux
48L’évolution de la croissance démographique humaine, du système de consommation, de la globalisation des échanges commerciaux et d’une régulation environnementale moins rigoureuse agissent en toile de fond comme facteurs indirects du déclin des pollinisateurs et donc de l’appauvrissement du service de pollinisation rendu (Watson, 2014).
49L’agriculture est en train de s’étendre et de s’intensifier afin de concilier l’offre alimentaire et énergétique avec la croissance démographique (Tilman et al., 2011). De plus, les décisions politiques jouent un rôle direct dans l’occupation des sols et des pratiques agricoles. Ces décisions sont susceptibles d’influencer considérablement la composition et la configuration du paysage. La consolidation de sociétés agro-chimiques (celles qui produisent les semences, engrais et pesticides) est considérée comme une des problématiques les plus importantes des années à venir. Ces industries possèdent le contrôle de l’accès à la terre et de la gestion des pratiques agricoles (Howard, 2009; Brown et al., 2016). En effet, ces sociétés favorisent les systèmes agricoles générant des produits homogènes et couvrant des surfaces de plus en plus importantes. Cette tendance progresse particulièrement dans les pays en voie de développement grâce à de nouveaux accords économiques transnationaux. L’expansion du maïs et du soja sur de larges régions aux USA et au Brésil, l’huile de palme en Afrique de l’Ouest et en Asie du Sud-Est illustrent parfaitement cette tendance (Meade et al., 2016; Pirker et al., 2016).
50Le commerce international est lui-aussi un acteur fondamental dans les changements de l’occupation du sol de milieux naturels ou semi-naturels vers une agriculture intensive et industrialisée. Il participe fortement à l’introduction de nouvelles espèces pollinisatrices offrant ainsi la possibilité à une multitude d’agents pathogènes de pouvoir changer d’hôte (Goka et al., 2001; Manley et al., 2015; Graystock et al., 2016). De plus, actuellement, il n’existe pas de régulation homogène des pesticides au niveau international. La plupart des pays diffèrent dans leur réglementation des pratiques de gestion des ravageurs. Cela implique des retombées néfastes au niveau des processus écologiques (Waterfield & Zilberman, 2012). Des pesticides interdits dans les pays développés de l’Amérique du Nord ou d’Europe sont vendus et exportés dans les pays en développement. Ils sont essentiellement utilisés sur des cultures d’exportations (mangue, ananas, patate douce…) et reviennent dans les pays développés sous forme de résidus dans les produits alimentaires importés (Galt, 2008).
Conclusion
51La dégradation du paysage, les pesticides, les changements climatiques, les espèces invasives et la transmission des maladies interagissent de manière complexe à travers différentes échelles temporelles et spatiales. Ils affectent les pollinisateurs tout au long de leur cycle et aucun type de milieu ne semble être épargné dans le monde. Ce constat prouve à quel point il est crucial de maintenir une diversité et une abondance de pollinisateurs : d’une part pour garantir la pérennité de nos écosystèmes naturels et de notre agriculture ; d’autre part, pour assurer notre sécurité alimentaire et notre bien-être au quotidien (Potts et al., 2016).
52Bien que des initiatives de recherches et des réseaux de connaissances, par exemple les projets BELBEES(www.belbees.be), STEP(www.step-project.net) et BWARS (www.bwars.com) aient éclairci une partie de la problématique, beaucoup d’inconnues demeurent. Ainsi, renforcer les connaissances à propos des liens entre les différents facteurs permettrait de proposer des mesures agro-environnementales (MAE) plus adaptées et donc anticiper d’une meilleure manière les conséquences du déclin des pollinisateurs. La présente analyse montre que le déclin mondial des pollinisateurs et de la biodiversité en général est catalysé indirectement par le contexte financier de la globalisation. Le capitalisme et le principe du libre échange ont permis de réduire des barrières tarifaires et des réglementations internationales ce qui a entre autres favorisé la production et les échanges de pesticides à travers le monde. Dès lors, la sphère économique doit être intégrée à la compréhension du déclin des pollinisateurs.
53Aussi, un lien intrinsèque subsiste entre l’introduction de pollinisateurs commerciaux dans de nouveaux milieux et l’émergence de maladies de pollinisateurs sauvages. Cette utilisation accrue de pollinisateurs domestiqués a créé de nouvelles opportunités pour toute une série d’agents pathogènes de transiter vers de nouveaux hôtes. Au final, la transmission des maladies joue un réel rôle dans le déclin des pollinisateurs et, avec l’émergence des nouvelles techniques de séquençage à haut débit, nous sommes encore en train d’en appréhender son potentiel, notamment sur l’écologie des communautés hôtes-pathogènes. Ainsi, une meilleure connaissance de la diversité, de la dynamique des cycles et des modes de transmission de nouveaux pathogènes permettrait de mieux caractériser des méthodes et des instruments de lutte sanitaire afin de diminuer les seuils d’émergence.
Remerciements
54Ce texte a été présenté lors de la 12ème Journée Entomologique (22/10/2016) intitulée « De la Passion à la Science ». Les auteurs tiennent également à remercier Catherine Wuillaume, Clara Amy, Clément Martin pour leurs informations et leurs relectures avisées.
Bibliographie
Ahrné K., Bengtsson J. & Elmqvist T., 2009. Bumble Bees (Bombus spp) along a Gradient of Increasing Urbanization. PLoS One, 4(5) : e5574.
Aizen M.A., Morales C.L. & Morales J.M., 2008. Invasive mutualists erode native pollination webs. PLoS Biology, 6(2) : e31, 396–403.
Aizen M.A., Garibaldi L.A., Cunningham S.A. & Klein A.M., 2009. How much does agriculture depend on pollinators? Lessons from long-term trends in crop production. Annals of Botany, 103(9), 1579–1588.
Aizen M.A. & Harder L.D., 2009a. The Global Stock of Domesticated Honey Bees Is Growing Slower Than Agricultural Demand for Pollination. Current Biology,19(11), 915–918.
Aizen M.A. & Harder L.D., 2009b. Geographic variation in the growth of domesticated honey bee stocks. Communicative & Integrative Biology,2(6), 464–466.
Aliferis K.A., Copley T. & Jabaji S., 2012. Gas chromatography-mass spectrometry metabolite profiling of worker honey bee (Apis mellifera L.) hemolymph for the study of Nosema ceranae infection. Journal of Insect Physiology,58(10), 1349–1359.
Allen-Wardell G. et al., 1998. The potential consequences of pollinator declines on the conservation of biodiversity and stability of food crop yields. Conservation Biology,12(1), 8–17.
Anderson D.L. & Trueman J.W.H., 2000. Varroa jacobsoni (Acari: Varroidae) is more than one species. Experimental and Applied Acarology,24(3), 165–189.
Annoscia D. et al., 2017. Elucidating the mechanisms underlying the beneficial health effects of dietary pollen on honey bees (Apis mellifera) infested by Varroa mite ectoparasites. Scientific Reports,7(6258), 1–13.
Antúnez K. et al., 2009. Immune suppression in the honey bee (Apis mellifera) following infection by Nosema ceranae (Microsporidia). Environmental Microbiology,11(9), 2284–2290.
Arbetman M.P. et al., 2013. Alien parasite hitchhikes to Patagonia on invasive bumblebee. Biological Invasions,15(3), 489–494.
Bailes E.J. et al., 2018. First detection of bee viruses in hoverfly (syrphid) pollinators. Biology Letters,14(20180001), 4–7.
Bailey L. & Ball B.V., 1991. Honey Bee Pathology, Academic Press London UK, 193 p.
Bailey L., Ball B.V. & Perry J.N., 1983. Honey bee paralysis: its natural spread and its diminished incidence in England and Wales. Journal of Apicultural Research,22, 191–195.
Bascompte J., Jordano P., Melián C.J. & Olesen J.M., 2003. The nested assembly of plant-animal mutualistic networks. Proceedings of the National Academy of Sciences of the United States of America,100(16), 9383–9387.
Bass C., Denholm I., Williamson M.S. & Nauen R., 2015. The global status of insect resistance to neonicotinoid insecticides. Pesticide Biochemistry and Physiology,121, 78–87.
Benaets K. et al., 2017. Covert deformed wing virus infections have long-term deleterious effects on honeybee foraging and survival. Proceedings of the Royal Society B,284(1848), 20162149.
Biesmeijer J.C. et al., 2006. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science,313, 351–354.
Blacquière T., Smagghe G., Van Gestel C.A.M. & Mommaerts V., 2012. Neonicotinoids in bees: A review on concentrations, side-effects and risk assessment. Ecotoxicology,21(4), 973–992.
Bommarco R., Lundin O., Smith H.G. & Rundlöf M., 2011. Drastic historic shifts in bumble-bee community composition in Sweden. Proceedings of the Royal Society B,279, 309–315.
Branquart E. & Hemptinne J.L., 2000. Selectivity in the exploitation of floral resources by hoverflies (Diptera : Syrphinae). Ecography,23(6), 732–742.
Brown M.J.F. et al., 2016. A horizon scan of future threats and opportunities for pollinators and pollination. PeerJ,4, e2249.
Brown M.J.F., 2017. Microsporidia : An Emerging Threat to Bumblebees ? Trends Parasitology,33(10), 754-762.
Brown M.J.F.F. & Paxton R.J., 2009. The conservation of bees : a global perspective. Apidologie,40, 410–416.
Brutscher L.M., Daughenbaugh K.F. & Flenniken M.L., 2015. Antiviral defense mechanisms in honey bees. Current Opinion in Insect Sciences,10, 71–82.
Cameron S.A. et al., 2011. Patterns of widespread decline in North American bumble bees. Proceedings of the National Academy of Sciences of the United States of America,108(2), 662–667.
Cardinale B.J. et al., 2012. Biodiversity loss and its impact on humanity. Nature,489(7415), 326–326.
Carreck N.L., Ball B. V & Martin S.J., 2010. The epidemiology of cloudy wing virus infections in honey bee colonies in the UK. Journal of Apicultural Research,49(1), 66–71.
Carvalheiro L.G. et al., 2013. Species richness declines and biotic homogenisation have slowed down for NW-European pollinators and plants. Ecology Letters,16(7), 870–878.
Chapman N.C., Beekman M. & Oldroyd B.P., 2010. Worker reproductive parasitism and drift in the western honeybee Apis mellifera. Behavioral Ecology and Sociobiology,64, 419–427.
Chen Y.P. & Huang Z.Y., 2010. Nosema ceranae, a newly identified pathogen of Apis mellifera in the USA and Asia. Apidologie, 41, 364–374.
Chen Y.P., Pettis J.S., Collins A. & Feldlaufer M.F., 2006. Prevalence and Transmission of Honeybee Viruses. Applied Environmental Microbiology, 72(1), 606–611.
Colla S.R., Otterstatter M.C., Gegear R.J. & Thomson J.D., 2006. Plight of the bumble bee: Pathogen spillover from commercial to wild populations. Biological Conservation,129(4), 461–467.
Collison E., Hird H., Cresswell J. & Tyler C., 2016. Interactive effects of pesticide exposure and pathogen infection on bee health -- a critical analysis. Biological Reviews,91, 1006–1019.
Core A. et al., 2012. A new threat to honey bees, the parasitic phorid fly Apocephalus borealis. PLoS One,7(1) : e29639, 1–9.
Cornman R.S. et al., 2012. Pathogen webs in collapsing honey bee colonies. PLoS One,7(8) : e43562.
Cox-foster D.L. et al., 2007. A Metagenomic Survey of Collapse Disorder. Science,318, 283–287.
Cremer S., Armitage S.A.O. & Schmid-Hempel P., 2007. Social Immunity. Current Biology,17, 693–702.
Danforth B.N. et al., 2013. The Impact of Molecular Data on Our Understanding of Bee Phylogeny and Evolution. Annual Review of Entomolgy,58, 57–78.
Daszak P., Cunningham A.A. & Hyatt A.D., 2000. Emerging Infectious Diseases of Wildlife — Threats to Biodiversity and Human Health. Science,287, 443–450.
de Miranda J.R. & Fries I., 2008. Venereal and vertical transmission of deformed wing virus in honeybees (Apis mellifera L .). Journal of Invertebrate Pathology,98, 184–189.
de Miranda J.R., Chen Y., Ribière M. & Gauthier L., 2011. Varroa and viruses. In: Carreck N.L. ed. Varroa: Still a Problem in the 21st Century ? The International Bee Research Association (IBRA), 11–33.
Deguines N. et al., 2014. Large-scale trade-off between agricultural intensification and crop pollination services. Frontiers in Ecology and the Environment,12(4), 212–217.
Diekotter T. et al., 2014. Mass-flowering crops increase richness of cavity-nesting bees and wasps in modern agro-ecosystems. GCB Bioenergy,6, 219–226.
Dolezal A.G. et al., 2016. Honey bee viruses in wild bees: Viral prevalence, loads, and experimental inoculation. PLoS One,11(11) : e0166190, 1–16.
Donaldson J.S., 2002. Pollination in Agricultural Landscapes, a South African Perspective. In: Kevan P. & Imperatriz Fonseca V.L. (eds). Pollinating Bees - The Conservation Link Between Agriculture and Nature - Ministry of Environment / Brasília. 97-104.
Doublet V. et al., 2017. Unity in defence: honeybee workers exhibit conserved molecular responses to diverse pathogens. BMC Genomics,18(207), 1–17.
Durrer S. & Schmid-Hempel P., 1994. Shared Use of Flowers Leads to Horizontal Pathogen Transmission. Proceedings of the Royal Society B,258(1353), 299–302.
Evans J.D. & Spivak M., 2010. Socialized medicine: Individual and communal disease barriers in honey bees. Journal of Invertebrate Pathology,103, 62–72.
Evison S.E.F. et al., 2012. Pervasiveness of parasites in pollinators. PLoS One,7(1) : e30641.
Fahrig L. et al., 2011. Functional landscape heterogeneity and animal biodiversity in agricultural landscapes. Ecology Letters,14(2), 101–112.
Fairbrother A., Purdy J., Anderson T. & Fell R., 2014. Risks of Neonicotinoid Insecticides to Honeybees. Environmental Toxicology and Chemistry,33(4), 719–731.
Falk S., 2015. Field Guide to the Bees of Great Britain and Ireland, Bloomsbury Publishing, London, 432.
Farré-Armengol G. et al., 2014. Changes in floral bouquets from compound-specific responses to increasing temperatures. Global Change Biology,20, 3660–3669.
Fauser A., Sandrock C., Neumann P. & Sadd B.M., 2017. Neonicotinoids override a parasite exposure impact on hibernation success of a key bumblebee pollinator. Ecological Entomology,42(3), 306–314.
Fievet J. et al., 2006. Localization of deformed wing virus infection in queen and drone Apis mellifera L. Virology Journal,3(16), 1–5.
Fischer J. et al., 2014. Neonicotinoids interfere with specific components of navigation in honeybees. PLoS One,9(3) : e91364, 1–10.
Fontaine C. et al., 2011. The ecological and evolutionary implications of merging different types of networks. Ecology Letters,14(11), 1170–1181.
Forister M.L. et al., 2010. Compounded effects of climate change and habitat alteration shift patterns of butterfly diversity. Proceedings of the National Academy of Sciences of the United States of America,107(5), 2088–2092.
Fornoff F. et al., 2017. Functional flower traits and their diversity drive pollinator visitation. Oikos,126, 1020–1030.
Fortel L. et al., 2014. Decreasing abundance, increasing diversity and changing structure of the wild bee community (Hymenoptera: Anthophila) along an urbanization gradient. PLoS One,9(8) : e104679.
Fortel L. et al., 2016. Use of human-made nesting structures by wild bees in an urban environment. Journal of Insect Conservation,20(2), 239–253.
Forup M.L. & Memmott J., 2005. The relationship between the abundance of bumblebees and honeybees in a native habitat. Ecological Entomology,30(1), 47–57.
Fouks B. & Lattorf H.M.G., 2011. Recognition and Avoidance of Contaminated Flowers by Foraging Bumbelbees (Bombus terrestris). PLoS One,6(10), e26328.
Freitas B.M. et al., 2009. Diversity, threats and conservation of native bees in the Neotropics. Apidologie,40(3), 332–346.
Fries I. et al., 1996. Nosema ceranae n. sp. (Microspora, Nosematidae), morphological and molecular characterization of a microsporidian parasite of the Asian honey bee Apis cerana (Hymenoptera, Apidae). European Journal of Protistology,32(3), 356–365.
Fries I. et al., 2006. Natural infections of Nosema ceranae in European honey bees. Journal of Apicultural Research,47(3), 230–233.
Fürst M.A. et al., 2014. Disease associations between honeybees and bumblebees as a threat to wild pollinators. Nature,506(7488), 364–366.
Galindo-Cardonaa A. et al., 2012. Landscape analysis of drone congregation areas of the honey bee , Apis mellifera. Journal of Insect Science,12, 1–15.
Gallai N., Salles J.M., Settele J. & Vaissière B.E., 2009. Economic valuation of the vulnerability of world agriculture confronted with pollinator decline. Ecological Economics,68(3), 810–821.
Galt R.E., 2008. Beyond the circle of poison: Significant shifts in the global pesticide complex, 1976-2008. Global Environmental Change,18(4), 786–799.
Garibaldi L.A. et al., 2013. Wild Pollinators Enhance Fruit Set of Crops Regardless of Honey Bee Abundance. Science,339, 1608–1611.
Garibaldi L.A. et al., 2016. Mutually beneficial pollinator diversity and crop yield outcomes in small and large farms. Science,351(6271).
Gauthier L. et al., 2011. Viruses Associated with Ovarian Degeneration in Apis mellifera L . Queens. PLoS One,6(1) : e16217.
Genersch E., 2010. Honey bee pathology: Current threats to honey bees and beekeeping. Applied Microbiology and Biotechnology,87(1), 87–97.
Genersch E., Yue C., Fries I. & De Miranda J.R., 2006. Detection of Deformed wing virus, a honey bee viral pathogen, in bumble bees (Bombus terrestris and Bombus pascuorum) with wing deformities. Journal of Invertebrate Pathology,91(1), 61–63.
Geslin B. et al., 2016. The proportion of impervious surfaces at the landscape scale structures wild bee assemblages in a densely populated region. Ecology & Evolution,6, 6599–6615.
Geslin B. et al., 2017. Massively Introduced Managed Species and Their Consequences for Plant–Pollinator Interactions. Advances in Ecological Research,57, 1–53.
Gilbert N., 2014. “Life on Earth” project gets under way. Nature,510(7506), 455.
Gill R.J. & Raine N.E., 2014. Chronic impairment of bumblebee natural foraging behaviour induced by sublethal pesticide exposure. Functional Ecology,28(6), 1459–1471.
Gill R.J., Ramos-Rodriguez O. & Raine N.E., 2012. Combined pesticide exposure severely affects individual- and colony-level traits in bees. Nature,491(7422), 105–108.
Gisder S., Mockel N., Linde A. & Genersch E., 2011. A cell culture model for Nosema ceranae and Nosema apis allows new insights into the life cycle of these important honey bee-pathogenic microsporidia. Environmental Microbiology,13(2), 404–413.
Goka K., Okabe K., Yoneda M. & Niwa S., 2001. Bumblebee commercialization will cause worldwide migration of parasitic mites. Molecular Ecology,10, 2095–2099.
Gómez J.M., Perfectti F. & Lorite J., 2015. The role of pollinators in floral diversification in a clade of generalist flowers. Evolution,69(4), 863–878.
Goulson D., Lye G.C. & Darvill B., 2008. Decline and Conservation of Bumble Bees. Annual Review of Entomolgy,53, 191–208.
Goulson D. & Hughes W.O.H., 2015. Mitigating the anthropogenic spread of bee parasites to protect wild pollinators. Biological Conservation, 191, 10–19
Goulson D., Nicholls E., Botías C. & Rotheray E.L., 2015. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science,347(6229).
Graystock P. et al., 2013. Emerging dangers: Deadly effects of an emergent parasite in a new pollinator host. Journal of Invertebrate Pathology,114(2), 114–119.
Graystock P., Goulson D. & Hughes W.O.H., 2015. Parasites in bloom: flowers aid dispersal and transmission of pollinator parasites within and between bee species. Proceedings of the Royal Society B,282, 20151371.
Graystock P. et al., 2016. Do managed bees drive parasite spread and emergence in wild bees? International Journal for Parasitology: Parasites and Wildlife,5(1), 64–75.
Griffin J.N. et al., 2009. Functional diversity predicts overyielding effect of species combination on primary productivity. Oikos,118(1), 37–44.
Hall D.M. et al., 2017. The city as a refuge for insect pollinators. Conservation Biology,31(1), 24–29.
Harder L.D. & Johnson S.D., 2009. Darwin’s beautiful contrivances: Evolutionary and functional evidence for floral adaptation. New Phytologist, 183(3), 530–545.
Haubruge E. et al., 2006. Le dépérissement de l’abeille domestique, Apis mellifera L ., 1758 (Hymenoptera : Apidae) : faits et causes probables. Notes fauniques de Gembloux,59(1), 3–21.
Hegland S.J. et al., 2009. How does climate warming affect plant-pollinator interactions? Ecology Letters,12(2), 184–195.
Heimbach F. et al., 2017. The Challenge: Assessment of risks posed by systemic insecticides to hymenopteran pollinators: New perception when we move from laboratory via (semi-)field to landscape scale testing? Environmental Toxicology and Chemistry,36(1), 17–24.
Henry M. et al., 2012. A Common Pesticides Decreases Foraging Success and Survival in Honey Bees. Science,336(6079), 348–350.
Higes M. et al., 2008. How natural infection by Nosema ceranae causes honeybee colony collapse. Environmental Microbiology,10(10), 2659–2669.
Higes M. et al., 2009. The presence of Nosema ceranae (Microsporidia) in North African honey bees (Apis mellifera intermissa). Journal of Apicultural Research,48(3), 217–219.
Higes M., García-Palencia P., Martín-Hernández R. & Meana A., 2007. Experimental infection of Apis mellifera honeybees with Nosema ceranae (Microsporidia). Journal of Invertebrate Pathology,94(3), 211–217.
Higes M., Martín-Hernández R. & Meana A., 2010. Nosema ceranae in Europe: an emergent type C nosemosis. Apidologie, 41(3), 375–392.
Holzschuh A. et al., 2016. Mass-flowering crops dilute pollinator abundance in agricultural landscapes across Europe. Ecology Letters,19(10), 1228–1236.
Holzschuh A., Dormann C.F., Tscharntke T. & Steffan-Dewenter I., 2011. Expansion of mass-flowering crops leads to transient pollinator dilution and reduced wild plant pollination. Proceedings of the Royal Society B,278(1723), 3444–3451.
Hoover S.E.R. et al., 2012. Warming, CO 2, and nitrogen deposition interactively affect a plant-pollinator mutualism. Ecology Letters,15(3), 227–234.
Howard P.H., 2009. Visualizing Consolidation in the Global Seed Industry: 1996-2008. Sustainability,1(4), 1266–1287.
Huang W.-F., Jiang J.-H., Chen Y.-W. & Wang C.-H., 2007. A Nosema ceranae isolate from the honeybee Apis mellifera. Apidologie,38(1), 30–37.
Jacquemin F., Violle C., Rasmont P. & Dufrêne M., 2017. Mapping the dependency of crops on pollinators in Belgium. One Ecosysteme 2,: e13738.
Kearns C.A., Inouye D.W. & Waser N.M., 1998. Endangered Mutualisms: The Conservation of Plant-Pollinator Interactions. Annual Review of Ecology and Systematics,29, 83–112.
Keeling P., 2009. Five questions about microsporidia. PLoS Pathogens,5(9) : e1000489, 1–3.
Keil P. et al., 2011. Biodiversity change is scale-dependent: An example from Dutch and UK hoverflies (Diptera, Syrphidae). Ecography,34(3), 392–401.
Kennedy C.M. et al., 2013. A global quantitative synthesis of local and landscape effects on wild bee pollinators in agroecosystems. Ecology Letters,16(5), 584–599.
Kerr J.T. et al., 2015. Climate change impacts on bumblebees converge across continents. Science,349(6244), 177–180.
Klee J. et al., 2007. Widespread dispersal of the microsporidian Nosema ceranae, an emergent pathogen of the western honey bee, Apis mellifera. Journal of Invertebrate Pathology,96(1), 1–10.
Klein A.-M. et al., 2007. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B,274, 303–3013.
Koch H., Brown M.J.F. & Stevenson P.C., 2017. The role of disease in bee foraging ecology. Current Opinion in Insect Sciences,21, 60–67.
Kovács-Hostyánszki A. et al., 2013. Contrasting effects of mass-flowering crops on bee pollination of hedge plants at different spatial and temporal scales. Ecological Applications,23(8), 1938–1946.
Kovács-Hostyánszki A. et al., 2017. Ecological intensification to mitigate impacts of conventional intensive land use on pollinators and pollination. Ecology Letters,20(5), 673-689.
Kremen C. et al., 2007. Pollination and other ecosystem services produced by mobile organisms: A conceptual framework for the effects of land-use change. Ecology Letters,10(4), 299–314.
Kunz T.H. et al., 2011. Ecosystem services provided by bats. Annals of the New York Academy of Sciences,1223(1), 1–38.
Lambdon P.W. et al., 2008. Alien flora of Europe: Species diversity, temporal trends, geographical patterns and research needs. Preslia,80(2), 101–149.
Le Féon V. et al., 2013. Solitary bee abundance and species richness in dynamic agricultural landscapes. Agriculture, Ecosystems and Environment, 166, 94–101.
Lhomme P., 2009. L’inquilinisme chez les bourdons. Osmia, 3, 17–22.
Lhomme P. et al., 2012. Born in an Alien Nest : How Do Social Parasite Male Offspring Escape from Host Aggression ? PLoS One,7(9) : e43053, 28–30.
Lindström S.A.M. et al., 2016. Experimental evidence that honeybees depress wild insect densities in a flowering crop. Proceedings of the Royal Society B,283: 20161641..
Longdon B. et al., 2011. Host Phylogeny Determines Viral Persistence and Replication in Novel Hosts. PLoS Pathogens,7(9) : e1002260.
Mallinger R.E., Gaines-day H.R. & Gratton C., 2017. Do managed bees have negative effects on wild bees ? A systematic review of the literature. PLoS One,12(12), 1–32.
Manley R., Boots M. & Wilfert L., 2015. Emerging viral disease risk to pollinating insects: Ecological, evolutionary and anthropogenic factors. Journal of Applied Ecology,52(2), 331–340.
Martin S.J. et al., 2012. Global Honey Bee Viral Landscape Altered by a Parasitic Mite. Science,336(1304).
Mayack C. & Naug D., 2009. Energetic stress in the honeybee Apis mellifera from Nosema ceranae infection. Journal of Invertebrate Pathology,100(3), 185–188.
Mcart S.H., Koch H., Irwin R.E. & Adler L.S., 2014. Arranging the bouquet of disease: Floral traits and the transmission of plant and animal pathogens. Ecology Letters,17(5), 624–636.
Mcmahon D.P. et al., 2015. A sting in the spit: Widespread cross-infection of multiple RNA viruses across wild and managed bees. Journal of Animal Ecology,84(3), 615–624.
McMenamin A.J. & Genersch E., 2015. Honey bee colony losses and associated viruses. Current Opinion in Insect Sciences,8, 121–129.
Meade B. et al., 2016. Corn and Soybean Production Costs and Export Competitiveness in Argentina , Brazil , and the United States. EIB-154, U.S. Department of Agriculture, Economic Research Service, 1-46
Memmott J., Waser N.M. & Price M. V, 2004. Tolerance of pollination networks to species extinctions. Proceedings of the Royal Society B,271(1557), 2605–2611.
Mevi-Schutz J. & Erhardt A., 2005. Amino acids in nectar enhance butterfly fecundity: a long-awaited link. The American Naturalist, 165(4), 411–419.
Michener C.D., 2007. The Bees of the World, The Johns Hopkins University Press, Baltimore, Maryland 21218-4363, 2406.
Möckel N., Gisder S. & Genersch E., 2011. Horizontal transmission of deformed wing virus: Pathological consequences in adult bees (Apis mellifera) depend on the transmission route. Journal of General Virology,92(2), 370–377.
Morandin L.A. & Kremen C., 2013. Hedgerow restoration promotes pollinator populations and exports native bees to adjacent fields. Ecological Applications,23(4), 829–839.
Moret Y. & Schmid-hempel P., 2000. Survival for Immunity : The Price of Immune System Activation for Bumblebee Workers. Science,290, 1166–1169.
Moritz R.F.A., Härtel S. & Neumann P., 2005. Global invasions of the western honeybee (Apis mellifera) and the consequences for the biodiversity. Ecoscience,12(3), 289–301.
Naeem S., Duffy J.E. & Zavaleta E., 2012. The Functions of Biological Diversity in an Age of Extinction. Science,336(6087), 1401–1406.
Naug D. & Gibbs A., 2009. Behavioral changes mediated by hunger in honeybees infected with Nosema ceranae. Apidologie,40(6), 595–599.
Navajas M.J., 2010. Tracking the colonisation history of the invasive species Varroa destructor. Trends in Acarology: Proceedings of the 12th International Congress, 375–378.
Nieto A. et al., 2014. European Red List of Bees. Luxembourg: Publication Office of the European Union, 98.
O’ Connor S., Park K.J. & Goulson D., 2013. Worker drift and egg dumping by queens in wild Bombus terrestris colonies Worker drift and egg dumping by queens in wild Bombus terrestris colonies. Behavioral Ecology and Sociobiology,67, 621–627.
Oldroyd B.P. & Wongsiri S., 2006. Asian Honey Bees: Biology, Conservation, and Human Interactions, Harvard University Press.
Oliver T.H. et al., 2015. Interacting effects of climate change and habitat fragmentation on drought-sensitive butterflies. Nature Climate Change,5, 941–945.
Ollerton J., Winfree R. & Tarrant S., 2011. How many flowering plants are pollinated by animals? Oikos,120(3), 321–326.
Parachnowitsch A.L. & Manson J.S., 2015. The chemical ecology of plant-pollinator interactions: Recent advances and future directions. Current Opinion in Insect Sciences,8, 41–46.
Parmesan C., 2007. Influences of species, latitudes and methodologies on estimates of phenological response to global warming. Global Change Biology,13(9), 1860–1872.
Paxton R.J., Klee J., Korpela S. & Fries I., 2007. Nosema ceranae has infected Apis mellifera in Europe since at least 1998 and may be more virulent than Nosema apis. Apidologie,38(6), 558–565.
Peck D.T., Smith M.L. & Seeley T.D., 2016. Varroa destructor Mites Can Nimbly Climb from Flowers onto Foraging Honey Bees. PLoS One,11(12) : e0167798.
Pereira H.M. et al., 2010. Scenarios for global biodiversity in the 21st century. Science,330(6010), 1496–1501.
Petanidou T. et al., 2008. Long-term observation of a pollination network: Fluctuation in species and interactions, relative invariance of network structure and implications for estimates of specialization. Ecology Letters,11(6), 564–575.
Pimentel D. et al., 1997. Economic and Environmental Benefits of Biodiversity. Bioscience,47(11), 747–757.
Pirker J. et al., 2016. What are the limits to oil palm expansion ? Global Environmental Change,40, 73–81.
Pitts-Singer T.L., 2008. Past and present management of alfalfa bees. In: Press. New York: Oxford Univ. ed. Bee Pollination in Agricultural Ecosystems. 105–123.
Pitts-Singer T.L. & Cane J.H., 2011. The Alfalfa Leafcutting Bee, Megachile rotundata: The World’s Most Intensively Managed Solitary Bee. Annual Review of Entomolgy,56, 221–237.
Potts S.G. et al., 2003. Linking Bees and Flowers: How Do Floral Communities Structure Pollinator Communities? Ecology,84(10), 2628–2642.
Potts S.G. et al., 2005. Role of nesting resources in organising diverse bee communities in a Mediterranean landscape. Ecological Entomology,30, 78–85.
Potts S.G. et al., 2006. Plant-pollinator biodiversity and pollination services in a complex Mediterranean landscape. Biological Conservation,129(4), 519–529.
Potts S.G. et al., 2010a. Declines of managed honey bees and beekeepers in Europe. Journal of Apicultural Research,49(1), 15–22.
Potts S.G. et al., 2010b. Global pollinator declines: Trends, impacts and drivers. Trends Ecology & Evolution,25(6), 345–353.
Potts S. et al., 2015. Status and Trends of European Pollinators, Pensoft Publishers, 72 p.
Potts S.G. et al., 2016. Safeguarding pollinators and their values to human well-being. Nature,540(7632), 220–229.
Pyšek P. et al., 2012. A global assessment of invasive plant impacts on resident species, communities and ecosystems: The interaction of impact measures, invading species’ traits and environment. Global Change Biology,18(5), 1725–1737.
Rader R. et al., 2015. Non-bee insects are important contributors to global crop pollination. Proceedings of the National Academy of Sciences of the United States of America,113(1), 146–151.
Rasmont P., Ebmer A., Banaszak J. & Van der Zanden G., 1995. Hymenoptera Apoidea Gallica. Liste Taxonomique des abeilles de France, de Belgique, de Suisse et du Grand-Duché de Luxemblourg. Société Entomologique de France,100, 1–98.
Rasmont P. & Iserbyt S., 2012. The Bumblebees Scarcity Syndrome: Are heat waves leading to local extinctions of bumblebees (Hymenoptera: Apidae: Bombus)? Annales de la Société Entomologique de France, 48(3–4), 275–280.
Rasmont P. et al., 2015. Climatic Risk and Distribution Atlas of European Bumblebees. Biorisk, 10 (Special Issue), 246 p.
Rasmont P. et al., 2017. Addition to the checklist of IUCN European wild bees (Hymenoptera: Apoidea). Annales de la Société Entomologique de France, 53(1), 17–32.
Ravoet J. et al., 2014. Widespread occurrence of honey bee pathogens in solitary bees. Journal of Invertebrate Pathology,122, 55–58.
Roberts S.P.M. et al., 2011. Assessing continental-scale risks for generalist and specialist pollinating bee species under climate change. BioRisk,6(1), 1–18.
Rosenkranz P., Aumeier P. & Ziegelmann B., 2010. Biology and control of Varroa destructor. Journal of Invertebrate Pathology,103, S96–S119.
Rundlöf M. et al., 2015. Seed coating with a neonicotinoid insecticide negatively affects wild bees. Nature,521, 77–80.
Sauquet H. et al., 2017. The ancestral flower of angiosperms and its early diversification ´. Nature Communications,8:16047, 10.
Schoonvaere K. et al., 2016. Unbiased RNA Shotgun Metagenomics in Social and Solitary Wild Bees Detects Associations with Eukaryote Parasites and New Viruses. PLoS One,11(12) : e0168456, 1–18.
Schwarz H.H. & Huck K., 1997. Phoretic mites use flowers to transfer between foraging bumblebees. Insectes Sociaux, 44, 303–310.
Schwarz R.S., Huang Q. & Evans J.D., 2015. Hologenome theory and the honey bee pathosphere. Current Opinion in Insect Sciences,10, 1–7.
Schweiger O. et al., 2010. Multiple stressors on biotic interactions: How climate change and alien species interact to affect pollination. Biological Reviews,85(4), 777–795.
Settele J. et al., 2008. Climatic Risk Atlas of European Butterflies., BioRisk, 1-712.
Settele J., Bishop J. & Potts S.G., 2016. Climate change impacts on pollination. Nature Plants, 2, 1–3.
Shen M., Cui L., Ostiguy N. & Cox-foster D., 2005. Intricate transmission routes and interactions between picorna-like viruses (Kashmir bee virus and sacbrood virus) with the honeybee host and the parasitic varroa mite. Journal of General Virology,86, 2281–2289.
Simon-Delso N. et al., 2015. Systemic insecticides (Neonicotinoids and fipronil): Trends, uses, mode of action and metabolites. Environmental Science and Pollution Research,22(1), 5–34.
Singh R. et al., 2010. RNA viruses in hymenopteran pollinators: Evidence of inter-taxa virus transmission via pollen and potential impact on non-Apis hymenopteran species. PLoS One,5(12).
Sommaggio D., 1999. Syrphidae: Can they be used as environmental bioindicators? Agriculture, Ecosystems and Environment,74, 343–356.
Sparks T.C. et al., 2013. Sulfoxaflor and the sulfoximine insecticides: Chemistry, mode of action and basis for efficacy on resistant insects. Pesticide Biochemistry and Physiology,107(1), 1–7.
Stanley D.A. et al., 2015. Neonicotinoid pesticide exposure impairs crop pollination services provided by bumblebees. Nature,528(7583), 548–550.
Stout J.C. & Morales C.L., 2009. Ecological impacts of invasive alien species on bees. Apidologie,40(3), 388–409.
Tarpy D.R., Delaney D.A. & Seeley T.D., 2015. Mating Frequencies of Honey Bee Queens (Apis mellifera L .) in a Population of Feral Colonies in the Northeastern United States. PLoS One,10(3) : e0118734, 1–12.
Tehel A., Brown M.J.F. & Paxton R.J., 2016. Impact of managed honey bee viruses on wild bees. Current Opinion in Virology,19, 16–22.
Theisen-Jones H. & Bienefeld K., 2016. The Asian Honey Bee (Apis cerana) is Significantly in Decline. Bee World,93(4), 90–97.
Thomas C.D., Franco A.M.A. & Hill J.K., 2006. Range retractions and extinction in the face of climate warming. Trends Ecology & Evolution,21(8), 415–416.
Thorp R.W., 2000. The collection of pollen by bees. Plant Systematics and Evolution,222, 211–223.
Tilman D., Balzer C., Hill J. & Befort B.L., 2011. Global food demand and the sustainable intensification of agriculture. Proceedings of the National Academy of Sciences of the United States of America,108(50), 20260–20264.
Traveset A. & Richardson D.M., 2006. Biological invasions as disruptors of plant reproductive mutualisms. Trends Ecology & Evolution,21(4), 208–216.
Traveset A. & Richardson D.M., 2014. Mutualistic Interactions and Biological Invasions. Annual Review of Ecology, Evolution, and Systematics,45(1), 89–113.
Vaissiere B., Morison N. & Carre G., 2005. Abeilles , pollinisation et biodiversité. Abeilles Cie, 3(106), 10–14.
Vanbergen A.J., 2013. Threats to an ecosystem service: Pressures on pollinators. Frontiers in Ecology and the Environment11(5), 251–259.
vanEngelsdorp D. et al., 2009. Colony collapse disorder: A descriptive study. PLoS One,4(8) : e6481.
vanEngelsdorp D. & Meixner M.D., 2010. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. Journal of Invertebrate Pathology,103, 80–95.
Velthuis H.H.W. & Doorn A. Van, 2006. A century of advances in bumblebee domestication and the economic and environmental aspects of its commercialization for pollination. Apidologie 37, 421–451.
Vereecken N.J., Dufrêne E. & Aubert M., 2015. Rapport de synthèse sur les risques liés à l’introduction de ruches de l’abeille domestique (Apis mellifera) vis-à-vis des abeilles sauvages et de la flore. Observatoire des Abeilles, 1–29.
Vereecken N.J., 2017. DÉCOUVRIR & PROTÉGER NOS ABEILLES SAUVAGES. Editions Glénat, 1–192.
Walther-Hellwig K. et al., 2006. Increased density of honeybee colonies affects foraging bumblebees. Apidologie,37, 517–532.
Warren M.S. et al., 2001. Rapid responses of British butterflies to opposing forces of climate and habitat change. Nature,414, 65–69.
Waterfield G. & Zilberman D., 2012. Pest Management in Food Systems : An Economic Perspective. Annual Review of Environmental Resources, 37, 223–247.
Watson J.E.M., 2014. Human responses to climate change will seriously impact biodiversity conservation: It’s time we start planning for them. Conservation Letters,7(1), 1–2.
Westphal C. et al., 2008. Measuring Bee Diversity in Different European Habitats and Biogeographical Regions. Ecological Monographs,4, 653–671.
Whitehorn P.R., O’Connor S., Wackers F.L. & Goulson D., 2012. Neonicotinoid Pesticide Reduces Bumble Bee Colony Growth and Queen Production. Science,336(6079), 351–352.
Wiens J.A., 2002. Central concepts and issues of landscape ecology. In: Gutzwiller K. ed. Applying Landscape Ecology in Biological Conservation. Springer, 3–21.
Wilfert L. et al., 2016. Deformed wing virus is a recent global epidemic in honeybees driven by Varroa mites. Science,351(6273), 594–597.
Wolowski M., Saad C.F., Ashman T.L. & Freitas L., 2013. Predominance of self-compatibility in hummingbird-pollinated plants in the Neotropics. Naturwissenschaften,100(1), 69–79.
Woodcock B.A. et al., 2016. Impacts of neonicotinoid use on long-term population changes in wild bees in England. Nature Communications,7(12459).
Woolhouse M.E.J., Haydon D.T. & Antia R., 2005. Emerging pathogens : the epidemiology and evolution of species jumps. Trends Ecology & Evolution,20(5), 238–244.
Yoneda M.Y. et al., 2008. Commercial colonies of Bombus terrestris (Hymenoptera : Apidae) are reservoirs of the tracheal mite Locustacarus buchneri (Acari : Podapolipidae). Applied Entomological Zoology,43(1), 73–76.
Yue C., Schro M., Gisder S. & Genersch E., 2007. Vertical-transmission routes for deformed wing virus of honeybees (Apis mellifera). Journal of General Virology,88, 2329–2336.
Yue C., Schröder M., Bienefeld K. & Genersch E., 2011. Detection of viral sequences in semen of honeybees (Apis mellifera): Evidence for vertical transmission of viruses through drones. Journal of Invertebrate Pathology,92(2006), 105–108.