- Startpagina tijdschrift
- Volume 71 (2018)
- Diversité et impact des insectes floricoles sur les rendements fruitier et grainier de Arachis hypogaea L. 1753 (Fabaceae) à Maroua (Extrême - Nord, Cameroun)
Weergave(s): 4044 (23 ULiège)
Download(s): 427 (7 ULiège)
Diversité et impact des insectes floricoles sur les rendements fruitier et grainier de Arachis hypogaea L. 1753 (Fabaceae) à Maroua (Extrême - Nord, Cameroun)

Nota's van de redactie
Reçu le 13 novembre 2017, accepté le 13 juillet 2018.
Résumé
D’août à octobre 2015 à Maroua (Extrême – Nord ; Cameroun), les fleurs de Arachis hypogaea L. 1753 (Fabaceae)ont été observées en vue de déterminer la richesse spécifique des insectes floricoles de cette plante, étudier leurs activités sur les fleurs et déterminer l’impact de ces insectes sur les rendements fruitier et grainier. Deux lots de 72 plants chacun ont été constitués à partir du marquage de huit sous lots différenciés par l’absence ou la présence de protection des plantes vis-à-vis des visites d’insectes. Entre 7h et 14h, les fleurs de l’arachide étaient visitées par 14 espèces d’insectes avec un pic d’activité situé entre 9h et 10h. Le principal produit floral récolté par les insectes était le pollen. Parmi les insectes floricoles de A. hypogaea, Lipotriches azarensis était le plus fréquent avec 69,23 % du nombre total de visites comptées sur les fleurs en libre pollinisation. La comparaison des rendements des différents lots a montré que les insectes anthophiles ont augmenté le taux de fructification, le pourcentage de graines normales et la masse moyenne de graines par gousse de 8,05%, 9,23% et 2,94% respectivement. Ainsi, pendant la période de floraison de l’arachide, les traitements aux pesticides chimiques sont à éviter pour pouvoir profiter du service de pollinisation assurée par les insectes floricoles.
Abstract
From August to October 2015 in Maroua (Far-Nord; Cameroon), the flowers of Arachis hypogaea L. 1753 (Fabaceae) were observed to determine the specific richness of anthophilous insects of this plant, to study their activities on flowers and evaluate their impact on the yields of fruit and seeds. Two lots of 72 plants each were formed from the marking of eight sub-lots differentiated according to the presence or absence of insect visits on plants. Between 7.00 am and 14.00 pm, the flowers of groundnut were visited by 14 insects’ species with the highest activity during the morning period, between 09.00 am and 11.00 am. Lipotriches azarensis was the most frequent species with 69.23% visits counted on the flowers in open-pollination. Comparing yields from insect visits on unprotected plants with the yield of protected plants, it appears that anthophilous insects increase the fruiting rate, the percentage of normal seeds and the average weight of seeds per pod of 8.05%, 9.23% et 2.94% respectively. Thereby, during the flowering period of Arachis hypogaea, the use of chemical pesticides should be avoided in order to protect pollinators
Inhoudstafel
INTRODUCTION
1Depuis plus d'une vingtaine d’années, les recherches sur les relations plantes – insectes pollinisateurs sont réalisées au Cameroun (Tchuenguem et al., 2014). Malgré ces travaux, les informations manquent sur les relations entre plusieurs plantes cultivées poussant au Cameroun et leurs insectes floricoles.
2L’arachide Arachis hypogaea (Fabaceae) représente 12 % de la production mondiale de graines oléagineuses (FAOSTAT, 2008). Elle est cultivée dans 120 pays environ repartis sur tous les continents (FAO, 2014). Les pays africains, possèdent les rendements à l’hectare les plus faibles avec en moyenne 1 t/ha, comparé à la Chine (2,62 t/ha), l’Inde (0,94 t/ha) et l’Amérique (3,76 t/ha) (Anonyme, 2003) et Israël (plus de 6 t/ha) (FAO, 2014) qui sont les grands producteurs. Dans la plupart des pays d’Afrique au sud du Sahara, les rendements sont inférieurs à 1 t/ha (FAO, 2014). Au Cameroun, l’arachide est cultivée presque dans toutes les régions. En 2010, les cultures d’arachide couvraient une superficie de plus de 377496 hectares pour une production annuelle de 536187 tonnes (MINADER, 2012), essentiellement concentrée dans les Régions de l’Extrême – Nord, du Nord et de l’Est (MINADER, 2012). Sur le plan national, cette culture sert à la fois comme culture de rente et culture alimentaire ou de subsistance (Betdogo et al., 2015). L’arachide occupe le second rang après le coton du point de vue monétaire dans la partie septentrionale du Cameroun (Betdogo et al., 2015). Dans ce pays en général et dans la zone soudano-sahélienne en particulier, cette oléagineuse présente un intérêt nutritionnel lié á la complémentation lipoprotéique d’une alimentation très exclusivement céréalière ou à base de féculents (Freeman et al., 1999). Dans ce pays, la demande en graines d’arachide est estimée à 655221 tonnes et la production disponible n’est que de 520681 tonnes (MINADER, 2012).
3Dans les pays qualifiés de grands producteurs d’arachide, les pollinisateurs de cette plante sont très bien connus et judicieusement exploités pour améliorer les rendements en gousses et en graines. C’est ainsi qu’en Israël, Ceratina bispinosa est le principal pollinisateur des fleurs d’arachide (Carmin cité par Free, 1970). Aux États-Unis d’Amérique, les agents vecteurs de pollen de cette espèce végétale sont les abeilles appartenant aux genres Halictus, Lasioglossum, Megachile, Bombus, Apis, Melissodes et Anthidium (Hammons & Leuck cités par Pesson & Louveaux, 1984). En Chine et en Inde, les principaux pollinisateurs de l’arachide sont les abeilles asiatiques Apis cerana et Apis mellifera (Abrol, 2012).
4Les travaux sur la pollinisation de A. hypogaea au Cameroun sont ceux de Tchuenguem (1993) et Tchuenguem et al., (2014)qui ont montré que les insectes anthophiles augmentent les rendements en graines et en gousses de l’arachide de 29,59% et de 28,13% à Yaoundé et de 14,97% et de 39,65% à Ngaoundéré respectivement.
5A notre connaissance, malgré que l’Extrême – Nord et le Nord soient les plus grands producteurs de l’arachide à l’échelle nationale, il n’existe aucun travail publié sur la pollinisation de cette plante dans ces régions. Il est pourtant très bien connu que les insectes floricoles augmentent généralement les rendements fruitiers et/ou en grainiers de plusieurs espèces végétales, via la pollinisation des fleurs au cours de leurs activités de butinage (Djonwangwé et al., 2011a ; Tchuenguem et al., 2014). De plus, la demande nationale en arachide est de loin supérieure à l’offre et la survie des pollinisateurs locaux semble être menacée par la course accrue aux pesticides des agriculteurs de ces deux régions.
6 L’objectif général de cette recherche est une contribution à la connaissance des relations existant entre A. hypogaea et ses insectes anthophiles en vue de leur exploitation optimale dans l’amélioration des rendements de cette oléagineuse au Cameroun. Les objectifs spécifiques incluent :
7- la détermination de la diversité de l’entomofaune anthophile de A. hypogaea ;
8- l’étude des activités des insectes sur les fleurs ;
9- l’évaluation de l’impact des insectes floricoles sur la pollinisation et les rendements en gousses et en graines.
Matériel et méthodes
Site d’étude et matériel biologique
10Les travaux ont été réalisés de juin à octobre 2015 au quartier Palar à Maroua (Extrême – Nord ; Cameroun). La station d’étude est une aire de 240 m2, centrée sur le point de latitude Nord 10°36'169’’, de longitude Est 14°16’373’’ et 415m d’altitude.
11Le matériel végétal est constitué des pieds de A. hypogaea de la variété 55-33 issus de la germination des graines achetées au marché de Guider (Nord ; Cameroun). Le matériel animal est constitué de l’ensemble des insectes naturellement présents dans la nature et qui visitaient les fleurs de A. hypogaea.
Méthode
Préparation, semis et entretien de la parcelle expérimentale
12La parcelle expérimentale est une aire rectangulaire de 21 m de long sur 13 m de large. Cette parcelle est subdivisée en quatre blocs de 9 m de longueur et 5 m de largeur chacun et séparés les uns des autres et tout autour par des allées de 1 m.
13Entre le 13 juin et le 17 juillet 2015, les opérations suivantes ont été successivement effectuées sur la parcelle expérimentale : défrichement, labour à la charrue et formation de quatre blocs. Le 21 juillet 2015, le semis a été fait, en ligne sur les blocs, à raison de 15 lignes par bloc (25 poquets sur la longueur et 15 poquets sur la largeur). Les graines sont semées individuellement par poquet, l’espacement était de 20 cm entre les poquets et 60 cm entre les lignes. De la germination survenue le 28 juillet à l’apparition des premières fleurs le 19 août 2015, le sarclage était régulièrement effectué à la houe. Durant la période de floraison jusqu’à la maturation des gousses (du 19 août au 10 octobre 2015), le désherbage était fait régulièrement par arrachage à la main.
Détermination de la diversité et de la fréquence de l’entomofaune floricole de Arachis hypogaea
14À l’apparition des premiers boutons floraux, 2 lots composés chacun de 72 pieds d’arachides ont été constitués.
15- lot I : constitué de 72 pieds subdivisés en quatre sous lots de 18 pieds chacun étaient laissés en libre pollinisation ;
16- lot II : constitué de 72 pieds subdivisés en quatre sous lots de 18 pieds chacun étaient complètement isolés des visites d’insectes à l’aide d’une cage en toile gaze (Figure 1) conformément aux recommandations de Delaplane et al., (2013).
17- Sur les fleurs du lot I, les observations sont faites au moins deux fois par semaine, pendant toute la période de floraison et selon quatre tranches horaires journalières : 7 h – 8 h, 9 h –10h, 11 h –12 h et 13 h –14 h. Pendant une heure, les fleurs du lot I sont observées à raison de 15 minutes pour chacun des sous lots 1, 2, 3 et 4 et pour chacune de ces tranches horaires. A chaque passage, les visites des différents insectes rencontrés sur les fleurs sont comptées. Les insectes n’étant pas marqués, les résultats cumulés ont été exprimés par le nombre de visites (Tchuenguem, 2005). Les données obtenues ont permis de déterminer la fréquence de chaque espèce d’insecte (Fi) sur les fleurs de A. hypogaea selon la formule : Fi = Vi/VI x100, avec Vi = nombre de visites de l’insecte i sur les fleurs du lot libre et Vi le nombre de visites de tous les insectes sur ces mêmes fleurs (Tchuenguem et al., 2001). La détermination des spécimens a été faite au Laboratoire de Sciences Biologiques de Ecole Normale Supérieure de l’Université de Maroua à l’aide des clés d’identification de Pauly (1998, 2014) et Eardley (2004).
Etude de l’activité des insectes sur les fleurs
Détermination des produits floraux prélevés par les insectes
18Les produits floraux (nectar et/ou pollen) recherchés par les insectes ont été notés pendant les mêmes dates et tranches horaires que pour la fréquence des visites. Un insecte qui enfonce sa trompe ou sa tête dans une fleur est un chercheur de nectar ; si à l’aide de ses pattes et de ses mandibules, il gratte les anthères, il s’agit d’un chercheur de pollen (Jean - Prost, 1987 ; Tchuenguem et al., 2009a). Le pollen récolté est accumulé dans les organes de transport, brosse ventrale chez les Megachilidae, corbeilles à pollen chez les Apidae (Leuck & Hammons, 1965).

Abondance des butineurs
19Les abondances par fleur et par plante ont été enregistrées à la suite des comptages directs. Elles correspondent au plus grand nombre d’insectes simultanément en activité sur une fleur ou sur une plante (Tchuenguem et al., 2009b).
20Pour l’abondance par 1000 fleurs (A1000), les individus de chaque espèce ont été comptés sur un nombre connu de fleurs épanouies ; l’abondance par 1000 fleurs (A1000) est ensuite calculée à l’aide de la formule suivante : A1000 = [(Ax / Fx) x 1000], où Fx et Ax sont respectivement le nombre de fleurs et le nombre d’insectes butineurs effectivement comptés sur les fleurs laissées en libre pollinisation à l’instant x (Tchuenguem, 2005 ; Pando et al., 2013).
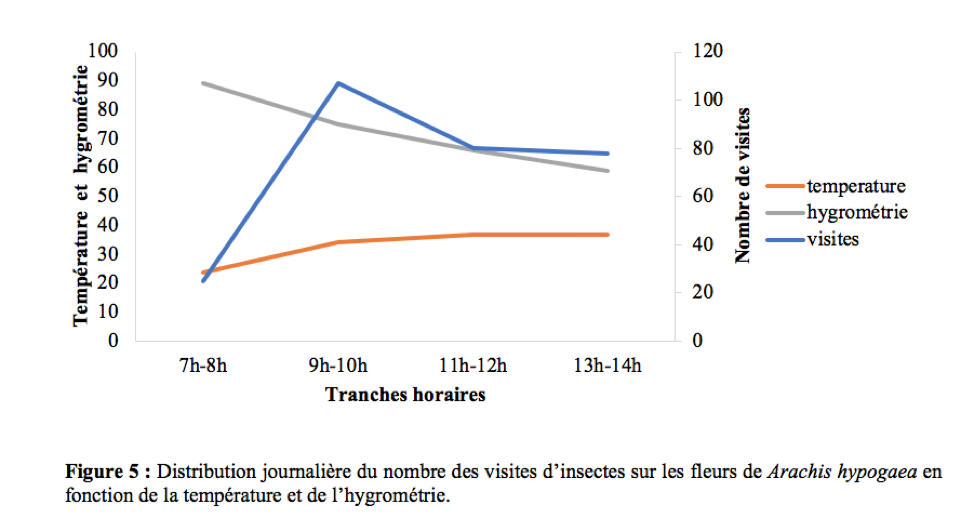
21Les données ont été enregistrées pendant les mêmes dates et périodes journalières que pour la fréquence des visites.
Evaluation de la durée de visites par fleur
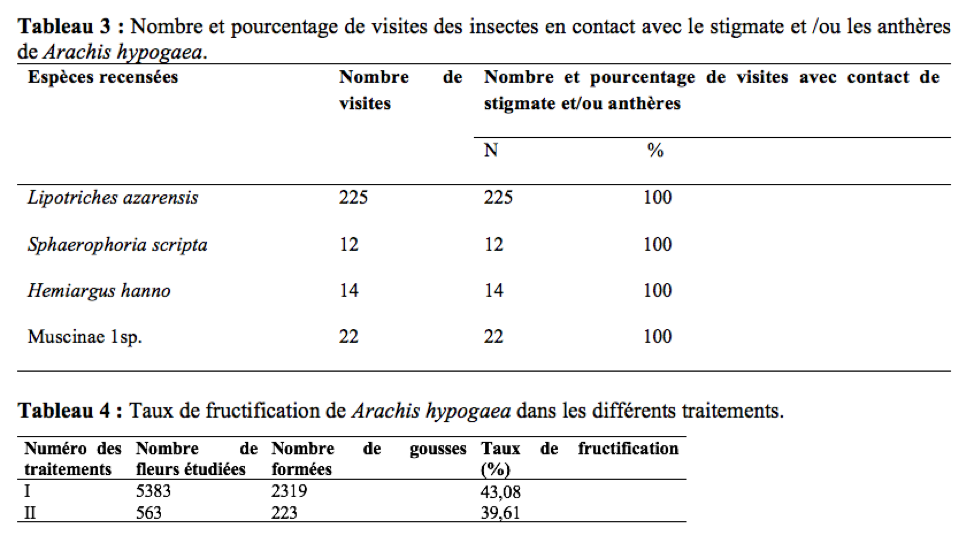
22La durée des visites par fleur est le temps que met l’insecte pour prélever un produit (pollen et/ou nectar) sur une fleur (Tchuenguem, 2005). Elle est obtenue à l’aide d’un chronomètre préalablement mis à zéro puis déclenché dès que l’insecte se pose sur la fleur et arrêté dès son départ. Elle a été enregistrée aux mêmes dates et tranches horaires journaliers que l’enregistrement des produits floraux récoltés.
Etho-écologie du butinage
23Tout au long de la période de floraison, le comportement de butinage du pollen et / ou du nectar par les différents insectes a été noté par une observation attentive des insectes sur les fleurs. (La vitesse de butinage selon Jacob-Remacle (1989) correspond au nombre de fleurs visitées par minute. Ces données ont été enregistrées pendant les mêmes dates et tranches horaires à l’aide d’un chronomètre mis en marche dès la pose de l’insecte sur la fleur et stoppé une fois que l’insecte est perdu de vue (Djonwangwé et al., 2011a ; Pando et al., 2013, 2014 ). Le nombre de fleurs visitées par l’insecte est donc compté au fur et à mesure qu’il passe de fleur en fleur. La vitesse de butinage (Vb) est :Vb = Fi /di x 60 où di est la durée de visite donnée par le chronomètre (en seconde) et Fi le nombre de fleurs correspondant à di (Tchuenguem et al., 2009a ; Djonwangwé et al., 2011b). Au cours de la manipulation, lorsqu’un insecte revient sur une fleur déjà visitée, le comptage est effectué comme s’il s’agit de deux fleurs différentes (Tchuenguem, 2005).
24L’influence de la faune avoisinante a été systématiquement enregistrée lors du chronométrage de la durée des visites par fleur. Chaque visite interrompue était marquée d’un signe distinctif tout en précisant l’auteur de cette interruption.
Etude de l’influence de la flore avoisinante
25L’influence de la flore avoisinante a été systématiquement enregistrée lors du chronométrage de la durée des visites par fleur. Le passage des insectes des fleurs de A. hypogaea aux autres fleurs des plantes avoisinantes et vice versa a été noté tout au long de la période d’investigation.
Etude de l’influence des facteurs climatiques
26La température et l’hygrométrie de la station d’étude ont été notées toutes les 30 minutes, à l’aide d’un thermo-hygromètre portable installé à l’ombre. La variation du nombre des visites d’insectes en fonction de la température et de l’hygrométrie permet d’évaluer l’influence de ces facteurs sur les activités de butinage.
Evaluation de l’impact des insectes sur la pollinisation de Arachis hypogaea
27L’évaluation de l’impact des insectes sur la pollinisation de A. hypogaea a été notée tout au long de l’étude de la durée des visites. Il s’agissait de noter le nombre de fois où le corps de l’insecte entre en contact avec le stigmate et/ou les anthères de la fleur visitée. C’est ce qui a permis de mettre en évidence la participation des insectes dans l’autopollinisation et la pollinisation croisée des fleurs visitées (Tchuenguem, 2005).
Evaluation de l’impact des insectes pollinisateurs sur le rendement de Arachis Hypogea

Analyse des données
28Le traitement des données est fait à l’aide de la statistique descriptive (calcul des moyennes, écart-types et pourcentages), du Coefficient de corrélation (r) pour l’étude des relations entre deux variables, du test Z pour la comparaison des moyennes de deux échantillons, du Khi-carré (χ2) pour la comparaison des pourcentages (Schwartz, 1984). Les logiciels Excel et XLSTAT 14.1 ont été utilisés.
RESULTATS ET DISCUSSION
Diversité de l’entomofaune floricole de Arachis hypogaea
29Durant la période de floraison, 325 visites de 14 espèces d’insectes appartenant à neuf familles ont été dénombrées sur 5383 fleurs de A. hypogaea (Tableau 1). La diversité de l’entomofaune de l’arachide à Maroua est moins abondante que celle de Ngaoundéré en 2009 (17 espèces) et plus abondante que celle de 2010 dans cette même localité (12 espèces) (Tchuenguem et al., 2014). Ceci est en accord avec les travaux de Roubik (2000) qui ont prouvé que la diversité et l’abondance des insectes anthophiles d’une plante peuvent varier dans le temps et dans l’espace. Il ressort de ce tableau que trois ordres d’insectes sont majoritaires sur les fleurs de la Fabaceae à savoir : Hymenoptera, Diptera et Lepidoptera avec des fréquences de visites de 76,58%, 10,14% et 7,16% respectivement. La famille à laquelle appartiennent les insectes les plus fréquents sur les fleurs de l’arachide est celle des Halictidae avec 71,68%. Lipotriches azarensis (Cockerell, 1932) est de loin le plus fréquent avec 69,23% de l’ensemble des visites enregistrées. A Ngaoundéré, le pourcentage des visites des Hyménoptères varie entre 91,25% et 98,48% (Tchuenguem et al., 2014). La fréquence des Halictes sur les fleurs de l’arachide est plus élevée à Maroua qu’à Ngaoundéré où le pourcentage de visites était de 57,65% (Tchuenguem et al., 2014). Cette différence serait liée à l’abondance et à la diversité de ces insectes dans chacune de ces régions.
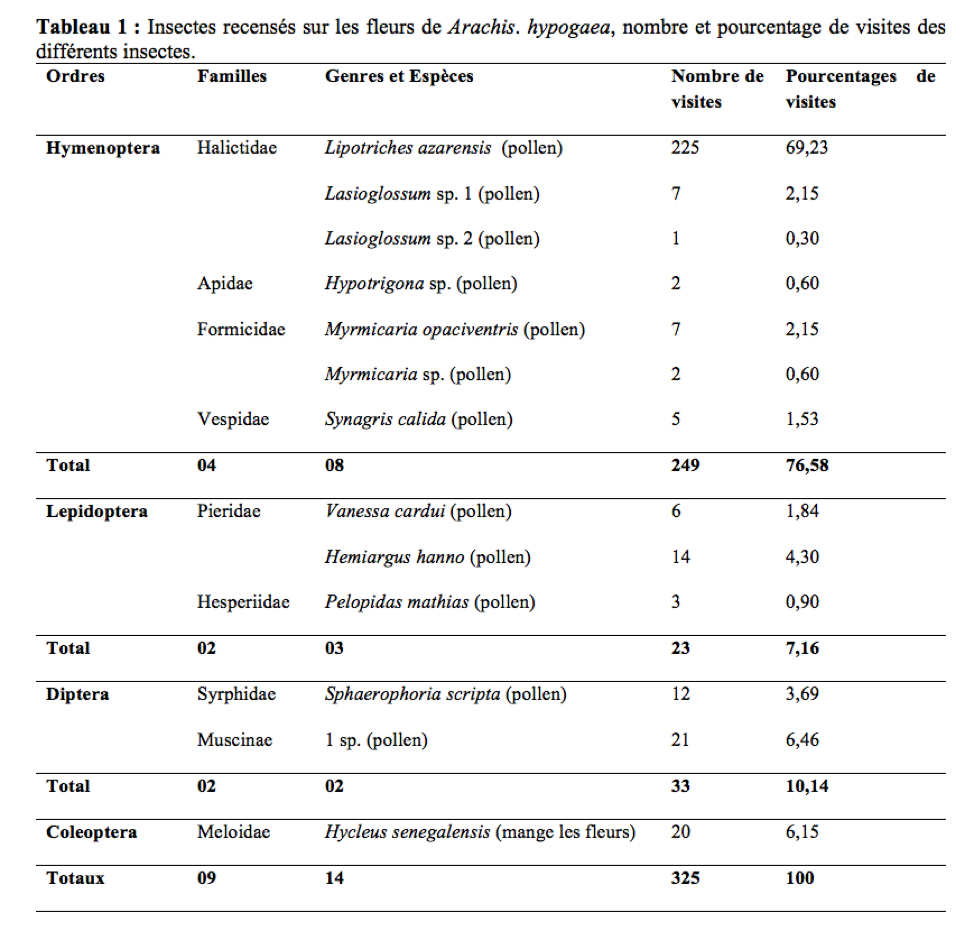
Activités des insectes sur les fleurs de Arachis hypogaea
Produit floral prélevé
30Tous les insectes floricoles de A. hypogaea à Maroua, récoltent le pollen de cette Fabaceae, exception faite de Hycleus senegalensis qui mange les fleurs. Durant la période d’investigation, Hycleus senegalensis consommait en moyenne une fleur toute les trois minutes (n = 32 ; m = 186,17sec ; s = 29,78).
31Parmi les récolteurs de pollen de l’arachide, on distinguait :
32- les consommateurs « in situ » du pollen représentés par :
33Myrmicaria opaciventris, Myrmicaria sp., Synagris calida, Vanessa cardui, Hemiargus hanno, Pelopidas mathias, Sphaerophoria scripta et Muscinae 1 sp ; dans ce groupe d’insectes pollinivores, tous sont dépourvus d’organes de transport de cet aliment (corbeilles ou brosse ventrale) ;
34- ceux qui récoltent et emportent le pollen dans leur nid représentés par L. azarensis (Figure 2), Lasioglossum sp. 1, Lasioglosumm sp. 2 et Hypotrigona sp. sont dotés d’organe de transport de pollen.
Abondance des insectes
35Le plus grand nombre d’insectes simultanément en activité sur les fleurs d’un pied d’arachide était de deux chez L. azarensis. L’Abondance moyenne par pied est de 1,003 (n = 324 ; s = 0,05). Cette faible densité d’insectes butineurs semble être liée à la non production de nectar par les fleurs d’arachide d’une part et à l’accessibilité difficile au produit floral (pollen) produit par cette plante d’autre part. Ce résultat est en accord avec ceux obtenus par Tchuenguem (1993) et Tchuenguem et al., (2014) qui indiquent qu’à Nkolbisson (Yaoundé) et à Dang (Ngaoundéré) que le nombre moyen d’insectes butinant simultanément sur un pied de A. hypogaea est de un.
Rythme de visites en fonction du rythme d’épanouissement des fleurs de Arachis hypogaea
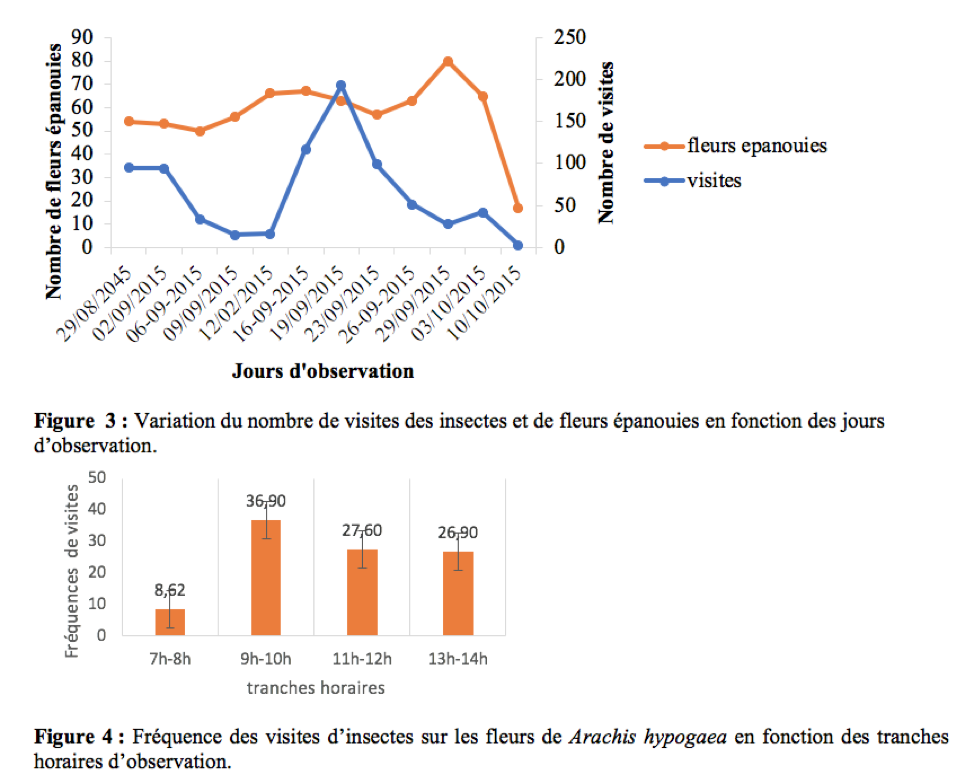
36Le nombre de visites des insectes sur les fleurs variait en fonction du nombre de fleurs épanouies (Figure 3). Il existe entre ces deux paramètres une corrélation positive et non significative (r = 0,24 ; ddl = 10 ; p > 0,05).
Rythme de visites selon les tranches horaires journalières
37Pendant la période d’observation, les insectes étaient actifs sur les fleurs de l’arachide entre 7h et 14h. Le pic d’activité se situe dans la matinée entre 9h et 10h (Figure 4). Ces résultats sont similaires à ceux obtenus par Tchuenguem (1993) sur l’arachide à Nkolbisson. A Ngaoundéré, Tchuenguem et al., (2014) ont trouvé que le pic des activités des insectes sur les fleurs de A. hypogaea se situait entre 8h - 9 h et 11 h - 12 h respectivement en 2009 et 2010. Ceci est une preuve que pour une espèce végétale, le pic d’activité peut varier avec les régions. En générale, la présence massive des insectes sur les fleurs à une tranche horaire coïncide le plus souvent avec la période à laquelle le pollen de la plante hôte est plus disponible.

Durée des visites par fleur
38Au cours de la floraison, les insectes prélevaient uniquement et intensément du pollen. La durée moyenne de visites varie en fonction de l’espèce d’insecte butineur des fleurs de A. hypogaea. La durée moyenne de visites était de 5,22 sec chez L. azarensis (n = 292 ; s = 5,27), de 4,30 sec chez Muscinae 1sp. (n = 26 ; s = 3,23). Ces durées moyennes sont inférieures à celles obtenues par Tchuenguem et al. (2014) qui étaient de 25,94 sec (n = 310 ; s = 18,68) chez Halictus sp., 34,34 sec (n = 505 ; s = 23,41) chez Ceratina sp. en 2009 sur la même plante.
Etho - écologie du butinage
39Sur les fleurs de A. hypogaea à Maroua, le passage de L. azarensis d’une fleur à une autre sur le même pied se fait soit par la marche si les fleurs sont rapprochées ou par le vol si les fleurs à exploiter sont distantes ; le passage d’un pied à un autre se fait toujours par le vol. Pour récolter du pollen, l’insecte repère les fleurs épanouies, se pose sur les ailes de la fleur tout en dirigeant la tête vers l’étendard puis recourbe cette dernière en direction des étamines, et enfin récolte le pollen des anthères à l’aide de ses pattes prothoraciques et de ses mandibules. Les pollens prélevés, sont rassemblés et accumulés dans les poils collecteurs des pattes métathoraciques par la suite dans la scopa. Ce comportement a été observé par Tchuenguem et al., (2014) sur A. hypogaea à Ngaoundéré.
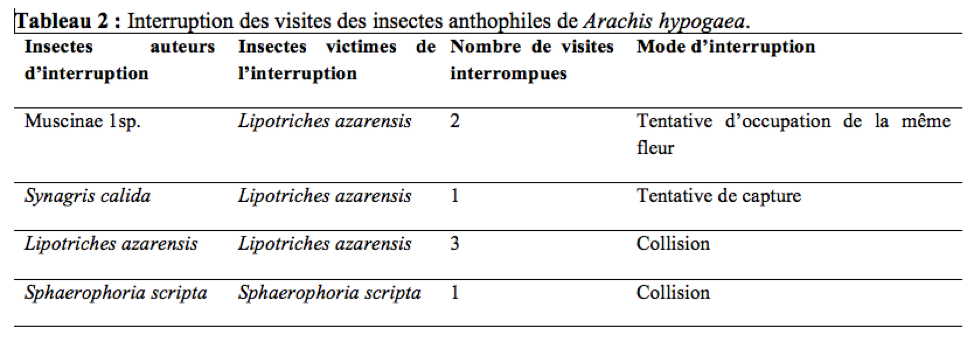
40Lipotriches azarensis visitait entre 5,4 à 19,8 fleurs/minute avec une vitesse de butinage moyenne de 16,02 fleurs par minute (n = 108 ; s = 9,52). Durant la période d’observation, 3,11% de visites de L. azarensis, 9,52% de visites deMuscinae 1sp., 20% de visites de S. calida et 8,33% de visites de S. scripta interrompues ont été notées ; les interruptions résultaient de la collision (L. azarensis, S. scripta), de tentative de capture (S. calida) et de tentative d’occupation de la même fleur (Muscinae 1sp.) entre les visiteurs d’une même fleur (Tableau 2). Une des conséquences de ces interruptions étaient la réduction de la durée de certaines visites ; chez L. azarensis, Muscinae 1sp., S. calida et S. scripta, ceci oblige l’individu à visiter un plus grand nombre de fleurs lors d’un voyage de butinage, afin d’obtenir sa charge maximale de pollen.
Influence de la flore avoisinante sur l’activité des insectes floricoles
41Durant la période d’observation, plusieurs autres espèces végétales en fleurs avoisinant A. hypogaea étaient visitées pour leur nectar (Ne) et/ou leur pollen (Po) par les insectes butineurs de cette Fabaceae. Parmi ces plantes, on peut citer : Zea mays (Poaceae) ; Vigna unguiculata (Fabaceae); Hibiscus esculentus (Malvaceae); Sesamum indicum (Pedaliaceae); Sorghum bicolor (Poaceae); Gossypium hirsutum (Malvaceae) ; Hibiscus sabdariffa (Malvaceae). Lipotriches azarensis est passé respectivement des fleurs de A. hypogaea à Zea mays (huit fois) (P), à Hibiscus sabdariffa (19 fois) (Ne) et à Sesamum indicum (23 fois) (N+P) ; Hypotrigona sp. est passé quatre fois de Hibiscus sabdariffa (P) à A. hypogaea et neuf fois de Sesamum indicum à la Fabaceae (Ne) ; Hemiargus hanno est passé des fleurs de A. hypogaea aux fleurs de Hibiscus sabdariffa (P) et in versement sept fois. Pour l’ensemble des insectes, le passage des fleurs de A. hypogaea à une autre plante était fréquemment observé ; l’opération inverse était rarement notée. Ceci s’expliquerait par la plus forte attractivité des fleurs des plantes avoisinantes ; cette forte attractivité serait liée à la disponibilité des produits floraux d’une part et à l’accessibilité facile (fleurs généralistes) à ces produits par rapport au pollen de l’arachide caché sous l’étendard, l’aile et la carène d’autre part. Ces observations sont en accord avec celles faites par Tchuenguem (1993) sur A. hypogaea à Yaoundé. Pendant la période de floraison de A. hypogaea, la présence près de la parcelle expérimentale de plusieurs autres plantes en fleurs aurait contribué à la réduction du pouvoir attractif de ses fleurs vis-à-vis des insectes.
Influence des facteurs climatologiques sur l’activité des insectes floricoles
42La température et l’hygrométrie n’ont pas influencé les activités de butinage des insectes. Il existe une corrélation positive et non significative entre le nombre de visites et la température (r = 0,82 ; ddl = 2 ; p > 0,05) et une corrélation négative et non significative entre le nombre de visites et l’humidité de l’air (r = -0,61 ; ddl = 2 ; p > 0,05). Ces résultats sont en accord avec ceux obtenus par Tchuenguem et al., (2014) qui ont trouvé une corrélation positive et non significative entre le nombre de visites des insectes et la température (r = 0,66 ; ddl = 4 ; p > 0,05), négative et non significative entre le nombre des visites des insectes et l’humidité relative de l’air (r = - 0,51; ddl = 4 ; p > 0,05). La Figure 5 montre l’allure de la variation du nombre de visites en fonction selon les tranches horaires en fonction de la température et de l’hygrométrie.
Impact des insectes sur la pollinisation de Arachis hypogaea
43Pendant la récolte du pollen, les insectes anthophiles de A. hypogaea sont régulièrement en contact avec les anthères et/ou le stigmate.
44Le Tableau 3 regroupe le nombre et les pourcentages de visites de quelques insectes ayant été en contact permanent avec les anthères et/ou le stigmate des fleurs de A. hypogaea durant les 12 jours d’observation. Au cours de la récolte du pollen, la fréquence des visites avec contact entre le corps de l’insecte visiteur et le stigmate et/ou les anthères de la fleur visitée était de 100%. Leur intervention dans l’autogamie est probable d’autant plus que ce mode de pollinisation est prépondérant chez A. hypogaea (Hammons & Leuk, 1966 ; Tchuenguem, 1993 ; Tchuenguem et al., 2014). Lors de leurs activités sur les fleurs, les insectes secouent celles-ci. Le rôle des insectes dans l’autopollinisation de l’arachide serait proportionnel à l’aptitude de l’insecte visiteur à agiter la fleur visitée. Ce qui est en accord avec les travaux de Girardeau & Leuck (1967) et de Rashad et al., (1978) en Egypte sur l’arachide. Ce mouvement faciliterait la libération optimale de grains de pollen et augmenterait les possibilités de leur dépôt sur le stigmate. La charge optimale de pollen sur le stigmate serait favorable à la formation des gousses et des graines (Segeren et al., 1996).
Impact des insectes sur les rendements de Arachis hypogaea
Taux de fructification dans les différents lots étudiés
45Dans les lots I et II le taux de fructification est de 43,08% ; 39,61% respectivement (Tableau 4). La comparaison du taux de fructification des lots I et II révèle une différence non significative (χ2 = 1,03 ; p ˃ 0,05). Les insectes floricoles ont contribué à l’augmentation du taux de fructification de H. hypogaea de l’ordre de 8,05%. La contribution des insectes anthophiles dans l’amélioration des rendements en gousses de l’arachide à Maroua est accord avec les travaux de Girardeau & Leuck (1967) qui ont trouvé que les plantes en libre pollinisation produisent 6 à 11 % plus des fruits que les plantes sous cage d’où est exclu toute visite d’Apoïdes.
Masse des gousses, nombre de graines par gousses, nombre de graines normales par gousse et masses de graines d’une gousse dans les différents lots étudiés
46Il ressort du tableau 5 que les gousses issues des plantes laissées en libre pollinisation ont une masse moyenne, un nombre moyen de graines par gousse, un nombre moyen de graines normales par gousses et une masse des graines par gousse légèrement supérieure à celles issues des plantes en cages.
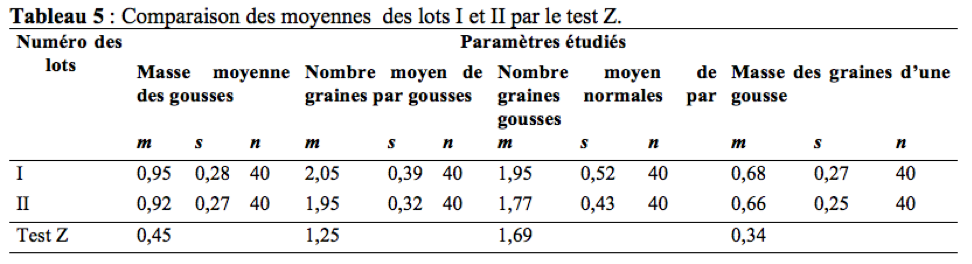
47La comparaison des moyennes des différents paramètres étudiés dans les lots I et II révèle une différence non significative (Tableau 5). La contribution des insectes floricoles dans l’augmentation de la masse des gousses est : 3,16%. La contribution des insectes floricoles dans l’augmentation du nombre de graines par gousse est de : 4,88%. Ce résultat est inférieur à celui trouvé par Tchuenguem et al. (2014) à Ngaoundéré qui était de 14,97%. Ceci pourrait s’expliquer par forte représentativité de Hyménoptères (94,86%) à Ngaoundéré qu’à Maroua (Hyménoptères : 76,58%). La contribution des insectes floricoles dans l’augmentation du nombre de graines normales par gousses est de : 9,23%. L’influence des insectes anthophiles sur l’augmentation du nombre de graines normales par gousse de A. hypogaea a donc été positive. La contribution des insectes floricoles dans l’augmentation de la masse des graines d’une gousse est de : 2,94%.
CONCLUSION
48A Maroua, les fleurs de A. hypogaea sont visitéespar 14 espèces d’insectes et ces insectes récoltent exclusivement du pollen. L’insecte le plus fréquent est Lipotriches azarensis avec 69,23% des visites. En comparant le rendement des plants d’arachide en libre pollinisation à celui des plants protégés des insectes, il est apparu que les insectes anthophiles ont augmenté le taux de fructification de 8,05% ; le nombre moyen de graines par gousse de 4,88% ainsi que le pourcentage de graines normales de 9,23%. Le pollinisateur majeur de A. hypogaea à Maroua est L. azarensis. Le traitement des plants d’arachide aux pesticides chimiques est à éviter pendant la période de floraison afin de bénéficier du service écosystémique des insectes pollinisateurs.
REMERCIEMENTS
49Les auteurs de ces travaux remercient le Musée Royal d’Afrique Centrale de Tervuren en Belgique pour avoir facilité la détermination des Rhopalocères (Papillons du jour) en accordant un stage de formation à DJONWANGWE Denis.
Bibliographie
Abrol D.P., 2012. Pollination biology: Biodiversity conservation and agricultural production. Springer Dordrecht Heidelberg. London, 792 p.
Anonyme, 2003. Gestion de la fertilité des sols pour la sécurité alimentaire en Afrique Subsaharienne. FAO, n° 25, Rome, Italie, 63 p.
Betdogo S., Sali B., Adamou I. & Woin N., 2015.Évaluation agronomique de cinq cultivars d’arachide (Arachishypogeae L.) introduits dans la région du Nord Cameroun. Journal of Applied Biosciences,89, 8311– 8319.
Cockerell T.D.A., 1932. Records of the African Bees. I. American Museum Novitiates,547, 1–16.
Delaplane K.S. et al., 2013.Standard methods for pollination research with Apismellifera. Journal of Apicultural Research,52(4), 1-25. DOI 10.3896/IBRA.1.52.4.12.
Demarly Y., 1997. Génétique et amélioration des plantes. Masson, Paris, 577 p.
Djonwangwé D. et al., 2011a.Impact de l’activité de butinage de Apis mellifera adansonii Latreille (Hymenoptera : Apidae) sur la pollinisation et la chute des jeunes fruits du Karité Vitellaria paradoxa (Sapotaceae) à Ngaoundéré (Cameroun). International Journal of Biological and chemical Sciences,5(4), 1538-1551.
Djonwangwé D., Tchuenguem F.F.N. & Messi J., 2011b.Foraging and pollination activities of Apis mellifera adansonii Latreille (Hymenoptera: Apidae) on Ximenia americana (Olecaceae) flowers at Ngaoundéré (Cameroon). International Research Journal of Plant Science,2(6), 170-178.
Eardley C.D., 2004. Taxonomic revision of the African stringless bees (Apoidea: Apidae: Apinae: Meliponini). African Plant Protection10(2), 63-96.
FAO, 2014. Statistiques de production alimentaires.
FAOSTAT, 2008.FAO Statistics, Food and Agriculture Organization of the United Nations, Rome, 2012. http://faostat.fao.org/.es
Freeman A.H. et al., 1999.The world groundnut economy, facts, trends and outlook. ICRISAT, India, 48 p.
Free J.B., 1970.Insect Pollinisation of Crops. Academic Press: London, New York, 544 p.
Girardeau & Leuck D.B., 1967. Effectof mechanical and bee tripping on yield of the peanut. Journal of Economic Entomology,60, 1454-1455.
Hammons R.O. & Leuck D.B., 1966. Natural cross pollination of the peanut, Arachishypogaea L., in the presence of bees and thrips. AgronomyJournal 58, 396.
Jacob-Remacle A., 1989. Comportement de butinage de l'abeille domestique et des Abeilles sauvages dans des vergers de pommiers en Belgique. Apidologie,20(4), 271-285.
Jean-Prost P., 198. Apiculture : Connaître l’Abeille - Conduire le Rucher. Éd Lavoisier, Paris. 579 p.
Leuck D.B. & Hammons R.O., 1965.Pollen-collecting activities of bees among peanut flowers. Journal of Economic Entomology,58, 1028-1030.
MINADER, 2012. Annulaire des statistiques du secteur agricole, campagnes 2009 & 2010. Direction des enquêtes et statistiques agri-stat Yaoundé, Cameroun, 123 p.
Pando J.B., Tchuenguem F.F-N. & Tamesse J.L., 2011a. Foraging and pollination behaviour of Xylocopa calens Lepeletier (Hymenoptera: Apidae) on Phaseolus coccineus L. (Fabaceae) flowers at Yaoundé (Cameroon). EntomologicalResearch, 41, 185-193.
Pando J.B., Tchuenguem F.F.-N. & Tamesse J.L., 2011b. Pollination and yield responses of pigeon pea (Cajanus cajan L. Millsp.) to the foraging activity of Chalicodoma cincta cincta (Hymenoptera: Megachilidae) in Yaoundé (Cameroon). Journal of Animal and Plant Sciences11(1), 1346-1357.
Pando J.B. et al., 2014. The importance of single floral visit of Chalicodoma cincta cincta Fabricius 1871 (Hymenoptera: Megachilidae) in the pollination and yield of Vigna unguiculata (L.) Walp. 1843 (Fabaceae) in Cameroun. International journal of Agronomy and Agricultural Research4(4), 179-187.
Pauly A., 1998. Hymenoptera Apoidea du Gabon. Annales Musée Royal de l’Afrique Centrale, Sciences Zoologiques,282, 1-121.
Pauly A., 2014. Les Abeilles des Graminées ou Lipotriches Gerstaecker, 1858, sensu stricto(Hymenoptera: Apoidea: Halictidae: Nomiinae) de l’Afrique subsaharienne.Belgian Journal of Entomology,20, 1-393.
Rashad S.E., Ewies M.A. & El Rabie H.G., 1978. Pollinators of peanuts (Arachis hypogaea L.) and the effect of honeybees on its yield. Research Journal of Plant Science4(2), 45-54.
Roubik D.W., 2000. Pollination system stability in Tropical America. Conservative Biology 14(5), 1235-1236.
Schwartz., 1984. Méthodes Statistiques à l’Usage des Médecins et des Biologistes. Flammarion Médecine-Science, Paris, 318 p.
Segeren P. et al., 1996.Apiculture sous les tropiques. Agrodok 32, 5ème éd., Agromisa, Wageningen, 88 p.
Tchuenguem F.F.-N., 1993. Activités des insectes anthophiles et son impact sur les rendements de deux plantes cultivées au Cameroun : Zea mays L. (Gramineae) et Arachis hypogaea L. (Papilionaceae). Thèse de Doctorat de 3ème Cycle : Université de Yaoundé I (Cameroun), 133 p.
Tchuenguem F.F.-N., 2005. Activité de butinage et de pollinisation d’Apis mellifera adansonii Latreille (Hymenoptera: Apidae, Apinae) sur les fleurs de trois plantes à Ngaoundéré (Cameroun): Callistemon rigidus (Myrtaceae), Syzygium guineense var. macrocarpum (Myrtaceae) et Voacanga africana (Apocynaceae). Thèse de Doctorat d’Etat : Université de Yaoundé I (Cameroun), 103 p.
Tchuenguem F.F.-N., Messi J. & Pauly A., 2001. Activité de Meliponula erythra sur les fleurs de Dacryodes edulis et son impact sur la fructification. Fruits,56, 179-188.
Tchuenguem F.F.-N. et al., 2009a. Activité de butinage et de pollinisation d’Apis mellifera adansonii sur les fleurs de Helianthus annus (Asteraceae) à Ngaoundéré (Cameroun). Cameroon Journal of Experimental Biology,5, 1-9.
Tchuenguem F.F.-N., Ngakou A. & Kengni B.S., 2009b. Pollination and yield responses of cowpea (Vigna unguiculata L.Walp.) to the foraging activity of Apis. 1218. Journal of Research in Biology,4(1), 1209-1219.
Tchuenguem F.F.-N., Kingha T.B.M. & Brückner D., 2014.Diversité des insectes floricoles et son impact sur les rendements fruitiers et grainiers de Arachis hypogaea L. (Fabaceae) à Dang (Ngaoundéré-Cameroun). International Journal of Biological and chemical Sciences,8(3), 983-997.