- Accueil
- Volume 73 (2020)
- Contribution à l’étude de la biodiversité entomologique associée à la culture de manioc (Manihot esculanta Crantz) dans le territoire de Mbanza-Ngungu (RDC)
Visualisation(s): 2311 (85 ULiège)
Téléchargement(s): 117 (2 ULiège)
Contribution à l’étude de la biodiversité entomologique associée à la culture de manioc (Manihot esculanta Crantz) dans le territoire de Mbanza-Ngungu (RDC)

Document(s) associé(s)
Version PDF originaleNotes de la rédaction
Reçu le 9 juillet 2018, accepté le 25 janvier 2019.
Résumé
Dans le contexte actuel d’intégration des interactions multitrophiques et d’application d’approches fonctionnelles, la biodiversité entomologique est investiguée afin de caractériser le fonctionnement d’un type d’agrosystème en se focalisant sur le rôle des insectes présents. La diversité de l’entomofaune associée à la culture de manioc (Manihot esculanta Crantz) a été ciblée dans le territoire de Mbanza-ngungu en République Démocratique du Congo (RDC). En particulier, notre objectif est de déterminer l’impact de la composition végétale de l’environnement proche des parcelles cultivées de manioc sur les populations d’insectes présentes dans ces parcelles. Au total, 3985 insectes ont été collectés, appartenant à 27 familles reparties dans neuf ordres. Les familles les plus abondantes sont les Acrididae, les Formicidae, les Coccinellidae, les Nasutitermitinae et les Macrotermitinae. Au sein de cette communauté d’insectes, des ravageurs, des ennemis naturels et des pollinisateurs ont été rencontrés. L’abondance des insectes est fortement corrélée à la diversité spécifique des arbres présents. Ainsi, il est nécessaire, en lutte intégrée contre les ravageurs de cultures, de considérer le rôle du paysage et l’effet de la composition et de la structure de ce paysage sur l’abondance des ravageurs, à différentes échelles
Abstract
In the current context of integration of multitrophic interactions and application of functional approaches, entomological biodiversity is investigated in order to characterize the functioning of a type of agro-ecosystem by focusing on the role of insects, which can be found inside on the spot. The diversity of the entomofauna associated with cassava cultivation (Manihot esculanta Crantz) was targeted in the Mbanza-Ngungu territory in the Democratic Republic of Congo (DRC). In particular, our objective is to determine the environment impact close to cultivated plots, in the forest and in the grassland in order to assess the impact of plant diversity on insect’s populations in cassava plots. A total of 3985 insects were collected referring to 27 families divided in to nine orders. The most abundant families were Acrididae, Formicidae, Coccinellidae, Nasutitermitinae, and Macrotermitinae. Within this insect community, pests, natural enemies, and pollinators have been encountered. The abundance of insects is strongly correlated with the specific diversity of the present (or current) trees. So, in intregrated fight against cultivations pests, it is necessary to consider the role of landscape and the effect of its composition and structure on pest’s abundance at different scales
Table des matières
Introduction
1Les insectes constituent un groupe important de la biodiversité du règne animal et jouent un rôle écologique remarquable comme bio-indicateurs de l’état des écosystèmes (Oudjiane et al., 2014). Ils interagissent à de multiples niveaux au sein des écosystèmes et sont à l’origine de différents services (Loreau, 2000 ; Lavelle et al, 2006). Les milieux naturels et les agrosystèmes renfermeraient souvent une faune entomologique typique et riche en espèces (Wratten et al., 2007). En effet, les insectes phytophages notamment seraient plus susceptibles de trouver leurs plantes hôtes en peuplements denses et de ce fait seraient plus abondants dans des environnements diversifiés parce qu’ils peuvent bénéficier de sources nutritionnelles alternatives. (Rodriguez-Saona et al., 2012 ; Bosquée et al., 2014).
2En République Démocratique du Congo (RDC), la biodiversité entomologique est mal connue. Très peu d’études ont été consacrées aux insectes en comparant les milieux naturels et les agrosystèmes. Des études ont pu majoritairement mettre en avant une corrélation positive entre richesse spécifique végétale et la productivité mais peu ont concerné à la fois la diversité des plantes et de l’entomofaune associée dans les monocultures comme celle de manioc. A ce jour, les données entomologiques sur ces écosystèmes dans le territoire de Mbanza-Ngungu sont inexistantes. C’est dans cette optique que s’inscrit ce travail qui a pour objectif de comparer la biodiversité entomologique associée à la culture de manioc dans un milieu forestier et dans une savane herbeuse. Nous le considérons comme une étape préliminaire dans une approche originale et innovante qui, à notre connaissance, n’a jamais été appliquée dans ce territoire.
Matériel et méthodes
3L’étude a été menée dans la région de Mbanza-Ngungu située à 154 Km de la ville de Kinshasa, en RDC. Elle est comprise entre 5° 16' Sud et 14° 51' Est. Le climat est du type Aw4 selon la classification de Koppen (Habiyaremye et al., 2011). Il s’agit d’un climat tropical humide soudanais, caractérisé par deux principales saisons : une grande saison des pluies d’une durée de huit mois (de fin septembre à fin mai), entrecoupée d’une petite saison sèche allant de janvier à février, et une saison sèche de juin à septembre. La pluviométrie annuelle moyenne est de 1500 mm, pour une température annuelle moyenne de 24° C.
4Deux biotopes naturels ont été ciblés :
-
La zone forestière située dans une vallée qui est constituée d’un sol sableux, fin, légèrement argileux, ocre à brunâtre. La végétation est composée des espèces suivantes : Pentaclethra eetveldeana De Wild. & T. Durand, Elaies guineensis Jacq., Anthocleista schweinfurthii Gilg, Chaetocarpus africanus Pax, Irvingia smithii Hook. f., Rodognaphalon lukayayense Pellegr., Cyclosorus goggulodus Wild, Lasimorpha senegalensis Schott.
-
La savane voisine s’étendant sur un plateau au sol sablonneux peu argileux. Elle est dominée par les espèces Crossopteryx febrifuga Benth et Hyparrhenia diplandra Stapf.
5Six parcelles d’environ 1 hectare chacunes ont été investiguées dans les deux biotopes. Afin de pouvoir capturer un nombre important d’insectes, le dispositif expérimental a été mis en place sur base de plusieurs transects comme recommandé par Le Feon (2010). Sur chacune des parcelles, trois transects de 30 mètres de longueur ont été définis (Bartomeus et al., 2010). Un premier transect a été positionné en bordure de champ, un deuxième localisé à 10 mètres du premier et le troisième est mis en place à 10 mètres du deuxième. Le long des transects en rouge sont réalisés à la fois les relevés du fauchage et de la chasse à vue (30 min / transect).
6Les captures ont été réalisées à vue à l’aide d’un filet fauchoir, une fois par semaine, aux mois de juin, juillet et août 2016. Les insectes ont été conservés dans de l’éthanol à 70%.
7Au laboratoire, les insectes ont été déterminés sous une loupe binoculaire, à image non inversée par la méthode Rapid Biodiversity Assessment (RBA). Cette méthode consiste à effectuer des relevés de biodiversité les plus complets possibles tout en s’affranchissant de la taxonomie classique (Krell, 2004). Dans ce cas, l’ordre est le seul niveau taxonomique atteint avec certitude. Les individus de chaque ordre sont ensuite déterminés en s’appuyant sur les collections de l’insectarium de l’Institut National des Études et Recherches Agronomiques et sur des clefs dichotomiques de Delvare et al. (1999). Les espèces indéterminées ont également été prises en considération.
8Pour les analyses statistiques des données, l’ensemble des données a été soumis à une analyse de variance à un critère de classification. Une comparaison multiple Post-Hoc des moyennes selon le test de Fisher au seuil de 5% a été également réalisée. les indices de diversité suivants ont été calculés : l’indice de Shannon-Weaver qui prend en compte le nombre d’espèces présentes dans un échantillon mais aussi l’abondance de chaque espèce et la taille totale de l’effectif (Ramade, 2003), dont la formule est la suivante :
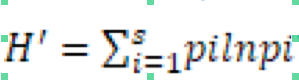
9Avec H’: indice de biodiversité de Shannon; i: une espèce du milieu d’étude ; Pi: la fréquence relative de l’espèce.
10La diversité spécifique a été mesurée à l’aide de l’indice de Simpson (1/D) qui ne tient pas compte des espèces rares. Cet indice se calcule avec la formule suivante :
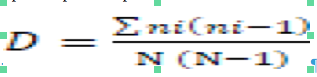
11Avec D: Indice de Simpson; ni: nombre d’individus de l’espèce i ; N: nombre total d’individus.
12L’équitabilité J d’un échantillon représente le rapport de la diversité spécifique observée à la diversité maximale théorique pouvant être obtenue avec le même nombre d’espèces. Cet indice de Pielou varie entre 0 et 1. Si toutes les espèces d’un échantillon ont la même abondance alors l’indice (J’) sera égal à 1. Il est calculé à partir de l’indice de Shannon-Weaver :
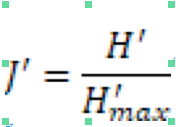
13de la richesse spécifique du point.
14Il renseigne sur la répartition de l’abondance relative de chaque espèce dans un échantillon, c'est-à-dire sur la structure de l’échantillon en termes de diversité spécifique.
15La diversité compositionnelle a été calculée à partir des coefficients de Bray-Curtis (Cs) (Bray & Curtis, 1957). Il est préféré au coefficient de similarité de Jaccard, car il donne deux fois plus de poids à la présence conjointe de deux espèces au même endroit qu’à la présence de l’une des deux espèces seulement. Ce coefficient est utilisé lorsque les inventaires sont insuffisants ou relativement variables.
16L’indice de Bray-Curtis est calculé par la formule :
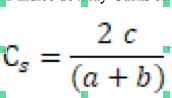
17Avec c : nombre d’espèces communes aux deux modalités ; a et b : nombre d’espèces présentes dans chacune des deux répétitions.
18Les logiciels Past et BioDiversy Pro ont servi aux calculs de ces indices.
Résultats et discussion
19Les captures effectuées au cours des campagnes d’échantillonnage ont permis d’inventorier trois mille neuf cent quatre-vingt-cinq (3985) individus dans toutes les parcelles (Tableau 1).
20Deux mille six cent soixante-sept (2667) insectes ont été collectés dans les parcelles forestières (Tableau 1). Ces insectes se composent de trente-neuf (39) espèces réparties dans vingt-sept (27) familles. Les Orthoptères sont les plus nombreux avec 22,6% des insectes collectés, suivis par les Coléoptères (21,8%), les Isoptères (19,0%) et les Hyménoptères (14,8%). Dans la savane, mille trois cent dix-huit (1318) insectes ont été collectés, pour un total de trente-cinq (35) espèces réparties dans vingt-six (26) familles. Les Coléoptères sont cette fois-ci les plus nombreux avec 34,1%, suivis des Isoptères (23,3%), des Diptères (13,4%), et des Orthoptères (12,2%).
21Il apparait de légères différences de richesse spécifique entre les parcelles situées en milieu forestier et celles situées en savane. La forêt représente la plus forte richesse spécifique (Tableau 1). La dynamique de répartition des insectes dans les champs est différente selon qu’il s’agit des parcelles des champs situés en forêt ou en savane. Les conditions microclimatiques différentes seraient certainement à la base des fluctuations des effectifs des ordres des insectes (Milau et al., 2016).
22Les récoltes ne sont pas constantes au fil des mois : juillet et août sont les plus riches en nombre d’espèces. Ces mois présentent également le nombre d’individus par espèce plus important pour la plupart des taxa recensées (Tableau 2).Les familles les plus abondantes dans les parcelles situées en forêt sont les Acrididae (Orthoptera), suivies des Formicidae (Hymenoptera) et les Coccinellidae (Coleoptera). En savane, les familles les plus abondantes sont les Coccinellidae (Coleoptera), suivies des Nasutitermitinae (Isoptera) et des Macrotermitinae (Isoptera). Nous n’avons pas inclus les cochenilles, qui sont toujours présentes en grand nombre sur les feuilles de manioc, mais dont les captures ne sont pas aisées. Les termites et les fourmis sont certainement plus nombreux. D’autres méthodes de collecte auraient pu être appliquées pour ces groupes particuliers mais ce n’était pas l’objet ciblé de cette étude.
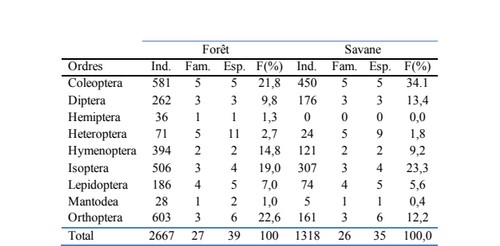
Tableau 1. Richesse spécifique et importance des ordres et familles d’insectes capturés
Ind : nombre d’individus ; Fam : nombre de famille ; Esp : nombre d’espèces ; F(%) : proportion en % du nombre total d’individus capturés
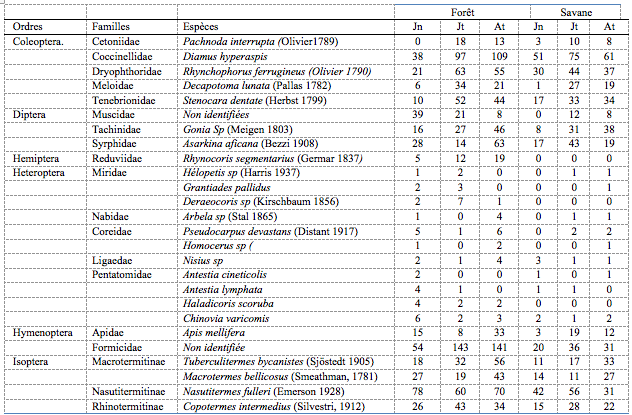
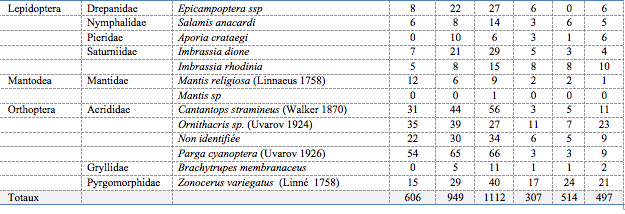
Tableau 2. Répartition des insectes inventoriés par ordres, familles et espèces en fonction des périodes de capture
Juin (Jn) ; Juillet (Jt) ; Août (At)
Les Coléoptères
23Cet ordre regroupe un grand nombre d’espèces xylophages et phytophages. Les adultes sont aussi floricoles (Brown, 1991). Ils sont abondants en juillet et août, les mois où l’humidité est la plus élevée, ce qui est important pour leur développement. Ils causent des dégâts sur les feuilles et les fleurs (Shanker & Dhyani, 2006). Parmi les Coléoptères récoltés on retrouve des Cetoniidae représentés par une seule espèce : Pachnoda interrupta. Les larves de cette espèce consomment les matières végétales en décomposition, les excréments et le bois. Les adultes consomment surtout la sève, le pollen et les fruits (Shanker & Dhyani, 2006).
24Une seule Coccinellidae : Diamus hyperaspis a été capturée, il s’agit d’une auxiliaire entomophage avérée pour les pucerons et les cochenilles (Hemptinne & Majerus, 2005). Cela explique sa présence en grand nombre.
25Les Dryophthoridae capturés sont composés d’une seule espèce aussi : Rhynchophorus ferrugineus connue pour les dommages considérables qu’elle cause aux plantations de cocotiers et palmiers.
26Une seule Meloidae a été observée : Decapotoma lunata. Les adultes fréquentent les fleurs et se nourrissent de pollen tandis que les larves sont prédatrices d’autres insectes.
27Les Tenebrionidae sont aussi représentés par une seule espèce : Stenocara dentata. Elle est signalée comme nuisible sur plusieurs plantes cultivées.
Les Diptères
28Trois familles de Diptères ont été capturées à savoir : les Muscidae, les Tachinidae : Gonia sp et les Syrphidae.
29Les adultes se nourrissent du nectar et du pollen et contribuent de ce fait à la pollinisation. Certaines larves sont parasites d’arthropodes, notamment de pucerons et de larves d’autres insectes.
Les Homoptères
30Les Homoptères sont représentés par une seule espèce récoltée : Rhynocoris segmentarius. Ces Reduviidae sont en majorité des ravageurs causant des dégâts non négligeables aux fleurs et aux fruits.
31D’autres sont des auxiliaires entomophages. Ils pullulent au mois d’août lors de la floraison des plantes. Les Homoptères représentent une très faible proportion des effectifs observés.
32Les espèces observées d’Hétéroptères appartiennent aux familles des Miridae, Nabidae, Coreidae et Pentatomidae. La plupart des espèces capturées sont signalées comme ravageurs des cultures au Nicaragua par Grimm & Maes (1997) et au Sénégal par Terren et al. (2009). Elles causent des dégâts non négligeables aux fleurs et aux fruits notamment en suçant la sève et le contenu liquide des fruits immatures et provoquent des malformations des graines.
33Les Miridae : Hélopetis sp, Grantiades pallidus et Deracocoris sp. sont signalés comme nuisibles pour les plantes cultivées étant des éventuels vecteurs des maladies. Les dommages causés par leurs piqures ont souvent été importants dans des cultures. Par contre, certains Miridae sont des auxiliaires entomophages (Terren et al., 2009).
34Les Nabidae sont des punaises prédatrices, voraces qui consomment des proies variées. L’espèce rencontrée durant la campagne est Arbela sp. Elles se nourrissent d’acariens, des chenilles et des pucerons et constituent d’utiles auxiliaires pour l’agriculture (Pericart, 1987).
35Les Coreidae sont bien représentées en zone tropicale. Ces punaises, souvent de grande taille, sont phytophages et se nourrissent du contenu des fruits ou de leurs graines ou par prélèvement de sève après piqûre de divers organes (tiges, méristèmes, boutons, pétioles, feuilles). Les deux espèces capturées Pseudotheraptus devastans et Homocerus sp ont un statut de ravageur de diverses plantes cultivées dont le manioc. D’autres Coreidae comptent parmi les espèces qui peuvent causer d’importants dégâts (Moulet, 1995).
36Les Lygaeidae sont des punaises phytophages, granivores, parfois prédatrices et hématophages de rongeurs (Forey & Fitzsimons, 1992). L’espèce Nisius sp que nous avons capturée prélève la sève de diverses plantes sans qu’on puisse affirmer qu’elle soit inféodée à une espèce précise (Pericart, 1998).
37Les Pentatomidae sont des punaises se nourrissant essentiellement aux dépens des fruits et de leurs graines. Elles ont la réputation de passer d’une plante ou d’une culture à une autre, suivant l’attractivité du stade phénologique. Antestia cineticolis, Antestia lymphata, Haladicoris scoruba et Chinovia varicomis sont les quatre espèces capturées. Harper (1997) reconnait cependant qu’il reste difficile de déterminer la spécificité de l’impact de chacune de ces punaises dans les dégâts constatés.
Les Hyménoptères
38Plusieurs Hyménoptères ont été capturés, les familles rencontrées sont les Apidae et le Formicidae. Les Apidae constituent une des plus importantes familles de pollinisateurs dans les régions tropicales. Une seule espèce Apis mellifera a été capturée. Sa présence coïncide effectivement avec la floraison des certaines plantes. Grimm & Maes (1997) ainsi que Solomon & Ezradanam (2002) ont démontré que cette abeille domestique présente une activité pollinisatrice globalement plus élevée que celle des autres insectes floricoles du fait de son régime alimentaire et de son comportement de butinage.
39Les Formicidae ont des mœurs variées (Foottit & Richards, 1993), certaines espèces peuvent être dommageables à l’agriculture en se nourrissant de nectar. En revanche, d’autres fourmis peuvent s’avérer fort utiles par leur prédation d’insectes nuisibles ou l’ingestion de miellat sécrété par certains insectes suceurs de sève, comme les pucerons, les cicadelles et les cochenilles. Cela explique la présence de nombreuses fourmis observées sur les feuilles et les tiges. Les individus rencontrés au niveau des champs lors de nos prospections n’ont pas été identifiés.
Les Isoptères
40Les Isoptères constituent un ordre assez important de par le nombre d’espèces et d’individus que nous avons rencontrés, surtout en savane.
41Parmi les individus capturés on retrouve des Macrotermitinae : Tuberculitermes bycanistes et Macrotermes bellicosus; des Nasutitermitinae : Nasutitermes fulleri et des Rhinotermitinae : Copotermes intermedius. Ces insectes sociaux sont surtout connus pour les dégâts qu’ils causent aux cultures (Zaremski et al., 2009). En dévorant les radicelles et les parties externes des racines, du tronc et des branches, ils provoquent de nombreux dépérissements.
42Tuberculitermes bycanistes (Macrotermitinae) est un termite humivore. Dans certains cas, il se nourrit aussi des tubercules et des matières organiques en décomposition. La présence de cet humivore est en parfaite relation avec sa biologie. En effet, en laissant tomber des feuilles mortes, brindilles sèches sur le sol, et en produisant des tubercules, les champs agricoles offrent des conditions idéales et une importante quantité de matières organiques pour la survie de ce termite (Kifukieto et al., 2014).
43Récoltée dans les champs de Manioc, Macrotermes bellicosus (Macrotermitinae) est une espèce champignonniste. Elle attaque aussi le tronc de certaines plantes (comme le manioc) déjà affaibli par une pourriture du collet dont il se sert dans sa relation symbiotique qu’il entretient avec un champignon du genre Termitomyces qui lui facilite la dégradation des aliments (Guedegbe et al., 2008 ; Kifukieto et al., 2014).
44Nasutitermes fulleri (Nasutitermitinae) et Copotermes intermedius (Rhinotermitinae) sont des termites xylophages (Soki, 1994). Dans leur activité d’alimentation, ils sont assistés par des zooflagellés dans la dégradation de la cellulose, provoquant ainsi des dégâts non négligeables aux végétaux (Eggleton & Tayasu, 2001; Kifukieto et al., 2014). Leur présence dans les champs pourrait être expliquée par l’appétence des feuilles et tiges des maniocs.
Les Lépidoptères
45Les espèces des Lépidoptères capturées sont pour la plupart des papillons appartenant aux familles des Drepanidae : Epicampoptera ssp ; des Nymphalidae : Salamis anacardi ; des Pieridae : Aporia crataegi et des Saturniidae : Imbrassia dione et Imbrassia rhodinia. Les chenilles (larves) parfois comestibles, causent des défoliations aux feuilles et sont très nuisibles, les adultes butinant le nectar des fleurs et représentent une ressource alimentaire importante à de nombreux oiseaux, reptiles, chauves-souris et rongeurs (Shanker & Dhyani, 2006).
Les Mantidés
46Une seule famille est enregistrée (Mantidae). Elle est composée de deux espèces : Mantis religiosa et Mantis sp. Ces insectes sont des auxiliaires entomophages redoutables pour de nombreux insectes (criquets, sauterelles, guêpes, chenilles, punaises, abeilles, mouches, coléoptères…)(Shanker & Dhyani, 2006).
Les Orthoptères
47Les Orthoptères représentent la faune prédominante dans les parcelles en forêt. Parmi les individus capturés on retrouve des Acrididae : Cantantops stramineus, Ornithacris sp., Parga cyanoptera et une espèce non identifiée ; des Gryllidae : Brachytrupes membranaceus et des Pyrgomorphidae : Zonocerus variegatus. Ces espèces sont connues comme des ravageurs redoutables des cultures (Olsen et al., 2000). Ils ont toujours été considérés comme un fléau et une catastrophe naturelle pour les cultures (Tankari, 2001).
Indices de diversité
48L’indice de Shannon varie entre les biotopes. Il est de 1,88a ± 0,05 en moyenne pour les parcelles en forêt, 1,70b ± 0,03 pour les parcelles en savane (F= 35,836 ; P=0,004) (Figure 1). Tandis que l’indice de Simpson est de 0,82a ± 0,04 pour les parcelles en forêt et de 0,78b ± 0,02 pour les parcelles en. Ces valeurs montrent que la diversité des espèces d’insectes collectées est plus élevée en forêt qu’en savane (F= 15,364 ; P=0,017).
49Quant à l’indice d’équirépartition, il est de 0,73a ± 0,03 en moyenne pour les parcelles en forêt et 0,68b ± 0,01 pour les parcelles en savane montrant ainsi une dominance de certaines familles d’insectes en l’occurrence les Acrididae, les Formicidae et les Coccinellidae en forêt et les Coccinellidae, les Nasutitermitinae et les Macrotermitinae en savane (F= 11,115 ; P=0,029).
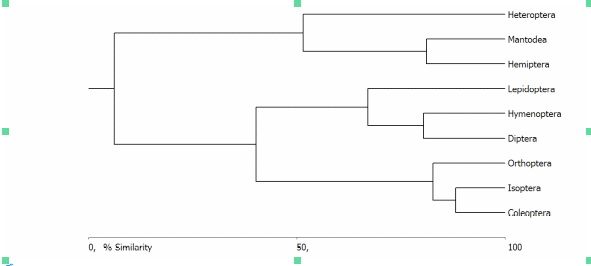
50La diversité a aussi été appréhendée par son aspect compositionnel à l’aide de l’indice de Bray-Curtis (Figure 2). Sur base du dendrogramme de similitude, deux ensembles peuvent globalement être dégagés. Le premier dont la similitude est plus ou moins faible par rapport aux autres ordres tels que des Mantidés et des Hémiptères d’une part et des Hétéroptères d’autre part. Le second ensemble se subdivise en deux sous-ensembles. Le premier dont la similitude est plus ou moins moyenne formé par les ordres des Lépidoptères, des Hyménoptères et des Diptères. Le second dont la similitude est très élevée, est représenté par les ordres des Orthoptères, des Isoptères et des Coléoptères. Ceci s’explique du fait que les ordres entomologiques récoltés présentent peu d’homogénéité phénologique d’une part et éthologique d’autre part.
Figure 1. Indices de diversité des insectes (CMF : champs de manioc situés en forêt ; CMS : champs de manioc situés en savane)
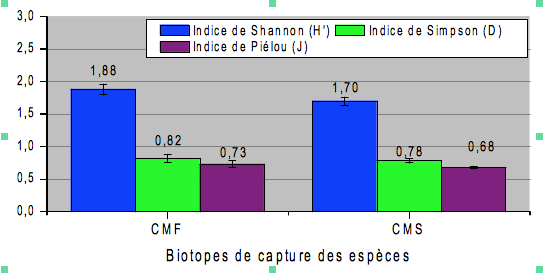
Figure 2 : Dendrogramme de similarité entre les différents ordres entomologiques
Conclusions
51L’objectif de cette étude a été d’observer si les populations d’insectes diffèrent entre les champs de manioc situés dans la forêt et les champs situés en pleine savane. Les champs situés dans le milieu forestier semblent attirer à la fois un plus grand nombre et une plus grande diversité d’insectes durant les trois mois concernés. Il reste donc à vérifier si cet effet est dû à la diversité végétale. En effet, aucune réelle affinité des insectes pour l’un ou l’autre milieu n’est avérée. Pour confirmer ces résultats, il serait intéressant de réitérer l’étude sur une période d’au moins une année en intégrant les variations saisonnières avec des méthodes de piégeage supplémentaires, en vue de faire la part éventuelle entre un effet « habitat » global d'un effet diversité ligneuse ou biomasse. Il serait aussi opportun de sélectionner certaines familles ciblées et identifier les relations précisées entre les espèces entomologiques observées et les taxa végétaux hôtes.
Bosquée E., Lopez T., Laurent S., Ju Lian C., Liu Y. & Frédéric F., 2014. Impacts d’une association culturale de pois et de pommes de terre sur les pucerons et auxiliaires aphidiphages en Chine. Entomologie Faunistique, 67, 97-104.
Bray J.R. & Curtis J.T. 1957. An ordination of the upland forest communities of southern Wisconsin. Ecological Monographs, 27: 325-349.
Brown M.W, Glenn D.M. & Wisniewski M.E. 1991. Functional and anatomical disruption of apple roots by the woolly apple aphid (Homoptera: Aphididae). Journal of Economic Entomology, 84, 1823-1826.
Delvare G. & Aberlenc H. 1999. Les insectes d’Afrique et d’Amérique tropicale. Clés pour la recommandation des familles. Clamecy : Imprimerie caballery.
Eggleton P.P. & Tayasu I. 2001. Feeding group, lifetypes and the global ecology of termites, Ecological research, 16: 941-960.
Foottit R.G. & Richards W.R. 1993. Part 22: The genera of the Aphids of Canada, Homoptera : Aphidoidea and Phylloxeroidea. In The Insects and Arachnids of Canada. Centre for Land and Biological Resources Research, Agriculture Canada, Ottawa, 766p.
Forey P. & C. Fitzsimons. 1992. Les Insectes. Paris: Librairie Grund.
Grimm C. & Maes J.M. 1997. Arthropod fauna associated with Jatropha curcas L. in Nicaragua: A Synopsis of Species, their Biology and Pest Status, In Gubitz G.M., Mithelbach M and Trabi M.,eds . Symposium on Biofuel and Industrial Products from Jatropha curcass and other Tropical Oil Seed Plants, February 23-27 1997, Managua, Nicaragua.
Guedegbe 2008. Diversité, origine et caractérisation de la mycoflore des meules de Macrotermintinae (Isoptera, Termitidae). Thèse université de Paris-Est, Science du vivant [q-bio] (France).
Harper P. 1997. Les insectes : caractéristiques des ordres et familles d’insectes. Université de Montréal, Canada :167pp
Habiyaremye M.F., Nlandu L. & Malio N., 2011, Habitats de la Réserve et Domaine de Chasse de Bombo-Lumene (R.D. Congo). Lexique Kiteke des plantes observées dans ces milieux, Institut Congolais pour la Conservation de la Nature, 144.
Hemptinne J-L., Magro A. & Majerus MEN. 2005. Les Cochenilles. Edition Delachaux & Niestle, Paris.
Kifukieto Carmel, Jean Deligne, Claude Kachaka & Fréderic Francis, 2014. Inventaire préliminaire des termites (Isoptera) du plateau des Batékés en République Démocratique du Congo. Entomologie Faunistique 67, 49-67.
Krell F.T. 2004. Parataxonomy vs. taxonomy in biodiversity studies—pitfalls and applicability of ‘morphospecies’ sorting, Biodiversity Conservator 13, p 795–812.
Lavelle P., Decaëns T., Aubert M., Barot S., Blouin M., Bureau F., Margerie P., Mora P. & Rossi J.P. (2006). Soil invertebrates and ecosystem services, European Journal of Soil Biology, 42, p 3–15.
Le Féon V. 2010. Insectes pollinisateurs dans les paysages agricoles : approche pluri-échelle du rôle des habitats semi-naturels, des pratiques agricoles et des cultures entomophiles. Ecologie, Environnement. Université Rennes 1, 257 p.
Loreau M. 2000. Biodiversity and ecosystem functioning: recent theoretical advances, Oikos 91, p 3–1.
Milau Fils Kifukieto C., Kachaka C., Aloni J. & Francis F. 2016. Contribution à l’étude de la faune associée à la décomposition du bois (Isoptera et Haplotaxida) à Bombo-Lumene au plateau des Batékés (RDC). Entomologie Faunistique 69, 37-44.
Moulet P. 1995. Hémiptères Coreoidea Euro-Mediterranéens. Faune de France n° 61. In : Bulletin mensuel de la Société linnéenne de Lyon, n° 10, pp.297-298.
Oudjiane A., Doumandji S., Daoudi-Hacini S & Boussad F. 2014. Biodiversity of entomological inventories in the Tigzirt region.AFPP-Proccdings of the Tenth International Conference on Agricultural Pests, 22-23 October, Montpellier France, pp:1-7.
Pericart J. 1998. Faune de France (84). Lygaeidae Euro-méditerranéens. Faune de France n°84, ed. Féd. Fr. Soc. Sc. Nat. 57 rue Cuvier, 75231 Paris Cedex 05, 418 p.
Pericart J., 1987. Hémiptères Nabidae d’Europe occidentale et du Maghreb. Faune de France n°71, ed. Féd. Fr. Soc. Sc. Nat. 57 rue Cuvier, 75231 Paris Cedex 05, 185 p.
Ramade F. 2003. Eléments d’écologie- écologie fondamentale. 3e édition. Dunod. Paris.
Rodriguez-Saona C., Blaauw B.R. & Isaacs R. 2012 Manipulation of natural enemies in agroecosystems: habitat and semiochemicals for sustainable insect pest control. in: integrated Pest Management and Pest Control, Current and Future Tactics. Soloneski S, Larramendy ML (Eds), in Tech Publishing, ISBN 978-953-307-926-4.
Shanker C. & Dhyani S.K. 2006. Insect pests of Jatropha curcas L. and the potential for their management. Current Science, 2 (91), 162-163.
Soki K. 1994. Biologie et écologie des termites (Isoptera) des forêts ombrophiles du nord -est du Zaïre (Kisangani). Thèse de doctorat, Université libre de Bruxelles (Belgique).
Solomon R.A.J. & Ezradanam V. 2002. Pollination, ecology and fruiting behavior in a monoecious species, Jatropha curcas L. (Euphorbiaceae). Current science, 11, p. 1395-1398.
Tankari D., 2001. Etude comparative de la toxicité des extraits de trois plantes acridifuges sur les larves du cinquième stade et sur les adultes de Schistocerca grégaria Forskal, 1775 (Orthoptera, Cyartacantacridinae). In : 5e journéé d’Acridilogie. (ed.), Institut National Agronomie, Département de Zoologie Agricole et forestière, El Harrach (Alger), P. 37-46
Terren M., Mignon J., Haubruge E., Winandy S., Saverys S., Jacquet de Haverskercke P., Toussaint A., Baudoin J.P. & Mergeai G. 2009. Nouveaux ennemis de Jatropha curcas L. identifiés au Sénégal. Poster. In : Dixième animation scientifique régionale du Réseau BIOVEG de l’AUF, du 10 au 13 nov. 2009, Dakar, Sénégal.
Wratten S.D., Gurr G.M., Tylianakis J.M. & Robinson K.A. 2007. Cultural control. In van Emden H.F. & Harrington R. (éd.), Aphids as Crop Pests, p. 423-445. CAB International, Cambridge, Massachusetts.
Zaremski A., Fouquet D. & Louppe D. 2009. Les termites dans le monde. Versailles : Ed. Quae, 93 p.
Bibliographie
Bartomeus I., Montserrat V. & Steffan-Dewenter I, 2010. Combined effect of Impatiens glandulifera invasion and landscape structure on native plant pollination. Journal of Ecology, 98, 440-450.