- Startpagina tijdschrift
- Volume 73 (2020)
- Structure des assemblages de termites (Insecta : Blattodea) le long d’un gradient d’âge d’anacardiers (Anacardium occidentale L.) dans la région de Ferké (Côte d’Ivoire)
Weergave(s): 1701 (45 ULiège)
Download(s): 104 (0 ULiège)
Structure des assemblages de termites (Insecta : Blattodea) le long d’un gradient d’âge d’anacardiers (Anacardium occidentale L.) dans la région de Ferké (Côte d’Ivoire)
Diversité des termites des anacardiers de la région de Ferké (Côte d’Ivoire)

Documenten bij dit artikel
Version PDF originaleRésumé
Une étude a été effectuée sur la diversité des termites dans trois parcelles d’anacardes dans la région de Ferké. L’objectif principal de cette étude était de rechercher l’effet de la mise en culture des terres sur la composition de la faune termitique dans ces plantations en fonction d’un gradient d’âge. Ainsi, les parcelles d’anacardes de 3 ans, de 14 ans et de plus de 20 ans ont été choisies. Des transects de 100 m de long et 2 m de large subdivisés en 20 sections consécutives de 5 m x 2 m ont été utilisés pour la collecte des termites. Les résultats obtenus ont permis de répertorier treize espèces de termites qui se répartissent en 2 familles et 5 sous-familles. Les espèces se présentent comme suit : Odontotermes sp., Macrotermes bellicosus, Ancistrotermes guineensis, Ancistrotermes crucifer, Pseudacanthotermes militaris, Trinervitermes geminatus, Trinervitermes togoensis, Trinervitermes oeconomus, Fulleritermes tenebricus, Amitermes evuncifer, Fastigitermes sp., Cubitermes sp. et Coptotermes sp. dont trois espèces sont communes aux trois milieux (F. tenebricus, A. crucifer et A. guineensis). L’indice de Shannon (H’) est relativement élevé dans la parcelle de 14 ans (H’= 1,80). Les parcelles de plus de 20 ans et de 3 ans enregistrent les plus faibles valeurs avec respectivement, H’= 1,65 et H’= 1,58. Au total, quatre groupes trophiques ont été recensés. On note les champignonnistes, les xylophages, les fourrageurs et enfin les humivores. Les champignonnistes sont très abondants dans les parcelles jeunes (3,5 ind/m2), par contre dans les anacardiers âgés, les humivores dominent le peuplement (0,5 ind/m2 à 9 ind/m2).
Abstract
A study was carried out on termite diversity in three plots of cashew nuts in the Ferké region. The main objective of this study was to investigate the effect of land use on termite fauna composition in cashew plantations according to the age. Thus, plots of 3 years old, 14 years old and more than 20 years old were chosen. Transects of 100 m long and 2 m wide subdivided into 20 consecutive sections (5 m x 2 m) were used to sampling termite. The results obtained identified thirteen termite species divided into two families and five sub-families. The species are as follows: Odontotermes sp, Macrotermes bellicosus, Ancistrotermes guineensis, Ancistrotermes crucifer, Pseudacanthotermes militaris, Trinervitermes geminatus, Trinervitermes togoensis, Trinervitermes oeconomus, Fulleritermes tenebricus, Amitermes evuncifer, Fastigitermes sp.; Cubitermes sp. and Coptotermes sp. of which three species are common to all three plots (Fulleritermes tenebricus, Ancistrotermes crucifer and Ancistrotermes guineensis). Shannon index is relatively high in the 14-year-old cashew plot (H’ = 1.80). Cashew plots of more than 20 years and 3 years record the lowest values of Shannon index, with H'= 1.65 and H' = 1.58 respectively. In total, four (4) trophic groups were identified. Fungus growers are very abundant in young plots (3.5 ind/m2), whereas in older cashew trees, humivores dominate the stand (0.5 ind/m2 to 9 ind/m2).
Inhoudstafel
1. INTRODUCTION
1Les termites sont des insectes appartenant à l’ordre des Blattoptères. Ils sont largement distribués dans le monde, particulièrement dans les régions tropicales, subtropicales et semi-arides (Eggleton, 2000). Ils constituent également l’un des plus importants groupes d’insectes nuisibles aux plantes cultivées (Mora, 1992 ; Tra Bi et al., 2019) et aux bâtiments (Cachan, 1951 ; Tenon et al., 2018). Les termites vivent dans le sol, certains genres établissent leurs nids dans les arbres mais gardent toujours un contact avec le sol. Ils forment des sociétés très élaborées et semblent avoir atteint, comme les Hyménoptères (abeilles, fourmis…), un haut degré d’organisation sociale (Wilson, 1971). Cette organisation fait intervenir des régulations complexes et sophistiquées, notamment pour assurer une bonne coordination des activités collectives. Ceci est d’autant plus important que dans les nids, chez les termites, on observe une très grande spécialisation des individus au sein de la société : ouvriers et soldats étant aptères, roi et reine provenant d’individu mâle et femelle ailés, observables pendant la période d’essaimage. Le nombre d’espèces de termites décrites ne cessent d’augmenter. Actuellement, on compte environ 2900 espèces, 270 genres, 14 sous-familles réparties dans 7 familles (Angel & Krishna, 2004). Sur les 2900 espèces identifiées dans le monde, plus de 1000 espèces sont présentes sur le continent africain (Langewal et al., 2003). La répartition des termites à l’échelle du globe se traduit par une diversité et une abondance qui varient d’un écosystème à un autre en fonction du climat, du type de sol et de la végétation (Eggleton, 2000). Divers travaux réalisés en Afrique de l’ouest ont montré que lorsque la pluviosité augmente, en passant de la végétation sahélienne aux savanes soudanienne et guinéenne à la forêt tropicale, la richesse spécifique des termites augmente (Gbenyedji et al., 2011). En outre, dans les milieux cultivés, les peuplements de termites restent moins importants qu’en savanes environnantes (Kouassi, 1999).
2En Côte d’Ivoire, quelques travaux portant sur la diversité de la faune termitique ont été réalisés dans les champs d’igname (Foua-Bi, 1983), les rizières et les parcelles de maïs (Akpesse et al., 2008), dans les palmeraies (Han et al., 1998), l’hévéaculture (Koudou et al., 2004; Tahiri & Mangue, 2007), les plantations de cacaoyers (Tra Bi et al., 2012) et récemment les vergers de mangue (Coulibaly et al., 2013).
3Cependant, les plantations d’anacardes n’ont pas encore fait l’objet d’une étude portant sur la composition spécifique et trophique des termites qu’elles abritent. Aussi, leur action néfaste dans les vergers d’anacarde demeure également inconnue. C’est dans le but d’apprécier le mode d’assemblage de la faune termitique dans ces milieux que cette étude a été menée dans la région de Ferké, grande zone de production de noix de cajou. Cette étude a pour objectif général de déterminer la diversité et l’abondance relative des termites dans un gradient d’âge de vergers d’anacarde et plus spécifiquement : (1) de faire l’inventaire de la faune termitique dans ces différents milieux, (2) de déterminer les différents groupes trophiques des termites présents, et (3) d’étudier l’effet de l’âge des vergers sur l’installation des termites.
2. MATERIEL ET METHODES
2.1. Milieu d’étude
Situation géographique
4Les travaux se sont déroulés au nord de la Côte d’Ivoire, dans la région de Ferké à 585 km d’Abidjan la capitale économique et à 360 km de Yamoussoukro la capitale politique. Le Département est situé entre 9°20’ et 9°60’de latitude Nord et 5°22’ et 5°40’ de longitude Ouest. Il est délimité au Nord par la ville d’Ouangolodougou, à l’Ouest par le département de Korhogo, au Sud par la ville de Tafiré et à l’Est par celle de Kong.
Climat
5Le climat de la région de Ferké est de type tropical sec avec deux saisons : l’une sèche, de novembre à avril et l’autre humide, de mai à octobre (Péné et al., 2012). La saison pluvieuse va de mai à octobre avec un maximum de précipitations en août. De mi-novembre à fin janvier souffle l’harmattan (Péné & Kéhé, 2005). Les écarts thermiques journaliers s’établissent au-delà de 20°C avec une humidité relative de l’air atteignant parfois 30-35 % (Péné et al., 2012). De mars à avril, les températures oscillent entre 29° et 40° (Kouamé et al., 2010 ; Péné et al., 2012).
Pluviométrie et hydrographie
6La pluviométrie de la région est marquée par deux maxima, l'un en août et l'autre en septembre cumulant presque la moitié de la quantité moyenne annuelle des précipitations à environ 1200 mm (Péné & Kéhé, 2005 ; Kouamé et al., 2010 ; Péné et al., 2012). Deux principaux cours d’eau arrosent la région : le Bandama qui sert de limite avec le Département de Sinématiali et la Comoé ou Laléraba qui prend sa source au Burkina-Faso puis sert également de frontière naturelle avec ce pays et la Sous-préfecture de Kong. Il y a également le Lokpoho, importante rivière pourvoyeuse d’eau de Ferké ainsi que le N’zi, affluent du fleuve Bandama.
Végétation
7La végétation de la région de Ferké appartient au type soudanais. Ainsi, on distingue les forêts claires à sous-bois herbacés, des savanes boisées, arborées, et arbustives. Cette végétation est parsemée de vergers de mangue, d’anacarde, de plantations de maïs, de riz. Cette végétation est également propice à l’élevage de bovins et ovins.
2.2. Méthodologie
Choix des parcelles d’échantillonnage
8Au total, trois vergers d’anacarde ont été prospectés. Deux transects ont été délimités dans un verger de trois ans. Dans les vergers de quatorze ans et plus de vingt ans, trois transects termites (Jones & Eggleton, 2000) ont été installés
Figure 1 : Différents sites d’échantillonnage de la faune termitique de Ferké



A : verger d’anacarde de 3 ans ; B : verger d’anacarde de 14 ans ; C : verger d’anacarde de plus de 20 ans
Echantillonnage des termites
9L’échantillonnage des termites a été effectué par la méthode standardisée préconisée pour la récolte des termites en forêt (Jones & Eggleton, 2000 ; Tra Bi et al., 2012). Elle consiste à délimiter 20 sections de 10 m² (5 m x 2 m) de surface le long d’un transect de 100 m de long et 2 m de large dans les cacaoyères et la forêt primaire. Chaque section est échantillonnée de la manière suivante : (1) la litière et les structures biogéniques au sol et au-dessus du sol, jusqu’à 1,5 m de hauteur sont fouillées à la recherche de termites ; (2) douze monolithes de sol de 12 cm x 12 cm de côté et 10 cm d’épaisseur sont extraits par section et fouillés à la recherche de termites ; (3) les termites récoltés sont conservés dans l’alcool à 70°. Chaque section est échantillonnée par deux personnes pendant trente minutes.
Identification des spécimens
10Les termites récoltés ont été déterminés jusqu’à l’espèce sous loupe binoculaire (LEICA), en utilisant les clés d’identification de Sjöstedt (1926), Ahmad (1950), Bouillon & Mathot (1965), Sands (1965, 1992 & 1998) et Roy-Noel (1966). Ensuite, chaque espèce a été classée dans un des quatre groupes trophiques (les champignonnistes, les humivores, les fourrageurs et les xylophages).
Analyse de la structure du peuplement
11L’abondance relative (A) des termites dans le transect est le nombre total de rencontres d’une espèce i récoltée dans le transect divisé par la surface totale des sections. Elle est basée sur l’incidence (présence = 1 et absence = 0) de l’espèce considérée.
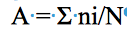
12ni = incidence de l’individu de l’espèce i dans le transect; N = nombre total de sections du transect multiplié par la surface d’une section (10 m2) dans un milieu considéré.
13La richesse spécifique (S) correspond au nombre total d’espèces de termites échantillonnées dans un milieu donné (Morin & Findlay, 2001). Par correspondance, la richesse générique est le nombre total de genres échantillonnés dans un milieu donné.
14La diversité spécifique peut être approchée par un indice rendant compte à la fois, de la richesse spécifique et de l’abondance des différentes espèces. L’indice de Shannon (H’) prend en compte le nombre de taxons rencontrés sur une parcelle (Magurran, 2004). Quand H’ tend vers 0, la diversité est minimale. Elle est maximale quand elle tend vers H’ = 5.
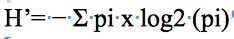
15pi= probabilité de rencontre de l’espèce i
16L’Indice d’équitabilité (E) mesure la répartition équitable des espèces. Il permet de comparer des peuplements comportant des nombres de taxons différents. L’équitabilité a pour objectif d’observer l’équilibre des populations présentes. E tend vers 0 lorsque le taxon domine un peuplement. Il est égale à 1 lorsque tous les taxons ont la même abondance.
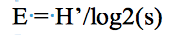
17L’indice de Simpson (D) (Morin & Findlay, 2001) évalue la probabilité que deux individus, tirés au hasard dans une population infinie de N individus appartiennent à la même espèce. Dans cette étude, l’indice "dérivé" de l’indice de Simpson a été utilisé (IS). L’indice de Simpson varie entre 0 et 1. La diversité est minimale pour D = 1 et maximale pour D = 0. Tous ces indices ont été calculés à l’aide du logiciel R (version 2.8) (Ihaka & Gentleman, 1996).
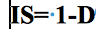
18L’abondance relative des termites entre parcelle a été comparée à partir d’une analyse de variance à un facteur (ANOVA) et les groupes formés ont été séparés à l’aide du Test LSD de Ficher au seuil p< 0,05. Cette analyse a été effectuée à l’aide du logiciel Statistica (version 7.0).
3. RESULTATS
3.1. Inventaire des groupes trophiques
19Au total, quatre groupes trophiques ont été identifiés, toutes les parcelles confondues. On note : les champignonnistes ; les fourrageurs ; les xylophages et les humivores. Les champignonnistes comportent quatre genres (Odontotermes, Macrotermes, Ancistrotermes et Pseudacanthotermes). Ils sont suivis des xylophages avec trois genres et enfin les humivores présents avec deux genres (Cubitermes et Fastigitermes). Les fourrageurs sont les moins représentés avec un genre (Trinervitermes)
Tableau 1 : Liste des espèces de termites récoltés dans différents milieux
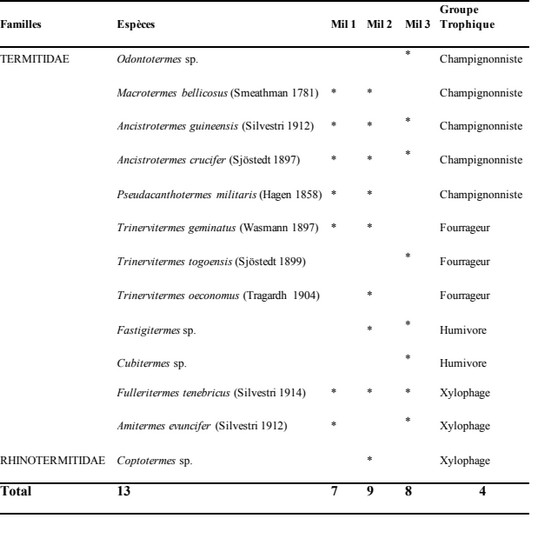
MIL 1 : parcelle d’anacarde de 3 ans ; Mil 2 : parcelle d’anacarde de 14 ans Mil 3 : parcelle d’anacarde de plus de 20 ans ; * : présence de l’espèce dans le milieu
3.2. Diversité des milieux
20L’indice de Shannon est relativement élevé dans la parcelle de 14 ans (H’= 1,80). Les parcelles de plus de 20 ans et de 3 ans enregistrent les valeurs les plus faibles de l’indice de Shannon, avec respectivement H’= 1,65 et H’= 1,58. L’indice de Simpson (IS) suit la même variation que l’indice de Shannon. Il est élevé dans la parcelle de 14 ans (IS= 0,81). Il est suivi par la parcelle de 3 ans (IS= 0,78). La plus faible valeur de l’indice (IS = 0,77) est obtenue dans la parcelle de plus de 20 ans. L’indice d’équitabilité (E) pour cette étude est compris entre 0,79 et 0,82. La valeur la plus élevée est observée dans la parcelle de 14 ans (E= 0,82). On enregistre les valeurs les plus faibles dans les parcelles de 3 ans et de plus de 20 ans avec respectivement des indices E de 0,81 et 0,79
Tableau 2 : Indice de diversité des milieux prospectés
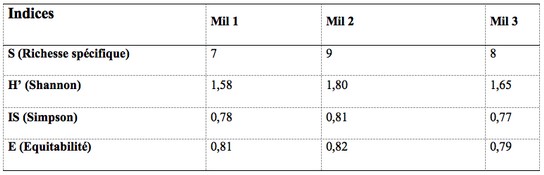
Mil 1 : parcelle d’anacarde de 3 ans ; Mil 2 : parcelle d’anacarde de 114 ans ; Mil 3 : parcelle d’anacarde de plus de 20 ans
3.3. Abondance relative des groupes trophiques selon le milieu
21Le mode d’assemblage des groupes trophiques dans les différents milieux montre nettement que les humivores sont exclusivement présents dans les parcelles âgées de 14 et 20 ans. L’abondance relative est respectivement comprise entre 0,5 ind/m2 et 9 ind/m2
Figure 2 : Variation des groupes trophiques dans les différents milieux
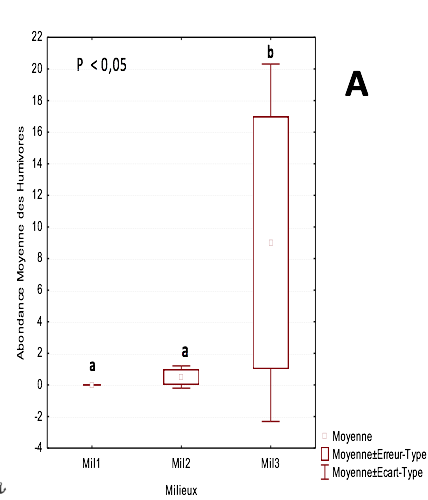
22Ce sont les xylophages qui sont les mieux représentés sur l’ensemble des trois habitats
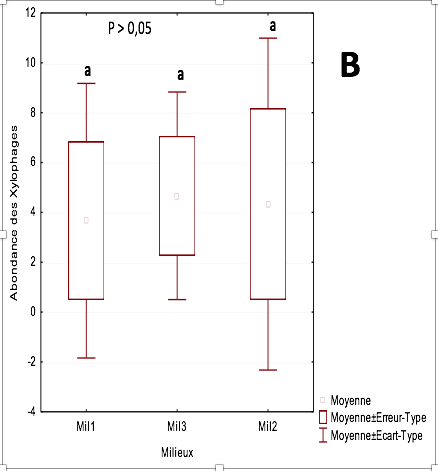
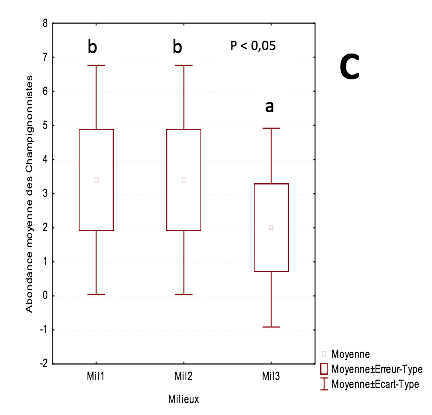
23L’abondance relative moyenne de ce groupe est comprise entre 3,8 ind/m2 dans la parcelle de 3 ans et 4,8 ind/m2 dans la parcelle de plus de 20 ans. Ils sont suivis par les champignonnistes dont l’abondance relative moyenne varie entre 3,5 ind/m2 dans les parcelles de 3 ans et de 14 ans. On enregistre 2 ind/m2 dans la parcelle de plus de 20 ans
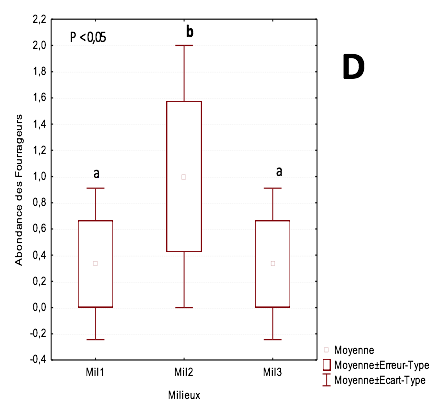
24Par contre, les fourrageurs constituent le groupe trophique le moins abondant avec 0,3 ind/m2 dans les parcelles de 3 ans et de plus 20 ans. Dans la parcelle de 14 ans, 1,3 ind/m2 ont été observés

4. DISCUSSION
25Les termites humivores sont très abondants dans les parcelles âgées de 14 ans et de plus de 20 ans. Ces milieux en pleine reconstitution seraient relativement plus stables que les parcelles jeunes. La quantité de litière et les débris végétaux en décomposition seraient très élevés dans ces parcelles. La strate humique ainsi mise en place serait abondante et propice à l’installation des termites humivores (Cubitermes sp. et Fastigitermes sp.). Ces termites ont un régime alimentaire très complexe (Coulibaly, 2014). Ils s’alimentent à partir de particules organiques en décomposition dans la fraction humique du sol (Yapi, 1991 ; Brauman, 2000). Ils joueraient le même rôle que les vers de terre géophages (Lavelle, 1997). Ces organismes interviennent efficacement dans le recyclage de la matière organique dans les écosystèmes (Black & Okwakol, 1997).
26Les termites champignonnistes sont abondants dans la parcelle jeune de 3 ans. Ce milieu abriterait les ressources nutritives de ces termites ; le bois en décomposition et la litière (Josens, 1972). Dosso et al. (2012) avancent qu’ils sont capables de s’adapter à tous les milieux avec des préférences alimentaires diverses (Kanvaly et al., 2017). En effet, des études réalisées par Coulibaly (2014) dans les vergers de mangue, dans la région voisine de Korhogo, sont en accord avec ceux obtenus lors de cette étude. Ces auteurs ont montré que les champignonnistes sont dominants dans tous les milieux étudiés. La plasticité de ce groupe trophique serait due à la symbiose extra digestive qu’ils établissent avec un champignon supérieur (Basidiomycètes) du genre Termitomyces. Ce champignon faciliterait la dégradation des aliments (Guedegbe et al., 2008 ; Brune et al., 2011). Ainsi, cette symbiose serait un atout majeur dans la colonisation des milieux les plus dégradés (Wood et al., 1980 ; Tondoh, 1992 ; Mora et al.,1996 ; Sileshi et al., 2005). Les xylophages du genre Coptotermes sont exclusivement présents dans la parcelle de 14 ans. Leur présence dans cette parcelle âgée est conforme à son trait écologique. Il se révèle comme étant un véritable ravageur du bois. La maturité des pieds d’anacarde dans cette parcelle constitue une source inépuisable d’aliment. En effet, les Coptotermes s’attaquent aux plantes âgées. Dans les cacaoyères âgées de plus de 25 ans, Tra Bi et al. (2019) ont observé une nette abondance et une attaque massive de ce termite. Ils causent également d’énormes dégâts aux bois de construction (Tenon et al., 2018). Leur voracité serait facilitée par les zooflagellés qui interviendraient dans la dégradation de la cellulose, l’hémicellulose, les tanins et la lignine (Eggleton, 2000 ; Eggleton & Tayasu, 2001).
5. CONCLUSION
27Cette étude a permis d’étudier le mode d’assemblage des termites dans les vergers d’anacarde en fonction d’un gradient d’âge. Il ressort que l’âge des parcelles influence l’installation des termites. Ainsi, la colonisation des termites champignonnistes diminue avec l’âge tandis que celle des xylophages et des humivores augmente. L’analyse des abondances relatives des espèces de termites a révélé également que celle-ci augmente avec l’âge des parcelles. Les xylophages et les humivores se révèlent être de bons indicateurs de la reconstitution de ces milieux fortement dégradés. Ce résultat annonce l’attaque des termites xylophages dans les vergers âgés d’anacarde. Il permet d’envisager les méthodes de lutte efficientes pour une gestion durable de ces ravageurs. Pour y parvenir, une étude portant sur la relation fourmis et termites dans les vergers d’anacarde serait indiquée
Bibliographie
Ahmad M., 1950. The phylogeny of termite genera based on imago-worker mandibles. Bulletin of the American Museum of Natural History (Entomology), 95(2), 86 p
Akpesse A.A., Kouassi K.P., Tano Y. & Lepage M., 2008. Impact des termites les champs paysans de riz et de maïs en savane sub-soudanienne (Booro-Borotou, Côte d’Ivoire). Sciences et Nature, 5(2), 121-131
Angel M.S. & Krishna K., 2004. Family-group names for termites (Isoptera). American Museum novitiates, 3432, 1-9
Black H.I.J & Okwakol M.N.J., 1997. Agricultural intensification, soil biodiversity and agroecosystem function in the tropics: the role of termites. Applied Soil Ecology, 6, 37-53.
Bouillon A. & Mathot G., 1965. Quel est ce termite Africain ? Collection Zooleo n°1. Léopoldville, Congo belge : Editions de l’Université.
Brauman A., 2000. Effect of gut transit and mound deposit on soil organic matter transformations in the soil feeding termite: a review. European Journal of Soil Biology, 36, 117-125.
Brune A., 2011. Microbial Symbioses in the Digestive Tract of Lower Termites. In: Beneficial Microorganisms in Multicellular Life Forms, E. Rosenberg and U. Gophna, (eds.), Springer-Verlag Berlin Heidelberg.
Cachan P., 1951. Les Termites de Madagascar, Mémoire Institut Scientifique de Madagascar, 5, 1-18.
Coulibaly T., Boga J.P., Yapi A. & Kouassi K.P., 2013. Effects of Continuous Cultivation of Soil on Termites (Isoptera) Diversity and Abundance in Savannas of Northern of Côte d’Ivoire. Asian Journal of Agriculture and Rural Development, 3(9), 632-649.
Coulibaly T., 2014. Diversité et dégâts des termites dans les vergers de manguiers (Mangifera indica L., Anacardiaceae) de la région de Korhogo (Côte d’Ivoire) : essai de lutte par utilisation d’extraits aqueux de trois plantes locales. Thèse de doctorat, UFR Biosciences, Université Félix Houphouët Boigny (Abidjan, Côte d’Ivoire).
Dosso K., Yéo K., Konaté S. & Linsenmair K.E., 2012. Importance of protected areas for biodiversity conservation in central Côte d’Ivoire: Comparison of termite assemblages between two neighboring areas under differing levels of disturbance. Journal of Insect Science, 12(131), 1-18.
Eggleton P., 2000. Global patterns of termite diversity. In: Abe, T., Bignell, D.E., Higashi, M. (Eds.), Termites: Evolution, Sociality, Symbiosis, Ecology. Kluwer Academic Publishers, Dordrecht, 25–51.
Eggleton P. & Tayasu I., 2001. Feeding group, life types and the global ecology of termites. Ecological research, 16, 941-960.
Foua-Bi K., 1983. Les déprédateurs animaux des ignames en cours de végétation. In : Séminaire international AUPELF, Les rencontres de l’ENSEA d’Abidjan ; N°1 L’igname, 311-329.
Gbenyedji J.N., Kotoklo E.A., Amevoin K. & Glitho I.A., 2011. Diversité spécifique des termites (Isoptera) dans deux plantations de tecks (Tectona grandis L.) au sud du Togo. International Journal of Biological and Chemical Sciences, 5(2), 755-765.
Guedegbe H., Houngnandan P., Roman J. & Rouland-Lefevre C., 2008. Patterns of substrate degradation by some microfungi from fungus-growing termites combs (Isoptera: Termitidae: Macrotermitinae). Sociobiology, 52(3), 525-541.
Han S H., Tokro G.P., Tano Y. & Lepage M., 1998. Dégâts des termites dans les jeunes plantations de palmiers à huile en Côte d’ivoire : évaluations et méthodes de lutte. Plantations, Recherches, Développement, 5(2), 119-123.
Ihaka R. & Gentleman R., 1996. A language for data analysis and graphics. Journal of Computational and Graphical Statistics, 5, 299-314.
Jones D.T. & Eggleton P., 2000. Sampling termite assemblages in tropical forests: testing a rapid biodiversity assessment protocol. Journal of Applied Ecology, 37, 191-203.
Josens G., 1972. Études biologiques et écologiques des termites (Isoptera) de la savane de Lamto. Thèse de Doctorat de l'Université libre de Bruxelles.
Kanvaly D., Foundiéré K., Kouadio D.K. & Souleymane K., 2017. Décomposition des résidus végétaux par les termites et apport de matière organique au sol dans la région de Lamto (Côte d’Ivoire). Journal of Animal & Plant Sciences, 3(33), 5320-5331.
Kouamé D.K., Péné C.B. & Zouzou M., 2010. Criblage de variétés commerciales de canne à sucre prometteuses dans le périmètre sucrier de Ferké 2 au Nord de la Côte d’Ivoire : Optimisation de la durée de sélection. Science et Nature, 7(1), 97-106.
Kouassi K.P., 1999. Structure et dynamique des groupes trophiques de la macrofaune du sol d’écosystèmes naturels et transformés de la Côte d’ivoire. Thèse d’Etat des Sciences, Université de Cocody, Abidjan.
Koudou G.B., Wahounou P.J. & Tano Y., 2004. Evaluation des antécédents culturaux dans les plantations d’hévéa en basse Côte d’Ivoire. Bioterre, 4, 128-141.
Langewald J., Mitchell J.D., Maniania N.K. & Kooyman C., 2003. Microbial control of termites in Africa. In: P. Neuenschwander, C. Borgameister, and J. Langewald, editors. Biological control in IPM systems in Africa. CAB International, Wallingford, UK.
Lavelle P., 1997. Faunal Activities .and Soil Processes: Adaptive Strategies That Determine Ecosystem Function. Advances in ecological research, 21, 1-40.
Magurran A.E. 2004. Measuring Biological Diversity. Blackwell Science Ltd., Oxford. 256 p.
Matoub M., 1993. La symbiose termite-champignon chez Macrotermes bellicosus (Termitidae : Macrotermitinae) : rôle des enzymes acquises dans la xylanolyse. Thèse de Doctorat, Université Paris XII, Val de Marne.
Mora P., 1992. Dégâts des termites champignonnistes (Macrotermitinae) Pseudacanthotermes spiniger et Microtermes subhyalinus dans les plantations de canne à sucre - Mise au point d'une lutte spécifique. Thèse de Doctorat, Université Paris XII.
Mora P., Rouland C. & Renoux J., 1996. Foraging, nesting and damage caused by Microtermes subhyalinus (Isoptera: Termitidae) in a sugar cane plantation in the Central African Republic. Bulletin of Entomology Research, 86, 387-395.
Morin A. & Findlay S., 2001. Biodiversité: Tendance et processus. Biologie de la Conservation des espèces. Université d’Ottawa: Canada.
Péné C.B., & Kéhé M., 2005. Performances de trois variétés de canne à sucre soumises au rationnement hydrique en prématuration au Nord de la Côte d’Ivoire. Agronomie africaine, 17(1), 7- 18.
Péné C.B., Boua B.M. & Pons P., 2012. Criblage de variétés de canne à sucre sous irrigation en début de campagne sucrière à Ferké 1 en Côte d’Ivoire sur sol ferralitique selon un nouveau schéma de sélection. Congrès sucrier ARTAS / AFCAS 2012, La Réunion.
Roy-Noel J., 1966. Mise au point systématique sur les Coptotermes (Isoptera) du Sénégal. Bulletin de l’IFAN, Serie A, 1, 145-155.
Sands W.A., 1965. A revision of the termite subfamily Nasutitermitinae (Isoptera, Termitidae) from the Ethiopian region. Bulletin of the British Museum (Natural History), (Entomology) Supp., 4, 1-172.
Sands W.A., 1992. The termite genus Amitermes in Africa and the Middle East. Natural Resources Institute (NRI) Bulletin, 51, 147 p.
Sands W.A., 1998. The identification of worker castes of termite genera from soils of Africa and the Middle East. CAB International, New York.
Sileshi G., Mafongoya P.L., Kwesiga F. & Nkunika P., 2005. Termite damage to maize grown in agroforestry systems, traditional fallows and monoculture on nitrogen-limited soils in eastern Zambia. Agriculture and Forest Entomology, 7, 61– 69.
Sjöstedt Y., 1926. Revision der Termiten Afrikas. 3. Monographie. Kunglika Svenska Vetenskapsakademiens Handlingar, (3) 3(1) [1925], 1-419.
Tahiri A. & Mangué J.J., 2007. Stratégies d’attaques de jeunes plants d’hévéa par les termites et effet comparés de deux insecticides utilisés pour leur protection en basse Côte d’Ivoire. Sciences et Nature, 4(1), 45-55.
Tondoh E.J., 1992. Influence de la mise en culture sur le peuplement de la macrofaune du sol enmoyenne Côte-d’Ivoire. Mémoire de DEA, Université Abidjan. Côte-d’Ivoire.
Tra Bi C.S., Boga J.P., Akpesse A.A.M., Konaté S., Kouassi P. & Tano Y., 2012. Diversité et effet de la litière sur l’assemblage des termites (Insecta : Isoptera) épigés le long d’un gradient d’âge de la cacaoculture (Theobroma cacao L.) en moyenne Côte d’Ivoire (Oumé). European Journal of Scientific Research, 79(4), 519-530.
Tra Bi C.S., Coulibaly T., Blei S.H., Souleymane K., Kouassi K.P. & Tano Y., 2019. Attacks of termites (Insecta: Isoptera) in cocoa farms (Theobroma cacao L.) in Oumé (Côte d’Ivoire). International Journal of Current Research, 11(9), 6899-6905.
Tenon C., Crolaud S.T.B. & Kanvaly D., 2018. Diversity and damage of termites in urban zones: the case of the campus of University Péléforo Gon Coulibaly of Korhogo (Côte d’Ivoire). International Journal of Entomology Research, 3(4), 44-50.
Wilson E.O., 1971. The Insect Societies. Belkanap Press of Harvard University Press, Cambridge, Mass.
Wood T.G., Johnson R.A. & Ohiagu C E., 1980. Termite damage and estimation of damage loss in yield and termite (Microtermes) abundance at Mokwa. Tropical Pest Management, 26(3), 241-253.
Yapi A., 1991. Biologie, écologie et métabolisme digestif de quelques espèces de termites humivores de savane. Thèse de Doctorat 3ème cycle, Université d’Abidjan, Côte d’Ivoire.