- Home
- Volume 73 (2020)
- Nouvelle observation de Geoica mimeuri (Gaumont 1930) et description de Forda riccobonii (Stefani 1899) sur Pistacia atlantica Desf. en Algérie
View(s): 1275 (8 ULiège)
Download(s): 158 (1 ULiège)
Nouvelle observation de Geoica mimeuri (Gaumont 1930) et description de Forda riccobonii (Stefani 1899) sur Pistacia atlantica Desf. en Algérie

Attached document(s)
original pdf fileEditor's Notes
Reçu le 5 juillet 2019, accepté le 6 juillet 2020
Résumé
Ce travail porte sur la caractérisation morphologique des galles foliaires et des pucerons responsables de leur formation sur Pistacia atlantica. Des feuilles présentant des galles ont été prélevées sur des arbres adultes localisés dans un peuplement naturel de P. atlantica, situé à Ain Ousserra dans la région de Djelfa, en Algérie. Les galles échantillonnées ont été classées selon leur forme puis leurs fréquences relatives ont été calculées. Une étude morphométrique de ces galles a, également, été réalisée. Des pucerons ailés issus des galles ont été montés sur lames et lamelles puis observés sous microscope optique pour être déterminés puis mesurés (15 caractères). Deux formes de galle, une forme globuleuse provoquée par le puceron Geoica mimeuri (Gaumont 1930) (espèce signalée pour la première fois en Algérie) et une deuxième, en croissant, provoquée par Forda riccobonii (Stefani 1899) ont été déterminées. La fréquence des galles causées par G. mimeuri est environ trois fois plus élevée que celles induites par F. riccobonii. La longueur, le diamètre minimal et maximal des galles de G. mimeuri sont respectivement de 1,38 cm, 1,12 cm et 1,51 cm. La longueur et la largeur des galles de F. riccobonii sont respectivement de 3,37 cm et 0,93 cm. La description morphométrique des pucerons ailés est également précisée dans l’article.
Abstract
This work deals with the morphological characterization of leaf galls and associated aphids on Pistacia atlantica. For this purpose, gall bearing leaves were collected from adult trees in a natural stand of P. atlantica, located in Ain Ousserra in Djelfa region of Algeria. The sampled galls were classified according to their morphology and their relative frequencies were calculated. Winged aphids, from the galls were mounted between slides and cover slips to be observed under an optical microscope to be identified and measured (15 characters). Two forms of galls, a globular form caused by Geoica mimeuri (Gaumont 1930) (reported for the first time in Algeria) and a second, crescent, caused by Forda riccobonii (Stefani 1899) were described. The frequency of galls caused by G. mimeuri was about three times higher than those induced by F. riccobonii. The length, minimum and maximum diameter of G. mimeuri galls were 1.38 cm, 1.12 cm and 1.51 cm, respectively. The length and width of F. riccobonii galls were 3.37 cm and 0.93 cm, respectively. The morphometric description of these winged aphids was also described here.
Table of content
1 INTRODUCTION
1Les pucerons (Hemiptera : Aphidoidea) sont un groupe important d’insectes qui se nourrissent du phloème des plantes qu’ils colonisent (Douglas, 2003; Alvarez, 2012). Ils peuvent limiter la productivité de la plante et transmettre des virus (Dixon, 1998; Shorthouse et al., 2005). Certains aphides, durant leur cycle de vie complexe, provoquent des galles qui sont des structures hautement spécialisées issues d’une croissance atypique de tissus végétaux (Dorchin et al., 2002). Ces structures fournissent aux insectes une nutrition abondante (Price et al., 1986; Zhang & Qiao, 2007), un microenvironnement favorable et une protection contre leurs ennemis naturels (Cornell, 1983; Price et al., 1986, 1987).
2La faune mondiale de pucerons se compose de 5000 espèces réparties dans 510 genres (Blackman & Eastop, 2018). Toutefois, la faune des pucerons d'Afrique du Nord est peu étudiée. Selon Ahmeid Al-Nagar & Nieto Nafría (1998), 158 espèces sont présentes au Maroc, 99 en Egypte, 73 en Libye, 44 en Tunisie et seulement 28 en Algérie. Grâce à l’étude de Boukhris-Bouhachem et al. (2007) sur les pucerons de la pomme de terre, la diversité identifiée s’élevait à 103 espèces en Tunisie. Les études de Laamari et al. (2010, 2013), réalisées en Algérie, ont permis d’évaluer l’aphidofaune à 156 espèces dont certaines se développent sur les plantes du genre Pistacia.
3En Algérie, le genre Pistacia est composé de cinq espèces : P. vera L. 1753, P. lentiscus L. 1753, P. terebinthus L. 1753, P. saportae Burnat 1896 et P. atlantica Desf. 1799 (Belhadj, 2007). A l’exception de P. vera, les autres espèces sont spontanées. Leurs fruits sont utilisés comme source de graines dans la production de porte-greffes, d’huile et de sirop dans les industries cosmétique et pharmaceutique (Al-Saghir & Porter, 2005; Ozden-Tokatli et al., 2010). Quant à Pistacia atlantica (pistachier de l’Atlas), c’est une espèce ligneuse et endémique d’Afrique du Nord (Quézel & Santa, 1963). Elle se caractérise par une plasticité écologique exceptionnelle. En Algérie, elle se localise sur différentes régions semi arides, arides et voire même sahariennes. Sa rusticité la rend intéressante dans les programmes de reforestation et de sylviculture dans ces zones où peu d’espèces d’arbres peuvent s’établir et se développer (Belhadj et al., 2008). Le Pistachier de l’Atlas ne cesse de se dégrader. Une exploitation anarchique, une évolution aggravante du climat et un mauvais état sanitaire des arbres sont autant de facteurs menaçants qui participent à la dégradation de cette ressource naturelle (Benhassaini & Belkhodja, 2004; Belhadj, 2007; Belhadj et al., 2008).
4Une importante partie de la faune phytophage du genre Pistacia est constituée par des pucerons gallicoles (Aphididae : Fordini) (Wool, 2012) qui produisent de grandes variétés de galles, parfois très grandes et élaborées (Blackman & Eastop, 2018). La plupart de ces espèces aphidiennes se trouvent en Asie centrale, en Europe et en Afrique du Nord (Bodenheimer & Swirski, 1957; Koach & Wool, 1977). Selon Blackman & Eastop (2018), quinze espèces de pucerons appartenant à sept genres peuvent se développer sur le Pistachier de l’Atlas. Néanmoins, les études menées sur les pucerons gallicoles qui se développent sur Pistacia spp sont très rares en Algérie (Louzabi et al., 2016). Laamari et al. (2010) ont signalé l’existence de six espèces de pucerons qui se développent sur le genre Pistacia : Baizongia pistaciae (L. 1767), Forda marginata Koch 1857, F. riccobonii (Stefani 1899), F. rotunda Theobald 1914, Paracletus donisthorpei Theobald 1929 et Rectinatus buxtoni Theobald 1914. Les mêmes auteurs ont rapporté l’existence du genre Geoica mais sans citer de nom d’espèces. Selon Blackman & Eastop (2018), le genre Geoica comporte 11 espèces aphidiennes, dont G. mimeuri, jamais décrite en Algérie.
5En raison du manque de travaux réalisés et dans le souci de contribuer à une meilleure connaissance des espèces de pucerons qui se développent sur P. atlantica en Algérie, nous avons entrepris ce travail de recherche qui porte sur la caractérisation morphologique des galles foliaires et des pucerons responsables de leur formation.
2 MATERIEL ET METHODES
2.1 Lieu d’échantillonnage
6Des feuilles de Pistacia atlantica ont été prélevées sur des arbres adultes localisés dans la station d’Ain Oussera, dans la région de Djelfa en Algérie dont les coordonnées géographiques sont 35°21N et 2°57E et présente une altitude de 737 m (Figure 1).
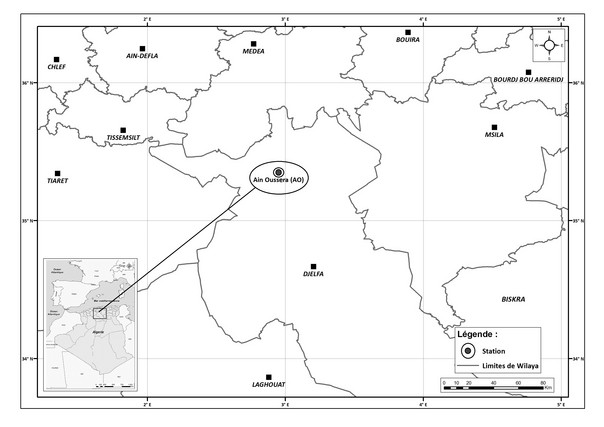
Figure 1. Carte de localisation de la station d’étude
7Afin de déterminer les caractéristiques climatiques de la station d’étude, nous avons pris en considération deux paramètres essentiels, à savoir la pluviométrie et les températures d’une période de 22 ans (1994-2016). Pour connaître la période sèche et l’étage bioclimatique de la station d’étude, le diagramme ombrothermique de Bagnouls & Gaussen (1953) ainsi que le quotient pluviométrique d’Emberger (Q3) modifié par Stewart (1969) ont été déterminés.
8Les températures moyennes des minimas et des maximas sont de 2,20 et 37,33 °C respectivement. La pluviométrie annuelle moyenne est de 209,86 mm. Le diagramme ombrothermique montre l’existence d’une période sèche de neuf mois et demi, allant de mi-février à décembre. Le Q3 obtenu est de 20,48, il permet de classer notre station d’étude dans un étage bioclimatique aride frais.
2.2 Matériel biologique
9Cinq arbres adultes ont été préalablement sélectionnés. Sur chacun de ces arbres, vingt feuilles porteuses de galles ont été prélevées puis conservées dans des sacs en papiers et mises au réfrigérateur pendant 24 heures. Les feuilles ont été récoltées durant le mois de septembre 2017, après le développement final des galles.
2.3 Méthodes d’étude
2.3.1 Morphologie des galles
2.3.1.1. Fréquences relatives des formes de galles inventoriées
10Pour chaque forme de galle répertoriée, nous avons calculé une fréquence d’apparition sur les arbres par la formule suivante :
11Fréquences relatives (%) = Nombre de galles d’une forme déterminée x 100 / Nombre total de galles échantillonnées.
2.3.1.2 Taille des galles
12Afin de caractériser la variabilité morphologique des galles échantillonnées, nous avons procédé à la mesure de leur taille à l’aide d’un pied à coulisse digital. Pour les galles en forme de croissant, nous avons mesuré la longueur et la largeur tandis que pour les galles globuleuses, nous avons mesuré la longueur, le diamètre minimal et maximal.
2.3.2 Identification des espèces de pucerons
13A partir de 20 galles échantillonnées de chaque forme, nous avons sélectionné aléatoirement 200 pucerons ailés qui ont été conservés dans de l’alcool 70° jusqu’à leur utilisation. Les insectes ont été montés entre lame et lamelle en suivant la méthode de Blackman & Eastop (2018).
14Pour déterminer les espèces de pucerons échantillonnés, nous avons utilisé la clé de détermination de Blackman & Eastop (2018) et de Brown & Blackman (1994) ainsi que les travaux de Ghosh (1984), de Davatchi & Remaudière (1957) et de Gaumont (1930).
15Lors de l’étude morphométrique, 15 caractères ont été mesurés (Tableau 1) sur 30 insectes ailés en utilisant un microscope optique (Motic BA-300) (x40, x100 et x400) muni d’une caméra numérique (Moticam 2.0) reliée à un ordinateur. Les mesures ont été effectuées par le logiciel d’analyse d’image "Motic Image Plus 2.0".
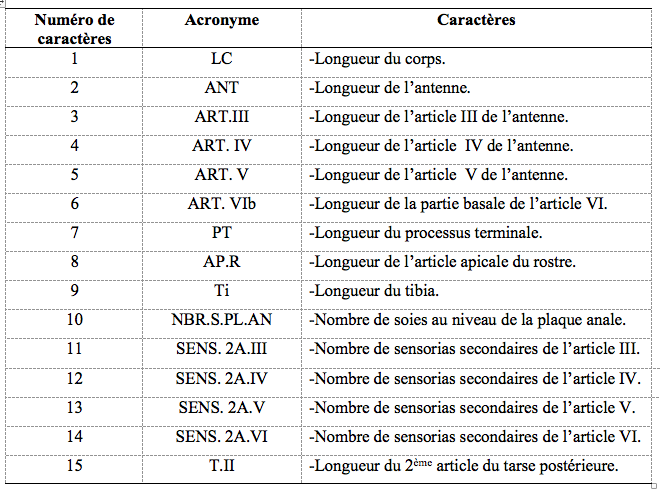
Tableau 1. Caractères morphologiques mesurés chez les ailés d’aphides.
2.4 Analyses statistiques
16Les données obtenues ont été exploitées à l’aide du logiciel Statistica version 8. Pour chaque caractère étudié, nous avons procédé à la réalisation des statistiques descriptives (moyenne, écart-type, valeur minimale et maximale).
3 RESULTATS
3.1 Morphologie des galles
3.1.1 Fréquences relatives des formes de galles inventoriées
17Lors de nos observations, nous avons inventorié deux formes de galles : une forme globuleuse qui prend naissance sur la nervure principale de la foliole et une forme en croissant qui se développe au niveau de la marge des feuilles.
18La fréquence d’apparition des galles globuleuses est de 74,78±5,7 %, tandis que les galles en croissant ont présenté une fréquence assez basse de 25,22±5,7 % environ trois fois moins importante que les globuleuses (Figure 2-A).
3.1.2 Taille des galles
19Les mesures effectuées sur les galles globuleuses ont permis de noter que leur longueur, leur diamètre maximal et minimal sont, respectivement, de 1,38±0,28 cm, 1,51±0,29 cm et 1,12±0,24 cm (Figure 2-B).
20Concernant les galles en forme de croissant, celles-ci ont présenté une longueur de 3,37±0,54 cm et une largeur de 0,93±0,24 cm (Figure 2-C).
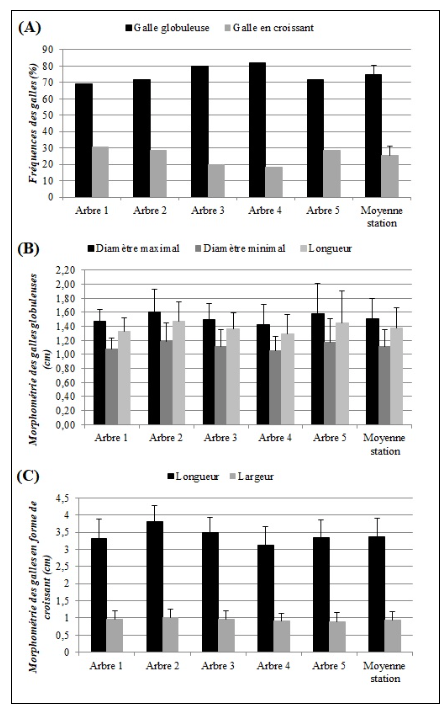
Figure 2. Morphologie des galles inventoriées.
A- Fréquences relatives des galles globuleuses et en croissant enregistrées entre les différents arbres échantillonnés chez P. atlantica. B- Taille des galles globuleuses entre les différents arbres échantillonnés de P. atlantica. C- Taille des galles en forme de croissant entre les différents arbres échantillonnés de P. atlantica.
3.2 Identification des espèces de pucerons
21Deux espèces de pucerons ont été identifiées : Forda riccobonii et Geoica mimeuri, responsables respectivement des galles en forme de croissant et globuleuse (Figure 3).

Figure 3. Observation sous microscope optique des deux espèces de pucerons inventoriés.
1- Ailé de Geoica mimeuri; 2- Antenne de Geoica mimeuri; 3- Ailé de Forda riccobonii; 4- Antenne de Forda riccobonii.
22Les caractères morphométriques des pucerons ailés de ces deux espèces sont présentés dans le tableau 2.
Tableau 2. Morphométrie des ailés de G. mimeuri et F. riccobonii.
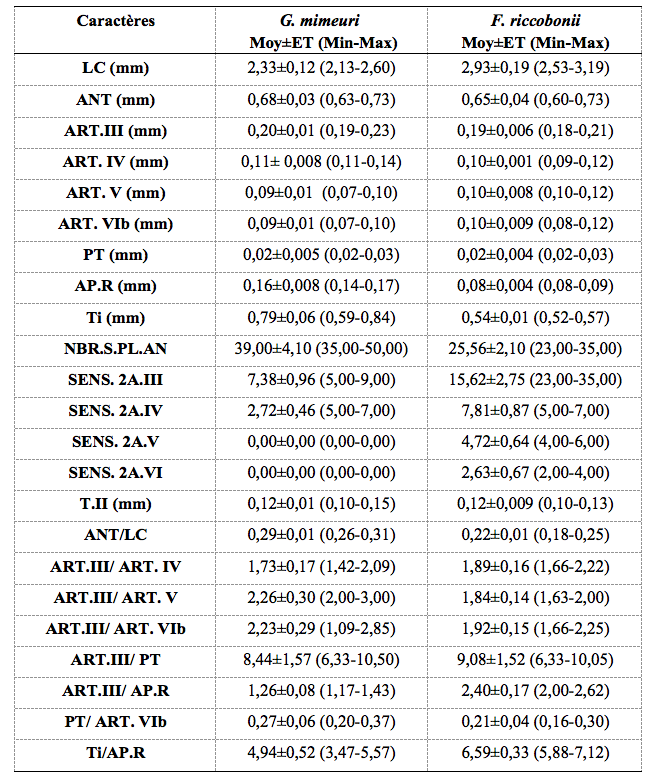
LC, Longueur du corps ; ANT, Longueur de l’antenne ; ART.III, Longueur de l’article III de l’antenne ; ART. IV, Longueur de l’article IV de l’antenne ; ART. V, Longueur de l’article V de l’antenne ; ART. VIb, Longueur de la base de l’article VI de l’antenne ; PT, Longueur du processus terminal ; AP.R, Longueur de l’article apicale du rostre ; Ti, Longueur du tibia ; NBR.S.PL.AN, Nombre de sois sur la plaque anale ; SENS. 2A.III, Nombre de sensorias secondaires sur l’article III ; SENS. 2A.IV, Nombre de sensorias secondaires sur l’article IV ; SENS. 2A.V, Nombre de sensorias secondaires sur l’article V ; SENS. 2A.VI, Nombre de sensorias secondaires sur l’article VI ; T.II, Longueur du 2éme article du tarse postérieure ; Moy, Moyenne ; ET, Ecart-type ; Min, Valeur minimale ; Max, Valeur maximale. Les mesures sont effectuées sur 30 ailés de chaque espèce.
3.2.1 Geoica mimeuri (Gaumont 1930)
23Les ailés de G. mimeuri examinés présentent une tête, un thorax et des pattes de couleur brun foncé. La longueur du corps varie de 2,13 à 2,60 mm. Leurs antennes varient de 0,63 à 0,73 mm de long (environ 1/4-1/3 de la longueur du corps) et sont formées de 6 articles. L’article III (0,19 à 0,23 mm) est 1,42 à 2,09 fois plus long que l’article IV et 2 à 3 fois plus long que l’article V. Il porte 5 à 9 sensorias secondaires d’une forme ovalaire. Le processus terminal (20 à 30 µm) présente le quart (1/4) de la longueur de la base de l’article VI. L’article apical du rostre, d’une longueur de 0,14 à 0,17 mm, est 1,17 à 1,43 fois plus petit que l’article III et 3,47 à 5,57 fois moins long que le tibia. La plaque anale est ornée de 27 à 43 soies. Les embryons contenus dans l’abdomen de ces ailées sont dépourvus de rostre.
3.2.2 Forda riccobonii (Stefani 1899)
24La tête, le thorax et les pattes sont de couleur brun foncé. La longueur du corps varie de 2,53 à 3,19 mm. Il est 3,89 à 5,28 fois plus long que les antennes. Ces dernières sont segmentées en 6 articles dont l’article III (0,18 à 0, 21 mm) est 1,66 à 2,22 fois plus long que l’article IV et 1,63 à 2 fois plus long que l’article V. Les sensorias secondaires sont au nombre de 14 à 18 sur l’article III, 5 à 7 sur l’article IV, 4 à 6 sur l’article V et 2 à 4 sur l’article VI. Le processus terminal (10 à 40 µm) présente le 1/6-2/6 de la longueur de la base de l’article VI. L’article apical du rostre (0,08 à 0,09 mm) est 2 à 2,62 fois plus petit que l’article III et présente le 1/7-1/6 de la longueur du tibia (0,52 à 0,57 mm). La plaque anale est ornée de 23 à 35 soies. Les embryons contenus dans l’abdomen sont tous pourvus de rostre.
4. DISCUSSION
25Cette étude a pour objectif, d’inventorier et d’étudier la biométrie des galles foliaires et des pucerons qui les provoquent au sein d’un peuplement naturel de P. atlantica présent dans la région de Djelfa, Algérie. Le développement de galles de forme globuleuse et en croissant a été observé. En Israël, Inbar et al. (2004) ont signalé la présence de deux autres formes de galles sur P. atlantica : la galle en forme de pois située sur la marge (pois-marge) et la galle plate marginale.
26Nos observations nous ont permis de déterminer que l’espèce Forda riccobonii provoque les galles en forme de croissant. Ce résultat est en accord avec ce qui a été rapporté par Blackman & Eastop (2018). Ces mêmes auteurs ont signalé que, sur P. atlantica, la forme globuleuse pouvait être provoquée par 4 espèces de pucerons appartenant au genre Geoica, à savoir G. harpazi Brown & Blackman 1994, G. mimeuri, G. rungsi Davatchi & Remaudière 1957 et G. swirskii Remaudière & Inbar 2004. Selon nos observations, c’est bien l’espèce G. mimeuri qui provoque les galles globuleuses échantillonnées lors de cette étude.
27Par ailleurs, dans ce peuplement, l’abondance des galles de G. mimeuri, est environ trois fois plus importante que celles de F. riccobonii. Cette dominance de G. mimeuri pourrait être liée aux conditions écologiques de la station. Selon Inbar & Kark (2007), les densités des populations des espèces de pucerons gallicoles sont fortement influencées par le site d’étude. Ceci peut également être expliqué par la disponibilité et la variabilité des ressources alimentaires présentes dans le site. En effet, d’après Hughes & Walker (1970), les ressources alimentaires déterminent le développement des insectes. De même, la nature complexe du cycle de vie de certains pucerons qui nécessitent l’alternance entre un hôte primaire et les racines d’un hôte secondaire non spécifique peut influencer leur distribution (Wool, 1984).
28Concernant les adultes ailés de G. mimeuri, les spécimens examinés par Davatchi & Remaudière (1957) présentaient des caractéristiques assez proches des nôtres : Article III environ 2 fois plus long que l’article V et la base de l’article VI, 1,2 à 1,4 fois plus grand que l’article apical du rostre. Une plaque anale ornée de 35 à 50 soies et des embryons dépourvus de rostre. L’espèce G. mimeuri est connue uniquement au Maroc (Blackman & Eastop, 2018). En Algérie, Laamari et al. (2010) ont mentionné l’existence de Geoica spp dans la région d’Oum Elbouaghi. Néanmoins, notre étude est la première qui signale l’existence de cette espèce et la décrit morphologiquement sur P. atlantica en Algérie.
29Selon Davatchi & Remaudière (1957), G. mimeuri a été découverte pour la première fois en août 1917 au Maroc sur P. terebinthus par Mimeur. Ce dernier avait envoyé des exemplaires de cette espèce en 1927 à Gaumont lequel l’avait reconnu comme une nouvelle espèce en 1930 (Gaumont, 1930). Davatchi & Remaudière (1957) ont confirmé la validité de l’espèce G. mimeuri et avaient complété sa description. Elle vit également sur P. atlantica (Davatchi & Remaudière, 1957; Brown & Blackman, 1994; Blackman & Eastop, 2018). Il s’agit d’une espèce monoécique holociclique (Blackman & Eastop, 2018). Les individus ailés qui sortent des galles n’émigrent pas. Ce sont des sexupares (Davatchi & Remaudière, 1957). Leurs embryons sont dépourvus de rostres (Davatchi & Remaudière, 1957; Brown & Blackman, 1994). Toutefois, il existerait, à titre exceptionnel, des ailés intermédiaires entre de vrais sexupares et d’émigrants virginipares (virgo-sexupare) qui contiendraient des embryons pourvus de rostres, ce qui suggèrerait la possibilité d’un cycle hétéroécique complet avec migration se superposant au cycle monoécique sur l’hôte primaire (Davatchi & Remaudière, 1957). Lors de nos observations, nous n’avons remarqué aucun virgo-sexupare. Tous les individus étudiés étaient des sexupares. Le reste des espèces du genre Geoica ont un cycle hétéroécique (Blackman & Eastop, 2018).
30Concernant F. riccobonii, celle-ci présente un cycle de type hétéroécique holocyclique (Martinez, 2008; Blackman & Eastop, 2018) complexe qui dure deux ans (Wool, 2003; Mifsud et al., 2009). Contrairement à Geoica sp., Slavum wertheimae Hille Ris Lambers 1957 et Baizongia pistaciae, cette espèce développe deux formes de galles sur le Pistachier de l’Atlas. Une petite galle sphérique de couleur rouge qui apparait au printemps, formée par la fondatrice (Martinez, 2009). Ensuite, les fondatrigènes forment une deuxième galle sur le bord des folioles voisines par l’élaboration d’une séquence de chambres articulées à l’intérieur desquelles elles se reproduisent (Wool, 1995). A l’automne, les fondatrigènes ailées quittent les galles de leur premier hôte à la recherche de leur deuxième hôte (graminées) (Wertheim, 1954; Mifsud et al., 2009). Sur les racines de ce dernier, plusieurs générations se forment par parthénogénèse et au printemps suivant, des ailés (ré-émigrants) retournent sur l’hôte primaire afin d’engendrer des formes sexués (mâle et femelle) qui donneront naissance à des œufs qui n’écloront qu’au printemps de l’année suivante (Wool, 2003). L’espèce est originaire de la région méditerranéenne (Maroc, Algérie, Italie, Espagne et Malte) mais elle est aussi connue en Asie du Sud-Ouest (Mifsud et al., 2009), en Israël (Martinez, 2008), en Turquie et en Inde (Ghosh, 1984).
5. CONCLUSIONS
31Les pucerons gallicoles qui se développent sur Pistacia atlantica dans la station d’Ain Oussera (Djelfa, Algérie) sont Geoica mimeuri (provoquant des galles globuleuses) et Forda riccobonii (provoquant des galles en forme de croissant). G. mimeuri est 3 fois plus abondant que F. riccobonii et a été identifié pour la première fois en Algérie lors de cette étude. D’autres, stations de P. atlantica devrait être investiguées afin de déterminer les différentes espèces aphidiennes en Algérie et d’étudier leur interaction avec les conditions écologiques. Une caractérisation moléculaire des différentes espèces inventoriées de pucerons serait également souhaitable.
REMERCIEMENTS
32Les auteurs tiennent à remercier le personnel technique du HCDS (Haut Commissariat au Développement de la Steppe) et de la conservation des forêts de la wilaya de Djelfa pour leur orientation et leur aide durant la campagne d’échantillonnage. Les auteurs expriment également leur gratitude à Mme Saidani Zineb, doctorante à l’université de Djelfa, pour son aide dans les observations microscopiques. Ce travail n’aurait pu être achevé sans l’aide précieuse apportée par l’équipe de Juan Manuel Nieto Nafría, Directeur du laboratoire du département de biodiversité et gestion de l’environnement de l’université de Léon, Espagne, et plus précisément celle de Nicolás Pérez Hidalgo, dans l’identification des espèces de pucerons.
33Cette recherche n'a reçu aucune subvention spécifique des organismes de financement du secteur public, commercial ou à but non lucratif.
Bibliographie
Ahmeid Al-Nagar O. & Nieto Nafría J.M., 1998. Notes on Libyan aphids: new recorded species from North Africa. In: Nieto Nafría J.M. & Dixon A.F.G., eds. Aphids in natural and managed ecosystems, Universidad de León, Secretariado de Publicaciones, León, 325-327.
Al-Saghir M.G. & Porter M., 2005. Stomatal Distribution in Pistacia sp. (Anacardiaceae). International Journal of Botany, 1(2), 183-187.
Alvarez R., 2012. Microscopic study of the walls of galls induced by Geoica utricularia and Baizongia pistaciae in Pistacia terebinthus: a contribution to the phylogeny of Fordini. Arthropod-Plant Interactions, 6(1), 137-145.
Bagnouls F. & Gaussen H., 1953. Saison sèche et indice xérothermique. Bulletin de la Société d'histoire naturelle de Toulouse, 88, 193-239.
Belhadj S., 2007. Etude Eco-Botanique de P. atlantica Desf. (Anacardiaceae) en Algérie préalable à la conservation des ressources génétiques de l’espèce et sa valorisation. Thèse de doctorat d’État en sciences agronomiques : Université Mouloud Mammeri de Tizi Ouzou, Algérie.
Belhadj S., Derridj A., Auda Y., Gers C. & Gauquelin T., 2008. Analyse de la variabilité morphologique chez huit populations spontanées de Pistacia atlantica en Algérie. Botany, 86(5), 520-532.
Benhassaini H. & Belkhodja M., 2004. Le Pistachier de l’Atlas en Algérie : entre survie et disparition. La feuille et l’aiguille, 54, 1-2.
Blackman R.L. & Eastop V.F., 2018. Aphids on World’s plants. An online identification and information guide. http://www.aphidsonworldsplants.info (14/01/2018).
Bodenheimer F.S. & Swirski E., 1957. The Aphidoidea of the Middle East. Jerusalem, Israel: Weizmann Science Press of Israel, 378 p.
Boukhris-Bouhachem S. et al., 2007. Aphid (Hemiptera: Aphidoidea) diversity in Tunisia in relation to seed potato production. Bulletin des séances de la Société entomologique de France, 43(3), 311-318.
Brown P.A. & Blackman R.L., 1994. Morphometric variation in the Geoica utricularia (Homoptera: Aphididae) species group on Pistacia (Anacardiaceae), with descriptions of new species and a key to emigrant alatae. Systematic Entomology, 19, 119-132.
Cornell H.V., 1983. The secondary chemistry and complex morphology of galls formed by the Cynipinae (Hymenoptera): why and how? American Midland Naturalist, 110(2), 225-234.
Davatchi A. & Remaudière G., 1957. Quelques Fordinae nouveaux ou peu connus des Pistacia (Hom. Aphidoidea). Revue de Pathologie végétale et d’entomologie agricole de France, 36(3), 165-183.
Dixon A.F.G., 1998. Aphid Ecology: An Optimization Approach. 2nd ed. London, UK: Chapman & Hall, 300 p.
Dorchin N., Freidberg A. & Aloni R., 2002. Morphogenesis of stem gall tissues induced by larvae of two cecidomyiid species (Diptera: Cecidomyiidae) on Suaedamonoica (Chenopodiaceae). Canadian Journal of Botany, 80, 1141-1150.
Douglas A.E., 2003. The nutritional physiology of aphids. Advances in Insect Physiology, 31, 73-140.
Gaumont L., 1930. Deux Pemphigella nouveau d’Afrique du Nord (Hem. APHIDAE). Bulletin de la Société entomologique de France, 18.
Ghosh A.K., 1984. The fauna of India and the adjacent countries, Homoptera: Aphidoidea, Part 3 Subfamily Pemphiginae. Calcutta, India: Zoological survey of India, 336 p.
Hughes R.D. & Walker J.M., 1970. The role of food in the population dynamics of the Australian bush fly. In: Watson A., eds. Animal populations in relation to their food resources. Oxford: Blackwell, 259-269.
Inbar M. & Kark S., 2007. Gender-related developmental instability and herbivory of Pistacia atlantica across a steep environmental gradient. Folia Geobotanica, 42, 401-410.
Inbar M., Wink M. & Wool D., 2004. The evolution of host plant manipulation by insects: molecular and ecological evidence from gall-forming aphids on Pistacia. Molecular Phylogenetics and Evolution, 32, 504-511.
Koach J. & Wool D., 1977. Geography distribution and host specificity of gall-forming aphids (Homoptera, Fordinae) on Pistacia trees in Israel. Marcellia, 40, 207-216.
Laamari M., Coeur D’acier A. & Joussellin E., 2010. Assesment of aphid diversity (Hemiptera: Aphididae) in Algeria: a fourteen-year investigation. Faunistic Entomology, 62, 73-87.
Laamari M., Coeur D’acier A. & Joussellin E., 2013. New data on aphid fauna (Hemiptera, Aphididae) in Algeria. ZooKeys, 319, 223-229.
Louzabi S., Belhadj S. & Bouragba Brague N., 2016. Morphology of healthy leaves and galling leaves in Pistacia terebinthus L. In: Kodad O et al., eds. XVI GREMPA Meeting on Almonds and Pistachios, 12-14 March, 2015. Meknes, Morocco : CIHEAM, Options Méditerranéennes : Série A. Séminaires Méditerranéens, 221-224.
Martinez J.J.I., 2008. Impact of a gall-inducing aphid on Pistacia atlantica Desf. Trees. Arthropod Plant Interactions, 2(3), 47-151.
Martinez J.J.I., 2009. Population ecology of Forda riccobonii (Stefani) (Hemiptera: Pemphigidae) on Pistacia atlantica. Orient Insects, 43, 241-251.
Mifsud D., Pérez Hidalgo N. & Barbagallo S., 2009. Aphids (Hemiptera: Aphidoidea) associated with native trees in Malta (Central Mediterranean). Bulletin of the Entomological Society of Malta, 2, 81-93.
Ozden-Tokatli Y., Akdemir H., Tilkat E. & Onay A., 2010. Current status and conservation of Pistacia germplasm. Biotechnology Advances, 28, 130-141.
Price P.W., Waring G.L. & Fernandes G.W., 1986. Hypotheses on the adaptive nature of galls. Proceedings of the Entomological Society of Washington, 88, 361-363.
Price P.W., Fernandes G.W. & Waring G.L., 1987. Adaptive nature of insect galls. Environmental Entomology, 16, 15-24.
Quézel P. & Santa S., 1963. Nouvelle flore de l’Algérie et des régions désertiques méridionales. Tome II. Paris : Centre National de la Recherche Scientifique, 1170 p.
Shorthouse J.D., Wool D. & Raman A., 2005. Gall-inducing insect – Nature ́s most sophisticated herbivores. Basic and Applied Ecology, 6, 407-411.
Stewart P.H., 1969. Quotient pluviothermique et dégradation biosphérique. Bulletin de la Société d'histoire naturelle d'Afrique du Nord, 59, 23-36.
Wertheim G., 1954. Studies on the biology and ecology of the gall producing aphids of the tribe Fordini (Homoptera: Aphidoidea) in Israel. Transactions of the Royal Entomological Society of London, 105, 79-96.
Wool D., 1984. Gall forming aphids. In: Ananthakrishnan T.N., eds. Biology of gall insects. New Delhi, India: Oxford and IBH, 11-58.
Wool D., 1995. Aphid-induced galls on Pistacia in the natural forest of Israel: which, where, and how many? Israel Journal of Zoology, 41, 591-600.
Wool D., 2003. Gall-inducing aphids: biology, ecology and evolution. In: Raman R., Schaefer C.W. & Withers T.M., eds. Biology, ecology, and evolution of gall-inducing arthropods. Enfield, USA: Science, 73-132.
Wool D., 2012. Autecology of Baizongia pistaciae (L.): a monographical study of a galling aphid. Israel Journal of Entomology, 41(42), 67-93.
Zhang H.C. & Qiao G.X., 2007. Systematic status of the genus Formosaphis Takahashi and the evolution of galls based on the molecular phylogeny of Pemphigini (Hemiptera: Aphididae: Eriosomatinae). Systematic Entomology, 32(4), 690-699.