- Portada
- Volume 74 (2021)
- Etude sur la faune Culicidienne (Diptera: Culicidae) de la région de Tizi-Ouzou (Nord d’Algérie) : Biodiversité, abondance et répartition
Vista(s): 4836 (20 ULiège)
Descargar(s): 128 (0 ULiège)
Etude sur la faune Culicidienne (Diptera: Culicidae) de la région de Tizi-Ouzou (Nord d’Algérie) : Biodiversité, abondance et répartition

Documento adjunto(s)
Version PDF originaleNotes de la rédaction
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
Résumé
Dans le but d’améliorer nos connaissances sur la diversité spécifique de la faune Culicidienne au niveau de la région de Tizi-Ouzou (Nord d’Algérie), nous avons mené un échantillonnage bimensuel dans 20 gîtes larvaires différents au cours d’une période allant du mois de février 2019 jusqu’au mois de juin 2020. Treize (13) espèces ont été recensées (Aedes (Ochlerotatus) caspius (Pallas, 1771), Aedes (Finlaya) geniculatus (Olivier, 1791), Anopheles maculipennis s.l. Meigen, 1818, Anopheles (Anopheles) claviger (Meigen, 1804), Culex (Culex) pipiens Linnaeus,1758, Culex (Maillotia) deserticola Kirkpatrick, 1925, Culex (Maillotia) hortensis Ficalbi, 1889, Culex (Neoculex) impudicus Ficalbi, 1890, Culex (Neoculex) territans Walker,1856, Culex (Culex) perexiguus (Theobald, 1903), Culiseta (Allotheobaldia) longiareolata (Macquart, 1838), Culiseta (Culiseta) subochrea (Edwards, 1921), Uranotaenia (Pseudoficalbia) unguiculata (Edwards,1913) appartenant à cinq genres (Aedes, Anopheles, Culex, Culiseta, Uranotaenia). Culex pipiens est l’espèce la plus abondante avec une fréquence relative de 44,53%, suivie par Culiseta longiareolata avec 41,96%.
Abstract
In order to improve our knowledge of the specific diversity of the Culicidian fauna in the Tizi-Ouzou region (Algeria Northern), we have carried out bimonthly sampling in 20 different breeding sites over a period from february 2019 to june 2020. Thirteen species have been recorded (Aedes (Ochlerotatus) caspius (Pallas, 1771), Aedes (Finlaya) geniculatus (Olivier, 1791), Anopheles maculipennis s.l. Meigen, 1818, Anopheles (Anopheles) claviger (Meigen, 1804), Culex (Culex) pipiens Linnaeus,1758, Culex (Maillotia) deserticola Kirkpatrick, 1925, Culex (Maillotia) hortensis Ficalbi, 1889, Culex (Neoculex) impudicus Ficalbi, 1890, Culex (Neoculex) territans Walker, 1856, Culex (Culex) perexiguus (Theobald, 1903), Culiseta (Allotheobaldia) longiareolata (Macquart, 1838), Culiseta (Culiseta) subochrea (Edwards, 1921), Uranotaenia (Pseudoficalbia) unguiculata (Edwards,1913) beloning to five genera (Aedes, Anopheles, Culex, Culiseta, Uranotaenia). Culex pipiens is the most abundant species with a relative frequency of 44,53%, followed by Culiseta longiareolata with 41,96%.
Tabla de contenidos
INTRODUCTION
1La faune Culicidienne occupe le centre de l’actualité entomologique mondiale en raison de son rôle dans la transmission des maladies virales et parasitaires qui peuvent affecter l’être humain et les animaux (Becker et al., 2003). Plusieurs espèces de moustiques sont des vecteurs de zoonoses d’incidences médicales et vétérinaires (Bawin et al., 2014), Anopheles (Anopheles) labranchiae Falleroni, 1926 est considérée comme vecteur majeur du Paludisme au Maghreb (Brunhes et al.,1999 ; Laboudi et al., 2014) jusqu’en 2004 (El Joubari et al., 2014). Une bonne connaissance de la faune Culicidienne, par l’étude de sa taxonomie, son écologie et son abondance est très importante avant de réaliser des compagnes de lutte anti-moustiques.
2En effet, l’homme contribue à l’apparition des endroits propices au développement des moustiques par la création des gîtes artificiels (Darriet, 2014), ce qui favorise la pullulation et l’augmentation de leur aire géographique. Actuellement, l’invasion du moustique tigre Aedes (Stegomyia) albopictus (Skuse, 1894) au Nord d’Afrique est une préoccupation majeure. Sa première détection en Algérie a été en 2010 au niveau de la région de Tizi-Ouzou (Izri et al., 2011). Il a été ensuite détecté à Oran en 2015 (Benallal et al., 2016) et à la capitale Alger en 2016 (Benallal et al.,2019). C’est un moustique originaire des forêts humides du Sud-est Asiatique (Darriet, 2019). Il est actuellement en expansion mondiale grâce au transport passif par le commerce international et les déplacements humains (Krupa et al., 2020). La présence de cette espèce peut engendrer un risque réel lié à l’apparition des épidémies de Chikungunia et de Dengue (Delaunay et al., 2009).
3Dans ce contexte, plusieurs travaux ont été réalisés sur les Culicidae en Algérie, notamment ceux de Rehimi & Soltani (1999), Messai et al. (2010), Izri et al. (2011), Berchi et al. (2012), Bouabida et al. (2012), Lafri et al. (2014), Benallal et al. (2015,2016, 2019), Benbetka et al. (2018), Benhissen et al. (2018), Hamaidia & Berchi (2018), Nabti & Bounechada (2019), Kharoubi et al. (2020).
4La présente étude a été consacrée à la détermination des espèces Culicidiennes inventoriées au niveau de la région de Tizi-Ouzou (Nord d’Algérie) et à l’exploitation des résultats par les indices écologiques afin de préciser l’abondance relative et les fréquences d’occurrence. Les résultats de cette étude peuvent servir aux planifications des stratégies de lutte au niveau de cette région pour des travaux ultérieurs.
MATERIELS ET METHODES
Présentation de la région d’étude :
5La région de Tizi-Ouzou se trouve au Nord d’Algérie (36.69’27’’83N, 4.05’01’’05E). Elle est délimitée au Nord par le bassin méditerranéen, au Sud par la wilaya de Bouira, à l’Est par la wilaya de Bejaia et à l’Ouest par la wilaya de Boumerdes.
6Elle présente un étage bioclimatique méditerranéen subhumide, et une pluviométrie moyenne de 600 à 1000mm d’eau par an. La figure 1 montre la localisation géographique de la région d’étude et des gîtes prospectés.
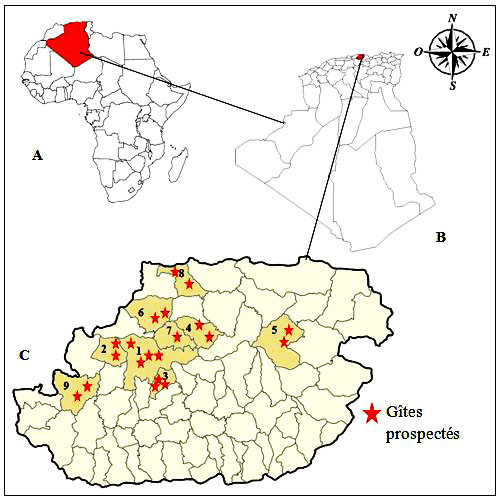
Figure 1 : Localisation géographique de la région d’étude : A localisation géographique de l’Algérie en Afrique, B localisation géographique de Tizi-Ouzou en Algérie, C localisation géographique des communes prospectées : 1 Tizi-Ouzou, 2 Draa Ben Khedda, 3 Beni Aissi, 4 Ouaguenoun, 5 Azaga, 6 Makouda, 7 Ait Aissa Mimoune, 8 Tigzirt, 9 Ait Yahia Moussa
Gites prospectés
7Notre étude a eu lieu de février 2019 à juin 2020, soit sur une période de 17 mois. Elle a porté sur un échantillon de 20 gîtes larvaires de différentes natures, artificiels ou naturels, distribués comme suit : Tizi-Ouzou (trois gîtes artificiels : vide sanitaire, puits, réservoir d’une fontaine et un gîte naturel : trous d’arbre), Draa Ben Khedda (deux gîtes artificiels : canal d’évacuation, regards d’égouts), Beni Aissi (un gîte artificiel, canal de passage d’eau, et deux gîtes naturels, étang et des petites retenues d’eau de pluie), Ouaguenoun (deux gîtes artificiels : deux regards), Azazga (un gîte naturel, fosse creusée, et un autre artificiel, une retenue d’eau de filtration des eaux usées), Makouda (deux gîtes naturels, une retenue collinaire et des petites retenues d’eau), Ait Aissa Mimoune (un gîte naturel : retenue d’eau de pluie), Tigzirt (deux gîtes artificiels, barques et ruine romaine), Ait Yahia Moussa (un gîte artificiel, un baril, et un autre naturel, une fosse creusée). Ces différents gîtes sont illustrés dans les figures 2 et 3.

Figure 2 : Variété des gîtes artificiels prospectés dans la région de Tizi-Ouzou de février 2019 à juin 2020. Tizi-Ouzou (1 puits, 2 vide sanitaire, 3 réservoir d’une fontaine), Draa Ben Khedda (4 canal d’évacuation, 5 regards), Beni Aissi (6 canal d’eau), Ouaguenoun (7 regards, 8 regards), Azazga (9 retenue de filtration des eaux usées), Tigzirt (10 barques, 11 ruine romaine), Ait Yahia Moussa (12 baril) (Cliché Chahed Soumeya)

Figure 3 : Variété des gîtes naturels prospectés au niveau de la région de Tizi-Ouzou de février 2019 à juin 2020. Tizi-Ouzou (1 trous d’arbre), Beni Aissi (2 étang), Azazga (3 retenue d’eau), Makouda (4 retenue collinaire, 5 retenue d’eau), Ait Aissa Mimoun (6 retenue d’eau de pluie), Ait Yahia Moussa (7 fosses creusée, 8 retenue d’eau) (Cliché Chahed Soumeya).
Méthode d’échantillonnage
8Un échantillonnage bimensuel a été fait selon plusieurs critères: la présence des larves de moustiques dans un gîte donné et l’accessibilité. Il a été basé sur la collecte des larves par la méthode de Dipping (Croset et al., 1976 ; Silver, 2008).
9Une louche d’une capacité de 500ml a été utilisée dans les gîtes ayant une eau facile à atteindre. Un ensemble de dix coups de louche a été effectué à différents endroits de chaque gîte et durant toutes les sorties du prélèvement.
10Dans les milieux profonds (Puits), l’échantillonnage a été réalisé à l’aide d’un seau de cinq litres attaché à une corde. Dix coups de seau ont été effectués durant toutes les collectes.
11Dans chaque prélèvement, nous avons utilisé des pipettes Pasteur afin de capturer les larves collectées, et des bouteilles en plastique d’un demi-litre remplies d’eau de gîte, pour les conserver, tout en mentionnant la date, le lieu et le numéro du gîte. Ensuite, les larves ont été transportées au laboratoire d’Ecologie et biologie des écosystèmes terrestres LEBIOT, de l’Université Mouloud Mammeri (Tizi-Ouzou, Algérie) pour l’élevage, le montage et l’identification.
Elevage et montage des larves
12Les œufs et les larves du 1er, 2ème et 3ème stade ont été élevés au laboratoire, dans des conditions ambiantes, par une méthode similaire à celle citée par Rehimi & Soltani (1999). Cette méthode consiste à mettre les larves dans des récipients en plastique, contenants 300ml de l’eau dichlorée à l’intérieur des cages cubiques à mailles fines (30Í30Í30 cm). Une nourriture composée d’un mélange de biscuit et de levure a été donnée aux larves tous les trois jours. Le changement d’eau a permis d’éviter la mort des individus par asphysie suite à la décomposition de la nourriture dans l’eau.
13Les larves de 4ème stade ont fait l’objet de notre identification par leur chétotaxie. Elles ont été éclaircies et montées par une méthode similaire à celle de Matile (1993). Elle consiste à mettre les larves dans une solution chaude de KOH à 10% pendant dix minutes, puis les rincer trois fois avec de l’eau distillée (trois minutes chacune) pour les débarrasser du KOH, et une minute dans l’éthanol absolu. Les larves ont été conservées dans des tubes Eppendorf remplis d’éthanol dilué à 70%.
14Le montage a été réalisé sous une loupe binoculaire de marque Optika (WF10X/21). Une goutte du liquide de Faure a été mise pour fixer les larves entre lame et lamelle. Chaque lame porte une étiquette qui inclut le nom, le lieu du gîte et la date de la collecte.
Identification des moustiques
15Notre identification a suivi la méthode standard, par l’étude morphologique citée par Schaffner & Mathieu (2020). Nous avons utilisé un microscope de marque Novex (grossissements de 10X à 100X) en se basant sur les clés dichotomiques de Rioux (1958). La confirmation a été faite grâce au logiciel d’indentification des Culicidae de l’Afrique méditerranéenne de Brunhes et al. (1999), et des spécialistes.
Méthodes d’exploitation des résultats
16Afin d’exploiter nos résultats, les indices écologiques de composition (Abondance relative ( et fréquence d’occurrence (F) et de structure (L’indice de Shannon Weaver (H’=-) et l’indice d’équitabilité (E=H’/H’max)) ont été utilisés.
17Dont ni est le nombre d’individus pour chaque espèce, N est le nombre total d’individus, p est le nombre de relevés contenant l’espèce donnée, C est l’abondance relative, F est la fréquence d’occurrence., S est le nombre d’espèces trouvées, i est une espèce d’un milieu étudié, pi=ni/N, log2 est le logarithme à base 2, H’max= log2S.
RESULTATS ET DISCUSSIONS
Biodiversité et abondance des Culicidae dans la région de Tizi-Ouzou (Nord d’Algérie)
18L’inventaire des moustiques réalisé dans la présente étude a révélé la présence de 13 espèces, regroupées en deux sous-familles (Culicinae et Anophelinae) et cinq genres différents. Elles sont clarifiées dans le tableau 1.
Tableau 1 : Liste des espèces de Culicidae recensées dans la région de Tizi-Ouzou (Nord d’Algérie) de février 2019 à juin 2020.
|
Famille |
Sous famille |
Genre |
Espèce |
|
Culicidae |
Culicinae |
Culex |
Culex (Culex) pipiens Linnaeus, 1758 |
|
Culex (Neoculex) impudicus Ficalbi, 1890 |
|||
|
Culex (Neoculex) territans Walker, 1856 |
|||
|
Culex (Culex) perexiguus (Theobald, 1903) |
|||
|
Culex (Maillotia) hortensis Ficalbi, 1889 |
|||
|
Culex (Maillotia) deserticola Kirkpatrick, 1925 |
|||
|
Culiseta |
Culiseta (Allotheobaldia) longiareolata (Macquart, 1838) |
||
|
Culiseta (Culiseta) subochrea (Edwards, 1921) |
|||
|
Aedes |
Aedes (Finlaya) geniculatus (Olivier, 1791) |
||
|
Aedes (Ochlerotatus) caspius (Pallas, 1771) |
|||
|
Uranotaenia |
Uranotaenia (Pseudoficalbia) unguiculata Edwards, 1913 |
||
|
Anophelinae |
Anopheles |
Anopheles (Anopheles) maculipennis s.l. Meigen, 1818 |
|
|
Anopheles (Anopheles) claviger (Meigen, 1804) |
19Le genre Culex a occupé la première position. Il a été représenté par six espèces : Culex pipiens, Culex impudicus, Culex territans, Culex perexiguus, Culex hortensis, et Culex deserticola, tandis que les genres Culiseta, Anopheles et Aedes, ont été représentés par deux espèces chacun : Culiseta longiareolata et Culiseta subochrea ; Anopheles maculipennis s.l.et Anopheles claviger ; Aedes geniculatus et Aedes caspius respectivement. Une espèce (Uranotaenia unguiculata) a représenté le genre Uranotaenia.
20Ce nombre élevé d’espèces trouvées au niveau de la région de Tizi-Ouzou peut être expliqué par le nombre élevé de récoltes réalisées et de prospections faites durant 17 mois, de février 2019 à juin 2020. Ou même, par le nombre important de gîtes inventoriés, 20 distribués dans neuf communes.
21Parmi les espèces trouvées dans le présent travail, cinq sont citées pour la première fois à Tizi-Ouzou: Cx. deserticola, Ae. geniculatus, An. claviger, Cs. subochrea et Ur. unguiculata. Cette première citation est peut être due au manque d’études sur les Culicidae dans cette région.
22Quatre espèces ont été déjà trouvées dans la même région par Lafri et al. (2014): An. maculipennis s.l., Cx. pipiens, Cx. territans et Cs. longiareolata. Ces auteurs ont rapporté aussi la présence de deux spécimens adultes de l’Ae. albopictus. De même, une femelle de cette espèce a été capturée dans la région de Larbaa Nath Irathen (Tizi-Ouzou) en 2010 par Izri et al. (2011). Par contre, elle a été absente dans nos résultats et elle n’a pas été observée dans notre prospection. Cela peut être dû à la nature des gîtes prospectés. Cette espèce vit proche de l’homme à l’intérieur des habitations : elle pond des œufs dans les petites collections d’eau, dans les jarres, les futs, les vases, les soucoupes placées sous les pots de fleurs, les boites de conserves etc… (Darriet, 2019). Cela peut être dû également à la méthode d’échantillonnage utilisée qui a été basée sur la collecte des larves dans notre étude alors que les auteurs ont indiqué la présence d’adultes.
23Le complexe An. maculipennis s.l. est composé d’espèces morphologiquement semblables qui ne peuvent être identifiées que par des techniques moléculaires, An. labranchiae a été la seule représentante de ce complexe au Nord-ouest Marocain (Laboudi et al., 2014), et à Sétif (Algérie) (Nabti & Bounechada., 2019). A partir des résultats enregistrés dans le tableau 2, nous avons recensé un effectif total d’individus récoltés dans différents gîtes au niveau de la région de Tizi-Ouzou égal à 3746. Le genre Culex a été le plus fréquent avec un total de 1888 (50%) larves. Le genre Culiseta a pris la deuxième position ; il a réunit 1633 (44%) larves. La troisième position a été prise par le genre Anopheles, soit 168 (4%) larves. Les genres Aedes (38 larves) et Uranotaenia (19 larves) ont été faiblement présentés par un pourcentage de 1% chacun.
Tableau 2 : Indices écologiques des espèces de Culicidae récoltées au niveau de la région de Tizi-Ouzou de février 2019 à juin 2020. Dont ni est le nombre d’individus de l’espèce considérée, F (%) est la fréquence relative, pi est le nombre des relevés contenant l’espèce i, Fi (%) est la fréquence d’occurence, H est l’indice de S hannon Weaver, H’ max est la diversité maximale, E est l’indice d’équitabilité.
|
Espèce |
ni |
F (%) |
pi |
Fi (%) |
Catégorie |
|
Culex (Culex) pipiens Linnaeus, 1758 |
1668 |
44.53 |
122 |
33.06 |
Accessoire |
|
Culex (Neoculex) impudicus Ficalbi, 1890 |
58 |
1.55 |
13 |
3.52 |
Accidentelle |
|
Culex (Neoculex) territans Walker, 1856 |
41 |
1.09 |
10 |
2.71 |
Accidentelle |
|
Culex (Culex) perexiguus (Theobald, 1903) |
7 |
0.19 |
2 |
0.54 |
Accidentelle |
|
Culex (Maillotia) hortensis Ficalbi, 1889 |
101 |
2.70 |
19 |
5.15 |
Accidentelle |
|
Culex (Maillotia) deserticola Kirkpatrick, 1925 |
13 |
0.35 |
3 |
0.81 |
Accidentelle |
|
Culiseta (Allotheobaldia) longiareolata (Macquart, 1838) |
1572 |
41.96 |
133 |
36.04 |
Accessoire |
|
Culiseta (Culiseta) subochrea (Edwards, 1921) |
61 |
1.63 |
7 |
1.90 |
Accidentelle |
|
Anopheles (Anopheles) maculipennis s.l. Meigen, 1818 |
59 |
1.58 |
20 |
5.42 |
Accidentelle |
|
Anopheles (Anopheles) claviger (Meigen, 1804) |
109 |
2.90 |
24 |
6.51 |
Accidentelle |
|
Aedes (Finlaya) geniculatus (Olivier, 1791) |
17 |
0.45 |
5 |
1.36 |
Accidentelle |
|
Aedes (Ochlerotatus) caspius (Pallas, 1771) |
21 |
0.56 |
7 |
1.90 |
Accidentelle |
|
Uranotaenia (Pseudoficalbia) unguiculata Edwards, 1913 |
19 |
0.51 |
4 |
1.08 |
Accidentelle |
|
Total |
3746 |
100 |
369 |
100 |
|
|
H’ |
1.85 bits |
||||
|
H’ max |
3.7 |
||||
|
E |
0.5 |
||||
24Au Cameroun, Bakwo Fils et al. (2009) ont trouvé d’un ensemble de 6740 adultes identifiés, 4035 (59,84%) appartenant au genre Culex. De son coté, Kayedi et al. (2020) ont trouvé d’un ensemble de 4211 moustiques piégés au niveau de la province de Lorestan (Iran), 94,68% appartenant au même genre ; cela montre la forte dominance de celui-ci au Cameroun et à Iran.
25Culex pipiens est l’espèce la plus abondante avec un effectif égal à 1668 et une fréquence relative de 44,53%, suivie par Culiseta longiareolata, avec 1572 larves et une fréquence de 41,96%. Les autres espèces ont occupé des effectifs plus ou moins faibles. Cx. pipiens a été trouvée d’un fort effectif dans les gîtes anthropiques urbains (puits, réservoir d’une fontaine, canal d’évacuation, regards d’égout, barque). Elle a été trouvée également en faibles effectifs dans les gîtes ruraux, que se soit naturels ou artificiels (étang, retenue d’eau, baril). Cela montre sa préférence pour les gîtes anthropiques urbains. Selon Almeida et al. (2020), les milieux anthropiques offrent des conditions favorables à certaines espèces, Berchi et al. (2012) ont indiqué que Cx. pipiens fréquente les gîtes urbains épigés et hypogés où la pollution d’origine organique est importante.
26La faiblesse des effectifs des autres espèces peut être expliquée par la localisation de leurs gîtes : ils étaient isolés et loin des mouvements humains, ce qui empêche le contact des moustiques avec l’homme pour les besoins du sang. Mais aussi par l’assèchement des gîtes temporaires pendant la période estivale, ce qui a diminué le nombre de récoltes, et les précipitations qui ont causé le lessivage (cas de petites retenues d’eau).
27Culiseta longiareolata a représenté la fréquence d’occurrence la plus élevée 36,04%, suivie par Culex pipiens avec 33,06%. Ces deux espèces étaient classées dans la catégorie accessoire. Elles étaient présentes presque dans toutes les communes étudiées. Leur abondance élevée s’explique par leur adaptation aux variations des conditions environnementales de la région d’étude. Selon Bouabida et al. (2012), Cx. pipiens et Cs. longiareolata se développent dans tous types de gîtes, qu’ils soient artificiels ou naturels. Leur probabilité de rencontre est élevée et leur pouvoir de dispersion est considérable.
28L’indice de Shannon Weaver calculé au niveau de la région de Tizi-Ouzou est de 1.85 bits. Cette valeur désigne un milieu moyennement diversifié. La valeur d’équitabilité trouvée est de 0.5, ce qui signifie que les espèces trouvées n’ont pas les mêmes abondances. Dans la région de Souk-Ahras (Algérie) Hamaidia & Berchi (2018) ont trouvé un indice de Shannon Weaver égal à 2.505 bits et une équitabilité de 0.677, ce qui explique un milieu moyennement diversifié.
Répartition des moustiques dans la région de Tizi-Ouzou
29La distribution des moustiques dans la région de Tizi-Ouzou pendant la période d’étude est représentée dans la figure 4.
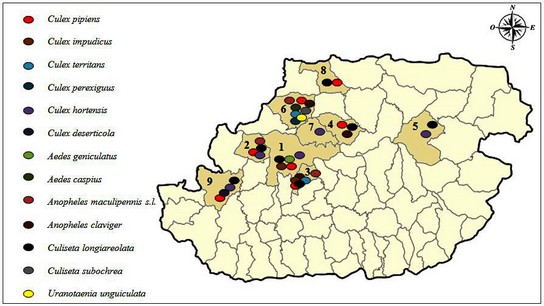
Figure 4 : Répartition des espèces de Culicidae dans la région de Tizi-Ouzou durznt la période d’étude, 1 Tizi-Ouzou, 2 Draa Ben Khedda, 3 Beni Aissi, 4 Ouaguenoun, 5 Azazga, 6 Makouda, 7 Ait Aissa Mimoune, 8 Tigzirt, 9 Ait Yahia Moussa.
30La commune de Makouda semble être très diversifiée : elle héberge les cinq genres recensés. Huit espèces ont été trouvées: Cx. perexiguus, An. claviger, An. maculipennis s.l., Cx. pipiens, Cx. territans, Cs. subochrea, Ae. caspius et Ur. unguiculata. Cette richesse spécifique peut être expliquée par la présence d’une végétation très abondante aux alentours. Selon Bouabida et al. (2012), la structure de la végétation assure un microclimat thermique et lumineux favorables. De son coté, Hamaidia & Berchi (2018) ont indiqué qu’on trouve beaucoup d’espèces dans un milieu donné lorsque les conditions de vie dans celui-ci sont favorables.
31Une biodiversité moyennement considérable a été trouvée dans les communes de Tizi-Ouzou, Draa Ben Khedda, Beni Aissi et Ait Yahia Moussa. Cela revient à la durabilité de leurs gîtes prospectés. Ils étaient majoritairement permanents, présents durant toute l’année, ce qui a augmenté le nombre de récoltes. Cinq espèces sont présentes dans la commune de Tizi-Ouzou: Cs. longiareolata, Cx. impudicus, Cx. pipiens, Cx. hortensis, Ae. geniculatus. Quatre à Draa Ben Khedda: Cx. pipiens, Cx. hortensis, Cs. longiareolata, An. maculipennis s.l.. Six à Beni Aissi: Cx. pipiens, Cx. impudicus, Cx. territans, Cs. longiareolata, An. maculipennis s.l., An. claviger. Et quatre à Ait Yahia Moussa: Cx. pipiens, Cx. deserticola, Cx. hortensis, Cs. longiareolata.
32Les communes d’Azazga, Ouaguenoun et Tigzirt ont présenté une biodiversité moyennement faible. Cela peut être expliqué par l’absence de la végétation auprès des gîtes ou à leur rapprochement aux activités anthropiques. Deux espèces ont été trouvées à Azazga: Cx. hortensis, Cs. longiareolata. Trois à Ouaguenoun: Cs. longiareolata, Cx. pipiens, An. claviger. Et deux à Tigzirt: Cs. longiareolata, Cx. pipiens.
33La diversité spécifique la plus faible a été trouvée dans la commune d’Ait Aissa Mimoune. Une espèce: Cx. hortensis a représenté cette dernière. Cela est dû à la nature du gîte prospecté, temporaire, qui a diminué le nombre de récoltes. Il s’agit d’une petite retenue d’eau, disparue en septembre par le lessivage. Le nombre d’espèces inventoriées est en fonction du nombre d’individus récoltés (Faurie et al., 1980 in Bouabida et al., 2012).
34Culex pipiens a été capturée dans treize gîtes larvaires: dix anthropiques et trois naturels, réparties sur sept communes: Tizi-Ouzou, Draa Ben Khedda, Beni Aissi, Ouaguenoun, Makouda, Tigzirt, Ait Yahia Moussa, et pendant toute l’année dans les gîtes permanents. C’est une espèce à forte aptitude écologique qui présente une dynamique saisonnière annuelle. Au Maroc, El Ouali Lalami et al. (2009) ont considéré cette espèce comme la plus fréquente au Maroc. Elle a été présente dans tous les gîtes durant toute l’année. Cx pipiens est l’espèce la plus présente en Algérie (Benallal et al., 2015 ; Kharoubi et al., 2020), en Tunisie (Krida et al., 2010), et à l’Arabie Saoudite, dans la région d’Al Madinah Al Munawwarah (Alahmadi et al., 2020). C’est un vecteur majeur de filariose de Bancroft et des virus West Nile et la Valley du Rift en Egypte (Brunhes et al., 1999), et même du virus Usutu (Holicki et al., 2020). Dans la région du Maghreb, au cours de l’été 2010, Cx. pipiens a été trouvée infectée par les virus West Nile et la Valley du Rift par Amraoui et al. (2012).
35Culiseta longiareolata a été signalée présente dans douze gîtes larvaires: onze artificiels et un naturel, distribués sur sept communes: Tizi-Ouzou, Draa Ben Khedda, Beni Aissi, Ouaguenoun, Azazga, Tigzirt, Ait Yahia Moussa. C’est une espèce cosmopolite (Khaligh et al., 2020) qui présente une grande capacité à coloniser différents gîtes. Plusieurs auteurs ont indiqué la présence de cette espèce en Algérie, notamment Messai et al. (2010) à Mila, Bouabida et al. (2012) à Tébessa, Amara Korba et al. (2015) au lac Tonga, Hamaidia & Berchi (2018) à Souk-Ahras, Benhissen et al. (2018) à Bousaada et Nabti & Bounechada (2019) à Sétif. Au Maroc, cette espèce a été aussi trouvée par Aouinty et al. (2017) et Ouattar et al. (2018). Elle est considérée comme vecteur important de plusieurs maladies, telles que la Brucellose, la grippe aviaire, et l’Encéphalite du Nil Occidental (Brunhes et al., 1999). C’est un hôte intermédiaire de Plasmodium aviaire qui peut transmettre la fièvre de Malte (Hazratian et al., 2019). Elle peut aussi provoquer de la Tularémie et des maladies arboviroses (Soltanbeiglu et al., 2020).
36Culex perexiguus a été collectée d’un seul gîte naturel, la retenue collinaire de la commune de Makouda. En Algérie, elle a été trouvée également à Tébessa par Bouabida et al. (2012), Souk-Ahras par Hamaidia & Berchi (2018), El Tarf dans le lac Tonga par Amara Korba et al. (2015), Bousaada par Benhissen et al. (2018), et dans les Oasis du Sahara, où elle a été signalée porteuse du virus West Nile par Benbetka et al. (2018). Selon Brunhes et al. (1999), Cx. perexiguus a transmis les virus West Nile et Sindbis en Egypte et dans plusieurs pays du Moyen orient. Récemment, en 2017, Elhawary et al. (2020) l’ont signalé présente en Egypte.
37Aedes caspius et Uranotaenia unguiculata ont été rencontrées dans un seul gîte naturel, une retenue d’eau au niveau de la commune Makouda. La première est une vectrice de filaires animales et d’arbovirus, alors que la seconde peut transmettre des parasites aux batraciens et aux reptiles (Brunhes et al., 1999). En Algérie, Ae. caspius a été trouvée aussi dans la région de Tébessa par Bouabida et al. (2012), Sétif par Nabti & Bounechada (2019). Alors qu’Ur. unguiculata a été trouvée à Mila par Messai et al. (2010), au lac Tonga par Amara Korba et al. (2015) et à Bousaada par Benhissen et al. (2018).
38Le complexe An. maculipennis s.l. est le vecteur principal de la Malaria en Europe et dans la région paléarctique (Ghavami, 2005). Au cours de notre prospection, il a été trouvé dans cinq gîtes: deux artificiels et trois naturels, distribués sur trois communes : Draa Ben Khedda, Beni Aissi, Makouda. Les espèces appartenant à ce complexe préfèrent les gîtes à eau propre, d’un aspect clair, où la végétation est abondante. El Ouali Lalami et al. (2009) ont trouvé Anopheles labranchiae dans les gîtes d’eau claire. En Algérie, ce complexe a été indiqué présent à Mila par Messai et al. (2010), El Tarf au niveau du lac Tonga par Amara Korba et al. (2015), Souk-Ahras par Hamaidia & Berchi (2018), Sétif par Nabti & Bounechada (2019). Au Maroc, Aouinty et al. (2017) et Ouattar et al. (2018) ont signalé sa présence.
39Anopheles claviger a été trouvée dans cinq gîtes: deux artificiels et trois naturels, répartis sur trois communes: Beni Aissi, Ouaguenoun, Makouda. C’est le vecteur du Paludisme au Maroc, dans le Haut Atlas (Carnevale & Robert., 2009).
40Culex territans a été inventoriée dans deux gîtes larvaires naturels: un étang à Beni Aissi et une retenue d’eau à Makouda. Cette espèce peut transmettre des filaires de batraciens. Cx. deserticola, Cx. hortensis, Cx. impudicus, Ae. geniculatus, Cs. subochrea ne jouent aucun rôle dans la transmission de parasitoses humaines (Brunhes et al., 1999).
41La répartition des moustiques dans la région de Tizi-Ouzou pendant la période d’étude dépend de la durabilité des gîtes larvaires prospectés (permanent ou temporaire). Celle-ci influe sur le nombre de prélèvements réalisés. Elle dépend également de leur localisation, leur rapprochement aux activités humaines et de la présence ou l’absence du couvert végétal.
CONCLUSION ET PERSPECTIVES
42L’étude de la faune Culicidienne de la région de Tizi-Ouzou (Nord d’Algérie) réalisée de février 2019 à juin 2020, a permis de recenser 13 espèces appartenant à cinq genres. Culex pipiens a été l’espèce la plus abondante suivie par Culiseta longiareolata. L’abondance importante de ces deux espèces montre leur adaptation aux conditions environnementales de cette région. Il ressort de ce travail que notre région d’étude héberge quelques espèces de moustiques vecteurs potentiels de maladies à transmission vectorielle.
43Ce travail bien que préliminaire, mériterait d’être plus élargi, par une poursuite de l’inventaire dans d’autres régions et durant plusieurs années pour avoir une liste plus complète des espèces de Culicidae en Algérie.
REMERCIEMENTS
44Nous remercions vivement Mr Benallal Kamel Eddine, Attaché à l’institut Pasteur d’Alger (Algérie) et Dr Nabti Ismahane, de l’Université Ferhat Abbas Sétif (Algérie) pour leur aide à la confirmation de notre identification.
Bibliographie
Alahmadi S., Ibrahim R., Messali M. & Ali M., 2020. Effect of aminopyridinium-based ionic liquids against larvae of Culex pipiens (Diptera: Culicidae), Journal of Taibah University for science, 14(1), 863-872.
Almeida J.F., Belchior H.C.M., Rios-Velasquez C.M. & Pessoa F.A.C., 2020. Diversity of mosquitoes (Diptera: Culicidae) collected in different types of larvitrapsin in an Amazon rural settelement, Plos One, 15(10), 1-15.
Amara Korba R., Boukraa S., Alayat M.S., Bendjeddou M.A., Francis F., Boubidi S.C. & Bouslama Z., 2015. Preliminary report of mosquitoes survey at Tonga lake (North-east Algeria). Advences in Environmental biology, 9(27), 288-294.
Amraoui F., Krida G., Bouattour A., Rhim A., Daaboub J., Harrat Z., Boubidi S.C., Tijane M., Sarih M. & Failloux A.B., 2012. Culex pipiens, an experimental efficient vector of West Nile and Rift Valley fever viruses in the Maghreb region, Plos One, 7(5), 1-8.
Aouinty B., Rihane A., Chennaoui M. & Mellouki F., 2017. Etude des gîtes larvaires de moustiques culicidés de la région de Mohammedia, littoral atlantique Marocain. Afrique science, 13(2), 120-129.
Bakwo Fils E.M., Akono P.N., Belong P. & Messi J., 2009. Impact des aménagements piscicoles sur le pullulement culicidien à Yaoundé, Cameroun, Entomologie faunistique-Faunistic entomology, 62(3), 109-114.
Bawin T., Seye F., Boukraa S., Zimmer J.Y., Delvigne F. & Francis F., 2014. La lutte contre les moustiques (Diptera : Culicidae) : diversité des approches et application du contrôle biologique, Entomological society of Canada, 00, 1-25p.
Becker N., Petric D., Zgomba M., Boase C., Madon M., Dahl C. & Kaiser A., 2003. Mosquitoes and their control. London New York : Springer Heidelberg Dordrecht. 577p.
Benallal K., Benbetka S., Tail G. & Harrat Z., 2015. Molecular characterization of Culex pipiens (Diptera: Culicidae) in Reghaia lake, Algeria. Annals of biological sciences, 3(1), 20-24.
Benallal K., Allal-Ikhlef A., Benhamouda K., Schaffner F. & Harrat Z., 2016. First report of Aedes (Stegomyia) albopictus (Diptera: Culicidae) in Oran, West of Algeria. Acta tropica. 164, 411-413.
Benallal K., Garni R., Bouiba L. & Harrat Z., 2019. First detection of Aedes albopictus (Diptera: Culicidae) in Algiers, the capital city of Algeria.J Arthropod-Borne Dis, 13(4), 420-425.
Benbetka S., Hachid A., Benallal K.E., Benbetka C., Khaldi A., Bitam I. & Harrat Z. 2018. First field evidence infection of Culex perexiguus by West Nile virus in Sahara Oasis of Algeria. J Vector Borne Dis, 55, 305-309.
Benhissen S., Habbachi W., Khellaf R. & Masna F., 2018. Etude entomologique et typologique des gites larvaires des moustiques (Diptera : Culicidae) dans la région de Bousaada (Algérie). Bulletin de la société royale de Liège, 87, 112-120.
Berchi S., Aouati A. & Louadi K., 2012. Typologie des gites propices au développement larvaire de Culex pipiens L. 1758 (Diptera: Culicidae), source de nuisance à Constantine (Algérie). Ecologia mediterranea, 38(2), 5-16.
Bouabida H., Djebbar F. & Soltani N., 2012. Etude systématique et écologiques des moustiques (Diptera : Culicidae) dans la région de Tébessa (Algérie). Entomologie faunistique-Faunistic entomology, 65, 99-103.
Brunhes J., RhaimA., Geoffroy B., Angel G. & Hervy J.P., 1999. Les Culicidae de l’Afrique méditerranéenne, Programme d’identification et d’enseignement, I.R.D. édition.
Carnevale P. & Robert V., 2009. Les anophèles biologie, transmission du Paludisme et lutte antivectorielle, I.R.D. édition : Marseille, 391p.
Croset H., Papierok B., Rioux J.A., Gabinaud A., Cousserans J. & Arnaud D., 1976. Absolute estimates of larval populations of culicid mosquitoes : comparison of «capture-recapture», «removal» and «dipping» methods. Ecological entomology, 1, 251-256.
Darriet F., 2014. Des moustiques et des hommes : Chroniques d’une pullulation annoncée. IRD : Marseille, 136p.
Darriet F., 2019. Le moustique tigre : le conquérant, Espèces, 34, 14-21.
Delaunay P., Jeannin C., Schaffner F. & Marty P., 2009.Actualités 2008 sur la présence du moustique tigre Aedesalbopictus en France métropolitaine, 24es journées annuelles du GPIP : Science Direct, 66-71.
Elhawary N.A., Soliman M.A., Seif A.I. & Meshrif W.S., 2020.Culicine mosquitoes (Diptera: Culicidae) communities and their relation to physicochemical characteristics in three breeding sites in Egypt, Egyptian journal of zoology, 1-13.
El Joubari M., Louah A. & Himmi O., 2014. Les moustiques (Diptera, Culicidae) des marais de Smir (nord-ouest du Maroc) : inventaire et biotypologie, Bull. Soc. Pathol. Exot, 107, 48-59.
El Ouali Lalami A., Hindi T., Azzouzi A., Elghadraoui L., Maniar S., Faraj C., Adlaoui E.B., Ameur I. & Ibensouda Koraichi S., 2009. Inventaire et répartition saisonnière des Culicidae dans le centre du Maroc, Entomologie faunistique- Faunistic entomology, 62(4), 131-138.
Faurie C., Ferra C. & Medori P., 1980. Ecologie, Baillière J.B. (ed) : Paris, 1091p in Bouabida et al., 2012. Etude systématique et écologiques des moustiques (Diptera : Culicidae) dans la région de Tébessa (Algérie). Entomologie faunistique-Faunistic entomology, 65, 99-103.
Ghavami M.B., 2005. Estimation and comparison of Anopheles maculipennis s.l. (Diptera: Culicidae) survival rates with light-trap and indoor resting data, Iranian J Publ Health, 34(2), 48-57.
Hamaidia H., & Berchi S., 2018. Etude systématique et écologique des moustiques (Diptera: Culicidae) dans la région de Souk-Ahras (Algérie). Entomologie faunistique-Faunistic entomology. 71. 1-8.
Hazratian T., Paksa A., Sedaghat M.M., Vatandoost H., Moosa-Kazemi S.H., Sanei-Dehkordi A., Salim-Abadi Y., Pirmohammadi M., Yousefi S., Amin M. & Oshaghi M.A., 2019. Baseline susceptibility of Culiseta longiareolata (Diptera: Culicidae) to different imagicides, in Eastern Azerbaijan, Iran, J Arthropod-Borne Dis, 13(4), 407-415.
Holicki C.M., Scheuch D.E., Zeigler U., Lettow J., Kampen H., Werner D. & Groschup M.H., 2020. German Culex pipiens biotype molestus and Culex torrentium are vector-competent for Usutu virus, Parasites vectors, 13(625), 1-10.
Izri A., Bitam I. & Charrel R.N., 2011. First entomological documentation of Aedes (Stegomyia) albopictus (Skuse, 1894) in Algeria, Microbiol. Infect, 17, 7.
Kayedi M.H., Sepahvand F., Mostafavi E., Chinikar S., Mokhayeri H., Sharafi A.C., Wong G., Shahhosseini N. & Moosa Kazemi S.H., 2020. Morphological and molecular identification of Culicidae mosquitoes (Diptera: Culicidae) in Lorestan, Western Iran, Heliyon, 6, 1-5.
Khaligh F.G., Naghian A., Soltanbeiglou S. & Gholizadeh S., 2020. Autogeny in Culiseta longiareolata (Culicidae: Diptera) mosquitoes in laboratory conditions in Iran, BMC Res Notes, 13(81), 1-5.
Kharoubi R., Rehimi N. & Soltani N., 2020. Essential oil from Mentha rotundifolia harvested in Northeast Algeria : Chemical composition, larvicidal and enzymatic activities on Culex pipiens larvae. Transylvanian review, XXVII(47), 14724-14732.
Krida G., Diancourt L., Bouattour A., Rhim A., Chermiti B. & Failloux A.B., 2010. Estimation du risque d’introduction du virus de la fièvre de la Vallée du Rift en Tunisie par le moustique Culex pipiens, Bull. Soc. Pathol. Exot, 1-10.
Krupa E., Schaffner F., Bender C. & Mathieu B., 2020. Progression du moustique tigre en France : surveillance transfrontalière dans le Grand-Est, Revue francophone des laboratoires, 524, 53-61.
Laboudi M., Sadak A., Ouahabi S., Boccolini D. & Faraj C., 2014. Molecular characterization of Anopheles maculipennis complex (Diptera: Culicidae) in Northern Morocco, Entomologie faunistique- Faunistic entomology, 67, 37-42.
Lafri I., Bitam I., Beneldjouzi A. & Ben Mahdi M.H., 2014. An inventory of mosquitoes (Diptera: Culicidae) in Algeria. Bulletin de la société zoologique de France, 139(1-4), 255-261.
Matile L., 1993. Les diptères d’Europe occidentale, Vol 1, Société nouvelle des éditions Boubée :Paris, 439p.
Messai N., Berchi S., Boulknafd F. & Louadi K., 2010. Inventaire systématique et diversité biologique de Culicidae (Diptera: Nematocera) dans la région de Mila (Algérie). Entomologie faunistique-Faunistic entomology, 63(3), 203-206.
Nabti I. & Bounechada M., 2019. Mosquito biodiversity in Setif region (Algerian high plains), density and species distribution across two climate zones. Entomologie faunistique- Faunistic entomology, 72, 161-176.
Ouattar H., Sassa S., Allami H., Slim M. & Fadli M., 2018. CulicidaeDiptera insects of some temporary pools of the Mamora forest : inventory and dynamics, International journal of Multidisciplinary research and development, 5(7), 1-7.
Rehimi N. & Soltani N., 1999. Laboratory evaluation of Alsystin, a chitin synthesis inhibitor against Culex pipiens pipiens L. (Dip., Culicidae): effects on development and cuticle secretion, J. Appl. Ent, 123, 437-441.
Rioux J.A., 1958. Les Culicides du «Midi» méditerranéen, étude systématique et écologique. Paris : Paul Lechevalier (Encylopédie entomologique), 303p.
Schaffner F. & Mathieu B., 2020. Identifier un moustique : morphologie classique et nouvelles techniques moléculaires associées pour une taxonomie intégrée, Revue Francophone des laboratoires, 524, 24-33.
Silver J.B., 2008. Mosquito ecology : Field sampling methods, 3ed edition, Springer : New-York, 1477p.
Soltanbeiglu S., Vahedi M., Mohammadi-Buvani M. & Chavshin A.R., 2020. Molecular characterisation of Cytochrome oxidase I and internal transcribed Spacer 2 fragments of Culiseta longiareolata, Turkey Parazitol Derg, 44(4), 191-196.
(46 Ref.)