- Portada
- Volume 75 (2022)
- Note sur la présence de Livia crefeldensis Mink, 1855 en Belgique (Hemiptera : Psylloidea, Liviidae)
Vista(s): 1584 (21 ULiège)
Descargar(s): 69 (0 ULiège)
Note sur la présence de Livia crefeldensis Mink, 1855 en Belgique (Hemiptera : Psylloidea, Liviidae)

Documento adjunto(s)
Version PDF originaleRésumé
L’Hémiptère Liviidae Livia crefeldensis Mink, 1855 est signalé pour la première fois en Belgique. Une femelle fut capturée au filet fauchoir le 9 septembre 2016 dans une minuscule zone humide près de la gare ferroviaire de Gembloux (province de Namur). Le 4 septembre 2018, une seconde femelle ainsi que deux exuvies nymphales et une galle y sont notées sur Carex disticha, une nouvelle plante-hôte identifiée pour ce psylle. L’habitat est une magnocariçaie isolée au bord d’un champ cultivé. Cette espèce est très rare partout en Europe avec une majorité de mentions anciennes. Les connaissances relatives à sa répartition et son écologie sont résumées et l’intérêt biologique du site est documenté. D’autres espèces remarquables ont été notées sur ce site dont les cicadelles Cosmotettix costalis (Fallén, 1826) et Macrosteles sardus Ribaut, 1948, nouvelles pour la faune belge, la punaise hygrophile Drymus pumilio Puton, 1877, ainsi que l'escargot Vertigo moulinsiana (Dupuy, 1849) inscrit à l’annexe 2 de la Directive CEE Habitats.
Abstract
The jumping plant-louse Livia crefeldensis Mink, 1855 is recorded for the first time from Belgium. An adult female was caught by sweeping net on 9 September 2016 in a small marshland near the railway station of Gembloux (province of Namur). On 4 September 2018, a second female, two nymphal exuvia and a gall were noted at the same location on Carex disticha, a new host plant for the species. The habitat is a sedge bed marsh vegetation isolated at the edge of a cultivated field. It's a very rare psyllid throughout Europe, with most of old records. The knowledge of its distribution and ecology is summarized and the biological interest of the site is documented. Other notable species include the leafhoppers Cosmotettix costalis (Fallén, 1826) and Macrosteles sardus Ribaut, 1948 which are new to Belgian fauna, the rare seed bug Drymus pumilio Puton, 1877, as well as the snail Vertigo moulinsiana (Dupuy, 1849) listed in Annex II of the Habitats Directive.
Tabla de contenidos
Reçu le 5 janvier 2022, accepté le 22 août 2022
Cet article est distribué suivant les termes et conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr.
INTRODUCTION
1L’inventaire d’un site exigu et isolé au sein d’un paysage de grandes cultures réserve quelquefois de belles surprises au naturaliste, alors que le contexte général semble a priori bien peu favorable à l’épanouissement d’une biodiversité remarquable. Ainsi, le 9 septembre 2016, lors de la prospection entomologique d'un minuscule marais situé en bordure du parking de la gare ferroviaire de Gembloux (Belgique, province de Namur), quel ne fut pas mon étonnement de découvrir dans la poche du filet un spécimen adulte de l’Hémiptère Livia crefeldensis Mink, 1855, un psylle réputé rare partout en Europe et que je tentais désespérément de dénicher en Belgique depuis plus de vingt ans, au point d’en devenir quasi mythique ! Plus surprenant encore, l’espèce sera revue deux ans plus tard exactement au même endroit et dans d’identiques circonstances.
2Outre l’intérêt biogéographique de cette trouvaille justifiant la synthèse des données relatives à la chorologie et à l’écologie de L. crefeldensis, il me paraît également opportun d'attirer l’attention sur la faune remarquable qui habite cette zone humide relictuelle, sur laquelle pèsent de fortes menaces d’urbanisation.
DETAIL DES OBSERVATIONS
3Matériaux examinés. Province de Namur : Gembloux, zone humide du Buisson Saint-Guibert (UTM 31UFS1903 ; altitude 152 m), 9.ix.2016, 1♀ au filet ; 4.ix.2018, 1♀ au filet, 2 exuvies nymphales et une galle sur Carex disticha (tous leg., coll. et det. J.-Y. Baugnée)1.Les conditions météorologiques étaient à peu près semblables les deux journées (météo calme et températures douces, précédées de périodes plutôt sèches) et les insectes ont été récoltés quasiment au même endroit, à deux mètres près (Figure 1). L'unique galle notée en 2018 a été découverte après quinze minutes de recherche à l’endroit même où l’adulte a été récolté, les exuvies étant accolées à la structure. En ce qui concerne l’identité de la plante-hôte, il y a eu hésitation entre la laîche hérissée (Carex hirta) et la laîche distique (C. disticha), toutes deux étant effectivement présentes dans la station mais dans un état de dessication au moment des observations : un examen attentif de l’échantillon et une coupe anatomique dans le limbe foliaire a permis de trancher en faveur de C. disticha.
4Le site s’étend à l'ouest du parking de la gare SNCB, en marge d’une vaste parcelle agricole contiguë à la voie cyclable et piétonne (ligne n° 147 du RAVeL) empruntant l’assise de l’ancienne ligne de chemin de fer Landen-Tamines (Figure 2). La carte topographique de l’IGN ne renseignant aucun lieu-dit, la situation et le caractère marécageux de l’endroit autorisent à le désigner sous le nom de "Zone humide du Buisson Saint-Guibert", ou mieux peut-être, du "Marais de l’Agasse", du nom d’un quartier et d’une rue voisine. Ce terrain d’à peine 0,45 ha est l’une des toutes dernières zones humides subsistant au nord-ouest du territoire communal dont les terres, limoneuses et fertiles, sont essentiellement vouées à l’agriculture intensive tout en subissant une pression urbanistique de plus en plus forte.
5L’origine et l’historique de ce marais ne semblent guère documentés. L’analyse des documents cartographiques consultables sur le Géoportail de la Wallonie apportent certes quelques éléments2. A la fin du 18ème siècle, la carte du Comte de Ferraris montre la présence d’un ruisseau coulant à travers des prairies, d’abord vers le sud, bifurquant ensuite vers l’est en direction de l’Escaille où il rejoint l’Orneau. La carte de Vandermaelen parue vers 1850 indique toujours la présence de ces prairies, mais quinze ans plus tard, celles-ci semblent avoir fortement régressé, la Carte du Dépôt de la Guerre ne figurant plus aucun cours d’eau à cet endroit. C’est à cette époque qu’est inaugurée la ligne de chemin de fer Landen-Tamines. On ignore quand le site a pris sa physionomie actuelle mais c’était déjà le cas il y a au moins cinquante ans, comme en témoigne notamment sa situation sur l’orthophotoplan de 1971. La parcelle formait alors une sorte d’extension rectangulaire de la friche de l’ancienne gare de triage laquelle, après une période d’abandon, fut aménagée fin des années 2000 en vaste parking attenant à la nouvelle gare de Gembloux. Il est difficile de savoir si le terrain était déjà de nature marécageuse durant les années septante ou si celle-ci est apparue ultérieurement (par exemple à la faveur de travaux d’infrastructure).
6La flore a fait l’objet de relevés épisodiques entre 2008 et 2019. La description qui suit repose essentiellement sur ces données dans la mesure où aucun autre inventaire antérieur ou contemporain n'a pu être trouvé pour ce site. La partie centrale du marais, qui repose sur un sol généralement gorgé d’eau durant tout l’hiver, est constituée principalement d'une magnocariçaie à laîche aigüe (Carex acuta) poussant typiquement en touradons, localement mêlée avec la laîche à bec (C. rostrata), la laîche distique (C. disticha) et la laîche hérissée (C. hirta). Cette végétation, très ponctuelle dans la région, correspond dans la typologie WalEUNIS à l’habitat D5.21a - Cariçaies à Carex acuta. Elle est ourlée d’éléments de mégaphorbiaie et de prairie humide à hautes herbes (habitat E5.411 - Mégaphorbiaies nitrophiles et hygrophiles), avec entre autres l’épilobe hirsute (Epilobium hirsutum), le lychnis fleur de coucou (Lychnis flos-cuculi), la prèle des marais (Equisetum palustre), la renouée amphibie (Persicaria amphibia), le liseron des haies (Calystegia sepium), la reine des prés (Filipendula ulmaria), le cirse des marais (Cirsium palustre), l’ortie dioïque (Urtica dioica), l’achillée sternutatoire (Achillea ptarmica), le lotier des fanges (Lotus pedunculatus), etc. S’y ajoutent de petites roselières à baldingère (Phalaris arundinacea), quelques massettes à larges feuilles (Typha latifolia) et l’une ou l’autre plage de scirpe des bois (Scirpus sylvaticus), en particulier à l’endroit d’une rigole d’écoulement, en contrebas du talus du RAVeL, où est présent également un peuplement irrégulier de cresson de fontaine (Nasturtium officinale). On observe depuis quelques années un développement important des ronces (Rubus fruticosus s.l.) jusque dans le noyau le plus humide du site.

Figure 1 : Habitat de Livia crefeldensis à Gembloux au moment de la seconde observation, 4.ix.2018 (© J.-Y. Baugnée).

Figure 2 : Situation du marais du Buisson Saint-Guibert à Gembloux : à l’est, le parking de la nouvelle gare SNCB, à l’ouest le champ cultivé (orthophotoplan 2018 © Service public de Wallonie).
7La marge méridionale du marais est plus sèche et comporte une friche rudérale à fromental (Arrhenatherum elatius), constituant une zone tampon avec le champ voisin. En outre, dans le coin sud-est du marais se développent des fourrés formés notamment du noisetier (Corylus avellana), de l’aubépine à un style (Crataegus monogyna), de l’un ou l’autre saule (Salix spp.), du framboisier (Rubus idaeus), de ronces (R. fruticosus s.l.) mais aussi de l’invasive renouée du Japon (Fallopia japonica).
Les psylles, groupe méconnu
8Livia crefeldensis fait partie de la superfamille des Psylloidea, un groupe d’Hémiptères sternorhynques proches des pucerons et communément nommés psylles, terme issu du grec "psulla" signifiant puce (d’où les appellations "bladvlooien" en néerlandais, "Blattflöhe" en allemand, "jumping plant-lice" en anglais, …). Ce sont des insectes terrestres ailés au stade adulte, de taille petite à modérée (1-6 mm), à antennes généralement de 10 articles, à pattes postérieures pourvues d’un organe saltatoire, à larves aplaties dorso-ventralement, et à diète exclusivement composée de sève végétale, la plupart montrant une haute spécialisation trophique qui se traduit par une association étroite avec une espèce ou un genre végétal bien précis (Hodkinson, 2009 ; Burckhardt et al., 2014 ; Burckhardt et al., 2021).
9Si l’on compte au moins 4000 espèces de Psylloidea décrites à travers le monde (Burckhardt & Ouvrard, 2012 ; Burckhardt et al., 2021) dont environ 400 en Europe (Burckhardt, 2013), ce groupe est d’une diversité assez modérée sur le territoire de la Belgique avec 78 espèces répertoriées à ce jour (Baugnée et al., 2002 ; Baugnée, 2013 + données non publiées), pour 69 espèces aux Pays-Bas (den Bieman et al., 2019). Ceci-dit, les connaissances faunistiques régionales peuvent être qualifiées de médiocres, principalement à cause d’un manque d’intérêt porté aux Psylloidea ; en effet, seules quelques espèces ayant un impact agronomique, notamment en tant que vecteurs de phytoplasmes, font l’objet de recherches ciblées (voir par ex. Fassotte et al., 2010 pour le cas des vergers). Néanmoins, quelques taxons cécidogènes bénéficient du regain d’attention porté aux galles de nos régions depuis une dizaine d’années (Lambinon et al., 2015).
10Livia crefeldensis vient donc compléter la liste des Psylloidea de Belgique en étant le second représentant du genre trouvé avec certitude dans le pays. En intensifiant les prospections et en complétant l’étude des matériaux disponibles dans les collections, il est certain que l’on parviendra à enrichir encore l’inventaire d’au moins 10-15 espèces (sans compter les taxa exotiques de plus en plus nombreux à apparaître, voire à s’établir, à nos latitudes).
Le genre Livia
11Traditionnellement, le genre Livia Latreille, 1802 [= Diraphia Waga, 1842] était classé soit parmi la famille des Psyllidae, soit parmi celle des Aphalaridae, mais le plus souvent dans une sous-famille particulière, les Liviinae (Heslop-Harrisson, 1949 ; Hodkinson & Bird, 2000) que certains auteurs ont même élevé, dans un sens restreint, au rang de famille avec pour seul composant le genre type (voir par ex. Hodkinson & White, 1979). Longtemps discutées, la position systématique et la composition de cette sous-famille ont récemment été réévaluées par Burckhardt & Ouvrard (2012) qui y rangent, aux côtés de Livia, cinq autres genres (dont Camarotoscena Haupt, 1935). Cette opinion vient d’être largement étayée par les données moléculaires (Burckhardt et al., 2021). Ces deux études confirment et redéfinissent également la famille Liviidae qui se compose donc désormais de trois sous-familles : Liviinae, Euphyllurinae (avec Psyllopsis Löw, 1879 et Strophingia Enderlein, 1914, parmi les genres de la faune belge) et Neophyllurinae (créée par Burckhardt et al., 2021, pour accueillir l’unique genre Neophyllura Loginova, 1973).
12Les Livia sont remarquablement bien typés sur le plan morphologique. Chez les adultes, le caractère le plus évident est l’aspect de la tête : très développée, celle-ci est dépourvue de cônes génaux (au contraire des Psyllidae et des Triozidae, par ex.) et présente une face dorsale (vertex) plus longue que large, plane, avec au bord antérieur deux lobes arrondis séparés par une échancrure plus ou moins profonde (Figure 4-5). La conformation des antennes est également singulière : bien que comportant les dix articles habituels, elles s’avèrent plus courtes que celles de la plupart des autres Psylloidea, avec le second article fortement dilaté et nettement plus gros que tous les autres (Hodkinson & White, 1979 ; Ossiannilsson, 1992). Les larves se démarquent par un corps proportionnellement plus allongé que chez les autres Psylloidea et par l’absence de sectasetae (c’est-à-dire des soies modifiées à contours anguleux) sur le thorax et l’abdomen ; elles possèdent aussi des antennes courtes avec, comme chez les adultes, le second article plus long et large que les premier et troisième. Une autre différence importante avec les larves des autres psylles se trouve dans l’apparence de l’anneau du pore anal, fortement étranglé au niveau de ce dernier ou divisé en deux (White & Hodkinson, 1982).
13Les Livia constituent un genre numériquement modeste regroupant tout au plus 19 espèces dans le monde, à peu près toutes cantonnées aux régions de l’hémisphère nord (Hodkinson & Bird, 2000), mais dont quatre seulement sont répertoriées en Europe (Burckhardt, 2013). Livia junci (Schranck, 1789) [= L. juncorum (Latreille, 1798)], l’unique représentant rencontré jusqu’ici en Belgique, y est signalé de longue date (Lethierry, 1878 ; Lameere, 1900) et se trouve sur l’ensemble du territoire. C’est aussi l’espèce la plus répandue à travers la Région paléarctique occidentale (Hodkinson & Bird, 2000). Elle induit sur divers joncs (Juncus spp.) une déformation spectaculaire prenant la forme d’amas de feuilles rougeâtres caractéristiques. Cette galle, bien connue des cécidologues, ne passe guère inaperçue - contrairement à l’insecte adulte, fort discret - et est d’ailleurs très souvent figurée dans les ouvrages naturalistes, la plus ancienne illustration recensée datant de 1620 (Löw, 1881 ; Hedicke, 1920) !
14Livia crefeldensis Mink, 1855 et L. limbata (Waga, 1842), les deux autres espèces d’Europe centrale, sont associées aux laîches (Carex spp.) - tout au moins la première - et leur observation a toujours été beaucoup plus occasionnelle. Fin du 19ème et début du 20ème siècle, on a signalé leur présence ici et là dans plusieurs pays limitrophes de la Belgique mais ces indications furent souvent auréolées de doute, plus particulièrement en ce qui concerne L. limbata. Ainsi, Coubeaux (1892) avait-il estimé envisageable l’occurrence de ce dernier sur notre territoire, en se référant vraisemblablement à la citation de l’espèce du département du Nord par Lethierry (1874). Or, quelque 150 ans plus tard, l’existence de L. limbata en France reste toujours à prouver puisqu’on ne la connaît que par quelques très rares mentions de la littérature (Cocquempot et al., en prép.). Pour la même raison, cette espèce a été écartée lors de l’élaboration du catalogue des psylles des Pays-Bas, contrairement à L. crefeldensis (den Bieman et al., 2019).
15Il faut se souvenir qu’une certaine confusion régnait jadis à la suite de Löw (1882) qui plaça Livia limbata en synonyme de L. crefeldensis3, pendant que d’autres faisaient l’inverse ! Cette situation perdura quelques décennies, y compris dans la publication de Hedicke (1920), avec pour effet de compliquer l’interprétation des anciennes données de la littérature. La mise au point de Horváth (1921) fut nécessaire pour y voir plus clair ! En outre, jusqu’aux années 1980, nombre d’auteurs classaient ces deux espèces dans un genre distinct, Diraphia Waga, 1842 (e.a. Horváth, 1921 ; Haupt, 1935 ; Loginova, 1964 ; Klimaszewski, 1975). Considérant que celui-ci était antérieur à Livia, Hedicke (1920) établit même un nouveau genre, Neolivia, à l’existence éphémère et destiné à recevoir notamment L. limbata et L. crefeldensis, tout en (re)transférant L. junci parmi les Diraphia (voir l’historique dans Horváth, 1921 et Hodkinson & Bird, 2000).
16Quant au quatrième Livia d’Europe, à savoir L. mediterranea Loginova, 1974, il s’agit d’un taxon essentiellement confiné au bassin méditerranéen où il fut confondu avec L. crefeldensis (Loginova, 1974 ; Hodkinson & Bird, 2000).
17Pour l’identification des Livia adultes, on se référera à l’excellente révision mondiale de Hodkinson & Bird (2000). Auparavant, les trois espèces d’Europe centrale pouvaient déjà être distinguées aisément les unes des autres grâce aux clés illustrées de Haupt (1936) et de Loginova (1964). La plus récente clé de détermination de Serbina et al. (2015), réalisée dans le cadre d’une révision des psylles de Biélorussie, pourra se révéler utile également. Celles de Hodkinson & White (1979) et de Ossiannilsson (1992) ne traitent que de L. junci et L. crefeldensis.
18L’examen sous la loupe binoculaire révèle deux critères importants à l’origine de l’ancienne dichotomie Livia/Diraphia. Le premier est relatif au vertex, très large et rectangulaire chez Livia crefeldensis et L. limbata et avec une encoche médiane peu profonde au bord antérieur (Figure 5), tandis qu’il est visiblement plus étroit et rétréci vers l’avant chez L. junci et pourvu d’une profonde échancrure antérieure. Le second caractère concerne les proportions du 2ème article antennaire, un peu plus grand que le 1er article chez L. crefeldensis et L. limbata, alors qu’il est presque trois fois plus volumineux chez L. junci. L’appareil génital montre également des différences spécifiques plus ou moins marquées, surtout chez le mâle. C’est plus particulièrement le cas des paramères, lesquels, vus de profil, sont en forme de lancette assez large avec l’apex étroitement arrondi chez le mâle de L. crefeldensis, alors qu’ils sont proportionnellement plus étroits et rétrécis à l’apex en une petite saillie anguleuse chez les trois autres Livia européens.
19La silhouette et l’aspect général des insectes apportent aussi des éléments utiles pour séparer ces trois espèces sur le terrain. Livia crefeldensis arbore une couleur beige à peu près uniforme, avec les ailes antérieures concolores (mis à part quelques mouchetures brunes), à bord costal plus ou moins parallèle à la marge postérieure, et à l’apex arrondi (Figures 3-4). L. limbata, de coloration brunâtre plus foncée, s’en distingue par des ailes plus courtes, nettement élargies dans leur portion apicale et ornées d’une bande postéro-apicale enfumée. Quant à L. junci, avec sa teinte brun rouge caractéristique et ses ailes antérieures sensiblement rétrécies vers l’apex, il s’avère aisé à reconnaître, malgré des dimensions plus réduites (2,5 à 3 mm, contre 3-4 mm pour les deux autres espèces).
20White & Hodkinson (1982) fournissent une clé dichotomique des larves de dernier stade de L. junci et L. crefeldensis. Les principales différences résident dans la conformation du pore anal et des antennes ainsi que dans la présence (L. crefeldensis) ou l’absence de soies lancéolées sur les marges de l’abdomen. Les pores anaux des deux espèces sont également bien illustrés par Hodkinson & Bird (2000).

Figure 3 : Livia crefeldensis. Femelle en vue latérale - long. 3,9 mm (© J.-Y. Baugnée).

Figure 4 : Livia crefeldensis. Femelle en vue dorsale (© J.-Y. Baugnée).

Figure 5 : Livia crefeldensis. Avant-corps en vue dorsale (© J.-Y. Baugnée).

Figure 6 : Galle de Livia crefeldensis sur Carex distichia. Gembloux, 4.ix.2018 (© J.-Y. Baugnée).
Le point sur Livia crefeldensis
Données chorologiques
21Livia crefeldensis est une espèce eurasiatique dont l’aire de distribution, bien qu’étendue, souffre de nombreuses lacunes et incertitudes. Cela s'explique sans doute par la très faible représentativité de cet insecte dans les collections muséologiques et par la rareté des mentions dans la littérature. De plus, les citations historiques sont fréquemment sujettes à caution du fait des confusions passées avec L. limbata et L. mediterranea. Sur les médias actuels, les informations apparaissent tout aussi éparses, que ce soit au travers d’internet dans les sites spécialisés comme Psyl’list (Ouvrard, 2016) et les blogs dédiés à l’entomologie, que sur les portails naturalistes en ligne (par exemple aucune occurrence sur Waarnemingen.nl, Observations.be4 et iNaturalist5, quelques rares données sur GBIF6). A vrai dire, en dehors des photos originales du présent article déjà reprises sur le site "Plantparasieten van Europa" (Ellis, 2020), je n’ai pu dénicher que deux photos correspondant indubitablement à cette espèce, postées sur des sites danois (voir ci-après). Dans le même ordre d’idée, la plupart des spécialistes actifs en Europe, à commencer par D. Burckhardt, P. Lauterer et I. Malenovský, m’ont avoué ne l’avoir jamais récolté personnellement.
22Klimaszewski (1975), dans son important travail de compilation pour le Paléarctique occidental, cite L. crefeldensis d’une dizaine de pays depuis l’Espagne et la Grande-Bretagne jusqu’à la Turquie et le Caucase. Ossiannilsson (1992) reprend la plupart de ces pays et régions, dont l'Estonie, la Roumanie, l'Espagne, la Turquie. Dans leur monographie, Hodkinson & Bird (2000) indiquent avoir examiné du matériel provenant d’Allemagne, de Suède, de Grande-Bretagne et de Russie y compris la Sibérie, ajoutant, sur base de la littérature, la région de la Baltique, le Danemark, l’Estonie, la Finlande, la France, les Pays-Bas, la Pologne, la Turquie. Il existe en outre des mentions pour le Kazakhstan (Khlebutina, 1983) et la Biélorussie (Serbina et al., 2015).
23Toutefois, de nombreuses indications bibliographiques relatives aux pays de l’est et du sud de l’Europe et d’Afrique du Nord (Espagne, Italie, Algérie, Turquie, etc.) ont été remises en question depuis la description de L. mediterranea, une espèce qui se montre davantage répandue dans ces régions (Conci et al. 1993 ; Hodkinson & Bird, 2000 ; Drohojowska & Burckhardt, 2014 ; D. Burckhardt, in litt. 18.xi.2016). L'occurrence de L. crefeldensis en Roumanie demeure aussi incertaine dans la mesure où la référence utilisée par tous les auteurs européens, c'est-à-dire l'ouvrage de Dobreanu & Manolache (1962), semble avoir été mal interprétée, alors que ces auteurs précisent bien que l'espèce n'a pas été trouvée jusqu'ici dans le pays. Pour l’Espagne, Antolínez et al. (2019) ont tout récemment mentionné L. crefeldensis des environs de Salamanque mais le réexamen par D. Ouvrard des spécimens concernés a révélé qu'il s'agit en fait de L. mediterranea (M. Carnegie, in litt. 27.iv.2021).
24De la même façon, la majorité des citations du Caucase se rapporte aussi probablement à L. mediterranea (Gegechkori & Loginova, 1990 ; A.M. Gegechkori, in litt. 1.ii.2017). Pourtant, Livia crefeldensis existe bel et bien dans cette région, tout au moins en Géorgie comme le prouve la collecte d’un mâle et deux femelles à Tbilisi en juin 1957 par A. Hoffer (in coll. P. Lauterer, Musée de Brno), spécimens déterminés par I. Hodkinson en personne (I. Malenovský, in litt. 20.i.2017) ; il s’agirait en fait de la première occurrence formelle de L. crefeldensis pour la Géorgie (A. M. Gegechkori, in litt.). En définitive, les pays européens dans lesquels la présence de L. crefeldensis a été prouvée sont peu nombreux. Ainsi, sur le site de référence Fauna Europaea, Burckhardt (2013) ne retient que la Grande-Bretagne, le Danemark, la Finlande, la Suède, la France, l’Allemagne, la Pologne, la Roumanie et, avec doute, les Pays-Bas.
25Livia crefeldensis a été décrit d’Allemagne d’où il a été signalé à ce jour dans les länder de Rhénanie-du-Nord-Westphalie, Thuringe, Basse-Saxe, Brandebourg et Berlin (Burckhardt & Lauterer, 2003). Pour sa description originale, Mink (1855) s’est basé sur des spécimens provenant des environs de Krefeld, en Rhénanie-du-Nord-Westphalie. Cette localité s’écrivant "Crefeld" jusqu’à la fin du 19ème siècle, est située en rive gauche de la vallée du Rhin, à une trentaine de kilomètres à peine du Limbourg néerlandais. L’espèce ne fut, par la suite, que très rarement citée du territoire allemand. Hedicke (1920) décrit une galle attribuée à cette espèce récoltée à Chorin, dans le Brandebourg, non loin de la frontière polonaise. Il évoque à cette occasion plusieurs autres observations réalisées par F. Schumacher dans l’est du Brandebourg, en particulier dans la vallée du Löcknitz. Il ajoute encore avoir vu des spécimens provenant de Finkenkrug, à l’ouest de Berlin, ainsi que de l’ile de Borkum, en Basse-Saxe. Cette dernière indication n’avait pu être confirmée par Burckhardt et al. (2007), mais il existe néanmoins, au Musée de Moravie à Brno, une femelle récoltée sur cette île de Frise-Orientale et conservée dans la collection K. Šulc (I. Malenovský, in litt. 20.i.2017). Parmi les quelques centaines de psylles récoltés durant les années septante par H. Schiemenz dans différents marais et tourbières de l’ex R.D.A., Lauterer (1976) n’a pu détecter le moindre individu de L. crefeldensis. Une quinzaine d’années plus tard, cette espèce est signalée pour la première fois de Thuringe par Sander & Lichter (1999) d’après une capture de J. Weipert en mai 1985 dans la réserve naturelle Apfelstädter Ried, au nord-ouest de Arnstadt. Il s’agit en fait, d’après Burckhardt & Lauterer (2003), de la seule occurrence récente connue pour toute l’Allemagne.
26Pour la Pologne, Klimaszewski (1963) écrit que L. crefeldensis n'est connu que de la région des Lacs de Poméranie [Pojezerzie Pomorski], dans l’extrémité nord-ouest du pays, où E. Schmidt l’a capturé en 1911 à Święta, une localité se trouvant au bord de l’Oder occidental, à une trentaine de kilomètres à l’ouest de Nowogard. Une femelle étiquetée "Pommern, Langenberg, 11.8.1911, E. Schmidt" figure dans la collection K. Vondracek du Musée de Moravie (I. Malenovský, in litt. 20.i.2017) et correspond vraisemblablement à l’occurrence mentionnée par Klimaszewski. Langenberg était une municipalité de l’ancienne province prussienne de Poméranie, rattachée jusqu’en 1939 au district de Randow puis dissoute dans le Comté de Naugard [= Nowogard] et située en territoire polonais depuis la conquête par l’Armée russe en 1945. Notons que la seule localité figurée sur Biomap est celle issue du travail de Klimaszewski7. Un siècle plus tard et à plus de 300 kilomètres à l’est du site historique, l’espèce est enfin retrouvée sur le territoire polonais par K. Szawaryn, en août 2016, dans une prairie humide à Wielki Kack, en bordure de la mer Baltique un peu au nord de Gdańsk (Drohojowska & Szawaryn, 2019).
27Bien que signalé de longue date d’Europe du Nord, L. crefeldensis y est rarissime et paraît encore inconnu de Norvège, de Lituanie et de Lettonie (Ossiannilsson, 1992 ; Norwegian Biodiversity Information Centre, 2019). Ossiannilsson (1992) détaille seulement trois localités du Danemark, actuellement rattachées au Jutland central, auxquelles s’ajoutent deux données plus récentes documentées sur internet : l’une en août 2014 dans la région du Sjælland (obs. F. Krone, sub Livia juncorum)8, la seconde en août 2016 en provenance de la tourbière du Porsemosen, à l’ouest de Copenhague, dans la région Hovedstaden, où l'espèce a encore été revue fin août et début septembre 2020 (obs. P. Ulrik; in litt. 28.ix.2020)9.
28De Suède, le premier signalement revient à Wahlgren (1934) qui dit avoir examiné des spécimens récoltés par A. Tullgren en 1920 à Rydboholm dans la province d'Uppland. Ossiannilsson (1992) énumère en plus, mais sans fournir de détail, les provinces de Ostergötland, Bohuslän, Närke et Södermanland. Une observation plus récente a été réalisée sur l’ile d’Öland, au sud de Borgholm, en décembre 2016 (C.A. Gertsson, in litt. 2.iii.2020), et une autre l'année suivante, le 12 août 2017, à Johannesdal sur la commune de Knivsta, au nord de Stokholm, par K. Martinsson10.
29De Finlande, L. crefeldensis est connu uniquement de l’ile de Eckerö dans l’archipel autonome d’Åland, à l’entrée du golfe de Botnie, où Lindberg l’a trouvé en 1943 (Lindberg, 1948 ; Ossiannilsson, 1992 ; Mattila & Söderman, 2012). Une mention historique existe par ailleurs pour l’Estonie : Flor (1861) relate en effet l’avoir découvert à Dorpat [actuel Tartu] dans une prairie sur l’E[r]mbach, nom allemand de la rivière Emajõgi11.
30Sur les Iles Britanniques, le psylle ne semble exister que dans la partie orientale de Grande-Bretagne, dans les comtés du Norfolk, du Suffolk, du Northumberland et du North Yorkshire (e.a. Heslop Harrison, 1936 ; Hodkinson & White, 1979 ; Redfern et al., 2011). Beaucoup de ces mentions sont anciennes, mais Lott et al. (2002) signalent plusieurs captures datant de 1989 et provenant de trois tourbières et marais alcalins du Norfolk. O’Connor & Malumphy (2011), dans leur synthèse sur les psylles d’Irlande, mentionnent uniquement L. junci.
31Aux Pays-Bas, si l’occurrence de L. crefeldensis est indiquée dès le 19ème siècle, celle-ci repose sur des mentions bibliographiques non vérifiables, justifiant sans doute le fait qu’elle soit considérée comme "douteuse" sur Fauna Europaea. De Graaf et al. (1862) seraient les premiers à avoir divulgué l’existence de l’espèce sur le territoire, en détaillant, sous le nom Diraphia limbata Waga, la capture de deux spécimens près d’Utrecht, par G. A. Six. C’est cette donnée qui, bien plus tard, est reprise sous L. crefeldensis Mink par van der Goot (1912) puis Blöte (1926b), ce dernier précisant cependant qu’il ne lui a pas été possible de voir le matériel de collection correspondant (d’où le "?" qu’il prend soin d’ajouter devant le nom du psylle). La même année, Blöte (1926a) traite L. crefeldensis dans une table d’identification des psylles des Pays-Bas, sans fournir aucun détail sur sa fréquence et sa répartition. Par la suite, il semble que Docters van Leeuwen (1941) ait été le seul à apporter des informations nouvelles, soit deux observations cécidologiques effectuées à Lindevallei et Groesbeek, localités situées respectivement dans les provinces de Friesland et de Gelderland. Les éditions successives du "Gallenboek" (Docters van Leeuwen, 1982 et 2009) ne fournissent aucun détail sur d’éventuelles données ultérieures. Au cours de ses recherches, K. den Bieman (in litt. 23.x.2016) a constaté l’absence totale de L. crefeldensis dans toutes les collections néerlandaises qu’il a pu examiner, à l’exception notoire d’un spécimen récolté par ses soins en septembre 1982 dans une carrière de sable à Veenendaal, dans la vallée du Rhin inférieur. Cette observation, initialement rapportée dans le 5ème volume de la Nederlandse Oecologische Flora (Weeda et al., 1994), représente à ce jour la seule preuve irréfutable de l’existence de L. crefeldensis aux Pays-Bas (den Bieman et al., 2019).
32En France, les mentions sont tout aussi fragmentaires et concernent majoritairement des observations datant de plus d’un siècle, de surcroît pas toujours attribuables de manière certaine à L. crefeldensis. A titre d’exemple, la citation de Puton (1871) à Lamalou, dans l’Hérault, l’une des premières renseignées pour le territoire français, a été attribuée à L. limbata par Reuter (1908), mais pourrait tout autant correspondre à L. mediterranea. Comme déjà évoqué, on est en droit de se demander si la mention de L. limbata dans le bois de Phalempin, au sud de Lille, par Lethierry (1874), ne se rapporterait pas plutôt à L. crefeldensis ? Quelques années auparavant, Bellevoye (1866) indiquait ce dernier du département de la Moselle. Perrier (1937), dans son catalogue manuscrit, ne cite l’espèce que de Saint-Hippolyte-du-Fort, dans le département du Gard. Mes recherches bibliographiques ne m’ont pas permis de trouver la moindre observation contemporaine de L. crefeldensis, tandis que le futur catalogue des Psylloidea de France (Cocquempot et al., en prép.) n’en rapporte aucune non plus même s’il mentionne une occurrence inédite des Yvelines datant probablement de la seconde moitié du 20ème siècle. En outre, aucune donnée de présence n’est affichée sur le site de l’Inventaire national du patrimoine naturel (MNHN & OFB, 2021). Ajoutons encore que l’espèce est ignorée par Dauphin & Aniotsbehere (1997) dans leur ouvrage classique "Les Galles de France", P. Dauphin (in litt. 29.xi.2016) m’ayant précisé qu’il n’avait jamais personnellement observé ce psylle ni sa cécidie. Des informations complémentaires se trouvent peut-être dans l’herbier cécidologique de Houard, en dépôt au Muséum d’Histoire Naturelle de Paris - inaccessible au moment de la finalisation de cet article - et qui renfermerait des galles de Livia sur Carex dioica et C. divisa en provenance de plusieurs localités françaises (S. Carbonnelle, in litt. 6.iii.2017).
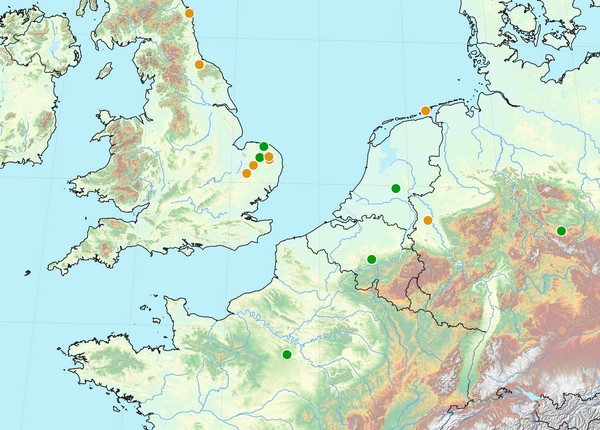
Figure 7 : Distribution des occurrences confirmées de Livia crefeldensis pour le nord-ouest de l’Europe ; cercle orange : donnée antérieure à 1960, cercle vert : donnée postérieure à 1960 (© Y. Barbier).
33Enfin, aucune information n’est disponible pour le Grand-Duché de Luxembourg, où la faune des psylles est restée largement méconnue jusque tout récemment. Lambinon & Schneider (2004) ne font pas mention de l’espèce dans leur inventaire des galles d’Hémiptères. Elle est absente de Recorder, la banque de données du Musée d’Histoire naturelle du Luxembourg (N. Schneider, in litt. 10.xii.2016) et son nom n’apparait pas plus dans la synthèse de Rapisarda et al. (2022).
34A titre indicatif, la distribution des rares occurrences authentifiées pour le nord-ouest de l’Europe (Danemark non compris) est illustrée sur la carte ci-dessus (Figure 7).
Mœurs et cycle biologique
35Le cycle biologique de Livia crefeldensis n’a jusqu’ici fait l’objet d’aucune étude détaillée. Les quelques informations disponibles indiquent une espèce univoltine passant l’hiver au stade adulte sur ses plantes-hôtes, la femelle déposant ses œufs dès le début du printemps et la nouvelle génération apparaissant au milieu de l’été et début de l’automne (Hodkinson, 2009 ; Drohojowska & Szawaryn, 2019).
36Dans la littérature, les biotopes de capture de L. crefeldensis sont fort peu évoqués mais pour ce qu’on en sait, il s’agit généralement de prairies humides, prés à joncs et marais de plaine, souvent en contact avec le réseau hydrographique ou à proximité du littoral (Hedicke, 1920 ; Drohojowska & Szawaryn, 2019). Les récoltes mentionnées par Lott et al. (2002) proviennent de tourbières et marais alcalins à végétation dominée par Juncus subnodulosus et Molinia caerulea. D’après leur situation géographique, on peut déduire que la quasi-totalité des localités européennes connues sont situées en plaine, entre 0 et 250 mètres d’altitude.
37Contrairement à ce qu’avance Hodkinson (2009), on ne sait pas vraiment où et comment hivernent les adultes : je n’ai trouvé aucune source originale indiquant qu’ils demeurent sur la plante-hôte durant cette saison. En revanche, plusieurs auteurs ont signalé des observations sur des genévriers (Juniperus spp.) et sur l’if (Taxus baccata) même si certaines d’entre-elles se réfèrent probablement à L. mediterranea (Reuter, 1908). Les observations de Schumacher rapportées par Hedicke (1920) concernent, elles, plus vraisemblablement des L. crefeldensis obtenus au battage de pins (Pinus sp.) en septembre-octobre, dans les prairies de la vallée du Löcknitz. On soupçonnait dès le 19ème siècle que l’espèce vivait en relation avec des Cypéracées du genre Carex, mais il a fallu attendre la contribution de Hedicke (1920) pour obtenir confirmation de ce lien, de même que de son caractère cécidogène. De fait, la galle de L. crefeldensis était inconnue de Kieffer (1901) tout autant que de Houard (1908), auteurs des deux plus importants travaux cécidologiques de leur époque.
38Hedicke (1920) serait donc le premier à avoir décrit et figuré la cécidie causée par L. crefeldensis. Il s’est basé pour cela sur une structure évoquant fortement la galle de L. junci - déjà bien connue à l’époque - mis à part qu’elle affectait une laîche non spécifiée (Carex sp.) collectée dans les environs de Chorin (Brandebourg) en septembre 1919. Néanmoins, Weeda et al. (1994) évoquent une probable représentation beaucoup plus ancienne de cette galle : il s’agit d’une gravure ornant le livre d’un certain Matthias de Lobel daté de 1581, qui illustre plusieurs plants de laîche des sables (C. arenaria) provenant des dunes de Zoutelande op Walchteren (aux Pays-Bas) sur lesquels on peut deviner des déformations feuillées similaires à celles provoquées par L. crefeldensis. Mis à part quelques ouvrages plus ou moins récents (Buhr, 1964 ; Docters van Leeuwen, 1982 et 2009 ; Redfern et al., 2011), cette cécidie aussi bien que le psylle responsable restent très rarement représentés tant dans la littérature que sur internet, ce qui laisse transparaître de réelles difficultés de détection. A cet égard, il est significatif que la galle ait été tout simplement ignorée dans la plupart des guides modernes consacrés aux cécidies comme ceux de Darlington & Hirons (1968), Coulianos & Holmåsen (1991), Csóka (1997), Dauphin & Aniotsbehere (1987), Bellmann (2012), Dauphin (2012), Lambinon et al. (2015) ou encore Grosscurt (2017).
39L’espèce de laîche parasitée n’est que très occasionnellement précisée, sans doute en raison des difficultés inhérentes à l’identification de ces plantes, surtout à l’état végétatif. Dans leur faune des Iles Britanniques, Hodkinson & White (1979) mentionnent "Carex spp." sans autre détail ni référence, tout comme d’ailleurs Ossiannilsson (1992), Hodkinson & Bird (2000) et d’autres encore ultérieurement. Aux Pays-Bas, Docters van Leeuwen (1941) évoque des galles attribuées à L. crefeldensis sur des Carex non spécifiés, mais quelques années après, Docters van Leeuwen & Alta (1946), dans la première édition du Gallenboek, sont plus précis en indiquant la laîche muriquée (C. muricata). Cependant, dans les éditions suivantes de cet ouvrage (e.a. Docters van Leeuwen, 1982, 2009), seule est citée la laîche en épis (C. spicata), une espèce mésophile assez répandue dans les prairies, friches et lisières forestières. Or, comme l’ont bien démontré Koopman & Więcław (2017), les Carex de la section Phaestoglochin, dont C. muricata et C. spicata, ont souvent été mal nommés dans le passé. De plus, pour ces auteurs, le véritable C. muricata est une plante rarissime et non indigène aux Pays-Bas, au contraire de la laîche de Paira (C. pairae) avec lequel il a fréquemment été confondu. On peut dès lors s’interroger sur l’identité du C. muricata cité par Docters van Leeuwen & Alta (1946). Dans son ouvrage monumental, Buhr (1964) se contente d'indiquer "Carex spec., Carex muricata [= spicata] u.a." tandis que Roskam (2019), dans sa volumineuse révision, n'ajoute rien d'autre.
40Tout cela démontre bien qu'il reste encore beaucoup d’inconnues à propos des Carex fréquentés par L. crefeldensis et de son degré d’oligophagie. Il est néanmoins plus que probable que C. spicata (pour autant que le lien soit confirmé) ne soit pas la seule laîche parasitée par le psylle au sein de sa vaste aire géographique. L’étude des matériaux d’herbiers pourrait sans doute apporter de nouveaux éléments à ce sujet (cf. la remarque précédente à propos de l’herbier Houard). Mais d’ores-et-déjà, la galle observée à Gembloux permet d’inclure C. disticha (Figure 6) dans le spectre trophique de L. crefeldensis. A cet égard, il est intéressant de remarquer que cette laiche appartient à la même section (Ammoglochin) que C. arenaria pour lequel il existe, rappelons-le, de plausibles représentations de cécidies remontant au 16ème siècle (voir Weeda et al., 1994).
41Les prédateurs et les parasites des psylles sont nombreux, notamment parmi les Hémiptères (Anthocoridae et Miridae), les Coléoptères (Coccinellidae), ou encore les Hyménoptères Chalcidoidea (Encyrtidae, e.a.), mais aucun ne semble avoir été décrit spécifiquement chez L. crefeldensis. Il serait intéressant de vérifier dans quelle mesure le Diptère Cecidomyiidae Lestodiplosis liviae Rubsaamen, 1901, renseigné comme prédateur de L. junci (Jensen, 1957 ; Baylac, 1988), ne s’attaquerait pas également à cette espèce. Cette cécidomyie reste cependant à découvrir en Belgique, n’étant pas recensée dans le récent catalogue établi par Roskam & Carbonnelle (2015).
Aperçu de l’intérêt biologique du marais du Buisson Saint-Guibert
42Malgré son étendue très modeste (moins d’un demi-hectare !) et son isolement dans un paysage agricole en voie d’urbanisation, le marais du Buisson Saint-Guibert se révèle être une véritable oasis de biodiversité, comme l’attestent les quelques inventaires réalisés au cours de la dernière décennie. Ce n’est donc pas par hasard si cet endroit est repris en tant que zone centrale du réseau écologique de la commune de Gembloux (Taymans et al., 2009) et qu’il est inscrit à l’inventaire des Sites de Grand Intérêt Biologique de la Région wallonne12.
43Un total de neuf visites étalées de 2009 à 2018 ont conduit à la collecte de près de 900 données biologiques, dont la moitié concerne des invertébrés, principalement insectes (400 espèces) et mollusques (20 espèces). Pour ce qui concerne l’entomofaune, quelques taxons sont commentés ci-après en fonction de leur intérêt faunistique ou patrimonial.
44Près d’un quart des espèces d’insectes identifiées à ce jour sont des Hémiptères, un groupe sur lequel s’est davantage porté mon attention. Et outre le rare Livia crefeldensis dont il vient d’être question, deux Cicadellidae s’avèrent nouveaux pour la faune belge (sensu den Bieman et al., 2011), tandis qu’un Lygaeidae mérite d’être épinglé pour sa rareté.
Cosmotettix costalis (Fallén, 1826) Belg. nov. sp.
45Matériaux : 1 ex., 4.ix.2018, au filet. Cette cicadelle à large répartition eurosibérienne se montre localisée en Europe occidentale. Elle est connue avec certitude de 18 pays européens dont la Grande-Bretagne, la Fenno-Scandinavie, l’Allemagne, les Pays-Bas, la Suisse, le Grand-Duché de Luxembourg (Borodin, 2004 ; Niedringhaus et al., 2010 ; Jach, 2013 ; Walczak et al., 2016 ; Seljak, 2018). Les données slovènes récemment publiées constituent les occurrences la plus méridionales d’Europe (Seljak, 2018). Aux Pays-Bas, deux femelles furent capturées en 1983 et 1985 au sein de la réserve naturelle du Tongerense heide près de Epe, dans la Veluwe (den Bieman & Rozeboom, 1993). Au Luxembourg, la seule capture recensée date de 2004 et provient de Sonlez, localité frontalière de la Belgique à 10 kilomètres de Bastogne (Niedringhaus et al., 2010). Bien que non indiquée formellement de France (e.a. sur Fauna Europaea et INPN), l’espèce est citée du Jura dans le document d’objectif du site Natura 2000 "Vallons de la Drésine et de la Bonavette" (Mazuez, 2016). Les populations du Benelux et du Jura se trouvent actuellement à la marge occidentale de l’aire de répartition de Cosmotettix costalis. Cette cicadelle est adulte de juin à octobre et hiverne à l’état embryonnaire. Hygrophile, voire tyrphophile, elle affectionne les prairies humides, les marais et les tourbières et se développe aux dépens de la laîche aigüe (Carex acuta) et sans doute d’autres espèces dont la laîche noire (Carex nigra) (voir e.a. Nickel, 2003).
Macrosteles sardus (Ribaut, 1948) Belg. nov. sp.
46Matériaux : 1♂, 26.ix.2017, fauchage cariçaie ; 3♂ 4♀ et 1 larve, 4.ix.2018, fauchage Epilobium hirsutum. Cette cicadelle d’Europe centrale et occidentale est signalée sur Fauna Europaea de six pays seulement : France, Allemagne, Italie, République tchèque, Slovaquie et Espagne (Jach, 2013). Sa présence est cependant établie dans plusieurs autres états : pour la Slovénie, Seljak (2004) mentionne trois observations datant de 2003 ; en Autriche, elle est indiquée par Holzinger (2009) ; en Pologne, l’espèce a été détectée récemment dans quelques localités méridionales (carte dans Walczak et al., 2016) ; au Luxembourg, Niedringhaus et al. (2010) la renseignent de 12 localités disséminées ; en Finlande, cinq occurrences sont connues dans l’extrême sud du pays (Söderman, 2018) ; enfin, aux Pays-Bas, den Bieman & de Haas (2019) détaillent des données de 2018 provenant de trois localités des provinces de Gelderland et Flevoland. Dans ce contexte, la découverte de Macrosteles sardus en Belgique n’apparaît pas anormale. L’espèce se rencontre en deux générations annuelles de mai à septembre et hiverne au stade œuf. Elle habite les zones humides principalement dans les plaines alluviales et sur les rives des plans d’eau et des rivières (Nickel, 2003). D’après Seljak (2004), la plante-hôte principale est Epilobium hirsutum, une plante très répandue et caractéristique des mégaphobiaies planitaires.
Drymus pumilio (Puton, 1877)
47Matériaux : 1♀, 22.ii.2012, tamisage de mousses détrempées ; 1♂ et 1♀, 26.ix.2017, tamisage de litière sous Carex acuta. Cette punaise de la famille des Lygaeidae, considérée comme rare partout en Europe (Péricart, 1998), n’était connue auparavant que d’une seule occurrence belge située en Région bruxelloise : Vorst/Forest, en 1929 (Bosmans, 1978). Sa découverte à Gembloux est donc aussi inattendue qu’intéressante ! Cependant, d’autres données à ma disposition, toutes recueillies par la technique du tamisage, augurent peut-être d’une distribution plus large dans la région : 1♂, ii.2006, Fosses-la-Ville, étang de Bambois (J.-M. Lempereur) ; 1♀, 22.iii.2013, Fleurus, berge d’étang dans la carrière du Berlaimont (J.-Y. Baugnée) ; 1♀, 15.iii.2012, Grand-Leez, RND Les Mottes (J.-Y. Baugnée). La rareté de cette punaise, souvent attribuée à sa petite taille, semble néanmoins bien réelle, comme constaté en territoire néerlandais où l’on ne recense que quelques observations isolées dans les provinces de Noord-Holland, Zeeland et Limburg, alors que la pression d’observation y est beaucoup plus élevée (Aukema & Hermes, 2016). Il en est de même au Grand-Duché de Luxembourg où Reichling (2001) ne renseigne qu’une localité isolée, Aarnescht, à l’est de Luxembourg-ville. C’est une espèce univoltine hivernant comme adulte, au régime granivore, et se tenant essentiellement dans les mousses, les sphaignes et la litière sur des sols mouilleux, au sein de différents types de végétations palustres (cariçaies, roselières, tourbières, bois marécageux, …). Il semble que le tamisage de mousses et de litière soit la méthode la plus indiquée pour la recherche de ce petit Drymus très hygrophile.
48La liste des Diptères recensés (45 espèces) est sans doute très peu représentative de la richesse réelle du site, mais deux éléments d'intérêt justifient un commentaire particulier en raison de leur rareté et de leur biologie spécialisée qui les rendent directement dépendants des milieux humides. Il s’agit tous deux de Stratiomyidae, famille comptant 47 représentants belges et que l’on appelle communément mouches soldats ou mouches armées (du grec στρατιώτης). Cette famille de mouches se caractérise par une grande diversité d’aspects, de formes et de mœurs, regroupant des espèces à larves aquatiques et/ou semi-aquatiques, des espèces saproxyliques se développant dans le bois mort et les cavités d’arbres, d’autres terricoles évoluant dans les matières organiques, et même une espèce myrmécophile.
Odontomyia argentata (Fabricius, 1794)
49Matériaux : 1 larve, 22.ii.2012, tamisage de mousses (Brachythecium rutabulum e.a.) dans une zone fontinale, donnant un ♂ le 7.iii.2012 ; 2 larves, 26.iii.2018, tamisage de litière détrempée de Carex acuta et Phalaris arundinacea. Bien que largement distribuée à travers l’Europe moyenne (Roskošný, 1982), cette mouche est qualifiée de rare dans maintes régions, notamment en France (voir e.a. Livory & Lair, 2010), dans le nord-ouest de l’Allemagne (Barkemeyer, 1993) ou encore aux Pays-Bas (Smit et al., 2019). Son statut en Belgique demeure méconnu et la plus récente synthèse (Brugge, 2002) ne faisait état que de 20 spécimens connus venant de 5 localités, dont une seule en Région wallonne (Montagne Saint-Pierre). Depuis lors, les données restent peu nombreuses malgré une pression d’observation très fortement accrue. On en compte ainsi une quarantaine sur le portail Observations.be, dont 26 ont été approuvées : la plupart d’entre-elles sont situées en Flandre et à peine cinq en territoire wallon, à savoir Virton en 2010 (P. Vantieghem), Tournai en 2014 (P. Bonmariage), Warchin en 2016 (S. Claerebout), Jodoigne en 2017 (D. Sevrin) et Volaiville en 2019 (D. Klaessens). S’y ajoutent encore trois autres captures inédites en province de Namur : Hingeon-Pontillas en 2007 (J.-Y. Baugnée), Dion en 2010 (G. Minet) et Schaltin en 2011 (J.-Y. Baugnée). Odontomyia argentata est étroitement lié aux milieux humides : marais, plaines alluviales inondables, rives d’étangs, fossés, dépressions dunaires, etc. En Grande-Bretagne, Lott et al. (2002) signalent ce diptère dans des marais alcalins abritant également Livia crefeldensis. Selon la littérature, les larves sont plus semi-aquatiques que véritablement aquatiques. Ce mode de vie amphibie est conforme avec la morphologie larvaire et expliquerait l’absence de cette espèce dans les échantillons recueillis lors des programmes d’évaluation de la qualité écologique des eaux de surface (Meurisse et al., 2011 ; Lock et al., 2014). Ces larves sont saprophages et évoluent préférentiellement parmi les mousses et les débris végétaux gorgés d’eau, particulièrement dans les zones de suintements, mais d’autres microhabitats ont été évoqués : laisses d’inondations, tronc pourri d’aulne, … (voir e.a. Roskošný, 1982 ; Brugge, 2002). Les imagos sont précoces, apparaissant dès la fin du mois de mars jusque début juin. Ils se tiennent sur la végétation herbacée environnant les sites larvaires et s’en éloignent peu ; en outre, ils se montrent peu floricoles, Roskošný (1982) ne citant que de rares visites sur Berberis, Crataegus et Salix.
Oxycera nigricornis (Olivier, 1812)
50Matériaux : 1 larve, 22.ii.2012, tamisage de mousses (Brachythecium rutabulum e.a.) dans une zone fontinale ; 3 larves, 26.iii.2018, tamisage de litière détrempée de Carex acuta et Phalaris arundinacea. Cette espèce d’Europe centrale et orientale se trouve proche de sa limite d’aire en Belgique, d’où elle est citée de 12 localités par Brugge (2002). Pour la Région wallonne, seules deux occurrences étaient renseignées, à savoir Mont-Saint-Aubert et Torgny. Meurisse et al. (2011) détaillent une capture larvaire attribuée à ce taxon à Court-Saint-Etienne, en Brabant wallon, en 2008. Mortelmans et al. (2014) mentionnent la collecte de plusieurs dizaines d’imagos de 2009 à 2011 par pièges Malaise au marais de Viesville, dans la vallée de la Sambre. Depuis lors, plusieurs observations inédites ont été rapportées sur les portails naturalistes mais sans que cela modifie substantiellement le statut de rareté d’Oxycera nigricornis. De fait, sur Observations.be on relève à peine une ou deux observations annuelles pour l’ensemble du pays, dont seulement deux localités wallonnes : Buzenol en 2016 (J. Hendrix et J. Mortelmans) et Lavaux-Sainte-Anne en 2019 (W. Tamsyn et al.). Deux données additionnelles se trouvent sur le portail du DEMNA, à savoir Hombourg en 2018 (J.-Y. Baugnée) et le marais de la Terme à Pin, en 2018 (J.-M. Couvreur). L’espèce n’est guère plus répandue dans les territoires voisins de la Belgique, notamment aux Pays-Bas où elle est strictement limitée au Limbourg méridional (Smit et al., 2019). A Gembloux, les larves ont été trouvées dans les mêmes conditions que celles d’Odontomyia argentata. Les imagos ont une activité strictement estivale s’étalant de juin à août.
51En ce qui concerne les Coléoptères, l’inventaire est également loin d’être exhaustif mais il comprend déjà diverses espèces dignes d’intérêt et typiques des zones humides, comme le minuscule Silvanidae Psammoecus bipunctatus (Fabricius, 1792), le Coccinellidae Coccidula rufa (Herbst, 1783), le Nanophyidae Nanophyes brevis Boheman, 1845, ainsi que plusieurs Carabidae dont le suivant :
Demetrias imperialis (Germar, 1824)
52Matériaux : 1 ad., 4.ix.2018, fauchage de Carex acuta. Ce petit Carabidae à l’apparence typique est réputé rare en Région flamande et à Bruxelles et très rare en Région wallonne, où l’essentiel des occurrences se concentre à l’ouest de la Meuse (Desender et al., 2008). Si une centaine d’observations étalées de 2004 à 2020 sont signalées sur Observations.be, une seule concerne le territoire wallon, Virelles en 2016 (S. Claerebout). En outre, dix données, toutes wallonnes, figurent sur le portail d’encodage du DEMNA. En Hesbaye, et dans la région de Gembloux notamment, cette espèce s’avère extrêmement localisée, tout comme d’ailleurs ses habitats préférentiels : sa présence n’y est connue pour le moment que de deux endroits isolés, le Long-Pont à Grand-Leez en 2014 (J.-Y. Baugnée) et l’étang de Boneffe en 2018 (J.-Y. Baugnée). Il s’agit d’un hôte très fidèle des ceintures de végétation bordant les eaux stagnantes et plus particulièrement les roselières et les cariçaies. Il y pourchasse d’autres petits arthropodes en se déplaçant avec aisance sur les tiges et le feuillage des hélophytes. Ce carabe se rencontre à l’état adulte toute l’année et se réfugie l’hiver parmi les débris végétaux.
53Relevant encore l’intérêt biologique de ce marais, mentionnons aussi l’observation de deux mollusques gastéropodes à haute valeur patrimoniale : Vertigo moulinsiana (Dupuy, 1849), espèce reprise à l’Annexe 9 de la Loi sur la Conservation de la Nature ainsi qu’à l’Annexe 2 de la Directive Habitats du décret Natura 2000, inconnue auparavant de la vallée de l’Orneau (Kervyn et al., 2004), et Vertigo substriata (Jeffreys, 1833), espèce non protégée mais très localisée et confinée principalement aux bois marécageux et aux abords des sources forestières.
CONCLUSION
54Toutes les informations recueillies dans la littérature, les collections muséologiques et auprès des principaux spécialistes des Psylloidea tendent à indiquer qu’en dépit d'une large répartition européenne, Livia crefeldensis se révèle être un insecte particulièrement rare dont les occurrences documentées sont partout fort éparses et souvent anciennes. Avec l'avènement des portails naturalistes favorisant la diffusion des données biologiques comme jamais auparavant, on aurait pu s'attendre à une multiplication des observations, mais il n'en n'est rien. Cela confirme que L. crefeldensis est, pour le moins, une espèce difficile à détecter, alors qu'elle occasionne des galles presque aussi spectaculaires que celles bien connues de L. junci. Le fait que l'on ne sache quasiment rien de l'identité précise des laiches hôtes représente sans doute un obstacle dans la recherche de l’insecte. De plus, le repérage d’éventuelles galles est d’autant plus ardu que ces plantes forment souvent des végétations touffues et denses. Ceci-dit, les observations originales et certaines sources détaillées dans ce travail encourageraient à orienter plutôt les prospections sur C. disticha et sur d’autres laiches de la section Ammoglochin dont fait également partie C. arenaria, sans pour autant négliger les autres espèces de Carex.
55Quoiqu’il en soit, la découverte d’une telle espèce à Gembloux, dans un marais « grand » comme un mouchoir de poche et miraculeusement épargné jusqu’ici par l'agriculture intensive et l'urbanisation, constitue assurément un évènement significatif du point de vue biogéographique. Elle souligne, une fois de plus, l'importance de toutes les zones humides, modestes ou étendues, en tant que refuge pour une biodiversité digne d’intérêt dans nos paysages fortement artificialisés. Chacune d’entre-elles doit être considérée comme un maillon essentiel d'un réseau écologique fonctionnel à l’échelle communale autant que régionale. Les inventaires réalisés jusqu'à présent au marais de l’Agasse témoignent que des espèces remarquables peuvent subsister dans un espace réduit mais que leur survie y est sans doute extrêmement précaire. En l’absence de données historiques, il est difficile de savoir à quelle époque remonte l’installation de L. crefeldensis sur le site, et donc si l’on est face à une population relictuelle ou bien à un phénomène de colonisation récent.
56Par ailleurs, dans le contexte d’un réchauffement climatique s’accentuant année après année et qui se traduit notamment par la survenue de périodes de sècheresses répétitives et une baisse généralisée du niveau des nappes phréatiques, les zones humides sont appelées à jouer un rôle crucial dans la régulation de ces phénomènes de plus en plus extrêmes. Encore faut-il que les autorités mettent tous les moyens nécessaires pour protéger celles qui subsistent et celles qui sont encore restaurables en Région wallonne. C’est le souhait formulé pour le marais du Buisson Saint-Guibert, dont l’avenir est en sursis et qui réclame d’urgence des mesures de protection. Le site gagnerait d’ailleurs à être inclut dans une zone de développement écologique plus vaste qui, idéalement, devrait s’étendre au moins à l’ensemble de la parcelle cadastrale concernée.
Au terme de cet article, je tiens à remercier vivement Kees Den Bieman, Daniel Burckhardt, Sébastien Carbonnelle, Mairi Carnegie, Christian Cocquempot, Patrick Dauphin, Willem Ellis, Arnold M. Gegechkori, Carl-Axel Gertsson, Igor Malenovský, David Ouvrard, Friedrich Sander, Nico Schneider et Poul Ulrik pour la communication d’informations utiles (et parfois inédites). Ma reconnaissance s’adresse en outre à Michèle Van Assche et Isabelle Sauvage (IRSNB) pour la recherche et l’envoi de plusieurs références bibliographiques, aux observateurs qui encodent leurs données sur les portails naturalistes, à Jean Fagot et à mes collègues du DEMNA Jean-Marc Couvreur, Emmanuelle Bisteau et Cédric Delannoy. Un merci tout particulier encore à Yvan Barbier qui a pris en charge la réalisation de la carte.
Bibliographie
Antolínez C. A., Moreno A., Ontiveros I., Pla S., Plaza M., Sanjuan S., Palomo J. L., Sjölund M. J., Sumner-Kalkun J. C., Arnsdorf Y. M., Jeffries C. J., Ouvrard D. & Fereres, A., 2019. Seasonal Abundance of Psyllid Species on Carrots and Potato Crops in Spain. Insects 2019, 10, 287; doi:10.3390/insects10090287.
Aukema B. & Hermes D. J., 2016. Verspreidingsatlas Nederlandse wantsen (Hemiptera : Heteroptera). Deel IV : Pentatomomorpha I (Aradidae, Lygaeidae, Berytidae en Pyrrhocoridae). EIS Kenniscentrum Insecten en andere ongewervelden, Leiden, 160 p.
Barkemeyer W., 1993. Zur Vorkommen von Holz-, Raub-, Schnepfen-, Stilett- und Waffenfliegen in Nordwestdeutschland (Diptera). Drosera, 93 (1/2), 59-80.
Baugnée J.-Y., 2013. Trioza cerastii (Linnaeus, 1758) et Trioza proxima Flor, 1861 : deux psylles cécidogènes observés récemment en Belgique (Hemiptera : Triozidae). Bulletin de la Société royale belge d'Entomologie/Bulletin van de Koninklijke Belgische Vereniging voor Entomologie, 149, 51-56.
Baugnée J.-Y., Burckhardt D. & Fassotte C., 2002. Les hémiptères Psylloidea de Belgique : état des connaissances et liste actualisée. Bulletin de l’Institut royal des Sciences naturelles de Belgique, Biologie, 72 (suppl.), 125-127.
Baylac M., 1988. Observations sur l’abondance et la spécificité prédatrice de quelques espèces du genre Lestodiplosis Kieffer (Diptera : Cecidomyiidae). Bulletin de la Société linnéenne de Lyon, 57 (5), 159-168.
Bellevoye A., 1866. - Catalogue des Hémiptères du Département de la Moselle. Bulletin de la Société d'Histoire Naturelle de Moselle, 10, 115-152.
Bellmann H., 2012. Geheimnisvolle Pflanzengallen. Quelle & Meyer Verlag, Wiebelsheim, 312 p.
Bieman C. F. M. den & Rozeboom G. J., 1993. Twee Cicadellidae nieuw voor de Nederlandse fauna en een herontdekte soort (Homoptera, Auchenorrhyncha). Entomologische Berichten, 53 (2), 23-25.
Bieman C. F. M. den, Biedermann R., Nickel H. & Niedringhaus R., 2011. The planthoppers and leafhoppers of Benelux. Identification keys to all families and genera and all Benelux species not recorded from Germany. Cicadina Supplement 1, WABV – Fründ, 120 p.
Bieman C. F. M. den, Malenovský I., Burckhardt D. & Heijerman T., 2019. First checklist of the Dutch jumping plant lice since 93 years (Hemiptera : Psylloidea). Nederlandse Faunistische Mededelingen, 53, 55-118.
Bieman C. F. M. den & De Haas M., 2019. Five leafhoppers and one plant-hopper new for the Netherlands (Homoptera: Auchenorrhyncha: Cicadellidae & Tettigometridae). Entomologische Berichten, 79 (4), 147-153.
Blöte H. C., 1926a. Overzicht der Nederlandse psylliden soorten. Tijdschrift voor Entomologie, 69, 57-84.
Blöte, H.C., 1926b. Nieuwe naamlijst der Nederlandsche Psylliden. Entomologische Berichten, 7, 64-67.
Borodin O., 2004. A checklist of the Auchenorrhyncha of Belarus (Hemiptera, Fulgoromorpha et Cicadomorpha). Beiträge zur Zikadenkunde, 7, 29-47.
Bosmans R., 1978. Voorkomen van de Belgische wantsen. IV. Lygaeidae Schilling. Biologische Jaarboek Dodonaea, 46, 61-85.
Brugge B., 2002. Wapenvliegen tabel. Tweede druk. Jeugdbondsuitgeverij, 94 p.
Buhr H., 1964. Bestimmungstabellen der Gallen (Zoo- und Phytocecidien) an Pflanzen Mittel- und Nordeuropas. G. Fischer, Jena, vol. 1, xvi + 762 p.
Burckhardt D., 2013. Fauna Europaea: Hemiptera Psylloidea. Fauna Europaea version 2.6, http://www.faunaeur.org
Burckhardt D. & Lauterer P., 2003. Verzeichnis der Blattflöhe (Psylloidea) Deutschlands. In : Klausnitzer B. (Hrsg.) : Entomofauna Germanica 6. Entomologische Nachrichten und Berichte, Beiheft, 8, 155-164.
Burckhardt D., Lauterer P. & Niedringhaus R., 2007. Die Blattflöhe der Sammlung Struve von der Nordseeinsel Borkum (Hemiptera, Psylloidea). Beiträge zur Zikadenkunde, 9, 39-44.
Burckhardt D. & Ouvrard D., 2012. A revised classification of the jumping plant-lice (Hemiptera : Psylloidea). Zootaxa 3509, 1-34.
Burckhardt D., Ouvrard D. & Percy D. M., 2021. An updated classification of the jumping plant-lice (Hemiptera: Psylloidea) integrating molecular and morphological evidence. European Journal of Taxonomy, 736, 137-182, https://doi.org/10.5852/ejt.2021.736.1257
Burckhardt D., Ouvrard D., Queiroz D. & Percy D. M., 2014. Psyllid host-plants (Hemiptera : Psylloidea) : resolving a semantic problem. Florida Entomologist, 97 (1), 242-246.
Conci C., Rapisarda C. & Tamanini L., 1993. Annotated catalogue of the Italian Psylloidea. First part (Insecta Homoptera). Atti Dell’Accademia Roveretana Degli Agiati, 242 (1992), series VII, 2 B, 33-136.
Coubeaux E., 1892. Enumération des Hémiptères de Belgique. Section II : Sternorhyncha. Annales de la Société entomologique de Belgique, 36, 80-83.
Coulianos C.-C. & Holmåsen I., 1991. Galler. En fälthandbok om gallbildningar på vilda och odlade växter. Interpublishing, Stockholm, 317 p.
Csóka G., 1997. Gubacsok / Plant galls. Erdészeti Tudományos Intézet/Forest Research Institute, 160 p.
Darlington A. & Hirons M. J. D., 1968. The Pocket Encyclopedia of Plant Galls in colour. Blandford Press, 191 p.
Dauphin P., 2012. Guide des galles de France et d’Europe. Belin, 240 p.
Dauphin P. & Aniotsbehere J.-C., 1997. Les Galles de France. Nouvelle édition revue et augmentée. Mémoires de la Société linnéenne de Bordeaux, Tome 2, 381 p.
Desender K., Dekoninck W., Maes D., Crevecoeur L., Dufrêne M., Jacobs M., Lambrechts J., Pollet M., Stassen E. & Thys N., 2008. Een nieuwe verspreidingsatlas van de loopkevers en zandloopkevers (Carabidae) in België. Rapporten van het Instituut voor Natuur- en Bosonderzoek 2008. Instituut voor Natuur- en Bosonderzoek & Koninklijk Belgisch Instituut voor Natuurwetenschappen, Brussel, 184 p.
Dobreanu E. & Manolache C., 1962. Homoptera, Psylloidea. Fauna Republicii Populare Romîne, Insecta, Volumul VIII, Fascicula 3. Editura Academiei Republicii Populare Romîne, 376 p.
Docters van Leeuwen W. M., 1941. Bijdrage tot de kennis van de Nederlandse zoocecidiën. Derde Supplement. Nederlandsche kruidkundig archief, Serie 3, 51 (1), 401-415.
Docters van Leeuwen W. M. & Alta H., 1946. Gallenboek. Nederlandse zoöcecidiën, door dieren veroorzaakte gallen. G.W. Breugel, Amsterdam, 288 p.
Docters van Leeuwen W. M., 1982. Gallenboek. Overzicht van door dieren en planten veroorzaakte Nederlandse gallen. 3e druk. Thieme & Cie, Zutphen, 355 p.
Docters van Leeuwen W. M., 2009. Gallenboek. Overzicht van door dieren en planten veroorzaakte Nederlandse gallen. 4e druk, herzien en bewerkt door J.C. Roskam. KNNV Uitgeverij, Zeist, 351 p.
Drohojowska J. & Burckhardt D., 2014. The jumping plant-lice (Hemiptera: Psylloidea) of Turkey: a checklist and new records. Turkish Journal of Zoology, 38, 559-568.
Drohojowska J. & Szawaryn K., 2019. Odkrycie rzadkiego koliszka Livia crefeldensis Mink, 1885 (Hemiptera: Sternorrhyncha, Psylloidea) na Pobrzeżu Bałtyku. Acta entomologica silesiana, 27, 1-2.
Ellis W., 2020. Plantparasieten van Europa. Bladmineerders, gallen en schimmels. https://bladmineerders.nl
Fassotte C., Steyer S., Olivier T., Cors R., Tomme M. & Facq M., 2010. Imaginal phenology of Cacopsylla picta and C. melanoneura in Belgian apple orchards and hawthorn hedges. Poster, Phytoplasma Cost Meeting Sitges (SP) 02.2010, Centre wallon de Recherches agronomiques.
Flor G., 1861. Die Rhynchoten Livlands. 2. Sternorhyncha. Archiv für die Naturkunde Liv-, Ehst- und Kurlands. Zweite Serie : Biologische Naturkunde, 4, 436-546.
Gegechkori A. M. & Loginova M. M. 1990. Psillidy (Homoptera, Psylloidea) SSSR: annotirovannyi spisok. Metsniereba, Tbilisi, Georgia, 161 p.
Goot P. van der, 1912. Naamlijst van inlandse Psyllidae. Entomologische Berichten, 67 (3), 281-285.
Graaf H. W. de, Six G. A. & Snellen van Vollenhoven S. C., 1862. Tweede naamlijst van inlandsche Hemiptera (tweede gedeelte). Tijdschrift voor Entomologië, 5, 72-96.
Grosscurt A., 2017. Plantengallen. Gallen in Nederland. KNNV Uitgeverij, 422 p.
Haupt H., 1935. Blattflöhe, Psyllina. In : Brohmer P., Ehrmann P. & G. Ulmer (eds), Die Tierwelt Mitteleuropas. Verlag von Quelle & Meyer, Leipzig, p. 222-252.
Hedicke H., 1920. Über eine gallenerzeugende Psyllide (Rhynch. Hom.). Deutsche entomologische Zeitschrift, 1920 (1-2), 65-75.
Heslop Harrison G., 1936. The Psyllidae, or jumping plant-lice, of Northumberland and Durham. Transactions 1 (4), 217-228.
Heslop-Harrison G., 1949. The subfamily Liviinae Löw of the homopterous family Psyllidae II. Annals and Magazine of Natural History, 12 (2), 241-270.
Hodkinson I. D., 2009. Life cycle variation and adaptation in jumping plant lice (Insecta : Hemiptera : Psylloidea) : a global synthesis. Journal of Natural History, 43 (1-2), 65-179.
Hodkinson I. D. & White I. M., 1979. Homoptera Psylloidea. Handbooks for the Identification of British Insects, Vol. II, Part 5 (a), 1-98.
Hodkinson I. D. & Bird J. M., 2000. Sedge and rush-feeding psyllids of the subfamily Liviinae (Insecta : Hemiptera : Psylloidea) : a review. Zoological Journal of the Linnean Society, 128, 1-49.
Holzinger W. E., 2009. Rote Liste der Zikaden (Hemiptera : Auchenorrhyncha) Österreichs. In: Rote Listen gefährdeter Tiere Österreichs. Grüne Reihe des Lebensministeriums, Band 14/3, 41‐317.
Horváth G., 1921. Die Nomenklatur der Psylliden-Gattungen Livia Latr. und Diraphia Waga. Deutsche entomologische Zeitschrift, 1921 (3), 181-184.
Houard C., 1908. Les Zoocécidies des Plantes d’Europe et du Bassin de la Méditerranée. Tome Premier. Librairie scientifique A. Hermann et fils, Paris, 570 p.
Jach M., 2013. Fauna Europaea: Hemiptera Cicadomorpha. Fauna Europaea version 2.6, http://www.faunaeu.org
Jensen D. D., 1957. Parasites of the Psyllidae. Hilgardia, 27 (2), 71-99.
Kervyn T., Baugnée J.-Y., Paternoster T., Godeau J.-F., Fiévet V. & Vercoutere B., 2004. Vertigo moulinsiana, un gastéropode méconnu en Région wallonne. Parcs et Réserves, 59 (4), 33-39.
Khlebutina L. G., 1983. Psyllid fauna (Homoptera, Psylloidea) of Eastern Kazakhstan. VINITI, Alma-Ata, 466/84, 1-17.
Kieffer J.-J., 1901. Synopsis des Zoocécidies d’Europe. Annales de la Société entomologique de France, 70, 233-378.
Klimaszewski S. M., 1963. Przegląd krajowych gatunków z podrodzin Liviinae i Aphalarinae (Homoptera, Psyllidae). Fragmenta Faunistica, 10, 257-270.
Klimaszewski S. M., 1975. The Jumping plant lice or Psyllids (Homoptera, Psylloidea) of the Palaearctic. An annotated Check-list. Annales Zoologici Warszawa, 30 (7), 155-273.
Koopman J. & Więcław H., 2017. The section Phaestoglochin (Carex, Cyperaceae) in the Netherlands. Gorteria - Dutch Botanical Archives, 39, 79-87.
Lambinon J. & Schneider N., 2004. Contribution à la connaissance des galles d’hémiptères (Insecta, Hemiptera) du Luxembourg. Bulletin de la Société des Naturalistes luxembourgeois, 105, 109-132.
Lambinon J., Carbonnelle, S. & Claerebout, S., 2015. Aide-mémoire de cécidologie : choix de zoocécidies de la Belgique. Edition revue et augmentée. Cercles des Naturalistes de Belgique, 72 p.
Lameere A., 1900. Manuel de la faune de Belgique. Tome II. Lamertin, Bruxelles, 858 p.
Lauterer P., 1976. Psyllids of wetland nature reserves of the German Democratic Republic, with notes on their biology, taxonomy and zoogeography (Homoptera, Psylloidea). Faunistische Abhandlungen, 6 (10), 111-122.
Lethierry L., 1874. Catalogue des Hémiptères du Département du Nord. 2è édition. Imprimerie L. Danel, Lille, 108 p.
Lethierry L., 1878. Note sur les Homoptères de la faune belge. Annales de la Société entomologique de Belgique, 21, 36-40.
Lindberg H. 1948. Föreningsmeddelanden - Tietoja yhdistyksestä. Diraphia crefeldensis ny för faunan. Notulae Entomologicae, 28, 117.
Livory A. & Lair X., 2010. Stratiomyides : quatre nouveautés ! L’Argiope, 70, 53-57.
Lock K., Van Haaren T., Tempelman D., Chérot F. & Adriaens T., 2014. Distribution and ecology of soldier fly larvae captured in Flemish surface waters (Diptera: Stratiomyidae). Bulletin de la Société royale belge d’Entomologie/Bulletin van de Koninklijke Belgische Vereniging voor Entomologie, 149 (2013), 150-159.
Loginova M. M., 1964. Suborder Psyllinea - Jumping plant lice. In : Ya Bei-Bienko G. (ed.), Keys to the insects of the European U.S.S.R. 1, p. 437-482 [English translation, Israel Programme for Scientific Translation, Jerusalem, 1967]
Loginova M. M., 1974. Systematics of the family Liviidae (Homoptera: Psylloidea). Zoologicheskii Zhurnal, 53, 858-865.
Lott D. A., Procter D. A. & Foster, A. P., 2002. East Anglian Fen Invertebrate Survey. English Nature Research Reports 477, 169 p.
Löw F., 1881. Beiträge zur biologie und Synonymie der Psylloden. Verhandlungen der Zoologischbotanischen Gesellschaft in Wien, 31, 157-170.
Löw F., 1882. Revision der palaärktischen Psylloden in Hinsicht auf Systematik und Synonymie. Verhandlungen der zoologisch-botanischen Gesellschaft in Wien, 32, 227-254.
Mazuez C., 2016. Document d’objectifs du site Natura 2000 FR4310027/FR4301283 "Vallons de la Drésine et de la Bonavette". Les Amis de la Réserve Naturelle du Lac de Remoray, Labergement-Sainte-Marie, 72 p. + annexes.
Mattila K. & Söderman G., 2012. Atlas of the Psylloidea, Aleyrodoidea and Coccoidea of Finland / Suomen kemppi-, jauhiais- ja kilpikirva-atlas / Atlas över Finlands bladloppor, mjöllöss och sköldlöss 2017. http://biolcoll.utu.fi/hemi/psyll_etc/kempmaps.htm
Meurisse V., Chérot F., Baugnée J.-Y. & Cammaerts R., 2011. Apport à la chorologie des Stratiomyidae de Wallonie (Insecta Diptera), avec une discussion sur la pertinence de leur introduction dans l'indice biotique global normalisé. Bulletin de la Société royale belge d’Entomologie, 147, 199-210.
Mink W., 1855. Eine neue Livia. Stettiner Entomologischen Zeitung, 16, 370-371.
MNHN & OFB, 2021. Fiche de Livia crefeldensis Mink, 1855. Inventaire national du patrimoine naturel (INPN). Site web : https://inpn.mnhn.fr/espece/cd_nom/220392
Mortelmans J., Limbourg P. & Dekoninck W., 2014. Syrphidae and Stratiomyidae collected during a three year survey with a Malaisetrap in Viesville (prov. Hainaut). Bulletin de la Société royale belge d'Entomologie/Bulletin van de Koninklijke Belgische Vereniging voor Entomologie, 150, 97-107.
Nickel H., 2003. The leafhoppers and planthoppers of Germany (Hemiptera, Auchenorrhyncha): patterns and strategies in a highly diverse group of phytophagous insects. Sofia and Moscow, 460 p.
Niedringhaus R., Biedermann R. & Nickel H., 2010. Verbreitungsatlas der Zikaden des Großherzogtums Luxemburg - Atlasband. Ferrantia 61, Musée national d’histoire naturelle, Luxembourg, 395 p.
Norwegian Biodiversity Information Centre, 2019. Livia crefeldensis Mink, 1855. https://www.biodiversity.no/ScientificName/Livia%20crefeldensis/111525
O’Connor J. P. & Malumphy C., 2011. A review of the Irish jumping plant-lice (Hemiptera : Psylloidea). Bulletin of the Irish Biogeographical Society, 35, 21-63.
Ossiannilsson F., 1992. The Psylloidea (Homoptera) of Fennoscandia and Denmark. Fauna Entomologica Scandinavica, 26, 1-347.
Ouvrard D., 2016. Psyl'list - The World Psylloidea Database. http://www.hemiptera-databases.com/psyllist
Péricart J., 1998. Hémiptères Lygaeidae euro-méditerranéens. Faune de France, 84/2, vi + 453 p.
Perrier A., 1937. Catalogue des Hémiptères de France. Manuscrit inédit de l’auteur déposé dans la bibliothèque de la Société entomologique de France, 200 p.
Puton A., 1871. Description de deux nouvelles espèces de Psyllides et observations sur quelques espèces de cette famille. Annales de la Société entomologique de France, 1, 435-438.
Rapisarda C., Weigand A.M., Braun P. & Eickermann M., 2022. First systematic inventory of the jumping plant lice of Luxembourg (Hemiptera, Sternorrhyncha, Psylloidea). Biodiversity Data Journal 10: e77571. https://doi.org/10.3897/BDJ.10.e77571
Redfern M., Shirley P. & Bloxham M., 2011. British Plant Galls. Field Studies Council Publications 125, iv + 432 p.
Reichling L., 2001. Atlas des hétéroptères non aquatiques du Luxembourg. Musée national d’histoire naturelle, Luxembourg, 134 p.
Reuter O. M., 1908. Charakteristik und Entwickelungsgeschichte der Hemipteren-Fauna (Heteroptera, Auchenorrhynchia und Psyllidae) der Palaearktischen Coniferen. Druckerei der Finnischen Litteratur-Gesellschaft, Helsingfors, 74 p.
Roskam J. C., 2019. Plant Galls of Europe. Volumes 1-3. KNNV Publishing, 2292 p.
Roskam J. C. & Carbonnelle S., 2015. Annotated checklist of the gall midges from the Netherlands, Belgium and Luxembourg (Diptera : Cecidomyiidae). Nederlandse Faunistische Mededelingen 44, 47-168.
Roskošný R., 1982. A biosystematic study of the European Stratiomyidae (Diptera). Volume 1. Introduction, Beridinae, Sarginae and Stratiomyinae. Series Entomologica, 21, viii + 401 p.
Sander F. W. & Lichter D., 1999. Checklist der Blattflöhe Thüringens (Homoptera : Psylloidea) mit Bemerkungen zu ihrer Gefährdungssituation. Check-Listen Thüringer Insekten und Spinnentiere, 7, 21-29.
Seljak G., 2004. Contribution to the knowledge of planthoppers and leafhoppers of Slovenia (Hemiptera : Auchenorrhyncha). Acta Entomologica Slovenica, 12, 189-216.
Seljak G., 2018. Notable new findings of Auchenorrhyncha (Hemiptera) in Slovenia. Acta entomologica slovenica, 26 (2), 181-194.
Serbina L., Burckhardt D. & Borodin O., 2015. The jumping plant-lice (Hemiptera: Psylloidea) of Belarus. Revue suisse de Zoologie, 122 (1), 7-44.
Smit J., de Bree E., van den Broek R., Reemer M., van Veen M. & Zeegers T., 2019. Verspreidingsatlas "leuke vliegen". Blaaskopvliegen, dazen, rooflvliegen, wapenvliegen, bastvliegen, wolzwevers en mierenwolzwevers. EIS Kenniscentrum Insecten en andere ongewervelden, 180 p.
Söderman G., 2018. Atlas of the Auchenorrhyncha of Finland / Suomen kaskasatlas / Atlas över Finlands stritar 2017. http://biolcoll.utu.fi/hemi/auch/kaskmaps.htm
Taymans J., Launoy S. & Mahy G., 2009. Commune de Gembloux. Etude du réseau écologique dans le cadre du Plan Communal de Développement de la Nature. Rapport final, Agro-Bio Tech Gembloux, 263 p.
Waga M., 1842. Diraphia. Novum Insectorum Genus Liviae Proximum (Aphidii, Homoptera). Annales de la Société entomologique de France, 11, 275-278.
Wahlgren E., 1934. Svenska bladloppor (Chermesidae). Entomologisk Tidskrift, 55 (2), 81-104.
Walczak M., Gębicki C., Wojciechowski W. & Świerczewski D., 2016. The fauna of planthoppers and leafhoppers (Hemiptera : Fulgoromorpha et Cicadomorpha) in the city of Częstochowa (southern Poland). The Monograph. Annals of the Upper Silesian Museum in Bytom (Entomology), 24-25, 1-193.
Weeda E. J., Westra R., Westra C. & Westra T., 1994. Nederlandse Oecologische Flora. Wilde planten en hun relaties 5. KNNV Uitgeverij/IVN, p. 280-281.
White I. M. & Hodkinson I. D., 1982. Psylloidea (Nymphal Stages). Hemiptera, Homoptera. Handbooks for the Identification of the British Insects, 2 (5b), 1-50.
(112 réf.)
Notes
1 Toutes les données originales de l’auteur détaillées dans ce travail ont été saisies sur le portail d’encodage en ligne du DEMNA-OFFH http://observatoire.biodiversite.wallonie.be/encodage/
2 https://geoportail.wallonie.be/walonmap
3 Cet auteur (p. 236, traduction libre) justifie la synonymie comme suit : "Parmi les écrits donnés par G. V. Frauenfeld, on trouve une description détaillée de Livia limbata Waga écrite par Förster selon des exemplaires typiques. J'ai comparé les spécimens de Livia crefeldensis Mk. de Crefeld de la collection Förster avec cette description et j'ai constaté qu'ils y correspondaient parfaitement."
4 https://observations.be/ [consultation 2/02/2017]
5 https://www.inaturalist.org/taxa/997170-Livia-crefeldensis
6 http://www.gbif.org/ [consultation 2/02/2017]
7 Voir http://baza.biomap.pl/pl/taxon/species-diraphia_crefeldensis/
8 https://www.naturbasen.dk/observation/1820614/sivbladloppe
9 (voir aussi https://www.fugleognatur.dk/forum/show_message.asp?page=1&MessageID=1614670&ForumID=34 https://www.naturbasen.dk/observation/2866483/livia-crefeldensis)
10 https://www.artportalen.se/Image/1891054
11 https://fr.wikipedia.org/wiki/Emaj%C3%B5gi
12 http://biodiversite.wallonie.be/fr/1873-zone-humide-du-buisson-saint-guibert.html?IDD=251660338&IDC=1881