- Startpagina tijdschrift
- Volume 75 (2022)
- Inventaire de la faune apiforme (Hymenoptera, Apoidea) des quartiers Myosotis et Engeland à Uccle (Bruxelles, Belgique)
Weergave(s): 1244 (26 ULiège)
Download(s): 81 (0 ULiège)
Inventaire de la faune apiforme (Hymenoptera, Apoidea) des quartiers Myosotis et Engeland à Uccle (Bruxelles, Belgique)

Documenten bij dit artikel
Version PDF originaleRésumé
Ce travail présente l’inventaire des abeilles sauvages (Hymenoptera Apoidea) observées dans l’ancien quartier Myosotis et le nouveau quartier Engeland de la commune d’Uccle à Bruxelles. Via une campagne d’échantillonnage dans les deux quartiers, 708 spécimens ont été capturés ou observés appartenant à 58 espèces différentes des 6 familles d’abeilles sauvages de Belgique. La faune apiforme capturée représente 14% de la faune belge et 28% de la faune bruxelloise. On y retrouve 10 espèces mono ou oligolectiques et 5 espèces font l’objet d’enjeux de conservation spécifiques selon la liste rouge des abeilles de Belgique. Quelques recommandations de gestion de conservation sont discutées dans ce travail en vue de favoriser au maximum la richesse de ces anthophiles pour la commune d’Uccle.
Abstract
This work presents the screening of wild bees (Hymenoptera Apoidea) observed in the old Myosotis district and the new Engeland district of the commune of Uccle in Brussels. By sampling campaign in both neighborhoods, 708 specimens were collected or observed belonging to 58 different species of the 6 families of wild bees in Belgium. The bee fauna captured represents 14% of the Belgian fauna and 28% of the Brussels fauna. There are 10 mono- or oligolectic species and 5 species are subject to specific conservation issues according to the Belgian Red List of Bees. Some recommendations for conservation management are discussed in this work with a view to promoting the richness of these wild bees in the municipality of Uccle as much as possible.
Inhoudstafel
Reçu le 29 avril, accepté le 04 octobre 2022.
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
INTRODUCTION
1En plus de concentrer les populations humaines pour des raisons socio-économiques, l’urbanisation convertit de manière croissante les espaces naturels en surfaces imperméables selon des aménagements urbains dynamiques dans le temps et dans l’espace. Ce processus s’est particulièrement accentué ces dernières décennies et ce, pratiquement dans toutes les régions du monde. Plus de la moitié de la population mondiale vit désormais en ville et certaines estimations prévoient que les 2/3 de cette population vivra dans ces espaces urbains à l’horizon 2050 (Grimm et al., 2008; United Nations, 2019).
2Par cette conversion du paysage naturel, l’espace urbain pose une des plus grandes menaces pour la biodiversité des organismes vivants (Seto et al., 2012; Noël et al., 2018). Cependant, de plus en plus de preuves montrent que les villes peuvent également servir de refuge pour une partie de la biodiversité, principalement par le biais d’aménagements, de la conservation et de la gestion d’espaces verts en ville (Alberti et al., 2017). Ces espaces verts comprennent entre autres les jardins, les potagers urbains et partagés, les friches, les cimetières, les forêts, les toitures vertes…. Les abeilles sauvages (Hymenoptera Apoidea) sont également sensibles aux paysages urbains et certaines espèces s’y sont installées durablement (Baldock et al., 2015; Hall et al., 2016; Theodorou et al., 2020). En effet, le taux et la couverture de particules biocides y sont moins élevés qu’en zones rurales. De plus, la ville est sujette à des ilots de chaleur qui favorisent certaines abeilles qui sont plutôt thermophiles, et qui offre une diversité et une hétérogénéité de patches urbains propices au développement d’une flore riche et présente toute l’année (Šlachta et al., 2020; Prendergast et al., 2022).
3Plus de la moitié de la superficie de Bruxelles (considérée ici comme la région de Bruxelles-Capitale) est recouverte par la végétation notamment due à la présence de la forêt de Soignes, ce qui en fait une des villes les plus vertes d’Europe (Bruxelles-Environnement, 2021). Comme dans la plupart des autres grandes villes, il y a peu de collections historiques des populations d’abeilles sauvages. Cependant, ces dernières années, la collecte d’abeilles sauvages s’est nettement accentuée en région bruxelloise grâce notamment aux études conjointes de Pauly (2019a), Pauly (2019b), de Vereecken et al., (2021a), de Vereecken et al., (2021b), ainsi que pour le projet d’Atlas des abeilles sauvages de Bruxelles (https://www.wildbnb.brussels/). Ces études ont notamment montré que la Région de Bruxelles-Capitale participe aux besoins floraux et de nidification de plus de 208 espèces d’abeilles sauvages, ce qui représente plus de la moitié des espèces de Belgique (Drossart et al., 2019).
4Dans ce contexte urbain, les quartiers Myosotis et Engeland de la commune d’Uccle (Bruxelles, Belgique) ont été investigués en vue d’établir un inventaire des abeilles sauvages présentes. Cet inventaire complètera les bases de données récemment créées pour la Région de Bruxelles-Capitale (Atlas des abeilles de Bruxelles ; ULB) mais également pour la Belgique via les bases de données d’Atlas Hymenoptera (UMons) et de l’Insectarium Hexapoda (ULiège) de Wallonie. A la suite des résultats de l’inventaire, quelques recommandations de gestion seront discutées concernant les espèces ayant des enjeux particuliers de conservation.
MATERIEL ET METHODES
Lieux d’étude
5Le quartier Engeland (Uccle, Belgique) s’étend sur une surface de 4,8 hectares (Figure 1). Le 25 juin 2020, 3 trios de pièges colorés, des pan-traps à couleur réfléchissante bleue, blanche et jaune, ont été placés de 9h à 17h sur les sites ENG1, ENG2 et ENG3 (Figure 1). Deux passages au filet de 15 min ont été réalisés sur les 6 sites représentés du quartier Engeland. Après la première journée d’échantillonnage du 25 juin 2020, il a été décidé que les Pantraps colorés ne seraient plus mis en place par contrainte logistique, et que seul le filet serait utilisé comme méthode de capture. Deux passages de 15 min sur chacune des zones d’échantillonnage ont été effectués pour les trois sessions suivantes: un passage au matin et le deuxième l’après-midi, toujours entre 9h et 17h afin de respecter les phases de vol des abeilles. Durant les trois premières sessions de capture, le site ENG6 n’était pas praticable pour cause de travaux. Cependant, il a pu être échantillonné lors de la journée du 5 août 2020.
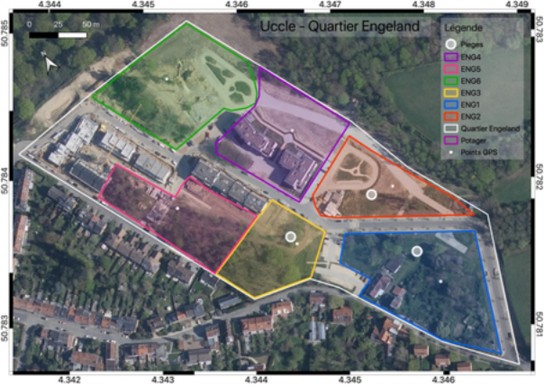
Figure 1 : Sites de capture au sein du quartier Engeland, Uccle (Belgique)
6Nous avons défini que le quartier Myosotis (1,2 ha) correspondait à 2,2 km de « rues » arpentées doublée par des trottoirs. Le protocole de capture au sein des rues entourant la résidence « Myosotis » a été modifié au cours des captures. Dans un premier temps, les rues ont été divisées en tronçons représentant chacun un site de capture (Figure 2). Chaque tronçon a été soumis à une prospection au filet de 15 min. Après la première journée de capture, certains tronçons ont été écartés pour cause d’absence totale de ressources florales ou d’abeilles sauvages. Ainsi, les sites EVO1, EVO2 et EVO4 (Figure 2), malgré la présence d’espèces végétales, n’ont plus été échantillonnés après la première journée de capture. De plus, lors de la première journée du 25 juin 2020, la résidence « Myosotis » était ouverte, permettant la prospection au filet. Étant fermée les autres jours, aucune capture n’a pu être réalisée après le 25 juin 2020 sur le tronçon MYO3 (Figure 2).
7Par la suite, la prospection au filet s’est faite en un seul passage sur chaque côté des rues, avec inspection plus approfondie des spots floraux et des sites de nidification. Les insectes ont alors été encodés selon l’adresse à laquelle ils ont été récoltés.
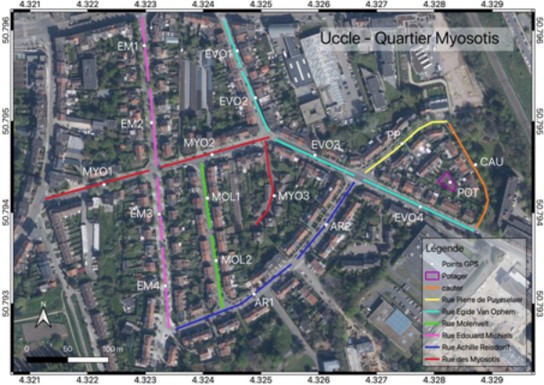
Figure 2 : Sites de capture au sein du quartier Myosotis, Uccle (Belgique).
8En raison de la météo et des disponibilités, l’échantillonnage de la première quinzaine de juin 2020 n’a pas pu être réalisé. Deux journées de captures ont donc été réalisées lors de la deuxième quinzaine de juin 2020. Au vu des conditions climatiques, la journée de capture de la seconde quinzaine de juillet 2020 n’a pu être réalisée et a été décalée début août 2020. Pour l’année 2021, nous n’avons pas pu avoir accès à la zone ENG6 (Figure 2) pour cause de travaux immobiliers. De plus, à cause de fortes intempéries, nous n’avons également pas pu prospecter durant le mois de mai et avons donc rattrapé ces deux journées d’échantillonnage lors de la journée du 04.VI.2021.
Mise en place de la collection entomologique
9Suivant les recommandations de Mouret et al. (2007), les spécimens collectés au filet ont été congelés et conservés en fin de journée à -20°C. Par la suite, en laboratoire, ils sont piqués et étalés pour ainsi faciliter leur identification. Une fois les spécimens secs, après environ trois jours, ceux-ci ont été encodés, étiquetés puis identifiés jusqu’à l’espèce à la loupe binoculaire. Les clés de Pauly (2019c), de Falk (2015), de Patiny et Terzo (2010) et Rasmont et Terzo (2010) ont été utilisées pour déterminer à l’espèce des spécimens collectés. Les collections de référence du conservatoire de Gembloux Agro-Bio-Tech ont été utilisées pour vérifier certains spécimens difficiles. Tous les individus ont été encodés sous format de la base de données Data Fauna-Flora (Barbier et al., 2013).
RESULTATS
10Au total, 708 spécimens ont été récoltés lors des 8 journées de terrain dans les quartiers Myosotis et Engeland à Uccle (Tableau 1). Les 6 familles d’abeilles en Belgique sont représentées par ces 708 spécimens répartis au sein de 21 genres et de 58 espèces, soit 14% de la faune apiforme belge et 28% de la faune apiforme bruxelloise.
Tableau 1 : Nombre de spécimens collectés par espèces au sein de deux quartiers à Uccle : Myosotis et Engeland.
|
Famille |
Genre |
Espèce |
Lectisme |
IUCN (Belgique) |
Engeland |
Myosotis |
TOTAL |
|
Andrenidae |
(Latreille 1802) |
63 |
54 |
117 |
|||
|
Andrena |
(Fabricius 1775) |
59 |
48 |
107 |
|||
|
dorsata (Kirby 1802) |
P |
LC |
11 |
2 |
13 |
||
|
flavipes (Panzer 1799) |
P |
LC |
35 |
25 |
60 |
||
|
florea (Fabricius 1793) |
M |
LC |
14 |
14 |
|||
|
fulvida (Schenck 1853) |
P |
EN |
1 |
1 |
|||
|
sp. |
/ |
/ |
12 |
6 |
18 |
||
|
vaga Panzer 1799 |
O |
LC |
1 |
1 |
|||
|
Panurgus |
(Panzer, 1806) |
4 |
6 |
10 |
|||
|
calcaratus (Scopoli 1763) |
O |
LC |
4 |
6 |
10 |
||
|
Apidae |
(Latreille, 1802) |
78 |
162 |
240 |
|||
|
Anthophora |
(Latreille, 1803) |
3 |
4 |
4 |
|||
|
quadrimaculata (Panzer 1806) |
P |
LC |
4 |
4 |
|||
|
plumipes (Pallas 1772) |
3 |
3 |
|||||
|
Apis |
(Linnaeus 1758) |
17 |
44 |
61 |
|||
|
mellifera (Linnaeus, 1758) |
P |
LC |
17 |
44 |
61 |
||
|
Bombus |
(Latreille, 1802) |
34 |
109 |
143 |
|||
|
hypnorum (Linnaeus 1758) |
P |
LC |
1 |
1 |
|||
|
lapidarius (Linnaeus 1758) |
P |
LC |
12 |
5 |
17 |
||
|
lucorum ( Linnaeus 1761) |
P |
NT |
1 |
1 |
|||
|
pascuorum (Scopoli 1793) |
P |
LC |
20 |
25 |
45 |
||
|
pratorum (Linnaeus 1761) |
P |
LC |
3 |
3 |
|||
|
terrestris (Linnaeus 1758) |
P |
LC |
17 |
80 |
97 |
||
|
sp. |
1 |
1 |
|||||
|
Nomada |
(Scopoli 1770) |
1 |
1 |
||||
|
goodeniana (Kirby 1802) |
K |
LC |
1 |
1 |
|||
|
sp. |
4 |
4 |
|||||
|
Colletidae |
(Lepeletier de Saint Fargeau, 1841) |
83 |
18 |
101 |
|||
|
Colletes |
(Latreille 1802) |
77 |
1 |
78 |
|||
|
cunicularius |
O |
LC |
2 |
2 |
|||
|
daviesanus (Smith 1846) |
O |
LC |
69 |
1 |
70 |
||
|
similis (Schenck 1853) |
O |
LC |
6 |
6 |
|||
|
Hylaeus |
(Fabricius 1793) |
6 |
17 |
23 |
|||
|
brevicornis (Nylander 1852) |
P |
DD |
2 |
2 |
|||
|
communis (Nylander 1852) |
P |
LC |
3 |
4 |
7 |
||
|
dilatatus (Kirby 1802) |
P |
DD |
1 |
1 |
|||
|
hyalinatus (Smith 1842) |
P |
LC |
2 |
9 |
11 |
||
|
pictipes (Nylander 1852) |
P |
LC |
1 |
1 |
|||
|
punctulatissimus (Smith 1842) |
O |
LC |
1 |
1 |
|||
|
Halictidae |
(Thomson 1869) |
52 |
71 |
123 |
|||
|
Halictus |
(Latreille 1804) |
11 |
2 |
13 |
|||
|
scabiosae (Rossi 1790) |
P |
LC |
11 |
2 |
13 |
||
|
Lasioglossum |
(Curtis 1833) |
34 |
58 |
92 |
|||
|
calceatum (Scopoli 1763) |
P |
LC |
1 |
7 |
8 |
||
|
laticeps (Schenck 1868) |
P |
LC |
1 |
2 |
3 |
||
|
leucozonium (Schrank 1781) |
P |
LC |
7 |
4 |
11 |
||
|
minutissimum (Kirby 1802) |
P |
LC |
1 |
1 |
|||
|
morio (Fabricius 1793) |
P |
LC |
3 |
7 |
10 |
||
|
nitidulum (Fabricius 1804) |
P |
LC |
12 |
12 |
|||
|
parvulum (Schenck 1853) |
P |
LC |
1 |
1 |
|||
|
pauxillum (Schenck 1853) |
P |
LC |
1 |
1 |
|||
|
semilucens (Alfken 1914) |
P |
LC |
2 |
2 |
|||
|
sexnotatum (Kirby 1802) |
P |
LC |
1 |
1 |
|||
|
sexstrigatum (Schenck 1868) |
P |
LC |
1 |
1 |
|||
|
sp. |
- |
- |
19 |
18 |
37 |
||
|
villosulum (Kirby 1802) |
P |
LC |
2 |
1 |
3 |
||
|
zonulum (Smith 1848) |
P |
LC |
1 |
1 |
|||
|
Seladonia |
(Robertson 1918) |
1 |
2 |
3 |
|||
|
tumulorum (Linnaeus 1758) |
P |
LC |
1 |
2 |
3 |
||
|
Sphecodes |
(Latreille 1804) |
6 |
9 |
15 |
|||
|
albilabris (Fabricius 1793) |
K |
LC |
4 |
4 |
|||
|
ferruginatus (Hagens 1882) |
K |
LC |
1 |
3 |
4 |
||
|
monilicornis (Kirby 1802) |
K |
LC |
1 |
1 |
|||
|
sp. |
- |
- |
5 |
5 |
|||
|
Megachilidae |
(Latreille, 1802) |
37 |
39 |
76 |
|||
|
Anthidium |
(Fabricius 1804) |
2 |
2 |
||||
|
manicatum (Linnaeus 1758) |
P |
LC |
2 |
2 |
|||
|
Chelostoma |
(Latreille 1809) |
2 |
2 |
4 |
|||
|
campanularum (Kirby 1802) |
O |
LC |
2 |
2 |
4 |
||
|
Coelioxys |
(Latreille 1809) |
1 |
1 |
||||
|
inermis (Kirby 1802) |
K |
LC |
1 |
1 |
|||
|
Heriades |
(Spinola 1808) |
32 |
22 |
54 |
|||
|
truncorum (Linnaeus 1758) |
O |
LC |
32 |
22 |
54 |
||
|
Hoplitis |
(Klug 1807) |
1 |
2 |
3 |
|||
|
claviventris (Thomson 1872) |
P |
VU |
1 |
1 |
|||
|
leucomelana (Kirby 1802) |
P |
LC |
1 |
1 |
2 |
||
|
Megachile |
(Latreille, 1802) |
1 |
4 |
5 |
|||
|
centuncularis (Linnaeus 1758) |
P |
LC |
1 |
1 |
2 |
||
|
ericetorum (Lepeletier 1841) |
O |
LC |
1 |
1 |
|||
|
rotundata (Fabricius 1787) |
P |
LC |
2 |
2 |
|||
|
Stelis |
(Panzer 1806) |
1 |
2 |
3 |
|||
|
breviuscula (Nylander 1848) |
K |
LC |
1 |
2 |
3 |
||
|
Osmia |
(Panzer 1806) |
4 |
4 |
||||
|
cornuta (Latreille 1805) |
P |
LC |
2 |
2 |
|||
|
rufa (L.) |
P |
LC |
2 |
2 |
|||
|
Melittidae |
(Schenck 1860) |
27 |
24 |
51 |
|||
|
Dasypoda |
(Latreille 1802) |
27 |
24 |
51 |
|||
|
hirtipes (Fabricius 1793) |
O |
LC |
27 |
24 |
51 |
||
|
Total général |
21 |
58 |
340 |
368 |
708 |
||
Le lectisme (M = monolectique ; O = oligolectique ; P = polylectique ; K = cleptoparasite) ainsi que leur statut IUCN (LC = préoccupation mineure ; NT = quasi menacé ; VU = vulnérable ; EN = en danger : DD = données insuffisantes) selon Drossart et al. (2019) sont indiqués.
DISCUSSION
11Sur des surfaces comparables, nous avons recensé un peu moins de la moitié des espèces que celles inventoriées sur la friche Josaphat (Schaerbeek) en Région de Bruxelles-Capitale. Or, la friche Josaphat a été investiguée durant 5 années en combinant un effort d’échantillonnage standardisé (pan-traps de couleur et filet entomologique) et des sciences participatives afin de générer des données opportunistes (Vereecken et al., 2021b). Dans une autre étude sur 15 sites d’échantillonnage en Région de Bruxelles-Capitale, 67 espèces d’abeilles sauvages ont été recensées seulement avec les pièges de couleurs pour les périodes d’avril à juin sur l’année 2015 pour certains sites et sur l’année 2016 pour les autres (Vereecken et al., 2021a). Sur la même période d’échantillonnage (été 2020 et printemps 2021), le site du Kauwberg à Uccle (54 ha), faisant partie du réseau Natura 2000, a été échantillonné pour en évaluer la diversité spécifique des abeilles sauvages. Adjacent aux deux quartiers de notre étude, ce site abrite plus de 95 espèces d’abeilles sauvages, dont certaines sont similaires à nos échantillonnages telles que Andrena flavipes ou encore Bombus terrestris. L’effort d’échantillonnage fourni pour le site du Kauwberg était plus intense en combinant filet entomologique et pièges de couleur sur l’ensemble du site avec 18 stations d’échantillonnage (Lamarre, 2021). Par conséquent, les quartiers Myosotis et Engeland pourraient être considérés comme relativement riche au niveau de l’entomofaune apiforme sachant que la campagne n’a pas fait l’objet d’un effort d’échantillonnage aussi important au moyen d’une collecte standardisée sur plusieurs années. La richesse spécifique de ces deux quartiers pourrait être expliquée par la proportion importante d’espaces verts persistants, combinés à leur connectivité à l’échelle du paysage (Buchholz et al., 2020).
Espèces dominantes
12Au travers de notre échantillonnage non-standardisé, nous retenons 5 espèces (Apis mellifera mises à part) ayant dominé nos collectes : Bombus terrestris (97 individus), Colletes daviesanus (70 individus), Andrena flavipes (60 individus), Heriades truncorum (54 individus) et Dasypoda hirtipes (51 individus), qui représentent 47% de l’ensemble de nos captures.
13En effet, l’andrène à pattes jaunes (Andrena flavipes) est une des espèces d’abeilles thermophiles les plus communes de Belgique et de la Région Bruxelles-Capitale (Drossart et al., 2019; Pauly, 2019a) (Figure 3A). C’est une espèce polylectique ayant une grande gamme de fleurs à butiner, dont principalement des Asteraceae et les Fabaceae disponibles à Uccle. Cette espèce est présente quasi toute l’année de par ses deux générations par an (bivoltine) de mars à mai et de juillet à septembre. En général, la génération printanière est plus abondante que la génération estivale (Falk, 2015). Elle a été récoltée de manière équitable parmi les deux quartiers. Le bourdon terrestre (B. terrestris) (Figure 3B) est la deuxième espèce de bourdons la plus présente en Belgique après le bourdon des champs (Bombus pascuorum). Les individus de ses colonies sont polylectiques et butinent donc sur toutes les fleurs disponibles (Rasmont et al., 2002). C’est dans les rues du quartier Myosotis que la plupart des bourdons terrestres ont été récoltés déjà morts au pied des tilleuls argentés (Tilia tomentosa Moench), ce qui explique la disproportion d’abondance entre les deux quartiers (Tableau 1) ainsi que leur dominance dans notre échantillonnage. Néanmoins, la littérature scientifique fait encore l’objet de nombreuses investigations pour déterminer si le tilleul argenté peut être considéré comme étant responsable de la mort des bourdons terrestres retrouvés à leurs alentours (Rasmont, 2010; Koch et al., 2017; Jacquemart et al., 2018). La collète commune (C. daviesanus) est une espèce oligolectique qui butine les Asteracées de préférence (Figure 3C). Cette espèce est particulièrement présente sur le plateau Engeland, ce qui est sans doute dû à de nombreuses surfaces de nidification présentes dans les alentours (notamment au Kauwberg). En effet, c’est une espèce terricole formant de grandes agglomération de nids sur de petites surface à granulométrie sableuse (Falk, 2015). La dasypode à culotte (D. hirtipes) est une espèce d’abeille solitaire terricole (Figure 3D) nidifiant dans des sols sableux, avec regroupement possible des nids sous forme de bourgades (Blagovestchenskaya, 1963). C’est une espèce oligolectique sur les Asteracées telles que Senecio jacobaea L., Cirsium arvense Scopoli, Hypochoeris radicata L., Picris hieracioides L., ou encore Cichorium intybus L. Sa période de vol s’étend de juillet à septembre (Rasmont et al., 2002; Falk, 2015). Son abondance est assez importante dans le quartier Engeland où elle été retrouvée à de nombreuses reprises, notamment sur les fleurs de C. intybus (Figure 3D). De plus, une forte concentration de nids a pu être mise en évidence dans la rue Achille Reisdorff du quartier Myosotis (Figure 4 et 5). Cette espèce a également la particularité de nicher à travers le joint de certains vieux trottoirs bruxellois (Noël et al., 2021). Cette bourgade était composée en majorité de nids de D. hirtipes, mais également de nids d’Halictus scabiosae, même si pour cette dernière, nous avons des occurrences dans le nouveau quartier Engeland. Enfin, l’hériade des troncs (H. truncorum) est également une espèce oligolectique des Asteracées, mais celle-ci niche dans les cavités en dehors du sol notamment dans les hôtels à insectes qui étaient présents dans les deux quartiers (Fortel et al., 2016).

Figure 3 : (A) L’andrène à pattes jaunes Andrena flavipes. (Crédit photo G.Delneuville). (B) Le bourdon terrestre Bombus terrestris. (C) La collète commune Colletes daviesanus sur une fleur de tanaisie Tanacetum vulgare L. (D) La dasypode à culotte Dasypoda hirtipes sur une fleur de chicorée Cichorium intybus L. (Crédit photo J.Bonnet)

Figure 4 : Bourgades de nids de Dasypoda hirtipes (et Halictus scabiosae) rue Achille Reisdorff, 05.VIII.2020 (Crédit photo J.Bonnet)

Figure 5 : Dasypoda hirtipes en cours de nidification rue Achille Reisdorff, 05.VIII.2020 (Crédit photo J.Bonnet)
Espèces remarquables
14Nous avons choisi d’établir un récapitulatif des espèces sauvages présentes sur les sites de relevé, nécessitant une attention particulière par rapport à leur lectisme, leur stratégie de nidification ou encore leurs enjeux de conservation en Belgique (Tableau 2).
15Andrena fulvida est une espèce estivale associée aux milieux forestiers ouverts et thermophiles. On retrouve les nids de cette espèce polylectique régulièrement dans les forêts alluviales. Cette espèce est actuellement placée en danger d’extinction sur la liste rouge de Belgique (Drossart et al., 2019). Il convient donc d’assurer la plantation des familles de plantes qu’elle pollinise dans les jardins pour garantir sa conservation dans le quartier de Myosotis (Tableau 2). Bombus lucorum est une espèce de bourdon menacée, mais difficilement distinguable de B. terrestris qui est très abondante sur tout le territoire. On suppose que c’est une espèce largement polylectique. L’espèce peut former des colonies de taille importante, comprenant jusqu'à 400 ouvrières (Benton, 2006). Deux espèces appartenant à la famille des Colletidae, Hylaeus brevicornis et Hylaeus dilatatus, définies par Drossart et al., (2019) comme étant déficientes de données au niveau de leur statut IUCN (Tableau 1), s’explique par le fait que ce genre d’abeilles est taxonomiquement difficile avec des complexes spécifiques encore présents et peu d’experts pouvant les reconnaître (Rasmont et al., 2002). Il est donc fort probable que ces deux espèces soient peu concernées par des menaces d’extinction. Hoplitis claviventris (Megachilidae), classée comme vulnérable en Belgique (Tableau 2) a été collecté dans le quartier Myosotis (Drossart et al., 2019). C’est une espèce polylectique avec une nette préférence pour les Fabaceae du genre Lotus spp. Cette espèce niche dans des tiges creuses de plantes mortes de certaines Asteraceae, Rosaceae et Scrophulariaceae (Westrich, 2018). Les sites de nidification particulièrement importants sont des massifs ronciers fortement exposés au soleil. De ce fait, pour garantir le maintien de cette population, il faut miser sur la plantation de Lotus sp. dans des jardins par exemple, mais également conserver des sources de plantes permettant de générer des tiges creuses pour la nidification de l’espèce tels que les ronciers (Rubus spp.).
Tableau 2 : Espèces d’abeilles sauvages présentes sur les site de relevés et nécessitant une attention particulière, ainsi que leurs plantes associées.
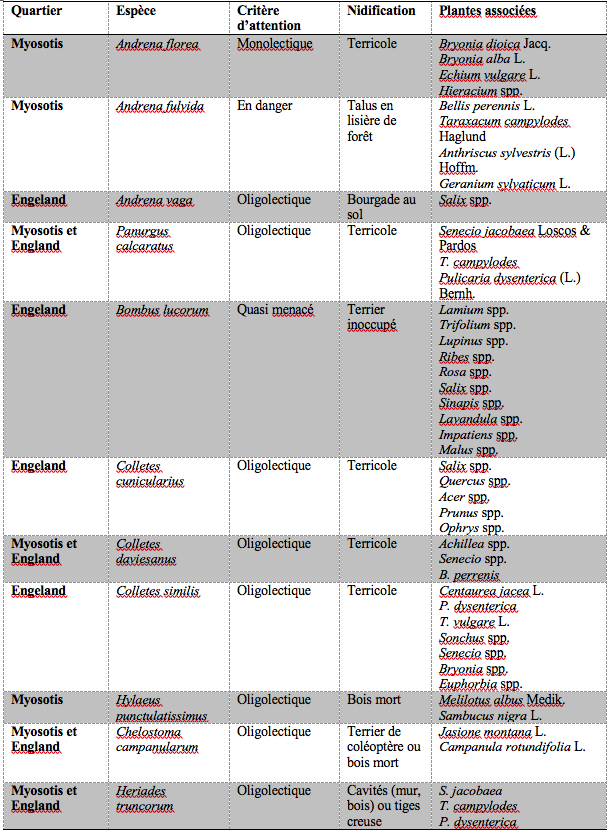
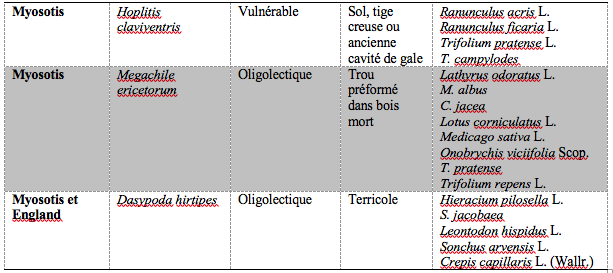 La liste des plantes associées provient des ressources scientifiques suivantes : Atlas Hymenoptera (Rasmont et al, 2002) ; Atlas de la faune de Suisse ; Bees, Wasps & Ants Recording Society (BWARS 2020) ; Les couples FlorAbeilles.
La liste des plantes associées provient des ressources scientifiques suivantes : Atlas Hymenoptera (Rasmont et al, 2002) ; Atlas de la faune de Suisse ; Bees, Wasps & Ants Recording Society (BWARS 2020) ; Les couples FlorAbeilles.
Recommandations de gestion de conservation en faveur des abeilles sauvages
16A l’échelle des deux quartiers, différentes mesures peuvent être envisagées et mises en place. Au vu de notre inventaire, la majorité des abeilles échantillonnées sont des espèces polylectiques (Tableau 1) qui sont plus résilientes face aux perturbations liées à l’activité humaine. De ce fait, semer les ressources florales en ciblant celles butinées par les oligolectiques (Tableau 1) est une disposition principale à mettre en place, que ce soit dans les jardins des riverains, les potagers partagés ou encore les espaces environnants ces deux quartiers. Il est donc important d’optimiser et de diversifier la disponibilité des associations florales nécessaires au maintien des populations oligolectiques inventoriées en favorisant des espèces florales indigènes. Celles-ci seront beaucoup mieux adaptées au milieu, mais aussi aux espèces que l’on essaie de soutenir. Elles nécessiteront également moins d’entretien surtout s’il s’agit d’espèces vivaces. De plus, semer des espèces végétales ciblées pour les espèces d’abeilles oligolectiques est également bénéfique pour les espèces polylectiques par l’asymétrie des interactions plantes-pollinisateurs (Bascompte et al., 2003). Au niveau des plantations, nous recommandons de semer des Asteracées (notamment Tanacetum vulgare) et des Ombellifères pour attirer des genres d’abeilles dont les espèces sont particulièrement spécialistes : Colletes sp., Heriades truncorum, Hoplitis sp. et Chelostoma sp.
17Les bandes fleuries sont souvent mentionnées pour favoriser les espèces pollinisatrices en milieu agricole, néanmoins elles sont difficiles à mettre en place en milieu urbain où la place est déjà limitée (Bretzel et al., 2016). Cela dit, le quartier d’Engeland, disposant de plus d’espaces verts au demeurant non urbanisés, pourrait envisager ce genre de dispositif. Combinées avec l’installation de haies libres, ces bandes fleuries permettraient la création d’un maillage écologique des plus intéressants avec les bois disponibles en bordure du quartier.
18Par rapport à nos investigations du printemps 2021 (17/04 et 27/04), nous avons observé que la strate arborée fournissait principalement les ressources florales pour la communauté de pollinisateurs dans le quartier Myosotis. Néanmoins, cette communauté pollinisatrice est particulièrement composée d’abeilles mellifères, dominantes dans tout le quartier au printemps, probablement à cause de la présence de ruchers à proximité. Nous n’avons pas eu accès aux jardins des riverains ce qui peut tendre à sous-estimer la réelle richesse présente dans le quartier Myosotis. La glycine (Wisteria floribunda Nutt.) sur les murs des maisons du quartier Mysosotis offre également une ressource en nectar intéressante pour les abeilles mellifères principalement. De plus, la diversité de Myosotis est principalement composée d’espèces communes et polylectiques sans grands enjeux de conservation exceptée pour A. fulvida.
19L’aménagement des pieds d’arbre, souvent délaissés et peu accueillants, est l’une des possibilités les plus accessibles et ce dans les 2 quartiers prospectés. En effet, leurs rues sont déjà végétalisées avec l’implantation régulière d’arbres, ce qui pourrait encore être optimisé par l’installation supplémentaire de parterres fleuris à leur pied. Divers mélanges de plantes pourraient y prendre place (voir Tableau 2), mais on y privilégiera les plantes vivaces pour en limiter l’entretien et le placement par semis. Certains arbres, aux racines apparentes, sont en effet plus fragiles et ne supporteront pas que le sol soit perturbé. Favoriser les parterres fleuris sur les surfaces piétonnes, comme ceux observés dans le quartier Myosotis (Figure 6), est une excellente alternative pour augmenter les ressources en nectar et en pollen pour les pollinisateurs. Ce type d’aménagement est à intensifier dans le futur.
20En ce qui concerne les sites de nidifications, il est important de préserver ceux déjà existants, et si possible d’en mettre de nouveaux à disposition. La majorité des espèces inventoriées nichent dans le sol. Un intérêt particulier sera donc porté à la sauvegarde d’espaces nus de végétation et sans aménagements urbains, ce qui constitue les préférences de ces espèces (Cane, 1991; Antoine et al., 2021). Les bourgades déjà observées devront être conservées en l’état (Figure 7), protégées et entretenues en évitant le bâchage jardinier ou le semis, afin de laisser une zone dévégétalisée pour que les conditions de nidification restent optimales. Par rapport à notre collecte printanière dans le quartier Engeland en zone ENG2 (Figure 2), nous avons observé d’importantes bourgades d’abeilles terricoles. En effet, la bourgade d’abeilles solitaires la plus importante (Figure 7) est principalement composée de A. vaga, C. cunicularius, et Lasioglossum spp. avec une surface de 40 m² et des centaines de nids. D’autres bourgades ont également été observées plus loin (Figure 14), avec plus ou moins les mêmes compositions de surface au sol, abritant plus de 100 nids sur des surfaces de 5m². Nous y avons relevé la présence d’abeilles solitaires de grandes tailles telles que A. vaga, C. cunicularius et S. albilabris avec des Lasioglossum spp.
21Les hôtels à insectes sont particulièrement à la mode depuis presque 10 ans et restent envisageables. Néanmoins, privilégiant l’agrégation d’insectes en un endroit, leur effet peut s’avérer plutôt négatif (MacIvor, 2017). Ils peuvent augmenter les phénomènes de prédation, mais aussi favoriser la propagation des parasites et maladies à cause de la concentration des individus en leur sein. Il est toujours intéressant d’en disposer quelques-uns mais en privilégiant ceux de petites tailles et en les disposant de manière assez éloignée. D’autant plus que, comme mentionné auparavant, la plupart des abeilles solitaires sont terricoles dans cette étude et ne nichent donc pas dans ces structures.
22Pour que toutes ses implantations soient efficaces et durables, il est évidemment nécessaire de communiquer avec les riverains et usagers des lieux sur les abeilles occupant leur quartier. Ils doivent être sensibilisés aux stratégies adoptées pour en avoir conscience, voire y participer. Des panneaux explicatifs pourront être établis à certains points stratégiques tels qu’au niveau des zones de nidification ou des bandes fleuries. Il est, entre autres, important de signaler les nids, et par la même occasion de les protéger, afin d’éviter de potentiels conflits (piqûres ou destruction des nids).

Figure 6 : Parterre fleuri sur le trottoir, quartier Myosotis

Figure 7 : Bourgade d’abeilles terricoles dans le quartier Engeland (ENG2)
CONCLUSION
23Ce travail à l’initiative de la commune d’Uccle et de l’ASBL Apis Bruoc Scella vient s’insérer dans les recherches actuellement réalisées dans la Région de Bruxelles-Capitale, notamment les projets l’Atlas des abeilles régional, STREETBEES et KAUWBEES, financés par Bruxelles Environnement. La forte diversité des abeilles sauvages dans les quartiers Myosotis et Engeland de la commune d’Uccle plaide en faveur d’une réflexion par rapport à nos aménagements urbains futurs : peut-on continuer à convertir des zones naturelles en surfaces habitables au détriment des pollinisateurs arborant le paysage ucclois ?
Merci à Julie Ellange pour la préparation et l’encodage des spécimens. Merci à Jeannine Bortels pour la gestion de la mise en collection des spécimens. Nous remercions également le Professeur Rasmont (UMons) pour son accessibilité et son aide dans la détermination des bourdons. Merci à Bruxelles Environnement (Julien Ruelle), la commune d’Uccle et l’ASBL Apis Bruoc Scella (Marina Rechul, Valérie Vanparys et Sophie Maerckx) pour le financement de cette étude. Nous remercions également Yvan Barbier pour sa relecture avisée.
Bibliographie
Alberti M., Correa C., Marzluff J.M., Hendry A.P., Palkovacs E.P., Gotanda K.M., Hunt V.M., Apgar T.M. & Zhou Y., 2017. Global urban signatures of phenotypic change in animal and plant populations. Proceedings of the National Academy of Sciences U. S. A. 114(34), 8951-8956. doi: 10.1073/pnas.1606034114
Antoine C.M. & Forrest J.R.K., 2021. Nesting habitat of ground-nesting bees: a review. Ecological Entomology. 46(2), 143-159. doi: 10.1111/een.12986
Baldock K.C.R., Goddard M.A., Hicks D.M., Kunin E., Mitschunas N., Osgathorpe L.M., Potts S.G., Robertson K.M., Scott A. V, Stone G.N., Vaughan I.P. & Memmott J., 2015. Where is the UK ’ s pollinator biodiversity ? The importance of urban areas for flower- visiting insects. Proceedings of the Royal Society B. 282, 20142849. doi: 10.1098/rspb.2014.2849
Barbier Y., Rasmont P., Dufrene M. & J.-M S., 2013. Data Fauna-Flora Guide d’Utilisation. Version 4.0. Université de Mons-Hainaut, Mons, 106 p. http://zoologie.umons.ac.be/dff/default.asp (05/10/2022).
Bascompte J., Jordano P., Melián C.J. & Olesen J.M., 2003. The nested assembly of plant-animal mutualistic networks. Proceedings of the National Academy of Sciences U. S. A. 100(16), 9383-9387. doi: 10.1073/pnas.1633576100
Benton T.G., 2006. Bumblebees. Collins New Naturalist Library, 592 p.
Blagovestchenskaya N., 1963. Giant colony of the solitary bee Dasypoda plumipes (PZ) (Hymenoptera, Melittidae). Entomologischeskoe Obozrenie. 42, 115-117.
Bretzel F., Vannucchi F., Romano D., Malorgio F., Benvenuti S. & Pezzarossa B., 2016. Wildflowers: From conserving biodiversity to urban greening—A review. Urban Forestry & Urban Greening. 20, 428-436. doi: 10.1016/j.ufug.2016.10.008
Bruxelles-Environnement, 2021. Les espaces verts gérés par Bruxelles Environnement. https://geodata.environnement.brussels/client/view/67bc5ff0-90f6-4b76-9f05-15c15a928980 (05/10/2022).
Buchholz S., Gathof A.K., Grossmann A.J., Kowarik I. & Fischer L.K., 2020. Wild bees in urban grasslands: Urbanisation, functional diversity and species traits. Landscape and Urban Planning. 196, 103731. doi: 10.1016/j.landurbplan.2019.103731
Cane J.H., 1991. Soils of ground-nesting bees (Hymenoptera: Apoidea): Texture, moisture, cell depth and climate. Journal of the Kansas Entomological Society. 64(4), 406-413.
Drossart M., Rasmont P., Vanormelingen P., Dufrêne M., Folschweiller M., Pauly A., Vereecken N.J., Vray S., Zambra E., D’Haeseleer J. & Michez D., 2019. Belgian Red List of bees. Université de Mons, Mons, 140 p.
Falk S., 2015. Field Guide to the Bees of Great Britain and Ireland. Bloomsbury Publishing, London, 432 p.
Fortel L., Henry M., Guilbaud L., Mouret H. & Vaissière B.E., 2016. Use of human-made nesting structures by wild bees in an urban environment. Journal of Insect Conservation. 20(2), 239-253. doi: 10.1007/s10841-016-9857-y.
Grimm N.B., Faeth S.H., Golubiewski N.E., Redman C.L., Wu J., Bai X. & Briggs J.M., 2008. Global change and the ecology of cities. Science. 319(5864), 756-760. doi: 10.1126/science.1150195
Hall D.M., Camilo G.R., Tonietto R.K., et al., 2016. The city as a refuge for insect pollinators. Conservation Biology. 31(1), 24-29. doi: 10.1111/cobi.12840
Jacquemart A.L., Moquet L., Ouvrard P., Quetin-Leclercq J., Hérent M.F. & Quinet M., 2018. Tilia trees: toxic or valuable resources for pollinators? Apidologie 49(5), 538-550. doi: 10.1007/s13592-018-0581-3.
Koch H. & Stevenson P.C., 2017. Do linden trees kill bees? Reviewing the causes of bee deaths on silver linden (Tilia tomentosa). Biology Letters. 13(9). doi: 10.1098/rsbl.2017.0484
Lamarre M., 2021. Recensement et impact de la structure paysagère urbaine sur les communautés d’abeilles sauvages au Kauwberg (Uccle). Unpublished master's thesis, Université de Liège, Liège, Belgique, 71 p. https://matheo.uliege.be/handle/2268.2/12953.
MacIvor J.S., 2017. Cavity-nest boxes for solitary bees: a century of design and research. Apidologie 48(3), 311-327. doi: 10.1007/s13592-016-0477-z
Mouret H., Carre G., Roberts S.P.M., Morison N. & Vaissière B.E., 2007. Mise en place d’une collection d’abeille (Hymenoptera, Apoidea) dans le cadre d’une étude de la biodiversité. Osmia 1, 8–15.
Noël G., Bebermans J., Gengler N. & Francis F., 2018. Rôle de la transmission des maladies dans le déclin des pollinisateurs – Synthèse bibliographique. Entomologie Faunistique. 71, 1-23. doi: 10.25518/2030-6318.4096
Noël G., Van Keymeulen V., Barbier Y., Smets S., Van Damme O., Colinet G., Ruelle J. & Francis F., 2021. Nest aggregations of wild bees and apoid wasps in urban pavements: a street life to be promoted in urban planning. bioRxiv. doi: 10.1101/2021.12.15.472743
Patiny S. & Terzo M., 2010. Catalogue et clé des sous-genres et espèces du genre Andrena de Belgique et du nord de la France (Hymenoptera, Apoidea), Laboratoire de Zoologie, Université de Mons, 39 p.
Pauly A., 2019a. Contribution à l’inventaire des abeilles sauvages de la Région de Bruxelles-Capitale et de la Forêt de Soignes (Hymenoptera: Apoidea). Belgian Journal of Entomology. 79:1-160.
Pauly A., 2019b. Les abeilles sauvages du Jardin Botanique “Jean Massart” à Bruxelles (Hymenoptera: Apoidea). Belgian Journal of Entomology. 78, 1-86.
Pauly A., 2019c. Abeilles de Belgique et des régions limitrophes (Insecta: Hymenoptera: Apoidea). Famille Halictidae. Faune de Belgique, Institut royal des Sciences naturelles de Belgique, Bruxelles, 518 p.
Prendergast K.S., Dixon K.W. & Bateman P.W., 2022. A global review of determinants of native bee assemblages in urbanised landscapes. Insect Conservation and Diversity.15(4), 385-405. doi: 10.1111/icad.12569
Rasmont P., 2010. Note de synthèse sur la mortalité des butineurs de Tilia tomentosa. L’echo du Marais 93, 12-14.
Rasmont P. & Haubruge É., 2002. Atlas Hymenoptera. http://www.atlashymenoptera.net/default.aspx (06/09/2022)
Rasmont P. & Terzo M., 2010. Catalogue et clé des sous-genres et espèces du genre Bombus de Belgique et du nord de la France (Hymenoptera, Apoidea). Université de Mons, Mons, 28 p.
Seto K.C., Güneralp B. & Hutyra L.R., 2012. Global forecasts of urban expansion to 2030 and direct impacts on biodiversity and carbon pools. Proceedings of the National Academy of Sciences U. S. A. 109(40), 16083-16088. doi: 10.1073/pnas.1211658109
Šlachta M., Erban T., Votavová A., Bešta T., Skalský M., Václavíková M., Halešová T., Edwards-Jonášová M., Včeláková R. & Cudlín P., 2020. Domestic gardens mitigate risk of exposure of pollinators to pesticides—an urban-rural case study using a red mason bee species for biomonitoring. Sustainability. 12(22), 1-17. doi: 10.3390/su12229427
Theodorou P., Radzevičiūtė R., Lentendu G., Kahnt B., Husemann M., Bleidorn C., Settele J., Schweiger O., Grosse I., Wubet T., Murray T.E. & Paxton R.J., 2020. Urban areas as hotspots for bees and pollination but not a panacea for all insects. Nature Communication. 11(1), 1-13. doi: 10.1038/s41467-020-14496-6
United Nations D. of E. and S.A.P.D., 2019. World Urbanization Prospects: The 2018 Revision (ST/ESA/SER.A/420)., Demographic Research, 126 p.
Vereecken N.J., Weekers T., Leclercq N., De Greef S., Hainaut H., Molenberg J.M., Martin Y., Janssens X., Noël G., Pauly A., Roberts S.P.M. & Marshall L., 2021a. Insect biomass is not a consistent proxy for biodiversity metrics in wild bees. Ecological Indicators. 121, 107132. doi: 10.1016/j.ecolind.2020.107132
Vereecken N.J., Weekers T., Marshall L., D’Haeseleer J., Cuypers M., Vanormelingen P., Pauly A., Pasau B., Leclercq N., Tshibungu A., Molenberg J.-M. & De Greef S., 2021b. Five years of citizen science and standardized field surveys reveal a threatened urban Eden for wild bees in Brussels, Belgium. Insect Conservation and Diversity. 14(6), 868-876. doi: 10.1111/icad.12514
Westrich P., 2018. Die Wildbienen Deutschlands., 822 p.
(38 Réf)