- Accueil
- Volume 78 (2025)
- Gîtes larvaires et composition spécifique des moustiques vecteurs d’arbovirus à Adaou, village du département d’Aboisso (Côte d’Ivoire)
Visualisation(s): 549 (2 ULiège)
Téléchargement(s): 214 (2 ULiège)
Gîtes larvaires et composition spécifique des moustiques vecteurs d’arbovirus à Adaou, village du département d’Aboisso (Côte d’Ivoire)

Document(s) associé(s)
Version PDF originaleRésumé
La dengue est l’arbovirose la plus répandue dans le monde avec environ 300 millions de cas par an. En Côte d’Ivoire, des épidémies récurrentes de dengue sont observées. Ainsi, une surveillance des vecteurs d’arbovirus a été mise en place dans différents sites sentinelles. Son objectif est de déceler la circulation des arbovirus et de lancer la riposte. Le département d’Aboisso, situé au sud-est du pays, fait partie des sites sentinelles nouvellement choisis du fait des cas notifiés de dengue. Ainsi, une étude entomologique transversale répétée a été initiée en avril, juin et septembre 2023 dans le village d’Adaou. Des moustiques de différents stades ont été récoltés à travers des prospections des gîtes larvaires dans 300 concessions et sous double moustiquaire. Au total, 480 gîtes larvaires ont été dénombrés, dont 44% (n=211) en avril. Les récipients de stockage d’eau ont été les plus nombreux avec 51% des gîtes larvaires. Parmi les gîtes trouvés, 46% (n=221) contenaient des larves d’Aedes. Le plus grand nombre de gîtes larvaires positifs (n = 91) a été obtenu en avril. Les récipients abandonnés contenaient pléthore de larves, avec en moyenne 23 larves par gîte. Des onze espèces identifiées, Aedes aegypti (Linnaeus, 1762) a été la plus abondante avec 62% (n=137). Quant au rythme d’activité, le pic se situe entre 17 h et 18 h. Les gîtes larvaires préférentiels des vecteurs d’arbovirus sont présents et diversifiés à Adaou. Cela peut constituer des facteurs de risque de circulation et de transmission des arbovirus.
Abstract
Dengue is the most widespread arbovirosis in the world, with around 300 million cases per year. Recurrent dengue epidemics have been observed in Côte d'Ivoire. This situation has led to the introduction of surveillance of arbovirus vectors at various sentinel sites. This will make it possible to detect arboviruses circulation and launch a response. Aboisso department, in the south-east of Côte d’Ivoire, was one of the sentinel sites chosen because of the number of cases of dengue fever reported. A repeated cross-sectional entomological study (April, June and September 2023) was carried out in Adaou. Mosquitoes were collected through surveys of breeding sites in 300 concessions and collection of adult mosquitoes under double mosquito nets. A total of 480 breeding sites were counted, of which 44% (n=211) were found in April. Water storage containers were the most numerous, accounting for 51% of the breeding sites. Of the sites found, 46% (n=221) contained Aedes larvae. The highest number of positive breeding sites (n = 91) was obtained in April. Abandoned containers contained the highest number of larvae, with an average of 23 larvae per site. Of the eleven species identified, Aedes aegypti (Linnaeus, 1762) was the most abundant at 62% (n=137). As for the rhythm of activity, the peak was between 5 p.m. and 6 p.m. The preferred breeding grounds of arbovirus vectors are present and diverse in Adaou. This may constitute a risk factor for the circulation and transmission of arboviruses.
Reçu le 6 août 2024 , accepté le 22 avril 2025
Cet article est distribué suivant les termes et conditions de la licence CC-BY (http://creativecomons.org/licenses/by/4.0/deed.fr)
INTRODUCTION
1La dengue est une maladie causée par un virus appartenant au genre Flavivirus (OMS, 2016). Elle est l’une des infections les plus répandues au monde (Beltrán-Silva et al., 2018 ; Sànchez-Carbonel, 2018). Elle est transmise à l’homme par des moustiques du genre Aedes, principalement Aedes aegypti et Aedes albopictus (Skuse, 1894) (Failloux, 2018). Son incidence progresse actuellement de manière très importante, et l’inscrit aujourd’hui aux rangs des maladies dites « ré-émergentes » (Tinto et al., 2022). Le nombre de cas dans le monde est estimé à environ 390 millions par an, dont le nombre de cas sévères est passé de 2000 à 2019, de 500000 à 5,2 millions (OMS, 2023). L’augmentation du nombre de cas de dengue peut être expliquée par plusieurs facteurs : la croissance démographique incontrôlée de certaines régions du globe et une urbanisation anarchique mais aussi les voyageurs et des échanges commerciaux qui participent à la propagation des virus de la dengue. Enfin, l’essoufflement des programmes de lutte antivectorielle constitue un des facteurs importants (Tinto et al., 2022). L’absence de politique adéquate de gestion de l’eau dans les zones urbaines et rurales encourage l’entreposage de l’eau à domicile. Cette situation fait également augmenter le risque d’épidémies transmises par les moustiques (OPS, 2019). L’Afrique figure parmi les régions les plus touchées par les arboviroses (OMS, 2023). Des flambées épidémiques sont signalées dans plusieurs pays dont la Côte d’Ivoire (OMS, 2023) où des épidémies récurrentes y sont déclarées depuis sa première apparition en 2008 (Ano et al., 2022). L’isolation en 1980 de 28 souches de dengue 2 chez quatre vecteurs selvatiques (Aedes furcifer taylori (Edwards, 1936), Aedes luteocephalus (Newstead, 1907), Aedes opok, (Corbet and Van Someren, 1962) et Aedes africanus (Theobald, 1901)) a confirmé l'existence d'une circulation selvatique de ce virus en Côte d'Ivoire (Cordellier et al., 1983). Depuis cette date, le pays en est à sa sixième épidémie déclarée de dengue (Flu Trackers.com, 2023). Plusieurs régions du pays, dont Aboisso, ont notifié des cas de cette maladie. Face à la généralisation des cas, les autorités sanitaires ont envisagé une riposte mais, pour rendre efficace les stratégies de lutte contre les vecteurs, une étude écologique préalable s’impose (Kutomy et al., 2022). Elle est nécessaire pour la reconnaissance des gîtes larvaires, l’identification des espèces vectorielles présentes, les périodes d’abondance, leur rythme d’activité et leurs répartitions géographique et temporelle (Berchi et al., 2012). Elle permettra ainsi d’approfondir les connaissances sur la circulation des arbovirus et déceler éventuellement d’autres vecteurs potentiels. C’est dans ce contexte que cette étude a été initiée à Adaou, un village d’Aboisso situé à la lisière de la forêt classée de Soumié. Elle avait pour objectif de faire l’inventaire des gîtes larvaires des vecteurs potentiels d’arbovirus et les espèces qui composent la faune culicidienne à Adoua.
MATÉRIEL ET MÉTHODES
Présentation de la zone d’étude
2L’étude a été réalisée à Adaou (Fig. 1), un village du département d’Aboisso, dans la Région du Sud-Comoé dans le sud-est de la Côte d’Ivoire, à 116 km d’Abidjan et à 60 km de la frontière du Ghana. Il est très accidenté mais reste un pôle important pour l’agriculture. Le département est drainé par la Bia et ses affluents ainsi que la Tanoe. Quant au climat, il est de type équatorial, caractérisé par quatre saisons de durée inégale : la grande saison sèche (décembre à février), la grande saison des pluies (mars à juillet), la petite saison sèche (août à septembre) et la petite saison des pluies (octobre à novembre). À Aboisso se trouvent des forêts classées (Soumié et Négué) d’une superficie de 1075 ha. La forêt classée de Soumié est située à proximité du village d’Adaou.
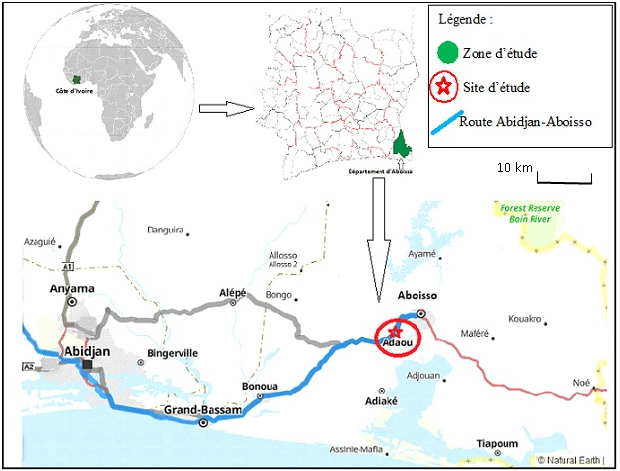
Figure 1 : Localisation du village d’Adaou, site de l’étude
Collecte des moustiques
3Il s’est agi d’une étude transversale répétée, avec des collectes de moustiques en avril, juin (grande saison des pluies) et septembre 2023 (petite saison sèche).
Prospection des gîtes larvaires
4Les prospections des gîtes larvaires ont été faites à pied, à l’intérieur et à l’extérieur de 300 concessions, (soit 100 par enquête) choisies de façon aléatoire dans le village. Dans chacune des concessions prospectées, il a été également expliqué au chef de famille ou à son représentant la raison et la méthodologie de cette investigation. Après son consentement oral et son autorisation, tous les réceptacles artificiels et naturels contenant de l’eau ont été examinés. Toutes les informations sur les gîtes larvaires trouvés ont été enregistrées sur une tablette Android munie de l’application KoboCollect. Tout récipient contenant au moins un stade pré imaginal ou une exuvie, a été considéré comme positif (OMS, 2014). Dans ce cas, des larves ou nymphes du genre Aedes ont été prélevées à l’aide de pipettes Pasteur, de poires à lavement et/ou de louches ; idem pour les autres genres larvaires. Elles ont été conservées dans des pots contenant de l’eau du gîte larvaire. Chaque pot a été étiqueté avec les scotch Kaki en indiquant la date de collecte, le numéro d’identification de l’habitation et le type de gîte larvaire. Les larves et les nymphes recueillies ont été ramenées au laboratoire pour leur élevage. Au laboratoire, elles ont été mises dans des gobelets jetables recouverts de tulle moustiquaire dont l’ouverture a été bouchée avec du coton. Un tri journalier a permis de séparer les nymphes des larves. Ces dernières ont été nourries quotidiennement avec des croquettes pour chat moulues. Les imagos ont été aspirés et identifiés sous une loupe binoculaire à l’aide des clés de détermination.
Capture des moustiques adultes sous double-moustiquaire
5Les moustiques adultes à la recherche d’un repas de sang ont été collectés sous double-moustiquaire. Pour ce faire, trois points de capture ont été choisis ; deux dans le village et le troisième à la lisière de la forêt. Sous la double moustiquaire, l’homme a été remplacé par un dispositif de production de CO2. En effet, c’est le CO2 rejeté par l’homme qui attire le moustique (Simard et al., 2016). Ainsi, afin de réduire la charge de l’appât humain qui est en même temps collecteur des moustiques emprisonnés entre les deux moustiquaires, celui-ci a été remplacé par une source artificielle de production de CO2, comme source d’attraction. Ce dispositif a été inspiré de celui des pièges BG-Sentinel et adapté à notre contexte. Il est constitué d’un pot en plastique dans lequel a été introduit sucre, levure boulangère et eau. La fermentation du mélange dégage du CO2 dont la diffusion attire les moustiques. Ce dispositif a été déposé sous la double-moustiquaire. Il décharge le collecteur qui doit rester sous la double-moustiquaire tout le temps de la capture. Le collecteur se contente, à la fin de chaque tranche horaire, d’aspirer les moustiques qui se retrouvent entre les deux moustiquaires. Pendant trois jours successifs, de 15h00 à 19h00, les moustiques ont été collectés par celui-ci et mis dans des tubes à hémolyse à l’aide d’un aspirateur à bouche et classés dans des saccules sur lesquelles figurent les indications horaires. Les échantillons de moustiques collectés ont été acheminés au laboratoire pour être identifiés.
Analyse des données
6Le tableur Excel a été utilisé pour la saisie des données, le calcul des différentes proportions et la réalisation des figures et des graphiques. L’analyse statistique des données a été faite avec le logiciel STATISTICA 7.1.
RÉSULTATS
Caractérisation des gîtes larvaires
7Au total, 480 gîtes larvaires ont été dénombrés dont 211 en avril, 147 en juin et 122 en septembre. L’analyse des variances a montré une différence significative (ddl=2 ; F=,78 ; p-value=0,0235). Le plus grand nombre de gîtes larvaires a été obtenu en avril, avec une proportion de 44%. En revanche, le plus petit nombre a été observé en septembre avec une proportion de 25%. Environ 256 gîtes larvaires, dont 125 en avril, ont été éliminés pendant la prospection par la sensibilisation des populations. Cette action a eu un impact sur le nombre de gîtes larvaires de juin et septembre. En effet 147 et 122 ont respectivement été obtenus pour 211 en avril.
Typologie des gîtes larvaires
8Les gîtes larvaires ont été regroupés en 7 grandes catégories. Ce sont les récipients abandonnés (RA), les récipients de stockage d’eau (RS), les pneus usagés (PN), les pots de fleurs (PF), les gîtes naturels (GN), les sanitaires (SA) et les autres types de gîtes (AU). Les 7 catégories ont été retrouvées au cours des trois périodes de la prospection des gîtes larvaires. Les récipients de stockage d’eau, avec un nombre de 243 (51%), ont été les plus nombreux. L’analyse de variance a montré une différence hautement significative (ddl=1 ; f=76,98 ; p-Value=0,0000). Ils ont été également plus nombreux au cours des 3 périodes d’échantillonnage avec 125, 60 et 58 gîtes larvaires, respectivement en avril, juin et septembre. Les récipients abandonnés, avec n = 157, soit 33% ont été également nombreux. Les plus faibles nombres de gîtes positifs ont été les gîtes naturels où seulement un gîte larvaire a été rencontré au cours de cette étude.
Répartition des gîtes larvaires positifs et négatifs sur le site
9Parmi les 480 gîtes larvaires trouvés, 221 contenaient des larves de moustiques de type Aedes, soit une proportion de 46%. Le test t a montré une différence significative (ddl=333 ; p-value=0,01120). En avril, 91 gîtes larvaires positifs ont été dénombrés, soit 41%. Le test t pour des échantillons appariés a montré une différence significative (ddl=334 ; p-value=0,0000). En rapportant le nombre de gîtes positifs sur le nombre total, il ressort que le plus grand nombre de gîtes positifs a été obtenu en septembre avec une proportion de 52%. Parmi les gîtes positifs, les récipients de stockage d’eau et les récipients abandonnés ont été les plus colonisés par les larves de moustiques. Le test t a révélé une différence hautement significative pour les catégories de gîtes (ddl=334 ; p-value=0,0000). Il y a eu respectivement 99 (45%) et 91 (41%) parmi eux qui étaient positifs. Aucun gîte larvaire positif n’a été observé dans les pots de fleur et les gîtes naturels au cours du temps (Tableau 1).
10Au niveau des périodes d’échantillonnage, le plus grand nombre de gîtes larvaires positifs a été observé au mois d’avril où 91 d’entre eux ont été dénombrés, soit une proportion de 41%. Le test t pour échantillons appariés a montré une différence hautement significative (ddl=334 ; p-value=0,0000). Le rapport du nombre de gîtes larvaires positifs sur le nombre total de gîtes dénombrés a donné une proportion de 58% pour les récipients abandonnés, 41% pour les récipients de stockage d’eau et 44% pour les pneus usagés. Les récipients abandonnés ont été les gîtes préférentiels pour les larves des moustiques du genre Aedes.
Tableau 1 : Proportion des différents gîtes larvaires positifs au cours du temps
|
Catégorie |
avril |
juin |
septembre |
total positif |
% |
|
|
*RA |
38 |
32 |
21 |
91 |
41 |
|
|
RS |
47 |
23 |
29 |
99 |
45 |
|
|
Pn |
3 |
6 |
8 |
17 |
8 |
|
|
Pf |
0 |
0 |
0 |
0 |
0 |
|
|
Au |
1 |
5 |
5 |
11 |
5 |
|
|
Gn |
0 |
0 |
0 |
0 |
0 |
|
|
Sa |
2 |
1 |
0 |
3 |
1 |
|
|
Total |
91 |
67 |
63 |
221 |
100 |
* RA : récipients abandonnés, RS : récipients de stockage, Pn : pneus usagés, Pf : pots de fleur, Au : autres gîtes larvaires, Gn : Gîtes larvaires naturels, Sa : Sanitaires
Productivité des gîtes larvaires positifs
11Les récipients abandonnés ont comptabilisé en moyenne 23 larves de moustiques du genre Aedes dans chacun d’eux pour un nombre moyen de 16 larves d’Aedes dans les sanitaires. Quant aux récipients de stockage d’eau, un nombre moyen de 11 larves de Aedes a été observé dans chacun d’eux. L’analyse de variances a révélé une différence significative entre le nombre de larves et les catégories de gîtes larvaires (ddl=6 ; p-value=0,00456). Au niveau des périodes de prospection des gîtes larvaires, c’est en avril et dans les récipients abandonnés que le plus grand nombre de larves de Aedes a été obtenu, avec une moyenne de 27 larves par gîte larvaire (Fig. 2).
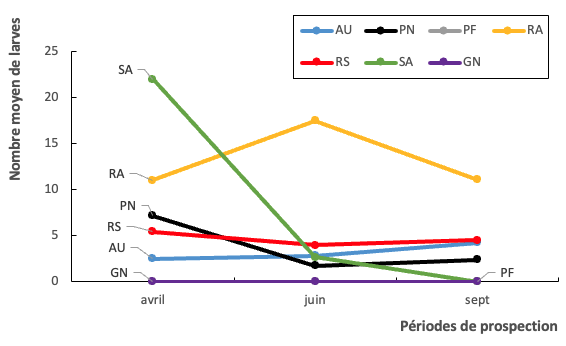
Figure 2 : Nombre moyen de larves du genre Aedes dans les types de gîtes larvaire dans le temps
12Les larves des autres genres de moustiques (Anopheles et Culex) ont été également observées dans certains gîtes larvaires. Le genre Anopheles, par exemple, a été observé dans 10 récipients de stockage d’eau dont 1, 6 et 3 respectivement en avril, juin et septembre 2023. En septembre, les larves de Anopheles ont aussi été récoltées dans un gîte larvaire dénommé « Autres types ». Quant à celles du genre Culex, elles ont été également observées au cours de toutes les périodes de collecte, dans les récipients abandonnés (n = 22) ; les récipients de stockage d’eau (n = 14) ; Pneus (n = 1) et dans les sanitaires (n = 1).
Moustiques adultes du genre Aedes issus de la prospection des gîtes larvaires
13Au total, 416 moustiques adultes issus de l’élevage des larves des gîtes larvaires ont été identifiés, dont 295 (71%) en avril, 63 (15%) en juin et 58 (14%) en septembre. Le plus grand nombre de moustiques a été obtenu en avril, alors que le plus petit nombre de moustiques adultes issus de la prospection a été obtenu en septembre. Au niveau spécifique, quatre espèces appartenant à deux genres (Aedes et Culex) ont été identifiées. Ce sont Aedes aegypti, Aedes fraseri (Edwards, 1912), Culex annulioris (Theobald, 1901) et Culex poicilipes (Theobald, 1903). Aedes aegypti, avec un effectif de 357 (86%) spécimens a été identifiée à chaque période de collecte de données. Le plus grand nombre de spécimens de cette espèce a été observé en avril, avec un total de 264 (89%). Le nombre de spécimens de cette espèce a considérablement baissé lors de la collecte de juin et de septembre, où 58 (15%) et 35 (14%) moustiques ont été respectivement obtenus.
Tableau 2 : Composition spécifique et abondance relative des moustiques adultes capturés par dispositif de la double moustiquaire
|
Espèces |
avril |
juin |
septembre |
|
Aedes aegypti |
15 |
84 |
38 |
|
Culex cinereus |
0 |
2 |
0 |
|
Culex culiciomya |
0 |
2 |
6 |
|
Culex decens |
0 |
0 |
0 |
|
Culex fraseri |
25 |
0 |
0 |
|
Culex nebulosus |
1 |
1 |
1 |
|
Culex quinquefasciatus |
7 |
5 |
7 |
|
Culex weschei |
1 |
0 |
0 |
|
Eretmapodites chrysogaster |
0 |
0 |
1 |
|
Eretmapodites quinquevitatus |
2 |
11 |
0 |
|
Mansonia africana |
0 |
6 |
5 |
|
Aedes sp |
0 |
2 |
0 |
|
Total |
51 |
113 |
58 |
Capture des moustiques adultes sous double-moustiquaire
14Au total, 222 moustiques, dont 51, 113 et 58 moustiques ont été respectivement capturés en avril, juin et septembre. Le plus grand nombre de moustiques a été observé en juin. Onze espèces appartenant à quatre genres (Aedes, Culex, Eretmapodites et Mansonia) ont été identifiées. Le genre Culex, avec quatre espèces identifiées en a le plus grand nombre. Au niveau d’Aedes, une seule espèce a été identifiée, Aedes aegypti. Elle a été, par ailleurs, l’espèce la plus abondante au cours de cette étude avec 137 spécimens identifiés, soit une proportion de 62%. Le test t a révélé une différence significative au niveau de l’abondance des espèces (p-value=0,00). Cette espèce a également été retrouvée au cours de toutes les périodes de collecte avec des effectifs respectifs de 15, 84 et 38 individus. Culex quinquefasciatus (Say, 1823) a elle aussi été rencontrée tous les mois mais avec de faibles effectifs par rapport à Aedes aegypti. Culex fraseri a été identifiée en avril où elle a eu le plus grand nombre de spécimens (n = 25). Par contre, en juin et septembre, aucun spécimen n’a été obtenu.
Rythme d’activité de Aedes aegypti
15En ce qui concerne le rythme d’activité des moustiques dans le village d’Adaou, ceux à la recherche d’un repas de sang ont été très actifs en juin entre 16h et 17h où 39 moustiques ont été capturés. En revanche, aux mois d’avril et de septembre, le plus grand nombre de moustiques à la recherche de repas de sang a été observé entre 17h et 18h où respectivement 22 et 23 moustiques ont été capturés (Fig.3).
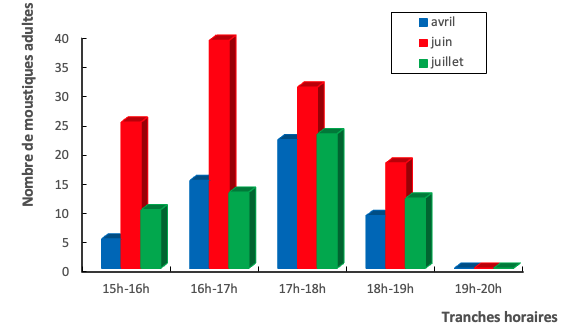
Figure 3 : Rythme d’activité de Aedes aegypti au cours du temps dans le village d’Adaou
DISCUSSION
16Cette étude a permis de dénombrer 480 gîtes larvaires en eau dans le village d’Adaou. Selon Makanga (2016), les moustiques évoluent généralement dans des systèmes écologiques naturels et anthropisés. Tous les gîtes inventoriés ont été pour la plupart des gîtes larvaires de ce type. Aucun gîte naturel n’a été trouvé dans le village d’Adaou. Ils ont tous été créés par la population ; pour la plupart par ignorance mais aussi par négligence (Kutomy et al., 2022). En effet, la majorité de la population d’Adaou ignore que la présence de l’eau non protégée autour d’eux est la cause de la pullulation des moustiques dans leurs habitations. La dégradation de l’environnement, suite aux activités anthropiques, fournit des habitats favorables au développement des moustiques vecteurs de maladies (Silva et al., 2020). Quant à N’dri et al., (2022), ils ont conclu que les gîtes larvaires obtenus au cours de leur étude étaient des gîtes larvaires artificiels. De plus, les moustiques se développent dans tous les types de gîtes et préféreraient les surfaces d’eau artificielles (N’dri et al., 2022). Cette présence massive de gîtes larvaires pourrait être favorable à la pullulation des moustiques et particulièrement ceux du genre Aedes qui les aiment artificiels, se trouvant à proximité des hommes (OMS, 2011 ; Koumba et al., 2018). Ainsi, l’abondance et la distribution des moustiques sont étroitement liés aux gîtes larvaires qui sont propices à leur reproduction.
17Selon Iro et al., (2020), les populations sont responsables de la mise en place des conditions propices au développement et au maintien des moustiques. La présence, en effet, de gîtes larvaires préférentiels de moustiques vecteurs d’arbovirus augmente considérablement les probabilités de contact vecteurs-homme et, par conséquent, le risque de transmission et de propagation des arbovirus (Hery et al., 2021).
18Près de la moitié des gîtes larvaires trouvés mensuellement contiennent des larves de moustiques et c’est en avril que le plus grand nombre positif a été rencontré. Cependant, Aedes aegypti a été la seule espèce présente dans les gîtes. La présence de nombreux gîtes larvaires, et particulièrement les gîtes larvaires positifs, va entrainer une pullulation de moustiques dans les ménages. Koumba et al., (2018) ont également estimé que la pullulation de ces insectes serait liée à l’insalubrité de l’environnement immédiat et aux activités anthropiques qui créent et assurent le maintien des sites de reproduction des moustiques. Leur présence pourrait ainsi occasionner la nuisance culicidienne au sein de la population du village d’Adaou et accroitre ainsi les contacts vecteur-homme et le risque de transmission des arbovirus.
19Les gîtes larvaires présents dans les ménages du village d’Adaou sont aussi nombreux que diversifiés. Les récipients abandonnés qui constituent les déchets de civilisation (Kutomy et al., 2022) sont les plus colonisés par Aedes aegypti. Les récipients de stockage d’eau, quant à eux, sont également nombreux et présents dans chaque ménage.
20La mauvaise gestion de ceux-ci peut créer des conditions favorables pour le développement des moustiques et plus particulièrement Aedes aegypti qui aime ces gîtes présents dans l’environnement immédiat de l’homme (Kutomy et al., 2022). Dans le village d’Adaou, les gîtes larvaires rencontrés sont essentiellement constitués de récipients de stockage d’eau, abandonnés ou non, de pneus usagés, de pots de fleurs. Ils sont présents partout, dans tous les ménages du village d’Adaou tout comme dans les villes, à l’instar d’Abidjan (Fofana et al., 2022) et autres de la Côte d’Ivoire. Dans une étude similaire menée dans le périmètre universitaire de Korhogo, les mêmes résultats ont été obtenus (Coulibaly et al., 2023). Cette présence de récipients de stockage d’eau pourrait expliquer le maintien des populations de moustiques toute l’année et aider à comprendre les épidémies répétées d’arboviroses en Côte d’Ivoire. En effet, la présence continuelle de moustiques pourrait favoriser la circulation et la transmission des arbovirus aux hommes (Hery et al., 2021).
21Les larves d’Aedes ont été retrouvées dans diverses catégories de gîtes larvaires artificiels tels que les récipients de stockage d’eau qui, au prorata de leurs dimensions, en contiennent de grandes quantités. Cela démontre de la forte adaptation de ce moustique à une large diversité de gîtes larvaires (Kahamba et al., 2020) même si cela est contraire aux résultats trouvés par Saleh et al., (2018) qui ont montré que les larves d’Aedes ont été observées en grande partie dans les gîtes larvaires artificiels de petites tailles. Quant à Estallo et al., (2008), pour Aedes aegypti, tous les types de récipients artificiels et naturels de petites tailles et susceptibles d’être mis en eau constituent des gîtes potentiels.
22Les types de gîtes larvaires qui ont produit le plus grand nombre de larves de moustiques au cours de cette étude ont été les récipients abandonnés avec, en moyenne, 23 larves. Les gîtes larvaires productifs d’Aedes aegypti varient d’une région à une autre. Par exemple, les pneus usagés sont cités comme les plus productifs en Afrique (Abilio et al., 2018). Bien que ceux-ci aient été considérés comme étant les gîtes préférentiels d’Aedes aegypti, ils ne le sont pas à Adaou. Ce sont, par contre, les récipients abandonnés qui ont eu les plus grands nombres de larves dans ce village. Nos résultats sont en concordance avec ceux de Islam et al., (2019) qui ont affirmé que la productivité augmente avec la taille du conteneur et le volume d’eau. Cela montre une grande diversité des gîtes larvaires utilisés par Aedes aegypti pour pondre. En effet, selon certains auteurs, le choix des gîtes dépend des facteurs visuels, olfactifs et tactiles (Matthews et al., 2019). Les récipients abandonnés à Adaou ont donc fourni les meilleures conditions pour la survie les larves d’Aedes aegypti comme l’ont affirmé Hery et al. (2021).
Composition spécifique et dynamique des populations adultes
23Le remplacement de l’homme utilisé comme appât, qui produit le CO2 par la respiration et autres liquides corporels et collecteur des moustiques, par une source artificielle de production de gaz carbonique (CO2) sous la double moustiquaire a permis de collecter 11 espèces de moustiques. Parmi elles, Aedes aegypti a été la plus abondante au cours du temps. Ces abondance et présence pourraient constituer un facteur de risque d’exposition et de transmission des virus aux populations (Adjobi et al., 2024). Les résultats montrent aussi que la faune culicidienne à Adaou est riche, diversifiée et qu’elle est attirée par une source artificielle produisant le CO2. Cette étude prouve, en effet, que c’est le CO2 qui attire les moustiques à la recherche d’un repas de sang. Cela peut réduire la charge de travail des collecteurs. L’abondance des moustiques adultes pourrait être liée à la présence de nombreux gîtes larvaires potentiels qui fournissent les caractéristiques écologiques optimales aux moustiques pour leur développement. Cette étude a également révélé la présence d’autres espèces d’importance médicale, comme Cx quinquefasciatus, qui sont déjà actives au crépuscule. En revanche, le genre Anopheles, bien que décrit dans certains gîtes larvaires dans le village d’Adaou, n’a pas été obtenu lors de la capture sous double moustiquaire. De même, aucun spécimen adulte de ce genre n’a été obtenu suite aux élevages en laboratoire des larves récoltées dans les gîtes larvaires. Les densités d’Ae aegypti sont restées élevées au cours de cette étude. Cela pourrait être dû à la présence dans le village d’un nombre important et varié de gîtes larvaires très productifs présentant des caractéristiques favorables au développement des stades pré imaginaux d’Ae aegypti. En effet, les très nombreux récipients abandonnés qui étaient dans l’environnement immédiat de l’homme, ont contribué à la pullulation des moustiques. Quant aux cycles horaires d’agressivité dans le village d’Adaou, une activité maximale d’Aedes aegypti a été observée entre 16 heures et 18 heures. Cette espèce a constitué la principale source de nuisance culicidienne à Adaou pendant la journée et est relayée par les autres espèces crépusculaires dont Culex quinquefasciatus.
24Les densités des moustiques et les gîtes larvaires étaient par ailleurs très élevées au mois d’avril, date de début de l’étude. Il s’agissait donc du premier contact des populations avec les gîtes larvaires des moustiques dans leur environnement immédiat. Cette présence a permis à la population de prendre réellement conscience de la gestion efficiente de leur cadre de vie, visant à éliminer les sites de ponte des moustiques qui sont présents dans la plupart des ménages. Cette communication a eu pour incidence de réduire le nombre de gîtes larvaires les deux mois suivants. La sensibilisation sur le rôle des collections d’eau dans les récipients présents dans leur environnement et la pullulation des moustiques devrait être renforcée dans le village d’Adaou pour briser le cycle de transmission des arbovirus et autres pathogènes.
CONCLUSION
25Cette étude dans le village d’Adaou a révélé la présence de nombreux gîtes larvaires artificiels à l’intérieur et à l’extérieur des habitations. Ceux-ci sont essentiellement constitués de récipients de stockage et abandonnés mais aussi de réserves d’eau. Néanmoins, les récipients abandonnés ont été les plus colonisés par les larves du genre Aedes, vecteurs des arbovirus. Celles des moustiques du genre Aedes, Anopheles et Culex ont été récoltées dans les divers gîtes larvaires créés par l’activité des populations dans leur environnement. La mauvaise gestion des points d’eau peut être propice au développement et à la pullulation des moustiques en maintenant transmission et propagation des maladies telles que la dengue qui a été notifiée dans le département d’Aboisso. Le risque d’arbovirus est réel à Adaou. Ainsi, des actions comme la sensibilisation des populations et l’assainissement de l’environnement par les habitants devraient être entreprises par les autorités pour éviter d’éventuelles épidémies d’arboviroses dans cette localité où les déplacements des populations de part et d’autre de la frontière entre les deux pays (Côte d’Ivoire et Ghana) sont élevés.
26Contribution des auteurs et conflit d’intérêt :
27KKL et FD ont conceptualisé l’étude. KKL, KS, DA, OK et BJMV ont collecté les données sur le terrain et procédé à leur analyse. KKL a écrit et produit le premier draft. KAB, FD et EKD ont participé à la correction du manuscrit en apportant leurs observations. Tous les auteurs ont contribué à la version finale du manuscrit. Ils déclarent qu’il n’existe aucun conflit d’intérêts lié à la présente étude.
Bibliographie
Abílio A.P., Abudasse G., Kampango A., Candrinho B., Sitoi S., Luciano J., Tembisse D., Sibindy S., de Almeida A.P.G., Garcia G.A., David M.R., Maciel-de-Freitas R., Gudo E.S., 2018. Distribution and breeding sites of Aedes aegypti and Aedes albopictus in 32 urban/peri-urban districts of Mozambique: implication for assessing the risk of arbovirus outbreaks. PLoS Negl. Trop. Dis., 12 (9), e0006692, doi.org/10.1371/journal.pntd.0006692
Adjobi C.N., Zahouli J.Z.B., Guindo-Coulibaly N., Ouattara A.F., Vavassori L., Adja M.A., 2024. Assessing the ecological patterns of Aedes aegypti in areas with high arboviral risks in the large city of Abidjan, Côte d’Ivoire. PLoS Negl Trop Dis 18(11): e0012647. https://doi.org/10.1371/journal. pntd.0012647
Ano A.K.M.N., Coulibaly D., Bénié V.J., Akani B.C., Douba A., Ahoussou E.M.et Dagnan N.S. 2022. Situation épidémiologique de la dengue en Côte d'Ivoire de 2017 à 2020. Revue d'Epidémiologie et de Santé Publique ; 7 (3). Doi : 10.1016/j.respe.2022.06.048
Beltrán-Silva S.L., Chacón-Hernández S.S., Moreno-Palacios E., Pereyra-Molina J.A. 2018. Clinical and differential diagnosis: Dengue, chikungunya and Zika. Revista Médica del Hospital General de Mexico; 81: 146–153
Berchi, S., Aouati, A., Louadi, K. 2012. Typologie des gîtes propices au développement larvaire de Culex pipiens L. 1758 (Diptera-Culicidae), source de nuisance à Constantine (Algérie). Ecologia Mediterranea, 38 (2), 1–16
Cordellier R., Bouchite B., Roche J.C., Monteny N., Diaco B., Akoliba P. 1983. Circulation selvatique du virus Dengue 2 en 1980, dans les savanes sub-soudaniennes de Côte d'Ivoire : données entomologiques et considérations épidémiologiques. Cahiers ORSTOM. Série Entomologie Médicale et Parasitologie, 21 (3), p. 165-179.
Coulibaly D, Yapo M.L, Koné M, Akpess E.G, Ozoukou E.P.V, Tuo Y, 2023. Caractérisation des gîtes larvaires de moustiques en saison des pluies à l’intérieur et autour du périmètre universitaire de Korhogo (Côte d’Ivoire), Entomologie Faunistique-Faunistic Entomology, 111-125. https://popups.uliege.be/2030-6318/index.php?id=6177.
Estallo E.L., Lamfri M.A., Scavuzzo C.M., Almeida F.F., Introini M.V., Zaidenberg M.., Almiron W.R. 2008. Models for predicting Aedes aegypti larval indices based on satellite images and climatic variables. Journal of the American Mosquito Control Association, 24 (3), 368-376.
Failloux A.B. 2018. Les moustiques vecteurs d’arbovirus : une histoire sans fin. Biologie Aujourd’hui, 212, 89-99
Flu Trackers.com, 2023. Côte d’Ivoire-Dengue outbreak 2023. In: FluTrackers News and Information [Internet]. 14 Jul 2023 [cited 30 Nov 2023]. Available: https://flutrackers.com/forum/forum/emerging-diseases-other-health-threats-alphabetical-a-thru-h/dengue/976705-Côte-d’Ivoire-dengue-outbreak-2023
Fofana D., Konan K.L., Koné A.B., Coulibaly D., Beugré J.M.V., Akaffou M.H., Diallo A., Bénié B.V.J., Dosso M. and N’goran K.E. 2022. Household water storage containers: Aedes aegypti larval breeding site and high risk of transmission of arboviruses in Abidjan, Côte d'Ivoire. Int. J. Biol. Chem. Sci. 16 (4): 1733-1744. DOI: https://dx.doi.org/10.4314/ijbcs.v16i4.29
Hery L., Boullis A., Vega-Rúa A. 2021. Les propriétés biotiques et abiotiques des gîtes larvaires d’Aedes aegypti et leur influence sur les traits de vie des adultes (synthèse bibliographique). Biotechnol. Agron. Soc. Environ. 25 (1) ; 57-71
Iro S.M., Yaro S.A., Doumma A. 2020. Mesures des indicateurs de prolifération des larves de moustiques au niveau des mares permanentes et semi permanentes de Saga, Niger. Int. J. Biol. Chem. Sci. 14 (4) : 1188-1202 ; DOI : https://doi.org/10.4314/ijbcs.v14i4.3
Islam S., Haque C.E., Hossain S. & Rochon K. 2019. Role of container type, behavioural, and ecological factors in Aedes pupal production in Dhaka, Bangladesh: an application of zero-inflated negative binomial model. Acta Tropica, 193, 50-59, doi.org/10.1016/j.actatropica.2019.02.019
Kahamba N.F., Limwagu A.J., Mapua S.A., Msugupakulya B.J., Msaky D.S., Kaindoa E.W., Ngowo H.S., Okumu F.O. 2020. Habitat characteristics and insecticide susceptibility of Aedes aegypti in the Ifakara area, south-eastern Tanzania. Parasit Vectors; 13 (1) ; 53. doi: 10.1186/s13071-020-3920-y. PMID: 32033619; PMCID: PMC7006121
Koumba A.A., Koumba C.R.Z., Nguema R.M., Djogbenou L.S., Ondo P.O., Ketoh G.K., Comlan P., M’batchi B., Mavoungou J.F. 2018. Distribution spatiale et saisonnière des gîtes larvaires des moustiques dans les espaces agricoles de la zone de Mouila, Gabon. Int. J. Biol. Chem. Sci ; 2 (4): 1754-1769. DOI: https://dx.doi.org/10.4314/ijbcs.v12i4.19
Kutomy O.O.P., Zinga-Koumba C.R., Koumba A., Lendzele S., Mavoungou F.J., Faye O. 2022. Typologie Des Gites Larvaires Et Sensibilite d’Anopheles gambiae S.L. Aux Insecticides En Zone Urbaine, Peri-Urbaine Et Rurale A Oyem (Nord Du Gabon) European Scientific Journal, ESJ, 18 (17) ; 22. https://doi.org/10.19044/esj.2022.v18n17p22
Makanga B.K. 2016. Ecologie de la transmission des Plasmodium simiens au Gabon. Thèse de 3ème cycle, Ecole Doctorale Régionale de Franceville, Franceville, p. 191.
Matthews B.J., Younger M.A., Vosshall L.B. 2019. The ion channel ppk301 controls freshwater egg-laying in the mosquito Aedes aegypti. Elife, 8, e43963, doi.org/10.7554/eLife.43963.00
N’dri F.K., Kouamé A.K.D., N’guessan N.A., Beugré J.M.V., Fofana D., Djagoua E.V., Hauhouot A.C. 2022. Identification des gîtes larvaires d’Anopheles et cartographie du risque d’accès palustre dans un contexte de lutte anti-vectorielle dans le district sanitaire de Cocody-Bingerville (Sud de la Côte d’Ivoire). International Journal of Engineering Science Invention; 11 (10) ; PP 01-08. DOI: 10.35629/6734-11100108
OMS. 2011. Operational guide for assessing the productivity of Aedes aegypti breeding sites, www.who.int/tdr/publications/documents/sop-pupal-surveys.pdf?ua=1
OMS. 2014. Évaluation entomologique rapide sur le terrain pendant les épidémies de fièvre jaune en Afrique. Manuel ; Orientations méthodologiques à l’usage des scientifiques ayant des connaissances de base en entomologie ; 50 p.
OMS. 2016. Note de synthèse de l’OMS sur le vaccin contre la dengue– juillet 2016. Relevé épidémiologique hebdomadaire ; 91 (30) : pp. 349–364.
OMS. 2023. Bulletin d’information sur les flambées épidémiques, dengue — situation mondiale. Disponible à l’adresse : https://www.who.int/fr/emergencies/disease-outbreak-news/item/2023 : (20/03/2024).
Organisation panaméricaine de la Santé (OPS). 2019. Manuel de gestion intégrée des vecteurs dans les Amériques. Washington, D.C. 68 pages ; Disponible à l’adresse http://iris.paho.org
Saleh F., Kitau J., Konradsen F., Alifrangis M., Lin C-H., Juma S., Mchenga S.S., Saadaty T., Schioler K.L. 2018. Habitat characteristics for immature stages of Aedes aegypti in Zanzibar city, Tanzania. J. Am. Mosq. Control Assoc., 34 (3), 190-200, doi.org/10.2987/17-6709.1
Sánchez-Carbonel J., Derek T.Y., Miguel A.A.L., Wilmer S.C., Pablo Weilg, F.V.A., Luis Costa J. M.L., Isabel S., Valle-Mendoza J. 2018. « Identification of Infection by Chikungunya, Zika, and Dengue in an Area of the Peruvian Coast. Molecular Diagnosis and Clinical Characteristics ». BMC Research Notes 11 (1): 175. https://doi.org/10.1186/s13104-018-3290-0
Silva A.P., Plácido E.J.M.d.S., Moraes W.B.D.S. 2020. Les impacts du moustique transgénique sur l’homme et l’environnement. Revista Científica Multidisciplinar Núcleo do Conhecimento. An 05, Ed. 10 (09); p. 158-176
Simard F., Farraudière L., Yébakima A. 2016. Alerte aux moustiques ? IRD Editions ; 84 pages
Tinto B., Kania D., Kagone T. S., Dicko D., Traore I., De Rekeneire N., Bicaba B W., Hien H., Van de Perre P., Simonin Y., Salinas S. 2022. Circulation du virus de la dengue en Afrique de l’Ouest ; Une problématique émergente de santé publique ; Médecine Science (Paris); 38 : 152–158 ; DOI ttps://doi.org/10.1051/medsci/2022007
(30 Réf.)