Modes d’adaptation de quatre espèces de Labeo (Pisces, Cyprinidae) pour occuper différentes niches écologiques au Pool Malebo du Fleuve Congo en République Démocratique du Congo
Reçu le 19.03. 18 et accepté pour publication le 08.05.19
Résumé
Dans le but de comprendre les relations éventuelles entre l’anatomie, la morphologie et les facteurs de l’environnement dans les niches écologiques de quatre espèces du genre Labeo au Pool Malebo du Fleuve Congo, 15 paramètres morphologiques mesurés sur 15 spécimens adultes de Labeo : L. lineatus, L. weeksii, L. nasus et L. sorex ont été étudiés et comparés à 13 variables abiotiques évaluées dans 6 sites de pêche de ces poissons. Deux groupes de sites ont été identifiés et explorés : 4 sites lentiques (Japon, Mipongo, Molondo et Tandalitoko) et 2 sites lotiques : Kinsuka et Ngamanzo. La vitesse du courant d’eau, la profondeur et le substrat du fond sont à la base des adaptations de ces poissons. La réduction du diamètre de l’oeil et de la vessie gazeuse, de larges nageoires paires en position ventrale et de petites branchies permettent à L. sorex et L. nasus de s’adapter aux milieux lotiques. Par contre, de gros yeux, une longue vessie gazeuse segmentée en deux parties, des nageoires paires latérales et de larges branchies permettent à L. lineatus et L. weeksii de s’adapter aux milieux lentiques.
Abstract
Adaptation Modes of four Species of Labeo (Pisces, Cyprinidae) to Occupy Different Ecological Niches in the Pool Malebo of the Congo River in the Democratic Republic of the Congo
The aim of this study was to understand the possible relations between anatomy, morphology and environmental factors of the ecological niches of different Labeo species in the “Pool Malebo” of the Congo River in the Democratic Republic of the Congo. Fifteen morphological parameters were measured on 15 adult specimens of 4 species of Labeo: L lineatus, L weeksii, L nasus and L sorex and compared to 13 environmental variables in 6 fishing sites of these fish. Two types of sites were identified and explored: 4 lentic sites (Japon, Mipongo, Molondo and Tandalitoko) and 2 lotic sites (Kinsuka and Ngamanzo). The speed of the stream, the depth and the bottom substratum are the main factors which induce fish adaptations. The reduction of the eye size and the gaseous bladder, the large pair flippers in ventral position and the small gills allow L. sorex and L. nasus to adapt to lotic areas. On the other hand, big eyes, a long gaseous bladder divided into two sections, lateral pair flippers and wide gills help L. lineatus and L. weeksii to fit in lentic areas.
Introduction
1Les organismes vivants sont généralement confrontés à plusieurs problèmes écologiques auxquels ils adaptent leurs morphologies. Ainsi, le phénotype observé reflète non seulement les facteurs génétiques liés à l’espèce mais aussi et surtout l’influence des variables de l’environnement (3, 20).
2L’approche écomorphologique visant à comprendre les causes de la séparation des niches écologiques des êtres vivants dans un écosystème donné est l’étude des relations entre la forme des organismes et les facteurs abiotiques de leur environnement (7, 14). Ainsi, la sélection naturelle a conduit les espèces occupant des niches écologiques proches à avoir des traits morphologiques similaires. Cela peut être compris comme une réponse à une pression sélective identique. De plus, la morphologie d’un poisson est liée à son écologie. Ce fait lui permet d’exploiter correctement les ressources de son habitat en fonction de ses capacités hydrodynamiques et de son accès aux ressources trophiques (1).
3Dans les milieux aquatiques, la répartition géographique et la sélection des habitats des espèces de poissons sont en relation étroite avec certains facteurs abiotiques. Il s’agit par exemple de l’oxygène dissous, de la profondeur de la colonne d’eau, de la vitesse du courant d’eau et du substrat de fond auxquels on peut ajouter les prédispositions ontogéniques comme déterminé chez Barbus sp. (2).
4Les études sur l’écomorphologie et l’occupation des habitats sont très avancées pour plusieurs espèces de poissons lacustres telles que celles des Cichlidae du lac Tanganyika (13). Toutefois, elles restent fragmentaires pour les poissons du fleuve Congo (12, 16).Dans le Pool Malebo, dix-sept espèces de poissons du genre Labeo (Cyprinidae) ont été décrites(21) parmi lesquelles, Labeo lineatus, L. nasus, L. sorex et L. weeksii ont été les plus abondantes dans les captures (18).Ces poissons ont des niches écologiques séparées les unes des autres. Les unes sont rhéophiles et sont pêchées dans les sites lotiques à substrat composé de pierres alors que les autres sont limnophiles et localisées dans les milieux lentiques à substrat vaseux, cependant les traits morphologiques des espèces appartenant à ces deux groupes et qui leur permettent d’exploiter correctement ces milieux n’ont pas été examinés.
5Dans ce travail, nous examinons les traits morphologiques de quatre espèces de poissons du genre Labeo en rapport avec les variables environnementales caractéristiques des habitats préférentiels qu’elles occupent afin de repérer les différentes guildes écomorphologiques auxquelles elles appartiennent.
Milieu d’étude
6Les poissons ont été pêchés dans six sites choisis dans le Pool Malebo sur la rive gauche du fleuve Congo. Il s’agit d’une part de Kinsuka et Ngamanzo (milieux lotiques) et d’autre part de Japon, Mipongo, Molondo et Tandalitoko (milieux lentiques) (Figure 1).
7Le Pool Malebo, anciennement appelé Stanley Pool, est la partie terminale du cours moyen du fleuve Congo. Il se situe à une altitude moyenne de 272 m et s’étend de 4°05’ à 4°20’ latitude Sud et 15°19’ à 15°32’ longitude Est. C’est l’élargissement du fleuve Congo situé aux frontières entre la République Démocratique du Congo (ville province de Kinshasa) et la République du Congo (préfecture de Brazzaville.
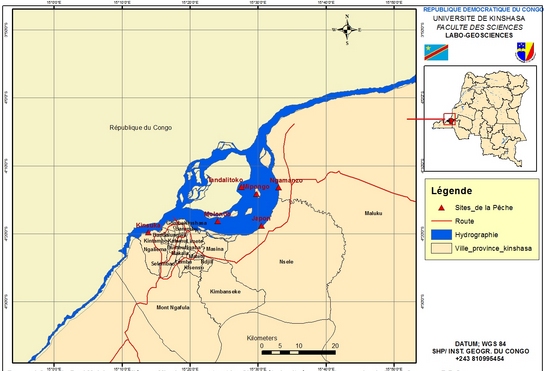 Figure 1 : Carte du Pool Malebo modifiée par Mbadu (12) montrant les sites d’étude situés sur la rive gauche du fleuve Congo en R.D. Congo.
Figure 1 : Carte du Pool Malebo modifiée par Mbadu (12) montrant les sites d’étude situés sur la rive gauche du fleuve Congo en R.D. Congo.
Matériel
8Nous avons étudié quatre espèces de poissons Cyprinidae du genre Labeo qui se sont avérées les plus abondantes et les plus fréquentes dans les captures au Pool Malebo pendant la période de l’étude. Les spécimens des deux premières espèces ont été pêchées dans les milieux lentiques : Labeo lineatus Boulenger, 1909 et L. weeksii Boulenger, 1909 et ceux des deux autres dans les eaux lotiques du Pool Malebo (L. nasus, Boulenger, 1899 et L. sorex, Nichols et Griscom, 1917) (Figures 2, 3, 4 et 5).

Figure 2. Vue latérale de Labeo nasus Boulenger, 1899.

Figure 3. Vue latérale de Labeo weeksii Boulenger.

Figure 4 : Vue latérale de Labeo sorex Nichols et Griscom, 1917 (Photo Pwema, 2013).

Figure 5 : Vue latérale de Labeo nasus Boulenger, 1899 (Photo Pwema, 2013).
Méthodes
Mesure des variables abiotiques
9En vue d’élaborer des relations fonctionnelles éventuelles entre la morphologie des espèces de Labeo et l’habitat occupé, 13 variables abiotiques ont été mesurées dans les endroits de pêche des espèces étudiées. Il s’agit de l’oxygène dissous, de la profondeur de la colonne d’eau, de la vitesse du courant d’eau, du substrat du fond, du pH, de la conductivité, de la température de l’eau, de la turbidité, de la transparence, des nitrates, des ions calcium, des ions magnésium et chlorures.
10L’oxygène dissous (mg/l) a été mesuré à l’aide d’un oxymètre de marque WTW, OXI 315 i / set. La profondeur de la colonne d’eau dans le site de pêche a été systématiquement mesurée soit à l’aide d’un bathymètre de type Kritech 702806, dans les zones de plus de deux mètres de profondeur, soit à l’aide d’une grosse latte graduée dans les zones de moins de deux mètres de profondeur. La vitesse du courant d’eau a été mesurée à l’aide d’un courantomètre portable de marque Flo-Mate Marsh-McBirneyInc, Model 2000 de type digital, avec lecture directe des valeurs de la vitesse du courant d’eau sur l’écran. Quatre types de substrats dominants ont été définis d’après l’échelle de Wentworth modifiée par Malvoi et Souchon (1989) (11) : Limon < 2 µ, sable <0,2 mm (sable/gravier fin), 12-96 mm (cailloux, gravier), 96-192 mm (pierre), >192 mm (blocs, roches). Les ions ont été mesurés au moyen du spectrophotomètre de marque Hach, DR 2400 de 2008 à 2013 en saison sèche et en saison des pluies.
Traits morphologico-anatomiques mesurés sur les spécimens de Labeo
11Pour comparer les espèces de Labeo limnophiles et rhéophiles du Pool Malebo, nous avons analysé les caractères suivants : le diamètre de l’oeil, la structure des os circum orbitaires, la structure de la vessie gazeuse, la structure des adducteurs des mâchoires, la structure des branchies, le type des lèvres, la structure et la position des nageoires paires et la forme plus ou moins comprimée latéralement du corps. Ces caractères ont été mesurés sur 15 spécimens adultes de chaque espèce de Labeo à l’aide d’un pied à coulisse. Le choix des variables était basé sur les études écomorphologiques antérieures où les auteurs ont pu mettre en évidence les relations entre ces variables et les paramètres abiotiques de l’habitat (10, 11, 15, 22).
Analyses statistiques
12L’Analyse Factorielle des Correspondances (AFC) a été utilisée pour déterminer le rapport entre les variables abiotiques des sites de pêche de différentes espèces de Labeo et les traits morphologiques mesurés sur les spécimens après une transformation logarithmique de type LOG (X+1).
13L’analyse de classification hiérarchique ou l’analyse de regroupement (cluster analysis) a été également utilisée pour regrouper les espèces ayant des traits morphologiques similaires (8). Le logiciel Past (Paleontological statistics, Version 2.16) a été utilisé à cet effet (6).
Résultats
Relations sites - variables environnementales.
14Les valeurs moyennes des paramètres abiotiques mesurés dans chaque site de pêche des spécimens de Labeo sont présentées dans le tableau 1. Les sites de Kinsuka et Ngamanzo se caractérisent par des eaux bien oxygénées, une profondeur située entre 7 et 8 m, un courant d’eau rapide et un substrat composé de rochers. Par contre les sites de Japon, Mipongo, Molondo et Tandalitoko sont caractérisés par une teneur en oxygène relativement faible, une profondeur variant autour de 1,5 m et un substrat de fond composé soit de sable, soit de vase soit encore de sable vaseux.
Tableau 1 : Valeurs moyennes des variables environnementales mesurées dans 6 sites étudiés au Pool Malebo.
|
Variables |
Sites d’échantillonnage |
|||||
|
Kinsuka |
Japon |
Molondo |
Ngamanzo |
Mipongo |
Tandalitoko |
|
|
Oxygène dissout (mg/l) |
7,19 |
6,2 |
6,2 |
7,2 |
6,3 |
6,3 |
|
Vitesse du courant d’eau (m/s) |
0,39 |
0,11 |
0,11 |
0,37 |
0,14 |
0,14 |
|
Type de substrat |
1 |
0,5 |
0,5 |
1 |
0,5 |
0,5 |
|
Transparence (cm) |
48,9 |
52,9 |
52,9 |
52,4 |
53,4 |
53,2 |
|
Turbidité (UNT) |
12,4 |
12,7 |
12,8 |
12,4 |
12,7 |
12,7 |
|
Profondeur (m) |
6,9 |
1,2 |
1,6 |
6,98 |
1,4 |
1,5 |
|
pH |
6,3 |
6,03 |
6,2 |
6,3 |
6,1 |
6,2 |
|
Conductivité, K25 (µS/cm) |
30,4 |
29,3 |
28,9 |
52,4 |
29,9 |
35,8 |
|
Température (°C) |
28,1 |
28,2 |
28,2 |
28,1 |
28,3 |
28,3 |
|
Ca++ (mg/l) |
0,95 |
0,61 |
0,6 |
0,53 |
0,57 |
0,56 |
|
Mg+ (mg/l) |
1,58 |
1,5 |
1,2 |
1,35 |
1,35 |
1,26 |
|
Cl – (mg/l) |
1,16 |
1,19 |
1,2 |
1,02 |
1,23 |
1,23 |
|
N03 – (mg/l) |
0,05 |
0,01 |
0,08 |
0,04 |
0,02 |
0,02 |
15L’Analyse Factorielle des Correspondances (Figure 6) effectuée sur les données des paramètres abiotiques mesurées dans les sites de pêche explique 99,35% de variabilités (P-value = 3,98). L’axe 1 est très significatif (P-value = 0,02364) et exprime 76,76% de l’information. Cet axe est corrélé positivement avec le substrat, la profondeur de la colonne d’eau, l’oxygène dissous et la vitesse d’écoulement de l’eau, ce qui caractérise les sites de Ngamanzo et Kinsuka. L’axe 2 (P-value = 0,00529), exprime 22,4% de l’information. Il est corrélé négativement avec le substrat, la profondeur de la colonne d’eau, l’oxygène dissous et la vitesse d’écoulement de l’eau, ce qui caractérise les sites de Japon, Mipongo, Molondo et Tandalitoko.
16Cette analyse permet de distinguer deux groupes de sites d’étude :
-
Groupe 1 : Ngamanzo et Kinsuka qui sont caractérisés par une vitesse d’écoulement d’eau et un taux d’oxygène dissous relativement élevée, une profondeur élevée et un substrat composé de pierres.
-
Groupe 2 : Japon, Mipongo, Molondo et Tandalitoko qui sont par contre caractérisés par le substrat sableux ou sablo- vaseux, une faible vitesse d’écoulement de l’eau et une faible profondeur de la colonne d’eau.
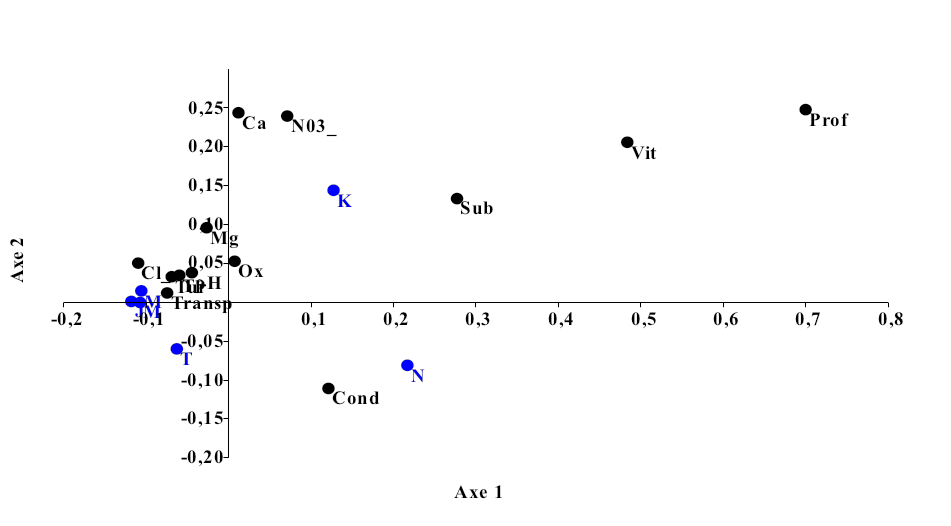
Figure 6 : Ordination des sites de pêche par rapport aux variables environnementales J : Japon, M : Mipongo, Mol : Molondo ; K : Kinsuka ; N : Ngamanzo ; T : Tandalitoko).
Influence des variables environnementales sur la distribution des espèces de Labeo étudiées
17L’analyse des correspondances réalisée sur les données d’abondance des poissons du genre Labeo pêchés dans six sites (Tableau 2) montre que ces poissons sont bien répartis dans le Pool Malebo (Figure 7). Elle explique 93,3% % de la variabilité observée dont 83,867% expliquées par l’axe 1 et 10,454% par l’axe 2, les valeurs propres étant de 0,5762 et 0,0726 respectivement.Ceci se traduit par la distinction de deux groupes d’espèces dans les sites de pêche. Le premier groupe est composé de Labeo lineatus et de Labeo weeksii qui sont pêchés dans les sites de Japon, Mipongo, Molondo et Tandalitoko. Le deuxième groupe comprend Labeo nasus et Labeo sorex qui sont corrélés avec l’axe 1 et qui sont pêchés à Kinsuka et à Ngamanzo.
Tableau 2 : Abondance numérique des espèces de Labeo pêchées au Pool Malebo (2008-2011).
|
Espèces |
|
|
Sites de pêche |
|
|
|
|
|
Kinsuka |
Japon |
Mipongo |
Ngamanzo |
Molondo |
Tandalitoko |
|
Laleolineatus |
65 |
126 |
370 |
29 |
407 |
449 |
|
Labeosorex |
368 |
0 |
0 |
505 |
1 |
0 |
|
Labeoweeksii |
147 |
86 |
243 |
24 |
335 |
115 |
|
Labeonasus |
76 |
0 |
0 |
0 |
0 |
0 |
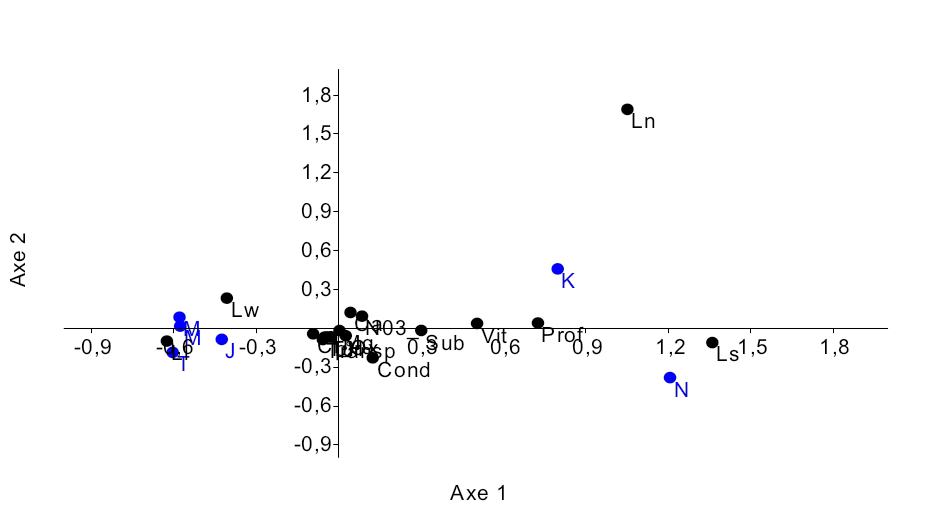
Figure 7 : Diagramme de l’ordination (CCA) de 5 espèces du genre Labeo par rapport aux sites d’échantillonnage.
Caractéristiques morphologico-anatomiques
Structure de la vessie natatoire (gazeuse)
18La forme et la dimension de la vessie gazeuse varient d’une espèce à une autre chez les espèces du genre Labeo étudiées au Pool Malebo. Nous avons identifié deux types morphologiques de vessies gazeuses : Le premier type est une vessie réduite à une chambre installée près de la région thoracique. Elle est arrondie avec un diamètre d’1cm. Ce type se rencontre chez Labeo sorex (Figure 8) et Labeo nasus (Figure 9). La vessie gazeuse représente 0,4% de la longueur standard de L. sorex et L. nasus.
19Le deuxième type de vessie est rencontré chez Labeo lineatus (Figure 10) et Labeo weeksii (Figure 11). Cette vessie est allongée, cylindrique, composée de deux chambres distinctes et d’une longueur totale de 12 cm. La chambre antérieure est courte et située dans la région thoracique. La chambre postérieure est longue et se prolonge jusqu’à l’anus. Pour L. lineatus et L. weeksii, la première chambre représente le 0,3 dixième de la longueur standard du poisson et la deuxième partie représente 2/10 de la longueur standard. La première portion de la vessie gazeuse est située dans le rapport 1 : 4 de la deuxième partie. Cette forme est généralement rencontrée chez la plupart des poissons. La vessie gazeuse de L. lineatus et de L. weeksii leur offre l’opportunité de se maintenir en équilibre dans la colonne d’eau.
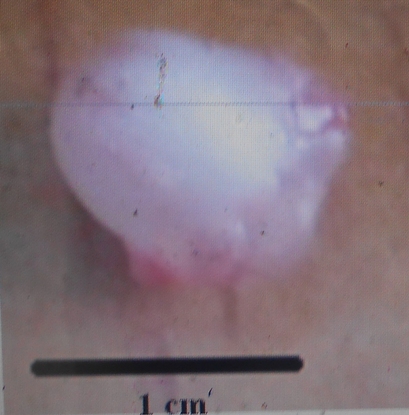
Figure 8. Vue de la vessie natatoire de L. sorex de 41 cm de longueur totale (Photo Pwema, 2013).
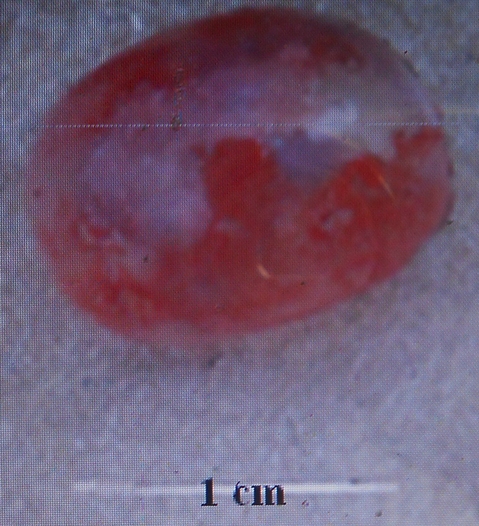
Figure 9. Vue de la vessie natatoire de L. nasus de 41 cm de longueur totale (Photo Pwema, 2013).

Figure 10. Vue de la vessie natatoire de L. lineatus de 10 cm de longueur totale (Photo Pwema, 2013).
Types de lèvres
20Les poissons étudiés présentent deux types morphologiques de lèvres. Les lèvres papilleuses rencontrées chez L. lineatus (Vue macroscopique Figure 12 et vue microscopique Figure 13) et les lèvres plissées observées chez L. nasus et L. sorex (vue macroscopique Figure 14 et vue microscopique Figure 15).

Figure 11 : Vue de la vessie natatoire de L. weeksii de 10 cm de longueur totale (photo Pwema, 2013).
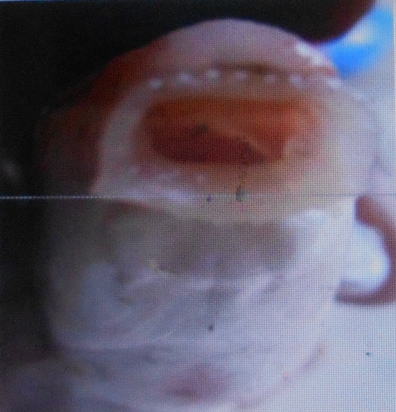
Figure 12. Vue macroscopique supéro-antérieure des lèvres papilleuses de L. weeksii (Photo Pwema, 2013).

Figure 13. Vue supéro-antérieure en microscopie électronique des tissus des lèvres de Labeo sorex (lèvres plissées) (Photo Pwema, 2013).

Figure 14. Vue macrocopique supéro-antérieure des lèvres plissées de Labeo sorex (Photo Pwema, 2013)

Figure 15. Vue supéro-antérieure en microscopie électronique des tissus des lèvres de Labeo sorex (lèvres plissées) (Photo Pwema, 2013).
Corrélations morphologiques entre les espèces étudiées
21Treize caractères anatomo-morphologiques ont été considérés pour l’analyse des corrélations entre les espèces du genre Labeo étudiées. L’Analyse en composante principale (Figure 16) réalisée sur les données morphologiques des poissons montre une corrélation positive entre les traits morphologiques et les espèces concernées. La figure 16 explique 92,39% de la variabilité observée dont 72,22 % expliqués par l’axe 1 et 20,17 % par l’axe 2, les valeurs propres étant de 2,888 et 0,806 respectivement.
22Positivement à l’axe 2 est positionné le groupe composé de Labeo nasus et Labeo sorex. Ces espèces sont corrélées avec la longueur des branchies, la distance interoculaire, la longueur du bord ventral des lacrymales et la couverture des mâchoires. Chez Labeo sorex, plusieurs adaptations innovantes ont été décelées. Il s’agit de l’alourdissement de la tête dû aux os et à la fusion des adducteurs A1 et A2 en une masse unique, de la réduction de la vessie gazeuse en une petite sphère placée dans la cavité thoracique, du faible diamètre de l’oeil, de la position ventrale des nageoires paires lui permettant de s’agripper contre les pierres et de résister ainsi contre le courant d’eau, des lèvres plissées lui permettant de racler les algues poussant sur les substrats durs.
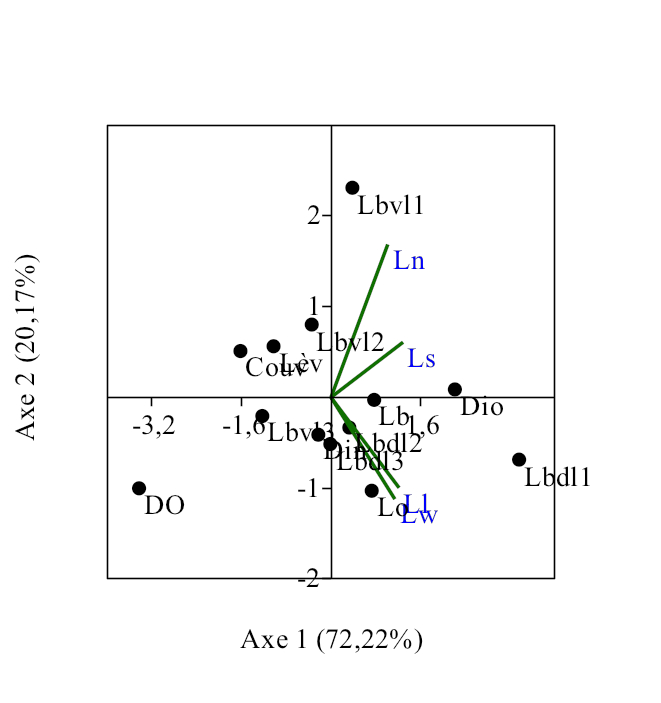
Figure 16. Corrélations entre les paramètres morphométriques et les spécimens du genre Labeo étudiés.
Ll : Labeo lineatus ; Ln : Labeo nasus ; Ls : Labeo sorex ; Lw :Labeo weeksii ; DO: Diamètre de l’oeil ; Lo : nombre des lobes de la vessie gazeuse ; Couv : Couverture des adducteurs ; Din : Distance interoculaire ; Lb :longueur de branchie; Lbvl1 : Longueur du bord ventral du lacrimal 1 ; Lbvl2 : Longueur du bord ventral du lacrimal 2 Lbvl3 : Longueur du bord ventral du lacrimal 3 ; Lbdl1 : Longueur du bord dorsal du Lacrimal 1: ; Lbdl2 : Longueur du bord dorsal du Lacrimal 2; Lbdl 3 : Longueur du bord dorsal du Lacrimal 3 ; Lèv : Type de lèvre.
23Labeo nasus, nous avons observé les caractères semblables suivants :
-
fusion des adducteurs des mâchoires A1 et A2
-
réduction de la vessie gazeuse à une petite sphère placée dans la région thoracique,
-
petit diamètre de l’oeil,
-
position ventrale des nageoires paires,
-
forme comprimée dorso-ventrale du corps,
-
lèvres plissées.
24Chez Labeo lineatus et L. weeksii, les adducteurs ne sont pas fusionnés, la vessie gazeuse est longue et divisée en deux parties, la première partie est plus réduite que la deuxième, l’oeil est grand, les nageoires paires (pectorales et ventrales) sont en position latéro-ventrale et les lèvres sont papilleuses.
25Le dendrogramme de similarité (Figure 17), issu de la classification hiérarchique ascendante montre qu’il existe deux grands groupes écomorphologique (r = 72) chez les espèces du genre Labeo étudiées au Pool Malebo :
-
Le premier groupe est composé des espèces de L. lineatus et de L. weeksii.
-
Le deuxième groupe comprend les espèces de L. sorex, et L. nasus.
26Les paramètres abiotiques mesurés dans les sites de pêche, les caractéristiques anatomiques et morphologiques prélevés sur chaque espèce ont permis de proposer un diagramme prédictif de l’habitat occupé par les quatre espèces de poissons Cyprinidae du genre Labeo au Pool Malebo (Figure 18).
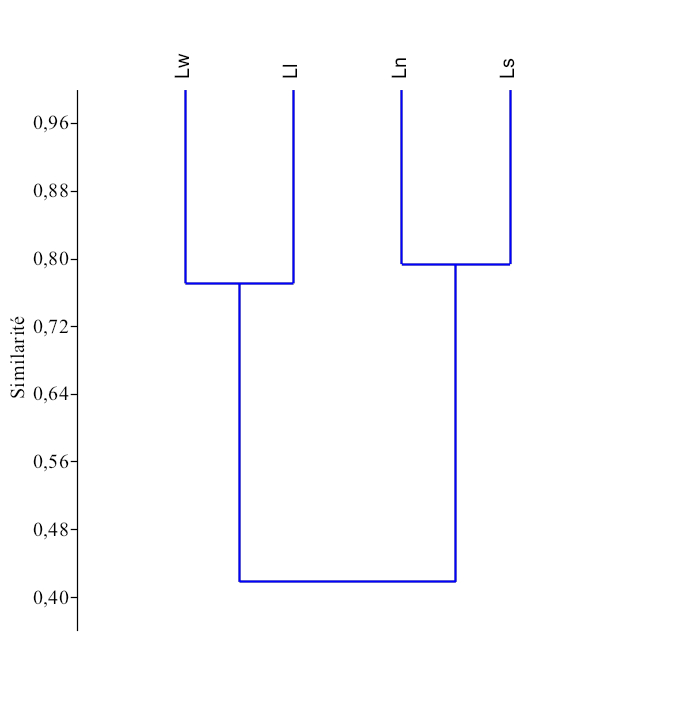
Figure 17. Dendrogramme de similarité basé sur l’analyse écomorphologique entre les espèces du genre Labeo au Pool Malebo.
(Ll : Labeo lineatus, Ln : Labeo nasus, Ls : Labeo sorex, Lw : Labeo weeksii).
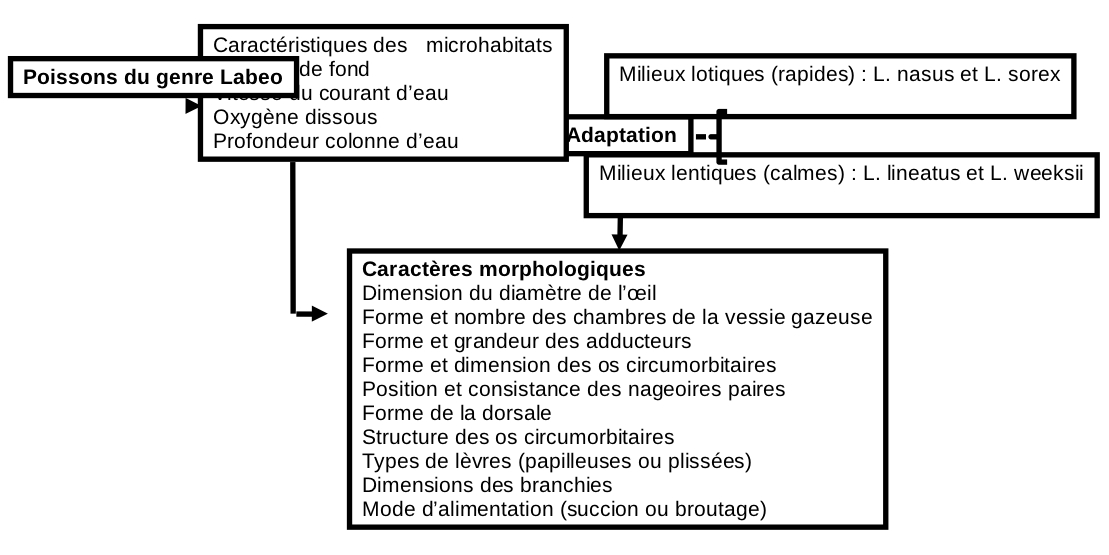
Figure 18. Diagramme prédictif de l’habitat occupé par les espèces du genre Labeo étudiées dans le Pool Malebo, fleuve Congo.
Discussion
27L’analyse de la répartition de quatre espèces de Labeo dans le Pool Malebo permet la distinction de deux guildes d’espèces : rhéophiles (Labeo nasus et L. sorex) et limnophiles (L. lineatus et L. weeksii).
28Le choix des habitats des espèces étudiées dépend de la profondeur de la colonne d’eau, de la vitesse du courant d’eau, de l’oxygène dissous et du substrat de fond. L’importance de ces quatre variables apparaît dans de nombreuses études et peut être définie comme une règle générale de l’organisation des peuplements piscicoles d’eau courante. Cependant, au sein de ces deux groupes d’espèces mis en évidence, l’adaptation par rapport aux variables morphologiques n’est pas identique. Les espèces rhéophiles apparaissent adaptées, notamment pour les variables vitesse de courant et oxygène dissous alors que les espèces limnophiles ne le sont pour aucune de ces deux variables. La dimension et la consistance des nageoires paires permettent au poisson d’adopter une cinétique caractéristique en fonction du milieu de vie de ce dernier (4).
29Cette étude a permis de distinguer 5 caractères morphologiques à l’origine de l’adaptation des Labeo spp aux caractéristiques de leurs habitats. Les espèces limnophiles qui ne doivent pas lutter contre un fort courant d’eau ont des nageoires moins solides, des branchies larges leurs permettant de filtrer de grandes quantité de l’oxygène dissous dans l’eau, des yeux grands et une forme comprimée latéralement. Par ailleurs, les espèces rhéophiles qui doivent faire face à un courant fort ont des yeux minuscules, une forme arrondie et fusiforme et des petites branchies. Ces caractères permettent d’expliquer l’occupation de différentes niches écologiques au Pool Malebo par les quatre espèces de Labeo.
30La vitesse de l’eau et, par conséquent, la quantité de l’oxygène dissous influencent la forme du corps (plus la vitesse du courant est faible, plus la teneur en oxygène diminue), la grandeur et la forme des nageoires ainsi que la grandeur des branchies. Selon ces auteurs, ce phénomène a été observé chez la plupart des poissons (5, 19).
31Sur base des caractères étudiés, deux guildes morphologiques ont été distinguées. La première constituée de L. nasus et Labeo sorex qui présentent une faible surface des branchies alors que la deuxième, composée de L. lineatus et L. weeksii, présente de larges branchies. La longueur des branchies varie de 8,9% à 10,3% de la longueur totale de Labeo weeksii et de 9,1% à 15,1% de la longueur totale pour Labeo lineatus. Elle varie de 5,9% à 8,4% pour Labeo nasus et de 5,2% à 7,8% pour Labeo sorex. Les effets combinés des besoins en oxygène et de l’aptitude à la nage face au courant d’eau amènent ces poissons à s’adapter à leur milieu de vie (4).
32Les poissons vivant dans des milieux à courant rapide présentent généralement un corps fusiforme et une section circulaire. Ainsi, l’indice de compression a varié de 0,35 à 4,1 pour Labeo lineatus et Labeo weeksii. Il a oscillé entre 5,5 et 7,1 chez Labeo nasus et Labeo sorex. Les valeurs des indices de compression calculée pour ces espèces a montré que les espèces limnophiles sont comprimées ventralement alors que les espèces rhéophiles sont fusiformes. Le courant de l’eau joue donc un rôle important dans le comportement rhéotaxique des poissons, dans la détermination et le choix de leurs habitats.
33Le Pool Malebo est un milieu complexe où on trouve plusieurs habitats caractérisés par les substrats rocheux, sablonneux ou boueux qui sont occupés de façon spécifique par les diverses espèces de Labeo présentes ( 18). Au cours de leur évolution, les Labeo se sont diversifiés et ont ainsi occupés divers habitats disponibles en se spécialisant. L. lineatus et L. weeksii occupent les habitats à fonds sableux (Labeo weeksii) et sablo-vaseux, alors que L. nasus et L. sorex vivent sur des substrats à fond rocheux.
34Toutefois le mode de prélèvement de ces aliments est soit la succion, cas de Labeo lineatus et L. weeksii ; soit le broutage, cas de L. nasus et L. sorex (17). Ce constat a été également fait par Lévêque et Paugy (9).
Conclusion
35L’objectif de cette étude était d’étudier le complexe phénotype - variable environnemental afin de comprendre les mécanismes d’isolement des espèces de Labeo au Pool Malebo qui conduit à une spécialisation sympatrique.
36L’analyse statistique effectuée sur les données morphologiques et biologiques des spécimens et les variables abiotiques des sites de pêche montre que ces poissons peuvent être regroupés en deux catégories, chaque groupe présente des caractères adaptatifs propre à son habitat. Le premier groupe vit dans les eaux lentiques et présente une surface des branchies relativement grandes, des nageoires paires peu résistantes face au courant d’eau, une forme générale comprimée latéralement, la dimension élevée du diamètre de l’oeil, la longueur et la fragmentation de la vessie gazeuse et des lèvres papilleuses. A l’opposé, le deuxième groupe vit dans les eaux lotiques du Pool Malebo et présentent quelques adaptations morphologiques et comportementales leurs permettant de se spécialiser et d’évoluer dans ces milieux. Parmi ces adaptations on peut citer la réduction de la surface des branchies, la résistance des nageoires paires contre le courant de l’eau, la réduction du diamètre de l’oeil et la réduction de la vessie gazeuse et des lèvres plissées.
Bibliographie
-
Allan J.D., 1995, Stream ecology: Structure and function of running waters. Chapman & Hall. London, 338 p.
-
Bouhbouh S., 2002, Bio-écologie de Barbus callensis (Valenciennes, 1842) et Barbus fritschi (Gunther, 1874) au niveau du réservoir Allal el fassi (Maroc). Thèse de doctorat présentée et défendue en vue de l’obtention du grade de Docteur en sciences, Université Sidi Mohamed ben Abdallah, Fac. Sciences, Maroc, 467 p.
-
De Witt T.J. & Langerhans R.B., 2003, Multiple prey traits, multiple predators: keys to understanding complex community dynamics. J. Sea Res., 49, 143-155.
-
Fulton C.J., Bellwood D. & Wannright P., 2001, The relationship between swimming ability and habitat use in wrasses Labridae. Marine Biol., 137, 25-33.
-
Glalanbor C.K., Reznick D.N. & Walker J.A., 2004, Constraints on adaptive evolution: the functional trade-off between reproduction and fast-start swiming performance in the Trinidadian guppy (Poecilia reticulata). Am. Nat. 164, 38-50.
-
Hammer Ø., Harper D.A.T. & Ryan P.D., 2001, PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica 4(1): 9pp. http://palaeo-electronica.org/2001_1/past/issue1_01.htm. (consulté en janvier 2013).
-
Karr J.R. & James F.C., 1975, Ecomorphology in eastern blennioid fishes: character transformation of oral jaws and associated change of their biology roles. Environ. Biol. Fishes, 24, 199-218.
-
Legendre P. & Legendre L., 1998, Écologie numérique. 2e éd., Elsevier Science BV, Amsterdam, Pays-Bas.
-
Levêque C. & Paugy D., 2006, Les poissons des eaux continentales africaines : Diversité, écologie et utilisation par l’homme. IRD, Paris, 564 p.
-
Mahon R., 1984, Divergent structure in fish taxocenoses of north temperate streams. Can. J. Fish. Aquat. Sci., 41, 330-350.
-
Malavoi J.R. & Souchon Y., 1989, Méthodologie de description et quantification des variables morphodynamiques d’un cours d’eau à fond caillouteux. Reu. Go. Lyon, 64, 4, 252-259.
-
Mbadu Z.V., 2011, Biologie des espèces du genre Distichodus Muller et Troschl, 1845 (Distichodontidae, Pisces) du Pool Malebo (Fleuve Congo) en rapport avec les mécanismes d’exploitation de leurs niches trophiques. Thèse de doctorat, Université de Kinshasa, R.D. Congo, 442 p.
-
Mbomba B.N., 1986, Comparative feeding ecology of aufwuchs eating Cichlid Fishesin Lake Tanganyika, with reference to their developmental changes. Physiol. Ecol. Japan, 23, 79-108.
-
Motta P.J., Norton S.F. & Luczkovich J.J., 1995, Perspectives on the Ecomorphology of bony fishes, Environ. Biol. Fishes., 44, 11-20.
-
Portt C.B., Minns C.K. & King S.W., 1988, Morphological and ecological characteristics of common fishes in Ontario lakes. Cari. MS Rep. Fish. Aquat, Sci. 37 p.
-
Pwema K.V., 2014, Ecologie alimentaire, reproduction et modes d’adaptation de cinq espèces de Labeo Cuvier, 1817 dans les milieux lentiques et lotiques du Pool Malebo dans le fleuve Congo. Thèse de doctorat, Université de Kinshasa, RD. Congo, 163 p. Inédit.
-
Pwema V.K., Mbomba N.B., Takoy A.L., Malekani J.M. & Micha J-C., 2015, Comparison of the diet of two species of Labeo (Cyprinidae): a rheophilic one, Labeo sorex and a limnophilic one, Labeolineatusin the Malebo Pool (Congo River). Congo Sci., 3, 1, 1-30.
-
Pwema K.V., Pigneur L.M., Mbomba N.B., Takoy L.A. & Micha J-C., 2011, Environmental variables structuring Labeo species (Pisces, Cyprinidae) in Malebo Pool, Congo River. Int. J. Biol. Chem. Sci., 5, 2, 507-514.
-
Sidlauka B., Chernolft B, Machado & Allisone A., 2006, Geographic and environmental variation in Bryonops sp. Cl. Pantanal. Ichtyol, Res., 53, 24-33.
-
Schluter D., 2000, The Ecology of Adaptive Radiation. Oxford University Press, Oxford, 288 p.
-
Tshibwabwa S.M., 1997, Systématique des espèces du genre Labeo (Teleostei, Cyprinidae) dans les régions ichtyogéographiques de basse Guinée et du Congo. Thèse de doctorat, Université de Namur, 530 p.
-
Wirkramanayake E.D., 1990, Ecomorphology and biogeography of a tropical stream fish assemblage: evolution of assemblage structure. Ecology, 71, 5, 1756-1764.

