- Accueil
- Volume 37 (2019)
- Numéro 3
- Performances germinatives des graines de Lannea microcarpa Engl. & K. Krause (Anacardiaceae) de provenance sahélo-soudanienne du Burkina Faso
Visualisation(s): 3552 (9 ULiège)
Téléchargement(s): 0 (0 ULiège)
Performances germinatives des graines de Lannea microcarpa Engl. & K. Krause (Anacardiaceae) de provenance sahélo-soudanienne du Burkina Faso

Notes de la rédaction
Reçu le 15.05.17 et accepté pour publication le 11.01.19
Résumé
L’étude vise à évaluer les performances de germination des graines et de croissance des plantules de Lannea microcarpa. À cet effet, les fruits mûrs ont été récoltés et soumis à trois traitements prégerminatifs (fruits entiers sans traitement, dépulpage des fruits et décorticage des noyaux). Pour chaque traitement, les graines sont semées et le nombre de graines germées est noté quotidiennement. Les paramètres de croissance tels que la hauteur, le diamètre au collet et le nombre de feuilles des plantules ont été mesurés pendant 60 jours. Les résultats montrent que les fruits dépulpés présentent le meilleur taux de germination (83,33 ± 1,97%) à la récolte. Quand les graines sont conservées pendant 35 à 65 jours, leur capacité à germer baisse de 46,67%. Comparés aux fruits entiers, les noyaux décortiqués et les fruits dépulpés présentent les temps de latence les plus courts. La vitesse de germination des noyaux décortiqués (12,67 jours) est supérieure à celle des fruits dépulpés (14,33 jours) et des fruits entiers (18 jours). La croissance des plantules est plus rapide au premier mois avec un accroissement de 1,51 ± 0,10 mm/jour du diamètre au collet. Les fruits fraîchement récoltés doivent être utilisés pour obtenir un taux de germination élevé afin de réussir la conservation de L. microcarpa dans les parcs agroforestiers.
Abstract
Germinative Performances of Lannea microcarpa Engl. & K. Krause Seeds from Sahelo-Sudanian Zone of Burkina Faso.
This study aims to assess the peformances of seed’s germination and the seedling’s early growth of Lannea microcarpa. Thereby, ripe fruits have been collected and submitted to three pre-germinative treatments (entire fruits without treatment, peeled fruits and pulled pits). For each treatment, the seeds were sowed and the number of germinations was daily recorded. The growth parameters such as the height, the collar diameter and the number of leaves of seedlings have been measured during 60 days. The results showed that fruits without pulp had the highest germination rate (83.33±1.97%). When seeds were conserved between 35 and 65 days, their germination rate decreased by 46.67%. Compared to the entire fruits, the peeled fruits and the ones without pulp had the shortest latent period. The germination rate of peeled fruits (12.67 days) was greater than the one of fruits without pulp (14.33 days) and entire fruits (18 days). The growth of seedlings was fast during the first month with an increase of 1.51 ± 0.10 mm/day of collar diameter. The harvested fresh fruits might be used to obtain a high germination rate in order to successfully conserve L. microcarpa in agroforestry parks.
Table des matières
Introduction
1Lannea microcarpa Engl. & K. Krause (Anacardiaceae) ou raisinier est un arbre fruitier spontané très apprécié des populations des savanes sahélo-soudaniennes et soudaniennes du Burkina Faso (28). Localement connu sous le nom de Bu cabu en Gourmantchéma et Sabga en Mooré, L. microcarpa est une espèce pantropicale répandue du Sénégal au Cameroun (6). Ses produits sont employés dans divers domaines dont principalement l’alimentation et la pharmacopée. Dans le domaine de l’alimentation, les fruits de L. microcarpa qui sont des drupes monospermes, sont beaucoup consommés et vendus sur les marchés (2). Dans la pharmacopée, les écorces, les feuilles et les rameaux sont utilisés pour traiter de nombreuses maladies telles que la plaie, la tuberculose, la diarrhée. Aussi, les feuilles de l’espèce sont utilisées comme fourrage pour le bétail. Le bois intervient dans la construction et est souvent utilisé comme bois de chauffe (6). Plusieurs études (16, 17) ont montré que les arbres fruitiers spontanés dont L. microcarpa participent significativement à l’alimentation et à l’amélioration des conditions socio- économiques des populations locales en Afrique.
2Compte tenu des biens et services que L. microcarpa procure à la population locale, elle subit une forte pression anthropique qui menace ses peuplements naturels. Les pratiques anarchiques de récolte (fruits, racines, écorces et bois) mettent en danger la ressource dans les parcs agroforestiers. En plus de la pression anthropique, les feux de brousse et les effets du changement climatique apparaissent comme des facteurs aggravant des menaces qui pèsent sur l’espèce au Burkina Faso (23).
3Bien qu’étant une plante utilitaire et que son état de conservation soit préoccupant au Burkina Faso, L. microcarpa est reléguée à une place marginale dans les campagnes de reboisement. Pour pallier cette situation et lui donner une importance sylvicole, il est nécessaire de connaitre ses potentialités de reproduction afin de trouver les stratégies appropriées de conservation et de gestion durable de ses ressources. La plupart des travaux disponibles sur L. microcarpa au Burkina Faso portent sur les aspects ethnobotaniques et les techniques de multiplications végétatives (27, 28). Les travaux relatifs aux essais de bouturage de L. microcarpa ont révélé un taux de succès très bas (moins de 16%) si bien que l’espèce pourrait être classée parmi celles qualifiées de « difficile à enraciner » (28). Dans un tel contexte, d’autres pistes de recherche telles que la reproduction par graines doivent être investiguées afin de proposer des solutions appropriées pour la conservation in-situ de l’espèce. C’est dans cette optique que cette étude a été initiée et a pour objectif général d’évaluer les performances germinatives des graines de L. microcarpa dans la zone sahélo-soudanienne du Burkina Faso. Elle a pour objectif spécifique de : (i) déterminer la viabilité des graines en fonction du temps de conservation, (ii) évaluer l’impact des traitements prégerminatifs sur la capacité de germination des graines et (iii) évaluer la croissance initiale des plantules. Les résultats de cette étude peuvent apporter une contribution à la pratique de la sylviculture et à la domestication de L. microcarpa au Burkina Faso.
Matériel et méthodes
Zone d’étude
4Les fruits de L. microcarpa utilisés dans cette étude proviennent de deux villages (Golo et Tanghin) de la province du Passoré, avec pour chef-lieu Yako, située dans la région du Nord du Burkina Faso (Figure 1). Le climat y est de type sahélo-soudanien (13), marqué par deux saisons contrastées ; une longue saison sèche de 7 mois (novembre à mai) et une courte saison pluvieuse de 5 mois (juin à octobre). La température moyenne annuelle est de 29°C. Dans cette zone, les précipitations sont irrégulières avec une pluviométrie moyenne annuelle qui oscille entre 600 et 800 mm (30). La végétation est dominée par des savanes caractérisées par l’abondance des épineux du genre Acacia et des espèces telles que Balanites aegyptiaca, Parkia biglobosa, Tamarindus indica, Bombax costatum, Sclerocarya birrea, Lannea microcarpa et Adansonia digitata (8).
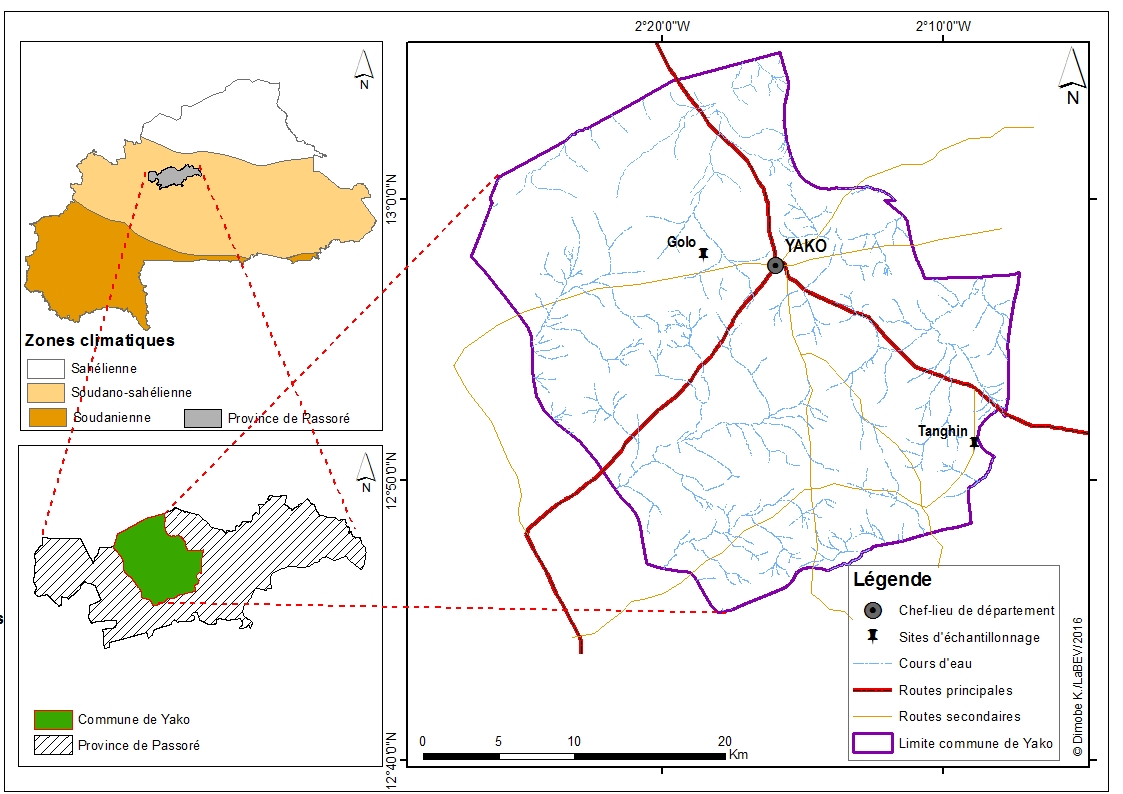
Figure 1: Localisation de la zone de provenance des fruits de Lannea microcarpa.
Echantillonnage et collecte des données
Récolte des fruits
5L’échantillonnage a concerné 10 semenciers par site, soit au total 20 arbres distants d’au moins 100 mètres l’un de l’autre, sur lesquels les fruits ont été récoltés. Pour chaque arbre, des grappes de fruits mûrs (Photo 1) ont été prélevées sur des rameaux situés à des niveaux différents du houppier (à la base, à la médiane et au sommet). Les fruits prélevés ont été emballés dans du papier humidifié et mis dans des sacs en toile pour le transport au laboratoire.

Photo 1 : Grappe de fruits mûrs de Lannea microcarpa.
Traitement prégerminatif des fruits
6Les fruits prélevés sur le terrain ont été dépouillés au laboratoire où les fruits sains ont été triés pour constituer trois lots de semences sources correspondant à trois traitements prégerminatifs utilisés dans l’essai de germination. Les divers traitements prégerminatifs testés sont: fruits entiers sans traitement préalable (Témoin) représentant le traitement prégerminatif 1 (T1); le dépulpage des fruits représentant le traitement prégerminatif 2 (T2) et le décorticage des noyaux qui représente le traitement prégerminatif 3 (T3).
7Le dépulpage est un traitement prégerminatif qui consiste à tremper les fruits dans de l’eau et à les frotter avec du sable fin jusqu’à les débarrasser de la pulpe tandis que le décorticage est un traitement prégerminatif qui consiste à débarrasser les fruits dépulpés de leur endocarpe.
8Les trois lots de fruits sont conservés dans des bacs plastiques au laboratoire à la température ambiante (25-28°C). Les premiers semis ont été effectués cinq jours après la récolte.
Mise en germination des semences
9Le dispositif utilisé dans la présente étude est constitué de pots en polyéthylène contenant de la terre arable comme substrat et disposés en bloc de Ficher randomisé à trois sous-blocs. Chaque sous-bloc comporte 10 pots et correspond à une répétition des trois traitements prégerminatifs (Figure 2). Pour suivre l’évolution de la capacité de germination des graines, le semis a été effectué à trois périodes : 5 jours après la récolte (Essai 1), 35 jours après la récolte (Essai 2) et 65 jours après la récolte (Essai 3) (25). La répétition échelonnée des essais a été faite pour tester la viabilité des semences dans le temps en se basant sur les travaux de Agbogan et al (1). Pour chaque essai, les semis ont été effectués à raison d’une graine par pot. Les relevés de la germination ont été effectués quotidiennement pendant deux mois pour chaque essai. Une graine est considérée comme ayant germé quand la tigelle apparaît au-dessus du substrat, ce qui correspond à la levée. Les essais ont été conduits entre les mois de juin et novembre 2013. Durant cette période la température variait entre 28°C et 31°C.
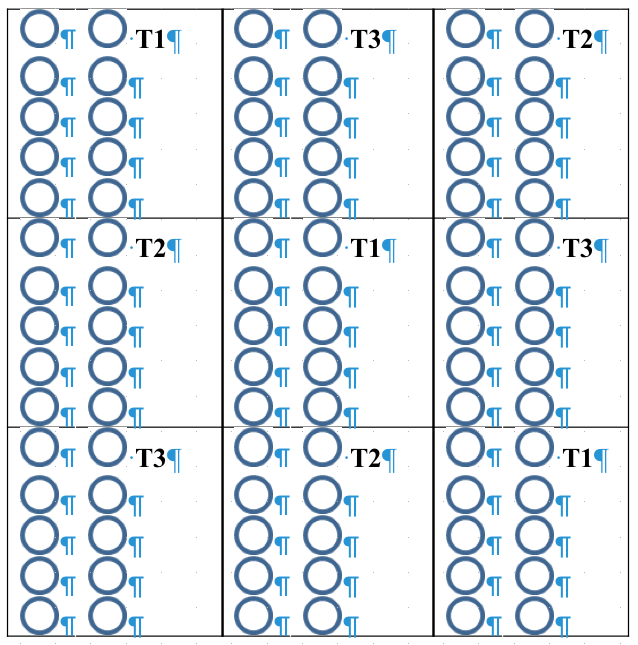
Figure 2: Dispositif expérimental des essais de germination. Les cercles représentent les pots en polyéthylène contenant de la terre arable
Evaluation de la croissance initiale des plantules
10Pour chaque essai, la croissance des plantules a été suivie sur 10 plantules par traitement prégerminatif, soient au total 30 plantules sélectionnées et étiquetées juste après la germination des graines. Les paramètres de croissance évalués sont le diamètre au collet et la hauteur totale des plantules mesurés respectivement à l’aide d’un pied à coulisse (± 0,01 mm de précision) et d’un double décimètre. Le nombre de feuilles a également été compté. Les mesures ont été effectuées tous les deux jours pendant 60 jours.
Analyse des données
11Des statistiques descriptives ont été réalisées sur les données collectées et des courbes ont été dressées pour illustrer l’évolution des paramètres de croissance en fonction du temps de conservation des semences.
12Pour caractériser la germination des graines de L. microcarpa, les paramètres suivants ont été calculés pour chaque traitement prégerminatif en fonction du temps de conservation :
-
le délai de germination qui représente le temps mis pour observer la première germination ;
-
la vitesse de germination (T50) qui est le temps mis pour atteindre 50% du taux de germination. La formule I a été utilisée pour calculer cette vitesse :
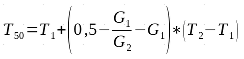 (I)
(I)
13où G1 représente le pourcentage cumulé des graines germées dont la valeur est la plus proche de 50% par valeur inférieure, G2 représente le pourcentage cumulé des graines germées dont la valeur est la plus proche de 50% par valeur supérieure; T1 et T2 correspondent aux temps nécessaire pour avoir respectivement G1 et G2 (5).
14-le taux de germination (Tg) qui représente le pourcentage de graines germées à la fin de l’essai. Le taux de germination (Tg) a été calculé suivant la formule II:
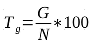 (II)
(II)
15où G est le nombre de graines germées et N = nombre total de graines semées.
16Les données collectées ont été traitées et analysées à l’aide du logiciel R (24) et la discrimination des moyennes a été faite par les tests ANOVA au seuil de 5%.
Résultats
17Caractéristiques de la germination en fonction des prétraitements et du temps de conservation des graines
18Les paramètres de la germination et les résultats du test de comparaison suivant les traitements prégerminatifs et la durée de conservation des graines sont consignés dans le tableau 1. Les taux de germination les plus élevés (T > 50%) ont été obtenus avec les fruits dépulpés cinq jours après la récolte tandis que les fruits entiers enregistrent les plus faibles taux après 35 et 65 jours de conservation. Après un mois de conservation, les graines des fruits entiers n’ont plus germé car elles ne sont plus viables. L’analyse des taux de germination en fonction du temps de conservation montre que la capacité germinative des fruits dépulpés a baissé de 26,66% contre 73,33% pour les noyaux décortiqués après 65 jours de conservation (Tableau 1). Les résultats du test de l’analyse de variance (ANOVA) révèlent une différence significative des taux de germination entre les traitements prégerminatifs (p < 0,001) (Tableau 1).
19Pour ce qui concerne les délais et vitesses de germination, ils varient en fonction des traitements prégerminatifs et du temps de conservation des semences. Les résultats du test ANOVA montrent qu’il n’y a pas de différence significative (p = 0,510) des délais de germination à la récolte entre les trois traitements prégerminatifs. Cependant, après 35 et 65 jours de conservation des semences, la différence devient significative (p < 0,05) (Tableau 1).
20En considérant la vitesse de germination, les résultats montrent que les noyaux décortiqués germent significativement plus rapidement que les fruits dépulpés et les fruits entiers quel que soit le temps de conservation des semences. La vitesse de germination des semences diminue avec la durée de conservation. Elle est passée de 12,67±0,47 jours à la récolte à 18,5±9,26 jours après 65 jours de conservation pour les noyaux décortiqués. Quant aux fruits dépulpés, elle est de 15±0,82 jours à la récolte contre 30,5±17,11 jours après 65 jours (Tableau 1). Les résultats du test ANOVA révèlent que les différences ne sont pas significatives (p = 0,630) à la récolte entre les trois traitements prégerminatifs. Cependant, après 35 et 65 jours de conservation, on constate que la vitesse de germination varie significativement (p < 0,05) en fonction des traitements prégerminatifs (Tableau 1).
Tableau 1 : Paramètres de la germination des graines de L. microcarpa en fonction des traitements prégerminatifs et de la durée de conservation.
|
Essai 1 (5 jours après la récolte) |
Essai 2 (35 jours après la récolte) |
Essai 3 (65 jours après la récolte) |
|||||||||||||
|
T1 |
T2 |
T3 |
T1 |
T2 |
T3 |
T1 |
T2 |
T3 |
|||||||
|
Taux (%) |
16,67±0,46 |
83,33±1,97 |
46,67±1,32 |
0 |
56,67±1,5 |
20±0,59 |
0 |
10±0,37 |
16,67±1,67 |
||||||
|
DDL |
2 |
2 |
2 |
||||||||||||
|
F |
45,60 |
64,64 |
15,84 |
||||||||||||
|
P- Valeur |
<0,001 |
0,0010 |
0,001 |
||||||||||||
|
Délai (jours) |
17±0,82 |
12,33±1,25 |
11,33±0,47 |
0 |
11,33±2,05 |
10,64±0,47 |
0 |
29,5±16,67 |
17,5±8,76 |
||||||
|
DDL |
2 |
2 |
2 |
||||||||||||
|
F |
1,35 |
11,01 |
28,10 |
||||||||||||
|
P- Valeur |
0,51 |
0,004 |
0 |
||||||||||||
|
Vitesse (en jours) |
18±0,82 |
15±0,82 |
12,67±0,47 |
0 |
14,33±0,94 |
11,67±0,47 |
0 |
30,5±17,11 |
18,5±9,26 |
||||||
|
DDL |
2 |
2 |
2 |
||||||||||||
|
F |
0,94 |
116,28 |
29,974 |
||||||||||||
|
P- Valeur |
0,63 |
0 |
0 |
||||||||||||
T1: Fruits entiers (témoin), T2: Fruits dépulpés, T3: Noyaux décortiqués, DDL: Degré de liberté, F: Fisher
Croissance initiale des plantules en fonction des traitements prégerminatifs et de la durée de conservation des semences
Croissance en hauteur
21La croissance en hauteur des plantules de L. microcarpa varie en fonction des traitements prégerminatifs et du temps de conservation de ses graines (Figures 3). Deux jours après la levée, l’allongement initial de la tige est en moyenne de 2 cm. Ce sont les plantules issues des fruits dépulpés et semés cinq jours après la récolte qui ont montré une meilleure croissance avec un taux de 92,30%. Les résultats de l’ANOVA montrent que la croissance en hauteur des plantules varie significativement (p <0,001) en fonction du traitement prégerminatif et de la durée de conservation des graines (Tableau 2).
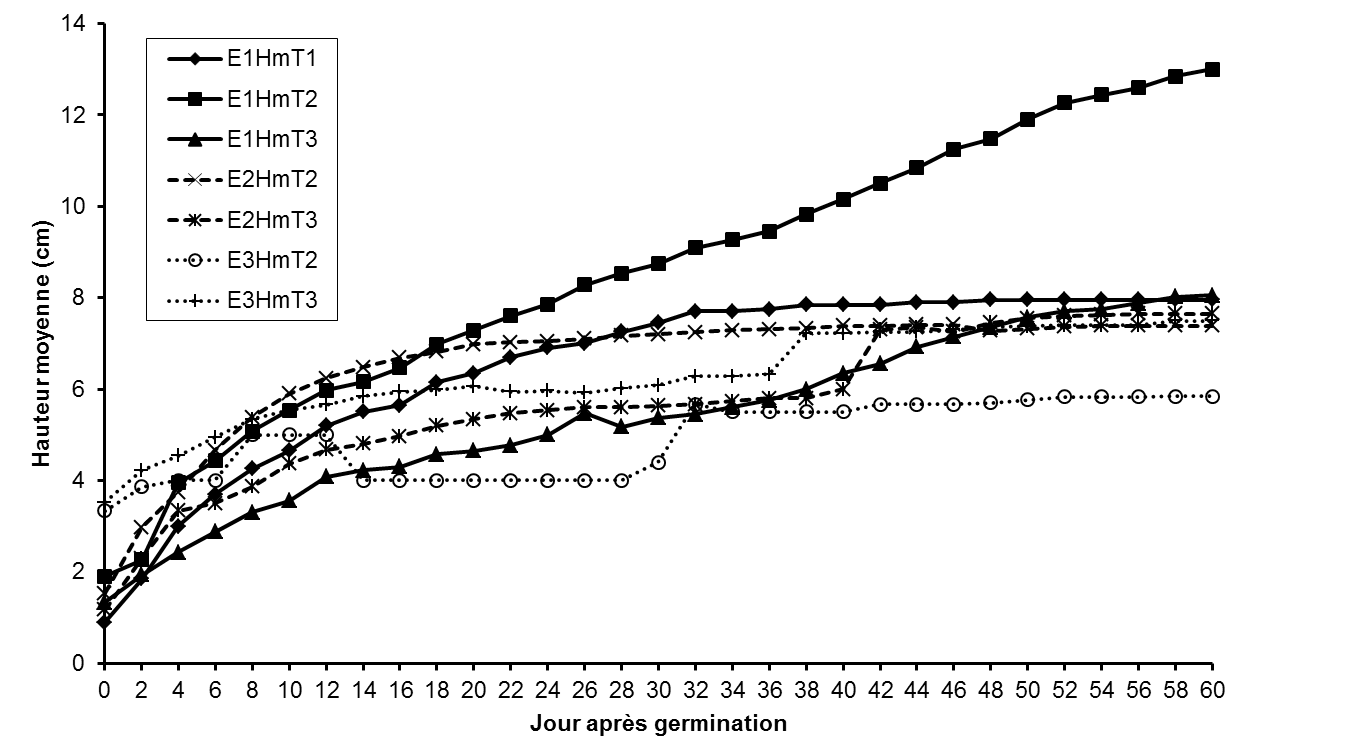
Figure 3 : Evolution de la croissance moyenne en hauteur des plantules en fonction des traitements prégerminatifs et de la durée de conservation des fruits
E1HmT1: hauteur moyenne des plantules issues du traitement prégerminatif 1 à l’essai 1, E1HmT2: hauteur moyenne des plantules issues du traitement prégerminatif 2 à l’essai 1, E1HmT3: hauteur moyenne des plantules issues du traitement prégerminatif 3 à l’essai 1, E2HmT2: hauteur moyenne des plantules issues du traitement prégerminatif 2 à l’essai 2, E2HmT3: hauteur moyenne des plantules issues du traitement prégerminatif 3 à l’essai 2, E3HmT2: hauteur moyenne des plantules issues du traitement prégerminatif 2 à l’essai 3, E3HmT3: hauteur moyenne des plantules issues traitement prégerminatif 3 à l’essai 3.
Croissance en diamètre
22Les plantules issues des fruits dépulpés (E1DmT2) présentent une allure de croissance régulière en fonction du temps tandis que celles des plantules issues des fruits entiers et des noyaux décortiqués (E1DmT1 et E1DmT3, respectivement) présentent une allure irrégulière et une croissance plus lente du diamètre des plantules (Figure 4). Par ailleurs, la croissance en diamètre des plantules issues des graines conservées pendant 35 et 65 jours est relativement plus lente. Les résultats consignés dans le tableau 2 confirment ceux de la figure 4 et montrent que les plantules issues des fruits dépulpés, semés cinq jours après la récolte, ont un diamètre moyen plus élevé (2,59 ± 0,67 mm) que celui des plantules issues des fruits entiers (2,30 ± 0,39 mm) et des noyaux décortiqués (2,01 ± 0,39 mm). A l’exception de l’essai 2 (35 jours après récolte), les résultats du test ANOVA montrent que les diamètres moyens des plantules varient significativement (p <0,001) en fonction du traitement prégerminatif et de la durée de conservation des graines (Tableau 2).
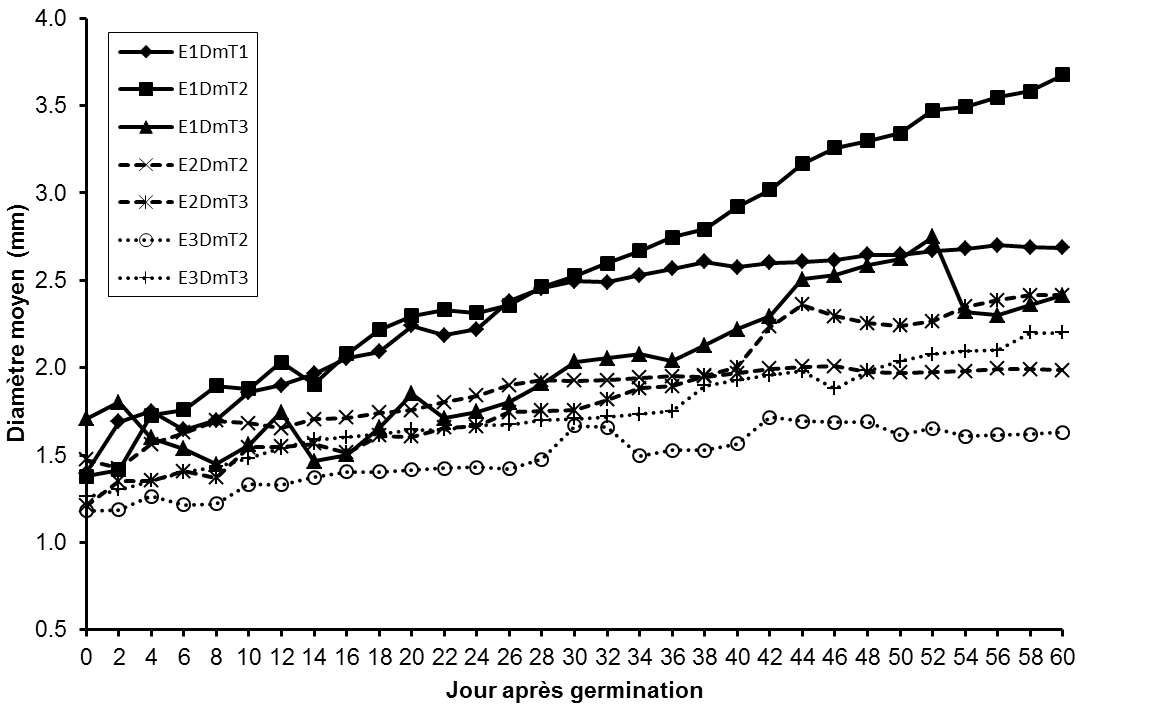
Figure 4 : Evolution de la croissance moyenne en diamètre des plantules en fonction des traitements prégerminatifs et de la durée de conservation des fruits.
E1DmT1: diamètre moyen des plantules issues du traitement prégerminatif 1 à l’essai 1, E1DmT2: diamètre moyen des plantules issues du traitement prégerminatif 2 à l’essai 1, E1DmT3: diamètre moyen des plantules issues du traitement prégerminatif 3 à l’essai 1, E2DmT2: diamètre moyen des plantules issues du traitement prégerminatif 2 à l’essai 2, E2DmT3: diamètre moyen des plantules issues du traitement prégerminatif 3 à l’essai 2, E3DmT2: diamètre moyen des plantules issues du traitement prégerminatif 2 à l’essai 3, E3DmT3: diamètre moyen des plantules issues du traitement prégerminatif 3 à l’essai 3. Production de feuilles
23La production foliaire des plantules de L. microcarpa ne varie pas significativement (p = 0,865) entre les traitements prégerminatifs des graines conservées durant 35 jours (Tableau 2). Cependant les résultats du test ANOVA révèlent qu’elle varie significativement entre les traitements prégerminatifs pour les essais 1 (5 jours après récolte) et 3 (65 jours) (Tableau 2).
24L’analyse de la figure 5 montre que la production foliaire est relativement plus élevée pour les plantules issues des fruits dépulpés et des noyaux décortiqués et fraîchement récoltés que chez les plantules issues des fruits.
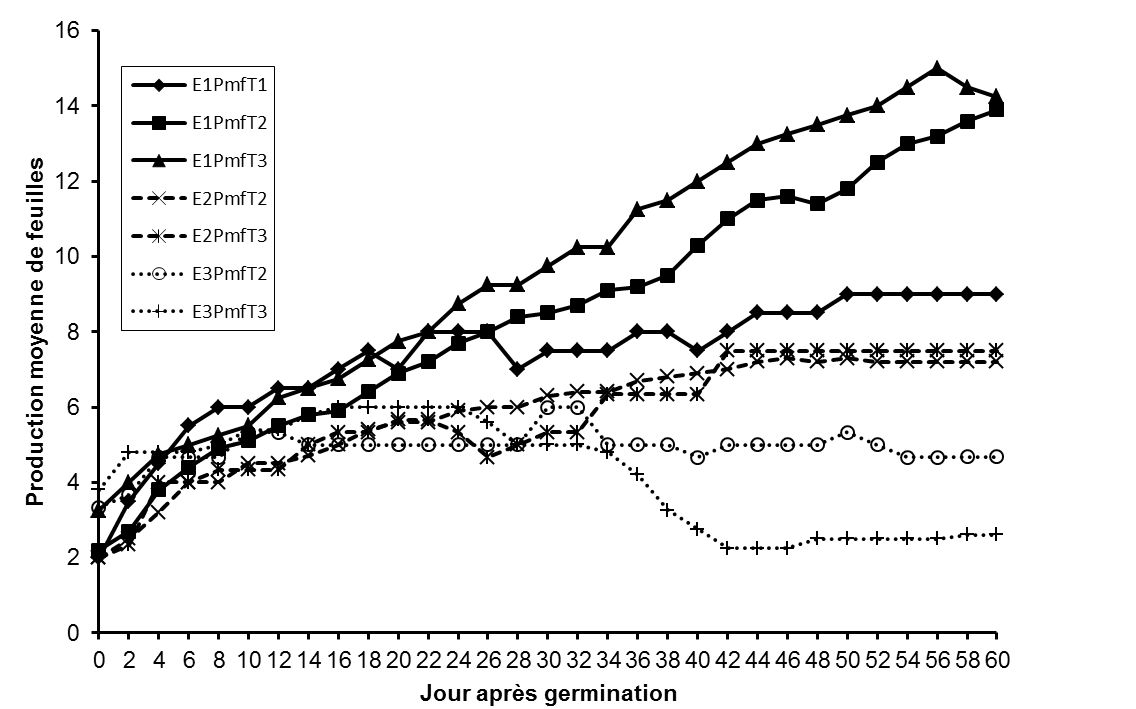 Figure 5 : Evolution de la production moyenne de feuilles des plantules en fonction des traitements prégerminatifs et du temps de conservation des fruits.
Figure 5 : Evolution de la production moyenne de feuilles des plantules en fonction des traitements prégerminatifs et du temps de conservation des fruits.
E1PmFT1 : production moyenne de feuilles des plantules issues du traitement prégerminatif 1 à l’essai1, E1PmfT2: production moyenne de feuilles des plantules issues du traitement prégerminatif 2 à l’essai 1, E1PmfT3: production moyenne de feuilles des plantules issues du traitement prégerminatif 3 à l’essai 1, E2PmfT2: production moyenne de feuilles des plantules issues du traitement prégerminatif 2 à l’essai 2, E2PmfT3: production moyenne de feuilles des plantules issues du traitement prégerminatif 3 à l’essai 2, E3PmfT2: production moyenne de feuilles des plantules issues du traitement prégerminatif 2 à l’essai 3, E3PmfT3: production moyenne de feuilles des plantules issues du traitement prégerminatif 3 à l’essai 3.
Tableau 2 : Valeurs moyennes des paramètres de croissance des plantules en fonction des traitements prégerminatifs et du temps de conservation des fruits.
|
Essai1 |
Essai2 |
Essai3 |
DDL |
F |
P-valeur |
|
|
Hauteur (cm) |
||||||
|
T1 |
6,47±1,96 |
0 |
0 |
|||
|
T2 |
8,51±3,11 |
6,55±1,45 |
4,92±0.86 |
2 |
24.07 |
<0.001 |
|
T3 |
5,39±1,87 |
5,61±1,63 |
6,27±1,05 |
2 |
2.709 |
0.072 |
|
DDL |
2 |
2 |
2 |
|||
|
F |
13.72 |
5.77 |
31.02 |
|||
|
P-value |
<0.001 |
0.0195 |
<0.001 |
|||
|
Diamètre au collet (mm) |
||||||
|
T1 |
2,30±0,39 |
0 |
0 |
|||
|
T2 |
2,59±0,67 |
1,84±0,17 |
1,49±0,17 |
2 |
57.37 |
<0.001 |
|
T3 |
2, 01±0,39 |
1,86±0,37 |
1,75±0,26 |
2 |
4.39 |
0.03579 |
|
DDL |
2 |
2 |
2 |
|||
|
F |
10.35 |
0.095 |
21.81 |
|||
|
P-value |
<0.001 |
0.76 |
<0.001 |
|||
|
Production de feuilles |
||||||
|
T1 |
7,31±1,67 |
0 |
0 |
|||
|
T2 |
8,51±3,33 |
5,82±1,50 |
4,90±0,50 |
2 |
24 |
<0.001 |
|
T3 |
9,70±3,61 |
5,75±1,56 |
4,19±1,43 |
2 |
42.91 |
<0.001 |
|
DDL |
2 |
2 |
2 |
|||
|
F |
4.967 |
0.029 |
6.865 |
|||
|
P-value |
<0.001 |
0.865 |
0.01264 |
|||
T1 : prétraitement 1 (Fruits entiers), qui n’ont germés qu’au premier essai, T2 : prétraitement 2, T3 : prétraitement 3.
Discussion
Caractéristiques de germination des graines
25Le choix de dix semenciers par site distants d’au moins 100 m les uns des autres dans cette étude a été effectué dans le but de capturer une bonne variabilité génétique de l’espèce à travers l’échantillonnage et aussi pour minimiser la consanguinité génétique entre les arbres.
26Les caractéristiques de la germination des graines de L. microcarpa varie en fonction du temps de conservation et des traitements prégerminatifs appliqués aux fruits. Les résultats de la présente étude ont montré qu’après un peu plus d’un mois de conservation, les fruits entiers de L. microcarpa sont incapables de germer. Une observation similaire a été faite par Sanogo et al. (25) qui ont constaté que le taux de germination des graines de Carapa procera diminue au fur et à mesure que le temps de conservation des graines augmente. Pour L. microcarpa, cela pourrait être lié à une dormance tégumentaire induite par la durété de l’endocarpe commune aux Anacardiaceae et qui peut constituer une barrière physique à l’imbibition de l’embryon, aux échanges gazeux respiratoires ou à l’émergence de la radicule (20, 26). En milieu naturel, une telle prédisposition peut être préjudiciable à la régénération de l’espèce au regard des fluctuations pluviométriques qui peuvent causer des réductions plus ou moins importantes de la période favorable à la germination. La baisse du taux de germination des fruits dépulpés, des noyaux décortiqués et des fruits entiers en fonction du temps de conservation pourrait être due soit à une sensibilité à la dessiccation, soit à des modifications structurales de l’endocarpe (1). Or, les travaux de Daws et al. (12) ont montré que les graines de L. microcarpa sont classées parmi les graines tolérantes à la dessiccation (graines orthodoxes); donc l’hypothèse des modifications structurales de l’endocarpe pourrait être probable. Selon d’autres auteurs (11, 29), la baisse du taux de germination serait due à une perte du pouvoir germinatif des graines au cours de la conservation car lorsque les graines sont fraîchement récoltées, elles germent mieux à cause de leur teneur élevée en eau (15, 25). La perte du pouvoir germinatif des graines peut constituer un handicap à la régénération sexuée de l’espèce, exacerbé par les conditions anthropiques et climatiques de plus en plus sévères et la prédation des insectes et des rongeurs (11, 29).
27Les résultats obtenus dans cette étude mettent en évidence l’importance des traitements prégerminatifs pour l’amélioration de la germination des graines de L. microcarpa. Les traitements dépulpage des fruits et décorticage des noyaux augmentent la capacité de germination des graines de l’espèce. Ces résultats sont similaires à ceux de Mezghenni et al. (19) qui ont montré que le dépulpage et le décorticage améliorent le taux de germination des graines d’Argania spinosa (L.) Skeels. Dans le même sens, Dan Guimbo et al. (10) rapportent que le décorticage des noix de Neocarya macrophylla (Sabine) Prance est nécessaire avant semis car cela permet d’avoir une germination rapide et homogène. Selon Mbaye et al. (18), Agboola et al. (3) et Hamidou et al. (14), les traitements prégerminatifs ont pour action de fragiliser les parois ou les téguments des fruits ou des graines et de faciliter, d’une part, l’accès de l’eau et de l’air à l’embryon et d’autre part, la sortie radiculaire. Le faible taux de germination observé au niveau des fruits entiers serait probablement dû à une inhibition d’origine tégumentaire (18). Les téguments ont pour rôle d’empêcher la dispersion des réserves de la graine nécessaire à la germination et la croissance des plantules (10). Les résultats ont également révélé des traitements prégerminatifs qui améliorent la vitesse et les délais de germination de L. microcarpa. Ces derniers sont conformes à ceux de Ahoton et al. (4) et de Jaouadi et al. (15) qui ont aussi obtenu une amélioration des taux, de la vitesse et du délai de germination après une scarification ou un traitement chimique par l’acide sulfurique des graines d’Acacia tortilis (Forsk.) Hayne ssp. raddiana (Savi) Brenan et de Prosopis africana (Guill., Perrot. et Rich.) Taub. Mbaye et al. (18) ont aussi constaté une augmentation du taux et de la vitesse de germination après scarification des fruits de Zornia glochidiata Reichb. ex DC. Ainsi, dans le souci d’optimiser la capacité de germination des graines des ligneux tropicaux, l’impact des traitements prégerminatifs tels que la scarification, l’ébouillantage, l’utilisation de l’acide sulfurique, le dépulpage et le décorticage doit être évalué (19).
Croissance des plantules
28La survie des plantules de nombreux ligneux est liée à leur capacité de croissance en milieu naturel (21). A la levée, les plantules issues des fruits dépulpées présentent une croissance plus rapide, indiquant que ce traitement prégerminatif est un facteur stimulant de la croissance initiale. La présence de l’endocarpe dur joue un rôle important de protection de l’embryon et des tissus de réserve essentiels pour la croissance (10). Le dépulpage qui conserve l’endocarpe est donc un traitement prégerminatif indiqué pour favoriser le développement des plantules de L. microcarpa. Dans le même sens, Bayen et al. (7) ont constaté une amélioration de la taille des plantules issues de graines de Sterculia setigera Delile prétraitées à l’acide sulfurique. Les plantules issues des fruits dépulpées montrent également un développement plus important en diamètre et une production de feuilles plus élevée que les plantules issues des autres traitements prégerminatifs. Dans une étude similaire, Bayen et al. (7) ont démontré que les prétraitements n’ont pas d’impact sur la croissance en diamètre des plantules de S. setigera, mais plutôt sur la production foliaire qui augmente avec le traitement à l’acide sulfurique. La vigueur observée chez les plantules issues des fruits dépulpés de L. microcarpa constitue un avantage certain pour la réussite de la régénération naturelle de l’espèce face aux aléas de l'environnement. Au contraire, la faible taille des plantules issues des fruits entiers et décortiqués est naturellement préjudiciable au recrutement en milieu naturel comme cela a été rapporté pour de nombreux arbres et arbustes des régions semi-arides (9). Les plantules de petite taille sont souvent vulnérables en milieu naturel du fait du piétinement des animaux, des feux de végétation et de la sécheresse (7, 22).
Conclusion
29La caractérisation de la germination des graines de L. microcarpa montre une variation en fonction du temps de conservation et des traitements prégerminatifs. Dans les conditions expérimentales sensiblement proches de celles du milieu naturel, les graines germent bien à la récolte mais ne conservent que pendant deux mois leur pouvoir germinatif. Cette étude a révélé que le dépulpage des fruits et le décorticage des noyaux sont les traitements prégerminatifs qui offrent les meilleures capacités de germination à l’espèce. Le dépulpage des fruits est l’un des traitements prégerminatifs qui offre les meilleures potentialités de croissance et permet d’obtenir des plantules vigoureuses. Du fait de la simplicité et du faible coût de ces traitements prégerminatifs ils peuvent être recommandés aux pépiniéristes et aux sylviculteurs.
30En milieu naturel, les fruits peuvent subir des traitements prégerminatifs similaires suite à l’action des prédateurs mais l’intégrité de la graine ne sera pas toujours garantie. La bonne croissance initiale des plantules est un atout pour survivre aux aléas de l'environnement. Toutefois, au regard des difficiles conditions des milieux semi-arides anthropisés, de meilleures performances des plantules sont nécessaires pour assurer la régénération naturelle. Il y a donc un besoin d’investiguer sur les capacités de résilience des plantules de L. microcarpa dans les parcs agroforestiers en vue d’une gestion appropriée et durable des ressources de l’espèce.
Remerciements
31Les auteurs remercient Danida à travers le projet QualiTree (10-002AU) pour le financement de cette étude. Ils expriment également leur gratitude aux populations locales pour leur collaboration pendant la collecte des données sur le terrain.
Bibliographies
-
Agbogan A., Bammite D., Tozo K. & Akpagana K., 2014, Contribution à la multiplication, par graines et par bouturage de segments de tiges et de racines, de trois fruitiers spontanés de la région des Savanes au Togo: Haematostaphis barteri Hook. F., Lannea microcarpa Engl. & k. Krauss et Sclerocarya birrea. Eur. Sci. J., 10, 195-211.
-
Agbogan A., Tozo K., Wala K., Bellefontaine R., Dourma M., Akpavi S., Woegan Y.A., Dimobe K. & Akpagana K., 2015, Structure des populations de Sclerocarya birrea, Lannea microcarpa et Haematostaphis barteri au nord du Togo. J. Anim. Plant. Sci., 25, 3871-3886.
-
Agboola D.A., Idowu W.F. & Kadiri M., 2006, Seed germination and seedling growth of the Mexican sunflower Tithonia diversifolia (Compositae) in Nigeria, Africa. Rev. Biol. Trop., 54, 395-402.
-
Ahoton L.E., Quenum F. & Mergeai G., 2011, Evaluation agromorphologique et sélection des meilleures accessions de Pourghère (Jatropha curcas L.) introduites au Bénin. Int. J. Biol. Chem. Sci., 5, 1619-1627.
-
Alaoui M.M., El Jourmi L., Ouarzane A., Lazar S., El Antri S., Zahouily M. & Hmyene A., 2013, Effet du stress salin sur la germination et la croissance de six variétés marocaines de blé (Effect of salt stress on germination and growth of six Moroccan wheat varieties). J. Mater. Environ. Sci., 4, 997-1004.
-
Arbonnier M., 2002, Arbres, arbustes et lianes des zones sèches d’Afrique de l'Ouest. 2nd édition, CIRAD, France, 574 p.
-
Bayen P., Lykke A.M., Ouédraogo A. & Thiombiano A., 2015, Population structure in natural stands, seed germination and seedling growth of Sterculia setigera under sursery sonditions in Burkina Faso (West Africa). Int. J. Plant. Soil. Sci., 7, 202-210.
-
Belem Ouedraogo M., 1993, Contribution à l’étude de la flore et de la végétation de la forêt classée de Toessin, province du Passoré (Burkina Faso). Thèse de doctorat, Université de Ouagadougou, Faculté des Sciences et Technique, 161 p.
-
Bellefontaine R. & Monteuuis O., 2002, Le drageonnage des arbres hors forêt: un moyen pour revégétaliser partiellement les zones arides et semi-arides sahéliennes pp 135-148. In : M. Verger (editeur), Multiplication végétative des ligneux forestiers, fruitiers et ornementaux : troisième rencontre du groupe de la Sainte Catherine, Orléans du 22 au 24 novembre 2000, Loiret-Conseil général, Ville d'Orléans, INRA, CTA, CIRAD. Montpellier : CIRAD, ISBN 2-87614-498-0.
-
Dan Guimbo I., Ambouta K.J.M., Mahamane A. & Larwanou M., 2011, Germination et croissance initiale de Neocarya macrophylla (Sabine) Prance, une espèce oléagineuse du Niger. Tropicultura, 29, 2, 88-93.
-
Danthu P., Roussel J. & Neffati M., 2003, La graine et la germination d’Acacia raddiana. In : M. Grouzis & E. Le Floc’h (Editeurs), Un arbre au désert Acacia raddiana, Paris : IRD, 265-283.
-
Daws M.I., Garwood N.C. & Pritchard H.W., 2006, Prediction of desiccation sensitivity in seeds of woody species: a probabilistic model based on two seed traits and 104 species. Ann. Bot., 97, 667-674.
-
Fontès J. & Guinko S., 1995, Carte de la végétation et de l’occupation du sol du Burkina Faso: Notice explicative. Ministère de la coopération française, projet Campus, Toulouse, 1-68.
-
Hamidou A., Iro D.G., Boubé M., Malick T.S. & Ali M., 2014, Potential germination and initial growth of Sclerocarya birrea (A. Rich.) Hochst, in Niger. J. Appl. Biosci., 76, 6433–6443.
-
Jaouadi W., Hamrouni L., Souayeh N. & Khouja M.L., 2010, Etude de la germination des graines d’Acacia tortilis sous différentes contraintes abiotiques. Biotechnol. Agron. Société. Environ., 14, 4, 643-652.
-
Larwanou M., Oumarou I., Snook L., Danguimbo I. & Eyog-Matig O., 2010, Pratiques sylvicoles et culturales dans les parcs agroforestiers suivant un gradient pluviométrique nord-sud dans la région de Maradi au Niger. Tropicultura, 28, 2, 115-122.
-
Marie M.P., Constantine D.M., Myriam Y.T., Guidawa F., David D.G., Baptiste N.T.J., Louise A.T.M. & Ronald B., 2012, Domestication de Vitex doniana Sweet. (Verbenaceae): influence du type de substrat, de la stimulation hormonale, de la surface foliaire et de la position du nœud sur l’enracinement des boutures uninodales. J. Agric. Environ. Int. Dev., 106, 1, 23-45.
-
Mbaye N., Diop A.T., Gueye M., Diallo A.T., Sall C.E. & Samb P.I., 2002, Etude du comportement germinatif et essais de levée de l’inhibition tégumentaire des graines de Zornia glochidiata Reichb. ex DC., légumineuse fourragère. Revue Élev. Méd. Vét. Pays Trop., 55, 1, 47-52.
-
Mezghenni H., Hamrouni L., Hanana M., Jamoussi B., Bouzid S. & Khouja M.L., 2014, Multiplication de l’Arganier Argania spinosa (L.) Skeels. J. New Sci., 10, 6-17.
-
Neya O., Hoekstra F.A. & Golovina E.A., 2008, Mechanism of endocarp-imposed constraints of germination of Lannea microcarpa seeds. Seed Sci. Res., 18,13-24.
-
Ouédraogo A., 2006, Diversité et dynamique de la végétation ligneuse de la partie orientale du Burkina Faso. Thèse de doctorat unique, Université de Ouagadougou, 196 p.
-
Ouédraogo A. & Thiombiano A., 2012, Regeneration pattern of four threatened tree species in Sudanian savannas of Burkina Faso. Agroforest. Syst., 86, 35-48.
-
Ouédraogo A., Thiombiano A., Hahn-Hadjali K. & Guinko S., 2006, Régénération sexuée de Boswellia dalzielii Hutch., un arbre médicinal de grande valeur au Burkina Faso. Bois For. Trop., 289, 41-48.
-
Development Core Team, 2013, a language and environment for statistical computing. Vienna: Foundation for Statistical Computing.
-
25. Sanogo S., Sacandé M., Van Damme P. & NDiaye I., 2013, Caractérisation, germination et conservation des graines de Carapa procera DC. (Meliaceae), une espèce utile en santé humaine et animale. Biotechnol. Agron. Soc. Environ., 17, 2, 321-331.
-
26. Schmidt L., 2000, Guide to handling of tropical and subtropical forest seed. Danida forest seed center, Krogerupvej-21, Denmark, 1-11.
-
27. Semde K., 2013, Caractérisations botaniques ethnobotaniques de Lannea sp de la commune urbaine de Zorgho (Burkina Faso). Université de Ouagadougou, Unité de Formation en Sciences de la Vie et de la Terre (UFR/ SVT), 58p.
-
28. Sereme A., Millogo-Rasolodimby J., Kouda-Bonafos M., Guinko S., Nacro M., 2008, Bouturage horticole du raisinier sauvage: Lannea microcarpa Engl. et K. Krause. J. Sci., 8, 18-24.
-
29. Thiombiano A., Wittig R. & Guinko S., 2003, Conditions de la multiplication sexuée chez des Combretaceae du Burkina Faso. Rev. Ecol. Terre Vie, 58, 361-379.
-
30. Zongo K.F., 2013, Associations légumineuses-céréales dans les agrosystèmes soudano-Sahéliens du Burkina Faso: Perceptions et pratiques paysannes, effets du Zaï et des amendements organiques et organo-minéraux sur les rendements des cultures associées niébé-sorgho. Université Polytechnique de Bobo-Dioulasso, Institut du Développement Rural.
Pour citer cet article
A propos de : O. Lompo
Burkinabè, MSc, Doctorant, Université Joseph Ki-Zerbo, Unité de Formation et de Recherches en Sciences de la Vie et de la Terre, Laboratoire de Biologie et Ecologie végétales, Ouagadougou Burkina Faso. E-mail: lompoounyambila@yahoo.fr
A propos de : K. Dimobe
Burkinabè, PhD, Enseignant-Chercheur, Université Josepk Ki-Zerbo, Unité de Formation et de Recherches en Sciences de la Vie et de la Terre, Laboratoire de Biologie et Ecologie végétales, Ouagadougou, Burkina Faso. Université de Dédougou, Dédougou, Burkina Faso.
A propos de : B. Lankoandé
Burkinabè, PhD, Enseignant-Chercheur, Université Joseph Ki-Zerbo, Unité de Formation et de Recherches en Sciences de la Vie et de la Terre, Laboratoire de Biologie et Ecologie végétales, Ouagadougou Burkina Faso. Université de Fada N’Gourma, Fada N’Gourma, Burkina Faso.
A propos de : A. Ouédraogo
Burkinabè, PhD, Enseignant-Chercheur, Université Joseph Ki-Zerbo, Unité de Formation et de Recherches en Sciences de la Vie et de la Terre, Laboratoire de Biologie et Ecologie végétales, Ouagadougou Burkina Faso.