- Accueil
- Volume 37 (2019)
- Numéro 4
- Importance des cercosporioses de l'arachide et sélection des variétés pour la résistance aux maladies au Bénin
Visualisation(s): 4701 (60 ULiège)
Téléchargement(s): 0 (0 ULiège)
Importance des cercosporioses de l'arachide et sélection des variétés pour la résistance aux maladies au Bénin

Notes de la rédaction
Reçu le 19.10.18 et accepté pour publication le 27.06.19
Résumé
Les cercosporioses précoce et tardive de l'arachide sont d'importantes maladies qui induisent des pertes élevées de rendements dans le monde. Les objectifs de cette étude sont d'évaluer la distribution spatiale des cercosporioses de l'arachide au Bénin et de tester 14 variétés d'arachide pour leur résistance à la maladie. Pour ce faire, une prospection a été conduite en août 2016 sur 72 sites de production de l'arachide localisés dans quatre zones agroécologiques du Bénin. Sur chaque site 30 plants ont été inspectés au hasard suivant les diagonales du champ pour évaluer l'incidence et la sévérité des maladies. Aussi, l'essai de criblage des variétés a été réalisé sous serre et au champ à la ferme expérimentale de l'Université de Parakou de juillet à octobre en 2015 et en 2016. De l'analyse, il ressort une incidence moyenne de 94,02% et une sévérité moyenne de 45,01% pour la savane sud guinéenne alors que la savane côtière a enregistré une incidence moyenne de 90,02% et une sévérité moyenne de 56,62%. Les savanes nord guinéenne et soudanienne suivent respectivement avec des valeurs d'incidence de 87,14% et 86,80% et des sévérités de 32,48% et 37,22%. Parmi les variétés testées, 73.9.11, 57.313 et H.75.0 moyennement résistantes à résistantes sous inoculation et infection naturelle ont des rendements moyens à très élevés. La variété TS 32.1 sensible a un rendement très élevé. Les variétés à symptômes modérés et à rendements moyens à très élevés pourront être recommandées aux producteurs.
Abstract
Importance of Early and Late Spots of Groundnut and Selection of Varieties for Resistance to the Diseases in Benin
Early and late leaf spots of groundnut are important diseases that cause high yield losses around the world. The objectives of this study are to evaluate the spatial distribution of early and late leaf spots of groundnut in Benin and to test 14 varieties of groundnut for their resistance to the disease. For this purpose, a survey was conducted in August 2016 on 72 groundnut production sites located in four agroecological zones of Benin. At each site 30 plants were randomly inspected along the diagonals of the field to assess incidence and severity. Also, the screening for resistance trial was carried out under greenhouse and field conditions at the experimental farm of the University of Parakou from July to October in 2015 and 2016. The analysis shows an average incidence of 94.02% and an average severity of 45.01% for the southern Guinean savannah, while the coastal savannah has an average incidence of 90.02% and an average severity of 56.62%. The northern Guinean and Sudanese savannas follow with incidence values of 87.14% and 86.80% and severities of 32.48% and 37.22% respectively. Among the varieties tested, 73.9.11, 57.313 and H.75.0 moderately resistant to resistant under inoculation and natural infection have medium to very high yields. The susceptible variety TS 32.1 has a very high yield. Varieties with moderate symptoms and medium to very high yields may be recommended to farmers.
Table des matières
Introduction
1Les cercosporioses précoce et tardive causées respectivement par Cercospora arachidicola Hori et Cercosporidium personatum (Berk & M. A. Curtis) Deighton sont des maladies fongiques très redoutables pour l'arachide (36). Les températures cardinales de croissance sont de 4-25°C à 30-34°C pour le Cercosporidium personatum et de 2-25°C à 32-35°C pour le Cercospora arachidicola. Les symptômes des cercosporioses sont influencés par le génotype de l'hôte et les facteurs environnementaux. Les premiers symptômes apparaissent au niveau des feuilles inférieures sous forme de petites taches chlorotiques 10 jours après l'infection (19). Sur les pétioles et les tiges, les lésions sont ovales et plus distinctes que celles des feuilles (11). Les lésions causées par Cercospora arachidicola sont circulaires avec une bordure irrégulière, et ont un diamètre de 8 à 10 mm. Ils sont d'un brun foncé sur la face supérieure des feuilles et plus claires sur la face inférieure (3).
2Les lésions causées par les Cercosporidium personatum sont plus circulaires et plus déterminées que celles de Cercospora arachidicola, souvent très nombreuses, isolées et coalescentes, d'abord jaunâtres; puis brunissantes, enfin, presque noires, ne dépassant pas, en général, cinq millimètres de diamètre. Ces lésions portent, surtout à la face inférieure de la feuille, de petites ponctuations noires, assez nombreuses, plus ou moins régulièrement disposées en cercles concentriques. La nécrose des feuilles et la défoliation consécutive peuvent atteindre 35 % de la surface assimilatrice. Les défoliations répétées entrainent la mort prématurée des plants (22).
3Elles sont sans doute celles qui occasionnent le plus de perte de rendement car outre la réduction du rendement en graine, elles causent de sérieux dommages au feuillage qui constitue un précieux fourrage pour le bétail durant la saison sèche (29). Combinées, ces deux maladies peuvent causer d'énormes pertes de rendement variant de 1 à plus de 50%. Aux Etats Unis d'Amérique, 50% des pertes de rendement de l'arachide sont dues à la cercosporiose (13, 31). Au Cameroun, des pertes de 53 % ont été signalées en condition expérimentale (12). Au Nigéria, les pertes avoisinent 30-40% (21) et en Côte d'Ivoire elles varient de 10 à 30% (4). Par ailleurs, combinées à la rouille, les cercosporioses précoce et tardive peuvent entraîner des pertes de rendement atteignant 70% (27).
4Au Bénin, la production de l'arachide accuse une baisse régulière à chaque campagne agricole, parce que soumise à d'énormes pressions parasitaires au nombre desquelles on peut citer les cercosporioses. Il urge de diagnostiquer la maladie dans les zones de production de l'arachide afin de prendre des mesures adéquates prévenant les dommages de Cercospora arachidicola et Cercosporidium personatum sur l'arachide. Les dommages peuvent aller jusqu'à la destruction complète du plant, compromettant ainsi toute la production nationale.
5L'utilisation des cultivars résistants, les pratiques culturales (3) et les traitements à base des fongicides sont recommandés pour limiter les infections. Toutefois, l'utilisation des fongicides, bien qu'efficace est peu rentable (3). La résistance variétale s'offre donc comme la voie la plus sûre et la plus durable pour lutter efficacement contre ces maladies. (23). Le développement de cultivars à haut rendement dotés de résistance aux cercosporioses et d'une adaptation aux systèmes de production reste donc le défi à relever par les sélectionneurs. Ainsi, les recherches visant non seulement à incorporer la résistance à la cercosporiose au haut rendement des cultivars mais également à sélectionner les variétés résistantes à la cercosporiose se poursuivent dans plusieurs pays. Ainsi aux Etats Unis d'Amérique, l'Université de Floride a développé un cultivar à haut rendement en graine, Southern Runner (UF 80202), avec résistance à la cercosporiose tardive. Entre 1976 et 1980 à l'ICRISAT, le criblage de quelques 10 000 entrées d'une collection de ressources génétiques a permis d'isoler quinze (15) génotypes résistants à la cercosporiose tardive (34). De même, en 1989, 54 lignées fiables résistantes à la cercosporiose tardive de l'arachide ont été identifiées à l'ICRISAT. Au Sénégal, des hybridations ont été initiées et évaluées entre des lignées résistantes du Texas et de I'ICRISAT et des variétés locales afin de sélectionner les lignées avancées résistantes à la cercosporiose (23).
6Il convient donc de diagnostiquer les cercosporioses de l'arachide au Bénin et de déterminer le comportement des variétés d'arachide face aux cercosporioses au Bénin dans une perspective d'amélioration de la production d'arachide. L'objectif de la présente étude est d'évaluer l'importance des cercosporioses au Bénin et d'étudier le comportement de quatorze variétés d'arachide à la maladie.
Matériel et méthodes
Sites de prospection
7Pour une représentativité de l'étude, 72 champs ont été prospectés durant la période végétative de l'arachide en août 2016 comme suit : 21 sites de la savane Soudanienne répartis dans les communes (Banikoara, Copargo, Gogounou, Kandi, Kouandé, Malanville et Tanguiéta), 17 sites dans la savane nord Guinéenne répartis dans les communes (Djougou, Bembèrèkè, N'Dali, Nikki, Ouèssè, Pèrèrè et Savè), 26 sites dans la savane sud Guinéenne répartis dans les communes (Aplahoué, Covè, Dassa, Djidja, Glazoué, Kétou, Sakété, Savalou, Zakpota et Zogbodomè) et 8 sites dans la savane côtière répartis dans les communes (Abomey-Calavi, Adjohoun et Dogbo). Le choix de ces sites est basé sur le potentiel de production d'arachide des communes dans lesquelles ils sont situés qui est de 1000 tonnes au minimum (18). Les champs d'au moins un quart d'hectare et distants d'au moins 5 km ont été retenus (Figure 1). La savane soudanaise (SS) comprise entre une latitude de 10.5 à 12° est caractérisée par une saison culturale qui s'étend de Mai à Septembre, un sol ferrugineux tropical plus ou moins sablonneux, une pluviométrie de 900- 1.000 mm et une température variant de 28- 45°C. La savane nord guinéenne (SNG) est comprise entre une latitude 8.5 à 10.5°et est caractérisée par une saison culturale qui s'étend d'Avril à Septembre, un sol ferralitique rouge, avec des vertisols et des sols hydromorphes par endroit plus ou moins sableux ou argileux, une pluviométrie de 1.000- 1.100 mm et une température variant de 28-40°C. La Savane Sud Guinéenne (SSG) entre 7,5 et 8,5° latitude est caractérisée par deux saisons culturales qui s'étendent d'Avril à Juillet et de Septembre à Novembre), un sol ferralitique rouge, des vertisols, et des sols hydromorphes, une pluviométrie de 1.000 -- 1.300 mm et une température de 26 - 38°C. La Savane Côtière (CS) au sud de 7,5° de latitude, est caractérisée par deux saisons culturales (avril à juillet ; septembre à novembre), des sols ferralitiques rouges, des Vertisols, des sols hydromorphes, une pluviométrie de 1.300- 1.500 mm et une température de 25 -35°C (1).
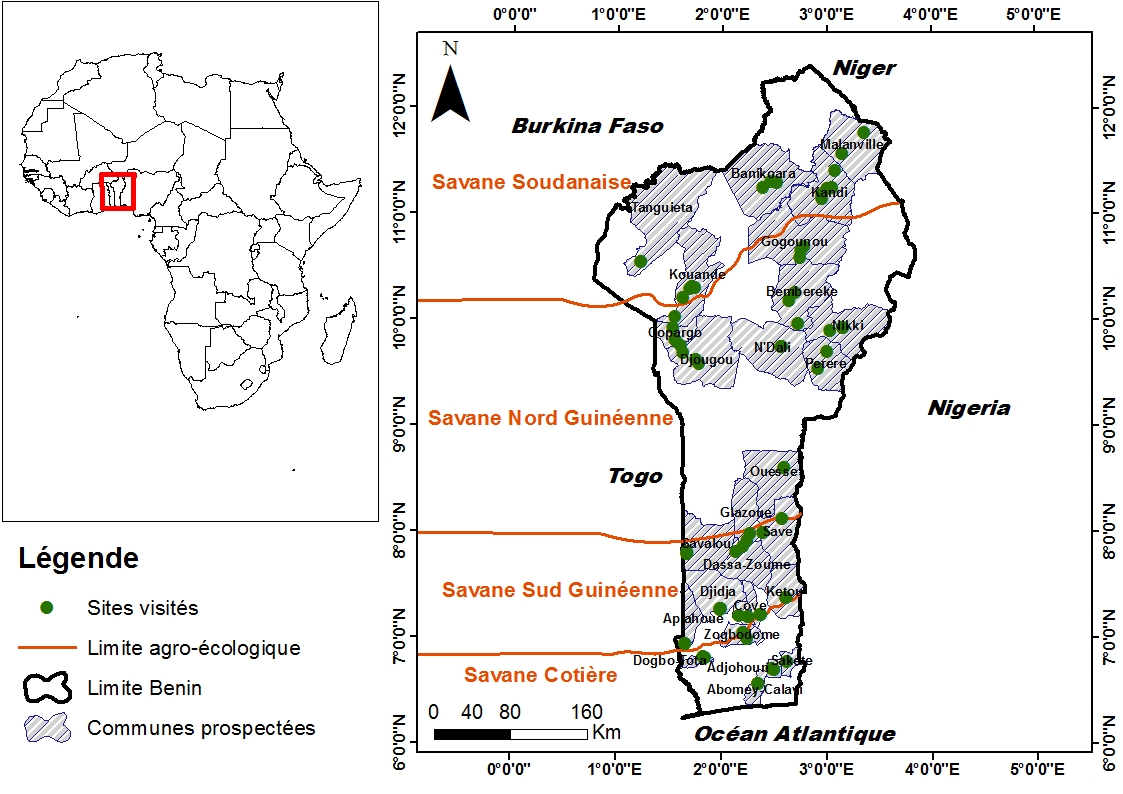 Figure 1 : Carte indiquant les sites parcourus pour la prospection dans les zones agroécologiques du Bénin.
Figure 1 : Carte indiquant les sites parcourus pour la prospection dans les zones agroécologiques du Bénin.
Isolement et identification des isolats de champignons
8Trois échantillons de feuilles provenant de quatre zones agroécologiques (savane soudanienne, savane nord guinéenne, savane sud guinéenne et savane côtière) de production d'arachide prospectées à fortes valeurs d'incidence et de sévérité ont été choisis (Copargo, Ouèssè, Djidja et Abomey-calavi). Ils ont été prélevés sur des plantes présentant des symptômes de fortes attaques de cercosporiose. Les échantillons prélevés de la partie incluant les tissus malades et sains ont été découpés puis stérilisés dans une solution à 0,35% d'hypochlorite de sodium puis dans de l'éthanol à 70% pendant une minute, rincés trois fois à l'eau stérile. Environ 2 mm2 de surface de feuille de chaque échantillon sont déposés dans une boite de Pétri, avec 3 répétitions pour chaque type d'isolat, sur milieu de culture Pomme de terre Dextrose Agar (PDA, 39 g/l). Les boites ont été ensuite incubées à 25°C pendant 72h. Les cultures pures des champignons ont été obtenues par transfert de2 mm2 environs des fragments mycéliens des isolats obtenus prélevés à l'extrémité des mycéliums développés puis déposés dans une boite de Pétri, sur milieu de culture PDA avec 10 répétitions pour chaque isolat. Les boites ont été ensuite incubées à 25°C pendant 7jours. Après fructification, nous avons procedé à l'identification de l'agent causal de la maladie sous microscope optique, grâce à une clé sur la base des caractéristiques microscopiques (la nature du mycélium, la morphologie et la formation du conidiophore, l'arrangement des conidies sur les conidiophores, la forme et la taille des conidies, le type et le nombre de conidies, etc.) (40).
Préparation de l'inoculum
9Les colonies de champignons ont été prélevées du milieu de culture purifié à l'aide d'une spatule métallique stérilisée, le mycélium mis en suspension dans l'eau distillée stérile puis homogénéisé. La suspension résultante a été filtrée au travers de la mousseline pour séparer les spores des fragments mycéliens. Le comptage des conidies pour obtenir la concentration a été fait à l'aide de l'hémacytomètre. La suspension de spores a été ensuite ajustée avec l'eau distillée stérile à une concentration finale de 2.104 spores/ml. Il a été ajouté à l'inoculum ainsi obtenu 0,05% de Tween 20 pour permettre la fixation des spores aux feuilles lors de la pulvérisation. La solution de spores ainsi préparée est versée dans un pulvérisateur et appliquée aux plantes. Les plants ont été inoculés trois semaines après le semis.
Test de virulence des isolats de champignons
10L'essai a été conduit dans la serre de la Faculté Agronomie de l'Université de Parakou (FA-UP) selon un dispositif de bloc aléatoire complet avec trois répétitions. La parcelle élementaire est constituée par un pot dans lequel est semée la variété Moto Locale. Le substrat utilisé (sol) a été pasteurisé à 65°C pendant 72 heures, et mélangé à du compost au rapport de ¾ (sol) et ¼ (compost). Quatre isolats provenant de Copargo, Ouèssè, Djidja et Abomey-Calavi ont été utilisés pour l'inoculation (UP-Co-S2, UP-Ou-S2, UP-Dj-S3 et UP-Ab-S1). La solution de spores initialement préparée est versée dans un pulvérisateur et appliquée aux plantes. Les plants ont été inoculés trois semaines après semis.
11Deux études ont été menées: un essai de criblage de variétés d'arachide avec trois isolats de cercosporiose sélectionnés pour leur virulence en serre et un essai de criblage de variétés d'arachide au champ.
Essai de criblage avec trois isolats de cercosporiose en serre
Matériel végétal
12Des variétés d'arachide ont été fournies par l'Institut National des Recherches Agricoles du Bénin (INRAB) (AZI Moto, Moto Locale, PC-79-79 ; H 75-0 ; GH 119-20 ; TS 32-1; 57-313, 73-27 ; 73-28 ; Niger ou 69-101 ; 55-33; ICGVSM 85045, 73.9.11 et SRV 1-19) pour le test de résistance à la cercosporiose.
Dispositif expérimental
13L'essai de criblage des variétés a été conduit dans la serre de la Faculté d'Agronomie de l'Université de Parakou selon un dispositif en parcelles subdivisées (factoriel bloc) avec l'isolat comme facteur principal et la variété comme facteur secondaire. Le dispositif est constitué de trois blocs et chaque bloc est subdivisé en quatre sous blocs installé sous serre à 21,4-31,4°C et 60-96% d'humidité relative. Chaque sous bloc comporte 14 variétés d'arachide à raison d'une variété par pot, un pot contenant un volume de 1,5dm3 de sol. Le substrat utilisé (sol) a été pasteurisé à 65°C pendant 72 heures, et mélangé à du compost au rapport de ¾ (sol) et ¼ (compost). A chaque bloc était inoculé un isolat du pathogène. Trois isolats provenant de Copargo, Ouèssè et Djidja ont été utilisés pour l'inoculation (UP-Co-S2, UP-Ou-S2, UP-Dj-S3,).
Essai de criblage de quatorze variétés d'arachide au champ
Site expérimental
14Les essais ont été effectués à la ferme expérimentale de la Faculté d'Agronomie de l'Université de Parakou située dans la zone soudano-guinéenne (N 09°18 908'; E 002°42 106') de Juillet à Octobre en 2015 puis répété en 2016. La pluviométrie totale de la période des essais est de 555,23 mm en 2015 et de 546,9 mm en 2016. L'hygrométrie est comprise entre 29 et 92% en 2015 et entre 27 et 99 % en 2016, et la température a varié de 20°C à 33,7°C en 2015 et de 20°C à 34,6°C en 2016. La saison pluvieuse s'étend de Mai à Octobre et la saison sèche de Novembre à Avril. Le sol repose sur le socle granito-gneissique où évoluent essentiellement les sols ferrugineux tropicaux.
Dispositif expérimental
15L'essai a été conduit selon un dispositif de Bloc Aléatoire Complet (BAC) à 4 répétitions. Il a été installé sur une superficie de 1160m^2 ^; soit 58m de long sur 20m de large. Chaque bloc est constitué de 14 parcelles (variétés) de 9 m2 (3 m x3 m) séparées par des allées de 1m, soit un total de 56 parcelles pour tout l'essai. Les blocs sont distants les uns des autres de 2m. Les variétés utilisées (AZI Moto, Moto Locale, PC-79-79 ; H 75-0 ; GH 119-20 ; TS 32-1; 57-313, 73-27 ; 73-28 ; Niger ou 69-101 ; 55-33; ICGVSM 85045, 73.9.11 et SRV 1-19) sont fournies par l'Institut National des Recherches Agricoles du Bénin (INRAB). Un semis en ligne a été réalisé le 03 juillet à raison de deux (02) graines par poquet. Les écartements de semis sont de 0,5m entre lignes et de 0,2 m sur la ligne. La densité est 180 plants/parcelle. Au cours de l'essai, deux sarclages ont été réalisés: le premier, 15 jours après le semis, le second au moment de la floraison (40ème jour). Le 3ème passage a consisté à arracher manuellement les mauvaises herbes qui ont échappé aux précédentes interventions.
Collecte, traitement et analyse des données
16Pour évaluer l'incidence et la sévérité de la cercosporiose de l'arachide, 30 plants ont été choisis au hasard sur deux lignes centrales (diagonales) des champs lors de la prospection. La sévérité a été aussi évaluée sur les plants inoculés dans la serre lors du test de virulence des quatre isolats de champignons.
17L'incidence a été notée en se basant sur la présence ou l'absence des symptômes caractéristiques de la maladie : taches nécrotiques de formes irrégulières ou circulaires de couleur brune foncée à noirâtre.
18Les données ont été saisies avec le logiciel Microsoft Excel 2013. L'incidence de la maladie sur chaque site prospecté a été calculée à l'aide de l'équation I proposée par Cooke et al. (7).
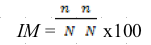
19(I)
20Avec IM, l'incidence de la maladie sur le site, n, le nombre de plants sur lesquels la maladie est présente sur le site et N, le nombre total de plants observés sur le site.
21L'indice de sévérité a été évalué sur chaque plante grâce à l'échelle de 1 -- 9 comme décrite par Subrahmanyam et al. (35) où le pourcentage de la surface de la feuille infectée est : 1 = 0%, 2 = 1-5%, 3 = 6-10%, 4 = 11-20%, 5 = 21-30%, 6 = 31-40%, 7 = 41-60%, 8 = 61-80%, 9 = 81-100%. La sévérité de la maladie a été calculée au champ et dans la serre avec la formule II.
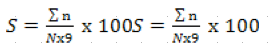
22(II)
23Avec S = sévérité sur la surface foliaire, n = somme des indices individuels, N = nombre total de plantes évaluées, 9 niveaux de sévérité élevée de l'échelle.
24Au total quatre évaluations ont été effectuées dans la serre, à intervalle de quatorze jours chacune. Les valeurs de la sévérité de la cercosporiose à chaque date d'évaluation ont été utilisées pour calculer la surface sous la courbe d'évolution de la sévérité (AUSPC, Area Under Severity Progress Curve) suivant la formule III.
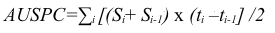
25(III)
26Avec ti= date de l'évaluation, Si = moyenne de la sévérité à la date ti (30; 15; 41).
Rendement en grains
27Le rendements en gousse et le poids de 100 graines ont été évalués pour chacune des quatorze variétés testées. Ainsi, Sur chaque parcelle, pour le rendement en gousse, suivant les diagonales et de façon aléatoire, un échantillon de soixante (60) plants (tiers de la normale par parcelle) sont arrachés et égoussés (séparation des fanes des gousses). Les gousses ont été séchées jusqu'à un taux d'humidité de 10%. Pour chaque parcelle, 100 graines sans coque ont été aussi séchées et pesées afin de connaitre le poids de 100 graines de chaque variété et le rendement en grains.
28Le logiciel statistique R version 3.0.3 a été utilisé pour l'analyse des données. Une classification a été faite en se basant sur les données d'analyse d'incidence et de sévérité moyennes par site afin d'établir la carte de distribution de la cercosporiose au Bénin.
29Incidence: Classe 1: 0-15%, Classe 2: 15-35%, Classe 3: 35-55 %, Classe 4 :> 55%
30Sévérité : Classe 1 : 0-5%, Classe 2 : 5-15%, Classe 3 : 15-30%, Classe 4 : 30-45%, Classe 5 : > 45%.
31Le test de Tukey a été utilisé pour comparer les moyennes entre les valeurs d'incidence et de sévérités entre les sites et les zones agroécologiques (p ≤ 0,05). Les valeurs des tableaux sont les moyennes réelles avec leurs erreurs standards. Une classification ascendante hiérarchique a été effectuée à partir des données de sévérités et de rendement des variétés.
Résultats
Incidence et sévérité dans les zones de production et les communes de prospection
32Les valeurs d'incidence et de sévérité sont significativement différentes d'une commune prospectée à l'autre (p= 0,00). L'incidence varie de 53,33 à 100% et la sévérité varie de 18,33 à 95,43% (Tableau 1). Une différence significative a été observée entre les zones agroécologiques prospectées en termes d'incidence (p =0,00) et de sévérité (p= 0,00). Les valeurs d'incidence varient de 86,80 à 94,02% alors que celle de la sévérité varie de 32,48 à 56,62%. La savane sud guinéenne a enregistré une incidence moyenne de 94,02% et une sévérité moyenne de 45,01% alors que la savane côtière a enregistré une incidence moyenne de 90,02% et une de sévérité moyenne 56,62%. Les savanes nord guinéenne et soudanienne suivent respectivement avec des valeurs d'incidence de 87,14% et 86,80% et des sévérités de 32,48% et 37,22% (Tableau 1).
Tableau 1 : Incidence et sévérité moyennes par zone agroécologique en 2016.
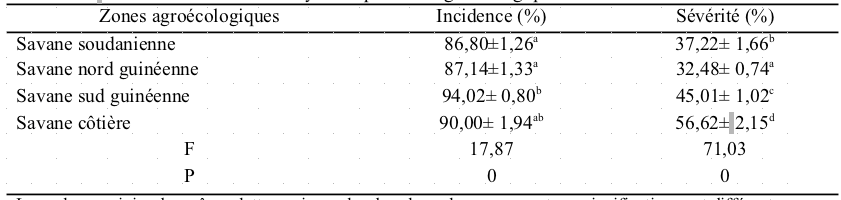 Les valeurs suivies des mêmes lettres minuscules dans les colonnes ne sont pas significativement différentes au seuil de 5% selon le test de Tukey.
Les valeurs suivies des mêmes lettres minuscules dans les colonnes ne sont pas significativement différentes au seuil de 5% selon le test de Tukey.
Incidence et sévérité moyennes par site prospecté
33Les cercosporioses étaient présentes sur les 72 sites prospectés dans les zones agroécologiques du Bénin. Les symptômes développés ont été regroupés en quatre classes d'incidence et en cinq classes de sévérité (Figures 2 et 3). Les valeurs d'incidences extrêmes de la cercosporiose (100%) ont été observées sur 42 sites répartis dans toutes les zones agroécologiques (7 sites sur 21 dans la savane soudanienne, 12 sites sur 17 dans la savane nord guinéenne, 16 sites sur 26 dans la savane sud guinéenne et 7 sites sur 8 dans la savane côtière). Les valeurs extrêmes de la sévérité (Classe 5 : > 45%) ont été observées sur 2 des 21 sites de la savane soudanienne, sur 3 des 17 sites dans la savane nord guinéenne, sur 5 des 26 sites dans la savane sud guinéenne et sur 2 des 8 sites de la savane côtière.
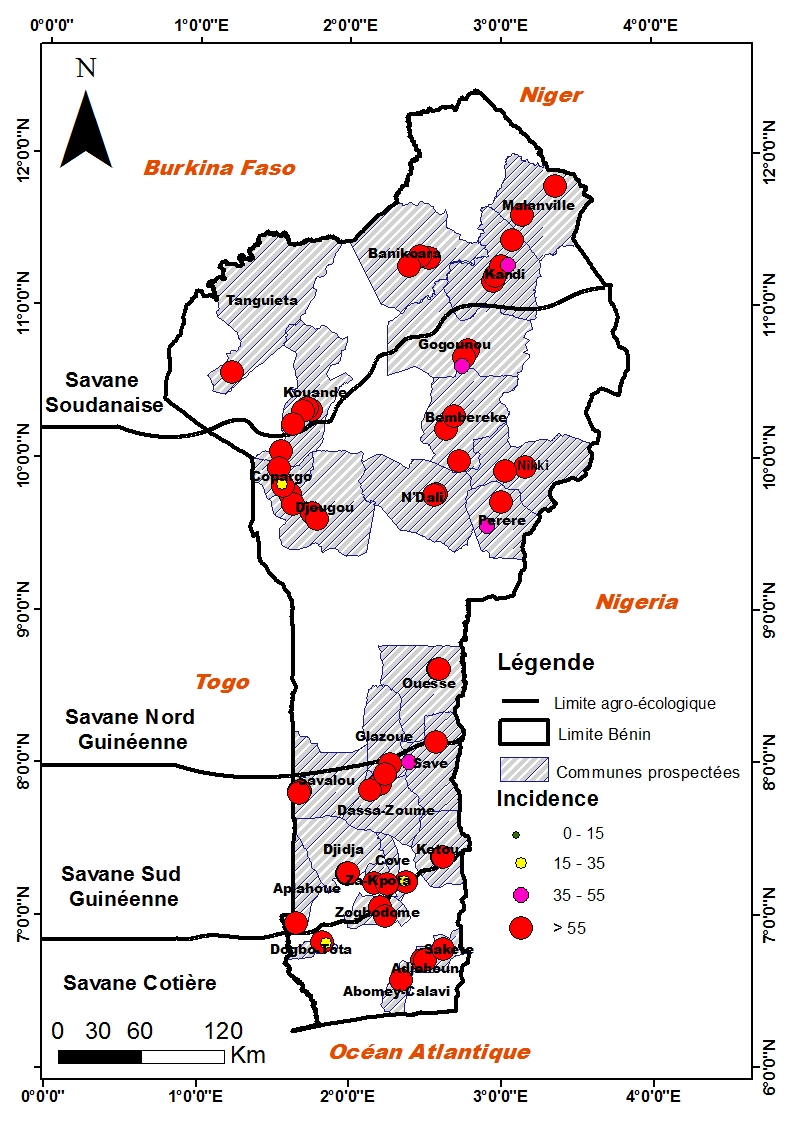 Figure 2 : Carte de distribution des incidences des cercosporioses de l'arachide en 2016.
Figure 2 : Carte de distribution des incidences des cercosporioses de l'arachide en 2016.
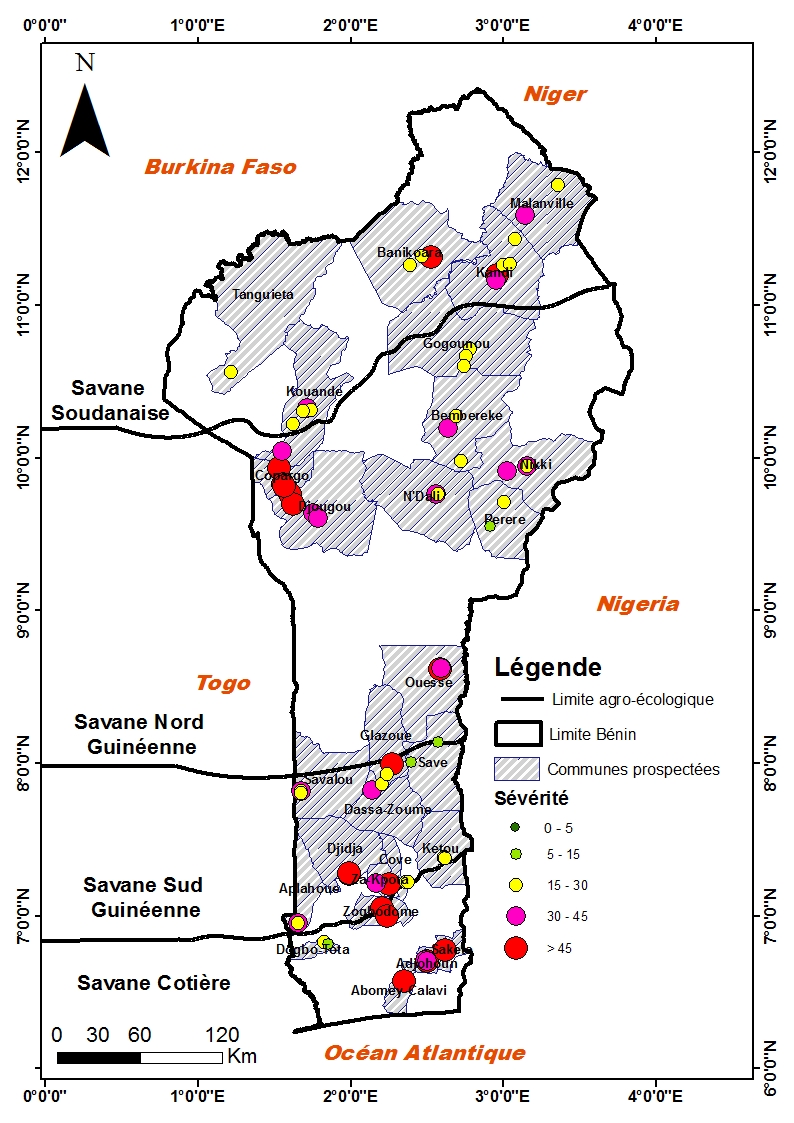 Figure 3 : Carte de distribution des sévérités des cercosporioses de l'arachide en 2016.
Figure 3 : Carte de distribution des sévérités des cercosporioses de l'arachide en 2016.
Virulence des isolats de Cercosporidium personatum
34Les quatre isolats utilisés ont développé des symptômes sur la variété d'arachide Moto Locale mais les valeurs de AUSPC observées ne sont significativement différentes au niveau des isolats (P=0,286) (Tableau 2).
Tableau 2 : Moyenne des sévérités (AUSPC) par isolat.
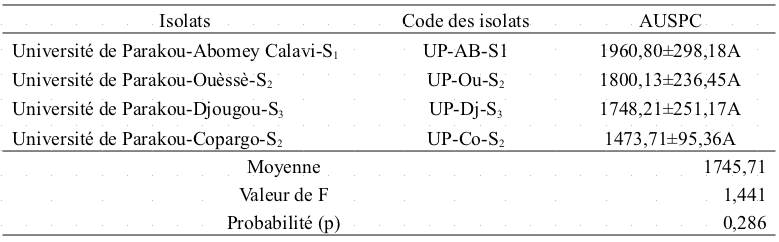 Les valeurs suivies des mêmes lettres minuscules ne sont pas significativement différentes au seuil de 5% selon le test de Tukey.
Les valeurs suivies des mêmes lettres minuscules ne sont pas significativement différentes au seuil de 5% selon le test de Tukey.
Sévérité des variétés à l'infection artificielle par trois isolats en serre
35Les valeurs des AUSPC observées sur les variétés testées pour l'isolat UP-Co-S2 sont significativement différent (p = 0,017) et ont varié de 894,44 à 1652,77 (Tableau 3). Pour l'isolat UP-Ou-S2, les valeurs des AUSPC observées sur les variétés n'ont pas significativement varié (p = 0,254), allant de 1147,22 à 2041,66. L'isolat UP-Dj-S3 a eu un effet significatif sur les variétés (p =0,011) et les valeurs d'AUSPC vont respectivement de 1023,75 à 2041,66. Les isolats UP-Ou-S2 et UP-Dj-S3 sont donc les plus virulents avec des AUSPC moyens respectives de 1562,93 et 1562,44.
36Les variétés PC-79-79, AZI Moto, 55-33, Moto Locale et SRV 1-19 ont montré une sensibilité plus élevé à l'isolat UP-Ou-S2 (1750, 1808,33, 1944,44, 1963,88 et 2041,66), mais les variétés 73-9-11 et H 75-0 ont développé moins de sévérité après l'inoculation (1147,22 et 1205,55). Aussi, les variétés AZI Moto, 55-33, SRV 1-19, TS 32-1 et 73.28 ont montré une sensibilité à l'isolat UP-Dj-S3, alors que les variétés 57-313 et H 75-0 ont développé une moindre valeur de sévérité après inoculation (1023,75 et 1114,55). Toutes les autres variétés ont développé moins de symptômes à l'isolat UP-Co-S2, cependant, il est à remarquer que la variété Moto Locale a développé une sévérité élevée (1652,77) à cet isolat. Bien que les isolats UP-Co-S et UP-Ou-S soit virulents, la variété H 75-0 s'est révélée résistante à ces deux isolats.
Tableau 3 : Sévérité (AUSPC) de 14 variétés d'arachide soumises à l'infection artificielle par trois isolats de C. personatum en serre.
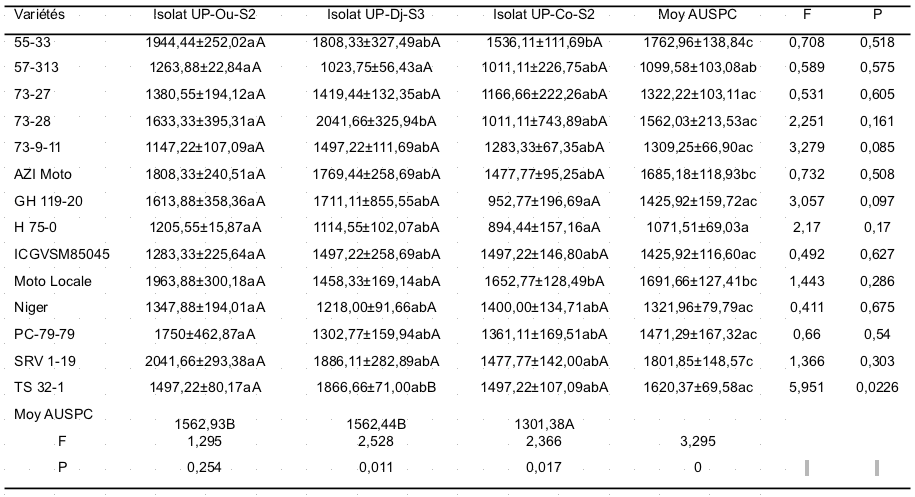 UP : Université de Parakou, Ou : Ouèssè, Dj : Djougou, Co : Copargo, S : Site
UP : Université de Parakou, Ou : Ouèssè, Dj : Djougou, Co : Copargo, S : Site
37Les valeurs suivies de mêmes lettres minuscules en colonne et celles suivies de mêmes lettres majuscules dans les lignes ne sont pas significativement différentes au seuil de 5%
38En sommes les variétés testées se répartissent en quatre groupes (sensible, moyennement sensible, moyennement résistant et résistant). Le groupe des variétés sensibles a un AUSPC moyen ≥ 1550 et le groupe des variétés moyennement sensibles a un AUSPC moyen compris entre 1400 et 1550 (1400 ≤ AUSPC moyen <1550). Le groupe de variétés moyennement résistantes a un AUSPC moyen compris entre 1100 et 1400 (1100 ≤ AUSPC moyen < 1400) et le groupe de variétés résistantes a un AUSPC moyen < 1100 (Tableau 3). Ainsi, les variétés H 75-0 et 57-313 appartiennent au groupe des variétés résistantes aux trois isolats et les variétés 73-27, 73-9-11 et Niger appartiennent à celui des variétés moyennement résistantes. Les variétés moyennement sensibles sont composées des variétés GH 119-20, ICGVSM85045 et PC-79-79 et les variétés sensibles regroupent les variétés 55-33, 73-28, AZI Moto, Moto Locale, SRV 1-19 et TS 32-1 (Figure 4).
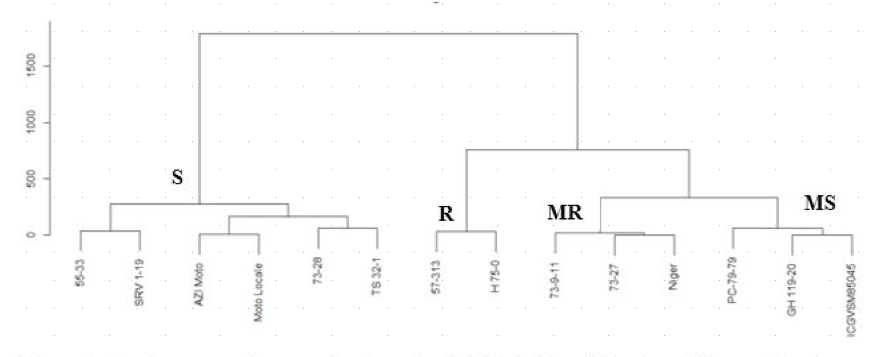 Figure 4 : Dendogramme illustrant le niveau de sévérité de 14 variétés d'arachide soumises à l'infection artificielle par trois isolats de C. personatum en serre.
Figure 4 : Dendogramme illustrant le niveau de sévérité de 14 variétés d'arachide soumises à l'infection artificielle par trois isolats de C. personatum en serre.
S : Sensible ; MS : Moyennement Sensible ; R : Résistantes ; MR : Moyennement résistantes
Sévérité des variétés à l'infection naturelle de Cercospora spp. au champ
39L'analyse de variance de l'AUSPC montre une différence significative entre les variétés en 2015 et 2016 (Tableau 4). La sévérité (AUSPC) varie de 1624,01 à 2585,11 en 2015 et de 1931,64 à 2702,16 en 2016. Les plus faibles valeurs de sévérité ont été observées sur les variétés suivantes : H.75.0, 57.313, 73.27, Niger, 73.28 et PC-79.79. Les plus fortes valeurs de sévérité ont été observées sur les variétés suivantes: SRV.1.19, 73.9.11, ICGVSM.85045 55.33, TS-32.1, GH-11920, AZI Moto et Moto locale.
Tableau 4 : Sévérité (AUSPC) de 14 variétés d'arachide sous infection naturelle de Cercospora spp. en 2015 et 2016.
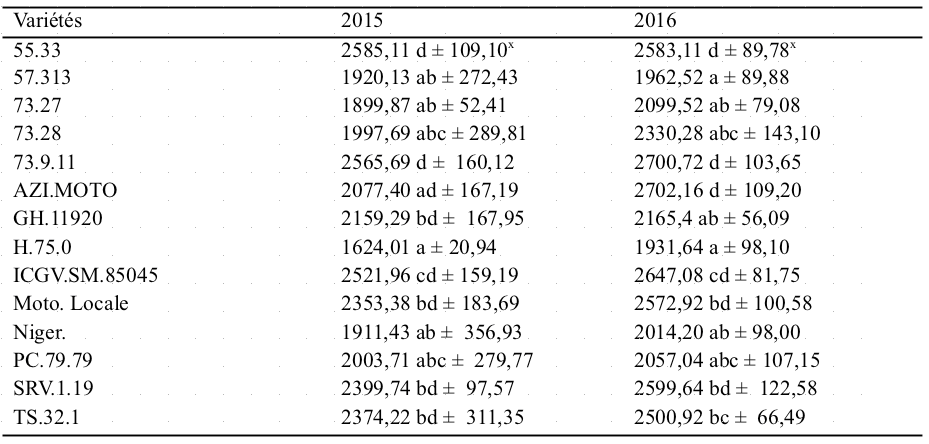 X : Moyenne ± écart, Les moyennes des sévérités affectées des mêmes lettres ne sont pas
X : Moyenne ± écart, Les moyennes des sévérités affectées des mêmes lettres ne sont pas
significativement différentes au seuil de 5%.
40Le regroupement des variétés en fonction des sévérités (AUSPC) nous donne cinq (5) groupes (sensible, moyennement sensible, moyennement résistant et résistant). Le groupe des variétés sensibles a un AUSPC moyen ≥ 2200 et le groupe des variétés moyennement sensibles a un AUSPC moyen compris entre 2000 et 2200 (2000 ≤ AUSPC moyen <2200). Le groupe de variétés moyennement résistantes a un AUSPC moyen compris entre 1800 et 2000 (1800 ≤ AUSPC moyen < 2000) et le groupe de variétés résistantes a un AUSPC moyen < 1800 (Tableau 5). Suite à l'inoculation en serre, 6 variétés (55.33, 73.28, AZI.MOTO, Moto Locale, SRV.1.19, TS.32.1) sont sensibles, 3 variétés sont moyennement sensibles (GH.11920, ICGV.SM.85045, PC.79.79), 3 variétés sont moyennement résistantes (73.27, 73.9.11, Niger) et 2 variétés sont résistantes (H.75.0, 57.313).
Tableau 5 : Réaction de 14 variétés d'arachide à la cercosporiose sous infection au champ et sous serre.
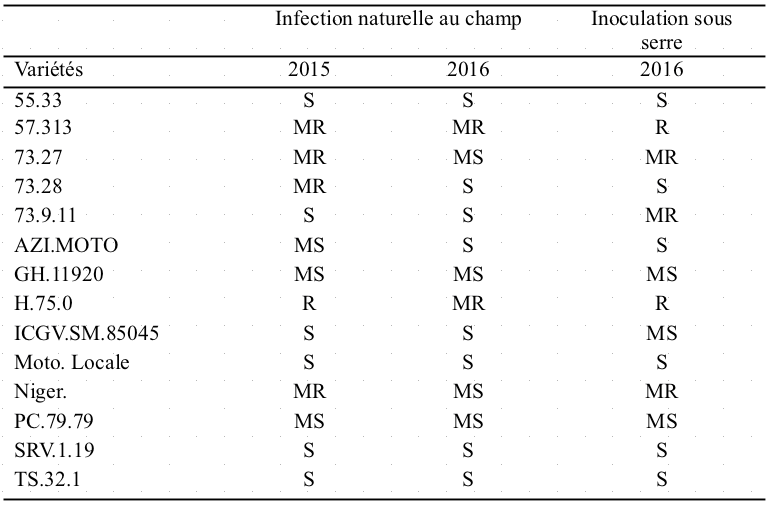 S: Sensible; MS: Moyennement sensible; MR: Moyennement résistant; R: Résistant
S: Sensible; MS: Moyennement sensible; MR: Moyennement résistant; R: Résistant
Evaluation du rendement en grains des variétés sous infection naturelle
41Le rendement en grain varie de 0,83 t/ha (GH.11920) à 2,99 t/ha (TS.32.1) en 2015. En 2016, le rendement est passé de 1,01 t/ha (GH.11920) à 3,45 t/ha (73.9.11) (Tableau 6). Ainsi les variétés pourraient être regroupées en groupe de variétés à faibles rendements Rf< 1,3t/ha (GH.11920, 73.27, 73.28) ; groupe de variétés à rendements moyens 1,3t/ha ≤ RM < 1,90t/ha (55.33, Niger, 57.313, SRV.1.19, AZI.MOTO, ICGV.SM.85045, Moto. Locale); groupe des variétés à rendements élevés 1,90t/ha ≤ RE< 2,85 t/ha (PC.79.79, H.75.0); et en groupe des variétés à rendements très élevés RTE ≥ 2,85t/ha (TS.32.1, 73.9.11) (Figure 5). Aucune corrélation n'a été trouvée entre la sévérité (AUSPC) et le rendement sous infection naturelle en 2015 (r=0,21 ; p=0,46) et en 2016 (r=0,33 ; p=0,25).
Tableau 6 : Rendement des variétés à l'infection naturelle de Cercospora spp. au champ.
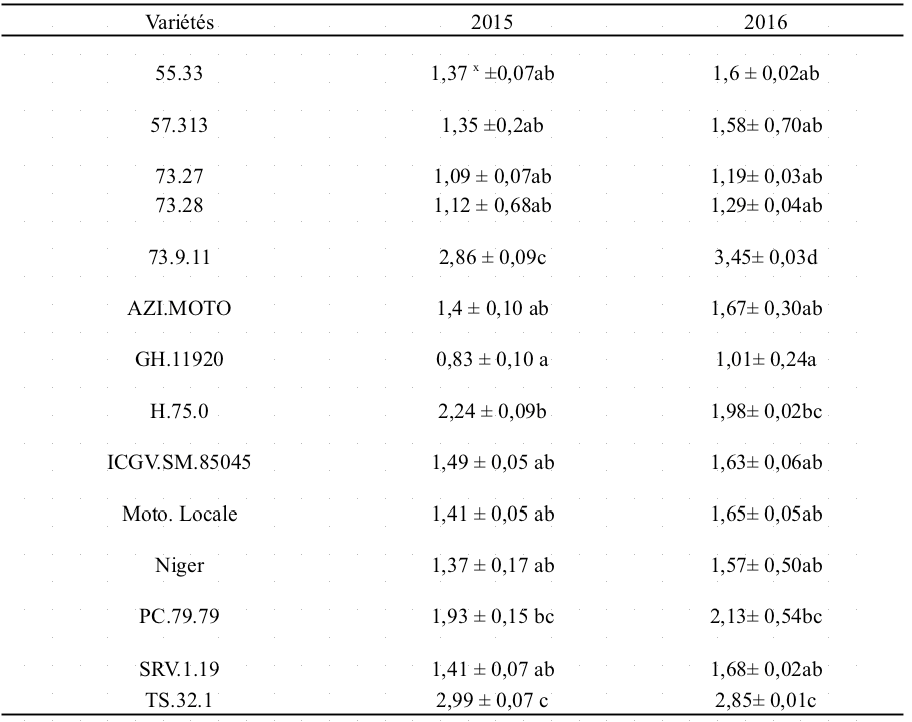 X : Moyenne ± écart, Les moyennes de rendement affectées des mêmes lettres ne sont pas significativement différentes au seuil de 5%.
X : Moyenne ± écart, Les moyennes de rendement affectées des mêmes lettres ne sont pas significativement différentes au seuil de 5%.
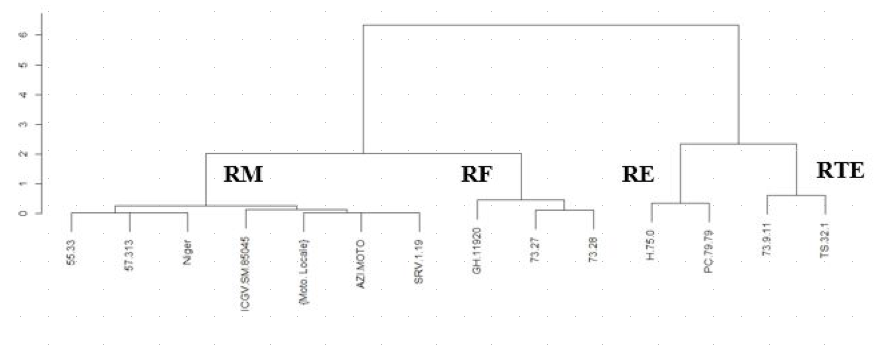 Figure 5 : Dendogra illustrant le niveau de rendement de 14 variétés d'arachide soumises à l'infection naturelle par cercosporioses.
Figure 5 : Dendogra illustrant le niveau de rendement de 14 variétés d'arachide soumises à l'infection naturelle par cercosporioses.
RF : Rendement Faible ; RM : Rendement Moyen ; RE : Rendement Elevé ; RTE : Rendement Très Elevé
Discussion
42L'incidence moyenne ainsi que la sévérité a varié d'une zone agroécologique à une autre. L'incidence à varié de 86,80% à 94,02%, avec une sévérité allant de 32,48% à 56,62%ce qui montre que la cercosporiose est une importante maladie de l'arachide au Bénin. Les plus grandes valeurs d'incidence ont été obtenues dans la savane sud guinéenne accompagnée d'une sévérité moyenne de 45,01%. On a enregistré la plus forte valeur de sévérité dans savane côtière 56,62%. Ceci signifie que la savane côtière et la savane sud guinéenne font partie des zones les plus vulnérables aux cercosporioses de l'arachide. Cela pourrait s'expliquer soit par les conditions climatiques qui règnent sur les sites, soit aux variétés cultivées dans ces régions, soit enfin à la virulence des souches de chaque zone. En effet, les facteurs climatiques tels que la pluie et la température influencent l'expression de la maladie (38). Plusieurs auteurs (25, 33) ont montré que les périodes prolongées d'humidité et l'humidité des feuilles favorisent la sporulation qui engendre le développement de la cercosporiose. Falconer (10) a montré que la diversité des réactions obtenues sous différents environnements de variétés est due aux réponses différentielles d'un même groupe de gènes ou à l'expression de différents groupes de gènes. Bai et Shaner (2) ont également mentionné qu'un cultivar avec une résistance adéquate dans une localité pourrait être sensible sous un autre environnement.
43La virulence du champignon sur les sites serait également due à certains facteurs génétiques de l'isolat, soit à différents déterminants génétiques qui sont régulés par les gènes essentiels pour la pathogenèse. Selon certains auteurs certaines toxines comme la cercosporine produite par les espèces de Cercospora contribuent à la virulence des isolats (9, 37). D'autres toxines comme le dothistromine et l'averufine produites en grande quantité joueraient un rôle dans le développement des nécroses (28, 37).
44Quatorze variétés d'arachide sont soumises à une inoculation artificielle en serre en 2016 et une infection naturelle en 2015 et en 2016 pour évaluer leur réaction à la cercosporiose.
45Suite à l'inoculation artificielle en serre, 6 variétés sont sensibles, 3 variétés sont moyennement sensibles, 3 variétés sont moyennement résistantes et 2 variétés sont résistantes. La variabilité du comportement observée au sein des variétés d'arachide peut s'expliquer par les caractéristiques génétiques de chaque variété et l'habileté du pathogène à surmonter les conditions environnementales spécifiques de l'hôte et à l'expression des gènes de virulence (20).
46Les variétés 55.33, 73.28, AZI.MOTO, Moto Locale, SRV.1.19, TS.32.1) sensibles à l'inoculation en serre sont sensibles, moyennement sensibles et moyennement résistantes au champ en 2015 et 2016. Ceci pourrait être dû au fait que certaines variétés avec une résistance adéquate dans une zone pourraient devenir sensible dans une autre. Waliyar et al. (39) ont rapporté que les cultivars commerciaux varient selon leur sensibilité aux cercosporioses précoce et tardive. Les mêmes variations et réactions de l'arachide à la cercosporiose ont été rapportées par (14, 17, 38). Cette fluctuation de la sévérité au champ pourrait aussi être due aux conditions expérimentales. Génétiquement la cercosporiose est une maladie quantitative contrôlée par plusieurs gènes de résistance. Ainsi des réactions différentes à la cercosporiose dans différents environnement pourraient être observées. Les 2 variétés résistantes (H.75.0, 57.313) à l'inoculation sous serre sont moyennement résistantes à résistantes au champ. La résistance par la plante aux pathogènes de la cercosporiose a été attribuée à plusieurs caractères morphologique et anatomique de la plante hôte et à différents composants chimiques des feuilles et des graines. Ceci peut être dû à la capacité à produire des substances phénologiques qui peuvent inhiber la germination des spores et les fonctions microbiennes toxiques des pathogènes (16). La variété H 75.0 a été plus résistante aux symptômes en développant de petites lésions. Chiteka et al. (5) ont rapporté que les variétés résistantes ont de petites lésions, de longues périodes de latence et une sporulation réduite. L'étude anatomique des folioles de plusieurs variétés mettant en évidence des différences nettes dans l'épaisseur du parenchyme assimilateur montre que la vitesse de propagation du parasite serait plus lente à travers les feuilles plus épaisses, ce qui expliquerait partiellement l'apparition plus tardive des lésions chez certaines variétés. La pénétration de Cercospora dans les feuilles n'est possible que par des stomates ayant un diamètre supérieur à 13,4 µm et elle n'est fréquente que par des stomates de 16,7 µm et plus.
47Le rendement en grain varie de 0,83 t/ha (GH.11920) à 2,99 t/ha (TS.32.1) en 2015. En 2016, le rendement a varié de 1,01 t/ha (GH.11920) à 3,45 t/ha (73.9.11). Cette gamme de rendements rend bien compte de la diversité de réactions des variétés dans les conditions de culture. Le faible rendement en gousses de certaines variétés suggère en fait de mauvaises conditions de maturation d'ordre climatique notamment en ce qui concerne la période de forte floraison, elle n'a pas coïncidé avec la période de floraison utile. La forte floraison est intervenue plus tard; ainsi les gousses formées n'ont pas eu le temps de mûrir. De plus, des fleurs émises par une plante, la proportion de fleurs produisant des gynophores et des fruits est réduite, de l'ordre du dixième, et variable dans le temps (6). Ce sont les variétés caractérisées par une floraison précoce et groupée qui donnent souvent de meilleurs rendements en gousses (8). Les variétés 73.9.11 57.313 et H.75.0 moyennement résistantes à résistantes sous inoculation et infection naturelle ont des rendements moyens à très élevés. La variété TS 32.1 sensible est à rendement très élevé. Aussi, Aucune corrélation n'a été trouvée entre la sévérité (AUSPC) et le rendement sous infection naturelle au cours des deux années. Ces résultats sont contraires à ceux de (26). Selon l'auteur, les cercosporioses causent de dommages aux plantes par la réduction de la surface photosynthétique à travers la formation des lésions, l'accroissement du nombre et de la surface des lésions ainsi que la chute des folioles atteintes. Il en résulte une diminution du rendement en gousses, un abaissement du poids des graines et de leur teneur en huile.
Conclusion
48Les cercosporioses sont des maladies importantes inféodées à l'arachide au Bénin. La savane côtière et la savane sud guinéenne sont plus vulnérables aux cercosporioses de l'arachide. Les variétés 73.9.11 57.313 et H.75.0 moyennement résistantes à résistantes sous inoculation et infection naturelle ont des rendements moyens à très élevés. Ces variétés pourront être recommandées aux producteurs dans la perspective d'amélioration de la production d'arachide.
Remerciements
49Les auteurs remercient le Dr Hountondji Yvon et M. Kocou Justo Amédé pour la réalisation des cartes de distribution de la cercosporiose.
Bibliographie
-
Azontonde A., 1991, Propriétés physiques et hydrauliques des sols au Bénin, Proceedings of the Niamey Workshop, February 1991, IAHS Publ. no. 199.
-
Bai G. & Shaner G., 1994, Scab of wheat: prospects for control, Plant Dis., 78, 760-766.
-
Bijlmakers H.W.L. & Verhoek B.A., 1995, Guide de défense des cultures au Tchad «Cultures Vivrières et Maraîchères». Projet FAO/PNUD CHD/88/001 Food and Agriculture Organization of the United Nations Rome, 414 p.
-
Blizoua bi P.Z. & Djan N.V., 1995, Pertes de rendement chez l'arachide dues à un déficit hydrique en relation avec la cercosporiose tardive (Cercosporidium personatum) en Côte d'Ivoire, Cah. Agric., 4, 307-310.
-
Chiteka Z.A., Gorbet W.A., Shokes F.M., Kucharek T.A. & Knauft D.A., 1988, Components of resistance to late leaf spot in peanut. I. Levels and variability- Implications for selection, Peanut Sci., 15, 25-30.
-
Clavel D., & Gautreau J., 2001, Groundnut. In: Tropical Plant Breeding, CIRAD et Science Publishers Inc (Ed.), Plymouth, pp. 246-266.
-
Cooke B.M., Jones D.G. & Kaye B., 2005, Disease assessment and yield loss, In: The epidemiology of plant diseases, 2nd Edition, Springer, Netherlands, 43-80 p.
-
Doikh N.L., 2001, Evaluation Agronomique des variétés d'arachide de bouche à Nioro DU RIP (Centre Sud du Bassin Arachidier), Ecole Nationale des Cadres Ruraux B(ENCR) de BAMBEY, 42 p.
-
Fajola A.O., 1978, Cercosporin, a phytotoxin from Cercospora spp, Physiol. Plant. Pathol. 13, 157-164.
-
Falconer D.S., 1990, Selection in different environments: effects on environmental sensitivity (reaction norm) and on mean performance, J. Genet., 56, 57-70.
-
Frangoie N., Tata H. & Mahungu N.M., 2012, Module III : Les systèmes de production et de gestion des principales cultures vivrières, Manuel destiné aux Producteurs (IITA), 44 p.
-
Fontem D. A., Iroume R.-N. & Aloleko F., 1996, Effets de la résistance variétale et des traitements fongicides sur la cercosporiose de l'arachide, Cah. Agric., 5, 33-38.
-
Hagan A.K., Campbell H. L., Bowen K.L. & Pegues M., 2006, Evaluation of calendar and AU-Peanuts fungicide schedules for the control of late leaf spot and rust on peanut in southern Alabama, Alabama Agric. Exper. St. Bull., 663, 5 p.
-
Izge A.U., Mohammed Z.H. & Goni A., 2007, Levels of variability in groundnut (Arachis hypogaea L.) to cercospora leaf spot disease-Implication for selection, Afr. J. Agric. Res., 2, 182-186.
-
Jeger M.J. & Viljanen-Rollinson L.H., 2001, The use of the area under the disease progress curve (AUDPC) to assess quantitative disease resistance in crop cultivars, Theor. Appl. Genet., 102, 32-40.
-
Kalaichelvan P.T., 1980, Prohibitins in groundnut (Arachis hypogaea), Ph.D. Thesis, University of Madras.
-
Knauft D.A. & Gorbet D.W., 1990, Variability In Growth Characteristics And Leaf Spot Resistance Parameters of Peanut Lines, Crop Sci., 10, 1, 169- 175.
-
MAEP 2010, Ministère de l'Agriculture de l'Elevage et de la Pêche: Annuaire Statistiques Production Agricole 2008 à 2009.
-
McDonald D., Subrahmanyam P., Gibbons R. W. & Smith D.H.,1985, Les cercosporioses précoce et tardive de l'arachide, Information Bulletin no. 21. 28 p, Patanchem 502-324. International Crops Research Institute for the Semi-Arid Tropics.
-
Mekanalos J.J., 1992, Enviromental signal controlling expression of virulence determinants in bacteria, J. Bacteriol., 174, 1-7.
-
Mohammed Z. H., 2004. Evaluation of groundnut varieties for resistance to cercospora leaf spot in the sudan savanna of Nigeria, M.Sc. Thesis, The Department of Crop Protection, University of Maiduguri, Nigeria, 77 p.
-
Mukerji Rajeev K.G., Upadhyay H.O., Chamola B.P. & Dueby P., 2009, Integrated Pest And Disease Management. APH Publishing, Pp.710, ISBN 8131304752, 9788131304754.
-
N'Doye O., 1992, Le point de la recherche sur les cercosporioses de l'arachide au Sénégal. NIORO-DU-RIP 12 p.
-
Nutsugah S.K., Abudulai M., Oti-Boating R.L. & Bradenburg D.L., Jordan, 2007, Management of leaf spot disease of groundnut with fungicides and local detergents in Ghana, Plant Pathology. J., 6, 248-253.
-
Nutter F.W.Jr. & Shokes F.M., 1995, Management of foliar diseases caused by fungi. Peanut Health Management. Am. Phytopathol. Soc., 65-73.
-
Padwick G.W., 1956, Losses caused by Plant Diseases in the Tropics. Commonwealth Mycological Institute Kew, Surrey, Phytopathol. Papers, 1, 60 p.
-
PROTA 14, 2007, Ressources végétales de l'Afrique tropicale, vol. 14, Oléagineux. éd, par H.A.M. van der Vossen & G.S. Mkamilo, Wageningen, Fondation PROTA - Backhuys - CTA, 261 p.
-
Shabana B. S., Venkatappa B., Reddy H. & Nageswari, 2013, Variation in pigment production by Cercospora personata, Int. J. Appl. Biol. Pharmac. Techn. 4, 3, 147-157.
-
Shapshi Bdliya B, & Karabi Gwio-Kura K., 2007, Efficacy of some fungicides in the management of cercospora leaf spot of groundnut in the sudan savanna of Nigeria, J. Plant Prot. Res., 47, 3, 243-253.
-
Shaner G. & Finney R.E., 1977, The effect of nitrogen fertilization on the expression of slow-mildewing resistance in Knox wheat, Phytopathology, 67, 1051-1056.
-
Shokes F.M. & Culbreath A.K., 1997, Early and late leaf spots, In: "Compendium of Peanut Diseases" (Kokalis-Burell N., Porter D.M., Rodriguez-Kabana R., Smith D.H. & Subrahmanyam P., eds.). 2nd ed, The APS Press, St. Paul, 17-20.
-
Singh A.K., Mehan V.K. & Nigam S., 1997, Sources of resistance to groundnut fungal and bacterial diseases: an update and appraisal, ICRISAT.50, 52 p.
-
Smith D.H., Pauer G.D.C. & Shokes F.M., 1992, Plant disease of international importance, Diseases of vegetables and oil seed, 232 p.
-
Subrahmanyam P., Mehan V.K., Nevil D.J. &McDonald D., 1980, Research on fungal diseases of groundnutat ICRISAT, In: "Proccedings of International Workshop on Groundnut", ICRISAT, Patencheru, India, 193-198.
-
Subrahmanyam P., McDonald D., Waliyar F., JReddy L., Nigam S. N., Gibbons R .W., Ramanatha Rao V., Singh A. K., Pande S., Reddy P. M. & Subba Rao P. V., 1995, Screening Methods and Sources of Resistance to Rust and Late Leaf Spot of Groundnut, International Crops Research Institute for the Semi-Arid Tropics, Patanchem 502-324, Information Bulletin no. 47. 26 p.
-
Subrahmanyam P., Wongkaew S., Reddy D. V. R., Demski J. W., McDonald D., Sharma S. B. & Smith D. H., 2012, Field diagnosis of groundnut diseases, Information Bulletin no. 36 (revised), Patancheru A.P. 502-324, India: International Crops Research Institute for the Semi-Arid Tropics, 88 p.
-
Stoessl A., 1984, Structure and biogenetic relations: Fungal: Non-host specific, In: Toxins plant disease (ed) R. D. Durbin, Academic Press, 109-219.
-
Tshilenge L., 2010, Pathosystem Groundnut (Arachis hypogaea L.), Cercospora spp. and Environment in DR-Congo: Overtime Interrelations," In: K.K.C. Nkongolo, Ed., Contribution to Food Security and Malnutrition in DR Congo, Laurentian Press, 195-221.
-
Waliyar F., Shew B.B., Sidahmed R. & Beute M.K, 1995, Effects of host resistance on germination of Cercospora arachidicola on peanut leaf surfaces, Peanut Sc. 22, 154-157.
-
Watanabe T., 1994, Pictorial atlas of soil and seed fungi, CRC Press, Inc, 411p
-
Zinsou V., Wydra K., Ahohouendo B. & Hau B., 2005, Genotype environment interactions insymptom development and yield of cassava genotypes with artificial and natural cassava bacterial blight infections, Eur. J. Plant Pathol., 111, 217-233.
Pour citer cet article
A propos de : V.A. Zinsou
Béninois, PhD, Université de Parakou, Phytopathologiste et Vice-Doyen de la Faculté d'Agronomie, Parakou, Bénin. email: valzinsou@gmail.com ; valerien.zinsou@fa-up.bj
A propos de : L. Garba Say
Béninois, MSc, Université de Parakou, Assistant de recherche, Faculté d'Agronomie, Bénin.
A propos de : A. Fanou
Béninois, PhD, Université de Parakou, Phytopathologiste et Chef adjoint de département de production végétale de la Faculté d'Agronomie, Bénin.
A propos de : E. Sekloka
Béninois, PhD, Université de Parakou, Généticien Sélectionneur et Chef de département de production végétale de la Faculté d'Agronomie, Bénin.
A propos de : C. Koussinou
Béninois, MSc, Université de Parakou, Assistante de recherche, Faculté d'Agronomie, Bénin.
A propos de : A.J. Djenontin
Béninois, PhD, Université de Parakou, Système de production, Faculté d'Agronomie, Bénin.
A propos de : A. Aweha
Béninois, MSc, Université de Parakou, Assistant de recherche, Faculté d'Agronomie, Bénin.
A propos de : M. Dramane
Béninois, MSc, Université de Parakou, Assistant de recherche, Faculté d'Agronomie, Bénin.
A propos de : C. Korogone
Béninois, BSc, Université de Parakou, Assistante de recherche, Faculté d'Agronomie, Bénin.
A propos de : F. Gagnon
Béninois, BSc, Université de Parakou, Assistant de recherche, Faculté d'Agronomie, Bénin.