- Accueil
- volume 38 (2020)
- Numéro 3-4
- Variations spatio-temporelles de l’abondance des nauplii de copépodes dans les lagunes côtières tropicales en relation avec les variables environnementales : cas des lagunes de la Côte d’Ivoire
Visualisation(s): 1963 (6 ULiège)
Téléchargement(s): 0 (0 ULiège)
Variations spatio-temporelles de l’abondance des nauplii de copépodes dans les lagunes côtières tropicales en relation avec les variables environnementales : cas des lagunes de la Côte d’Ivoire

Résumé
Les nauplii de copépodes sont abondants dans les milieux aquatiques en zone tropicale et présentent des caractéristiques biochimiques et physiques intéressantes qui font d’eux, une bonne alternative et/ou un supplément de nourriture pour les larves de poissons. Tous les facteurs environnementaux gouvernant leur variation peuvent avoir un impact sur le succès de reproduction et le développement de ces larves de poissons. Ce travail vise principalement à connaître les variations spatio-temporelles de l’abondance des nauplii de copépodes dans les milieux lagunaires de Côte d’Ivoire en relation avec les paramètres physico-chimiques de ces écosystèmes saumâtres afin d’en identifier le déterminisme. Cette étude montre que l’abondance des nauplii varie significativement durant les saisons, avec les valeurs moyennes de la saison sèche (12-98 ind.l-1) supérieures à celle de la saison humide (9-88 ind.l-1). Nos résultats montrent également qu’au niveau des lagunes de Grand-Lahou et de Fresco, les abondances les plus faibles ont été enregistrées au niveau de la zone de communication entre la lagune et la mer (canal) à toutes les saisons. L’étude de la corrélation entre les paramètres physico-chimiques et l’abondance des nauplii des copépodes montre que l’abondance des nauplii augmente avec la température, la conductivité, l’oxygène dissous, le nitrite, l’ammonium avec une corrélation significativement positive (Rs: 0,21-0,94 et p < 0,001). En revanche, l’abondance des nauplii montre une corrélation négative et non significative à la turbidité et au pH dans tous les milieux d’étude (Rs: -0,03 à -0,62 et p > 0,05).
Abstract
Copepod nauplii are abundant in aquatic environments in tropical areas and have interesting biochemical and physical characteristics that make them a good alternative and/or supplemental food for fish larvae. All environmental factors governing their variation can have an impact on the reproductive success and development of fish larvae. The main aim of this work is to determine the spatio-temporal variations in the abundance of copepod nauplii in the lagoon environments of Côte d'Ivoire in relation to the physico-chemical parameters of these brackish ecosystems in order to identify their determinism. This study shows that the abundance of nauplii varies significantly during the seasons, with mean values in the dry season (12-98 ind.l-1) higher than in the wet season (9-88 ind.l-1). Our results also show that in the Grand-Lahou and Fresco lagoons, the lowest abundances were recorded in the communication zone between the lagoon and the sea (channel) in all seasons. The study of the correlation between physico-chemical parameters and the abundance of nauplii of copepods shows that the abundance of nauplii increases with temperature, conductivity, dissolved oxygen, nitrite, and ammonium with a significantly positive correlation (Rs: 0.21-0.94 and p < 0.001). On the other hand, nauplii abundance shows a non-significant and negative correlation with turbidity and pH in all study media (Rs: -0.03 to -0.62 and p > 0.05).
Table des matières
Introduction
1Les poissons constituent une source de protéines importante pour de nombreuses populations humaines. Leur teneur en protéine est estimée entre 17 et 21,6 %. Cette teneur en protéine des poissons est de valeur équivalente à celles de la viande de vache (18,2 à 20,6 %), et supérieure à celle du lait de vache (3,8 %) et de l’œufs de poules (12,1-12,9 %) (20). La capture mondiale de poissons des pêcheries a été estimée à environ 93,4 millions de tonnes en 2014 tandis que la consommation moyenne annuelle de poissons par habitant dans les pays en voie de développement est estimée à 18,9 kg contre 26,8 kg dans les pays industrialisés en 2013 (21). Les statistiques mondiales sur la pêche en 2014, ont également montré qu’environ 56,6 millions de personnes dans le monde vivaient de la pêche et des produits de la pêche, avec 36 % engagés dans le secteur de la pêche en plein temps, 23 % engagés dans le secteur de la pêche en temps partiel et le reste (41 %) engagé soit comme pêcheurs occasionnels ou à statut non spécifié (21). Ces statistiques sur la pêche de 2014 indiquaient aussi que la grande majorité des poissons capturés provenait des milieux marins (≈ 87 % ; 81,5 millions de tonnes) contre ≈ 13 % et 11,9 millions de tonnes provenant des eaux douces (21). Ces observations montrent l’importance des poissons et des milieux marins dans la vie des populations humaines. Dans la reproduction et le développement des poissons, les écosystèmes côtiers, avec leur mangrove, jouent un rôle important, soit en tant que zone de ponte, de nurserie, de refuge, etc. (25, 28). Parmi ces écosystèmes, on peut citer les milieux lagunaires côtiers qui occupent 13-15 % des étendues côtières mondiales (15) et sont considérés comme des milieux très productifs. Dans le fonctionnement de ces écosystèmes lagunaires côtiers, comme dans celui de tous les écosystèmes aquatiques, le zooplancton joue un rôle capital dans le transfert de matières et d’énergie, en tant que consommateur principal du phytoplancton (production primaire) (6) et source de nourriture pour les organismes de niveau trophique supérieur, parmi lesquels les poissons (38). Parmi le zooplancton, les copépodes constituent un des groupes dominants avec environ 13 000 espèces décrites dans le monde dont la plus grande diversité observée dans les environnements marins (10186 espèces ; soit ≈ 78 % de la diversité totale) (7). Ils peuvent constituer jusqu’à 99 % de l’abondance du zooplancton total dans les milieux marins et les environnements côtiers: lagunes, estuaires, mangroves, etc. (16, 19, 24). Cette dominance numérique des copépodes dans les écosystèmes marins et côtiers fait qu’ils y jouent un rôle essentiel dans la dynamique trophique et dans le cycle biogéochimique du carbone (44). Dans le cycle de vie des copépodes, après les œufs et la phase de développement embryonnaire, suivent dans l’ordre chronologique les stades nauplii, copépodites et adultes. Au niveau des populations des copépodes, les stades naupliens constituent une fraction importante et peut contribuer jusqu’à 30 à 70 % de leur abondance totale (19, 47).
2Cette abondance des nauplii de copépodes et leur proportion sont largement sous-estimées à cause de l’utilisation des filets conventionnels de vide de maille ≥ 200 µm recommandée pour l’échantillonnage du zooplancton marin (47). Les travaux menés en Côte d’Ivoire ont permis d’obtenir une proportion moyenne des nauplii de copépodes de 48 % de l’abondance totale du zooplancton échantillonné de la lagune de Grand-Lahou au moyen d’un filet à plancton de vide de maille plus faible (64 µm) (16). Ces nauplii de copépodes entrent dans l’alimentation de beaucoup d’espèces de poissons et sont fréquemment utilisés comme proies vivantes en aquaculture en substitution à Artemia salina et les rotifères du genre Brachionus (33). Cette utilisation des nauplii des copépodes en aquaculture est liée à plusieurs raisons. En effet, les nauplii de copépodes présentent des caractéristiques biochimiques et physiques qui font d’eux, avec les stades copépodites et les adultes, une bonne alternative et/ou un supplément de nourriture pour les larves de poissons (27). En effet, les nauplii de copépodes, contiennent plus de 50 % de phospholipides (acides gras essentiels) par rapport à d'autres espèces de proies vivantes (31). En plus, dans les nauplii de copépodes récemment éclos, la teneur en lipides représentait 14 % du poids sec et la teneur en acides gras essentiels, le DHA (DocosaHexaenoic Acid), et l’EPA (EicosaPentaenoic Acid) représente respectivement 16 et 11 % des acides gras totaux. Les nauplii et copépodites de copépodes contiennent aussi plus de protéines (59-63 g/100 de matière sèche: MS) que les rotifères (37-38 g/100 de MS) et que l’Artemia (39-55 g/100 de MS). Il en est de même pour l’acide aminé taurine qui est présent avec 50-63 g/100 de MS au niveau des copépodes contre 0,7-0,8 g/100 de MS chez les rotifères et 29-59 g/100 de MS chez l’Artemia (27). Les acides gras essentiels DHA et EPA sont importants pour le développement des larves de poissons et autres organismes animaux.
3Ce sont des composantes importantes des membranes cellulaires pour le transport des lipoprotéines et qui sont impliquées dans l’édification de la structure de la membrane cellulaire. L’incorporation de ces acides gras comme composantes structurales primaires des membranes cellulaires, fournit la fluidité essentielle nécessaire au bon fonctionnement et à la signalisation des membranes biologiques (4). Une autre raison de l’intérêt de l’utilisation des nauplii de copépodes comme nourriture des poissons est liée au fait que les poissons marins principalement des régions tropicales et subtropicales n’ont pas la capacité de synthétiser les acides gras essentiels DHA et EPA, ou ont une capacité de synthèse réduite de ces acides gras, et doivent de ce fait compter sur leur alimentation pour recevoir ces éléments nutritifs essentiels (39). Enfin, les acides gras essentiels sont signalés comme importants pour la digestion optimale des lipides, pour le développement normal des larves de poissons, la survie et la croissance des larves et la tolérance aux stress environnementaux (11). Concernant la taurine, diverses études ont montré qu’elle est impliquée dans la croissance et le développement des poissons marins (22, 27). En effet, selon 22, les larves de Lepidopsetta polyxystra nourries avec des rotifères enrichis en taurine avaient 2-3 fois le poids de celles qui ont été nourries avec les rotifères non enrichis à la taurine. De plus, les copépodes renferment des antioxydants et des vitamines (C et E), et contiennent plus d’astaxanthine (141 mg/kg de MS), d’iodine (19-35 mg/kg de MS) et de zinc (120 - 714 mg/kg de MS) que chez les rotifères (respectivement 11,1 ; 1,1 – 2,6 ; et 41 - 52 mg/kg de MS) et l’Artemia (respectivement non déterminé ; 2,2-3,9 et 120-155 mg/kg de MS) (27). L’astaxanthine comme les autres antioxydants protège les acides gras essentiels de la peroxydation, et est donc bénéfique pour la santé des larves de poissons (32). Quant à l’iodine, son déficit dans l’alimentation des larves de poissons entraîne une réduction de leur croissance. Le zinc est un co-facteur nécessaire dans l'activité catalytique de plus de 300 protéines impliquées dans la croissance des larves de poissons, dans le développement, la reproduction et la vision des poissons (10). À ces différentes actions bénéfiques des nauplii de copépodes dans la croissance et le développement des larves de poissons, il faut également ajouter que leur taille (38-220 µm) fournit un spectre de dimensions plus adaptées à la largeur de la « bouche » des larves de poissons (39) et facilite donc leur ingestion. De plus, la littérature scientifique montre que les nauplii de copépodes constituent d’excellentes proies vivantes pour les larves de poissons, par le fait que leur comportement à la nage (intermittence des mouvements saccadés et périodes de repos) permet aux larves de poissons de les identifier comme proies, de stimuler une réponse d'alimentation et augmenter leur taux d’ingestion (39).
4En Côte d’Ivoire, il existe plusieurs plans d’eaux lagunaires d’une superficie totale de 1 200 km2 (13). Ces milieux lagunaires sont localisés le long de la moitié orientale de la façade maritime ivoirienne jusqu’à la frontière du Ghana et s’étirent sur près de 300 km entre les longitudes ouest 2°50’ et 5°25’. Ces écosystèmes saumâtres sont constitués de trois principales lagunes, qui sont d’Ouest en Est, la lagune de Grand-Lahou (4°51-5°11 W, 5°8-5°3 N ; 190 km2), la lagune Ebrié (5°13'15" N, 4°42'0" W; 564 km2) et le système lagunaire Aby-Ehi-Tendo (5°14'30" N, 3°13'38" W ; 424 km2) (13). À ces principaux systèmes lagunaires, il faut ajouter d’autres petites lagunes comme celle de Fresco (5°40'-5°70' N, 5°32'-5°38' W ; 17-29 km2), la lagune Kodjoboué (5°14'N ; 3° 35'W ; 8 km2), la lagune Ono (5°22'22" N, 3°33'53" W ; 400 Ha), la lagune Ouladine (5°12'26" N, 3°45'28" W ; 4,35 km2), et la lagune Hébé (5°12'13" N, 3°33'2" W ; 3,5 Km2). Dans ces principaux milieux lagunaires de Côte d’Ivoire, en dehors du système Aby-Ehi-Tendo et du secteur I (Aghien) de la lagune Ebrié où le peuplement zooplanctonique est dominé par les rotifères (1, 34), les copépodes constituent le groupe majoritaire en termes d’abondance, avec 51 à 99 % de l’abondance totale du zooplancton, dans les autres écosystèmes lagunaires (1, 5, 16, 17, 41). Au niveau de ces communautés de copépodes, les stades naupliens dominent largement par rapport aux stades copépodites et adultes: lagune de Grand-Lahou (59 % de nauplii) contre 41 % de copépodites et adultes (16), lagune Ébrié (53 % de nauplii) contre 47 % de copépodites et adultes (5), lagune de Fresco (55 % de nauplii) contre 45 % de copépodites et adultes (19). Cette dominance numérique de ces nauplii dans le peuplement zooplanctonique leur fait jouer un important rôle dans le flux de matière et d’énergie dans ces différents écosystèmes aquatiques saumâtres de Côte d’Ivoire.
5L’objectif de ce présent travail est d’étudier des variations spatio-temporelles de l’abondance des nauplii de copépodes dans les milieux lagunaires de Côte d’Ivoires en relation avec les facteurs environnementaux. Ce travail permettra d’avoir une idée des facteurs pouvant compromettre le succès de reproduction des poissons et du développement de leurs larves dans les écosystèmes côtiers comme les lagunes et les estuaires en zone tropicale et impacter le stock de poissons marins desquels les humains tirent l’essentiel de leurs besoins en protéines.
Matériel et méthode
6Les données de ce présent travail viennent d’échantillonnages réalisés au niveau des écosystèmes lagunaires de la Côte d’Ivoire : (1) lagune de Grand-Lahou (21 stations échantillonnées mensuellement de janvier à décembre 2004 ; Figure 1A), (2) lagune de Fresco (cinq stations échantillonnées mensuellement de août 2014 à juillet 2015 ; Figure 1B) et (3) lagune Ébrié (Figure 1C; secteurs 1 (lagune Aghien, cinq stations échantillonnées d’octobre 2014 à avril 2015 ; Figure 1D). Le prélèvement des différents échantillons a été réalisé avec un filet à plancton de vide de maille 64 µm. Au niveau des lagunes de Grand-Lahou et Ébrié (Secteur I : Aghien), l’échantillonnage a été fait par la réalisation de traits verticaux dans toutes les stations tandis qu’à Fresco il a été réalisé par filtration de 200 litres d’eau à cause de faible profondeur des stations visitées (< 2 m). Tous les échantillons récoltés ont été traité au rouge neutre pour faciliter l’observation des organismes au microscope optique, puis conservés dans le formaldéhyde tamponné au borax et de concentration finale 5 %. Au laboratoire, le volume de l’échantillon est ramené à 50 ml dans un bécher, puis les nauplii de copépodes (sans distinction des espèces) ont été dénombrés dans tous les échantillons à partir de sous fractions prélevées avec une pipette Eppendorf. Les résultats obtenus sont convertis en densité exprimée en nombre d’individus par litre (ind.l-1).
7Parallèlement à l’échantillonnage, les paramètres physico-chimiques des eaux lagunaires ont été mesurés in situ ou dosés plus tard au laboratoire à partir d’échantillons d’eau prélevés et conservés dans une glaciaire remplie de paillettes de glace. Ainsi, la température (°C), la salinité (‰), la conductivité à 28-30°C (µS.cm-1), la teneur en oxygène (mg.l-1), la turbidité (ntu) et le potentiel d’hydrogène (pH) de l’eau ont été mesurés in situ à l’aide d’un multi-paramètre portatif (HANNA HI 9829 ou TURO T-611). La transparence (m) de l’eau a été estimée à l’aide d’un disque de Secchi tandis que les sels nutritifs [Nitrite (µmol.l-1), nitrate (µmol.l-1), phosphate (µmol.l-1) et l’ammonium (µmol.l-1)] ont été dosés par spectrophotométrie en suivant le protocole de 45.
8L’analyse de variance à un facteur (ANOVA I) a été utilisée pour tester la significativité des variations spatiale et temporelle de la densité des nauplii de copépodes, et des paramètres physico-chimiques des eaux lagunaires. Avant l’analyse, les données ont été normalisées par transformation logarithmique log (x +1). De plus le coefficient de corrélation de Spearman (Rs) a été utilisé pour tester l’effet des paramètres physico-chimiques mesurés sur l’abondance des nauplii de copépodes. Ces différentes analyses ont été réalisées à l’aide du programme Statistica 7.1.
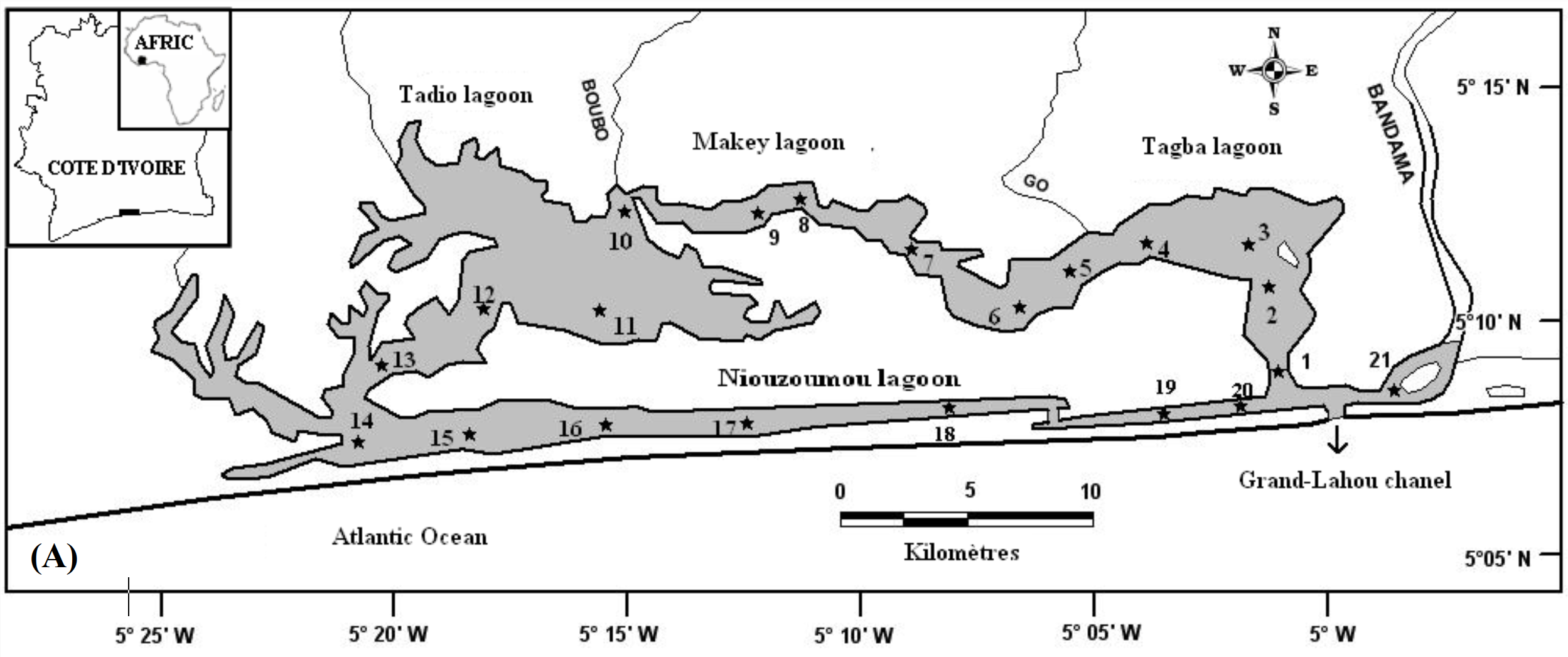
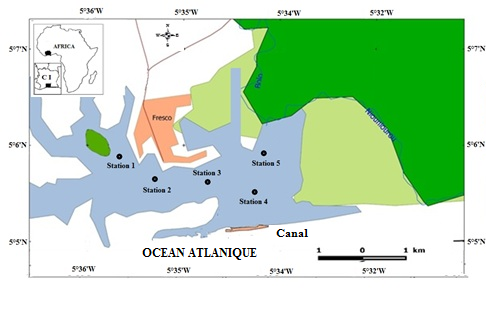
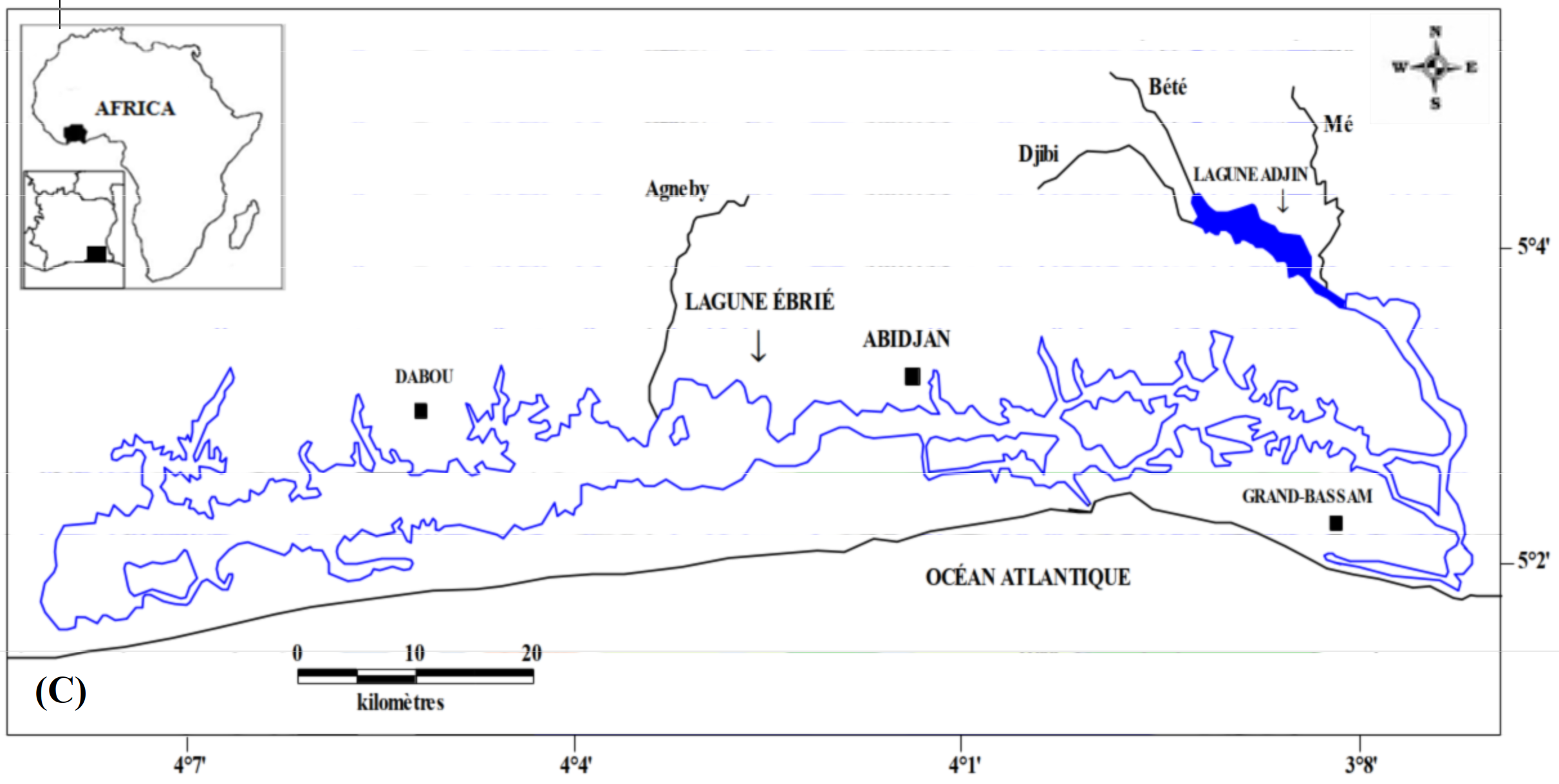
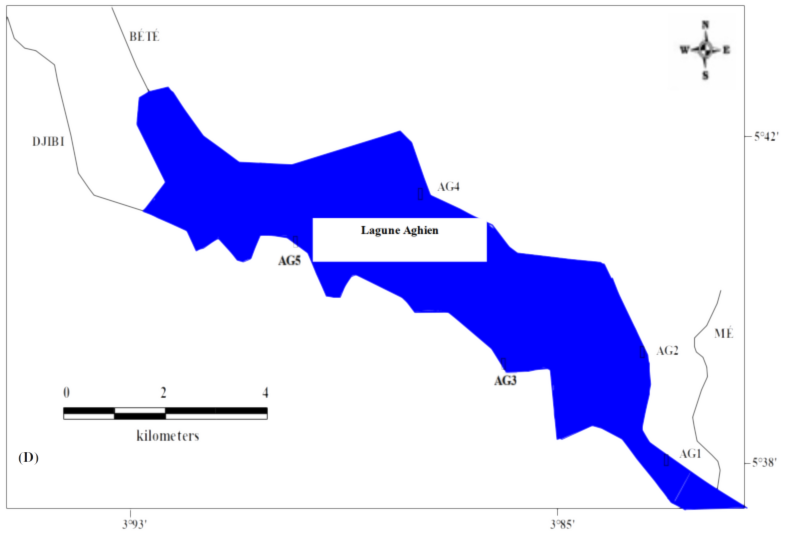
Figure 1 : Cartes des lagunes de Côte d’Ivoire avec les sites d’échantillonnage: A - Lagune de Grand-Lahou, B - Lagune de Fresco, C - Lagune Ebrié, D - Lagune Aghien.
Résultats
Variations spatio-temporelles des paramètres physico-chimiques
9Les valeurs minimales, maximales et moyennes saisonnières des paramètres physico-chimiques mesurés et dosés dans les eaux des lagunes de la Côte d’Ivoire sont consignées dans les tableaux 1 à 3. Les salinités varient de 0 à 31 ‰ avec les valeurs des saisons sèches (27,50-30,50 ‰) supérieures à celles des saisons humides dans toutes les lagunes (8,31-10,48 ‰), à l’exception du secteur I de la lagune Ébrié (Aghien) où la salinité est toujours nulle ou proche de zéro. La conductivité et pH suivent la même tendance saisonnière avec des valeurs variant respectivement de 0 à 84 µS.cm-1 et 6,38 à 9,18. Les températures oscillent entre 20 et 39°C, avec une différence saisonnière assez faible : 28-29°C pendant la saison sèche contre 28 à 30°C durant la saison humide. Les eaux des lagunes de Côte d’Ivoire présentent un état anoxique (≈ 0 mg.l-1) à bien oxygéné (≈ 13,20 mg.l-1) selon les secteurs et les saisons. Les variations saisonnières du taux d’oxygène dissous ne sont pas importantes avec toutefois les valeurs des saisons humides (2,70 à 6,70 mg.l-1) relativement plus élevées que celles obtenues pendant la saison sèche (4,88 à 7,33 mg.l-1).
10La turbidité présente également des valeurs moyennes plus importantes en saison humide (21 à 46 ntu) que durant la saison sèche (12 à 44 ntu), avec des valeurs ponctuelles variant de 2,80 à 114,70 ntu. Concernant les sels nutritifs, les teneurs en phosphates sont en moyenne plus élevées durant la saison sèche que pendant la saison humide, principalement au niveau des lagunes de Grand-Lahou et de Fresco, avec 0,89-1,26 µmol.l-1 contre 0,68-0,97 µmol.l-1. Les données du secteur Aghien de la lagune Ébrié, et de la lagune de Grand-Lahou montrent qu’en moyenne, les teneurs en nitrates durant les saisons humides (respectivement 1,16-1,61 µmol.l-1) sont plus importantes que celles enregistrées pendant les saisons sèches (0,41-0,47 µmol.l-1). C’est la même tendance avec le nitrite dosé dans la lagune de Fresco et au niveau d’Aghien (Secteur 1 de la lagune Ébrié): 0,01-0,34 µmol.l-1 durant la saison sèche, contre 0,04-0,47 µmol.l-1 obtenue durant la saison humide.
Variations spatio-temporelles de l’abondance des nauplii de copépodes
11L’abondance des nauplii de copépodes échantillonnés dans les eaux des lagunes de Côte d’Ivoire est marquée en moyenne par des valeurs relativement plus élevées en saison sèche (12-98 ind.l-1) que pendant la saison humide (9-88 ind.l-1) (Figure 2A, B, C). Notons toutefois que cette tendance générale n’est pas observée dans tous les sites échantillonnés. Ainsi, au niveau de la lagune de Grand-Lahou, les stations d’échantillonnage St5 à St8 (secteur Mackey) et St20 (canal de Grand-Lahou) présentent des abondances plus importantes pendant la saison humide (24-117 ind.l-1) que pendant la saison sèche (10-82 ind.l-1) (Figure 2A). Il en est de même pour les stations d’échantillonnage St5 dans les lagunes de Fresco (canal) et Ébrié (Aghien), avec respectivement 52 et 34 ind.l-1 pendant la saison humide contre 8 et 15 ind.l-1 durant la saison sèche. Nos résultats montrent également qu’au niveau des lagunes de Grand-Lahou et de Fresco, en toute saison, les abondances les plus faibles ont été enregistrées au niveau de la zone de communication entre la lagune et l’océan atlantique (canal) (Figure 2 A, B).
Tableau 1 : Valeurs moyennes saisonnières des paramètres physico-chimiques mesurés dans la lagune de Grand-Lahou de janvier à décembre 2004. (nd : non déterminés, Mini : Minimums, Maxi. : Maximums, Moye. : Moyennes).
|
|
Saison sèche |
Saison des pluies |
||||
|
|
Mini. |
Maxi. |
Moye. |
Mini. |
Maxi. |
Moye. |
|
Température (°C) |
26,25 |
30,69 |
29,47 |
23,57 |
28,64 |
27,08 |
|
Conductivité (µS.cm-1) |
1,45 |
61,46 |
25,18 |
2,50 |
50,00 |
17,82 |
|
0,82 |
30,30 |
13,78 |
1,28 |
30,00 |
10,48 |
|
|
pH |
7,74 |
9,03 |
8,21 |
7,51 |
8,90 |
8,17 |
|
Oxygène dissous (mg.l-1) |
- |
5,90 |
2,79 |
0,10 |
13,55 |
4,94 |
|
Turbidité (ntu) |
32,40 |
73,55 |
43,84 |
35,95 |
66,90 |
46,78 |
|
Transparence (m) |
0,30 |
2,00 |
0,94 |
0,30 |
2,50 |
0,90 |
|
Phosphate (µmol.l-1) |
0,37 |
2,31 |
1,26 |
0,07 |
2,31 |
0,97 |
|
Nitrate (µmol.l-1) |
0,02 |
1,97 |
0,41 |
- |
10,95 |
1,61 |
|
Nitrite (µmol.l-1) |
Nd |
Nd |
Nd |
0,04 |
2,07 |
0,47 |
Corrélations paramètres physico-chimiques et abondance des nauplii de copépodes
12L’étude de la corrélation entre les valeurs des paramètres physico-chimiques et l’abondance des nauplii des copépodes consignés dans le tableau 4 montre que l’abondance des nauplii augmente avec celles des variables température, conductivité, oxygène dissous, nitrite, ammonium et demande biochimique en oxygène des eaux des lagunes de Côte d’Ivoire, avec une corrélation significativement positive (Rs : 0,21-0,94 et p < 0,001). En revanche, l’abondance des nauplii montre une corrélation significative et négative à la turbidité au niveau de la lagune Aghien, durant la saison sèche (Rs : -0,30 et p < 0,01) et une corrélation négative et non significative au pH dans tous les milieux d’étude (Rs : -0,03 à -0,62 et p > 0,05). Cette même tendance est observée avec le phosphate au niveau de la lagune Aghien durant la saison sèche (Rs : -0,14 et p < 0,05) et avec le nitrate au niveau de la lagune de Fresco durant la saison humide (Rs : -0,91 et p < 0,05) (Tableau 4).
Tableau 2 : Valeurs moyennes saisonnières des paramètres physico-chimiques mesurés dans la lagune de Fresco de août 2013 à juillet 2014. (nd : non déterminés, Mini : Minimums, Maxi : Maximums, Moye : Moyennes)
|
|
Saison sèches |
Saison des pluies |
||||
|
Mini. |
Maxi. |
Moye. |
Mini. |
Max. |
Moye. |
|
|
Température (°C) |
20,00 |
32,60 |
27,95 |
27,00 |
31,90 |
29,98 |
|
Conductivité (µS.cm-1) |
0,09 |
54,50 |
24,80 |
3,90 |
28,30 |
18,28 |
|
Salinité (‰) |
1,80 |
27,50 |
16,58 |
- |
15,00 |
8,31 |
|
pH |
6,95 |
8,63 |
7,78 |
7,01 |
9,18 |
8,17 |
|
Oxygène dissous (mg.l-1) |
0,75 |
13,20 |
5,09 |
4,25 |
5,60 |
4,88 |
|
Turbidité (ntu) |
2,80 |
30,90 |
12,99 |
15,60 |
114,70 |
39,28 |
|
Transparence (cm) |
0,30 |
101,00 |
6,46 |
0,20 |
0,50 |
0,33 |
|
Phosphate (µmol.l-1) |
0,11 |
3,92 |
0,89 |
0,28 |
1,14 |
0,68 |
|
Nitrate (µmol.l-1) |
Nd |
Nd |
Nd |
0,74 |
38,51 |
22,94 |
|
Nitrite (µmol.l-1) |
- |
1,23 |
0,34 |
0,28 |
0,97 |
0,47 |
|
Sulfate (µmol.l-1) |
120,75 |
436,74 |
263,13 |
Nd |
nd |
Nd |
|
NH+4 (mg.l-1) |
0,01 |
0,09 |
0,04 |
0,03 |
0,06 |
0,04 |
|
Matière en suspension (mg.l-1) |
7,80 |
71,30 |
35,07 |
18,40 |
48,40 |
37,68 |
Tableau 3 : Valeurs moyennes saisonnières des paramètres physico-chimiques mesurés dans les eaux de la lagune de Ébrié (secteur I : Aghien) de octobre 2014 à avril 2015. (Mini : Minimums, Maxi : Maximums, Moye : Moyennes)
|
|
Saison sèche |
Saison humide |
||||
|
Mini |
Maxi. |
Moye. |
Mini. |
Maxi. |
Moye. |
|
|
Température (°C) |
22,20 |
35,90 |
27,77 |
27,70 |
31,00 |
29,25 |
|
Conductivité (µS.cm-1) |
63,30 |
84,00 |
73,39 |
63,70 |
70,40 |
67,56 |
|
Turbidité (ntu) |
5,20 |
23,40 |
12,32 |
14,10 |
31,20 |
20,98 |
|
pH |
5,80 |
9,10 |
7,63 |
6,90 |
8,60 |
7,80 |
|
Oxygène dissous (mg.l-1) |
2,60 |
8,70 |
6,70 |
5,50 |
8,60 |
7,33 |
|
Phosphate (µmol.l-1) |
0,04 |
0,59 |
0,17 |
0,09 |
0,38 |
0,23 |
|
Nitrate (µmol.l-1) |
0,12 |
1,88 |
0,47 |
0,09 |
4,44 |
1,16 |
|
Nitrite (µmol.l-1) |
0,00 |
0,05 |
0,01 |
0,00 |
0,27 |
0,04 |
|
Ammonium (µmol.l-1) |
0,10 |
1,00 |
0,17 |
0,10 |
1,03 |
0,33 |
|
Matière en Suspension |
2,40 |
19,00 |
8,71 |
9,40 |
20,00 |
13,71 |
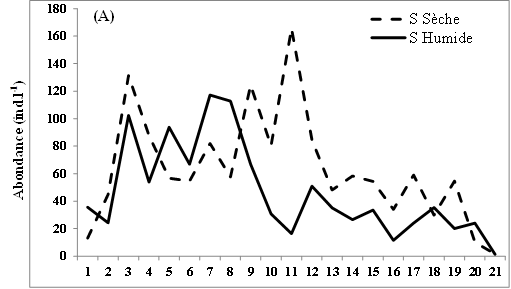
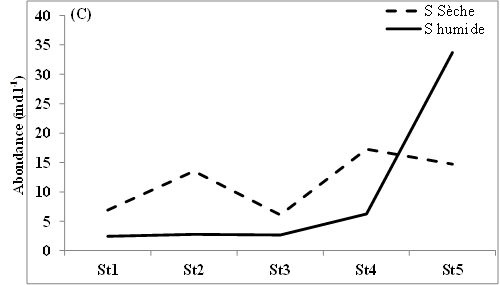
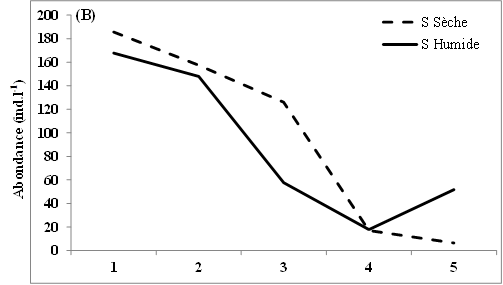
Figure 2: Variations spatio-temporelles de l’abondance des nauplii de copépodes échantillonnés dans les lagunes de Grand-Lahou (A), de Fresco (B), lagune Ebrié : Secteur 1 (Aghien) (C) et Secteur II & II (D)
Tableau 4 : Coefficients de corrélations de Pearson (Rs) reliant les paramètres physico-chimiques à l’abondance des nauplii de copépodes respectivement mesurés et échantillonnés dans les eaux des lagunes de Côte d’Ivoire (S : Saison; Nd : Non déterminé).
|
Paramètres physico-chimiques |
Grand-Lahou |
Fresco |
Ebrié (Secteur Aghien) |
|||
|
S Sèche |
S humide |
S Sèche |
S humide |
S Sèche |
S humide |
|
|
Température |
0,34٭٭٭ |
0,35٭٭ |
0,09 |
0,04 |
0,4٭ |
0,67 |
|
Conductivité |
0,21٭ |
0,11 |
0,44٭٭ |
- 0,12 |
-0,17٭ |
-0,71 |
|
Salinité |
0,21٭ |
0,14 |
0,06 |
0,26 |
Nd |
nd |
|
pH |
- 0,13 |
- 0,22 |
0,40٭ |
- 0,03 |
-0,30 |
-0,10 |
|
Oxygène dissous |
0,27٭٭ |
- 0,19 |
- 0,15 |
0,23 |
0,22 |
-0,07 |
|
Turbidité |
- 0,03 |
- 0,15 |
- 0,14 |
- 0,08 |
-0,30٭٭ |
0,83 |
|
Transparence |
0,01 |
0,14 |
- 0,17 |
0,39 |
Nd |
nd |
|
Phosphate |
0,61٭٭٭ |
0,33٭٭ |
0,06 |
- 0,10 |
-0,14٭ |
-0,66 |
|
Nitrate |
0,36٭ |
- 0,17 |
nd |
- 0,90٭ |
0,10 |
0,33 |
|
Nitrite |
Nd |
- 0,16 |
- 0,31 |
- 0,03 |
0,12٭ |
0,69 |
|
Ammonium |
Nd |
Nd |
- 0,14 |
0,26 |
0,05 |
-0,87 |
|
Matière en suspension |
Nd |
Nd |
- 0,03 |
0,60 |
-0,36 |
0,53 |
Discussion
13Cette étude a montré une fluctuation saisonnière de l’abondance des nauplii des copépodes, avec les valeurs moyennes obtenues durant la saison sèche (12-98 ind.l-1) relativement plus importantes que celles enregistrées pendant la saison humide (9-88 ind.l-1) dans tous les milieux lagunaires échantillonnés. La variation saisonnière de l’abondance des nauplii de copépodes est similaire à celle de l’abondance totale du zooplancton et des copépodes échantillonnés dans les milieux lagunaires de la Côte d’Ivoire : lagunes de Grand-Lahou (16), Ébrié (1, 5, 41), de Fresco (19), et le système lagunaire Aby-Ahi-Tendo (5). Cette variation saisonnière de l’abondance des nauplii des copépodes avec les valeurs de la saison sèche supérieures à celles de la saison humide au niveau des lagunes de Grand-Lahou et de Fresco pourrait être liée à la reproduction de Oithona breviscornis, la principale espèce zooplanctonique de ces écosystèmes saumâtres (16, 19). En effet, les femelles ovigères sont obtenues avec des abondances plus importantes durant les saisons sèches (février-avril et septembre) (16, 18). Ces abondances maximales des femelles ovigères durant les saisons sèches permettent de dire que la sèche constitue la période favorable à la reproduction de cette espèce dans les lagunes de Grand-Lahou et de Fresco, et donc la période de forte production des œufs et de développement des nauplii.
14Au niveau de la lagune Ébrié (secteur Aghien), la fluctuation saisonnière de l’abondance des nauplii de copépodes peut être mise en relation avec les principales espèces de copépodes que sont Mesocyclops ogunus (29,92 %), Mesocyclops leukarti (7,02 %) et Thermocyclops decipiens (5,28 %) (2), même si leur reproduction n’est pas encore étudiée dans cet écosystème. Les abondances maximales des nauplii des copépodes constatées durant la saison sèche peuvent être mises en relations avec la variation saisonnière de la température (plus élevée durant la saison sèche) qui constitue un paramètre qui conditionne le métabolisme, l’activité de nutrition, et le cycle de développement et de reproduction du zooplancton, notamment des copépodes (3). En outre, selon 12, l’augmentation de la température accélère la croissance, la maturation sexuelle et la reproduction des espèces zooplanctoniques. Cela justifierait ainsi les abondances des femelles ovigères, les nombres d’œufs par femelle ovigère, et les taux de production des œufs (nombre œuf.femelle-1.jour-1) plus élevés obtenus chez O. brevicornis au niveau des lagunes de Grand-Lahou (16) et de Fresco (18), et des nauplii de copépodes (présente étude) durant la saison sèche. L’influence positive de la température sur les caractéristiques de reproduction des espèces de copépodes du genre Oithona, notamment la durée de reproduction, la durée du développement embryonnaire, le taux de production des œufs (nombre œufs.femelle-1.jour-1) et la production des femelles adultes a été également soulignée par 36. La même tendance d’augmentation du taux de production des œufs a été obtenu chez Acartia longiremis et Temora longicornis, avec leur taux de production d’œufs moyens respectifs passant de 3,8 ± 0,5 et 8,7 ± 0,9 œufs.femelle-1.jour-1 (5°C) à 5,3 ± 0,5 et 16,5 ± 1,5 œufs.femelle-1.jour-1 (10°C) (14) ; chez Paracalanus parvus avec un taux de production d’œufs moyen de 8 ± 2,82 œufs.femelle-1.jour-1 à 18°C et 35,3 ± 1,41 œufs.femelle-1.jour-1 à 25 °C (42). L’augmentation de la température influence la reproduction des copépodes par (1) la stimulation du métabolisme et l’ingestion d’aliment entraînant l’augmentation du taux de production des œufs (3, 23); (2) l’accélération de la maturation sexuelle (12). Cette influence positive de la température sur la maturation sexuelle et les paramètres de reproduction telle que le nombre de femelles ovigères, la durée du développement embryonnaire, le taux de production des œufs (nombre œufs.femelle-1.jour-1) et la production des femelles adultes, expliquerait également les plus faibles abondances des nauplii de copépodes obtenues durant la saison sèche dans les zones proches de la communication entre les lagunes (Grand-Lahou: stations 20 et 21; Fresco : stations 4 et 5) et l’océan atlantique (respectivement 1-13 ind.l-1 et 6-17 ind.l-1) contre des valeurs plus importantes dans les zones éloignées (respectivement 39-166 ind.l-1 et 17-187 ind.l-1). En effet, dans les zones de communication océan atlantique-lagunes, les entrées d’eaux marines plus froides provoquent une baisse de la température des eaux lagunaires (26-30 °C) comparativement aux autres zones (28-31 °C), et y favoriseraient peu ou pas la reproduction de la principale espèce (Oithona brevicornis). À ce facteur température, il faudrait associer la turbidité des eaux qui est plus importante dans ces zones de communication océan-lagune, en raison des vagues et de la marée, et qui constitue un facteur corrélé négativement aux paramètres de reproduction de O. brevicornis [abondances des femelles ovigères, les nombres d’œufs par femelle ovigère, et les taux de production des œufs (nombre œuf.femelle-1.jour-1)] étudiés au niveau des lagunes de Grand-Lahou (18) et de Fresco (17). Le faible taux de production des œufs, le succès de l’éclosion et le taux de survie des larves (nauplii) dans un environnement avec une turbidité élevée a été également souligné chez Temora stylifera (35). Par contre, les mêmes auteurs soulignent une corrélation positive entre la turbidité et le taux de production des œufs chez Centropages kroyeri. Dans les zones à forte turbidité, l’action mécanique de la turbulence favorise une remise en suspension des particules (matières en suspension) qui ont une faible qualité nutritionnelle à cause de leur faible proportion en matière organique (< 15 %) (9). En outre, la remise en suspension continue de ces particules limite la pénétration de la lumière, entraîne une diminution de la transparence de l’eau et limite la photosynthèse et la production phytoplanctonique. Tous ces facteurs combinés limitent fortement la disponibilité de la nourriture d’une part, augmentant la difficulté de sélection des aliments dans ces environnements turbides d’autre part (9). Les macromolécules organiques facilement extractibles par les copépodes pour leur développement étant insuffisantes, ces environnements n’offriraient pas les conditions propices pour la production d’œufs et le développement des copépodes. Ces faibles valeurs de l’abondance des femelles ovigères, du nombres d’œufs par femelle ovigère, et du taux de production des œufs (nombre œuf.femelle-1.jour-1) pourraient également être mises en relation avec l’action mécanique de la turbulence qui favoriserait le détachement des sacs ovigères, surtout lorsque les œufs sont à maturité, et entraînerait des biais dans l’estimation de l’abondance des femelles ovigères et du taux de production des œufs (49).
15Outre l’action de la température et de la turbidité dans la variabilité spatio-saisonnière de la fécondité des copépodes, la quantité et qualité de nourriture sont aussi mentionnées comme des facteurs affectant la production des œufs chez les copépodes, donc pouvant influer sur l’abondance des nauplii dans les écosystèmes aquatiques saumâtres (8). En effet, une corrélation positive et significative a été observée entre le taux de production des œufs par Oithona similis et l’abondance des dinoflagelés (37). Il a été également démontré que Temora longicornis a un taux de production d’œufs 2,66 fois supérieur (40 œufs.femelle-1.jour-1) dans les conditions de saturation alimentaire (400µgC.l-1 de phytoplancton) au taux obtenu dans des conditions de non saturation alimentaire (100µgC.l-1 de phytoplancton) (15 œufs.femelle-1.jour-1) (26). La même tendance a été observée chez Paracalanus parvus, avec un taux de production d’œuf moyen de 9 œufs.femelle-1.jour-1 pour une concentration algale de 1000 cellules.ml-1 et de 53,5 œufs.femelle-1.jour-1 pour une concentration algale de 20 000 cellules.ml-1 (42).
16Aussi durant la présente étude, une corrélation négative a été observée entre l’abondance des nauplii de copépodes et le pH des eaux des différentes lagunes échantillonnées. Certes cette corrélation n’est pas assez forte (Rs : - 0,03 à - 0,61) et est non significative (p > 0,05), mais elle est à prendre en considération dans un contexte mondial de réchauffement climatique au niveau de la planète terre, et d’acidification des océans (diminution du pH) en relation avec l’augmentation de la teneur en dioxyde de carbone (CO2) atmosphérique et avec la dissolution accrue du CO2 dans les eaux de surface des océans (46). Cette corrélation négative entre l’abondance des nauplii de copépodes et le pH observée durant la présente étude pourrait être liée au fait que la diminution du pH dans un contexte d’augmentation de la température entraîne une baisse de la production des œufs chez les copépodes et du succès de leur éclosion (48). En effet, selon ces auteurs (48), la production d’œufs peut augmenter avec la diminution du pH à une température fixe. Toutefois, la diminution du pH associée avec l’augmentation de la température entraîne inéluctablement une diminution de la production des œufs chez les copépodes.
17L’eutrophisation est également soulignée comme facteurs pouvant affecter les copépodes par l’hypoxie qu’elle provoque dans les couches profondes, à travers différents mécanismes comme la réduction du développement, de la croissance, du taux de reproduction et de la viabilité des œufs chez les taxons bentho-pélagiques ou chez les taxons pélagiques à œufs libres qui sédimentent (30). À titre d’exemple, il a été établi que les faibles concentrations d’oxygène dissous (0,53 ml.l-1) diminuaient le taux de production des œufs du copépode Acartia tonsa (43). Par contre, chez la même espèce, des études ont montré en laboratoire que des conditions hypoxiques sont nécessaires pour que les œufs de résistance restent intacts et survivent après plusieurs mois de repos induit (26).
Conclusion
18L’abondance des nauplii de copépodes varie significativement dans l’espace et dans le temps (saison) dans les lagunes de Côte d’Ivoire où Oithona brevicornis constitue la principale espèce en dehors du système Aby-Ehi-Tendo. Ces variations sont principalement liées à celle de la température, de la turbidité et du pH qui sont des facteurs influençant la production des œufs chez les copépodes. Les actions combinées de la température et du pH sur la variation de l’abondance des nauplii de copépodes sont à prendre en considération dans le contexte mondial de réchauffement climatique actuel couplé avec l’acidification des océans. Elles pourraient avoir une conséquence majeure sur les stocks de poissons marins, vu le rôle important des copépodes dans le flux de matière et d’énergie dans ces milieux et de celui des nauplii de copépodes dans la survie et le développement des larves des poissons.
Bibliographie
-
-
Aka M.N., R.N. Etilé, & G.K. Blahoua, 2016, Anthropogenic Activities Impact on Zooplankton Community in a Tropical Coastal Lagoon (Ebrié, Côte d’Ivoire). International Journal of Contemporary Applied Sciences, 3(9), 43-63.
-
Aka N.M., R.N. Etilé, F.K. Konan & Y.K. Bony, 2016, Zooplankton Composition and Distribution in Relationship with Environmental Parameters in a Tropical Coastal Lagoon (Ebrié lagoon: Aghien, Côte d’Ivoire). International Research Journal of Biological Sciences, 5(12), 1-12.
-
Amblard C. & B. Pinel-Alloul, 1995, Variations saisonnières et interannuelles du plancton. In: R Pourriot & M. Meybeck (Eds). Limnologie générale. Masson Publisher, Paris. Collection d’Ecologie, pp. 441-472.
-
Anderson T. & S. De Silva, 2003, Nutrition. In: Lucas J.S. & P.C. Southgate (Eds.), Aquaculture: Farming Aquatic Plants and Animals. Blackwell, Oxford, pp. 146–171.
-
Appiah S.Y., R.N. Étilé, A.K. Kouamé & P.E. Kouamélan, 2017, Zooplankton diversity and its relationships with environmental variables in a West African tropical coastal lagoon (Ebrié lagoon, Côte d’Ivoire, West Africa). Journal of Biodiversity and Environmental Sciences (JBES), 13, N° 3, 1-16.
-
Atienza D., A. Calbet, E. Saiz, M. Alcaraz & I. Trepat. 2006, Trophic impact, metabolism, and biogeochemical role of the marine cladoceran Penilia avirostris and the co-dominant copepod Oithona nana in NW Mediterranean coastal waters. Marine Biologie, 150, 221-235.
-
Boxshall G.A. & D. Defaye, 2008, Global diversity of copepods (Crustacea: Copepoda) in freshwater. Hydrobiologia, 595, 195-207. DOI 10.1007/s10750-007-9014-4.
-
Bunker A.T. & A.G. Hirst, 2004, Fecundity of marine planktonic copepods: global rates and patterns in relation to chlorophyll a, temperature and body weight. Marine Ecology Progress Series, 279, 161-181.
-
Burdloff D., S. Gasparini, B. Sautour, H. Etcheber & J. Castel, 2000, Is the copepod egg production in a highly turbid estuary (the Gironde, France) a function of the biochemical composition of seston? Aquatic Ecology, 34, 165-175. doi.org/10.1023/A:1009903702667.
-
Bury N.R., P.A. Walker, & C.N. Glover, 2003. Nutritive metal uptake in teleost fish. Journal of Experimental Biology, 206, 11-23. DOI 10.1242/jeb.00068.
-
Busch K.E.T., Peruzzi S., F. Tonning & I.B. Falk-petersen, 2011, Effect of prey type and size on the growth, survival and pigmentation of cod (Gadus morhua, L.) larvae. Aquaculture Nutrition, 17(2), 595-603.
-
De Azevedo F. & C.C. Bonecker, 2003. Community size structure of zooplanktonic assemblage in three lakes on the upper river Paramä floodplain, PR-MS, Brazil. Hydrobiologia, 565, 147-158.
-
Durand J.R., J.M. Écoutin & E. Charles-Dominique, 1982, Les ressources halieutiques Exploitation des lagunes ivoiriennes. Oceanologica Acta, 1982, N° spécial : Actes Symposium International sur les lagunes côtières, SCOR/IABO/UNESCO, Bordeaux, 8-14 septembre 1981, 277-284.
-
Dvoretsky V.G. & A.G. Dvoretsky, 2014, Egg production rates of two common copepods in the Barents Sea in summer. Polar Science, Volume 8, Issue 3, 298-305. doi.org/10.1016/j.polar.2014.04.001.
-
Emiroglu D. & T. Tolon, 2003, Fish Production and Marketing in the Mediterranean Coastal Lagoons. New Medit N°4/2003, 59-62p.
-
Etilé N.R., M.K. Aka, M.N. Aka, M. Pagano, V. N’douba & N.J. Kouassi, 2009, Spatio-temporal variations of the zooplankton abundance and composition in a West African tropical coastal lagoon (Grand-Lahou, Côte d’Ivoire). Hydrobiologia, 624, 171-189.
-
Etilé R.N., G.K. Blahoua, A.K. Kouamé, G. Goore Bi, P.E. Kouamelan & V. N’Douba, 2019, Spatio-temporal Variability of Oithona brevicornis (Copepoda, Cyclopoida) Population Dynamic and Reproductive Parameters in Fresco lagoon (Côte d’Ivoire). Nature and Science, 1710), 225-237. doi:10.7537/marsnsj171019.30.
-
Etilé R.N., M.N. Aka, A.M. Kouassi, M. Pagano & V. N’douba, 2012, Spatiotemporal Variations in the Abundance, Biomass, Fecundity, and Production of Oithona brevicornis (Copepoda: Cyclopoida) in a West African Tropical Coastal Lagoon (Grand-Lahou, Côte d’Ivoire). Zoological Studies, 51(5), 627-643.
-
Etilé R.N., M.N. Aka, G.K. Blahoua, P.E. Kouamelan & V. N’Douba, 2018, Zooplankton Diversity and Distribution In Freco Lagoon (West Africa, Côte d’Ivoire). International Research Journal of Environmental Sciences, 7(10), 9-20.
-
FAO, 1979, Report to the Government of Nigeria on experiments in brackish-water fish culture in the Niger Delta Nigeria, 1965-1968. Basedon the work of K.K. Nair, FAO/UNDP (TA) Inland fishery biologist (Fish Culture). Rep.FAO/UNDP (TA), (2759); 14.
-
FAO. 2016, The State of World Fisheries and Aquaculture 2016. Contributing to food security and nutrition for all. Rome. 200 pp.
-
Hawkyard M., B. Laurel & C. Langdon, 2014, Rotifers enriched with taurine by microparticulate and dissolved enrichment methods influence the growth and metamorphic development of northern rock sole (Lepidopsetta polyxystra) larvae. Aquaculture, 424-425, 151-157. DOI 10.1016/j.aquaculture.2013.12.035.
-
Hirche H.J., U. Meyer, & B. Niehoff, 1997, Egg production of Calanus finmarchicus - effect of food, temperature and season. Marine Biology, 127, 609-620.
-
Hsu P., Lo W., & Shih, 2008, The coupling of copepod assemblage and hydrography in a eutrophic lagoon in Taiwan: Seasonal and spatial variations. Zoological Studies, 47(2), 172-184.
-
Jones D.L., J.F. Walter, E.N. Brooks, & J.E. Serafy, 2010, Connectivity through ontogeny: fish population linkages among mangrove and coral reef habitats. Marine Ecology Progress Serie, 401, 245-258.
-
Jørgensen T.S., P.M. Jepsen, H.C.B. Petersen, D.S.Friis, & B.W. Hansen, 2019, Eggs of the copepod Acartia tonsa Dana require hypoxic conditions to tolerate prolonged embryonic development arrest. BMC Ecology, 19, 1-9. doi.org/10.1186/s12898-018-0217-5.
-
Karlsen Ø., Te. Van Der Meeren, I. Rønnestad, A. Mangor-Jensen, T.F. Galloway, E. Kjørsvik & K. Hamre, 2015, Copepods enhance nutritional status, growth and development in Atlantic cod (Gadus morhua L.) larvae - can we identify the underlying factors? PeerJ 3:e902; DOI 10.7717/peerj.902.
-
Kathiresan K., 2012. Importance of Mangrove Ecosystem. International Journal of Marine Science, 2(o.10), 70-89. http://ijms.sophiapublisher.com.
-
Maps F., J.A. Runge, B. Zakardjian & P. Joly, 2005, Egg production and hatching success of Temora longicornis (Copepoda, Calanoida) in the southern Gulf of St. Lawrence. Marine Ecology Progress Serie, 285, 117-128.
-
Marcus N., 2004. An overview of the impacts of eutrophication and chemical pollutants on Copepods of the coastal zone. Zoological Studies,* 43(2)**, 211-217.
-
McEvoy L.A., T. Naess, J.G. Bell & Ø. Lie, 1998, Lipid and fatty acid composition of normal and malpigmented Atlantic halibut (Hippoglossus hippoglossus*) fed enriched Artemia: a comparison with fry fed wild copepods. Aquaculture, 163, 237-250.
-
Mckinnon A.D., S. Duggan, P.D. Nichols, M.A. Rimmer, G. Semmens & B. Robino, 2003, The potential of tropical paracalanid copepods as live feeds in aquaculture. Aquaculture, 223, 89-106.
-
Mitsuzawa A., H. Miyamoto & H. Ueda, 2017, Feeding selectivity of early-stage fish larvae on the nauplii and eggs of different copepod species. Plankton Benthos Research, 12(2), 115-122.
-
Monney I.A., R.N. Etilé, I.N. Ouattara & T. Koné, 2015, Seasonal distribution of zooplankton in the Aby-Tendo-Ehy lagoons system (Côte d’Ivoire, West Africa). International Journal of Biological and Chemical Sciences, 9(5), 2362-2376. DOI: dx.doi.org/10.4314/ijbcs.v9i5.9.
-
Neffati N., O.D. Yahia-Kefi, D. Bonnet, F. Carlotti & M.N. D. Yahia, 2013, Reproductive traits of two calanoid copepods: Centropages ponticus and Temora stylifera, in autumn in Bizerte Channel. Journal of Plankton Research, Volume 35, Issue 1, 80-96, doi.org/10.1093/plankt/fbs071.
-
Nielsen T.G., E.F. Møller, S. Satapoomin, M. Ringuette & R.R. Hopcroft, 2002. Egg hatching rate of the cyclopoid copepod Oithona similis in arctic and temperate waters. Marine Ecology Progress Series, Vol. 236, 301-306.
-
Nielsen T.G. & M. Sabatini. 1996, Role of cyclopoid copepod Oithona spp. in North Sea plankton communities. Marine Ecology Progress Series, 139, 79-93.
-
Nip T.H.M., W. Ho & C.K. Wong, 2003, Feeding ecology of larval and juvenile black seabream (Acabthopagrus schlegeli) and Japanese seaperch (Lateolabrax japonicus) in Tolo Harbour, Hong Kong. Environmental Biology of Fishes,66, 197-209.
-
Ohs C.L., E.J. Cassiano & A. Rhodes, 2012, Choosing an Appropriate Live Feed for Larviculture of Marine Fish. FA176, Institute of Food and Agricultural Sciences (IFAS extension), University of Florida, 6p. edis.ifas.ufl.ed.
-
Pagano M. & L. Saint-Jean, 1985, Premières données sur la nutrition d’Acartia clausi en lagune Ebrié (Côte d’Ivoire) obtenues par des mesures de fluorescences de broyats d’animaux. Hydrobiologia, 121, 83-95.
-
Pagano, M. & Saint-Jean L., 1994, Le zooplancton. In: Durand J.R., P. Dufour, D. Guiral & G.S. Zabi (Eds.). Environnement et ressources aquatiques de Côte d'Ivoire, Tome II-milieux lagunaires. Editions ORSTOM, pp 155-188.Santhanam P., N. Jeyaraj & K. Jothiraj, 2013, Effect of temperature and algal food on egg production and hatching of copepod, Paracalanus parvus. Journal of Environmental Biology, Vol. 34, 243-246.
-
Sedlacek C., 2003, Effect hypoxia has on feeding and egg production rates of Acartia tonsa Dana 1849 (Copepoda: Calanoida). Theses, Florida State University, Department of Oceanography, 285p.
-
Stamieszkin K., A.J. Pershing, N.R. Record, C.H. Pilskaln, H.G. Dam & L.R. Feinberg, 2015, Size as the master trait in modeled copepod fecal pellet carbon flux. Limnology and Oceanography, 60, 2090-2107.
-
Strickland J.D.H. & T.R. Parsons, 1972, A practical handbook of seawater analysis. Journal of the Fisheries Research Board of Canada, 167, 1-311.
-
Turley C., C. Brownlee, H.S. Findlay, S. Mangi, A. Ridgwell, D.N. Schmidt & D.C. Schroeder, 2010, Ocean Acidification in MCCIP Annual Report Card 2010-11, MCCIP Science Review, 27pp. (www.mccip.org.uk/arc.).
-
Turner J.T., 2004, The importance of small planktonic copepods and their roles in pelagic marine food webs. Zoological Studies, 43, 255-266.
-
Vehmaa A., A. Brutemark & J. Engström-öst. 2012, Maternal Effects May Act as an Adaptation Mechanism for Copepods Facing pH and Temperature Changes. PLOS ONE, Vol. 5, Issue 10, 1-8. dx.doi.org/10.1371%2Fjournal.pone.0048538.
-
Zamora-Terol S., A.D. Mckinnon & E. Saiz, 2014, Feeding and egg production of Oithona spp. in tropical waters of North Queensland, Australia. Journal of Plankton Research, 36(4), 1047-1059. DOI: 10.1093/plankt/fbu039.
-
Pour citer cet article
A propos de : Raphaël N’doua Etilé*
Thèse Unique, Enseignant-Chercheur, Maitre-Assistant, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : ndouaetile@gmail.com
A propos de : Marius Tanoh Kamelan
Thèse Unique, Enseignant-Chercheur, Maitre-Assistant, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : ktmarius@gmail.com
A propos de : Théophile Aké Bedia
Thèse Unique, Enseignant-Chercheur, Maitre-Assistant, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : bediaaket@gmail.com
A propos de : Maryse N’guessan Aka
Thèse Unique, Chargé de recherche, Centre de Recherche Océanologique (CRO), BPV 18, Abidjan, Côte d’Ivoire. E-mail : akanguessanmaryse@yahoo.fr
A propos de : Gouli Gooré Bi
Doctorat d’État, Enseignant-Chercheur, Maitre de Conférences, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : gouligoorebi@gmail.com
A propos de : Paul Essetchi Kouamelan
Thèse Unique, Enseignant-Chercheur, Professeur Titulaire, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : kessetch2012@gmail.com
A propos de : Valentin N’douba
Doctorat d’État, Enseignant-Chercheur, Professeur Titulaire, Nationalité ivoirienne, Unité Pédagogique et de Recherche en Hydrobiologie, Laboratoire des milieux naturels et de conservation de la biodiversité, UFR Biosciences, Université Félix Houphouët-Boigny de Cocody (Abidjan, Côte d’Ivoire), 22 BP 582 Abidjan 22. E-mail : ndouval@hotmail.com