- Startpagina tijdschrift
- Volume 39 (2021)
- Numéro 1
- Méta-analyse exploratoire des effets de perturbations anthropiques sur la diversité des amphibiens dans les stations de Kasugho, Butembo, Mambasa et Kisangani en République Démocratique du Congo
Weergave(s): 2073 (8 ULiège)
Download(s): 164 (4 ULiège)
Méta-analyse exploratoire des effets de perturbations anthropiques sur la diversité des amphibiens dans les stations de Kasugho, Butembo, Mambasa et Kisangani en République Démocratique du Congo

Résumé
Ce travail présente les résultats d’une méta-analyse de quatre études menées sur les Amphibiens à Kasugho, Butembo, Mambasa et Kisangani en République Démocratique du Congo. L’objectif principal était de vérifier le lien entre le taux d’anthropisation des habitats et la fréquence des espèces observées afin d’identifier d’éventuelles espèces indicatrices des perturbations anthropiques. L’observation directe a généré 815 Amphibiens capturés dans les habitats anthropisés (étang piscicole, jachère) et non anthropisés (marécage, forêt secondaire, forêt primaire). Sur les 37 espèces identifiées, 2 (Amietophrynus kisoloensis, Hoplobatrachus occipitalis) vivent uniquement dans les habitats anthropisés et 11 (Afrixalus quadrivittatus, Amietophrynus gracilipes, Arthroleptis variabilis, Cardioglossa gracilis, C. leucomystax, Hyperolius viridiflavus, Leptopelis aubryioides, L. ocellatus, Phrynobatrachus auritus, Ptychadena anchietae, P. chrysogaster) préfèrent uniquement les habitats non anthropisés. La plus forte similarité entre les habitats anthropisés et non anthropisés a été observée à Mambasa (étang piscicole, marécage, jachère, forêt secondaire, forêt primaire) et la plus faible entre les habitats à Butembo (marécage, jachère). Un test de Chi-carré souligne un lien entre le statut d’habitat et les abondances d’Amphibiens. Une corrélation linéaire significative confirme qu’il n’y a pas de relation directe entre les fréquences dans les deux statuts d’habitat. La présente étude confirme le potentiel des Amphibiens comme indicateurs de perturbations anthropiques des écosystèmes.
Abstract
Exploratory meta-analysis of anthropogenic disturbances on amphibian diversity in the Kasugho, Butembo, Mambasa and Kisangani stations in the Democratic Republic of the Congo.
We present the findings of a meta-analysis based on four studies on Amphibians in Kasugho, Butembo, Mambasa and Kisangani in the Democratic Republic of the Congo. The main objective was to verify the correlation between the anthropogenic character of the habitats and species frequency in order to identify potential indicator species. Direct observations rendered 815 Amphibians captured in anthropogenically disturbed (fish pond, fallow) and non-disturbed (swamp, primary and secondary forests) habitats. Amongst the 37 identified species, 2 (Amietophrynus kisoloensis, Hoplobatrachus occipitalis) were found only in disturbed habitats and 11 (Afrixalus quadrivittatus, Amietophrynus gracilipes, Arthroleptis variabilis, Cardioglossa gracilis, C. leucomystax, Hyperolius viridiflavus, Leptopelis aubryioides, L. ocellatus, Phrynobatrachus auritus, Ptychadena anchietae, P. chrysogaster) were present only in undisturbed habitats. The highest similarity between both habitat types was observed in Mambasa (fish pond, swamp, fallow, primary forest and secondary forest habitats) while the lowest similarity was found in Butembo (swamp and fallow habitats). A Chi-square test indicated a relationship between the disturbance status of the habitat and amphibian abundance. A significant linear correlation confirmed the absence of a direct relationship between the species frequencies in both habitat types. The current study confirms the potential of Amphibians as indicators of anthropogenic disturbances of ecosystems.
Introduction
1La République Démocratique Congo (RD Congo) renferme la plus grande richesse spécifique des Amphibiens qui exploitent une large variation de milieux écologiques (17). À part la revue de la littérature postcoloniale sur l’herpétofaune des forêts d’Afrique tropicale et subtropicale par (30), les Amphibiens du bassin du Congo demeurent un groupe parmi les moins étudiés (25). Pourtant, ils constituent des éléments symptomatiques de l’effondrement et des indicateurs de l’intégrité des écosystèmes (48) dont ils évaluent le degré de stress (31).
2Les Amphibiens sont des composantes clés des réseaux trophiques à travers le maintien des équilibres biologiques dans divers écosystèmes (6). Malgré leur importance écologique, ils constituent le groupe le plus menacé parmi les vertébrés (10, 29). La crise actuelle, associée à la dégradation et la fragmentation des habitats naturels, conséquences de l’anthropisation, se manifeste également sur les populations d’Amphibiens (4, 13, 46, 49). Ces formes d’anthropisation provoquent la disparition des espèces à un rythme accéléré depuis quelques années (6, 29).
3Pour évaluer les effets de l’anthropisation des habitats sur la biodiversité, particulièrement sur les Amphibiens, la présente étude s’inspire de travaux antérieurs (21, 22, 23, 24, 35). Ces derniers ont étudié l’existence d’éventuelles espèces de rongeurs, bio-indicatrices des perturbations anthropiques des écosystèmes forestiers fragmentés dans la région de Kisangani.
4Cette étude procède par une méta-analyse des données issues des recherches exploratoires (36, 37, 38, 39) effectuées respectivement à Kasugho, Mambasa, Kisangani et Butembo en République Démocratique du Congo. Ainsi, à travers cette méta-analyse, l’on cherche à comprendre le potentiel des Amphibiens en tant qu’indicateurs des perturbations anthropiques des habitats naturels. L’objectif poursuivi est de démontrer le lien qui existe entre le statut d’anthropisation (ou de perturbation anthropique) des habitats et la présence/absence de certaines espèces d’Amphibiens en tenant compte de leurs fréquences.
Matériel et Méthodes
5Les données ont été récoltées dans les quatre stations : Kasugho (00°15’20“S, 28°59’59”E), Butembo (00°06’31“N, 29°18’24”E), Mambasa (01°22’17“N, 29°02’06”E) et Kisangani (00°30’34“N, 25°11’31”E) situées en République Démocratique du Congo. Avec un relief montagneux, Kasugho et Butembo jouissent d’un climat équatorial influencé par des périodes sèches et une longue saison pluvieuse observée presque toute l’année.
6À Kasugho, on enregistre une végétation dominée par des jachères, des îlots de forêts secondaires et des lambeaux de forêts primaires. La végétation de Butembo est caractérisée par les jachères. Kisangani, avec le même type climatique que les deux stations précédentes, accuse une flore forestière initiale, arborescente et graminéenne (27). À l’intérieur de ces forêts, suite aux activités humaines, l’on enregistre des formations secondaires et des complexes agricoles (8). Mambasa connaît un climat de transition entre le climat équatorial continental et le climat tropical à saison sèche marquée (33). La région est caractérisée par bien d’autres successions végétales, résultat des activités anthropiques (Figure 1).
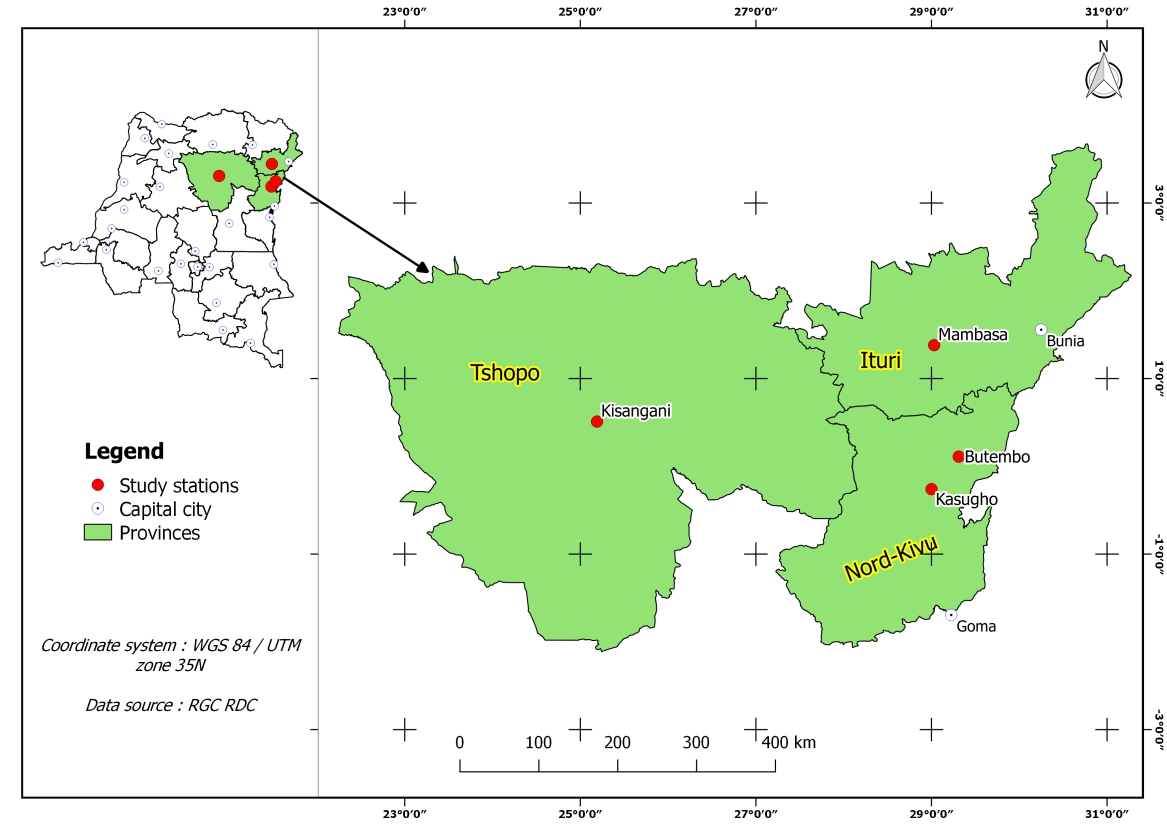
Figure 1 : Carte de localisation des stations de capture des Amphibiens dans les zones étudiées en République Démocratique du Congo.
Les stations de Kasugho et Butembo se situent en Province du Nord-Kivu. La station de Mambasa, quant à elle, se trouve en Province de l’Ituri et celle de Kisangani se situe en Province de la Tshopo dont elle constitue le Chef-lieu.
7En fonction de notre connaissance des sites visités sur le terrain, les habitats exploités dans les quatre stations ont pu être regroupés en deux catégories selon leur statut : habitats anthropisés ou perturbés versus habitats non anthropisés ou pas modifiés par des perturbations d'origine anthropique (Tableau 1). Les jachères (caractérisées par les espèces telles que Macaranga spinosa, Penisetum purpureum, Palisota ambigua) ainsi que les étangs ont été considérés comme des habitats anthropisés.
8À l’opposé, les forêts secondaires (avec Musanga cecropioides, Myrianthus arboreus et Zanthophylum gilletii parmi les espèces caractéristiques) et les forêts primaires (caractérisées par les espèces telles que Cynometra alexandri et Julbernardia seretii) ont été considérées dans cette étude comme des habitats non anthropisés selon le gradient d’anthropisation défini par (14, 41). Les marécages sont caractérisés par des espèces telles que Desplatsia dewevrei et Pycnanthus marchalianus.
9La présence de D. dewevrei indique qu’il s’agit d’écosystèmes boisés. En raison de leur non susceptibilité aux activités agricoles, ces marécages ont été classés parmi les écosystèmes non anthropisés. Ainsi, deux statuts d’habitat ont été définis, les habitats anthropisés (les étangs piscicoles et les jachères) et les habitats non anthropisés (les forêts primaires, les forêts secondaires et les marécages).
10La méta-analyse a porté sur un total de 815 Amphibiens inégalement répartis dans les quatre stations et collectés à différentes périodes (Tableau 2). L'aperçu systématique des espèces observées est donné en Annexe 1. Le lecteur est invité à consulter les recherches exploratoires (36, 37, 38, 39) pour les détails à propos des superficies et écosystèmes échantillonnés, la nature des cours d’eau présents, les périodes d’observation, etc.
Tableau 1 : Classes d’occupations du sol (habitats) présentes et leurs statuts en termes d’anthropisation pour Kasugho, Butembo, Mambasa et Kisangani en République Démocratique du Congo.
|
Habitats |
Stations |
Statuts |
|||
|
Kasugho |
Butembo |
Mambasa |
Kisangani |
||
|
Forêt primaire |
x |
x |
x |
NA |
|
|
Forêt secondaire |
x |
x |
x |
NA |
|
|
Marécage |
x |
x |
x |
x |
NA |
|
Jachère |
x |
x |
x |
x |
A |
|
Etang piscicole |
x |
x |
x |
A |
|
NA = non anthropisé ; A = anthropisé ; x = présence de l’habitat en question.
Tableau 2 : Effectifs des Amphibiens capturés en différentes périodes à Kasugho, Butembo, Mambasa et Kisangani.
|
Station |
Période d’échantillonnage |
Année d’étude |
Effectifs capturés |
|
Kasugho |
Janvier - Mai |
2010 |
64 |
|
Butembo |
Mars - Juin |
2013 |
71 |
|
Mambasa |
Août |
2014 |
179 |
|
Kisangani |
Avril - Juin |
2015 |
501 |
À Mambasa, les captures ont été réalisées pendant 15 jours successifs. À Kasugho et à Butembo, elles ont été effectuées pendant 6 jours la première semaine et 6 jours la troisième semaine du mois. À Kisangani, les séances de capture ont été organisées pendant 6 jours chaque semaine du mois.
11À travers les captures nocturnes (45), nous sommes partis de l’observation appuyée par deux techniques afin de collecter les Amphibiens. Premièrement, l’écoute des chants qui consiste à repérer les mâles des espèces vocalement actives à la tombée de la nuit. A partir des vocalisations, les individus sont localisés grâce à la lumière d’une lampe torche. Cette technique oblige à l’observateur de rester stationnaire, pendant un certain temps, dans les environs des lieux d’émission des sons afin de repérer et capturer les individus. Deuxièmement, la recherche visuelle des individus consiste à les collecter directement dès qu’ils sont rencontrés au passage dans les différents habitats (43, 45). Il convient de signaler que l’échantillonnage proprement dit a été réalisé à la main (25, 3).
12Soulignons que les deux techniques d’échantillonnage ont été appliquées dans tous les statuts d’habitats accessibles de toutes les stations. L’analyse a porté uniquement sur les espèces dont les individus étaient vus et capturés. Tous les spécimens collectés étaient gardés dans les bocaux sur lesquels étaient reprises les indications relatives aux lieux de récolte et aux statuts d’habitats. Ils étaient ensuite identifiés, euthanasiés et fixés avant d’être conservés.
13L’identification faite à partir des guides (11, 12, 17, 42) a été complétée au Centre de Surveillance de la Biodiversité de l’Université de Kisangani. La similarité entre les habitats perturbés et non perturbés dans les quatre stations a été estimée avec le coefficient de Sørensen () (32) en tenant compte des données de présence/absence des espèces. Elle s’exprime par l’équation 1 :
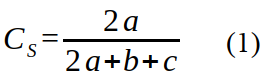
14avec a égal au nombre d’espèces présentes dans les deux habitats; b et c les nombres d’espèces présentes uniquement dans l’un des deux habitats. Une similarité faible est attendue lorsque la présence ou absence des espèces est fonction du taux de perturbations anthropiques.
15Afin de vérifier la relation entre les fréquences des espèces et la perturbation anthropique des habitats, le test de Chi-carré de Pearson (34) a été appliqué pour les espèces dont le nombre d’observations est supérieur ou égal à 5 pour chaque habitat étudié. Il permet d’identifier les différences des fréquences selon le statut. La régression linéaire simple entre les fréquences des espèces dans les deux statuts d’habitat a également été examinée. Si cette relation se caractérise par une pente 1:1 et une ordonnée à l’origine ou constante égale à 0, l’influence de la perturbation anthropique sur les fréquences est considérée non existante. Lorsqu’il n’y a pas de relation significative entre les fréquences ou qu’elle n’est pas caractérisée par les valeurs citées ci-dessus pour les coefficients de l’équation de la droite de régression, on présume une influence de la perturbation anthropique sur les abondances. Le test t de Student a été appliqué pour analyser la significativité de la régression.
Résultats
16Les effectifs des espèces par statut d’habitat dans les quatre stations renseignent que Ptychadena mascareniensis et Amietophrynus maculatus sont les espèces présentes dans toutes les stations et dans tous les statuts d’habitats. Ptychadena mascareniensis est l’espèce la plus abondante dans les habitats anthropisés. Amnirana albolabris, Afrixalus quadrivittatus, A. osorioi, Cryptothylax greshoffi sont plus abondantes dans les habitats non anthropisés. Amietophrynus maculatus, Leptopelis christyi, L. nordaequatorialis et Ptychadena aequiplicata sont présentes à proportion égale dans les deux statuts d’habitats, tandis que toutes les autres espèces y sont moins abondantes et à des proportions variables. Afrixalus quadrivittatus, Amietophrynus gracilipes, Arthroleptis variabilis, Cardioglossa gracilis, C. leucomystax, Hyperolius viridiflavus, Leptopelis aubryioides, Leptopelis ocellatus, Phrynobatrachus auritus, Ptychadena anchietae et P. chrysogaster vivent uniquement dans les habitats non anthropisés. Amietophrynus kisoloensis et Hoplobatrachus occipitalis sont présentes uniquement dans les habitats anthropisés, tandis que toutes les autres espèces exploitent les deux statuts d’habitats (Tableau 3).
Tableau 3 : Effectifs des Amphibiens capturés par statut d’habitat à Kasugho (2010), Butembo (2013), Mambasa (2014) et Kisangani (2015).
|
Kasugho |
Butembo |
Mambasa |
Kisangani |
Total |
||||||
|
Espèce |
A |
NA |
A |
NA |
A |
NA |
A |
NA |
A |
NA |
|
Afrixalus equatorialis Laurent, 1941 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
|
Afrixalus osorioi Ferreira, 1906 |
0 |
0 |
0 |
0 |
0 |
13 |
2 |
23 |
2 |
36 |
|
Afrixalus quadrivittatus Werner, 1908* |
0 |
0 |
0 |
0 |
0 |
0 |
11 |
48 |
11 |
48 |
|
Amietia angolensis Bocage, 1866 |
0 |
0 |
8 |
0 |
0 |
0 |
0 |
2 |
8 |
2 |
|
Amietophrynus gracilipes Boulenger, 1899 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
|
Amietophrynus kisoloensis Loveridge, 1932 |
0 |
0 |
14 |
0 |
0 |
0 |
0 |
0 |
14 |
0 |
|
Amietophrynus maculatus Hallowell, 1854* |
4 |
4 |
2 |
2 |
4 |
5 |
16 |
15 |
26 |
26 |
|
Amietophrynus regularis Reuss, 1833* |
5 |
3 |
0 |
0 |
4 |
2 |
9 |
5 |
18 |
10 |
|
Amnirana albolabris Hallowell, 1856* |
1 |
6 |
0 |
0 |
2 |
5 |
5 |
42 |
8 |
53 |
|
Arthroleptis variabilis Matshie, 1893 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
|
Cardioglossa gracilis Boulenger, 1900 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
3 |
|
Cardioglossa leucomystax Boulenger, 1903 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
5 |
0 |
5 |
|
Chiromantis rufescens Günther, 1869* |
0 |
0 |
0 |
0 |
0 |
0 |
5 |
10 |
5 |
10 |
|
Cryptothylax greshoffi Schilthuis, 1889* |
0 |
0 |
0 |
0 |
0 |
0 |
12 |
33 |
12 |
33 |
|
Hoplobatrachus occipitalis Günther, 1858 |
0 |
0 |
0 |
0 |
0 |
0 |
11 |
0 |
11 |
0 |
|
Hyperolius cinnamomeoventris Bocage, 1866 |
0 |
0 |
0 |
0 |
4 |
3 |
0 |
26 |
4 |
29 |
|
Hyperolius tuberculatus Mocquard, 1897* |
0 |
0 |
0 |
0 |
0 |
0 |
10 |
21 |
10 |
21 |
|
Hyperolius viridiflavus Duméril & Bibron, 1841 |
0 |
6 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
6 |
|
Leptopelis aubryi Duméril, 1856 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
19 |
2 |
19 |
|
Leptopelis aubryioides Anderson, 1907 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
0 |
3 |
|
Leptopelis calcaratus Boulenger, 1906 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
1 |
2 |
|
Leptopelis christyi Boulenger, 1912 |
1 |
1 |
0 |
0 |
0 |
0 |
1 |
1 |
2 |
2 |
|
Leptopelis nordequatorialis Perret, 1966 |
2 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
2 |
|
Leptopelis notatus Buchloz & Peters in Peters, 1875 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
2 |
1 |
2 |
|
Leptopelis ocellatus Mocquard, 1902 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
0 |
2 |
|
Phlyctimantis verrucosus Boulenger, 1912* |
0 |
0 |
0 |
0 |
0 |
0 |
9 |
13 |
9 |
13 |
|
Phrynobatrachus auritus Boulenger, 1900 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
|
Phrynobatrachus latifrons Ahl, 1924* |
0 |
5 |
0 |
0 |
0 |
0 |
5 |
19 |
5 |
24 |
|
Ptychadena aequiplicata Werner, 1908 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
1 |
|
Ptychadena anchietae Bocage, 1867 |
0 |
0 |
0 |
28 |
0 |
0 |
0 |
0 |
0 |
28 |
|
Ptychadena christyi Boulenger, 1919* |
0 |
0 |
0 |
0 |
0 |
0 |
7 |
12 |
7 |
12 |
|
Ptychadena chrysogaster Laurent, 1954 |
0 |
0 |
0 |
13 |
0 |
0 |
0 |
0 |
0 |
13 |
|
Ptychadena mascareniensis Duméril & Bibron, 1841* |
2 |
1 |
4 |
0 |
95 |
32 |
46 |
16 |
147 |
49 |
|
Ptychadena perreti Guibe & Lamotte, 1958 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
7 |
2 |
7 |
|
Xenopus cfr victorianus Ahl, 1924 |
3 |
14 |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
14 |
|
Xenopus pygmaeus Loumont, 1986 |
4 |
0 |
0 |
0 |
0 |
0 |
0 |
11 |
4 |
11 |
|
Xenopus tropicalis Gray, 1864 |
0 |
0 |
0 |
0 |
3 |
7 |
0 |
0 |
3 |
7 |
A = habitats anthropisés (étangs piscicoles et la jachère) ; NA = habitats non anthropisés (forêt primaire, forêt secondaire et le marécage). Voir tableau 1 pour la répartition des habitats par station de capture. Les espèces marquées par * ont été utilisées pour le test de Chi-carré.
17À Kasugho, Mambasa et Kisangani, la richesse spécifique des habitats non anthropisés est plus élevée que celle des habitats anthropisés (Tableau 3). La situation contraire a été constatée à Butembo. Les 37 espèces enregistrées se répartissent inéquitablement dans les statuts d’habitats : 2 espèces sont propres aux habitats anthropisés, 11 espèces sont inféodées aux habitats non anthropisés et 24 espèces s’adaptent mieux aux fluctuations des conditions diverses des habitats. A Kisangani et à Kasugho, il a été constaté un nombre élevé d’individus associé à une richesse spécifique élevée dans les zones non anthropisées que dans celles anthropisées. Par contre, à Butembo, au nombre élevé d’individus enregistré dans les zones non anthropisées, a été associée une faible richesse spécifique des Amphibiens. Tandis qu’à Mambasa, les zones non anthropisées sont moins riches en individus, mais avec une richesse spécifique légèrement supérieure à celle des zones anthropisées. Les données réunies des quatre stations renseignent que les zones non perturbées sont plus riches en individus avec une richesse spécifique plus élevée que les zones perturbées. De toutes les stations, Kisangani est la plus riche en termes d’individus avec une richesse spécifique élevée pour les deux statuts d’habitats.
18A Mambasa, les habitats ont fourni un taux élevé de similarité (92%) contrairement à Butembo où ce taux est faible (29%). Ainsi, selon la valeur accordée aux Amphibiens afin d’être utilisés comme bio-indicateurs des perturbations des habitats, la réponse est plus favorable sur base des données de Butembo. Mais, lorsque nous considérons les données de Mambasa, la réponse est plutôt défavorable car le taux de similarité est élevé. Kasugho et Kisangani respectivement avec 82 % et 75% de taux de similarité des habitats se situent entre ces deux extrêmes. Ces situations peuvent être justifiées par le nombre élevé d’habitats et leur connectivité (physique ou fonctionnelle) dans les trois stations. Le cas particulier à Butembo peut être interprété à partir du nombre réduit d’habitats exploités par chaque statut et leur isolement les uns des autres. Mais, malgré le taux de similarité élevé, il existe toujours des différences dans les fréquences des espèces au sein des habitats des trois stations : Kisangani, Mambasa et Kasugho (Tableau 4).
Tableau 4 : Similarité entre les habitats anthropisés et non anthropisés à Kasugho (2010), Butembo (2013), Mambasa (2014) et Kisangani (2015).
|
EA |
EN |
EA+N |
SA |
SN |
SA+N |
S’A |
S’N |
S’A+N |
Cs |
|
|
Kasugho |
22 |
42 |
64 |
8 |
9 |
10 |
1 |
2 |
7 |
0,82 |
|
Butembo |
28 |
43 |
71 |
4 |
3 |
6 |
3 |
2 |
1 |
0,29 |
|
Mambasa |
112 |
67 |
179 |
6 |
7 |
7 |
0 |
1 |
6 |
0,92 |
|
Kisangani |
156 |
345 |
501 |
19 |
29 |
30 |
1 |
11 |
18 |
0,75 |
|
Total |
318 |
497 |
815 |
26 |
35 |
37 |
2 |
11 |
24 |
0,79 |
EA : effectifs capturés dans les habitats anthropisés ; EN : effectifs capturés dans les habitats non anthropisés ; EA+N : nombre total d'effectifs capturés = EA + EN ; SA : nombre d’espèces enregistrées dans les habitats anthropisés ; SN : nombre d’espèces enregistrées dans les habitats non anthropisés ; SA+N : nombre total d’espèces enregistrées = S’A+ S’N+ S’A+N ; S’A : nombre d’espèces enregistrées uniquement dans les habitats anthropisés ; S’N : nombre d’espèces enregistrées uniquement dans les habitats non anthropisés ; S’A+N : nombre total d’espèces enregistrées dans les deux statuts d’habitat (anthropisé et non anthropisé) et Cs : coefficient de Sørensen.
19La valeur de Chi-carré obtenue (χ10(0,05) = 135,3) permet de conclure qu’il existe une relation significative entre le statut d’habitat et la communauté d’Amphibiens observée. Il convient de noter que le test en question ne portait pas sur les espèces absentes des deux statuts. La relation entre l’abondance des espèces et le statut d’habitat reflète donc une autre relation que celle identifiée lors d’une première lecture des tableaux 3 et 4, étant donné que les espèces absentes d’un des deux statuts d'habitat n’étaient pas éligibles en termes statistiques pour le test. Ceci impliquait que les 13 espèces uniquement observées dans un des deux statuts d’habitat (Tableau 4 ; S’A* et S’*N) n'étaient pas considérées dans cette analyse.
20L’examen de significativité de la droite obtenue à partir des fréquences d’espèces (Figure 2) selon le statut d’habitat (t=14,39 ; ddl=813 et p<0,05) indique que la droite est significative, elle ne passe pas par l’origine et sa pente n’est pas égale à 1. Il y a donc lieu de dire que les perturbations d’origine anthropique influencent les fréquences d’Amphibiens observés. Il convient de noter que, pour cette analyse, les espèces absentes dans les deux statuts n’ont pas été exclues, car ceci ne faisait pas partie des conditions d’application de ce test. Notons que la régression linéaire est caractérisée par un coefficient de détermination relativement faible, ce qui confirme l’importance d’autres variables (et nous présumons que le taux de perturbation anthropique en fait partie), pour la relation entre les fréquences observées dans les deux habitats.
21L’on peut donc conclure, sur base des analyses statistiques effectuées, qu’il y a un lien entre le statut d’habitat et la présence ou fréquence des espèces. Par conséquent, le potentiel des Amphibiens en tant qu’indicateurs des perturbations anthropiques a donc été démontré par cette méta-analyse.
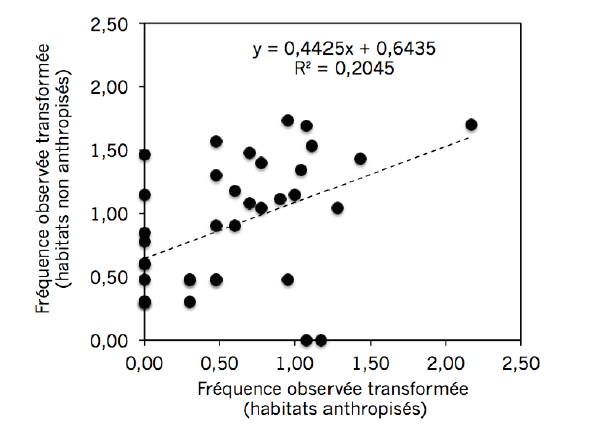
Figure 2 : Test de significativité de la corrélation linéaire entre les fréquences des Amphibiens dans les deux statuts d’habitat : habitats anthropisés versus habitats non anthropisés.
Analyse effectuée en considérant toutes les espèces rencontrées à Kasugho (2010), Butembo (2013), Mambasa (2014) et Kisangani (2015).
Discussion
22À partir de l’observation directe effectuée selon (43, 45), les Amphibiens ont été collectés. L’audition des chants, basée sur un temps d’écoute dont la durée est variable selon les espèces, a permis de capturer les espèces vocalement actives pendant la nuit (45). Les méthodes et techniques de captures des Amphibiens varient selon les auteurs (2, 3, 25, 26, 46, 50). Selon (3), les rendements sont influencés par l’expérience du chercheur et l’effort engagé dans la capture. Les captures à l’aide de l’observation visuelle et acoustique ont permis de couvrir rapidement de vastes zones dans un temps bien défini. Aussi, les méthodes de capture devraient être uniformisées afin de garantir les comparaisons (43).
23Nous avons recouru à ces deux types d’observation sur base des avantages qu’ils présentent. Les efforts d’échantillonnage dans les quatre stations ont permis de comparer les richesses spécifiques et les fréquences des Amphibiens dans les zones aux conditions écologiques variées. Selon (3), la durée d’installation des pièges varie entre 6 et 12 nuits consécutives par mois. Les captures des Amphibiens sont trouvées fructueuses pendant les saisons des pluies (40). Nous estimons que ceci serait dû à la présence permanente de l’eau. Ainsi, il a été conclu que le nombre très réduit d’études sur les Amphibiens rend difficile la définition de la période et de la durée d’échantillonnage afin d’établir les comparaisons (25).
24Les espèces enregistrées étant inégalement réparties dans les quatre stations : Kasugho (10 espèces), Butembo (6 espèces), Mambasa (7 espèces) et Kisangani (30 espèces), nous pensons que les efforts d’échantillonnage ont influencé les scores des captures. Vingt espèces ont été recensées en République du Congo (25), tandis que 16 ont été enregistrées dans une forêt humide semi-décidue au Ghana (48). Dans les localités au Nord de l’Algérie, 6 espèces ont été identifiées (3), contrairement à (46) qui ont récemment souligné l’existence de 7 espèces dans la partie Nord-Est.
25À Kisangani, dans un passé récent, une enquête préliminaire (28) a été réalisée selon laquelle 15 espèces sont présentes à Masako, une réserve forestière située dans cette éco-région et actuellement soumise à une forte pression anthropique. La richesse spécifique de notre étude reste ainsi élevée par rapport aux listes fournies par les travaux réalisés dans le passé. Selon que la richesse spécifique varie selon les statuts d’habitats, 26 espèces sont présentes dans les habitats anthropisés avec 2 espèces qui leur sont propres. Tandis que lors de leur étude dans les habitats dégradés en République du Congo, 12 espèces ont été listées (26). Dans les années suivantes, 14 espèces dans les mêmes statuts d’habitat au Ghana ont été reconnues (49). Parmi les espèces communes avec notre étude, figurent Hyperolius cinnamomeoventris, Hoplobatrachus occipitalis, Amnirana albolabris, Ptychadena anchietae, P. perreti, Amietophrynus maculaus, A. regularis et Phrynobatrachus latifrons.
26Certains chercheurs (28) sont partis de l’hypothèse qu’à Kisangani, les espèces d’Amphibiens sont sylvicoles, pourtant, nos résultats révèlent que leurs habitats sont aussi situés dans les zones dégradées. Ainsi, ont-ils conclu par exemple que Ptychadena mascareniensis vit le long des ruisseaux, des étangs piscicoles et rivières, des mares quasi permanentes et dans les alentours des habitations humaines comme nous l’avons aussi observé dans cette étude.
27Ceci peut traduire son degré élevé d’adaptation à une grande variété d’habitats afin de maintenir ses populations. L'hypothèse a été soutenue que la circulation des espèces d’Amphibiens à travers le paysage favorise leur survie (13). Bien qu’Amietophrynus maculatus soit tolérante aux habitats dégradés (20), Amietophrynus regularis, quant à elle, est savanicole, vit aussi en forêts, le long des routes forestières et dans les habitats perturbés (42). Nous avons enregistré les deux espèces dans les mêmes habitats avec Amietophrynus regularis qui est présente aussi dans les marécages. Ptychadena mascareniensis, P. perreti, Amietophrynus maculatus et Amnirana albolabris sont anthropophiles (17).
28Au-delà des habitats d’Amnirana albolabris qui sont situés en forêt primaire, en forêt secondaire et dans les marécages en Afrique de l’Ouest et Centrale (9), nous l’avons aussi enregistrée dans les habitats dégradés. Afrixalus quadrivittatus,* H. tuberculatus* et Leptopelis aubryi étant abondantes dans les habitats non perturbés, d'autres chercheurs (17) soulignent, par contre, qu’elles sont anthropophiles.
29La plus forte richesse spécifique dans les habitats naturels que dans ceux perturbés, peut se justifier par plusieurs facteurs : écologiques, microclimatiques ou physiologiques. Certains chercheurs (47) affirment que la richesse spécifique varie en fonction du statut d’habitat. La richesse spécifique élevée dans les habitats naturels est positivement corrélée avec le nombre élevé des niches écologiques (26).
30Selon (15), l’anthropisation entraîne la fragmentation des habitats et des populations d’Amphibiens et (26) attestent que la présence des espèces dans ces types d’habitats peut être liée à la capacité de colonisation propre à chaque espèce. Cette présence serait le résultat d’un hasard de récentes colonisations (47). La présence des Amphibiens dans les habitats exploités des quatre stations peut être justifiée par leur alimentation associée aux conditions écologiques des habitats. Elle est liée à leurs modes de vie auxquels sont associées les adaptations physiologiques (44). Nous pensons que les Amphibiens ont une alimentation spécialisée (5) et seraient des prédateurs opportunistes (19) dont le régime alimentaire varie selon les proies disponibles (18).
31La présence de différentes espèces dans les habitats des quatre stations peut être confirmée par la répartition géographique et la distribution écologique fournies dans la littérature (9, 11, 12, 17, 42). Certaines espèces sont largement distribuées et d’autres constituent des fragments des populations vivant dans des zones limitées (16). Les espèces sur lesquelles ont porté nos analyses font partie de la faune reconnue pour l’Afrique Centrale (17).
32Le nombre élevé et la connectivité des habitats seraient à la base des fortes similarités entre les habitats à Mambasa, Kasugho et Kisangani. A l’opposé, le nombre réduit et l’isolement des habitats les uns des autres auraient une influence sur la faible similarité entre les habitats à Butembo. Des similarités élevées entre la forêt dense et les zones de lisières dans la Réserve de Faune de la Lopé au Gabon ont été observées (7); ainsi ils ont conclu que l’absence du couvert végétal dans les lisières n’influence pas leur colonisation par les Amphibiens. Par contre, de faibles similarités ont été constatées (49) entre les forêts riveraines et les savanes boisées lors des études sur l’herpétofaune menacée au Ghana.
33Les différences des similarités peuvent être liées aux différences d’habitats et aux conditions écologiques imposées par leurs végétations caractéristiques. Les tests statistiques associés aux valeurs de similarité ont prouvé l’influence qu’ont les statuts d’habitat sur la présence/absence des espèces. Ainsi, parmi les Amphibiens inféodés aux habitats dégradés, certains chercheurs (17) distinguent les espèces ubiquistes, les espèces anthropophiles et les espèces parasylvicoles ; les espèces sylvicoles et savanicoles sont liées, selon eux, aux habitats non dégradés. Une corrélation entre la distribution des Amphibiens et les étages de végétation reconnus par les phytogéographes avait déjà été établie (1).
34Comme la plupart d’espèces recensées ont une assez large distribution pour tolérer différents niveaux de perturbations d’habitats, les Amphibiens peuvent ainsi être biogéographiquement intéressants pour apprécier la santé des écosystèmes. L’on peut donc se servir d’eux comme des unités de renseignements sur les perturbations de leurs habitats. La fusion, dans les analyses, des données des quatre stations a été motivée par la comparaison des listes spécifiques et les similarités entre les différents types d’habitats. Cette fusion des données n’influence pas les conclusions de cette étude.
Conclusion
35À partir de cette méta-analyse, nous avons pu mettre en évidence le lien entre l’anthropisation des habitats et la faune des Amphibiens. En effet, l’étude a pu démontrer qu’il y a certaines espèces qui semblent s’associer aux habitats non anthropisés (absentes des habitats anthropisés). Il s’agit des espèces : Afrixalus quadrivittatus, Amietophrynus gracilipes, Arthroleptis variabilis, Cardioglossa gracilis, C. leucomystax, Hyperolius viridiflavus, Leptopelis aubryioides, L. ocellatus, Phrynobatrachus auritus, Ptychadena anchietae et P. chrysogaster.
36À l’inverse, il y en a d’autres qui se révèlent uniquement présentes dans les habitats perturbés par l’homme. Ce sont : Amietophrynus kisoloensis et Hoplobatrachus occipitalis. Les résultats ont prouvé que les zones non perturbées hébergent plus d’individus avec une richesse spécifique plus élevée que les zones perturbées par l'Homme. Les similarités entre ces deux statuts d’habitat (anthropisé et non anthropisé) varient entre 29% et 92%. Cet intervalle au sein duquel varient ces similarités justifie le fait que ce volet peut être encore mieux exploité pour comprendre de façon plus approfondie les facteurs qui conditionnent ces variations.
37Les valeurs de similarité obtenues traduisent l’existence d’un potentiel de ces espèces absentes dans les deux statuts d’habitat ; ce sont par conséquent ces espèces qui pourraient renseigner sur le degré de perturbation des habitats et servir potentiellement comme espèces indicatrices. A partir de cette méta-analyse, il a été remarqué que les statuts d’habitat influencent les fréquences des espèces d’Amphibiens. Les analyses présentées n’ont pas tenu compte des facteurs comme la saison d'échantillonnage et la dispersion spatiale des stations afin d’évaluer leur influence sur la distribution des Amphibiens. C’est pourquoi, des études complémentaires sont jugées nécessaires pour encore mieux comprendre la relation entre les Amphibiens et le taux d'anthropisation de leurs habitats respectifs. Ces études permettront de dresser les listes fauniques propres à chaque statut d’habitat en considérant un nombre plus important de paramètres écologiques. Ces listes d'espèces indicatrices de la perturbation anthropique pourront orienter les gestionnaires des habitats naturels et semi-naturels lors du suivi de la santé des écosystèmes tropicaux.
Remerciements
38Les auteurs remercient le CIFOR à travers le Projet Forêts et Changement Climatique au Congo (FCCC) et l’Université de Liège à travers le Projet « Glocal Health » pour le soutien financier. Ils sont reconnaissants aussi envers le doctorant Nestor Luambua Kashikija de l’Université de Kisangani pour l’élaboration de la carte de localisation des stations d’échantillonnage.
Bibliographie
-
Amiet J.-L., 1987. Aires disjointes et taxons vicariants chez les Anoures du Cameroun : implications paléoclimatiques. Alytes 6(3-4), 99-115.
-
Aliko N.G., Assemian N.E., Boussou K.C., Keita G. & Konan K.F., 2018, Habitat-based breeding strategies of female Hoplobatrachus occipitalis (Anura: Discoglossidae) from Daloa department, Midwest of Cote d’Ivoire. International Journal of Research Studies in Zoology 4 (3), 28-36.
-
Amrouche-Larabi L., Denys C., Boukhemza M., Bensidhoum M., Hamani A., Nicolas V., Khifer L. & Mamou R., 2015, Inventaire des petits vertébrés terrestres de quelques localités du Nord Algérien. Travaux de l’Institut Scientifique, Série Générale 8, 85-95.
-
Arntzen J.W., Abrahams C., Meilink W.R., Iosif R. & Zuiderwijk A., 2017, Amphibian decline, ponds loss and reduced population connectivity under agricultural intensification over a 38 years period. Biodivers. Conserv. 16, 1411-1430.
-
Bellakhal M., Bellakhal F.M. & Missaoui H., 2010, Le régime alimentaire de la grenouille verte d’Afrique du Nord, Rana saharica. REDVET 11 (7), 1-14.
-
Ben Hassine J. & Nouira S., 2012, Répartition géographique et affinités écologiques des Amphibiens de Tunisie. Rev. Ecol. (Terre et Vie) 67, 437-457.
-
Blanc C. & Frétey T., 2004, Répartition écologique des Amphibiens dans la Réserve de Faune de la Lopé et la station biologique de la Makandé (Gabon). Bull. Soc. Zool. Fr. 129 (3), 297-315.
-
Boyemba B.F., 2011, Ecologie de Pericopsis elata (Harms) Van Meeuwen (Fabaceae), arbre de forêt tropicale africaine à répartition agrégée. Thèse de doctorat, Université Libre de Bruxelles, Bruxelles, 181p.
-
Burger M., Pauwels, O.S.G., Branch, W.R., Tobi, E., Yoga, J.A. & Mikolo, E.N., 2006, An assessment of the amphibian fauna of the Gamba Complex of protected areas, Gabon. pp. 297-307. In: Alonso A., M.E. Lee, P. Campbell, O.S.G. Pauwels & F. Dallmeier (editors). Bulletin of the Biological Society of Washington 12.
-
Catenazzi A., 2015, State of the world’s Amphibians. Annu. Rév. Environ. Resour. 40, 91-119.
-
Channing A., 2001, Amphibians of Central and Southern Africa, Comstock Publishing Associations, Ithaca and London, 455p.
-
Channing A. & Howell K.M., 2006, Amphibians of East Africa. Ed. Chimaira, 403p.
-
Decout S., Manel S., Miaud C. & Luque S., 2012, Integrative approach for landscape-based graph connectivity analysis: a case study with the common frog (Rana temporaria) in human-dominated landscapes. Landscape Ecol. 27, 267-279.
-
De Wasseige C., De Marcken P., Bayol N., Hiol F., Mayaux Ph., Desclée B., Nasi R., Billand A., Defourny P & Eba’a R. (Eds), 2012, Les forêts du bassin du Congo - État des forêts 2010. Office des publications de l’Union Européenne. Luxembourg. 276p.
-
El Hamoumi & Himm O., 2010, Distribution et état des lieux des peuplements d’Amphibiens dans le complexe de zones humides du bas Loukkos (Larache, Maroc). Bulletin de l’Institut Scientifique, Rabat 32 (2), 95-100.
-
Escoriza D. & Ben Hassine J., 2015, Niche partitioning at local and regional scale in the North African Salamandridae. J Herpetol. 49, 276-283.
-
Frétey T., Dewynter M. & Blanc C.P., 2000, Amphibiens d’Afrique Centrale et d’Angola. Clé de détermination illustrée des Amphibiens du Gabon et du Mbini, Collection Parthénope, France, 179p.
-
Hirai T. & Matsui M., 1999, Feeding habitats of the Pond Frog, Rana nigromaculata, inhabiting rice fields in Kyoto, Japan. Copeia 4, 940-947.
-
Horat P. & Semlitsch R.D., 1994, Effets of predation risk and hunger on the behavior of two species of tadpoles. Behav. Ecol. Sociobiol. 34, 393-401.
-
Howell K.M., 2010, Field Guide to the Amphibians of the Eastern Arc Mountains and Coastal Forests of Tanzania and Kenya, CPI, Nairobi, Kenya, 316p.
-
Iyongo W.M., Visser M., Verheyen E., Leirs H., Dudu A., Ulyel A. & Bogaert J., 2009a, Étude préliminaire des effets de lisière sur quatre espèces de rongeurs dans la Réserve Forestière de Masako (Kisangani, RD Congo). Ann. ISEA 4, 156-167.
-
Iyongo W.M., Visser M., Verheyen E., Leirs H., Iyongo B., Ulyel A. & Bogaert J., 2009b, Etude préliminaire des effets de la fragmentation des forêts sur la similarité des habitats et leurs richesses en espèces de rongeurs (Masako, RD Congo). Ann. ISEA 4, 177-186.
-
Iyongo W.M., Visser M., De Cannière C., Verheyen E., Dudu A., Ulyel A. & Bogaert J., 2012, Anthropisation et effets de lisière : impact sur la diversité des rongeurs dans la Réserve Forestière de Masako (Kisangani, RD Congo). Tropical Conservation Science 5 (3), 270-283.
-
Iyongo W.M., De Cannière C., Ulyel A., Dudu A., Bukasa K., Verheyen E. & Bogaert J., 2013, Effets de lisière et sexe-ratio de rongeurs forestiers dans un écosystème fragmenté en République Démocratique du Congo (Réserve de Masako, Kisangani). Tropicultura 31 (1), 3-9.
-
Jackson J. & Blackburn D., 2007, The amphibians and reptiles of Nouabale-Ndoki National Park, Republic of Congo. Salamandra 43 (3), 149-164.
-
Jackson J. & Blackburn D., 2010, A survey of Amphibians and reptiles at degraded sites near Pointe-Noire, Kouilou Province, Republic of Congo. Herpetological Conservation and Biology 5 (3), 414-429.
-
Kahindo M., 2011, Potentiel en produits forestiers autres que le bois d’œuvre dans les formations forestières de la région de Kisangani. Cas des rotins Eremospatha haullevilleana de Wild. et Laccosperma secundiflorum (P.Beauv.) Küntze de la Réserve Forestière de Yoko (Province Orientale, RD Congo). Thèse de Doctorat., Université de Kisangani, 269p.
-
Kazadi M.B. & Gevaerts H., 1986, Notes préliminaires sur la batrachofaune de Masako (Kisangani, Zaïre), Fam. Pipidae, Bufonidae et Ranidae. Ann. Fac. Sc. (N° Spécial), 39-43.
-
Knapp R.A., Fellers G.M., Kleeman P.M., Miller D.A.W., Vredenburg V.T., Rosenblum E.B. & Briggs C.J., 2016, Large-scale recovery of an endangered amphibian despite ongoing exposure to multiple stressors. PNAS 113 (42), 11889-11894.
-
Lawson D.P. & Klemens M.W., 2001, Herpetofauna of the African Rain Forest: Overview and recommendations for conservation, 291-310. In: Weber W., White L.J., Vedder A. & Naughton-Treves L., (editors): African Rain Forest Ecology and Conservation: An interdisciplinary perspective. Yale University Press, New Haven and London.
-
Leduc C.J., Kozlowicz J.K., Litzgus D.J., Lesbarreres D., 2012, Ecology of herpetofaunal populations in Smelting tailings wetlands. Herpetol. 5, 115-125.
-
Legendre P. & Legendre L., 1998, Numerical Ecology. Developments in Environmental Modelling. Elsevier Science B.V., Amsterdam, 853p.
-
Makana J.R., 1999, Forest structure, species diversity and spatial patterns of trees in monodominant and mixed stands in the Ituri forest, Democratic Republic of Congo. M.S. Thesis, Department of Forest Science, Oregon State University, 116p.
-
McCreery C., 2018, The chi-square Test: A test of Association between categorical variables. Magdalen College, Oxford Forum. Repéré à: http://www.celiagreen.com/charlesmccreery/statistics/chisquare.pdf
-
Meniko T.H., 2015, Impacts de la mobilité spécifique, de la connectivité des habitats et des activités anthropiques sur les populations de Rongeurs dans la Réserve forestière de Masako (Kisangani, RD Congo) : un écosystème fragmenté. Thèse de doctorat : Université de Kisangani, Faculté de Gestion des Ressources Naturelles Renouvelables, Kisangani (RD Congo), 212p.
-
Musubaho K.W. & Juakaly M., 2011, Diversité de la faune batracologique à Kasugho et ses environs (RD Congo). Conserv. & Société, UCNDK. 1 (2), 33-46.
-
Musubaho K.W., Mapoli M. & Gembu T., 2015, Diversité de l’herpéto-batracofaune à Mambasa (RD Congo). Conserv. & Société, UCNDK 1 (5), 48-63.
-
Musubaho K.W., 2016, Diversité des Amphibiens dans les forêts de Kisangani et ses environs : Réserves Forestières de Yoko et Masako (RD Congo). Conserv. & Société, UCNDK 1 (5), 13-24.
-
Musubaho K.W. & Muhinda N., 2016, Contribution à l’inventaire systématique des Amphibiens en Ville de Butembo : Communes Kimemi et Mususa (RD Congo). Conserv. & Société, UCNDK 1 (8), 1-6.
-
Omogbai E.K.I., Nworgu Z.A.M., Imhafidon M.A., Ikpeme A.A., Ojo D.O & Nwako C.N., 2002, Snakes bites in Nigeria: A study of the prevalence and treatment in Benin City. Trop. J. Pharm. Research 1 (1), 39-44.
-
Potapov P.V., Turubanova S.A., Hansen M.C., Adusei B., Broich M., Altstatt A., Mane L. & Justice C.O., 2012, Quantifying forest cover loss in Democratic Republic of the Congo, 2000-2010, with Landsat ETM+data. Remote Sensing of Environment 122, 106-116.
-
Rödel M.-O., 2000, Herpetofauna of West Africa 1. Amphibians of the West African Savana. Ed. Chimaira, Franckfurt am Main, 332p.
-
Rödel M-O. & Ernst, R., 2004, Measuring and monitoring amphibian diversity in tropical forests. I. An evaluation of methods with recommendations for standardization. Ecotropica 10 (1), 1-14.
-
Sinsch U., Böcking H., Leskovar C., Öz M. & Veith M., 2017, Demography and lifetime growth patterns in viviparous salamanders (genus Lyciasalamandra): living underground attenuates interspecific variation. Zoologischer Anzeiger 269, 48-56.
-
Tanguy A. & Gourdain P., 2011, Guide méthodologique pour les inventaires faunistiques des espèces métropolitaines terrestres-Atlas de la biodiversité dans les communes. Muséum National d’Histoire Naturelle, Vol. 2, 195p.
-
Tlidjane A., Menaa M., Rebbah A.C., Tellailia S., Seddik S., Chefrour A. & Maazi M.C., 2019, La richesse et la distribution des Amphibiens dans la région de Souk Ahras (Nord-Est de l’Algérie). Bull. Soc. Zool. Fr. 144 (4), 179-201.
-
Vignoli L., Pau F., Luiselli L. & Carpaneto G.M., 2010, Co-occurrence patterns of five species of anurans at a pond network in Victoria Lake, Kenya. African Journal of Ecology 48, 275-279.
-
Yahaya M., Attuquayefio D.K., Owusu E.H., Holbech L.H & Ofori B., 2013, A conservation assessment of the herpetofauna of moist semi-deciduous forest in Ghana. JBES. 3 (12), 186-197.
-
Yahaya M., Attuquayefio D.K., Ofori B,Y. & Owusu E.H., 2015, Herpetofauna under threat: A study of Kogyae Strict Nature Reserve in Ghana. Int. J. Biodivers. Conserv. 7 (11), 420-428.
-
Zimkus B.M., Lawson L.P., Barej M.F., Barratt C.D., Channing A., Dash K.M., Delhing J.M., Du Preez L. Gehring P-S., Greenbaum E., Gvozdìk V., Harvey J., Kielgast J., Kusamba C., Nagy Z.T., Pabijan M., Penner J., Rödel M-O., Vences M. & Lötters S., 2017, Leapfrogging into new territory: How Mascarene ridged frogs diversified across Africa and Madagascar to maintain their ecological nice. Molecular Phylogenetics and Evolution. 106, 254-269.
Om dit artikel te citeren:
Over : Loving Musubaho Kako-Wanzalire
MSc, Enseignant, Département d’Écologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Conservation de la Nature et de Développement à Kasugho/Goma (RD Congo) ; Doctorant, Unité Biodiversité et Paysage, Université de Liège, Gembloux Agro-Bio Tech, 2 Passage des Déportés, 5030, Gembloux (Belgique).
Auteur correspondant : lovingkakow2@gmail.com
Over : Léon Iyongo Waya Mongo
PhD, Professeur Associé, Enseignant, Section des Eaux et Forêts, Institut Supérieur d’Études Agronomiques de Bengamisa/Kisangani, 202, RD Congo.
Over : Marc Boketshu Ilonga
Enseignant-Chercheur, Section d’Agronomie Générale, Institut Supérieur d’Etudes Agronomiques de Yatolema, 2324, Opala/RD Congo.
Over : Joël Mbusa Mapoli
Enseignant-Chercheur, Département d’Écologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Conservation de la Nature et de Développement à Kasugho/Goma (RD Congo).
Over : Jean-Louis Juakaly Mbumba
PhD, Professeur, Enseignant, Département d’Écologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Kisangani, 2012, Kisangani (RD Congo).
Over : Sylvie Muhinda Neema
Chercheuse, Département d’Ecologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Conservation de la Nature et de Développement à Kasugho/Goma (RD Congo).
Over : Guy-Crispin Gembu Tungaluna
PhD, Professeur, Enseignant, Département d’Ecologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Kisangani, 2012, Kisangani (RD Congo). Centre de Surveillance de la Biodiversité, Faculté des Sciences, Université de Kisangani, 2012, Kisangani (RD Congo).
Over : Jean-Claude Mukinzi Itoka
PhD, Professeur Associé, Enseignant, Département d’Ecologie et Gestion des Ressources Animales, Faculté des Sciences, Université de Kisangani, 2012, Kisangani (RD Congo).
Over : Jan Bogaert
PhD, Professeur Ordinaire, Enseignant, Unité Biodiversité et Paysage, Université de Liège, Gembloux Agro-Bio Tech, 2 Passage des Déportés, 5030, Gembloux (Belgique).