- Portada
- Volume 40 (2022)
- numéro 1
- Valeurs nutritives, propriétés antioxydantes et cytotoxicité des cossettes de Dioscorea dumetorum pour la valorisation en alimentation animale et humaine au Bénin
Vista(s): 3313 (18 ULiège)
Descargar(s): 0 (0 ULiège)
Valeurs nutritives, propriétés antioxydantes et cytotoxicité des cossettes de Dioscorea dumetorum pour la valorisation en alimentation animale et humaine au Bénin

Résumé
Le présent travail vise à évaluer la valeur nutritive et les propriétés antioxydantes de D. dumetorum pour une meilleure valorisation en alimentation humaine et animale. Les tubercules frais ont été découpés en morceaux, cuits dans l’eau pendant 30, 60 et 90 minutes puis séchés au soleil pour obtenir respectivement des cossettes CD30, CD60 et CD90. Les dosages chimiques et phytochimiques ont été réalisés sur les différents types de cossettes. La teneur en cendres totales a varié de 3,36 à 3,55 %. La teneur en protéines brutes a varié de 7,86 à 9,8 %. Quant à la teneur en cellulose brute, elle a varié de 0,69 à 1,71 %. Au total, 10 classes de métabolites secondaires sont présentes dans les cossettes. Les teneurs en polyphénols totaux, en flavonoïdes et en tanins sont plus élevées dans les cossettes CD30. Le taux d’inhibition des radicaux libres a varié de 51,97 à 54,08 %. La valeur de concentration inhibitrice 50 % a varié de 2,62 à 12,10 µg/mL dans les cossettes. D. dumetorum est une ressource alimentaire dont la capacité antioxydant pourrait contribuer à la prévention des dommages causés par le stress oxydatif et par conséquent à l’amélioration de la productivité chez les animaux.
Abstract
Nutritional values, antioxidant properties and cytotoxicity of Dioscorea dumetorum chips for valorization in animal and human food in Benin.
The aim of this work was to assess the nutritional value and antioxidant properties of D. dumetorum for better use in human and animal nutrition. The fresh tubers were cut into pieces, cooked in water for 30, 60 and 90 minutes, then sun dried to obtain CD30, CD60 and CD90 chips respectively. Chemical and phytochemical assays were carried out on different types of chips. The total ash content varied from 3.36 to 3.55 %. The crude proteins content varied from 7.86 to 9.8 %, while the crude cellulose content varied from 0.69 to 1.71 %. A total of 10 classes of secondary metabolites are present in the chips. The contents of total polyphenols, flavonoids and tannins are higher in the CD30 chips. The rate of free radical inhibition ranged from 51.97 to 54.08 %. The 50 % inhibitory concentration value varied from 2.62 to 12.10 µg / mL in the chips. D. dumetorum is a food resource that antioxidant capacity could help prevent damage caused by oxidative stress and therefore improve productivity in animals.
Tabla de contenidos
Introduction
1La culture de Dioscorea dumetorum est relativement répandue au Bénin et constitue un aliment d’appoint pour la sécurité alimentaire. Toutefois, la capacité de stockage des tubercules est limitée à cause du phénomène de durcissement de la peau qui se produit dans les 48 heures suivant la récolte et les rend impropres à la consommation humaine, même après de longues heures de cuisson (4). Les auteurs signalent que cela limite leur production et leur commercialisation en dehors des zones de production. Ce qui affecte négativement sa valeur économique et nutritive en tant qu'aliment. Ce durcissement post-récolte des tubercules de D. dumetorum résulte de l’apparition d’épaississements membranaires au niveau du parenchyme amylifère et qui s’accompagne d’une augmentation des teneurs en certains constituants pariétaux, notamment en lignine et en pentosanes (39).
2Pour la fabrication des cossettes des autres espèces d’igname, les tubercules sont épluchés, découpés ou non en morceaux, puis cuits à l’eau et séchés au soleil (9). Ce procédé présente l’avantage d’éviter le noircissement de la surface des morceaux de tubercules séchés au soleil et de limiter les attaques d’insectes au cours du stockage. Mais, cette technologie de transformation et de conservation en cossette n’est pas jusque-là appliquée à Dioscorea dumetorum pour son utilisation ultérieure.
3En général, les plantes à racines et tubercules ne sont pas facilement digérées dans leur état naturel et doivent être cuites avant d'être consommées (18). Ces auteurs signalent que la cuisson améliore leur digestibilité, favorise la palatabilité et améliore leur qualité de conservation tout en rendant les racines plus sûres à manger. L’une des contraintes de l’utilisation de D. dumetorum est son goût amer (12), qui peut être éliminé durant la cuisson (17). Les travaux ont montré que la durée de cuisson des tubercules crus (18), de leur trempage (12) et de leur blanchiment (16) diminuent la teneur en facteurs antinutritionnels (12, 16, 18) des tubercules traités de Dioscorea dumetorum.
4Du point de vue qualité nutritive, la teneur en protéines brutes des tubercules crus de D. dumetorum cultivé est de l’ordre de 11,41 % MS (18). Son profil en acides aminés essentiels est assez équilibré, mais légèrement déficitaire en lysine (5). Ses amidons sont solubles et faciles à digérer (1). D. dumetorum est également une source potentielle d’acides gras essentiels, principalement l’acide linoléique, dont la teneur varie de 35,98 à 39,77 % (6). Outre ces valeurs nutritionnelles, les tubercules crus de D. dumetorum possèdent des propriétés hypoglycémiques (33), hypocholestérolémiques (34), antimicrobiennes et antioxydantes (42).
5Concernant les propriétés antioxydantes, la teneur en composés phénoliques (22,83 et 28,67 mg GEA/g) des tubercules de variétés consommables et non consommables de D. dumetorum transformées est bien corrélée avec le potentiel antioxydant (42). Selon Doka et al. (15), le traitement à l’eau chaude pendant 10 minutes de la variété non cultivée n'a pas changé de manière significative l’activité antioxydante des tubercules transformés (IC50=74,13 mg/L dans le test DPPH) bien qu’une diminution significative des teneurs totales en composés phénoliques (60 %) et en vitamine C (56,7 %) ont été observées.
6Les producteurs béninois cultivent les variétés D. dumetorum à chair blanche et à chair jaune (27). Malheureusement, aucune des deux variétés de D. dumetorum cultivées n'a été étudiée en termes de mode de transformation, de valeur nutritive et potentiel antioxydant. Les travaux effectués au Nigeria sur la variété à chair jaune cultivée (18), bouillie pendant 30, 60 et 90 minutes, n’ont pas abordé les classes de métabolites secondaires, l’activité antioxydante et la cytotoxicité des tubercules transformés. Par contre, les travaux de Doka et al. (15) ont porté sur la variété non cultivée du Soudan dont la couleur de la chair n’est pas précisée.
7Ces auteurs pour la transformation ont procédé au trempage des morceaux de tubercules dans l’eau pendant trois jours, puis bouillis pendant 10 minutes. Ces travaux, n’ont pas aussi abordé les classes de métabolites secondaires, les teneurs en tanins et en flavonoïdes pour les composés phénoliques et la cytotoxicité des tubercules transformés de la variété non cultivée. Par ailleurs, la valeur nutritive en termes de teneurs en cendres totales (CT) et en cellulose brute (CB) n’a pas non plus été abordée par ces auteurs.
8L’intérêt de ce travail est d’apporter des informations scientifiques sur la variété de D. dumetorum à chair jaune cultivée au Bénin et de combler le vide d’information sur le potentiel antioxydant des tubercules bouillis puis séchés, sujet peu abordé par les précédents travaux de la sous-région. Ainsi, le présent travail vise à évaluer la composition nutritionnelle, le profil phytochimique et la capacité antioxydante des cossettes de D. dumetorum pour leur valorisation en alimentation animale et humaine.
Matériel et méthodes
9Procédés de transformation des tubercules de Dioscorea dumetorum en cossettes
10Les tubercules de D. dumetorum à chair jaune ont été collectés chez un producteur de la commune d’Adja-Ouèrè au Sud-Est du Bénin. Pour produire les cossettes, des échantillons de tubercule de diamètre moyen 4 ± 0,28 cm ont été lavés, épluchés puis divisés en 3 lots de 2 kg. Chaque lot de tubercules de D. dumetorum a été cuit à 100°C sur une cuisinière pendant 30, 60 et 90 minutes pour obtenir respectivement des types de cossettes CD30, CD60 et CD90 après découpes (40 ± 1,53 g) et séchage au soleil sur une bâche, jusqu’à poids constant.
Détermination de la valeur nutritionnelle des cossettes de D. dumetorum
11La méthode de AOAC (7) a été utilisée pour déterminer la teneur en matière sèche (MS), cendres totales (CT), matière azotée totale (MAT), matière grasse (MG) et la cellulose brute (CB). La matière sèche, cendre totale et la matière azotée totale ont porté sur trois échantillons de cossettes séchées de CD30, CD60 et CD90. Pour la matière grasse et la cellulose brute, l’analyse a été effectuée sur un échantillon composite constitué à partir des trois échantillons de chaque type de cossette.
Criblage phytochimique de D. dumetorum
12A partir de trois échantillons de chaque type de cossette, un échantillon composite a été constitué pour le criblage phytochimique. Ce criblage phytochimique de D. dumetorum a été effectué suivant le protocole décrit par (21), mais revue et adaptée aux conditions du Laboratoire de Pharmacognosie et des Huiles Essentielle (LaPHE). Les différents groupes chimiques recherchés et les tests de leur mise en évidence sont mentionnés dans le tableau 1.
Tableau 1 : Test de mise en évidence des principales classes de métabolites secondaires
|
Groupes chimiques |
Test de mise en évidence |
Résultats positifs |
|
Alcaloïdes |
- Réactif de Dragendorff - Réactif de Mayer |
Précipité rouge Précipité jaune |
|
Tanins |
- Chlorure ferrique |
Coloration bleu-noire |
|
Tanins catéchiques |
Réactif de Stiasny |
Précipité rose |
|
Tanins galliques |
Chlorure ferrique et saturation avec acétate de sodium |
Teinte bleue ou noire |
|
Flavonoïdes |
Test de Shinoda (réaction à la cyanidine) |
Coloration : - Orangée (flavones) - Rouge (Flavonols) - Violette (Flavonones) |
|
Anthocyanes |
Acide chlorhydrique et ammoniaque à 50 % |
Coloration : - Rouge (milieu acide) -Bleue violacée (milieu alcalin) |
|
Leuco-anthocyanes |
Réaction de Shinoda |
Coloration rouge cerise |
|
Dérivés quinoniques |
Réactif de Born-trager |
Coloration rose à rouge violacée |
|
Saponosides |
Test d’indice de mousse |
IM > 100 |
|
Triterpénoïdes |
Réaction de Liebermann-Buchard |
Coloration violette à bleue ou verte |
|
Stéroïdes |
Réaction de Kedde |
Coloration rouge pourpre ou rouge au vin |
|
Cardénolides |
Réaction de Raymond |
Coloration bleue |
|
Dérivés Cyanogéniques |
Réaction de Guignard |
Coloration orange à marron |
|
Mucilages |
Test d’alcool absolu |
Précipité floconneux |
|
Composés réducteurs |
Test avec liqueur de Fehling |
Précipité rouge-brique |
|
Coumarines |
Test avec ammoniaque à 25 % |
Fluorescence intense |
Extraction de la poudre des cossettes de D. dumetorum
13Un échantillon composite de 50 g de poudre de chaque type de cossette a été macéré avec le méthanol pendant 72 h. Le mélange a été filtré sur du coton hydrophile et du papier filtre, puis les filtrats obtenus ont été évaporés à l’aide d’un Rotavapor (RE300-Stuart). Les extraits obtenus ont été conservés au réfrigérateur pour doser les polyphénols totaux, les flavonoïdes et les tanins, déterminer le potentiel antioxydant et la cytotoxicité. Le rendement d'extraction a été obtenu par la formule suivante :
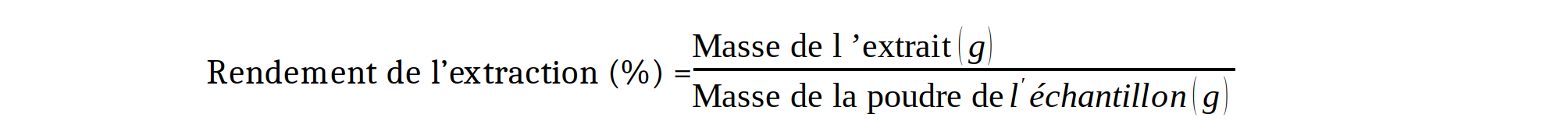
Dosage des polyphénols totaux
14La teneur en polyphénols totaux des extraits a été déterminée par la méthode de Singleton et Rossi (40), avec quelques légères modifications. Un volume de 125 µL de l'extrait (1 mg/mL) a été introduit dans les tubes à essai, suivi de 625 µL de réactif de Folin-Ciocalteu (10 %), puis le mélange a été agité. Après 5 minutes, 500 uL de bicarbonate de sodium (75 mg/mL) et 4,75 mL d'eau distillée y sont ajoutés respectivement. Le nouveau mélange a été agité et laissé au repos pendant 1 heure à la température ambiante. L'absorbance a été mesurée par spectrophotométrie à 765 nm. L'acide gallique a été utilisé comme standard pour quantifier les polyphénols totaux. Les résultats sont ainsi exprimés en milligrammes d'équivalent acide gallique (EAG) par gramme d'extrait (mg EAG/g).
Dosage des flavonoïdes
15La teneur totale en flavonoïdes des extraits a été estimée par la méthode du trichloride d’aluminium (AlCl3) (26, 45). A 500 µL de chaque extrait (1 mg/mL) a été ajouté successivement 500 µL de réactif au trichlorure d'aluminium (2 %) et 3 mL d'eau distillée. Le mélange obtenu a été agité et laissé au repos pendant 15 minutes à la température ambiante. L'absorbance a été lue à 415 nm. Les résultats sont exprimés en milligrammes d’équivalent de quercétine (EQ) par gramme d’extrait (mg EQ/g).
Dosage des tanins condensés
16Le dosage des tanins condensés a été réalisé selon la méthode à la vanilline sulfurique (11), modifié par (20). Un volume de 500 μL de chaque extrait a été ajouté à 1 mL de réactif de vanilline sulfurique (4 %) ; le mélange a été agité puis incubé pendant 15 minutes. L’absorbance a été mesurée à 500 nm à l’aide d’un spectrophotomètre. Les résultats ont été exprimés en milligrammes équivalent de catéchine (EC) par gramme d’extrait (mg EC/g).
Test de piégeage du radical 1-diphenyl-2-picrylhydrazyl (DPPH)
17Le test a été réalisé selon le protocole décrit par Panichayupakaranant et Kaewsuwan (35). Chaque solution mère d’extrait (1 mg/mL) a été diluée suivant une série géométrique de raison 2 dans 10 tubes à essai pour en avoir différentes concentrations. Puis, 1 mL de la solution de DPPH (0,04 mg/mL) y est ajouté dans chacun de ces tubes. Le mélange a été agité puis incubé pendant 30 minutes à l’abri de la lumière. A la fin de l’incubation, l’absorbance a été lue à 517 nm au spectrophotomètre. Le contrôle positif a été représenté par l’acide ascorbique puis traité dans les mêmes conditions que l’échantillon test. Le pourcentage d’inhibition du radical DPPH a été obtenu par la formule suivante :
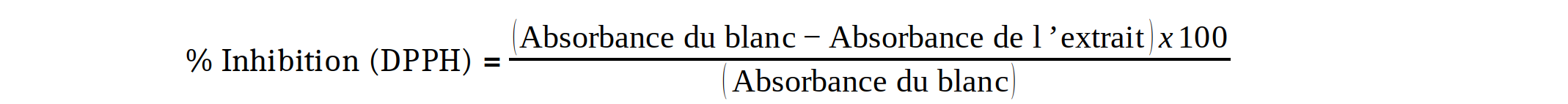
18La valeur CI50 est la concentration du substrat qui cause la perte de 50 % de l’activité de DPPH. Cette concentration a été déterminée graphiquement puis exprimée en µg/mL.
Test de cytotoxicité
19Le test de cytotoxicité des extraits a été réalisé sur les larves de Artemia salina Lech. (crevette saumure) en utilisant la méthode de Solis et al.(41). Les œufs de Artemia salina ont été éclos après incubation à la température du laboratoire (28-30°C) pendant 48 h dans un Erlenmeyer contenant de l’eau de mer et mis sous agitation douce. Une gamme de concentrations décroissantes des extraits a été réalisée dans 10 tubes à essai, en procédant à une dilution, en série géométrique de raison 2, de chaque solution mère (25 mg/mL). Ensuite, 16 larves ont été ensemencées dans chacun de ces tubes, mis ensuite à incubation pendant 24 h à la température du laboratoire (28-30°C). A la fin de l’incubation, le nombre de larves survivantes et mortes ont été comptés puis enregistrés au niveau de chaque tube. La concentration létale CL50 a été déterminée graphiquement en utilisant la courbe de meilleur ajustement donnant la concentration équivalente au décès de la moitié des larves. Cette méthode a été utilisé par Houmènou et al.(22).
20Le dosage des polyphénols totaux, des flavonoïdes, des tanins condensés, le test de piégeage du radical 1-diphenyl-2-picrylhydrazyl et la cytotoxicité ont été réalisés sur trois différents extraits de chaque type d’échantillon de cossette.
Analyses statistiques
21Les données de valeur nutritive (MS, CT et MAT), de potentiel antioxydant et de cytotoxicité des cossettes de D. dumetorum ont été soumises à un analyse de variance (ANOVA) à un critère, le mode de transformation de D. dumetorum, à l’aide du logiciel R (44). En cas de différence significative, le test de Student-Newman-Keuls a été appliqué à l’aide du package agricolae (14) pour faire la structuration des moyennes au seuil de 5 %. Les moyennes ajustées ont été calculées avec le package emmeans (29).
Résultats
Valeur nutritive des cossettes de D. dumetorum
22La teneur en matière sèche a varié de 93,5 à 95,5 % MS (tableau 2). Elle est plus élevée dans les cossettes CD30. La teneur en cendres totales a varié de 3,36 à 3,55 %. Elle est similaire pour tous les types de cossettes. La teneur en matière azotée totale a varié de 7,86 à 9,8 %. Elle est plus élevée pour les cossettes CD30. La teneur en matière grasse est similaire pour toutes les cossettes. Quant à la teneur en cellulose brute, elle a varié de 0,69 à 1,71 %.
Tableau 2 : Valeur nutritionnelle ( % MS) des cossettes de D. dumetorum
|
Type de cossette |
Matière sèche |
Cendre totale |
Matière azotée totale |
Matière grasse |
Cellulose brute |
|
CD30 |
95,52a |
3,55a |
9,8a |
0,38 |
0,69 |
|
CD60 |
93,87b |
3,43a |
8,62b |
0,25 |
0,79 |
|
CD90 |
93,58b |
3,36a |
7,86b |
0,24 |
1,71 |
|
SE |
0,29 |
0,15 |
0,25 |
- |
- |
|
Prob |
0,01 |
0,71 |
0,01 |
- |
- |
CD30 : cossettes obtenues après 30 minutes de cuisson de D. dumetorum, CD60 : cossettes obtenues après 60 minutes de cuisson de D. dumetorum, CD90 : cossettes obtenues après 90 minutes de cuisson de D. dumetorum, SE : Erreur standard résiduel, Prob : Probabilité, (a, b) : indique que les moyennes suivies des différentes lettres dans une même colonne sont significativement différentes au seuil de 5 %.
Composés phytochimique des cossettes de D. dumetorum
23Au total, 10 classes de métabolites secondaires ont été identifiées dans les cossettes de D. dumetorum (tableau 3). Le mode de transformation de D. dumetorum n’a pas affecté cette composition chimique.
Tableau 3 : Classes de métabolites secondaires identifiées dans les cossettes de D. dumetorum
|
Classes de composés chimiques |
Type de cossettes de D. dumetorum |
||
|
CD30 |
CD60 |
CD90 |
|
|
Alcaloïdes |
+ |
+ |
+ |
|
Tanins catéchétique |
+ |
+ |
+ |
|
Tanins galliques |
- |
- |
- |
|
Flavones |
+ |
+ |
+ |
|
Flavonols |
+ |
+ |
+ |
|
Flavonones |
- |
- |
- |
|
Anthocyanes |
+ |
+ |
+ |
|
Leuco-anthocyanes |
+ |
+ |
+ |
|
Dérivés quinoniques |
- |
- |
- |
|
Saponosides |
+ |
+ |
+ |
|
Triterpénoïdes |
- |
- |
- |
|
Stéroïdes |
- |
- |
- |
|
Cardénolides |
- |
- |
- |
|
Dérivés Cyanogéniques |
- |
- |
- |
|
Mucilages |
+ |
+ |
+ |
|
Composés réducteurs |
+ |
+ |
+ |
|
Coumarines |
+ |
+ |
+ |
CD30 : cossettes obtenues après 30 minutes de cuisson de D. dumetorum, CD60 : cossettes obtenues après 60 minutes de cuisson de D. dumetorum, CD90 : cossettes obtenues après 90 minutes de cuisson de D. dumetorum, + : Test positif/présence, - : test négatif/absence
Classes de composés chimiques, potentiel antioxydant et cytotoxicité
24L’extraction des cossettes CD30 avec le méthanol a présenté le rendement élevé (7,65 %) suivi respectivement de celle de CD60 (7,63 %) et CD90 (6,01 %). Les teneurs en polyphénols totaux ont varié de 2,49 à 4,09 mg EAG/g, celles en flavonoïdes sont comprises entre 1,10 à 2,49 mg EQ/g et les teneurs en tanins ont varié de 0,33 à 0,68 mg EC/g au niveau des cossettes (Tableau 4). Ces teneurs sont plus élevées (P< 0,001) dans les cossettes CD30. Concernant le potentiel antioxydant, le taux d’inhibition a varié de 51,97 à 54,08 %. Ces taux sont faibles (P< 0,001) par rapport à l’antioxydant standard (Acide Ascorbique), soit 97,46 %. La valeur de CI50 a varié de 2,62 à 12,27 µg/mL dans les cossettes. La valeur CI50 (0,25 µg/mL) du standard est significativement plus faible. La toxicité larvaire a montré des valeurs de CL50 variant de 0,51 à 0,87 mg/mL avec une valeur élevée pour CD90.
Tableau 4 : Composés chimiques, potentiel antioxydant et toxicité larvaire des cossettes de D. dumetorum
|
Types de cossettes |
Composés phénoliques |
Potentiel/Activité antioxydant |
Toxicité larvaire |
|||||
|
Polyphénols (mg EAG/g ) |
Flavonoïdes (mg EQ/g) |
Tanins (mg EC/g) |
% Inhibition |
CI50 (µg/mL) |
CL50 (mg/mL) |
|||
|
CD30 |
4,09a |
2,49a |
0,68a |
54,08b |
2,62c |
0,51c |
||
|
CD60 |
3,42b |
2,06b |
0,57b |
53,33c |
8,48b |
0,67b |
||
|
CD90 |
2,49c |
1,10c |
0,33c |
51,97d |
12,27a |
0,87a |
||
|
AS |
ND |
ND |
ND |
97,46a |
0,25d |
ND |
||
|
SE |
0,03 |
0,05 |
0,01 |
0,13 |
0,21 |
0,03 |
||
|
Prob. |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
< 0,001 |
0 |
||
CD30 : cossettes obtenues après 30 minutes de cuisson de D. dumetorum, CD60 : cossettes obtenues après 60 minutes de cuisson de D. dumetorum, CD90 : cossettes obtenues après 90 minutes de cuisson de D. dumetorum, SE : Erreur standard résiduel, Prob : Probabilité, AS : Acide ascorbique, EAG : Equivalent d’acide gallique, EQ : Equivalent de quercétine, EC : Equivalent de catéchine, CI50 : Concentration inhibitrice 50 %, CL50 : Concentration létale 50 %, ND : Non déterminé, (a, b, c, d) : indique que les moyennes suivies des différentes lettres dans une même colonne sont significativement différentes au seuil de 5 %.
Discussion
Valeur nutritive des cossettes de D. dumetorum
25Le mode de traitement à savoir la durée de cuisson dans l’eau suivie du séchage solaire des tubercules de D. dumetorum, permet la conversion de la denrée périssable en un produit stabilisé par déshydratation. Ce qui éviterait les attaques microbiennes et la dégradation de la qualité du produit liée aux réactions biochimiques indésirables. Enfin, ce procédé de transformation facilite la conservation et permet de réduire les pertes post-récolte pour une utilisation ultérieure. Ainsi, la valeur alimentaire des cossettes de D. dumetorum est comparable ou plus élevée à d’autres ingrédients alimentaires.
26En effet, la teneur en protéines des cossettes de D. dumetorum obtenues après 30 ou 60 minutes de cuisson est supérieure ou comparable au taux de 8,5 % MS rapportée pour le maïs blanc (19, 23, 38). Elle est largement supérieure à 1,2-1,8 % signalé pour le manioc (13), à 6,43 % pour le taro (2) et à 3,23-6,21 % pour le riz (8).
27Toutefois, pour les mêmes durées de cuisson, les valeurs de MAT obtenues au cours du présent travail sont nettement inférieures à celles enregistrées par Ezeocha et al. (18). Par ailleurs, les teneurs en matière sèche, en matière azotée totale et en matière grasse diminuent avec l’augmentation de la durée de cuisson des tubercules comme l’a observé Ezeocha et al. (18). Cette réduction de la MS pourrait résulter de la capacité des tubercules à absorber de l’eau durant la cuisson. Quant à la diminution de MAT, cela pourrait être du à la perte d'acides aminés libres qui se produit par lessivage comme l’ont rapporté Ezeocha et al. (18). Par contre, La cuisson des tubercules dans l’eau indique une tendance de diminution non significative de la teneur en cendre avec la durée de cuisson.
28Une durée de cuisson longue augmente la teneur en fibre totale des tubercules. Cette augmentation de fibre résulterait de la rupture de certaines liaisons glycosidiques et à la dépolarisation des polysaccharides des fibres alimentaires (36). Toutefois, ces deux derniers résultats sont différents de ceux obtenus par Ezeocha et al. (18) qui ont enregistré 32,29 % de taux de perte de matière minérale et 20,2 % de perte de fibre totale après 90 minutes de cuisson des tubercules.
29Cette différence serait liée aux variétés utilisées. Par ailleurs, les teneurs en cendres totales obtenues dans cette étude, sont supérieures à 1,6 %, valeur observée pour Dioscorea rotundata, à 2,18 % pour D. alata et à 1,53 % pour D. cayenensis (3). Par contre, les valeurs de la cellulose brute et de la matière grasse enregistrées sont respectivement inférieures à 5,26 % et 0,89 % signalés pour D. alata (3).
Profil phytochimique
30Au total 10 classes de composés ont été identifiées dans les cossettes de D. dumetorum. Les durées de cuisson testées n’influencent pas la présence ou non de ces composés phytochimiques. Les cossettes de D. dumetorum contiennent des composés polyphénols tels que les flavonoïdes (flavones et flavonols), tanins, anthocyanes et leuco-anthocyanes. Les alcaloïdes qui sont dans la majorité des dérivés des acides aminés ont été aussi identifiés, et la durée de cuisson n’a pas affecté leur présence. Toutefois, la durée de cuisson pendant 90 minutes a induit une diminution de 39,1 % de la teneur des polyphénols ; 55,8 % de la teneur des flavonoïdes et 51,5 % de la teneur de tanins par rapport à 30 minutes de cuisson.
31Les valeurs obtenues pour les flavonoïdes (0,32 à 0,66 %) et les tanins (0,15 à 0,32 %) par Ezeocha et al. (18) sont nettement inférieures à celles enregistrées pour les mêmes composés au cours de cette expérimentation. Cette différence pourrait se situer au niveau des variétés testées. Toutefois, les mêmes tendances de diminution avec la durée de cuisson ont été observées par Ezeocha et al. (18). Selon Kataria et al. (25), la diminution de la teneur en tanins pendant la cuisson peut être due à la dégradation thermique et à l'oxydation, la dénaturation des tanins ainsi que la formation de complexes insolubles.
32Concernant les valeurs de polyphénols enregistrés dans la présente étude, elles sont supérieures à 0,05-0,98 mg EAG/g rapportés par Bozin et al. (10) pour l’ail (Allium sativum). Elles sont également supérieures ou comparables à 0,89-2,69 mg EAG/g, tel que rapporté par Narkhede et al. (31) pour D. alata. De même, les teneurs de flavonoïdes enregistrées lors de cette étude sont supérieures à 4,16-6,99 µg EQ/g obtenues par Bozin et al. (10) pour l’ail, à 0,14-0,75 mg EQ/g signalés par Narkhede et al. (31) pour D. alata. Toutefois, les teneurs en flavonoïdes de D. dumetorum sont inférieures à 96,91 mg EQ/g rapportées par Salawu et al. (37) pour la patate douce à peau violette (Ipomea batatas).
33Tout extrait ayant une valeur de CI50 inférieure à 10 mg/mL possède un effet antioxydant (28). Ainsi, la présente étude a révélé que les cossettes de D. dumetorum obtenues après 30, 60 et 90 minutes de cuisson sont des sources naturelles d’antioxydants meilleurs comparé à d’autres aliments tels que l’ail, l’oignon et D. alata. En effet, les valeurs de CI50 obtenues pour les cossettes de D. dumetorum sont inférieures aux teneurs de 2,04 mg/mL signalées pour l’ail, de 2,81 mg/mL pour l’oignon blanc (Allium cepa) et de 0,76 mg/mL pour l’oignon violet (32).
34De plus, elles sont inférieures à la teneur de 12,9-70,6 µg/mL signalées pour D. alata (31). Par contre, les valeurs de CI50 des cossettes de D. dumetorum sont supérieures à la teneur de 0,64 µg/mL rapportée pour le gingembre (Zingiber officinale) (43). Les cossettes de D. dumetorum présentent des pourcentages d’inhibition des radicaux libres inférieurs à celui (90,1 %) rapporté pour le gingembre par Stoilova et al. (43). Toutefois, ces pourcentages d’inhibition des radicaux libres de D. dumetorum sont supérieurs au taux de 2,1-48,5 % obtenue pour les extraits de Taro (24).
35Les capacités d’inhibition des cossettes de D. dumetorum obtenues (51 à 54 %) sont importantes et montrent ainsi leur potentiel antioxydant. Ce qui pourrait permettre d’avoir une efficacité alimentaire avec pour conséquence une meilleure performance probable de production chez les animaux. Les cossettes CD30 dont le procédé de fabrication passe par 30 minutes de cuisson ont présenté un pourcentage d’inhibition des radicaux libres plus élevé par rapport à celles dont les durées de cuisson sont plus longues. Ce qui serait dû aux teneurs élevées des polyphénols et flavonoïdes dans les cossettes CD30 comparé à celles de CD60 et CD90. Ainsi, une courte durée de cuisson de D. dumetorum, lui confère une activité antioxydante plus élevée (CI50 = 2,62 µg/mL). Toutefois après comparaison à l’échelle de (30), les trois types de cossettes ne sont pas toxiques (CL50> 0,1 mg/mL) pour l’organisme (animal ou humain).
Conclusion
36La qualité nutritionnelle de la variété de D. dumetorum à chair jaune est sensible au traitement à l’eau chaude. En effet, la durée de chauffage des tubercules diminue la teneur en protéines brutes et probablement celle en acides aminés. A cet effet, il sera conseillé de limiter la durée de chauffage des morceaux de D. dumetorum à 30 minutes pour conserver une bonne valeur nutritionnelle. Les polyphénols, les flavonoïdes et les tanins présents dans cette matière première, bien que sensibles à la durée de cuisson, présentent une forte activité antioxydante en comparaison à celle de l’ail, de l’oignon et du taro. Toutefois, la cuisson de D. dumetorum pendant 30 minutes conserve une activité antioxydante appréciable des cossettes et peut être proposée aux utilisateurs. Le profil phytochimique des cossettes de D. dumetorum à chair jaune constitue une étape dans le domaine de recherche des antioxydants naturels. Cette ressource alimentaire peut être valorisée chez la volaille et les humains comme un aliment ayant une valeur nutritive importante et des propriétés antioxydantes.
Remerciements
37Notre gratitude va à l’endroit de l’Etat béninois à travers le Ministère de l’Enseignement Supérieur et de la Recherche Scientifique dans le cadre du Programme d’Appui aux Doctorants (PAD) pour son soutien financier dans la réalisation de ce travail.
BibliografÃÂa
-
Abiodun O.A., Adegbite J.A. & Oladipo T.S., 2010, Effect of cassava starch substituion on the functional and sensory properties of trifoliate yam (Dioscorea dumetorum) flours.Afr. J. Food Agric. Nutr. Dev. 10, 2837-2849.
-
Adane T., Shimelis A., Negussie R., Tilahum B., & Haki G.D., 2013, Effect of processing method on the Proximate composition, mineral content and antinutritional factors of Taro (Colocasia esculenta, L.) growth in Ethiopia. Afr. J. Food Agric. Nutr. Dev. 13, 7383-7398.
-
Adeniji A., Taiga A. & Ayodele M., 2020, Comparative studies on the proximate composition of three tubers of Dioscorea Species in Anyigba, Kogi State. Int. Ann. Sci. 8, 138-142.
-
Afoakwa E.O. & Sefa-Dedeh S., 2001, Chemical composition and quality changes occurring in Dioscorea dumetorum pax tubers after harvest. Food Chem. 75, 85-91.
-
Alozie Y., Akpanabiatu M., Eyong E., Umoh I. & Alozie G., 2009, Amino acid composition of Dioscorea dumetorum varieties.Pak. J. Nutr. 8, 103-105.
-
Alozie Y.E., Lawal O., Umoh B. & Akpanabiatu M., 2010, Fatty acid composition of Dioscorea dumetorum (Pax) varieties.Afr. J. Food Agric. Nutr. Dev. 10, 2956-2966.
-
AOAC, 1995, Official methods of analysis of the association of official analytical chemists, Washington, D.C.
-
Asaduzzaman M., Haque M.E., Rahman J., Hasan S.K, Ali M.A., Akter M.S. & Ahmed M., 2013, Comparisons of physiochemical, total phenol, flavonoid content and functional properties in six cultivars of aromatic rice in Bangladesh. Afr. J. Food Sci. 7, 198-203.
-
Attaie H., Zakhia N. & Bricas N., 1998, Etat des connaissances et de la recherche sur la transformation et les utilisations alimentaires de l'igname, pp. 275-284. In : J. Berthaud, N. Bricas & J.-L. Marchand (Editors), L'igname, plante séculaire et culture d'avenir. Actes du séminaire international Cirad-Inra-Orstom- Coraf, Montpellier, France, 3-6 juin 1997.
-
Bozin B., Mimica-Dukic N., Samojlik I., Goran A. & Igic R., 2008, Phenolics as antioxidants in garlic (Allium sativum L., Alliaceae). Food chem. 111, 925-929.
-
Broadhurst R.B. & Jones W.T., 1978, Analysis of condensed tannins using acidified vanillin.J. Sci. Food Agric. 29, 788-794.
-
Cemaluk E.A.C., Daniel N.C. & Nkiru E.O.C., 2014, Effect of soaking prior to oven‐drying on some nutrient and anti‐nutrient properties of Bitter Yam (Dioscorea dumetorum).J. Nutr. Food Sci. 4, 1-4.
-
Charles A.L., Sriroth K. & Huang T.-c., 2005, Proximate composition, mineral contents, hydrogen cyanide and phytic acid of 5 cassava genotypes. Food chem. 92, 615-620.
-
De Mendiburu F., 2019, Agricolae : statistical procedures for agricultural research. R package, version 1.3-1. https://CRAN.R-project.org/package=agricolae.
-
Doka I.G., El Tigani S. & Yagi S., 2016, Nutritional Profile and Radical Scavenging Capacity of Tubers of Two Dioscorea Species. Adv. J. Food Sci. Technol. 11, 262-268.
-
Egbuonu A.C.C. & Nzewi D.C., 2016, Influence of Blanching on Some Nutrient and Anti-nutrient Compositions of Bitter Yam (Dioscorea dumetorum). Br. J. Appl. Sci. Technol.16, 1-8.
-
Eka O., 1998, Root and Tubers, pp. 1-31. In : A. Osagie & O. Eka (Editors.), Nutritional Quality of Plant Foods, London.
-
Ezeocha V., Ojimelukwe P. & Onwuka G., 2012, Effect of cooking on the nutritional and phytochemical components of trifoliate yam (Dioscorea dumetorum). Glo. Adv. Res. J. Biochem. Bioinform. 1, 026-030.
-
FAO, 2010, Composition of Selected Foods from West Africa. In : B. Stadlmayr, U.R. Charrondiere, P. Addy, B. Samb, V.N. Enujiugha, R.G. Bayili, E.G. Fagbohoun, I.F. Smith & I.B.B. Thiam (Editors.), The State of Food Insecurity in the World, 43 p.
-
Heimler D., Vignolini P., Dini M.G., Vincieri F.F. & Romani A., 2006, Antiradical activity and polyphenol composition of local Brassicaceae edible varieties. Food chem. 99, 464-469.
-
Houghton P.J. & Raman A., 1998, Laboratory Handbook for the Fractionation of Natural Extracts. In : Chapman & Hall (Editors), 244 p.
-
Houmènou V., Adjatin A., Assogba F., Gbénou J. & Akoègninou A., 2018, Etude phytochimique et de cytotoxicité de quelques plantes utilisées dans le traitement de la stérilité féminine au Sud-Bénin. Eur. Sci. J. 14, 156-171.
-
Huart A, L.P., Thewis A, Bindelle J, Muland M. & Kibango D., 2003, La production porcine en République Démocratique du Congo (I). In : Troupeaux et cultures des tropiques, Kinshasa. Dossier spécial porc, CAVTK, 20 p.
-
Hung P. & Duy T., 2012, Effects of drying methods on bioactive compounds of vegetables and correlation between bioactive compounds and their antioxidants. Int. Food Res. J. 19, 327-332.
-
Kataria A., Chauhan B., Punia D. & 1989, Antinutrients and protein digestibility (in vitro) of mungbean as affected by domestic processing and cooking. Food Chem. 32, 9-17.
-
Kim D.-O., Chun O.K., Kim Y.J., Moon H.-Y. & Lee C.Y., 2003, Quantification of polyphenolics and their antioxidant capacity in fresh plums. J. Agric. Food Chem. 51, 6509-6515.
-
Laly J., Gbemavo D., Gbaguidi A., Dossou-Aminon I. & Dansi A., 2019, Dioscorea dumetorum (Kunth) Pax, a neglected and underutilized yam species in Benin: folk classification and post-harvest conservation. Genet. Resour. Crop Evol. 66, 965-979.
-
Lee Y.-L., Jian S.-Y., Lian P.-Y. & Mau J.-L., 2008, Antioxidant properties of extracts from a white mutant of the mushroom Hypsizigus marmoreus. J. Food Compos. Anal. 21, 116-124.
-
Lenth R., 2019, emmeans: Estimated Marginal Means, aka Least-Squares Means. R package version 1.3.5., https://CRAN.R-project.org/package=emmeans.
-
Mousseux M., 1995, Test de toxicité sur larves d'Artemia salina: entretien d'un élevage de balanes.
-
Narkhede A., Gill J., Thakur K., Singh D., Singh E., Kulkarni O., Harsulkar A. & Jagtap S., 2013, Total polyphenolic content and free radical quenching potential of Dioscorea alata L. tubers. Int. J. Pharm. Pharm. Sci. 5, 866-868.
-
Oboh G., Ademiluyi A.O., Agunloye O.M., Ademosun A.O. & Ogunsakin B.G., 2019, Inhibitory effect of garlic, purple onion, and white onion on key enzymes linked with type 2 diabetes and hypertension. J. Diet. Suppl. 16, 105-118.
-
Ogbunugafor H.A., Ilodigwe E.E., Ajaghaku D.L., Ezekwesili C.N., Okafor C.S., Ajuzieogu C.F. & Madunatum S.U., 2014, Dioscorea dumetorum-fed rats exhibited decreased body weight, blood glucose, and insulin in stz-induced diabetes. Funct. food health dis. 4, 87-97.
-
Oluwatosin B. & Olubunmi A., 2015, Effects of Discorea dumentorum tuber supplemented diet on plasma lipid profile and glucose level of hypercholesterolemic rats. World J. Pharm. Pharm. Sci. 4, 284-295.
-
Panichayupakaranant P. & Kaewsuwan S., 2004, Bioassay-guided isolation of the antioxidant constituent from Cassia alata L. leaves. Songklanakarin J. Sci. Technol. 26, 103-107.
-
Ramírez-Moreno E., Córdoba-Díaz D., de Cortes Sánchez-Mata M., Díez-Marqués C. & Goñi I., 2013, Effect of boiling on nutritional, antioxidant and physicochemical characteristics in cladodes (Opuntia ficus indica). LWT - Food Sci. Technol.51, 296-302.
-
Salawu S.O., Udi E., Akindahunsi A.A., Boligon A.A. & Athayde M.L., 2015, Antioxidant potential, phenolic profile and nutrient composition of flesh and peels from Nigerian white and purple skinned sweet potato (Ipomea batatas L.). Asian J. Plant Sci. Res. 5, 14-23.
-
Sauvant D., Perez J. & Tran G., 2002, Tables de composition et de valeur nutritive des matières premières destinées aux animaux d'élevage Porcs, volailles, bovins, ovins, caprins, lapins, chevaux, poissons. Bulletin Veterinaire Bimestriel-Societe Veterinaire Pratique de France. 86, 329-329.
-
Sefa-Dedeh S. & Afoakwa E.O., 2002, Biochemical and textural changes in trifoliate yam Dioscorea dumetorum tubers after harvest. Food Chem. 79, 27-40.
-
Singleton V.L. & Rossi J.A., 1965, Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents. Am. J. Enol. Viticult. 16, 144-158.
-
Solis P.N., Wright C.W., Anderson M.M., Gupta M.P. & Phillipson J.D., 1993, A microwell cytotoxicity assay using Artemia salina (brine shrimp). Planta med. 59, 250-252.
-
Sonibare M.A. & Abegunde R.B., 2012, In vitro antimicrobial and antioxidant analysis of Dioscorea dumetorum (Kunth) Pax and Dioscorea hirtiflora (Linn.) and their bioactive metabolites from Nigeria. J. Appl. Biosci. 51, 3583-3590.
-
Stoilova I., Krastanov A., Stoyanova A., Denev P. & Gargova S., 2007, Antioxidant activity of a ginger extract (Zingiber officinale). Food chem. 102, 764-770.
-
Team R.C., 2019, R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria , https://www.R-project.org/.
-
Zhishen J., Mengcheng T. & Jianming W., 1999, The determination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals. Food chem. 64, 555-559.
Para citar este artículo
Acerca de: Akadiri Faride Jospin
MSc, chercheur, Béninoise, Laboratoire des Sciences Animale et Halieutique (LaSAH), Ecole de Gestion et d’Exploitation des Systèmes d’Elevage (EGESE), Université Nationale d’Agriculture (UNA), BP 43 Kétou, Bénin, auteur correspondant : akajos90@gmail.com, +229 97 14 62 39
Acerca de: Aboh André Boya
PhD, Enseignant-Chercheur, Béninoise, Laboratoire des Sciences Animale et Halieutique (LaSAH), Ecole de Gestion et d’Exploitation des Systèmes d’Elevage (EGESE), Université Nationale d’Agriculture (UNA), BP 43 Kétou, Bénin, aboh.solex@gmail.com
Acerca de: Olounlade Pascal Abiodoun
PhD, Enseignant-Chercheur, Béninoise, Laboratoire des Sciences Animale et Halieutique (LASAH), Ecole de Gestion et d’Exploitation des Systèmes d’Elevage (EGESE), Université Nationale d’Agriculture (UNA), BP 43 Kétou, Bénin, abiodouno@yahoo.fr
Acerca de: Assogba Fidèle
PhD, Chercheur, Béninoise, Laboratoire de Pharmacognosie et des Huiles Essentielles (LaPHE), Faculté des Sciences et Techniques (FAST), Université d’Abomey-Calavi (UAC), 01 BP 06 Cotonou, Bénin, fideleassogba@gmail.com
Acerca de: Houndonougbo Frédéric
PhD, Enseignant-Chercheur, Béninoise, Laboratoire de Recherche Avicole et de Zoo-Économie (LARAZE), Faculté des Sciences Agronomiques (FSA), Université d’Abomey-Calavi (UAC), 01 BP 526 Cotonou, Bénin, fredericmh@gmail.com