- Accueil
- Volume 40 (2022)
- Numéro 3/4
- Constitution des références floristico - physionomique et dendrométrique pour le suivi de la dynamique structurale de la végétation et des habitats du Parc National de la Ruvubu (Burundi)
Visualisation(s): 1743 (37 ULiège)
Téléchargement(s): 0 (0 ULiège)
Constitution des références floristico - physionomique et dendrométrique pour le suivi de la dynamique structurale de la végétation et des habitats du Parc National de la Ruvubu (Burundi)

Résumé
Cette étude a pour fin l’amélioration des connaissances sur la flore du Parc National de la Ruvubu et la caractérisation de la dynamique de ses habitats grâce à l’interprétation des spectres écologiques des végétations et des facteurs abiotiques prépondérants dans ce parc. Un échantillonnage a été mené sur 31 parcelles permanentes le long de 4 transects répartis en raison d’un par secteur administratif du Parc. L’étude distingue 10 entités de végétations subdivisées en 31 types de végétations élémentaires, soit autant d’habitats correspondants. Sur le plan floristique, 563 espèces réparties en 315 genres et 97 familles ont été inventoriées. Les familles cosmopolites (Fabaceae, Asteraceae et Poaceae) dominent. L’analyse des spectres biologiques montre une prédominance des phanérophytes et des hémicryptophytes. Sur le plan phytogéographique, la flore de ce parc s’est révélée comme résultante d’une interpénétration des domaines zambézien et oriental. Les caractéristiques physionomiques et structurales reflètent une végétation influencée essentiellement par les feux de brousse annuels. L’absence de ces feux, surtout tardifs, pourrait induire une reprise de la dynamique progressive des habitats dans ce parc. L'état des lieux réalisé dans le présent article facilitera le renforcement d'un système de suivi de la dynamique de ses habitats qui est en cours dans les aires protégées au Burundi.
Abstract
Floristico - physiognomic and dendrometric reference for monitoring the dynamics of the vegetation and habitats of the Ruvubu National Park (Burundi)
The aim of this study is to improve the knowledge of the flora of the Ruvubu National Park and to characterize the dynamics of its habitats through the interpretation of the ecological spectra of the vegetation and the predominant abiotic factors in this park. Sampling was conducted on 31 permanent plots along 4 transects, one per administrative sector of the park. The study distinguishes 10 vegetation entities subdivided into 31 elementary vegetation types, i.e. as many corresponding habitats. In terms of flora, 563 species divided into 315 genera and 97 families were inventoried. The cosmopolitan families (Fabaceae, Asteraceae and Poaceae) dominate. The analysis of biological spectra shows a predominance of phanerophytes and hemicryptophytes. Phytogeographically, the flora of this park is the result of an interpenetration of the Zambezi and Eastern domains. The physiognomic and structural characteristics reflect a vegetation influenced essentially by annual bush fires. The absence of these fires, especially late in the season, could lead to a resumption of progressive habitat dynamics in this park. The baselines outputed in this article will facilitate the strengthening of a system for monitoring the dynamics of habitats that is has been undertaken in protected areas in Burundi.
Table des matières
Introduction
1Le souci de conservation de la biodiversité, avec la prise en compte des besoins et aspirations des populations locales, est devenu réel depuis le Sommet de la Terre en 1992 (27). Les Aires Protégées (APs) sont au cœur de la stratégie mondiale de conservation de la biodiversité (41). Actuellement, le Burundi compte 16 APs réparties dans 4 catégories: 3 Parcs Nationaux, 6 Réserves Naturelles, 2 Monuments Naturels et 5 Paysages Protégés (10).
2Le Parc National de la Ruvubu (PNRu) a été créée en 1980 et il est la plus grande Aire Protégée du Burundi. Bien qu'il n'abrite pas probablement d’espèces qui n’existent pas ailleurs, il a un intérêt qui dépasse les frontières burundaises puisqu’il s’agit d'une preuve rare de la transition entre forêts denses et savanes humides (49). Ce parc reste aussi un sanctuaire et un dernier refuge de grands mammifères disparus ailleurs dans le pays (42).
3Malgré les divers intérêts que cette AP revêt et les interventions menées pour sa préservation, le PNRu est resté sous des influences humaines telles que les coupe du bois et d’herbes, le pacage du bétail, la chasse illicite, etc. et principalement les feux de brousse annuels, qui y ont causé une dégradation importante de la biodiversité (37) et des pertes en espèces; ce qui se répercute malencontreusement sur l’évolution des habitats et la structure de la végétation de cet écosystème dans son ensemble. Il importe d’assurer le suivi de cette dynamique, notamment pour rendre compte de l’état des écosystèmes afin d’éclairer les décisions des gestionnaires des APs pour mieux en assurer la protection.
4Cela permettrait de favoriser la disponibilité et la durabilité des services que la nature offre, aider à les valoriser afin de réduire la pauvreté. En effet, ce sont les écosystèmes sains qui sont à même de fournir aux populations humaines des ressources abondantes et de grande qualité. Suivre l’évolution des habitats revient à observer la succession de types de végétation qui apparaissent chronologiquement sur une surface considérée. En effet, les plantes reflètent habituellement bien la nature et l’évolution des milieux dans lesquels elles s’intègrent (17). Ainsi donc, l’évaluation diachronique du PNRu et de son potentiel des services écosystémiques doit être basée sur des connaissances de la biodiversité (23) tant floristique que faunistique disponibles sur ce parc.
5Cependant, ces connaissances sont encore lacunaires et s’étoffent lentement. Les principales études relatives à la flore et à la végétation du PNRu ont été réalisées par Masharabu et al. en 2010 (36). Ces auteurs reconnurent que les données disponibles sur ce thème étaient encore fragmentaires. Ultérieurement, Masharabu (37) fournit à travers sa thèse de doctorat une liste de 515 espèces du PNRu. Dans la foulée, Masharabu et al., (38) élevèrent l’effectif de la flore vasculaire de ce parc à 522 espèces. Cet inventaire que ces auteurs ont considéré comme « le plus complet possible » est certes très important ; mais en entreprenant la présente étude nous présumons qu’il en résultera un certain lot d’espèces végétales vasculaires différentes de celles qui ont été recensées précédemment dans le PNRu.
6C’est dans cette optique que cette étude se propose de caractériser les habitats du PNRu sur le plan floristique et physionomique en vue de faciliter leur typologie et rendre aisée la récolte des observations à intégrer dans une base des données constituée dans le cadre du suivi de la dynamique des habitats de ce parc. Cela permet de mieux refléter le rôle des facteurs de dégradation qui influencent la dynamique des habitats au sein du parc. Compte tenu de l’objectif assigné à la présente étude et, à l’instar du « Code Corine Biotopes » (32), le terme « habitat » est employé dans le sens susmentionné en remplaçant « végétation » tout au long de cet article.
7La présente étude s’est basée sur l’hypothèse principale selon laquelle dans leur ensemble, les habitats du PNRu sont soumis à une dynamique régressive caractérisée par l’apparition des végétations de plus en plus dégradées à la fois sur les plans physionomique et floristique. De cette hypothèse il en ressort d’autres hypothèses spécifiques : (i) Le PNRu renferme une flore, riche et variant selon les types d’habitats, dominée par les familles cosmopolites reflétant la dégradation de ce milieu ; (ii) les spectres écologiques des types biologiques et des éléments phytogéographiques caractérisent un milieu dégradé soumis à des influences extérieures ; (iii) les habitats du PNRu sont caractérisés par les types de végétations plus ou moins basses et ouvertes, fortement influencées par les feux de brousse.
Méthodologie
Présentation du site d’étude
8L’étude a été menée dans le Parc National de la Ruvubu. Cette Aire Protégée, la plus grande du Burundi, est situé au Nord-Est du pays entre les latitudes 2°54' et 3°22' Sud et les longitudes 30°06' et 30°33' Est. Sa superficie de 50800 ha, représente environ 1,8 % du territoire national. Ce parc est étiré le long de la rivière Ruvubu qui lui a donné son nom. Administrativement, le PNRu est subdivisé en 4 secteurs dont la Rive Gauche I, la Rive Gauche II, la Rive Droite I et la Rive Droite II (Fig. 1).
9L’altitude varie généralement entre 1300-1800 m et culmine à 1836 m. La plupart des sommets des collines sont plats et généralement séparés par de larges vallées marécageuses. La végétation du PNRu se répartit en principales entités suivantes: Savane herbeuse, Savane Steppique, Savane arbustive, Savane Arborescente, Savane Boisée, Bosquet, Fourré, Forêt Claire, Galerie forestière, prairies des sols humides.
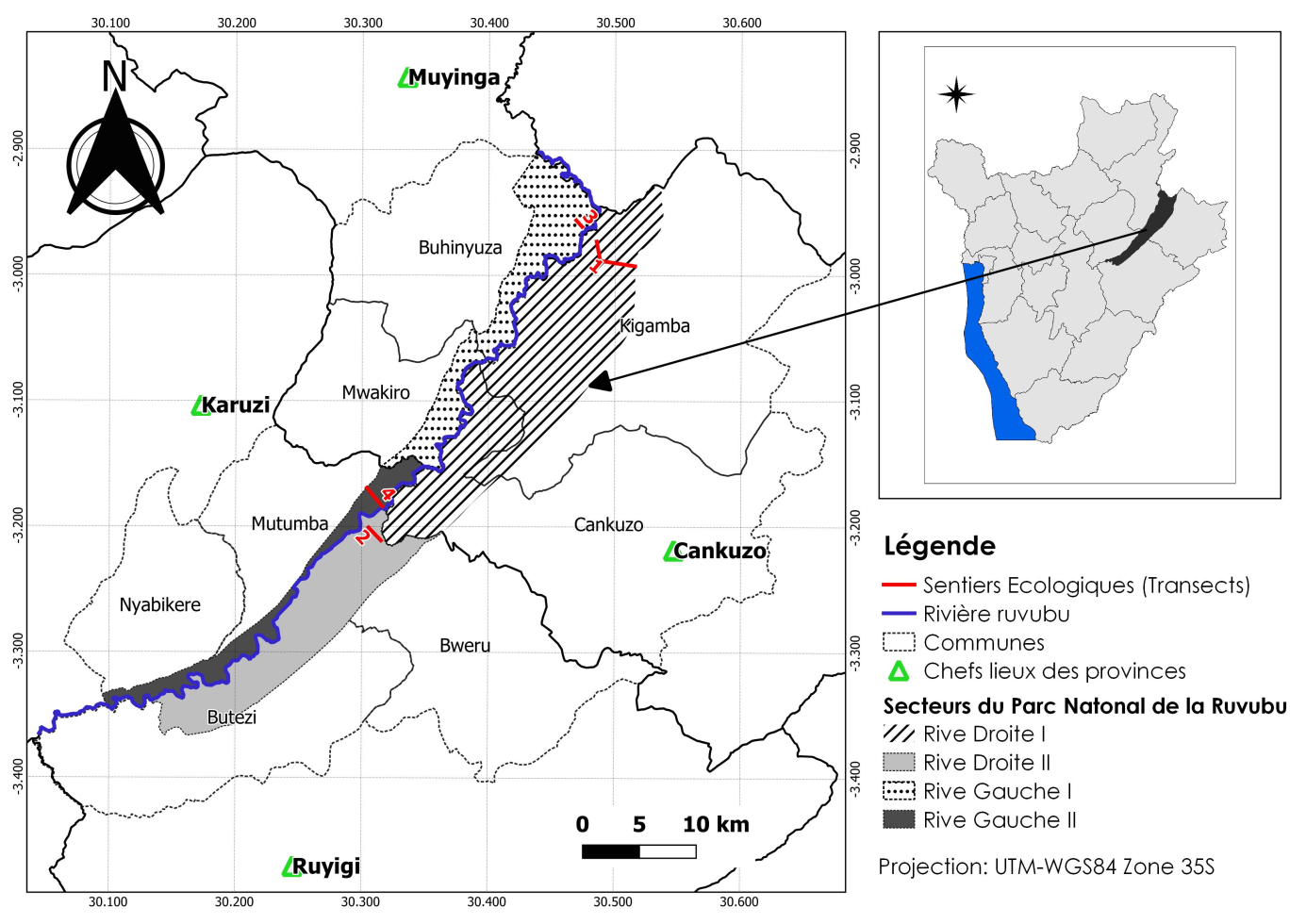
Figure 1: Localisation géographique du PNRu au sein des entités administratives (provinces et communes) du Burundi et des sentiers écologiques (transects)
Méthodes utilisées
Dispositif aménagé pour la collecte des données
10Quatre transects ou sentiers écologiques permanents ont été établis en raison d’un par chacun des secteurs du PNRu : RDI, RDII, RGI et la RGII. Au total, 31 parcelles permanentes de superficie variable, faisant soit une superficie totale de 38975 m2 environ 3,9 Ha, ont été délimitées sur l’ensemble de ces transects (Tabl. 1 et Fig. 2) de façon à représenter les différents types d’habitats selon le critère d’homogénéité des types de végétations respectifs.
Tableau 1: informations de différentes parcelles permanentes pour le suivi de la dynamique des habitats du PNRu (Légende : TR : Transect ; PA : Parcelle)
|
Secteur du PNRu |
TR |
PA |
Sites |
Altitude |
Types d’habitat observés |
Surperficie en m2 |
|
Transect I |
1 |
Rushubije 1 |
1467 m |
Savane arborescente |
1200 |
|
|
2 |
Rushubije 2 |
1463 m |
Savane arborescente |
1200 |
||
|
Secteur RD I |
3 |
Rushubije 3 |
1406 m |
Savane arborescente |
1000 |
|
|
4 |
Rushubije 4 |
1402 m |
Savane herbeuse |
800 |
||
|
5 |
Nyongera |
1400 m |
Cyperaie |
800 |
||
|
6 |
Rugoti |
1420m |
Bosquet |
1225 |
||
|
7 |
Rusagara 1 |
1399 m |
Savane arbustive |
1400 |
||
|
8 |
Rusagara 2 |
1375 m |
Galerie forestière |
1200 |
||
|
Sous total |
8825 |
|||||
|
Transect II |
1 |
Gasenyi 1 |
1435m |
Savane arbustive |
1200 |
|
|
2 |
Gasenyi 2 |
1439m |
Savane boisée |
1200 |
||
|
Secteur RD II |
3 |
Gasenyi 3 |
1428m |
Savane boisée |
1600 |
|
|
4 |
Gasenyi 4 |
1424m |
Savane arborescente |
900 |
||
|
5 |
Rugusa 1 |
1432m |
Forêt claire |
1200 |
||
|
6 |
Rugusa 2a |
1441m |
Forêt claire |
1200 |
||
|
7 |
Rugusa 2b |
1402m |
Savane boisée |
1200 |
||
|
Sous total |
8500 |
|||||
|
Transect III |
1 |
Mashenyo1 |
1530m |
Bosquet |
1600 |
|
|
2 |
Mashenyo2 |
1532m |
Savane arborescente |
1600 |
||
|
Secteur RG I |
3 |
Mashenyo3 |
1530m |
Savane arborescente |
1600 |
|
|
4 |
Mashenyo4 |
1505m |
Savane steppique |
1600 |
||
|
5 |
Mashenyo5 |
1484m |
Savane arbustive |
1200 |
||
|
6 |
Mashenyo6 |
1460m |
Savane arborescente |
1200 |
||
|
7 |
Mashenyo7 |
1427m |
Savane boisée |
1200 |
||
|
8 |
Mashenyo8 |
1372m |
Fourré |
1600 |
||
|
Sous total |
11600 |
|||||
|
Transect IV |
1 |
Bibara 1 |
1602 m |
Savane herbeuse |
1600 |
|
|
2 |
Bibara 2 |
1571m |
Savane arbustive |
1600 |
||
|
3 |
Bibara 3 |
1524m |
Savane arbustive |
1600 |
||
|
Secteur RG II |
4 |
Bibara 4 |
1474m |
Savane arborescente |
1200 |
|
|
5 |
Bibara 5 |
1445m |
Savane arbustive |
1200 |
||
|
6 |
Bibara 6 |
1447m |
Savane boisée |
1200 |
||
|
7 |
Bibara 7 |
1447m |
Galerie forestière |
900 |
||
|
8 |
Nyamugari |
1337m |
Galerie forestière |
750 |
||
|
Sous total |
4 |
31 |
10050 |
|||
|
Total |
4 |
31 |
38975 |

Figure 2 : Transects et parcelles permanentes pour le monitoring des habitats dans quatre secteurs du PNRu (BCG (2013) : Burundi Orthophoto WGS 84 UTM35)
Collecte des données
11Chaque parcelle a été préalablement subdivisée en quadrats de 1 m x 1 m. Ces derniers ont été séquentiellement scrutées pour y recenser et récolter la totalité des plantes présentes. Chaque espèce a été enregistrée en lui affectant un coefficient d’abondance dominance selon la méthode de Braun-Blanquet (7) qui a été utilisée par Lewalle (30) et ultérieurement par Masharabu (37).
12La hauteur et la circonférence ont été mesurés pour tous les arbres dont la circonférence était supérieure ou égale à 15 cm à 1,30 m au-dessus du sol conformément à Malaisse (34). Cette publication portant sur le Domaine zambézien, où les facteurs abiotiques et la végétation sont comparables à ceux de notre dition, offre des données qu’il importe de considérer dans le cadre de la préparation du présent article.
Analyse des données
Inventaire de la flore et sa similitude dans les habitats
13La détermination des espèces récoltées s’est référée à Troupin (46) et à Fischer et al. (14). L’herbarium de l’OBPE et celui de l’Université du Burundi (Faculté des sciences) ont été également consultés. La nomenclature des plantes à fleurs s’est référée à Lebrun & Stork (29). Une liste des espèces inventoriées a été établie et le nombre de familles, de genres et d’espèces a été évalué.
14Le degré de similarité floristique pour les habitats du PNRu a été analysé à l’aide de l’indice de Sorensen et celui de Bray Curtis.
-
L’indice ou Coefficient de Sorensen (44) :
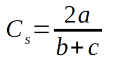
15Où
16a : le nombre total d’espèces communes à deux parcelles considérées
17b : le nombre total d’espèces de l’un des deux parcelles considérées
18c : le nombre total d’espèces de l’autre parcelle.
19Basé sur la présence-absence, cet indice a été utilisé pour évaluer le degré d’affinité floristique entre les différents habitats du PNRu. Il est considéré comme l'une des mesures de similitude de présence / absence les plus efficaces (33). Un indice plus petit indique moins de similarité dans la composition des espèces entre les différents sites (8).
-
L’indice de similarité de Bray-Curtis (IB) pour effectuer un Regroupement hiérarchique des habitats (UPGMA) :
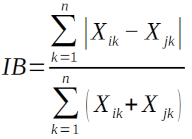
20Avec i et j : les lignes (relevés) de la matrice de données, k : une colonne de la matrice de données (espèce), Xik : valeur de la variable k (Abondance de l’espèce k) pour la ligne i, Xij : valeur de la variable k (abondance de l’espèce k) pour la ligne j, n : nombre total de variables (espèces) dans la matrice.
21L’indice de Bray-Curtis est l’équivalent quantitatif du précédent. Cet indice a l’avantage de donner des dendrogrammes à interprétation facile et ne donne pas du poids aux espèces rares (16). Le regroupement hiérarchique a été fait en appliquant" l’« UPGMA (Unweighted Pair Group Method with Arithmetic Mean) ».
22Le logiciel MVSP 3.2 (MultiVariate Statistical Package) (26), en particulier son option Cluster Analysis (Analyse par regroupement), a été utilisée ; un dendrogramme a été généré. Cette méthode regroupe de façon hiérarchique les différents habitats selon le degré d’affinité de leur florule. Ainsi, les sites qui se regroupent sont considérés comme plus similaires les uns aux autres (33).
Examen des formes biologiques et analyse phytogéographique
23L’inventaire des types biologiques (TB) a été réalisé selon la classification de Raunkiaer, telle qu’elle a été exposée par Lewalle (30). Comme dans ces publications, la distribution géographique (DG) des plantes que nous avons recensées a été mise en évidence selon le système chorologique de Lebrun (28). Sur cette base, le calcul des spectres biologiques et phytogéographiques bruts et pondérés des différents types des végétations que nous avons identifiées a été effectué comme suit :
24Spectre brut :
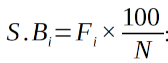
25il indique la proportion centésimale des espèces appartenant à chaque catégorie (TB, DG) considérée.
26S.Bi: désigne le spectre brut d’une catégorie i;
27Fi: Nombre de fois que les espèces d’une catégorie donnée sont dans l’ensemble des relevés;
28N: se rapporte au total des espèces.
29Spectre pondéré :
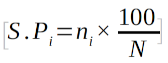
30il tient compte de l’abondance de chaque TB ou DG et pas seulement du nombre des espèces différentes (30).
31S.Pi est le spectre pondéré d’une catégorie i (TB, DG) ; ni est la part d’une catégorie i; N est la somme des parts de tous les TB ou de toutes les DG.
Analyse des caractéristiques dendrométriques
32Ces paramètres ont été évalués à l’aide des fiches d’enregistrement des observations pour le suivi de la dynamique des habitats dans les aires protégées du Burundi de l’OBPE ex I.N.E.C.N élaborées par Habiyaremye et qui figurent dans la série des travaux publiés sur ce thème (18 ; 39).
33Ces fiches signalent 5 strates dans la structure verticale des végétations : strates arborescente supérieure à très grands arbres (30-50 m), arborescente intermédiaire comprenant de grands arbres (20-29 m), arborescente inférieure composée d’arbres moyens (7-19 m), arbustive (2-6 m) et la strate sous - arbustive et herbacée (< 2 m). Le recouvrement moyen en (%) de chaque strate et de chaque espèce a été estimé selon l’échelle de Braun-Blanquet (7).
34Le calcul de la surface terrière a été fait par classes de circonférence à intervalle de 5 cm et par essence se trouvant dans chaque site à l’aide de la formule suivante :
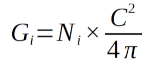
35Gi étant la surface terrière dans une classe (en m²/ha), C la circonférence moyenne dans une classe et Ni le nombre de tiges par classe. La surface terrière totale G s’obtient par la somme de toutes les surfaces terrières par classes ou par essence.
Résultats
Composition floristique et richesse spécifique
36Dans la présente étude, 563 espèces réparties en 315 genres et 97 familles ont été inventoriées. Le groupe des Dicotylédones renferme 439 espèces, soit 78 % tandis que celui des Monocotylédones comprend 108 espèces, soit 19 % du total de l’inventaire. Les Ptéridophytes sont représentées par 16 espèces seulement, soit 3 %. La figure 3 présente dans l’ordre décroissant de leurs effectifs spécifiques les familles les plus diversifiées du PNRu; chacune d’entre elles comprend au moins 6 espèces. Les familles des Fabaceae, des Asteraceae et des Poaceae sont les plus représentées.
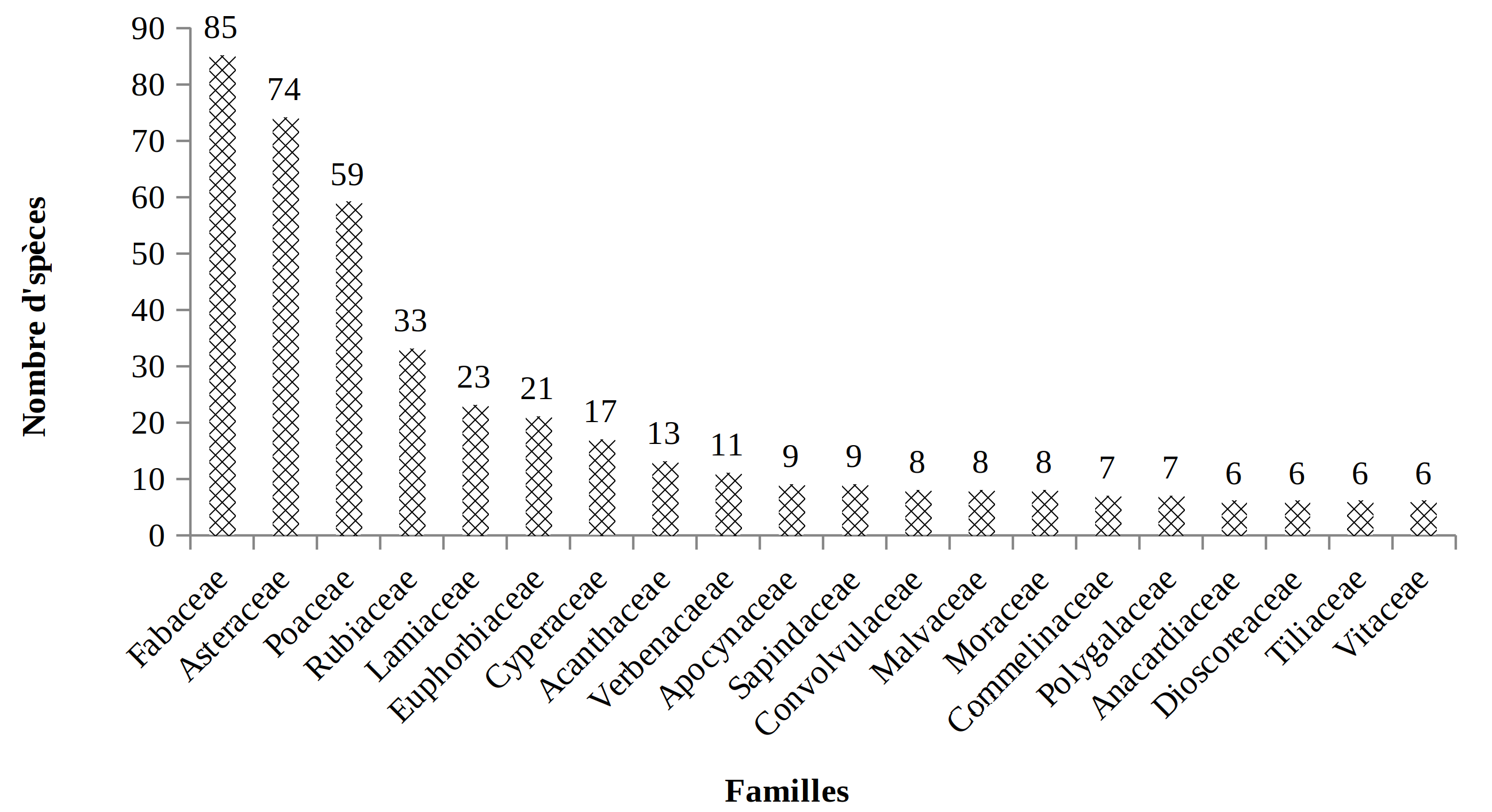
37Figure 3: Richesse en espèces pour les familles les mieux représentées (ayant au moins 6 espèces) des habitats du PNRu
Similitude floristique des habitats du PNRu
Regroupement hiérarchique des habitats du PNRu suivant l’indice de Bray Curtis
38D’abord l’analyse a été effectuée en tenant compte de l’abondance-dominance de chaque espèce inventoriée dans les habitats prospectés (Fig. 4). Les résultats montrent que l’ensemble des savanes est un bloc distinct de celui des autres types d’habitats. Cependant, quelques savanes semblent relativement proches des galeries forestières, des bosquets et du fourré, du fait que ces habitats sont partiellement constitués des espèces typiques des savanes, notamment Combretum collinum, Entada abyssinica, Parinari curatellifolia, Combretum molle et seraient donc en cours de savanisation.
39Les forêts claires et la cyperaie du PNRu se sont montrés très bien distincts des autres types d’habitats, les premières étant dominées presque exclusivement par Uapaca sansibarica et le deuxième par Cyperus papyrus.
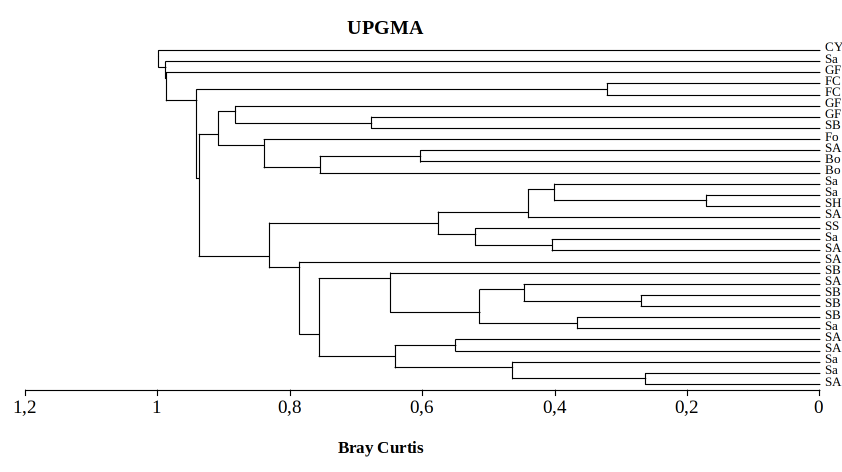
Figure 4: Regroupement hiérarchique des habitats identifiés dans le PNRu selon le recouvrement relatif de toutes les espèces inventoriées
SH : Savane herbeuse, Sa : Savane arbustive, SA : Savane Arborescente, SB : Savane Boisée, SS : Savane Steppique, Bo : Bosquet, Fo : Fourré, FC : Forêt Claire, GF : Galerie forestière, CY : Cyperaie
Coefficient de similarité de Sorensen
40Dans l’ensemble, les valeurs présentées dans le tableau 2 sont majoritairement faibles car elles sont inférieures à 0,50 ; ce qui traduit une faible affinité floristique entre ces habitats. Toutefois, une affinité pas assez forte s’observe entre certains types de savanes avec des valeurs allant jusqu’à 0,60.
Tableau 2: Valeurs du coefficient de similarité de Sorensen au sein des différents types d’habitats du PNRu
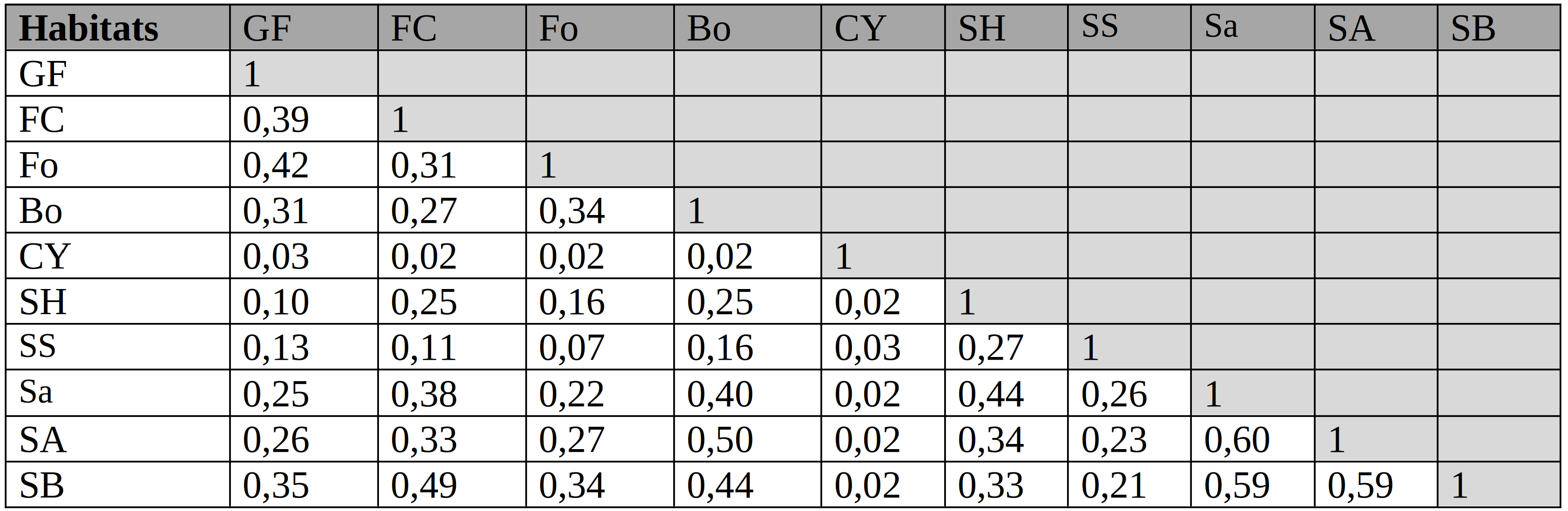
SH : Savane herbeuse, Sa : Savane arbustive, SA : Savane Arborescente, SB : Savane Boisée, SS : Savane Steppique, Bo : Bosquet, Fo : Fourré, FC : Forêt Claire, GF : Galerie forestière, CY : Cyperaie
Formes biologiques des espèces du PNRu
41L’analyse du spectre brut des formes biologiques des espèces du PNRu met en évidence la prédominance des phanérophytes et des chaméphytes dans les différents types d’habitats de terre ferme. Elles s’élèvent respectivement à 30,35 % et 25,65 % dans les savanes, 31,96 % et 23,20 % dans les bosquets, 66,67 % et 10,64 % au sein des galeries forestières, 54,13 % et 22,02 % dans les forêts claires, 49 % et 18 % dans le fourré. Les thérophytes sont mieux représentés dans les savanes (19,29 %) et les bosquets (21,65 %).
42Au niveau de la cyperaie s’observe une codominance des géophytes, des phanérophytes et des hémicryptophytes. Par contre, le calcul du spectre pondéré révèle une prépondérance des hémicryptophytes et des phanérophytes au sein des savanes. Ils y atteignent respectivement 57,3 % et 31,94 %. Une nette dominance des phanérophytes s’observe dans des galeries forestières (94,05 %), des forêts claires (85,52 %), le fourré (72,37 %) et des bosquets (60,1 %). Quant à la cyperaie, il est dominé par les géophytes (99 %). En effet, cet habitat est occupé presque exclusivement par Cyperus papyrus.
Synthèse phytogéographique
43Le spectre phytogéographique brut montre une prédominance des espèces à large distribution. Selon l’ordre décroissant de leurs proportions, il s’agit des espèces plurirégionales africaines, pantropicales, paléotropicales, afrotropicales, cosmopolites, subcosmopolites, afromalgaches. Elles représentent 49,24 % du total des plantes inventoriées. En seconde position, viennent les espèces soudano-zambéziennes qui représentent 33,33 %. Parmi ces dernières, les espèces omni soudano-zambéziennes émergent en constituant 35,95 % du spectre brut.
44Les espèces appartenant aux domaines oriental et zambézien viennent en seconde position avec 25,49 %. Enfin, le groupe de liaison regroupe 10,46 % du total des plantes recensées. Selon les résultats de la présente étude, le PNRu ne renferme pas d’espèces endémiques propres à cette aire ; plutôt il y a quatre espèces endémiques de rang régional. Ces dernières sont Leucas urundensis et Pycnostachys ruandensis, Dissotis ruandensis et Phragmanthera usuiensis.
45Les espèces montagnardes, introduites et guinéennes sont faiblement représentées. Le spectre pondéré montre également une prédominance des espèces à large distribution et de celles de l’élément-base Soudano-Zambézien; ces groupes constituent respectivement 38,39 et 39,45 % du spectre. Les espèces de liaisons suivent avec 21,1 % tandis que les autres groupes phytogéographiques sont pondéralement moins importants. Au sein de l’élément base, les espèces omni soudano-zambéziennes dominent en constituant 52,5 % du spectre pondéré.
Caractéristiques physionomiques et surface terrière
46Au point de vue physionomique et selon leur stade évolutif, les savanes du PNRu se caractérisent par 1 à 3 strates : - la strate arborescente (A) qui est constituée d’arbres petits à moyens (A-AM) atteignant rarement 15 m de hauteur, - la strate arbustive (aB) comprenant des arbustes de 2-7m de hauteur, - la strate des sous- arbustes (S), graminées (G) et autres herbes que les graminées (H), désigné par SsAH, dont la hauteur est ≤ 2 m. Le recouvrement de la composante graminéenne de cette strate est compris entre 30 % dans les savanes boisées et 100 % dans les savanes herbeuses. Hormis dans ces dernières, ces graminées sont parsemées d’arbustes et d’arbres qui recouvrent respectivement 1 à 70 % et 0 à 60 % des superficies des végétations examinées.
47Les bosquets sont souvent localisés sur des termitières. Ils diffèrent des savanes par la hauteur plus élevée, la densité des éléments ligneux et la composition floristique de leurs trois strates. Le recouvrement des arbres peut atteindre 60 % des superficies des bosquets. La hauteur des arbres peut dépasser 15 m. En plus des espèces savanicoles, les plantes ligneuses des milieux fermés y prennent place ainsi que des lianes notamment Landolphia kirkii, Clematis hirsuta, Cayratia ibuensis. Les galeries forestières sont plus ou moins fermées; leurs strates arbustive et arborescente recouvrent respectivement 80 à 90% et 20 à 70%. La strate herbacée est moins dense, voire même discontinue et pauvre en espèces.
48Cela est vraisemblablement dû à une faible pénétration de la lumière dans le sous-bois. Le fourré du PNRu se distingue par ses strates arborescentes dont l’une est constituée d’arbres de grande taille (hauteur ˃ 20 m), l’autre d’arbres petits à moyens (7-20 m). Quant à la strate herbacée, c’est un tapis dense formé par Desmodium sp. Dans les forêts claires, la strate arborescente est constituée essentiellement d’arbres d’Uapaca sansibarica, ses houppiers disjoints permettent la pénétration de la lumière. Par ailleurs, la strate arbustive recouvre seulement 30 à 40 % de leur superficie et est donc plus ouverte que celle des galeries forestières et du fourré.
49La structure physionomique des habitats identifiés sur les diverses parcelles d’échantillonnage et les surfaces terrières correspondantes sont présentées dans le tableau 3.
Tableau 3: Physionomie des habitats et surfaces terrières correspondantes (Légende : SE : Suivi-Ecologique, ST : Surface Terrière)
|
Secteur |
SE |
Sites |
ST (m2/Ha) |
Physionomie |
Types d’habitat |
|
Rive Droite I |
Sentier Ecologique I |
Rushubije 1 |
2,95 |
A1B1S0H0G9 |
Savane arborescente à Hyparrhenia spp. et Parinari curatellifolia, Anisophyllea boehmii |
|
Rushubije 2 |
6,36 |
A2B3S0H0 G9 |
Savane arborescente à Hyparrhenia spp., Pericopsis angolensis et Parinari curatellifolia |
||
|
Rushubije 3 |
9,23 |
A1B2S0H4G7 |
Savane arborescente à Hyparrhenia spp., Terminalia mollis |
||
|
Rushubije 4 |
2,99 |
A0B1S0H10G10 |
Savane herbeuse à Hyparrhenia spp. |
||
|
Nyongera |
0 |
A0B0S0G1H10 |
Cyperaie à Cyperus papyrus |
||
|
Rugoti |
24,17 |
A6B5S1H6G3 |
Bosquet à Entada abyssinica et Acacia sieberana |
||
|
Rusaga 1 |
2,63 |
A1B1S0H0G6 |
Savane arbustive à Pericopsis angolensis, Parinari curatellifolia et Hymenocardia acida |
||
|
Rusaga 2 |
23,57 |
A7B9S3H1G0 |
Galerie forestière à Anthocleista schweinfurthii, Ficus sur et Maesopsis eminii |
||
|
Rive Droite II |
Sentier Ecologique II |
Gasenyi 1 |
6,26 |
A+B4S+H+G9 |
Savane arbustive à Hyparrhenia diplandra et Hymenocardia acida |
|
Gasenyi 2 |
9.95 |
A2B5S+H+G9 |
Savane boisée à Hyparrhenia spp., Pericopsis angolensis et Hymenocardia acida |
||
|
Gasenyi 3 |
17,12 |
A5B5S1H+G9 |
Savane boisée à Hyparrhenia spp. et Pericopsis angolensis |
||
|
Gasenyi 4 |
8,63 |
A1B2S+H+G10 |
Savane arborescente à Hyparrhenia spp., Hymenocardia acida Pericopsis angolensis, Lannea schimperi |
||
|
Rugusa 1 |
24,17 |
A9B4S1H+G+ |
Forêt claire à Uapaca sansibarica |
||
|
Rugusa 2a |
24,5 |
A9B3S1H+G+ |
Forêt claire à Uapaca sansibarica |
||
|
Rugusa 2b |
12,23 |
A2B6S1H+G9 |
Savane boisée à Hyparrhenia spp., Hymenocardia acida et Pterocarpus tinctorius |
||
|
Rive Gauche I |
Sentier Ecologique III |
Mashenyo1 |
8,63 |
A7B3S+H+G7 |
Bosquet à Scolopia sp. |
|
Mashenyo2 |
15,64 |
A4B1S+H+G10 |
Savane arborescente à Hyparrhenia spp. et Entada abyssinica |
||
|
Mashenyo3 |
11,81 |
A2B3S+H+G8 |
Savane arborescente, Loudetia spp. et Parinari curatellifolia |
||
|
Mashenyo4 |
1,56 |
A+B+S+H+G6 |
Savane steppique à Loudetia simplex |
||
|
Mashenyo5 |
3,06 |
A+B2S+H+G6 |
*Savane à Loudetia kagerensis**, Hymenocardia acida* et Parinari curatellifolia |
||
|
Mashenyo6 |
10,58 |
A1B3S+H+G8 |
Savane arborescente à Hyparrhenia spp. et Albizia anthunesiana |
||
|
Mashenyo7 |
15,17 |
A4B5S1H+G7 |
Savane boisée à Hyparrhenia spp., Parinari curatellifolia et Pericopsis angolensis |
||
|
Mashenyo8 |
14,38 |
A7B7S1H10G+ |
Fourré à Bridelia brideliifolia et Parinari curatellifolia |
||
|
Rive Gauche II |
Sentier Ecologique IV |
Bibara 1 |
0,86 |
A0B+S+H+G10 |
Savane herbeuse à Loudetia simplex et Loudetia kagerensis |
|
Bibara 2 |
1,33 |
A0B2S+H+G9 |
Savane arbustive à Loudetia simplex, Hymenocardia acida et Parinari curatellifolia |
||
|
Bibara 3 |
6,41 |
A0B4S1H+G9 |
Savane arbustive à Loudetia simplex, Hymenocardia acida et Parinari curatellifolia |
||
|
Bibara 4 |
8,84 |
A4B2S+H+G10 |
Savane arborescente à Hyparrhenia spp. et Pericopsis angolensis |
||
|
Bibara 5 |
7,1 |
A1B3S+H+G10 |
Savane arbustive à Loudetia kagerensis, Entada abyssinica et Combretum collinum |
||
|
Bibara 6 |
14,06 |
A6B7S+H+G3 |
Savane boisée à Combretum collinum et Combretum molle |
||
|
Bibara 7 |
17,52 |
A2B8S+H2G+ |
Galerie forestière à Syzygium cordatum et Alchornea cordifolia |
||
|
Nyamugari |
14,38 |
A2B8S+H2G1 |
Galerie forestière à Bridelia micrantha |
La signification des symboles enregistrés dans le tableau est la suivante : A: arbres, B : arbustes, S : sous-arbustes, G : graminées, H : herbacée (herbes non Poaceae). L’indice variant de 0 ; + à 10 exprime le recouvrement de l’un ou l’autre de ces groupes des plantes selon l’échelle de Troupin (58): Exemple : G+ indique que recouvrement des graminées est inférieur à 5% tandis que G9 : indique que recouvrement des graminées est de 90%.
Discussion
50Afin d’établir les références floristico - physionomique et dendrométrique pour le suivi de la dynamique de la végétation et des habitats du PNRu, la méthode des parcelles permanentes, réparties sur des transects, a été adoptée. En effet, les études de dynamiques de population, ou de dynamique écosystémique dépendent fortement des suivis sur les parcelles permanentes (Moorcroft, Hurtt & Pacala 2001). Cependant, les résultats issus des parcelles permanentes sont limités par la faible surface échantillonnée (Wagner et al. 2010).
51L’inventaire floristique réalisé dans cette étude a décelé 563 espèces. Cet effectif correspond à 16 % de la flore totale du Burundi, estimée à environ 3500 espèces (40). La présente étude peut constituer à la fois une importante contribution à la connaissance et une confirmation de la très grande richesse floristique du PNRu car celui-ci équivaut seulement à environ 1,8 % du territoire burundais (49). Les 563 espèces des plantes correspondent également à 18 % de la flore de la mosaïque régionale du Lac Victoria qui compte 3000 espèces selon White (50). Le résultat de l’inventaire qui a été effectué dans la présente étude, dépasse de 41 espèces celui qui a été rapporté par Masharabu et al. (38). Sur base de nos résultats et de ceux qui ont été publiés par ces auteurs, l’effectif total actualisé de la flore du PNRu s’élève à 813 espèces (Fig. 5). L’importante augmentation du nombre des taxons floristiques relatifs à ce parc est due au fait que les transects et placeaux dont nos données proviennent sont différents des principaux lieux où nos prédécesseurs ont travaillé. Comme ces auteurs, nous admettons que la connaissance de la biodiversité du PNRu est loin d’être complète car plusieurs endroits non encore bien explorés, surtout des galeries forestières en bordure de la rivière Ruvubu, renfermeraient des espèces non encore répertoriées.
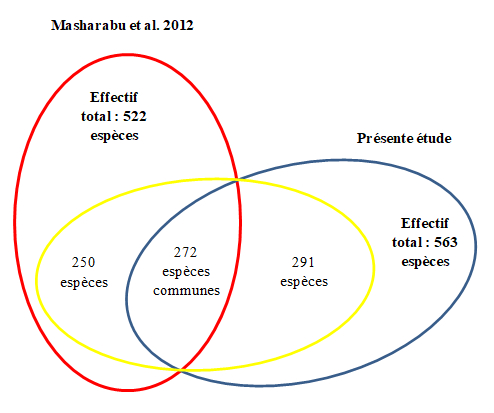
Figure 5 : Diagramme présentant les effectifs des plantes du PNRu reconnues dans la présente étude comparativement aux inventaires réalisés par Masharabu et al. (38)
52Concernant la richesse spécifique, la dominance des familles des Fabaceae des Asteraceae et des Poaceae corrobore les résultats de Masharabu (37) et Masharabu et al. (38) et ceux de Troupin (45) sur la flore du PN de l’Akagera (Tabl. 4). La richesse spécifique de ces familles a été signalée dans plusieurs études de la flore du Burundi (42) et dans les jachères du Burundi (6). Le succès de ces familles relève de leur distribution cosmopolite (6 ; 30) et de leur grande plasticité écologique (31). Leur dominance dans les savanes prospectées traduit la perturbation de ces dernières (6).
Tableau 4 : Familles les plus riches du Parc National de la Ruvubu et du Parc National de l’Akagera
|
Familles |
PNRu |
PN Akagera |
||
|
Présente étude |
Masharabu 2012 |
Masharabu et al. (2012) |
Troupin (1966) |
|
|
Fabaceae |
85 |
73 |
59 |
87 |
|
Asteraceae |
74 |
55 |
57 |
85 |
|
Poaceae |
59 |
52 |
52 |
95 |
53Tenant compte de la présence des espèces, les résultats de la présente étude montrent des valeurs de l’indice de similarité de Sorensen variant entre 0,01 et 0,46, soit 10 et 46%. Or deux sites sont considérés comme similaires lorsque la valeur de cet indice est supérieure à 50 % (13). Les faibles valeurs (toutes < à 50 %) trouvées au PNRu témoignent de la grande variabilité floristique (37) et de la moindre similarité dans la composition des espèces de ces habitats (8). Néanmoins, le regroupement hiérarchique, tenant compte du recouvrement relatif des espèces, a mis en évidence des groupes d’habitats dominés dans la plupart des cas par les mêmes espèces. Par ailleurs, la dissemblance très prononcée, telle que soulignée au début de ce paragraphe s’atténue quelque peu entre les habitats selon qu’ils se retrouvent soit dans la même tranche d’altitude ou dans les mêmes conditions hydrologiques ou pédologiques.
54Cependant, le rapprochement observé entre quelques savanes et les galeries forestières reflète la dégradation de ces dernières dans lesquelles se développe un lot des espèces typiques de savanes. Cette situation serait liée aux feux de brousse, surtout tardifs, que subissent le PNRu annuellement et constituant sa principale pression, modifiant progressivement la composition floristique et la structure des galeries forestières (43). Egalement, certaines espèces communes aux différents types d’habitats seraient non exigeantes et s’adapteraient non seulement aux effets des feux de brousse, mais aussi à d’autres conditions écologiques (humidité, sol, etc.) (25). Ces différents résultats confirment la première hypothèse stipulant que le PNRu renferme une flore, riche et variant selon les types d’habitats, dominée par les familles cosmopolites reflétant la dégradation de ce milieu.
55La répartition des espèces en forme biologique des habitats du PNRu diffère selon leurs stades évolutifs et la variabilité des conditions écologiques. Les phanérophytes et les chaméphytes sont bien représentées dans les différents types d’habitats de ce parc. De même, la proportion des phanérophytes s’explique non seulement par la présence d’arbres et d’arbustes de savane dotés de dispositifs, tel que l’écorce plus épaisse, leur permettant de résister au passage des feux (15 ; 21) mais aussi par leur capacité de se régénérer par rejet de souches après le feu (15). En outre, les thérophytes atteignent des proportions les plus élevées dans les savanes et les bosquets. Ces résultats corroborent ceux de Troupin (45), Bangirinama et al. (6) et Masharabu et al. (36).
56Ces thérophytes dans les savanes reflètent l’anthropisation (9) surtout liée aux feux de brousse tardif (22). Cependant, en considérant le recouvrement relatif des espèces du PNRu, les tendances changent. Les savanes sont dominées par les hémicryptophytes et les phanérophytes. L’abondance relative des hémicryptophytes, traduisant le caractère savanicole, est due à l’importance des Poaceae dans les savanes, entretenue par le passage régulier des feux (1) car ils influencent considérablement la composition et la structure de la biodiversité dans ces écosystèmes savanicoles (20).
57Au point de vue phytogéographique, la prédominance des espèces largement répandues a été démontrée. Ces résultats s’accordent avec ceux qui ont été publiés par Masharabu et al. (36). Ils indiquent une proportion élevée d’espèces largement distribuées traduisant l’ouverture de la flore aux influences extérieures. Par ailleurs, cela correspond bien à la prépondérance de la dynamique régressive telle que soulignée ci-haut. En effet, une forte proportion d’espèces à large distribution peut être un indice de dégradation car la flore perd sa territorialité (24) et traduire un certain degré d’altération de la flore locale (6). L’examen des résultats de la présente étude laisse également prévaloir une interpénétration des domaines zambézien et orientale dans le PNRu.
58Cependant, dans le centre d’endémisme zambézien, l’unité de végétation la plus largement répandue est «la forêt claire zambézienne de type Miombo» (50). Le fait que des arbres des genres Julbernardia et des Brachystegia caractéristiques du Miombo, (48) n’ont pas été recensés dans la présente étude corrobore la conclusion de Masharabu (37) et les recherches sur les territoires phytogéographiques du Burundi sur base de la carte de White (50), qui placent le PNRu dans le domaine oriental, mosaïque régionale du Lac Victoria. Les résultats sur les spectres écologiques des types biologiques et des éléments phytogéographiques confirment la deuxième hypothèse stipulant que ces deux spectres caractérisent un milieu dégradé soumis à des influences extérieures.
59Au point de vue physionomique, les savanes arborescentes et boisées du PNRu sont dépourvues de strates arborescentes à grands ou très grands arbres. Cela est dû à des feux de brousses annuels que subissent ce parc qui réduisent la strate arborée (3; 21). Ces feux contribuent dans la dégradation des sols et ralentissent la croissance des arbres en diamètre et en hauteur (Adjanohoun, 1974 cité par 25). Le recouvrement des strates arbustive et arborescente varie de 15 à 40% des surfaces des placeaux, excepté ceux qui ont été installés dans les savanes boisées et les forêts claires. Selon. Eldridge et al. (11), la fréquence élevée des incendies typique de la savane maintient la canopée dans un état ouvert favorisant ainsi les herbes hautement inflammables. Les valeurs de la surface terrière relatives aux savanes vont du minimum de 0,86 m2/ha pour les savanes herbeuses au maximum de 17,12 m2/ha pour les savanes boisées.
60Dans des formations végétales d’un paysage protégé en zone périurbaine de la ville de Lubumbashi en RDC, Useni Sikuzani et al. (47) signalent une surface terrière de 2,6 ± 1,3 m2/ha pour la savane boisée. Selon Malaisse (34), les surfaces terrière comprise entre 1 et 5 m2/ha caractérisent les savanes arbustives et arborescentes et celles de 5 et 15 m2/ha correspondent à des savanes boisées. Ces valeurs sont globalement inférieures à celles que nous avons indiquées pour le PNRu (Tabl. 5).
61Ces différences sont probablement en rapport avec l’intensité et la fréquence des feux appliqués dans ces territoires et dans une moindre mesure les coupes illicites des arbres. Dans les galeries forestières, les forêts claires, le fourré et les bosquets, 4 strates ont été dénombrés avec une strate arborescente supérieure (20 < 30 m) peu dense, les surfaces terrières étant comprises entre 13,06 et 23,57 m2/ha. Cela rappelle la synthèse établie par Malaisse (34) qui caractérise les forêts claires par les valeurs de la surface terrière comprise entre 15 et 25 m2/ha. Ces résultats confirment la troisième hypothèse qui stipule que les habitats du PNRu sont caractérisés par les types de végétations plus ou moins basses et ouvertes, fortement influencées par les feux de brousse.
62Dans l’ensemble, malgré les adaptations pyrophytiques confirmées pour les plantes ligneuses dominantes mentionnées au paragraphe précédent, la dynamique régressive est prépondérante. En effet, les savanes sont soumises aux feux de brousse tardifs ayant des effets extrêmement néfastes sur leur végétation. Ces feux tardifs gênent la croissance des ligneux et entrainent leur mort en les brûlant totalement jusqu'au feuillage ou en chauffant suffisamment la base des troncs, en détruisant le réseau d'approvisionnement de la partie supérieure (12) et en influençant ainsi la démographie des arbres de savane (3). Cela favorise l’apparition de nouvelles espèces thérophytiques, provoque la régression des phanérophytes et géophytes et limitent de ce fait le retour vers le climax (22).
63Les rudes conditions écologiques, notamment squelettique, rocailleux ou rocheux, associées au passage annuel des feux favorisent le développement des savanes arbustives et herbeuses (2) et entravent la mise en place de la forêt (3 ; 12 ; 21). Sur des sols relativement profonds, les savanes comportent trois strates, des ligneux plus ou moins dense, dont résultent des surfaces terrières plus ou moins élevées. Par ailleurs, la persistance des feux de brousses annuels ainsi que d’autres actions anthropiques observées conduiraient à une réduction progressive des strates et du recouvrement de leurs composants ligneux (3 ; 21), signe d’une évolution régressive (18). La transition du jeune arbre à l'adulte ou de la savane à la forêt nécessite des intervalles sans feu inhabituellement longs, tandis que les transitions inverses sont favorisées par une sécheresse prolongée lorsque les incendies de savane sont suffisamment intenses pour provoquer une destruction importante des arbres adultes et lorsque la forêt non perturbée devient inflammable (21).
64Sous protections stricte, elles évolueraient en savanes boisées dans lesquelles les précurseurs de forêt claire du genre Uapaca s’installeraient. Ces derniers finiraient par dominer les espèces de savanes, généralement héliophiles à courte durée de vie (quelques dizaines d’années) (12), qui disparaitraient progressivement. En effet, la suppression des feux dans les savanes engendre l’expansion des régions boisées (4) et conduit à la progression d'une végétation forestière (5). Bien que les galeries forestières, les forêts claires et les bosquets soient manifestement moins perturbés que les autres habitats du PNRu, ils présentent des signes évidents de dégradations, notamment une diminution considérable de leurs espèces caractéristiques telles que Syzygium cordatum, Albizia gummifera et Phoenix reclinata et la présence des espèces typiques de savane.
Conclusion
65L’objectif de cette étude était de caractériser la flore et les végétations sur le plan physionomique en vue de faciliter leur typologie et rendre aisée la récolte des observations. Ces données seront intégrées dans une base de données constituée dans le cadre du suivi de la dynamique des habitats du PNRu, étant entendu que les plantes reflètent habituellement bien la nature et l’évolution des milieux dans lesquels elles s’intègrent. Des analyses phytogéographiques et dendrométriques ont permis d’actualiser les connaissances disponibles dans ces domaines au niveau de l’aire de cette étude. Sur le plan floristique, 563 espèces réparties en 314 genres et 99 familles ont été inventoriées, ce qui traduit une flore riche et diversifiée.
66Par rapport aux inventaires floristiques préétablis, cette liste rehausse de 41 espèces le nombre total d’espèces trouvées dans le PNRu. Les familles cosmopolites (Fabaceae, Asteraceae et Poaceae) dominent, reflétant des perturbations auxquelles la végétation est sujette sur cette étendue. L’analyse des spectres écologiques montre une prédominance des phanérophytes et des hémicryptophytes.
67Également, la flore de ce parc s’est révélée soumise à des influences phytogéographiques diverses et caractérisée par une interpénétration des domaines zambézien et oriental. L’ensemble de ces résultats, ainsi que des caractéristiques physionomiques et structurales des habitats du PNRu reflètent une forte influence des feux de brousse annuels sur la végétation. L’exclusion de ces feux, surtout tardifs, favoriserait une dynamique progressive de ces habitats.
Remerciements
68Nous remercions l’OBPE qui a initié cette étude en vue de l’acquisition d’une meilleure connaissance de la flore et du suivi des habitats du Parc National de la Ruvubu. Nous tenons également à remercier l’IRSNB pour son soutien financier, scientifique et technique dans la mise en place d’un système de collecte données standardisées sur la dynamique des habitats au Burundi. Nous témoignons aussi notre gratitude envers l’Université du Burundi pour sa collaboration dans la vérification et la détermination, via son herbarium, des spécimens des plantes considérées dans la présente étude. Enfin, nous sommes redevables à Monsieur Nyabenda Mathias, préparateur à l’herbarium de l’OBPE, pour sa parfaite collaboration lors du séchage et de la conservation des herbiers récoltés.
Bibliographie
-
Achard F., Hiernaux P. & Banoin M., 2001, Les jachères fourragères naturelles et améliorées en Afrique de l’Ouest. In: Floret C. & Pontanier R. (eds.), La jachère en Afrique tropicale. John Libbey Eurotext, Paris, 201-239.
-
Ahouangan B. D., Houinato M., Ahamide B., Agbossou E., Sinsin B., 2010, Etude comparative de la productivité de repousses et de la capacité de charge des hémicryptophytes soumises aux feux de végétation dans les parcelles irriguée et non irriguées dans la Réserve Transfrontalière de Biosphère (RTB) du W – Benin. Int. J. Biol. Chem. Sci. 4(2), 479-490
-
Aleman J., 2013, Structure de la végétation en Afrique centrale : rôles des forçages anthropiques et naturels. Université Montpellier 2 – Sciences et techniques du Languedoc, 219 p. NNT : 2013MON20056. tel-00998484
-
Alvarado S. T, 2012, Evaluation du rôle des feux de brousse sur la composition, la structure, la phénologie, et la résistance de la végétation des bois de tapia (Uapaca bojeri) du massif d’Ibity, Nouvelle Aire Protégée, en vue de sa gestion durable. Université d’Avignon et des Pays de Vaucluse, France et l’Université d’Antananarivo, Madagascar, 202p.
-
Arabas K. B., 2000, Spatial and temporal relationships among fire frequency, vegetation, and soil depth in an eastern North American serpentine barren. Journal of the Torrey Botanical Sociery 127(1), 51-65
-
Bangirinama F., Bigendako M. J., Havyarimana F. & Bogaert J., 2011, Analyse de la flore des jachères du Burundi. Bulletin Scientifique de l’Institut National pour l’Environnement et la Conservation de la Nature 10, 1-19
-
Braun-Blanquet J., 1932, Plant sociology. The study of plant communities. Ed. Mac Gray Hill, New York, London, 439 p.
-
Condit R., Pitman N., Egbert G., Leigh Jr., E., G., Chave J., Terborgh J., Foster R., B., Nunez V., P., Aguilar, S., Valencia, R., Villa, G., Muller-Landau, H., C., Losos, E. & Hubbell, S., P., 2002, Beta-diversity in Tropical Forest Trees. Science 295, 666-669
-
Dossou-Yovo H. O., Assogbadjo A., E. & Sinsin B., 2016, The Contribution of Termitaria to Plant Species Conservation in the Pendjari Biosphere Reserve in Benin. Environment and Ecology Research 4(4), 200-206.
-
Doumenge C., Palla F., Scholte P., Hiol Hiol F. & Larzillière A. (Eds.), 2015. Aires protégées d’Afrique centrale - État 2015. OFAC, Kinshasa, République Démocratique du Congo et Yaoundé, Cameroun : 256 p.
-
Eldridge D.J., Bowker M.A., Maestre F.T., Roger E., Reynolds J.F. & Whitford W.G., 2011, Impacts of shrub encroachment on ecosystem structure and functioning: towards a global synthesis. Ecol. Lett. 14, 709-722
-
Favier C., 2005, Hommes, Savanes, Forêts: modélisation de systèmes dynamiques liant l'homme à son environnement. Thèse de doctorat, Université Paris XI Orsay (Spécialité Physique), 197p. Hal Id: tel-00009014v2
-
Faye E., Bindelle J., Lejoly J. & Maiga M., 2013, Biodiversity and pastoral value of herbaceous species of the Fina Reserve (Mali), Scripta Botanica Belgica 50, 111–120
-
Fischer E. & Killmann D., 2008, Illustrated Field Guide to the plants of Nyungwe National Park Rwanda. Koblenz Geographical Colloquia. Series Biogeographical Monographs1, 771 p.
-
Gignoux J., Clobert J. & Menaut J.C., 1997, Alternative fire resistance strategies in savanna trees. Oecologia 110, 576–583.
-
Grall J. & Coïc N., 2006, Synthèse des méthodes d’évaluation de la qualité du benthos en milieu côtier. Institut Universitaire Européen de la Mer, Ifremer DYNECO/VIGIES/06-13/REBENT, 1-90.
-
Habiyaremye Muhashy F., Lukebakio N. & Ngaliema M., 2011, Habitat de la Réserve et Domaine de chasse Bombo-Lumene (R.D.Congo). Lexique Kiteke des plantes observées dans ces milieux. Institut royal des Sciences naturelles de Belgique (IRSNB), 114p.
-
Habiyaremye Muhashy F. & Ruremesha K., S., 2020, Environnement et piliers endogènes de la valorisation de la biodiversité dans les secteurs sud et centre du parc national des Virunga, RD Congo. Geo-Eco-Trop 1, 15-41.
-
Hillman Smith, K., Habiyaremye Muhashy, F., Amube, J., Sidle, J., 2014. Habitats changes & Fire Management in Garamba. In Hillman Smith K., J. Kalpers, L. Arranz & N. Ortega (Eds) 2014. Garamba, Conservation in Peace and War. Published by the authors. 448pp. ISBN: 978-9966-1851-0-5.
-
Hoffmann W.A., Geiger E.L., Gotsch S.G., Rossatto D., R., Silva L.C., R., Lau O.L., Haridasan, M. & Franco A.C., 2012, Ecological thresholds at the savanna-forest boundary: how plant traits, resources and fire govern the distribution of tropical biomes. Ecology Letters, 15, 759-768.
-
Houinato M., Sinsin B. & Lejoly J., 2001, Impact des feux de brousse sur la dynamique des communautés végétales dans la forêt de Bassila (Bénin), Acta Botanica Gallica 148 (3), 237-251. DOI: 10.1080/12538078.2001.10515891
-
Hugé J., Rochette A.J., de Béthune S., Parra Paitan C.C., Vanderhaegen K, Vandervelden T., Van Passel S., Vanhove M.P.M., Verbist B., Verheyen, D., Waas T., Janssens I., Janssens de Bisthoven L., 2020, Ecosystem services assessment tools for African Biosphère Reserves: A review and user-informed classification. Ecosystem services 42 (2020) 101079
-
Kassi J.N., Kouassi R.H. & Yongo D. O., 2012, Analyse de la flore de la forêt classée de Sanaimbo à Bongouanou – Dimbokro (Côte d’Ivoire), Int. J. Biol. Chem. Sci. 6(5), 2139-2148.
-
Kouadio Kouakou B., N’Da Dibi H., Vroh Bi Tra A., Zobi Irié C. & N’Guessan Kouakou E., 2013, Dynamique de la végétation et fréquence des feux de brousse dans la réserve de faune d’Abokouamekro (centre, Côte d’Ivoire). European Scientific Journal 9, 179-192.
-
Kovach W. L., 1997, MVSP: MultiVariate Statistical Package data analysis. Pentraeth, Royaume-Uni, Kovach Computing Services, 137 p.
-
Larrere C. & Larrere R., 1997, Du bon usage de la nature. Pour une philosophie de l'environnement. Aubier, Paris, 355 p.
-
Lebrun J., 1947, La végétation de la plaine alluviale au Sud du lac Edouard. Institut des Parcs Nationaux du Congo Belge, Exploration du Parc National Albert. Mission Lebrun (1937-1938). Fascicule 1, 472-800. Bruxelles.
-
Lebrun J. P. & Stork A.L., 1991-2016, Enumération des plantes à fleurs d'Afrique tropicale et Tropical-African Flowering Plants: Ecology and Distribution, vol. 1, 2, 3, 4, 5. Conservatoire et Jardin botaniques de la Ville de Genève.
-
Lewalle J., 1972, Les étages de végétation du Burundi occidental. Bulletin du Jardin Botanique National de Belgique 42 (1/2), 247p.
-
Lisowski S., 1991, Les Asteraceae dans la flore d’Afrique Centrale Vol.1. Frangmenta Floristica et Geobotanica. Ann. XXXVI, Paris 1 Supplementum 1, 349 p.
-
Louvel Glaser J. & Gaudillat V. 2015, Correspondances entre les classifications d’habitats CORINE Biotopes et EUNIS https://inpn.mnhn.fr/docs/ref_habitats/Correspondances_CORINE_biotopes_EUNIS_Rapport_SPN_%202015_54.pdf 118 pp.
-
Magurran A.E., 2004, Measuring biological diversity. Blackwell Publishing company, United Kingdom, 256 p.
-
Malaisse F., 1985, Comparison of the woody structure in regressive zambezian succession, with emphasis on high termitaria vegetation (Luiswishi, Shaba, Zaïre). Bulletin de la Société Royale de Botanique de Belgique 118, 244-265.
-
Malaisse F., 1993, Endémisme, biodiversité et spéciation dans le centre «domanial» d’endémisme shabo-zambien: remarques préliminaires. Actes du colloque international de Phytogéographie tropicale, Paris, 193-203.
-
Masharabu T., 2012, Flore et végétation du Parc National de la Ruvubu au Burundi: diversité, structure et implication pour la conservation. Editions Universitaires Européennes, Sarrebruck-Allemagne, 256p.
-
Masharabu T., Bigendako M.J., Nzigidahera B., Mpawenayo B., M.F., Lejoly J., Bangirinama F. & Bogaert J., 2012, Vascular flora inventory and plant diversity of the Ruvubu National Park, Burundi. Adansonia, sér. 3, 34 (1), 155-162.
-
Masumbuko Ndabaga C., Habiyaremye Muhashy F., Mubalama Kakira L., 2013, Habitats du Parc National de Kahuzi-Biega (R.D.) Congo. Connaître et suivre leur évolution à l’aide d’un lexique des plantes. IRSNB 189 pp.
-
MEEATU, 2013, Stratégie Nationale et Plan d’Action sur la Biodiversité 2013-2020. Bujumbura-Burundi, 127p.
-
Moorcroft, P.R., Hurtt, G.C. & Pacala, S.W. (2001) A method for scaling vegetation dynamics: the ecosystem demography model (ed). Ecological Monographs, 71, 557–586.
-
Nations Unies, 1992, Convention sur la conservation de la biodiversité. Traité international adopté lors du sommet de la Terre, Rio de Janeiro, 32p.
-
Nzigidahera B., 2000, Etude de la biodiversité végétale et identification des priorités pour sa conservation. I.N.E.C.N, Bujumbura- Burundi, 126 p.
-
Poillecot P., Loua N.S., 2009, Les feux dans les savanes des monts Nimba, Guinée. Bois et forêts des tropiques 301, 51-66.
-
Sorensen T., 1948, A method of establishing group of equal amplitude in plant sociology based on similarity of species content and its application to analyse of the vegetation on Danish common. Kong. Danske Videns., Selskob bioi., Kj6benhavn 4, 1-34.
-
Troupin G., 1966, Etude phytocénologique du Parc National de l’Akagera et du Rwanda oriental. Recherche d’une méthode d’analyse appropriée à la végétation d’Afrique intertropicale. Thèse d’agrégation, ULg, 293p.
-
Troupin G., 1978-1988, Flore du Rwanda, Spermatophytes. Volumes I à IV. Musée Royal de l’Afrique Centrale, Tervuren, Belgique & Institut National de Recherche Scientifique, Butare, République Rwandaise.
-
Useni Sikuzani Y., Khoji Muteya H., Langunu S, Ebuy Alipade J. & Munyemba Kankumbe F., 2020, Structure des peuplements ligneux des formations végétales d’un paysage protégé en zone périurbaine de la ville de Lubumbashi (RD Congo). Geo-Eco-Trop. 44 (1), 1-13.
-
Vancutsem C., Pekel J.F., Evrard C., Malaisse F. & Defourny P., 2006, Carte de l’occupation du sol de la République Démocratique du Congo au 1/3.000.000. Notice explicative. Presses Universitaires de Louvain. 30p + Annexe
-
Vande weghe J.P. & Kabayanda A., 1992, Le Parc National de la Ruvubu et sa région limitrophe: Etude d’identification de la Ruvubu: Etude n° ET/44/2/92. MINATE-CEE, 195p.
-
White F., 1986, La végétation de l’Afrique, Mémoire accompagnant la carte de végétation de l'Afrique. Unesco/AETFAT/UNSO, 391p.
-
Wagner F., Rutishauser E., Blanc L. & Herault B., 2010, Effects of plot size and census interval on descriptors of forest structure and dynamics. Biotropica, 42, 664–671.
Pour citer cet article
A propos de : Didier Mbarushimana
Master en Gestion des Aires Protégées. Burundaise. Chercheur attaché au Service de Recherche en Biodiversité de l'Office Burundais pour la Protection de l'Environnement (OBPE). Bujumbura, Commune Mukaza, Quartier Jabe, Avenue de l'Imprimerie n° 12. Auteur correspondant : mbardi05@gmail.com, Tél : +257 79 352 590.
A propos de : François Habiyaremye Muhashy
Doctorat en sciences botaniques. Congolais. Chargé du module de Suivi de la dynamique des habitats et Valorisation des services écosystémiques dans les aires protégées en Afrique tropicale. Institut Royal des Sciences Naturelles de Belgique; Rue Vautier 29 1000 Bruxelles.
A propos de : Benoît Nzigidahera
Master en Science de l'Environnement. Burundais (décédé).
A propos de : Bernadette Habonimana
Doctorat en sciences agronomiques et Ingénierie biologique. Burundaise. Professeur à l’Université du Burundi. Avenue de l'Unesco, n°2, B.P 1550 Bujumbura. Burundi.
A propos de : Longin Ndayikeza
Master en Science de l'Environnement. Burundais. Chercheur attaché au Service de Recherche en Biodiversité de l'Office Burundais pour la Protection de l'Environnement (OBPE). Bujumbura-Burundi, Commune Mukaza, Quartier Jabe, Avenue de l'Imprimerie n° 12.