- Portada
- Volume 41 (2023)
- Influence de la liane envahissante Sericostachys scandens Gilg & Lopr. (Amaranthaceae) sur la structure des peuplements ligneux du Parc National de la Kibira au Burundi
Vista(s): 958 (12 ULiège)
Descargar(s): 123 (2 ULiège)
Influence de la liane envahissante Sericostachys scandens Gilg & Lopr. (Amaranthaceae) sur la structure des peuplements ligneux du Parc National de la Kibira au Burundi

Documento adjunto(s)
Anexidades
Résumé
Sericostachys scandens Gilg & Lopr. (Amaranthaceae), liane envahissante, représente une menace pour les espèces ligneuses des forêts tropicales. Cette étude vise à comparer les paramètres dendrométriques des peuplements ligneux entre les milieux envahis par S. scandens et les milieux non envahis, puis à estimer l’influence de S. scandens sur les stades de développement des espèces ligneuses (régénération, jeune arbre, arbre) dans le Parc National de la Kibira (PNK) au Burundi. L’abondance de S. scandens et des autres espèces ligneuses a été évaluée dans 100 placeaux de 50 m x 50 m (équitablement répartis entre les milieux envahis et les milieux non envahis du PNK) et soumise à une analyse de la covariance, à un test t de Student et à un modèle linéaire mixte avec pente et ordonnée à l’origine aléatoires. Les paramètres dendrométriques (densité, diamètre, hauteur et surface terrière) sont significativement plus élevées dans les milieux non envahis comparativement aux milieux envahis. La prolifération de S. scandens a un effet négatif sur la densité de tous les stades de développement. S. scandens affecte négativement les peuplements forestiers du PNK. Le contrôle de S. scandens pourrait améliorer le recrutement des espèces ligneuses.
Abstract
Influence of the invasive liana Sericostachys scandens Gilg & Lopr. (Amaranthaceae) on the structure of woody stands within Kibira National Park in Burundi
Sericostachys scandens Gilg & Lopr. (Amaranthaceae), an invasive liana, is a threat on woody species within tropical forests. This study aims to compare descriptors of woody stands between area invaded by S. scandens and non-invaded areas and to estimate the effect of S. scandens on developmental stages of woody species (regeneration, juvenile and adult trees) within the Kibira National Park (KNP) in Burundi. The abundance of S. scandens and other woody species was assessed within 100 plots of 50 m x 50 m (evenly distributed in invaded and non-invaded areas of the KNP) and subjected to an analysis of covariance, to a Student t test and to a linear mixed-effect model with random slope and intercept. Woody stands descriptors (density, diameter, height and basal area) were significantly higher in non-invaded areas than in invaded areas. Invasion of S. scandens has a negative effect on the density of all developmental stages. S. scandens negatively affects forest stands of the KNP. S. scandens control could improve the recruitment of woody species.
Tabla de contenidos
Introduction
1Les lianes sont en constante augmentation dans les forêts tropicales au cours de ces dernières décennies (50). Elles peuvent représenter 35% de la richesse spécifique des espèces ligneuses et 25% de la densité des tiges ligneuses (42). Leur abondance s’accroît considérablement dans les forêts perturbées (26). Pourvues de très longues tiges, les lianes s’appuient sur leurs tuteurs pour élever leur feuillage et leurs fleurs jusqu’au sommet de la couverture forestière (10; 30).
2Les lianes ont un impact important sur la dynamique des forêts en raison de leur aptitude élevée à la compétition et de leur grande capacité à modifier la structure de ces forêts (27). En effet, les lianes réduisent la régénération et la croissance des arbres dans de nombreuses forêts tropicales (21; 43; 47) et augmentent leur mortalité (21). Par exemple, au Panama, Schnitzer et al., (41) ont indiqué que les lianes peuvent bloquer le développement forestier en empêchant la régénération des arbres pendant au moins 13 ans. Explorant les effets de la compétition des lianes sur les plantules d’arbres dans une forêt tropicale en Bolivie, Pérez- Pérez-Salicrup et al., (36) ont signalé que la suppression des lianes a augmenté de façon significative la croissance de ces plantules. Dans une forêt tropicale humide de basses altitudes au Panama, Schnitzer et Carson (43) ont constaté que l’élimination des lianes augmente le recrutement des plantules d’arbres de 46%. Dans la réserve forestière de Porto Ferreira au Brésil, Botosso et al., (10) ont évalué l’effet des lianes sur l’accroissement diamétrique d’arbres adultes de Centrolobium tomentosum Guill. ex-Benth. (Fabaceae-Papilionoideae). Ils ont montré que la croissance mensuelle moyenne se réduit nettement chez les arbres affectés par les lianes (0,33 mm par mois), tandis qu’en l’absence de lianes, la vitesse de croissance atteint 1,34 mm par mois. Dans la forêt amazonienne, Phillips et al., (37) ont analysé l’implication des lianes dans la mortalité des grands arbres (diamètre ≥ 50 cm). Leurs résultats ont montré que les arbres infestés par les lianes sont trois fois plus susceptibles de mourir que les arbres non infestés et que les grandes lianes (diamètre ≥ 10 cm) ont contribué à la perte d’au moins 30% de la surface terrière des arbres en 24 ans. Les arbres peuvent aussi être endommagés ou tués lorsqu’un arbre voisin tombe parce que les lianes relient leur houppier. Lorsqu’elles sont tirées d’une canopée, elles peuvent briser des branches et faire tomber les arbres voisins (13).
3La prolifération de la liane envahissante Sericostachys scandens Gilg & Lopr. (Amaranthaceae) est l’un des changements les plus importants qui ont affecté les écosystèmes forestiers. La carte de distribution présentée par Global Biodiversity Information Facility montre que l’aire de distribution de S. scandens est limitée à l’Afrique tropicale (32). Son habitat principal est la zone montagneuse de l’Afrique centrale et orientale (31) qui constitue son milieu d’indigénat (44). Elle est très répandue dans les forêts de montagne de la République Démocratique du Congo, du Burundi, du Rwanda et de l’Ouganda (12). En grimpant sur les arbres, cette liane les couvre entièrement et beaucoup d’entre eux meurent par étouffement, modifiant la structure forestière. S. scandens prolifère dans les sites qui ont connu des perturbations humaines et couvre de nombreuses clairières dans lesquelles la régénération de la forêt est compromise (32).
4Le Parc National de la Kibira (PNK) est le plus grand massif forestier du Burundi bien qu’il ait connu une certaine fragmentation qui résulte principalement du défrichement à certains endroits au profit de l’agriculture (24). Dans le PNK, en plus des agressions anthropiques directes comme l’exploitation forestière illicite des essences autochtones de valeur, la coupe de bois de chauffage, le défrichement pour l’installation des cultures, le pacage du bétail, les feux de végétation, l’exploitation des mines et des carrières et des produits forestiers non ligneux, la prolifération naturelle de S. scandens entraîne la dégradation du milieu forestier (33). Selon le Ministère burundais de l’Eau, de l’Environnement, de l’Aménagement du Territoire et de l’Urbanisme (MEEATU) (33), S. scandens constitue une menace particulière pour la biodiversité du PNK autant que la déforestation. En se développant, cette liane couvre toutes les autres espèces, surtout ligneuses (les grands arbres), les étouffe en les empêchant d’accéder à la lumière. Les arbres finissent par sécher et par tomber.
5Cette étude vise à analyser l’influence de la liane envahissante S. scandens sur la structure des peuplements forestiers du PNK. Les objectifs spécifiques poursuivis sont: (1) de comparer les paramètres dendrométriques des peuplements ligneux entre les milieux envahis par S. scandens et les milieux non envahis, et (2) d’estimer l’influence de S. scandens sur les stades de développement des espèces ligneuses. Pour atteindre ces objectifs, les hypothèses suivantes ont été formulées: (i) les paramètres de structure (densité, hauteur, diamètre et surface terrière) sont plus faibles dans les peuplements forestiers envahis par S. scandens; (ii) l’influence négative de S. scandens sur la régénération varie d’une espèce à une autre.
Matériel et méthodes
Site d’étude
6Le PNK est situé au nord-ouest du Burundi sur la crête Congo-Nil (Figure 1). Il s’étend de Bugarama au sud jusqu’à la frontière rwandaise au nord où il se prolonge par la forêt de Nyungwe au Rwanda. Le PNK couvre une superficie de 40000 ha avec une longueur de plus ou moins 80 km et une largeur moyenne de 8 km (24). Il s’étend sur quatre provinces, à savoir Muramvya et Kayanza à l’Est d’une part et Bubanza et Cibitoke à l’Ouest d’autre part, couvrant les communes Muramvya, Bukeye, Matongo, Muruta, Kabarore, Musigati, Rugazi, Bukinanyana et Mabayi. Il se localise entre les parallèles 2o36′52′′ et 3o17′08′′ de latitude Sud et entre les méridiens 29o13′31′′ et 29o39′09′′ de longitude Est. Son altitude varie entre 1600 et 2666 m (4). Le PNK est subdivisé en quatre blocs ou secteurs: Teza (5794 ha), Rwegura (12424 ha), Mabayi (6359 ha) et Musigati (15424 ha) (16).
7Le relief du PNK est caractérisé par de fortes pentes de part et d’autre de la Crête Congo-Nil, davantage marquées sur le versant occidental (18). La ligne de crête délimite deux bassins versants communément appelés «Bassin du Nil» à l’Est et «Bassin du Congo» à l’Ouest (28).
8Le climat du PNK est de type tropical d’altitude à tendance tempérée marqué par son caractère montagnard. Les températures moyennes sont les plus basses du pays, variant entre 14 et 20oC selon l’altitude (24). La température moyenne mensuelle enregistrée à la station météorologique de Rwegura au cours des années 1986 à 2015 est de 16,4oC. Les températures les plus basses s’observent généralement durant les mois de juin (15,9oC) et juillet (16oC) et c’est le mois de septembre qui est le plus chaud de l’année avec une moyenne de 17oC (données recueillies à l’Institut Géographique du Burundi: IGEBU). C’est sur la crête Congo-Nil que l’on enregistre une pluviosité intense propice à des forêts denses ombrophiles. Les précipitations annuelles sont supérieures à 1800 mm et atteignent parfois 2000 mm. L’humidité relative se situe entre 60 % et 90 % pendant toute l’année mais reste généralement proche de la moyenne évaluée à 75 %. Le flanc ouest est plus chaud et plus humide que le versant oriental car il bénéficie des courants d’air en provenance de l’Ouest. Les brouillards sont fréquents en altitude, surtout dans les vallées (20).
9Selon la classification WRB-2014 (22), les sols du PNK appartiennent au groupe des ferralsols (23; 46). Ils sont caractérisés par de faibles valeurs de la capacité d’échange cationique effective (≤16 cmol+/kg) et une dominance de la fraction argileuse par la kaolinite et la gibbsite (23; 46).
10La végétation du PNK est caractérisée par la forêt ombrophile de montagne. En fonction des critères écologiques, floristiques et phytogéographiques, Lewalle (28) a distingué trois étages dans cette végétation montagnarde: étage inférieur compris entre 1600 et 1900 m d’altitude, étage moyen allant de 1900 à 2250 m d’altitude et étage supérieur compris entre 2250 m et 2450 m d’altitude. La physionomie des forêts de l’étage inférieur est caractérisée par une forte densité des ligneux et l’intrication des strates arborescentes. Dans la strate arborescente supérieure, de puissants arbres, tels que Anthonotha pynaertii (De Wild.) Exell & Hillc., Albizia gummifera (J.F. Gmel.) C. A. Sm., Parinari excelsa Sabine, Prunus africana (Hook. F.) Kalkman, et Syzigium guineense (Willd.) DC., peuvent atteindre 25 m de haut et ont une cime dense et large. La strate arborescente inférieure est très variée. Localement, Carapa grandiflora Sprague y est abondant. Dans la forêt ombrophile montagnarde de l’étage moyen, les strates sont assez distinctes que dans l’étage inférieur. La strate arborescente supérieure, atteignant 30 m et parfois 40 m, est constituée d’essences géantes telles que Entandrophragma excelsum (Dawe & Sprague) Sprague, P. africana, P. excelsa, et aussi par quelques essences secondaires, dont Polyscias fulva (Hiern) Harms.
11La strate arborescente dominée est riche en espèces comme Tabernaemontana johnstonii (Stapf) Pichon, Symphonia globulifera L. f, Strombosia scheffleri Engl. et de nombreuses espèces secondaires telles que Bersama abyssinica Fresen., Macaranga neomildbraediana Lebrun, Neoboutonia macrocalyx Pax., etc. La forêt de l’étage supérieur prend un aspect qui la distingue assez nettement de celles des étages précédents. A part quelques individus dominants de Podocarpus milanjianus Rendle atteignant 20 m, la cime s’arrête généralement à 15 m.
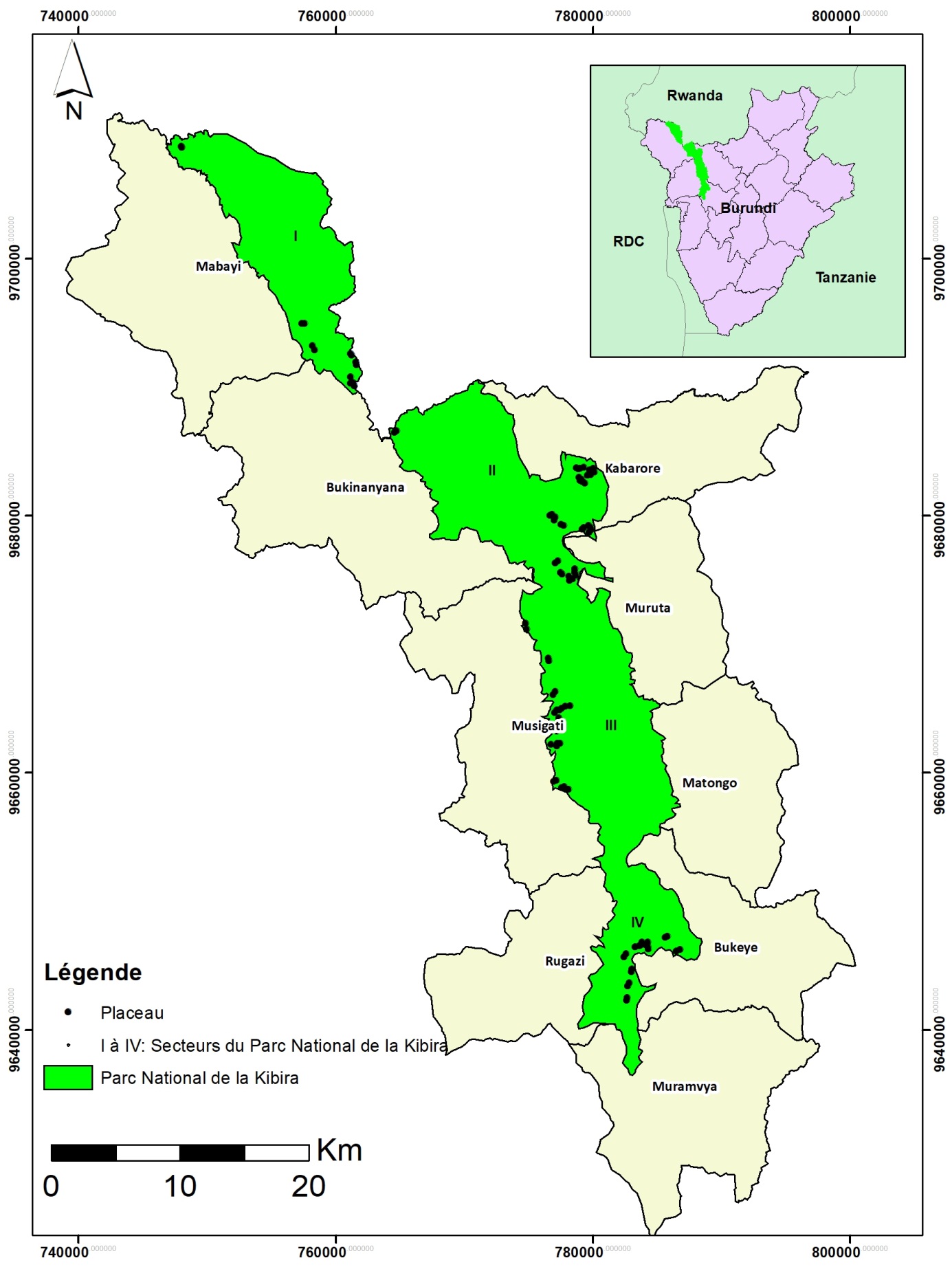
Figure 1. Localisation du Parc National de la Kibira (PNK): (A) localisation du PNK au Burundi, (B) localisation des placeaux d’échantillonnage dans les secteurs du PNK et les communes administratives du Burundi (I = secteur Mabayi, II = secteur Rwegura, III = secteur Musigati, IV = secteur Teza).
Collecte des données
12La collecte des données a été réalisée dans les quatre secteurs du PNK en considérant les deux bassins versants (bassins du Nil et du Congo) et les trois niveaux d’altitude 1600-1900 m, 1900-2250 m et 2250-2450 m) correspondant aux trois étages de la végétation du PNK. Les observations de terrain ont permis de noter l’absence de forêts au niveau d’altitude 1600-1900 m du côté bassin versant du Nil, ce qui correspond à cinq niveaux d’altitude sur l’ensemble des deux bassins versants. Les données ont été collectées dans les paires de placeaux de 0,25 ha (50 m × 50 m) (19), l’un situé en milieu envahi par S. scandens et l’autre situé en milieu non envahi par la liane (32). Par niveau d’altitude, la collecte des données a été faite dans 10 paires de placeaux; soit un total de 100 placeaux équitablement répartis entre les zones envahies par S. scandens et les zones non envahies à l’échelle du PNK. Dans chaque secteur du PNK, le choix des sites où installer une paire de placeaux était guidé par l’importance de la densité de S. scandens. Les sites étaient également choisis de façon à ce que chaque paire de placeaux soit située dans des conditions topographiques similaires. Il convient de signaler aussi que ces placeaux étaient installés chaque fois à au moins 10 m des routes ou pistes passant à l’intérieur du Parc et à au moins 100 m de la bordure de la forêt.
13Dans chaque placeau, tous les individus de S. scandens ayant un diamètre à hauteur de poitrine (dhp) supérieur ou égal à 1 cm ont été inventoriés et leurs diamètres mesurés, à l’aide d’un mètre ruban, suivant le protocole standard proposé par Gerwing et al., (14). Afin de faciliter l’inventaire de la liane, des placettes de 10 m de côté ont été délimitées à l’intérieur des placeaux (34). Quant aux espèces ligneuses, un inventaire exhaustif des individus a été fait en considérant trois catégories définies selon la taille des individus. La première catégorie était composée des arbres regroupant les individus ayant un dhp supérieur ou égal à 10 cm. La deuxième et la troisième catégorie étaient respectivement composées des individus de la strate arbustive haute (ayant une hauteur supérieure ou égale à 2 m et un dhp inférieur à 10 cm) et des individus de la strate arbustive basse (dont la hauteur est comprise entre 10 cm et 2 m et un dhp inférieur à 10 cm) (15). Les plantules de moins de 10 cm de hauteur ont été exclues de l’inventaire car en deçà de cette taille, la régénération subit une forte mortalité et témoigne d’un très faible taux de recrutement (11). Dans la suite du texte, on désignera les individus de la deuxième catégorie et ceux de la troisième catégorie par «jeunes arbres» et «régénération» respectivement. La hauteur a été mesurée par un clinomètre Suunto (fabriqué par la société Suunto en Finlande) auquel ont été associées une perche et une latte graduée de 5 m et 2 m de hauteur respectivement. Les diamètres ont été déduits des mesures des circonférences prises, à l’aide d’un mètre ruban, à 1,30 m au-dessus du sol. La mesure de la circonférence a concerné les individus dont la hauteur était supérieure à 1,50 m. Lors de la mesure de la circonférence, le mètre-ruban a été positionné perpendiculairement à l’axe du tronc suivant le protocole de Picard et Gourlet-Fleury (38).
14Sur le terrain, des spécimens de toutes les espèces recensées ont été récoltés et mis en herbier. La détermination des noms scientifiques des espèces a été réalisée grâce aux divers ouvrages notamment ceux de Besse (8) et Habiyaremye et Nzigidahera (17).
15L’Herbarium de l’Université du Burundi (BJA) et celui de l’Office Burundais pour la Protection de l’Environnement (OBPE) ont été également consultés. La nomenclature suivie pour les noms des espèces est celle de Lebrun et Stork (25) et les noms des familles ont été attribués selon APG IV (3). Les noms scientifiques des espèces ainsi que ceux des familles ont été validés après la vérification des noms actualisés dans la base de données des plantes africaines sur le site http://www.ville-ge.ch/musinfo/bd/cjb/africa/recherche.php. Il est important de souligner que trois spécimens de plantes n’ont pas pu être déterminés. Pour cela, ils ont été considérés comme appartenant aux genres et aux familles à part. Après l’identification des espèces végétales, les spécimens d’herbiers réalisés dans le cadre de la présente étude ont été déposés à l’Herbarium BJA. La liste des spécimens d’herbiers est fournie au niveau de l’annexe 1.
Analyse des données
16Pour chaque placeau, la densité des différents stades de développement (arbre, jeune arbre et régénération) a été calculée ainsi que le diamètre moyen, la hauteur moyenne et la surface terrière des arbres.
17La densité (D ; tiges/ha) été calculée par la formule suivante (9):
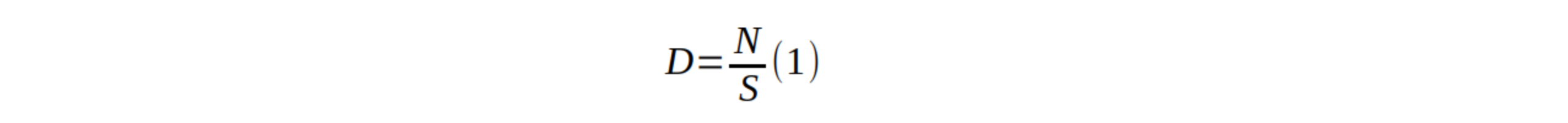
18où est le nombre d’individus et la surface échantillonnée (0,25 ha).
19La surface terrière d’un arbre (est la surface de la section transversale du tronc à 1,30 m de hauteur. Elle est calculée sur base de la formule suivante (9) :
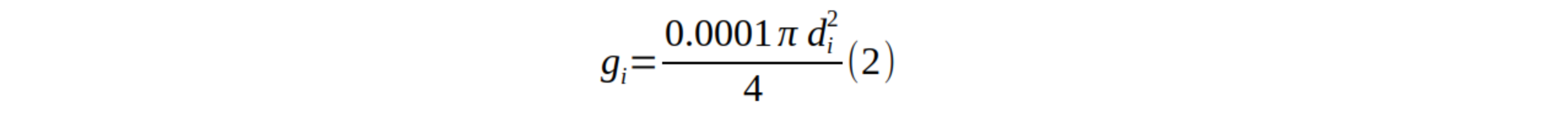
20où est le diamètre à hauteur de poitrine de l’arbre i.
21La surface terrière totale (g ; m2/ha) est calculée sur base de la formule suivante (9) :
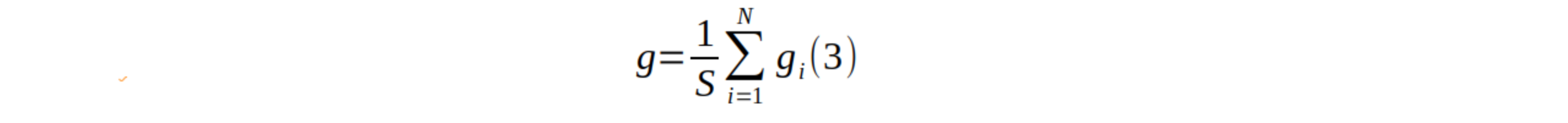
22où N est le nombre d’arbres et la surface échantillonnée (0,25 ha).
23Pour chaque stade de développement, une analyse de la covariance a été exécutée pour tester l’effet du facteur milieu (envahi versus non envahi par S. scandens), et de la covariable altitude sur la densité des individus dans les peuplements ligneux.
24Le test t de Student ou le test de Wilcoxon a été utilisé pour comparer la densité de S. Scandens, la densité de régénération, la densité des jeunes arbres, la densité des arbres, le diamètre moyen, la hauteur moyenne et la surface terrière moyenne entre les peuplements envahis par S. scandens et ceux non envahis. Dans chaque cas, la normalité des données a été vérifiée à l’aide du test de normalité de Shapiro-Wilk. La structure en diamètre et en hauteur des peuplements ligneux a été établie à l’aide d’histogrammes, en regroupant tous les arbres en classes de diamètre et de hauteur de 5 cm et de 2 m, respectivement.
25L’impact de S. scandens sur la démographie des espèces ligneuses a été évalué à l’aide de modèles linéaires à effets mixtes (39) sur les espèces les plus fréquentes, c’est-à-dire présentes dans au moins 10 % des placeaux de chaque milieu. Pour chaque stade de développement, l’existence d’effet aléatoire dans les données a été analysée par ajustement au modèle mixte (45). La corrélation intra-classe était respectivement 0,13; 0,14 et 0,19 pour les stades de développement régénération, jeune arbre et arbre. Ces valeurs indiquent que 13 %, 14 % et 19 % de la variance totale sont expliquées par l’espèce à laquelle appartient l’individu ligneux respectivement aux stades de développement régénération, jeune arbre et arbre. Les modèles linéaires à effets mixtes sont donc plus appropriés que l’ajustement à un modèle commun pour toutes les espèces ligneuses. Ainsi, le modèle à pente et ordonnée à l’origine aléatoires a été utilisé. La densité de S. scandens a été incorporée aux modèles comme facteur fixe et l’espèce de l’individu ligneux comme facteur aléatoire.
26Les placeaux constituent la pseudo-répétition du dispositif expérimental. Sur la base des valeurs de pente et d’ordonnée à l’origine obtenues pour chaque espèce ligneuse, la densité théorique de S. scandens qui annulerait la densité de régénération de l’espèce (exclusion du milieu) a été calculée. La variation de la densité théorique de S. scandens qui exclurait la régénération de chaque espèce a été représentée sous forme de boxplot. Les analyses statistiques ont été réalisées dans le logiciel R version 3.4.2 (40).
Résultats
Influence de S. scandens sur la structure du peuplement
27Soixante-trois espèces végétales ligneuses réparties dans 59 genres et 42 familles ont été inventoriées (Tableau 1).
Tableau 1. Liste des espèces végétales ligneuses inventoriées dans le Parc National de la Kibira au Burundi (Indét = indéterminé, r = régénération, j = jeune arbre, a = arbre adulte, M1 = milieu envahi, M2 = milieu non envahi).
|
Famille |
Espèce |
M1 |
M2 |
|
|
1 |
Alangiaceae |
Alangium chinense (Lour.) Harms |
r, j, a |
r, j, a |
|
2 |
Anacardiaceae |
Pseudospondias microcarpa (A. Rich.) Engl. |
a |
j, a |
|
3 |
Apocynaceae |
Tabernaemontana johnstonii (Stapf) Pichon |
r, j, a |
r, j, a |
|
4 |
Araliaceae |
Polyscias fulva (Hiern) Harms |
r, j, a |
r, j, a |
|
5 |
Bignoniaceae |
Markhamia lutea (Benth.) K.Schum. |
j, a |
r, j, a |
|
6 |
Boraginaceae |
Cordia africana Lam. |
a |
|
|
7 |
Buddlejaceae |
Nuxia floribunda Benth. |
r, j, a |
r, j, a |
|
8 |
Celastraceae |
Maytenus acuminata (L.f.) Loes. |
r, j, a |
r, j, a |
|
9 |
Celastraceae |
Maytenus heterophylla (Eckl. & Zeyh.) N. Robson |
r, j, a |
r, j, a |
|
10 |
Chrysobalanaceae |
Magnistipula butayei De Wild. |
r, j, a |
r, j, a |
|
11 |
Chrysobalanaceae |
Parinari excelsa Sabine |
r, j, a |
|
|
12 |
Clusiaceae |
Garcinia sp |
r, j, a |
|
|
13 |
Clusiaceae |
Harungana madagascariensis Poir. |
j |
j, a |
|
14 |
Clusiaceae |
Symphonia globulifera L. f |
r, j, a |
r, j, a |
|
15 |
Cornaceae |
Afrocrania volkensii (Harms) Hutch. |
r, j, a |
r, j, a |
|
16 |
Ebenaceae |
Diospyros gabunensis Gürke |
r, j |
|
|
17 |
Ericaceae |
Agauria salicifolia (Lam.) Hook. f. ex Oliv. |
j, a |
|
|
18 |
Euphorbaiceae |
Bridelia brideliifolia (Pax) Fedde |
r, j, a |
r, j, a |
|
19 |
Euphorbiaceae |
Croton megalocarpus Hutch. |
a |
a |
|
20 |
Euphorbiaceae |
Macaranga neomildbraediana Lebrun |
r, j, a |
r, j, a |
|
21 |
Euphorbiaceae |
Neoboutonia macrocalyx Pax. |
r, j, a |
r, j, a |
|
22 |
Euphorbiaceae |
Sapium ellipticum (Hochst.) Pax |
r, j, a |
r, j, a |
|
23 |
Fabaceae |
Albizia gummifera (J.F. Gmel.) C.A. Sm. |
r, j, a |
r, j, a |
|
24 |
Fabaceae |
Newtonia buchananii (Baker) G.C.C.Gilbert & Boutique |
r, j, a |
r, j, a |
|
25 |
Flacourtiaceae |
Casearia runssorica Gilg |
r, j, a |
r, j, a |
|
26 |
Flacourtiaceae |
Scolopia rhamniphylla Gilg |
j, a |
|
|
27 |
Icacinaceae |
Apodytes dimidiata E. Mey. ex Arn. |
r, j, a |
r, j, a |
|
28 |
Lauraceae |
Ocotea michelsonii Robyns & R. Wilczek |
r, j, a |
r, j, a |
|
29 |
Loganiaceae |
Anthocleista schweinfurthii Gilg |
r, j, a |
|
|
30 |
Meliaceae |
Carapa grandiflora Sprague |
r, j, a |
r, j, a |
|
31 |
Meliaceae |
Entandrophragma excelsum (Dawe & Sprague) Sprague |
r, j, a |
r, j, a |
|
32 |
Melianthaceae |
Bersama abyssinica Fresen. |
r, j, a |
r, j, a |
|
33 |
Monimiaceae |
Xymalos monospora (Harv.) Baill. Ex Warb. |
r, j, a |
r, j, a |
|
34 |
Moraceae |
Ficus auriculata Lour. |
r |
|
|
35 |
Moraceae |
Ficus capensis Thunb. |
a |
r, j, a |
|
36 |
Moraceae |
Ficus thonningii Blume |
r, j |
r, j, a |
|
37 |
Moraceae |
Myrianthus holstii Engl. |
r, j, a |
r, j, a |
|
38 |
Myricaceae |
Myrica salicifolia Hochst. |
j, a |
|
|
39 |
Myrsinaceae |
Ardisia kivuensis Taton |
r, j, a |
|
|
40 |
Myrsinaceae |
Maesa lanceolata Forsk. |
r, j, a |
r, j, a |
|
41 |
Myrsinaceae |
Myrsine melanophloeos (L.) R. Br. |
r, j, a |
r, j, a |
|
42 |
Myrsinaceae |
Rapanea melanophloeos (L.) Mez |
a |
r, j, a |
|
43 |
Myrtaceae |
Syzygium parvifolium (Engl.) Mildbr. |
r, j, a |
r, j, a |
|
44 |
Olacaceae |
Strombosia scheffleri Engl. |
r, j, a |
r, j, a |
|
45 |
Oleaceae |
Schrebera alata (Hochst.) Welw. |
r, j, a |
|
|
46 |
Pittosporaceae |
Pittosporum mannii Hook.f. |
r, j, a |
r, j, a |
|
47 |
Podocarpaceae |
Podocarpus usambarensis Pilg. |
j |
r, j, a |
|
48 |
Proteaceae |
Faurea saligna Harv. |
r, j, a |
r, j, a |
|
49 |
Rosaceae |
Hagenia abyssinica (Bruce) J.F. Gmel. |
j, a |
r, j, a |
|
50 |
Rosaceae |
Prunus africana (Hook. F.) Kalkman |
r, j, a |
r, j, a |
|
51 |
Rubiaceae |
Mitragyna rubrostipulata (K. Schum.) Havil. |
a |
r, j, a |
|
52 |
Rubiaceae |
Pavetta urundensis Bremek. |
r, j, a |
r, j, a |
|
53 |
Teclea grandifolia Engl. |
r, j, a |
r, j, a |
|
|
54 |
Rutaceae |
Zanthoxylum chalybeum Engl. |
r, j |
r, j, a |
|
55 |
Rutaceae |
Zanthoxylum gilletii (De Wild.) P. G. Waterman |
j |
|
|
56 |
Sapindaceae |
Allophylus africanus P. Beauv. |
r, j, a |
r, j, a |
|
57 |
Sapotaceae |
Chrysophyllum gorungosanum Engl. |
r, j, a |
r, j, a |
|
58 |
Sterculiaceae |
Dombeya goetzenii K.Schum. |
r, j, a |
r, j, a |
|
59 |
Strychnaceae |
Strychnos potatorum L.f. |
j, a |
|
|
60 |
Ulmaceae |
Trema orientalis (L.) Blume |
r, j, a |
|
|
61 |
Indét 1 |
Indét 1 |
r, j, a |
|
|
62 |
Indét 2 |
Indét 2 |
j |
r, j |
|
63 |
Indét 3 |
Indét 3 |
r, j, a |
r, j, a |
28Les résultats de l’analyse de la covariance (Tableau 2) indiquent qu’à tous les stades de développement, la densité des espèces ligneuses varie de manière très significative entre le milieu non envahi et le milieu envahi par S. scandens (p < 0,0001). L’effet de l’altitude n’est pas significatif. Il en est de même de l’interaction entre le milieu et l’altitude. Ainsi, tous les paramètres dendrométriques varient significativement entre le milieu non envahi et le milieu envahi par S. scandens (Tableau 3).
29La densité moyenne de S. scandens varie de 10,96 tiges/ha dans le milieu non envahi à 2776,40 tiges/ha dans le milieu envahi. La densité des espèces ligneuses s’élève à 1450,30 tiges/ha (stade de régénération); 659,30 tiges/ha (stade jeune arbre) et 577,20 tiges/ha (stade arbre) dans les milieux non envahis contre 117,44 tiges/ha (stade de régénération); 256,24 tiges/ha (stade jeune arbre) et 172,00 tiges/ha (stade arbre) dans les milieux envahis. Le diamètre moyen, la hauteur moyenne et la surface terrière sont respectivement de 28,63 cm; 18,07 m et 55,52 m2/ha dans les milieux non envahis contre 27,38 cm; 14,83 m et 15,07 m2/ha respectivement dans les milieux envahis.
Tableau 2. Résultats de l’analyse de la covariance sur la densité des ligneux en fonction du facteur milieu (envahi versus non envahi par S. scandens) et de la covariable altitude dans le Parc National de la Kibira.
|
Sources de variation |
Df |
Sum Sq |
Mean Sq |
F value |
Pr(>F) |
|
Régénération |
|||||
|
Milieu |
1 |
2646804 |
2646804 |
428,8 |
< 0,0001 |
|
Altitude |
1 |
6315 |
6315 |
1,02 |
0,31 |
|
Milieu x Altitude |
1 |
7097 |
7097 |
1,15 |
0,29 |
|
Residuals |
96 |
592571 |
6173 |
||
|
Jeunes arbres |
|||||
|
Milieu |
1 |
247104 |
247104 |
119,52 |
< 0,0001 |
|
Altitude |
1 |
633 |
633 |
0,31 |
0,58 |
|
Milieu x Altitude |
1 |
9 |
9 |
0 |
0,95 |
|
Residuals |
94 |
194348 |
2068 |
||
|
Arbres adultes |
|||||
|
Milieu |
1 |
253065 |
253065 |
577,89 |
< 0,0001 |
|
Altitude |
1 |
367 |
367 |
0,84 |
0,36 |
|
Milieu x Altitude |
1 |
72 |
72 |
0,17 |
0,69 |
|
Residuals |
94 |
41164 |
438 |
Tableau 3. Variation des paramètres dendrométriques (moyenne erreur type) des peuplements ligneux entre les milieux envahis par S. scandens et les milieux non envahis.
|
Paramètres |
Milieu envahi |
Milieu non envahi |
F value |
Pr(>F) |
|
Densité de S. scandens (tiges/ha) |
2776,4 ± 49,6 |
10,96 ± 3,03 |
NA |
< 0,0001 |
|
Densité de régénération (tiges/ha) |
117,44 ± 7,14 |
1450,30 ± 58,00 |
NA |
< 0,0001 |
|
Densité des jeunes arbres (tiges/ha) |
256,24 ± 9,30 |
659,30 ± 34,50 |
NA |
< 0,0001 |
|
Densité des arbres (tiges/ha) |
172,00 ± 5,85 |
577,20 ± 15,50 |
NA |
< 0,0001 |
|
Diamètre des arbres (cm) |
27,38 ± 0,416 |
28,63 ± 0,24 |
6,47 |
0,01 |
|
Hauteur des arbres (m) |
14,83 ± 0,173 |
18,07 ± 0,11 |
210,4 |
< 0,0001 |
|
Surface terrière des arbres (m2/ha) |
15,07 ± 0,796 |
55,52 ± 2,39 |
4 |
0,05 |
NA: Wilcoxon rank sum test
30La distribution des tiges par classes de diamètre (Figure 2) et de hauteur (Figure 3) montre globalement une allure en «L» indiquant la dominance des individus de diamètre et de hauteur faibles tant pour les peuplements des milieux envahis que pour les peuplements des milieux non envahis par S. scandens.
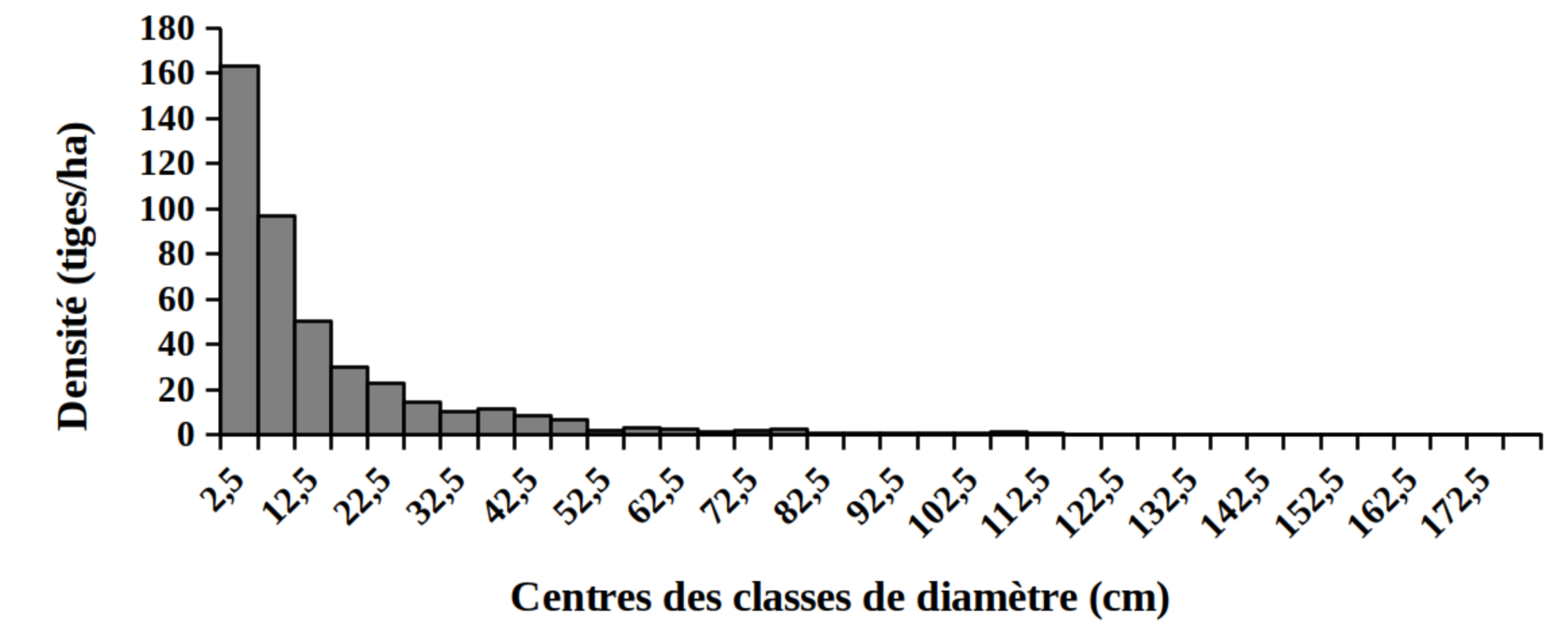
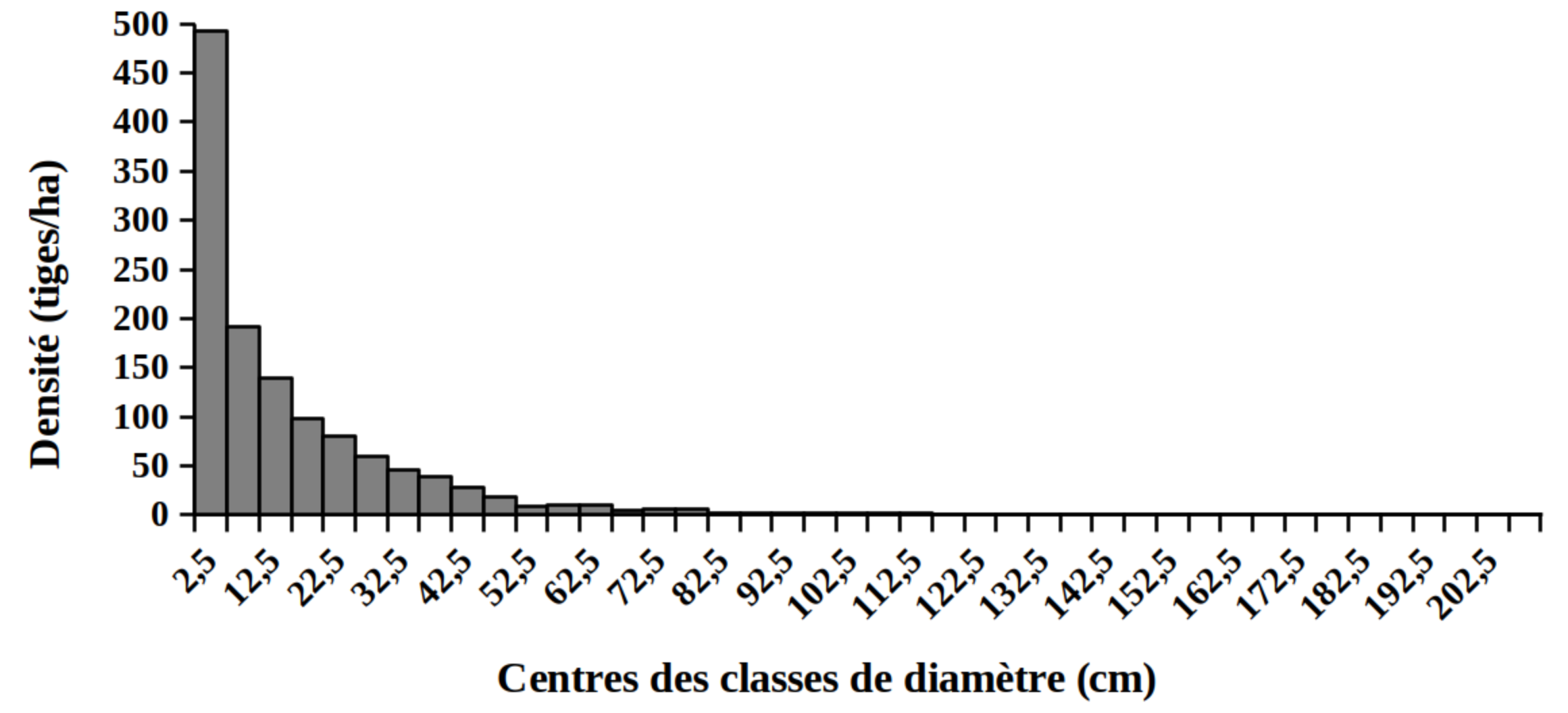
Figure 2. Structure en diamètre des peuplements du Parc National de la Kibira: (A) milieux envahis, (B) milieux non envahis.
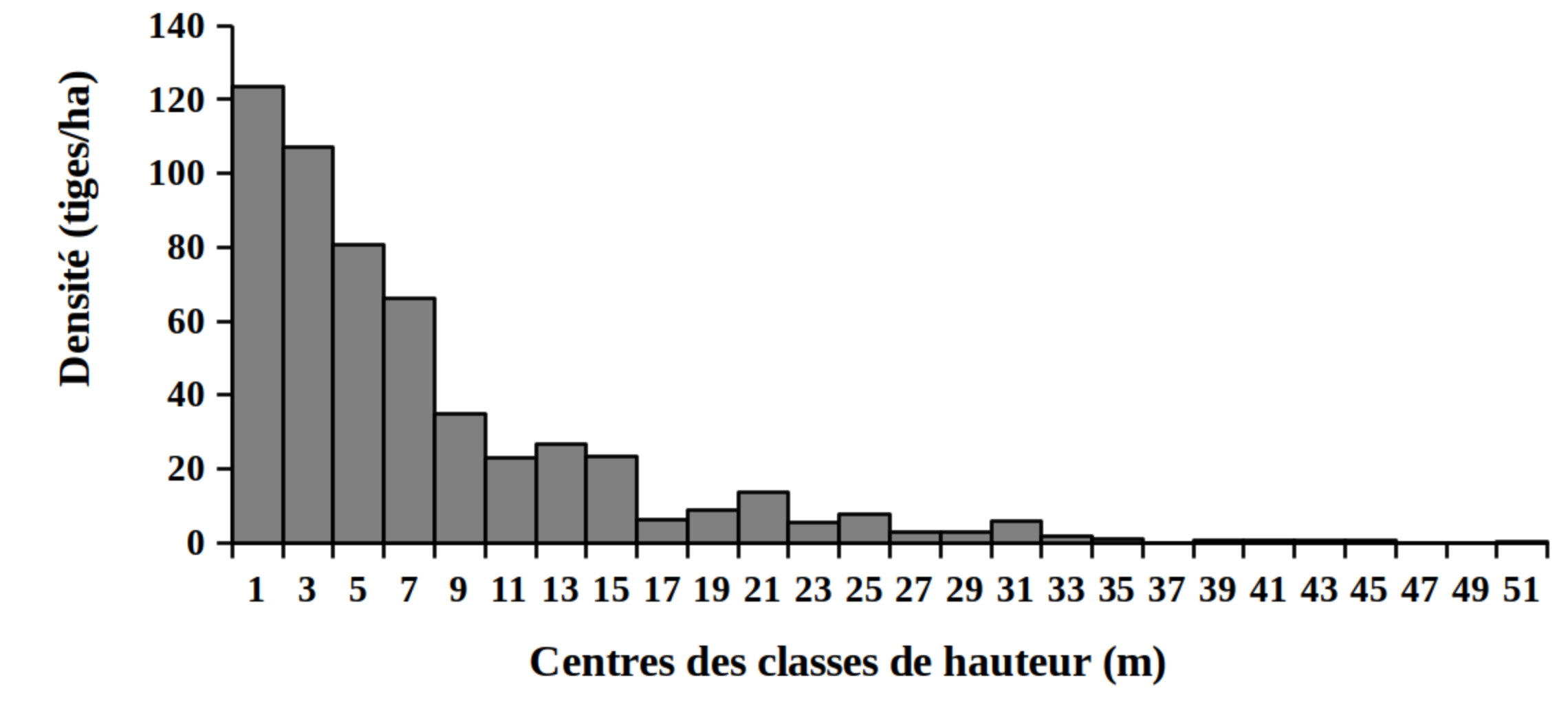
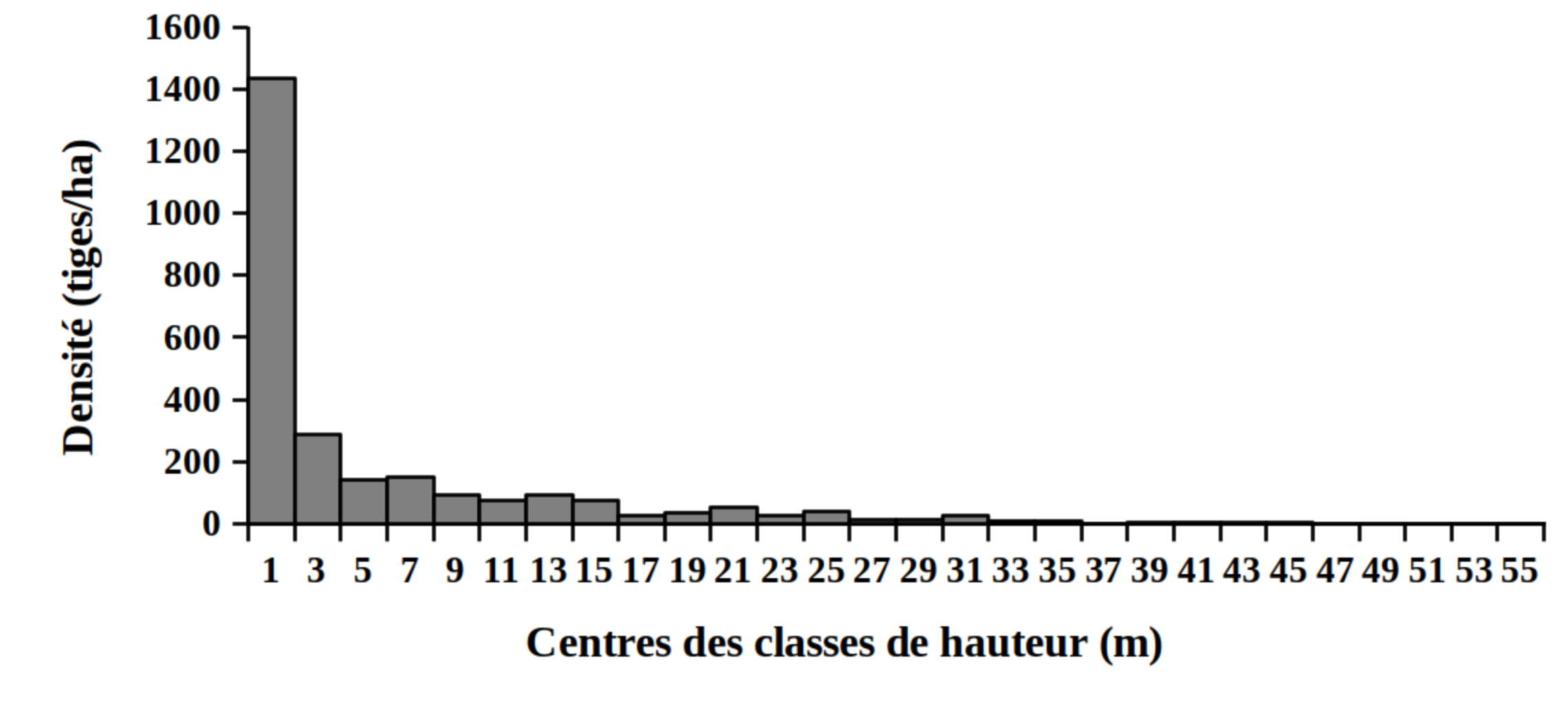
Figure 3. Structure en hauteur des peuplements du Parc National de la Kibira: (A) milieux envahis, (B) milieux non envahis.
Influence de S. scandens sur les stades de développement des espèces ligneuses
31Trente-quatre espèces appartenant à 25 familles ont été identifiées comme étant les plus fréquentes. Au stade de la régénération, la pente du modèle est négative pour toutes les espèces ligneuses (Tableau 4). Ainsi, la densité de S. scandens a un effet négatif sur la régénération des espèces ligneuses. Les plantules de Symphonia globulifera L. f sont les plus sensibles à l’invasion par S. scandens et pourraient théoriquement disparaître du milieu lorsque S. scandens atteint une densité de 3050 tiges/ha. Les plantules de Maesa lanceolata Forsk. seraient éliminées avec une densité de S. scandens égale à 4031 tiges/ha. La sensibilité des plantules des autres espèces à l’invasion du milieu par S. scandens occupe une position intermédiaire. Sur le terrain, la densité maximale observée de S. scandens (3952 tiges/ha) dépasse la densité théorique d’exclusion de la régénération de 31 espèces sur les 34 espèces ligneuses étudiées (Figure 4).
Tableau 4. Résultats des modèles linéaires à effet mixte de l’influence de S. scandens sur la régénération des espèces ligneuses présentes dans au moins 10 % des placeaux (Cons = Constante; Nlianes = pente du modèle; Déxclu = densité minimale de la liane qui pourrait entraîner l’exclusion de l’espèce au stade plantule de la régénération).
|
Famille |
Espèce |
Cons |
Nlianes |
Déxclu |
|
Clusiaceae |
Symphonia globulifera L. f |
61,98 |
-0,02 |
3050,51 |
|
Meliaceae |
Carapa grandiflora Sprague |
73,18 |
-0,02 |
3050,72 |
|
Myrtaceae |
Syzygium parvifolium (Engl.) Mildbr. |
31,38 |
-0,01 |
3073,26 |
|
Chrysobalanaceae |
Magnistipula butayei De Wild. |
30,26 |
-0,01 |
3076,35 |
|
Moraceae |
Myrianthus holstii Engl. |
45,33 |
-0,01 |
3081,49 |
|
Olacaceae |
Strombosia scheffleri Engl. |
41,88 |
-0,01 |
3087,18 |
|
Apocynaceae |
Tabernaemontana johnstonii (Stapf) Pichon |
30,31 |
-0,01 |
3093,38 |
|
Fabaceae |
Newtonia buchananii (Baker) G.C.C.Gilbert & Boutique |
18,46 |
-0,01 |
3108,44 |
|
Sapotaceae |
Chrysophyllum gorungosanum Engl. |
16,53 |
-0,01 |
3110,75 |
|
Proteaceae |
Faurea saligna Harv. |
14,25 |
0 |
3137,68 |
|
Euphorbiaceae |
Macaranga neomildbraediana Lebrun |
13,91 |
0 |
3148,8 |
|
Monimiaceae |
Xymalos monospora (Harv.) Baill. Ex Warb. |
12,18 |
0 |
3173,09 |
|
Meliaceae |
Entandrophragma excelsum (Dawe & Sprague) Sprague |
10,21 |
0 |
3174,21 |
|
Myrsinaceae |
Myrsine melanophloeos (L.) R. Br. |
8,27 |
0 |
3212,66 |
|
Celastraceae |
Maytenus acuminata (L.f.) Loes. |
6,72 |
0 |
3252,44 |
|
Euphorbaiceae |
Bridelia brideliifolia (Pax) Fedde |
6,42 |
0 |
3257,73 |
|
Rubiaceae |
Pavetta urundensis Bremek. |
5,38 |
0 |
3314,57 |
|
Flacourtiaceae |
Casearia runssorica Gilg |
4,43 |
0 |
3390,3 |
|
Alangiaceae |
Alangium chinense (Lour.) Harms |
3,81 |
0 |
3447,01 |
|
Pittosporaceae |
Pittosporum mannii Hook.f. |
3,41 |
0 |
3509,11 |
|
Fabaceae |
Albizia gummifera (J.F. Gmel.) C.A. Sm. |
3,13 |
0 |
3563,33 |
|
Sterculiaceae |
Dombeya goetzenii K.Schum. |
3,04 |
0 |
3582,89 |
|
Euphorbiaceae |
Neoboutonia macrocalyx Pax. |
2,83 |
0 |
3591,14 |
|
Rosaceae |
Hagenia abyssinica (Bruce) J.F. Gmel. |
2,94 |
0 |
3595,15 |
|
Araliaceae |
Polyscias fulva (Hiern) Harms |
2,66 |
0 |
3596,99 |
|
Buddlejaceae |
Nuxia floribunda Benth. |
2,75 |
0 |
3634,27 |
|
Chrysobalanaceae |
2,32 |
0 |
3769,12 |
|
|
Icacinaceae |
Apodytes dimidiata E. Mey. ex Arn. |
2,23 |
0 |
3796,59 |
|
Melianthaceae |
Bersama abyssinica Fresen. |
2,28 |
0 |
3821,06 |
|
Rosaceae |
Prunus africana (Hook. F.) Kalkman |
2,11 |
0 |
3866,24 |
|
Moraceae |
Ficus thonningii Blume |
2,14 |
0 |
3870,77 |
|
Cornaceae |
Afrocrania volkensii (Harms) Hutch. |
1,87 |
0 |
4016,9 |
|
Celastraceae |
Maytenus heterophylla (Eckl. & Zeyh.) N. Robson |
1,89 |
0 |
4018,93 |
|
Myrsinaceae |
Maesa lanceolata Forsk. |
1,78 |
0 |
4031,53 |
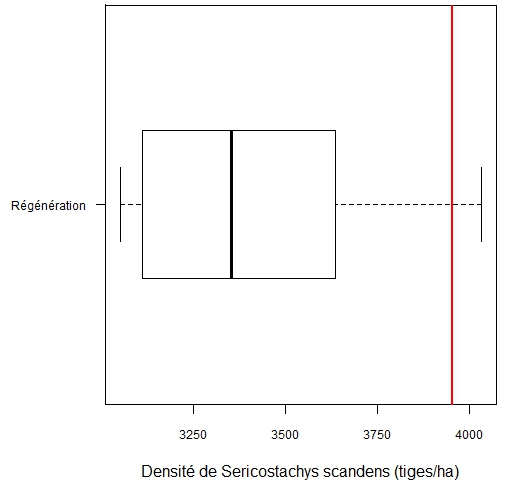
Figure 4. Variation de la densité théorique de S. scandens entrainant l’exclusion de la régénération des espèces ligneuses. Le trait vertical rouge indique la densité maximale de S. scandens enregistrée sur le terrain (3952 tiges/ha).
32Comme observé pour la régénération, la densité de S. scandens influence négativement la densité de toutes les espèces ligneuses aux stades de développement jeune arbre (Tableau 5) et arbre (Tableau 6).
Tableau 5. Résultats des modèles linéaires à effet mixte de l’influence de S. scandens sur les jeunes arbres des espèces ligneuses présentes dans au moins 10 % des placeaux (Cons = Constante; Nlianes = pente du modèle).
|
Famille |
Espèce |
Cons |
Nlianes |
|
Clusiaceae |
Symphonia globulifera L. f |
14,79 |
0 |
|
Olacaceae |
Strombosia scheffleri Engl. |
16,63 |
0 |
|
Meliaceae |
Carapa grandiflora Sprague |
23,81 |
0 |
|
Monimiaceae |
Xymalos monospora (Harv.) Baill. Ex Warb. |
16,1 |
0 |
|
Apocynaceae |
Tabernaemontana johnstonii (Stapf) Pichon |
10,67 |
0 |
|
Euphorbiaceae |
Macaranga neomildbraediana Lebrun |
21,26 |
0 |
|
Chrysobalanaceae |
Magnistipula butayei De Wild. |
7,79 |
0 |
|
Moraceae |
Myrianthus holstii Engl. |
21,84 |
0 |
|
Pittosporaceae |
Pittosporum mannii Hook.f. |
3,97 |
0 |
|
Sapotaceae |
Chrysophyllum gorungosanum Engl. |
4,65 |
0 |
|
Buddlejaceae |
Nuxia floribunda Benth. |
4,07 |
0 |
|
Fabaceae |
Newtonia buchananii (Baker) G.C.C.Gilbert & Boutique |
4 |
0 |
|
Myrsinaceae |
Myrsine melanophloeos (L.) R. Br. |
3,47 |
0 |
|
Melianthaceae |
Bersama abyssinica Fresen. |
3,22 |
0 |
|
Araliaceae |
Polyscias fulva (Hiern) Harms |
2,68 |
0 |
|
Myrtaceae |
Syzygium parvifolium (Engl.) Mildbr. |
2,64 |
0 |
|
Euphorbaiceae |
Bridelia brideliifolia (Pax) Fedde |
3,45 |
0 |
|
Celastraceae |
Maytenus acuminata (L.f.) Loes. |
3,02 |
0 |
|
Alangiaceae |
Alangium chinense (Lour.) Harms |
5 |
0 |
|
Rosaceae |
Hagenia abyssinica (Bruce) J.F. Gmel. |
2,77 |
0 |
|
Moraceae |
Ficus thonningii Blume |
2,7 |
0 |
|
Proteaceae |
Faurea saligna Harv. |
2,43 |
0 |
|
Flacourtiaceae |
Casearia runssorica Gilg |
2,32 |
0 |
|
Meliaceae |
Entandrophragma excelsum (Dawe & Sprague) Sprague |
2,25 |
0 |
|
Icacinaceae |
Apodytes dimidiata E. Mey. ex Arn. |
2,32 |
0 |
|
Sterculiaceae |
Dombeya goetzenii K.Schum. |
2,43 |
0 |
|
Euphorbiaceae |
Neoboutonia macrocalyx Pax. |
4,08 |
0 |
|
Myrsinaceae |
Maesa lanceolata Forsk. |
2,23 |
0 |
|
Fabaceae |
Albizia gummifera (J.F. Gmel.) C.A. Sm. |
2,15 |
0 |
|
Cornaceae |
Afrocrania volkensii (Harms) Hutch. |
1,74 |
0 |
|
Rubiaceae |
Pavetta urundensis Bremek. |
1,56 |
0 |
|
Rosaceae |
Prunus africana (Hook. F.) Kalkman |
1,39 |
0 |
|
Celastraceae |
Maytenus heterophylla (Eckl. & Zeyh.) N. Robson |
1,33 |
0 |
|
Chrysobalanaceae |
1,28 |
0 |
Tableau 6. Résultats des modèles linéaires à effet mixte de l’influence de S. scandens sur les arbres des espèces ligneuses présentes dans au moins 10 % des placeaux (Cons = Constante; Nlianes = pente du modèle).
|
Famille |
Espèce |
Cons |
Nlianes |
|
Clusiaceae |
Symphonia globulifera L. f |
13,51 |
0 |
|
Euphorbiaceae |
Macaranga neomildbraediana Lebrun |
27,69 |
-0,01 |
|
Proteaceae |
Faurea saligna Harv. |
16,37 |
0 |
|
Apocynaceae |
Tabernaemontana johnstonii (Stapf) Pichon |
9,22 |
0 |
|
Olacaceae |
Strombosia scheffleri Engl. |
8,84 |
0 |
|
Monimiaceae |
Xymalos monospora (Harv.) Baill. Ex Warb. |
8,24 |
0 |
|
Myrtaceae |
Syzygium parvifolium (Engl.) Mildbr. |
6,44 |
0 |
|
Moraceae |
Myrianthus holstii Engl. |
20,23 |
0 |
|
Buddlejaceae |
Nuxia floribunda Benth. |
8,06 |
0 |
|
Araliaceae |
Polyscias fulva (Hiern) Harms |
7,01 |
0 |
|
Meliaceae |
Carapa grandiflora Sprague |
8,91 |
0 |
|
Meliaceae |
Entandrophragma excelsum (Dawe & Sprague) Sprague |
5,03 |
0 |
|
Rosaceae |
Hagenia abyssinica (Bruce) J.F. Gmel. |
5,1 |
0 |
|
Myrsinaceae |
Myrsine melanophloeos (L.) R. Br. |
4,63 |
0 |
|
Chrysobalanaceae |
Magnistipula butayei De Wild. |
3,32 |
0 |
|
Euphorbiaceae |
Neoboutonia macrocalyx Pax. |
6,95 |
0 |
|
Alangiaceae |
Alangium chinense (Lour.) Harms |
4,64 |
0 |
|
Sapotaceae |
Chrysophyllum gorungosanum Engl. |
2,6 |
0 |
|
Rubiaceae |
Pavetta urundensis Bremek. |
2,44 |
0 |
|
Pittosporaceae |
Pittosporum mannii Hook.f. |
2,23 |
0 |
|
Celastraceae |
Maytenus acuminata (L.f.) Loes. |
2,32 |
0 |
|
Euphorbaiceae |
Bridelia brideliifolia (Pax) Fedde |
1,82 |
0 |
|
Sterculiaceae |
Dombeya goetzenii K.Schum. |
2,34 |
0 |
|
Fabaceae |
Newtonia buchananii (Baker) G.C.C.Gilbert & Boutique |
2,1 |
0 |
|
Chrysobalanaceae |
2,18 |
0 |
|
|
Cornaceae |
Afrocrania volkensii (Harms) Hutch. |
1,96 |
0 |
|
Melianthaceae |
Bersama abyssinica Fresen. |
2,28 |
0 |
|
Flacourtiaceae |
Casearia runssorica Gilg |
1,64 |
0 |
|
Moraceae |
Ficus thonningii Blume |
1,46 |
0 |
|
Icacinaceae |
Apodytes dimidiata E. Mey. ex Arn. |
1,38 |
0 |
|
Celastraceae |
Maytenus heterophylla (Eckl. & Zeyh.) N. Robson |
1,14 |
0 |
|
Rosaceae |
Prunus africana (Hook. F.) Kalkman |
1,17 |
0 |
|
Myrsinaceae |
Maesa lanceolata Forsk. |
1,05 |
0 |
|
Fabaceae |
Albizia gummifera (J.F. Gmel.) C.A. Sm. |
1 |
0 |
Discussion
Invasion de S. scandens et structure des peuplements ligneux
33Les résultats ont mis en relief que la densité des différents stades de développement (régénération, jeune arbre et arbre), la hauteur moyenne, le diamètre moyen et la surface terrière sont plus élevés dans les milieux non envahis que dans les milieux envahis par S. scandens. Ces observations confirment l’hypothèse d’un impact négatif des lianes sur la structure des peuplements ligneux envahis. Masumbuko (32) a démontré que l’expansion de la liane S. scandens a un effet négatif sur la densité des arbres en forêt de montagne au Parc National de Kahuzi-Biega en République Démocratique du Congo. Cela est en accord avec les résultats de ce travail. Dans le Parc National Impénétrable de Bwindi en Ouganda, les résultats de Babaasa et al., (6) ont également montré l’implication de S. scandens dans la réduction de la densité des arbres. Les résultats d’Alvira et al., (2) ont également révélé que les lianes affectent négativement la densité des arbres en Bolivie. Il est admis que les lianes rivalisent intensément avec les arbres (43), exercent un stress mécanique considérable sur les arbres hôtes (41) augmentant ainsi leur mortalité (10; 21; 37). Dans le cas du PNK, les arbres sur lesquels grimpe S. scandens sont souvent complètement couverts et ainsi étouffés. Au fil du temps, les arbres finissent par sécher. Lorsque les conditions du milieu ne permettent pas à S. scandens de grimper, elle tapisse de grandes surfaces en s’étalant sur la végétation basse et ainsi bloque le développement de la régénération.
34Les lianes réduisent considérablement la croissance des arbres dans de nombreuses forêts tropicales (10; 21; 37; 43; 48). Par exemple, Botosso et al., (10) ont montré que l’accroissement total (en pourcentage de la circonférence du tronc) est, en moyenne, de l’ordre de 1,18 % pour les arbres envahis de lianes et nettement plus élevé (5,12 %) pour les arbres sans lianes. Au Panama, Schnitzer et Carson (43) ont observé que l’élimination des lianes induit une augmentation de la croissance du diamètre des arbres de 55%. Cet effet inhibiteur des lianes sur la croissance des espèces ligneuses expliquerait les basses valeurs des paramètres dendrométriques (hauteur moyenne, diamètre moyen et surface terrière) des peuplements forestiers du PNK envahis par S. scandens.
35Les résultats de la structure en diamètre et en hauteur ont montré une allure en «L» indiquant que les basses classes sont mieux représentées que les classes supérieures tant pour les peuplements des milieux envahis que pour les peuplements des milieux non envahis par S. scandens. Cette structure qui met en évidence l’abondance des tiges de petite taille traduit une bonne régénération typique des forêts naturelles stables (35) ou moins perturbée par les faits anthropiques (5). En dépit de l’expansion de S. scandens, les peuplements forestiers du PNK seraient dans de bonnes conditions naturelles (édaphiques, topographiques, climatiques) favorables à leur régénération. En effet, la bonne régénération des arbres traduite par une courbe en «L» ou en «J» inversé a été attribuée aux bonnes conditions naturelles du milieu (19).
Invasion de S. scandens et densité des stades de développement des espèces ligneuses
36Les résultats ont montré que toutes les espèces, indépendamment de leurs stades de développement, sont négativement influencées par S. scandens. D’une part, ces résultats corroborent ceux de Masumbuko (32) qui a rapporté que cette liane ne s’attaque pas aux espèces d’arbres de manière sélective dans les forêts de montagne au Parc National de Kahuzi-Biega en République Démocratique du Congo. D’autre part, ces résultats concordent avec ceux de Toledo-Aceves (48) qui indiquent que les lianes présentent des effets nuisibles sur les arbres à toutes les étapes de la vie de ceux-ci. En effet, pour la régénération et les jeunes arbres, les lianes peuvent changer les modèles d’allocation de la biomasse, la performance physiologique et peuvent réduire la croissance et le recrutement (43). Pour les arbres adultes, les lianes peuvent affecter la performance physiologique (47), le taux de croissance (21) et la survie (21; 37).
37Les résultats ont également montré que, théoriquement, la régénération de Symphonia globulifera L. f. est la plus sensible à l’invasion par S. scandens. A l’opposé, la régénération de Maesa lanceolata Forsk. est la moins sensible. Il est indiqué que certaines espèces d’arbres sont moins affectées par les lianes que d’autres (2; 41; 49). Par exemple, Wright et al., (49) ont indiqué que les lianes ont un effet négatif important sur les espèces arborescentes tolérantes à l’ombrage que sur les espèces intolérantes à l’ombrage, en particulier au stade des plantules. Cependant, Martínez-Izquierdo et al., (29) ont rapporté que les lianes rivalisaient de façon similaire avec toutes les espèces d’arbres, indépendamment de leur identité (tolérante ou non à l’ombrage). Ainsi, il est moins évident que la susceptibilité de S. globulifera et de M. lanceolata (espèces respectivement tolérante et non tolérante à l’ombrage selon Lewalle, 28) soit liée à leur tempérament. Des études ultérieures sont nécessaires pour améliorer la compréhension de la relation entre l’identité des espèces et la sensibilité à l’invasion par S. scandens dans le PNK.
38Les lianes peuvent affecter de manière significative le développement de la régénération des espèces ligneuses par la compétition pour la lumière, les nutriments, l’eau ou par les dommages mécaniques (41; 49). Dans le Parc National de Kakum au Ghana, Addo-Fordjour et Rahmad (1) ont indiqué que la régénération des arbres était absente dans les milieux où les lianes forment des fourrés. Le mécanisme de régénération est naturellement stimulé par la lumière du soleil qui atteint les trouées dans les forêts (7). Dans le cas du PNK, la couverture de S. scandens empêcherait la lumière de pénétrer à la surface du sol et entraverait le développement de la régénération.
Implication de l’étude pour la conservation du PNK et de ses fonctions écologiques
39Cette étude a utilisé une approche communautaire pour mettre en évidence l’influence négative de l’invasion par S. scandens sur la structure des peuplements forestiers du PNK. Elle pose les bases des connaissances orientées vers l’impact de la liane sur chaque espèce ligneuse. Il s’agit d’une étape cruciale pour comprendre la variation interspécifique de la sensibilité à la prolifération de S. scandens en tenant compte du tempérament des espèces (sciaphile versus héliophile) ainsi que de leur stade de développement (régénération, jeune arbre, arbre adulte). Ainsi, il est possible d’identifier les espèces les plus exposées à une extirpation locale due à la prolifération de S. scandens et de prendre les mesures idoines de conservation du PNK, et par conséquent de ses fonctions écologiques.
Conclusion
40La liane envahissante S. scandens est en plein essor dans le PNK où elle influence fortement la structure des peuplements forestiers. La présente étude a montré que l’abondance de cette liane affecte négativement les paramètres de structure des peuplements ligneux (densité, diamètre, hauteur et surface terrière). Elle a également mis en relief que toutes les espèces ligneuses sont négativement influencées par S. scandens, quel que soit leur stade de développement. Les résultats de ce travail confirment l’hypothèse d’un impact négatif de l’invasion par S. scandens sur les paramètres dendrométriques des peuplements forestiers et celle de l’influence négative de S. scandens sur la régénération des espèces ligneuses. L’élaboration et la mise en œuvre d’un plan d’aménagement incluant l’élimination de cette liane au tout début de son installation, ainsi que la redynamisation des surveillances sont suggérées pour assurer une conservation durable des forêts de montagne du PNK.
Remerciements
41Les auteurs remercient le Gouvernement du Burundi qui a soutenu financièrement ce travail. Une profonde reconnaissance est également témoignée à la Direction Générale de l’Office Burundais pour la Protection de l’Environnement (OBPE) pour avoir délivré l’autorisation de mener cette étude dans le Parc National de la Kibira et aux gardes forestiers dudit parc pour leur aide sur le terrain.
BibliografÃÂa
1. Addo-Fordjour P. & Rahmad Z.B., 2015, Liana community assemblages in relation to human disturbance in a tropical forest in Ghana: implications for conservation. Int. J. Biodivers. Sci. Ecosyst. Serv. Manage., 11 (4), 286-297.
2. Alvira D., Putz F.E. & Fredericksen T.S., 2004, Liana loads and post-logging liana densities after liana cutting in a lowland forest in Bolivia. For. Ecol. Manage., 190, 73-86.
3. APG IV., 2016, An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Bot. J. Linn. Soc., 181(1), 1-20.
4. Arbonier M., 1996, Parc National de la Kibira: plan de gestion. Institut National pour l’Environnement et la Conservation de la Nature, Bujumbura, 55 p.
5. Asimonyio J.A., Ngabu J.C., Lomba C.B., Falanga C.M., Mpiana P.T. & Ngbolua K.N., 2015, Structure et diversité d’un peuplement forestier hétérogène dans le bloc sud de la réserve forestière de Yoko (Ubundu, République Démocratique du Congo). Int. J. Innov. Sci. Res., 18(2), 241-251.
6. Babaasa D., Eilu G., Kasangaki, A., Bitariho R. & McNeilage A., 2004, Gap characteristics and regeneration in Bwindi Impenetrable National Park, Uganda. Afr. J. Ecol., 42, 217-224.
7. Babweteera F., Plumptre A. & Obua J., 2000, Effect of gap size and age on climber abundance and diversity in Budongo Forest Reserve, Uganda. Afr. J. Ecol., 38, 230-237.
8. Besse F., 1989, Pour une flore usuelle du Burundi: Données phénologiques et pratiques. Ministère de l’Aménagement, du Tourisme et de l’Environnement, Bujumbura, 79 p.
9. Bonou W., Glèlè Kakaï R., Assogbadjo A.E., Fonton H.N. & Sinsin B., 2009, Characterisation of Afzelia africana Sm. habitat in the Lama forest reserve of Benin. For. Ecol. Manag., 258, 1084-1092.
10. Botosso P.C., Filho M.T., Maria V.R.B. & Ferreira-Fedele L., 2005, Les lianes et l’accroissement de Centrolobium tomentosum Guill. ex-Benth. (Papilionoideae) au Brésil. Bois For. Trop., 284 (2), 71-75.
11. Chapman C.A., Chapman L.J., Kaufman L. & Zanne A.E., 1999, Potential causes of arrested succession in Kibale National Park, Uganda: growth and mortality of seedlings. Afr. J. Ecol., 37, 81-92.
12. Dhetchuvi M.J.B. & Gakwavu R.J., 2006, Etude préliminaire de la régénération en forêt de montagne du Rwanda: cas de huit espèces d’arbres illégalement exploitées en Forêt de Nyungwe. Actes de la Deuxième Conférence Annuelle de la Recherche Scientifique, Université Nationale du Rwanda, Butare, 7-21.
13. Garrido-Pérez E.I., Durán R. & Gerold G., 2012, Liana tree relationships: consequences for tree communities and tree evolution. Interciencia, 37, 183-189.
14. Gerwing J.J., Schnitzer S.A., Burnham R.J., Bongers F., Chave J., DeWalt S.J., Ewango C.E.N., Foster R., Kenfack D., Martinez-Ramos M., Parren M., Parthasarathy N., Pérez-Salicrup D.R., Putz F.E. & Thomas D W., 2006, A standard protocol for liana censuses. Biotropica, 38(2), 261-261.
15. Gillet F., 2000, La phytosociologie synusiale intégrée: Guide méthodologique. 4e ed. Neuchâtel, Suisse: Institut de Botanique de l’Université de Neuchâtel, Neuchâtel, 65 p.
16. Gourlet S., 1986, Le Parc National de la Kibira. Quelle potentialité pour quel avenir? Rapport de stage, ENGREF, Montpelliet, 97 p.
17. Habiyaremye M.F. & Nzigidahera B., 2016, Habitat du Parc National de la Kibira (Burundi). Lexique des plantes pour connaître et suivre l’évolution des forêts du secteur Rwegura. Institut Royal des Sciences Naturelles, Bruxelles, 144 p.
18. Habonayo R., Azihou A.F., Dassou G.H., Adomou A.C. & Habonimana B., 2019. Facteurs déterminant l’abondance de Sericostachys scandens (Amaranthaceae) dans le Parc National de la Kibira au Burundi. J. Anim. Plant Sci., 39(1), 6359-6371.
19. Havyarimana F., Bogaert J., Ndayishimiye J., Barima S.S.Y., Bigendako M.J., Lejoly J. & Charles D.C., 2013, Impact de la structure spatiale de Strombosia scheffleri Engl. et Xymalos monospora (Harv.) Baill. sur la régénération naturelle et la coexistence des espèces arborescentes dans la réserve naturelle forestière de Bururi, Burundi. Bois For. Trop., 316(2): 49-61
20. IGEBU., 2001, Bulletin climatologique mensuel (1990-2001). Institut Géographique du Burundi, Gitega.
21. Ingwell L.L., Wright S.J., Becklund K.K., Hubbell S.P. & Schnitzer S.A., 2010, The impact of lianas on 10 years of tree growth and mortality on Barro Colorado Island, Panama. J. Ecol., 98, 879-887.
22. IUSS Working Group WRB., 2015, World Reference Base for Soil Resources 2014, update 2015 International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No 106. FAO, Rome, 192 p.
23. Kaburungu S., 1993, Pedogenic Development of Soils at High Altitude in Burundi. PhD dissertation, Louisiana State University, Baton Rouge, 182 p.
24. Krug O., 1993, Etude des systèmes de production et des systèmes agraires des trois communes riveraines du PNK: proposition en vue d’une réduction des conflits. Institut National pour l’Environnement et la Conservation de la Nature, Bujumbura, 55 p.
25. Lebrun J. P. & Stork, A. L., 1991-1997, Enumération des plantes à fleur d’Afrique tropicale. Conservatoire et Jardin botaniques de la Ville de Genève, Genève, 4 volumes.
26. Ledo A. & Schnitzer S.A., 2014, Disturbance and clonal reproduction determine liana distribution and maintain liana diversity in a tropical forest. Ecology, 95, 2169-2178.
27. Letcher S.G., 2015, Patterns of liana succession in tropical forests. In Schnitzer S.A., Bongers F., Burnham R. J. & Putz F. E. (Eds). Ecology of Lianas. Wiley-Blackwell Publishing, Oxford, pp 116-130.
28. Lewalle J., 1972, Les étages de la végétation du Burundi Occidentale. Bull. Jard. Bot. Nat. Belg., 42, 1-247.
29. Martinez-Izquierdo L., Garcia-Leon M.M., Powers J.S. & Schnitzer S.A., 2016, Lianas suppress seedling growth and survival of 14 tree species in a Panamanian tropical forest. Ecology, 97 (1), 215-224.
30. Marvin D.C., Asner G.P. & Schnitzer S.A., 2016, Liana canopy cover mapped throughout a tropical forest with high-fidelity imaging spectroscopy. Remote Sens. Environ., 176, 98-106.
31. Masumbuko N.C., Nyakabwa M.D.S. & Lejoly J., 2007, Dynamique forestière et impact de Sericostachys scandens GILG & LOPR. (Amaranthaceae) sur l’écosystème forestier en zone de montagne, Parc National de Kahuzi-Biega, RD Congo (Résumé d’une étude en cours). Taxonomania, 21, 1-11.
32. Masumbuko N.C., 2011, Écologie de Sericostachys scandens, liane envahissante dans les forêts de montagne du Parc National de Kahuzi-Biega, République Démocratique du Congo. Thèse de doctorat, Université Libre de Bruxelles, Bruxelles, 176 p.
33. MEEATU., 2013, Plan régional de mise en œuvre de la Stratégie Nationale et Plan d’Action sur la Biodiversité en zones écologiques de Mumirwa et de la Crête Congo-Nil. Ministère de l’Eau, de l’Environnement, de l’Aménagement du Territoire et de l’Urbanisme, Bujumbura, 44 p.
34. Muthuramkumar S. & Parthasarathy N., 2001, Alpha diversity of lianas in a tropical evergreen forest in the Anamalais, Western Ghats, India. J. Trop. Ecol., 6, 1-14.
35. Omatoko J., Nshimba H., Bogaert J., Lejoly J., Shutsha R., Shaumba J.P., Asimonyio J. & Ngbolua K.N., 2015, Etudes floristique et structurale des peuplements sur sols argileux à Pericopsis elata et sableux à Julbernardia seretii dans la forêt de plaine d’UMA en République Démocratique du Congo. Int. J. Innov. Appl. Stud., 13(2), 452-463.
36. Pérez-Salicrup D.R., Sork V.L. & Putz F.E., 2001, Lianas and trees in a liana forest of Amazonian Bolivia. Biotropica, 33, 34-47.
37. Phillips O.L., Martinez R.V., Mendoza A.M., Baker T.R. & Vargas P.N., 2005, Large lianas as hyperdynamic elements of the tropical forest canopy. Ecology, 86(5), 1250-1258.
38. Picard N. & Gourlet-Fleury S., 2008, Manuel de référence pour l’installation de dispositifs permanents en forêt de production dans le Bassin du Congo. COMIFAC, Yaoundé, 265 p.
39. Pinheiro J.C. & Bates D.M., 2000, Mixed-Effets Models in S and S-PLUS. Springer-Verlag, New York, 528 p.
40. R Core Team. 2017R, A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria: URL https://www.R-project.org.
41. Schnitzer S.A., Dalling J.W. & Carson W.P., 2000, The impact of lianas on tree regeneration in tropical forest canopy gaps: evidence for an alternative pathway of gap-phase regeneration. J. Ecol., 88, 655-666.
42. Schnitzer S.A., Mangan S.A. & Hubbell S.P., 2015, Diversity and distribution of lianas on Barro Colorado Island, Panama. In Schnitzer S.A., Bongers F., Burnham R. J. & Putz F. E. (Eds). Ecology of Lianas. Wiley-Blackwell Publishing, Oxford, pp 76-90.
43. Schnitzer S.A. & Carson W.P., 2010, Lianas suppress tree regeneration and diversity in treefall gaps. Ecol. Lett., 13, 849-857.
44. Scholte P., Rugyerinyange L., Bizimungu F., Ruzigandekwe F., Chao N., Mulindahabi F., Ntare N., Babaasa D., Sheil D., Fimbel R., Fischer E., Gapusi J. & Kaplin B., 2010, Reaching consensus: influence of the liana Sericostachys scandens on forest dynamics in Nyungwe National Park, Rwanda. Fauna Flora Int., 44(3), 321-327.
45. Singer J.D. & Willett J.B., 2003, Applied Longitudinal Data Analysis Modeling-Change and Event Occurrence. Oxford University Press, New York, 867 p.
46. Sottiaux G., Opdecamp L., Bigura C. & Frankart R., 1988, Carte des sols du Burundi. Echelle 1/250000. Notice explicative. AGCD, Bruxelles, 225 p.
47. Tobin M.F., Wright A J., Mangan S.A. & Schnitzer S.A., 2012, Lianas have a greater competitive effect than trees of similar biomass on tropical canopy trees. Ecosphere, 3, 1-11.
48. Toledo-Aceves T., 2015, Above and belowground competition between lianas and trees. In Schnitzer S.A., Bongers F., Burnham R. J. & Putz F. E. (Eds). Ecology of Lianas. Wiley-Blackwell Publishing, Oxford, pp 149-163.
49. Wright A.J., Tobin M.J., Mangan S.A. & Schnitzer S.A., 2015, Unique competitive effects of lianas and trees in a tropical forest understory. Oecologia, 177, 561-569.
50. Yorke S.R., Schnitzer S.A., Mascaro J., Letcher S. & Carson W.P., 2013, Increasing liana abundance and basal area in a tropical forest: the contribution of long distance clonal colonization. Biotropica, 45(3), 317-324.
Para citar este artículo
Acerca de: Richard Habonayo
Doctorat Unique en Ecologie Forestière, Chargé de Cours, Enseignant-Chercheur, Centre de Recherche en Sciences des Productions Animales, Végétales et Environnementales, Université du Burundi, Faculté d’Agronomie et de Bio-Ingénierie, B.P 2940 Bujumbura-Burundi, habonayorichard@gmail.com, +25779905378.
Acerca de: Akomian Fortuné Azihou
Doctorat Unique en Aménagement et Gestion des Ressources Naturelles, Maître de conférence, Enseignant-Chercheur, Laboratoire d’Ecologie Appliquée, Université d’Abomey-Calavi, Faculté des Sciences Agronomiques, 01 B.P 526 Cotonou, République du Bénin.
Acerca de: Gbèwonmèdéa Hospice Dassou
Doctorat Unique en Botanique, Maître-assistant, Enseignant-Chercheur, Laboratoire de Botanique et Ecologie Végétale, Université d’Abomey-Calavi, Faculté des Sciences et Techniques, 01 B.P 4521 Cotonou, République du Bénin.
Acerca de: André Nduwimana
Doctorat Unique en Ecologie tropicale, Porfesseur associé, Enseignant-Chercheur, Centre de Recherche en Sciences des Productions Animales, Végétales et Environnementales, Université du Burundi, Faculté d’Agronomie et de Bio-Ingénierie, B.P 2940 Bujumbura-Burundi.
Acerca de: Aristide Cossi Adomou
PhD en Botanique, Professeur Titulaire, Enseignant-Chercheur, Laboratoire de Botanique et Ecologie Végétale, Université d’Abomey-Calavi, Faculté des Sciences et Techniques, 01 B.P 4521 Cotonou, République du Bénin.
Acerca de: Bernadette Habonimana
PhD en Sciences et Ingénierie Biologique (option Eaux et Forêts), Professeur Ordinaire, Enseignant-Chercheur, Centre de Recherche en Sciences des Productions Animales, Végétales et Environnementales, Université du Burundi, Faculté d’Agronomie et de Bio-Ingénierie, B.P 2940 Bujumbura-Burundi, habonimanaberna@gmail.com.