- Startpagina tijdschrift
- Volume 42 (2024)
- Évaluation de l'abondance et de la diversité de la macrofaune du sol dans les espaces verts urbains à Lubumbashi (Haut Katanga, R.D. Congo)
Weergave(s): 397 (27 ULiège)
Download(s): 0 (0 ULiège)
Évaluation de l'abondance et de la diversité de la macrofaune du sol dans les espaces verts urbains à Lubumbashi (Haut Katanga, R.D. Congo)

Résumé
La conservation et l’équilibre des nombreux écosystèmes terrestres sont partiellement liés aux fonctions et services écosystémiques des organismes du sol. Cette étude vise à évaluer l’abondance et la diversité de la macrofaune du sol (MFS) dans les espaces verts urbains (EVU) de la ville de Lubumbashi (RDC). Six EVU ont été sélectionnés et chacun a été subdivisé en deux occupations du sol dont sol végétalisé (SV) et sol nu (SN). Pour chaque occupation du sol, 4 points d’échantillonnage ont été sélectionnés aléatoirement. Des monolithes de type TSBF (Tropical Soil Biology and Fertility), ont été creusés afin de collecter la MFS par tri manuel. Les résultats révèlent 8 genres de fourmis, 5 de vers de terre et 4 de termites. Sur l’ensemble des sites, les termites constituent le groupe taxonomique le plus abondant. Dans l’ensemble des sites, le SV présente une abondance totale de la MFS plus élevée que le SN. Les résultats de la diversité de la MFS montrent qu’il existe, dans chaque groupe taxonomique, un genre capable de s’adapter aux milieux perturbés, notamment sur le SN dans le milieu urbain. Il s’agit du genre Eisenia pour les vers de terre, Messor pour les fourmis et Cubitermes pour les termites.
Abstract
Assessment of the abundance and diversity of soil macrofauna in urban green spaces in Lubumbashi (Haut-Katanga, D.R. Congo) The conservation and balance of the many terrestrial ecosystems are partly linked to the ecosystem functions and services of soil organisms. This study aims to assess the abundance and diversity of soil macrofauna (SMF) in urban green spaces (UGS) in the city of Lubumbashi. Six UGS were selected and each was subdivided into two land uses including vegetated soil (VS) and bare soil (BS). For each land cover, 4 sampling points were randomly selected. TSBF (Tropical Soil Biology and Fertility)-type monoliths were dug to collect the SMF by manual sorting. The results reveal 8 genera of ants, 5 of earthworms and 4 of termites. Across all sites, termites are the most abundant taxonomic group. Across all sites, VS has a higher total SMF abundance than BS. The results of the diversity of the SMF show that there is, in each taxonomic group, a genus capable of adapting to disturbed environments, on the BS in the urban environment. These are the genus Eisenia for earthworms, Messor for ants and Cubitermes for termites.
Inhoudstafel
Introduction
1Les sols forment une interface active essentielle au bon fonctionnement des écosystèmes terrestres, et constituent un support et lieu de vie pour de très nombreuses espèces. Ils assurent la production des ressources alimentaires de presque tous les êtres vivants et contribuent à la qualité de l’eau et de l’air par leurs fonctions de régulation (Ferreira et al., 2018). Cependant, la dégradation des sols s’accélère, et ils sont de plus en plus convoités et soumis à d’importants conflits d’usage, alors qu’ils constituent un patrimoine non renouvelable à l’échelle de la vie humaine (Mougin et al., 2017). Dans son interaction avec le sol, la végétation joue un rôle essentiel au sein des écosystèmes terrestres puisqu’elle constitue 99% de la biomasse (Garnier et al., 2013 cité par Joimel, 2015). En effet, les propriétés de l'écosystème dépendent fortement de la biodiversité en termes de caractéristiques fonctionnelles des organismes qui y sont présents, de leur distribution et abondance dans l'espace et le temps. (Hooper et al., 2005). La faune du sol, qui inclus tous les habitants temporaires et permanents du sol, est considérée comme étant la troisième frontière biotique après les canopées des forêts tropicales (Wolters, 2001 cité par Joimel, 2015). Elle représente un quart de la diversité taxonomique globale (Decaëns et al., 2006 cité par Joimel, 2015).
2Parmi les organismes vivants, la macrofaune du sol joue un rôle majeur dans les écosystèmes naturels. Elle assure de nombreuses fonctions (cycle de carbone, infiltration de l’eau, agrégation) en influençant directement ou indirectement les processus du sol (Huhta, 2007 cité par Joimel, 2015). Les études récentes montrent ainsi l’importance de la macrofaune du sol dans les processus du sol en milieux naturels et urbains (relation entre les vers de terre et l’agrégation) (Pey et al., 2013). La macrofaune du sol contribue ainsi à la fourniture des services écosystémiques et présente un fort intérêt pour la conservation (Decaëns et al., 2006).
3Les espaces verts sont déterminants pour la provision des services écosystémiques en milieux urbains. Ces derniers en ville remplissent une fonction essentielle de conservation et de promotion de la biodiversité. Cette fonction est d’autant plus fondamentale que les villes sont par nature défavorables au développement d’une faune et d’une flore à la fois denses et diversifiées (Guilland et al., 2018). Les espaces verts, à la fois refuges pour de nombreuses espèces animales et réserves végétales, constituent des réserves de biodiversité urbaine (McKinney,2008).
4Malgré cela, le fonctionnement des villes perturbe au quotidien la vie de la faune et de la flore des espaces verts urbains (McKinney,2008). Ainsi, les propriétés des sols sont en effet impactées par le tassement, caractéristique des environnements urbains. Le tassement affecte fortement le microclimat du sol, la disponibilité en eau et l'activité des microorganismes (Tresch, 2019). Ces modifications mènent alors à des altérations des fonctions écosystémiques et des cycles biogéochimiques dans les environnements urbains (Ferreira et al., 2018). Cependant, les différents types d'organisations urbaines et leurs contextes affectent les sols de façons différentes. Plusieurs études montrent que l’urbanisation influence la nature du sol à travers les perturbations directes, les changements de disponibilité des ressources et l'altération des conditions physicochimiques (Tresch, 2019).
5Bien que l’accumulation des connaissances sur la biodiversité des sols ait connu une croissance exponentielle depuis les années 2000, les travaux se sont jusqu’à présent concentrés sur les milieux naturels ou agricoles (De Kimpe & Morel, 2000 cité par Guilland et al., 2018) et les sols urbains ont fait l’objet de moins d’investigations (environ 1% des travaux sur les sols concernent les sols urbain, enquête WOS octobre 2017) (Guilland et al., 2018). Il en résulte un manque de connaissances du patrimoine biologique présent dans les sols urbains (Guilland et al., 2018) et de son rôle dans les fonctions d’intérêts pour le retour de la nature en ville et l’amélioration de la qualité de vie des citadins (fertilité physique et biologique, dégradation des polluants, atténuation de changement climatique par le stockage de carbone) (Pataki et al., 2011 ; Morel et al., 2015 cité par Guilland et al., 2018), en particulier dans les villes tropicales. Face à l’urbanisation rapide à laquelle font face les villes d’Afrique, combler le manque de connaissances pour la conservation de la biodiversité des sols urbains et de ses services écosystémiques est urgent pour résoudre les problèmes complexes liés à l’environnement (Anderson et al., 2013).
6En Afrique tropicale, les organismes du sol comprennent principalement les termites, les vers de terre et les fourmis (Chotte et al., 2001). En raison de l'impact de leur activité sur les caractéristiques du milieu, ces organismes sont aussi appelés les ingénieurs de l'écosystème (Chotte et al., 2001). Ainsi, cette étude a porté une attention particulière sur ces trois groupes taxonomiques.
7Cette étude a pour objectif d’évaluer l’impact de la dégradation de la végétation sur l’abondance et la composition de la macrofaune du sol dans les espaces verts urbains de Lubumbashi. A cette fin nous comparons la macrofaune d’espaces végétalisés (strate herbacée et strate arborée) et non végétalisées au sein de six espaces verts de la ville. Trois questions ont été posées : (1) la présence de végétation est-elle un facteur influençant l’abondance de la macrofaune du sol ? (2) la composition taxonomique de la macrofaune varie-t-elle selon le degré de végétalisation des sols des espaces verts ? (3) quel est le groupe taxonomique dominant dans les espaces verts urbains de Lubumbashi ?
8Trois hypothèses en cohérence avec les trois questions posées ont été émises : (1) La destruction de la végétation pourrait diminuer l’abondance de la macrofaune du sol, car la végétation fournit un habitat et des ressources alimentaires essentielles pour ces organismes. (2) La composition taxonomique de la macrofaune pourrait varier selon le degré de végétalisation des sols des espaces verts, car différentes espèces ont des préférences écologiques spécifiques liées à la couverture végétale. (3) Les termites pourraient être le groupe taxonomique le plus dominant sur l’ensemble des sites et leur abondance pourrait être plus élevée dans les zones végétalisées que dans les sols nus, parce que la végétation fournit des matériaux organiques nécessaires à leur alimentation et à la construction de leurs nids.
Matériels et Méthodes
Sites d’étude
9Cette étude a été conduite dans la ville de Lubumbashi, province du Haut-Katanga, Sud-Est de la République démocratique du Congo. La ville bénéficie d'un climat tropical sec (type Cw du système de classification de Köppen) (Malaisse, 2010), caractérisée par une alternance d’une saison pluvieuse (Novembre à Mars) et une saison sèche (Mai à Septembre) avec Octobre et Avril comme périodes de transition. La pluviométrie annuelle avoisine 1270 mm avec une saison de pluie de 118 jours et une température moyenne annuelle d’environ 20°C. Le taux d’humidité moyenne de 62 % avec un niveau d’humidité minimum moyenne de 52 % en saison sèche et un maximum de 80 % durant la saison pluvieuse (Mpundu et al., 2013 cité par Useni et al., 2014). La population de Lubumbashi a été estimée à plus de 2 millions d'habitants en 2016 (UNDESA, 2016). Les sols de Lubumbashi sont dominés par le groupe de référence des Ferralsols (Ngongo et al., 2009 ; Mujinya et al., 2011).
10La ville de Lubumbashi a longtemps négligé la préservation des espaces verts au profit de l’extension rapide et incontrôlée du bâti. Il en résulte une érosion de la biodiversité causée par l'étalement urbain et la densification du bâti (Useni et al., 2018). Les forêts de reboisement d’eucalyptus et d’acacia sont destinées à compenser les pertes de végétation naturelle. Elles constituent une autre caractéristique du couvert végétal ligneux urbain (Useni et al., 2018).
11Les limites de la ville ont été utilisées pour circonscrire la zone d’étude (Useni et al., 2019) et l’identification des espaces verts a été faite à partir de Google Earth. Six espaces verts attachés aux institutions ou fermés, où au moins un tiers de la superficie totale est couverte par les arbres et arbustes, ont été sélectionnés, dont : le Jardin zoologique de Lubumbashi (ZOO), Safina-Salama (SA), Polytechnique/UNILU (POL), Cité des Jeunes (CJ), le Cercle hippique de Lubumbashi (CHL) et Arboretum/FSA/UNILU (ARB) (Figure 1). La description des activités anthropiques présents dans les sites a été faite pour discriminer les sites d’études.
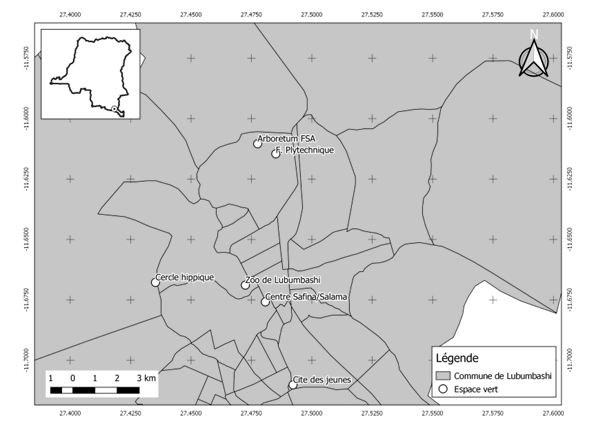
Figure 1. Localisation des espaces verts étudiés au sein de la ville de Lubumbashi
Méthodes
Identification de la macrofaune du sol (MFS)
12L’échantillonnage des sols et de la macrofaune du sol a été réalisé au mois de mai 2020 (échantillonnage complet en début de la saison sèche). Les spécimens de la macrofaune du sol ont été échantillonnés suivant la méthode dite Tropical Soil Biology and Fertility adaptée pour les régions tropicales (TSBF ; Anderson & Ingram, 1993 ; Swift & Bignell, 2001 cité par Bignell, 2009). Dans chaque site d’étude, quatre monolithes de sols (25X25cm, profondeur 30 cm) ont été prélevés dans deux différents types d’occupation de sols : sol nu (SN) et sol végétalisé (SV). Dans le cadre de cette étude, ont été considéré comme sol nu, des zones de 100m2 occupées par un maximum de 3 individus d’arbres dispersés et moins de 15% d’herbacées et, comme sol végétalisé, des zones de 100m2 occupées par plus de 3 individus d’arbres et plus de 95% d’herbacées. Dans chaque zone de 100m2, délimitant l’occupation de sol, 4 quadras de 25 m2 ont été délimités au sein desquels 4 monolithes de sols (25x25cm, profondeur 30 cm) ont été prélevés (figure 2). Au total, 48 monolithes de sol ont été prélevés dans 6 espaces verts. Par ailleurs, à chaque point d’échantillonnage de la macrofaune, un échantillon de sol a été prélevé (à 30 cm de profondeur) avec une tarière et soigneusement conservé dans un sachet en polyéthylène pour l’analyse de la matière organique du sol (MOS).
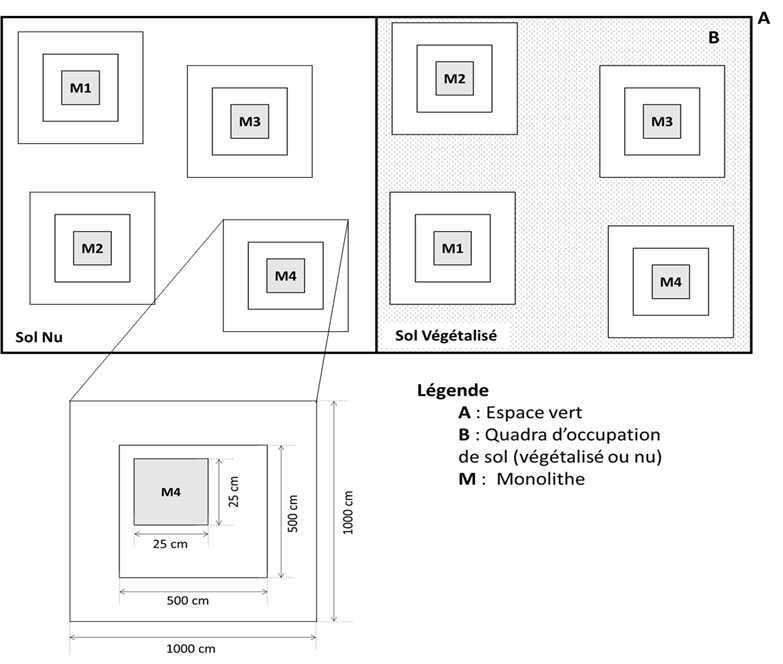
Figure 2. Dispositif d'échantillonnage conduit dans six espaces verts urbains de Lubumbashi pour le prélèvement des monolithes des sols dans les sols végétalisés et les sols nus
Avec A : Espace vert, B : Quadra d’occupation de sol (végétalisé ou nu), M : Monolithe
13Après prélèvement, chaque monolithe de sol a été tamisé à l’aide d’un tamis de 5 mm de maille et trié manuellement. Les trois groupes de macrofaune les plus importants (vers de terre, termites, fourmis) ont été conservés dans des bocaux hermétiques de 50 ml étiquetés et contenant respectivement une solution de formol à 4% pour les vers de terre et une solution d’éthanol à 75% pour les termites et fourmis (Zirbes et al., 2009).
14L’identification et classification de la macrofaune a été effectué à l’aide d’une loupe binoculaire (BRESSER, Reseacher ICD) à la Faculté des Sciences Agronomiques de l’UNILU. Les vers de terre ont été identifiés en utilisant la clé développée par l’Observatoire participatif des vers de terre (OPVT, 2014), les termites ont été identifiés en utilisant la clé de Bouillon & Mathot (1965), les fourmis ont été identifiées en utilisant les clés de Passera & Aaron (2005). Pour chaque échantillon, l’abondance (nombre) de la macrofaune a été déterminée par comptage manuel.
15Un inventaire floristique a été réalisé dans des quadras de 100 m2 centrés sur chaque prélèvement de monolithe sol (4 relevés par occupation du sol par site). Dans chaque quadra de 100m² la liste des espèces d’arbres présents et le nombre de pieds par espèce a été déterminé (figure 3).
Analyses statistiques
16L’abondance moyenne de la macrofaune (nombre d’individus par mètre carré) a été comparée entre sites et modalités de végétalisation du sol par une ANOVA à 2 facteurs croisés pour l’abondance totale de la macrofaune et pour l’abondance des trois groupes taxonomiques individuellement (termites, vers de terre, fourmis). L’analyse de la variance ayant révélé des effets significatifs de l’interaction site X végétalisation du sol sur l’abondance totale de la MFS et celles des trois principaux groupes taxonomiques étudiés (P ˂ 0.001 pour tous les cas), les abondances moyennes ont été comparées entre sols végétalisés et sols nus pour chaque site individuellement grâce à un test-t de student, la question principale de la recherche portant sur l’effet de la végétation sur la macrofaune. L’effet de la concentration en matière organique des sols sur l’abondance totale de la macrofaune a été testé par une régression linéaire pour tous les monolithes confondus et pour les sols végétalisés et sols nus. La variation de composition taxonomique de la macrofaune entre sites et modalités de sol a été caractérisée par une PcoA.
Résultats
Flore des espaces verts étudiés
17Sur l’ensemble des six EVU étudiés, un total de 43 espèces d’arbres a été observé, reparties en 28 espèces natives et 15 espèces exotiques. La richesse spécifique et l’abondance relatives des espèces natives et exotiques varient fortement d’un site à l’autre : de 20 espèces (ZOO) à deux espèces (POL), de 75% d’individus d’espèces natives (CHL) à 0% d’individus d’espèces natives (POL) (Figure 3).

Figure 3. Abondance (nombre d’individus) des espèces végétales natives et exotiques dans les différents espaces verts étudiés.
Abondance de la macrofaune
18L’abondance totale de la macrofaune et l’abondance des groupes taxonomiques étudiés (vers de terre, termites et fourmis) varient fortement d’un site à l’autre et entre sol végétalisé et sol nu au sein des sites (Figure 4). Au sein de chaque site, l’abondance totale moyenne de la macrofaune est significativement plus élevée sous sol végétalisé que sous sol nu ; (p<0.01 à SA et (p=0,04) à ARB, les sols végétalisés renferment 88% de MFS (soit respectivement 10992±3190 et 5552±5747 individus/m²), (p<0.01) au ZOO et (p=0,01) à POL, les sols végétalisés renferment 95% de MFS (soit respectivement 1264±1267 et soit 3504±1969 individus/m²). La proportion de l’abondance de la MFS représentée par les sols végétalisés varie de 100% (site CHL) à 76,7% (site CJ).
19Au niveau des groupes taxonomiques individuels, le nombre de sites où des différences d’abondance sont détectées entre sols végétalisés et non végétalisés varie entre groupes. Dans tous les cas, lorsqu’une différence significative est détectée, l’abondance du groupe taxonomique est supérieure dans les sols végétalisés que dans les sols nus.
20L’abondance moyenne des vers de terre est significativement supérieure sous sol végétalisé que sous sol nu dans deux sites : CHL (p=0,01) et CJ (p<0,01). Dans les deux sites, les SV renfermaient 100% de l’abondance des vers de terre (figure 4B), soit respectivement, 360±379 et 200±28 individus/m² pour CHL et CJ.
21L’abondance moyenne des termites est significativement supérieure sous sol végétalisé que sous sol nu dans 5 EVU : ARB (p=0,01), SA (p<0,01), CHL (p=0,01), CJ (p=0,01), POL (p<0,0.1). Sur l’ensemble de ces sites, les sols végétalisés représentent de 94.8% des termites (ARB) à 100% des termites (CH, CJ) avec des abondances variant de 64±37 individus/m² (CJ) à 7304±767 individus/m² (SA).
22L’abondance moyenne des fourmis est significativement supérieure dans sol végétalisé que dans sol nu dans 5 EVU : SA (p=0,04), ZOO (p=0,05), CHL (p<0,01), CJ (p=0, 05) et POL (p=0,01). Sur l’ensemble de ces sites, les sols végétalisés représentent de 72.4% (SA) à 100% (CHL) des fourmis avec des abondances variant de 48±37 (CJ) à 3632±3418 individus/m² (SA).
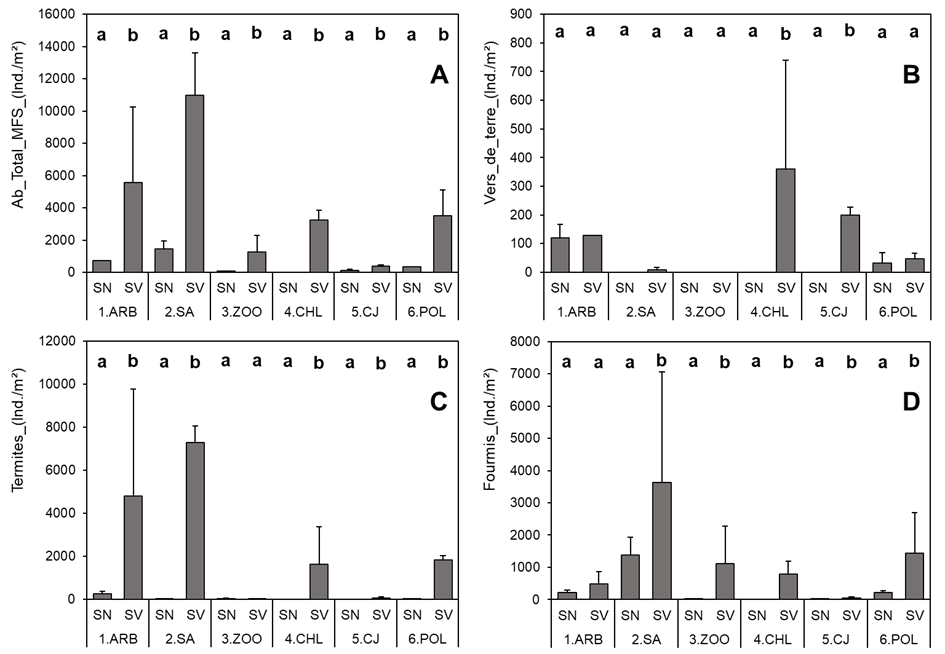
Figure 4. Effet de l’occupation du sol (test-t de student par site) sur l’abondance totale de la MFS, celle des vers de terre, termites et celle des fourmis dans les espaces verts étudiés.
Les abondances moyennes sont comparées par site.
Effet de la concentration en matière organique des sols sur l’abondance totale de la macrofaune
23La teneur en matière organique (MO) des sols varie de 2% à 25%. La teneur en MO est toujours supérieure dans le sol végétalisé que dans le sol nu quel que soit le site. Toutefois l’ordre de grandeur de cette différence varie fortement d’un site à l’autre (minimum : 2%, ARB, sol végétalisé : 4% MO, sol nu : 2% MO ; maximum : 25%, CHL, sol végétalisé : 25%, sol nu 4%). La teneur en MO influence très significativement l’abondance totale de la macrofaune que ce soit 1) sur l’ensemble des sols toutes occupations confondues (r² : 0,55 p<0.001), 2) dans les sols végétalisés (r² : 0,64, p<0,00), et, 3) et dans les sols nus (R2 : 0,38, p=0,01) (Figure 5).
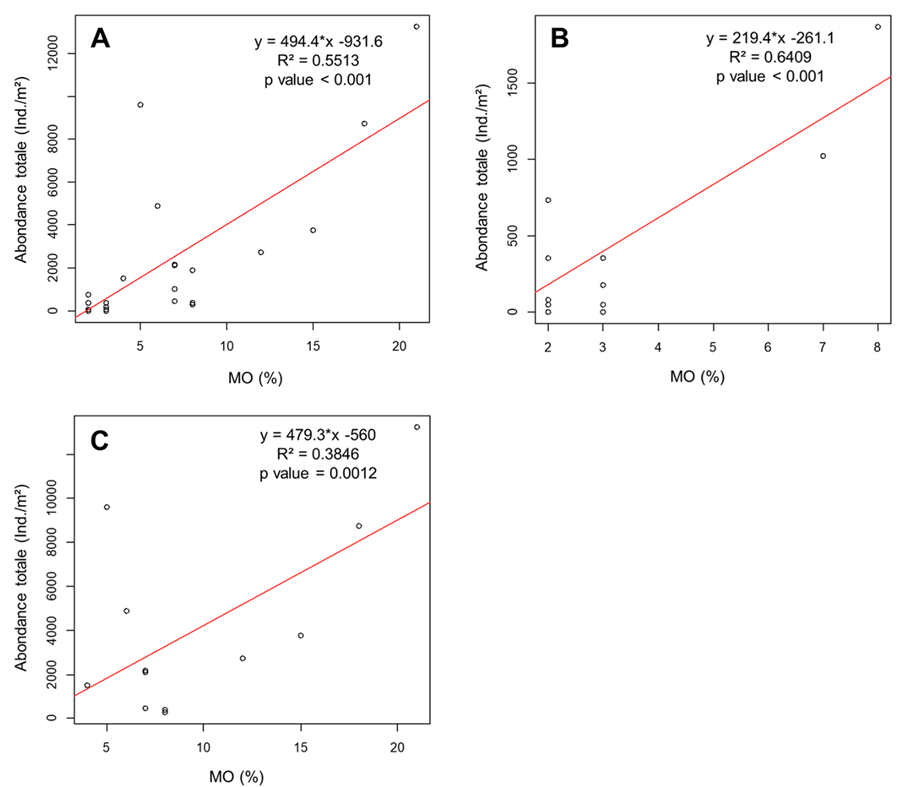
Figure 5. Evolution de l’abondance totale de la MFS en relation avec la teneur matière organique (MO) dans les EVU étudiés.
A : régression linaire entre l’abondance totale de la MFS et la teneur en MO dans le EVU sur tous les sites et toutes les occupations de sols ; B : régression linaire entre l’abondance totale de la MFS et la teneur en MO dans le EVU sur les sols nus de tous les sites ; C : régression linaire entre l’abondance totale de la MFS et la teneur en MO dans le EVU sur les sols végétalisés de tous les sites.
Composition taxonomique de la macrofaune
24Au total, 17 genres de macrofaune ont été identifiés dont 8 genres de fourmis, 5 genres de vers de terre et 4 genres de termites (Tableau 1). La diversité générique varie de 0 (CHLSN) à 7 (ARB-SV) en fonction des occupations de sol au sein des sites. Dans tous les sites, la diversité générique est inférieure dans le sol nu que dans le sol végétalisé (différences de 1 à 4 genres).
Tableau 1. Liste des genres (et espèces) identifiés dans les espaces verts
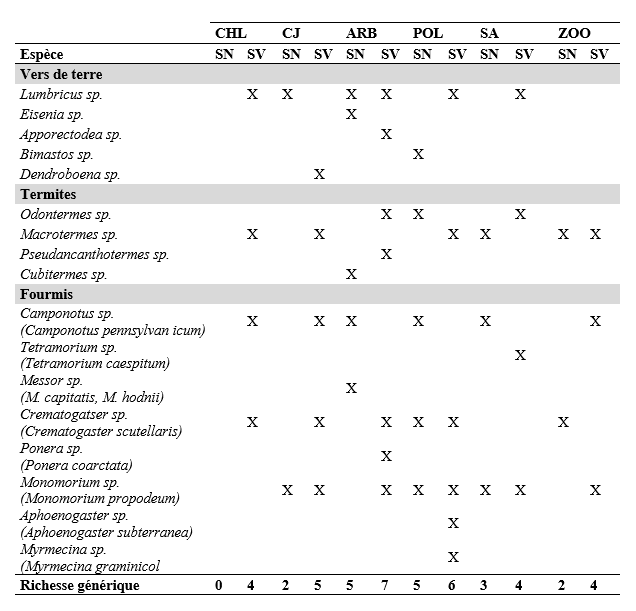
CHL : Cercle Hippique de Lubumbashi, CJ : Cité des Jeunes, ARB: Arboretum de la FSA, POL : Faculté de Polytechnique, SA : Complexe Safina-Salama, ZOO : jardin Zoologique de Lubumbashi, SN : Sol Nu, SV : Sol Végétalisé.
25Sur l’ensemble des sites, les termites constituent le groupe taxonomique le plus important (61% de la population totale de la MFS), alors que les vers de terre sont les moins représentés (3% de la population totale de la MFS).
26L’abondance relative des différents groupes taxonomiques de macrofaune varie fortement d’un site à l’autre avec 3 sites dominés par les termites (ARB, SA, CHL), un site dominé par les fourmis (ZOO), un site dominé par les vers de terre (CJ) et un site avec une codominance des fourmis et termites (POL). De même, au sein des sites, des différences importantes d’abondance relative des différents groupes taxonomique de macrofaune sont observées entre sol végétalisé et le sol nu, à l’exception de POL (figure 6).
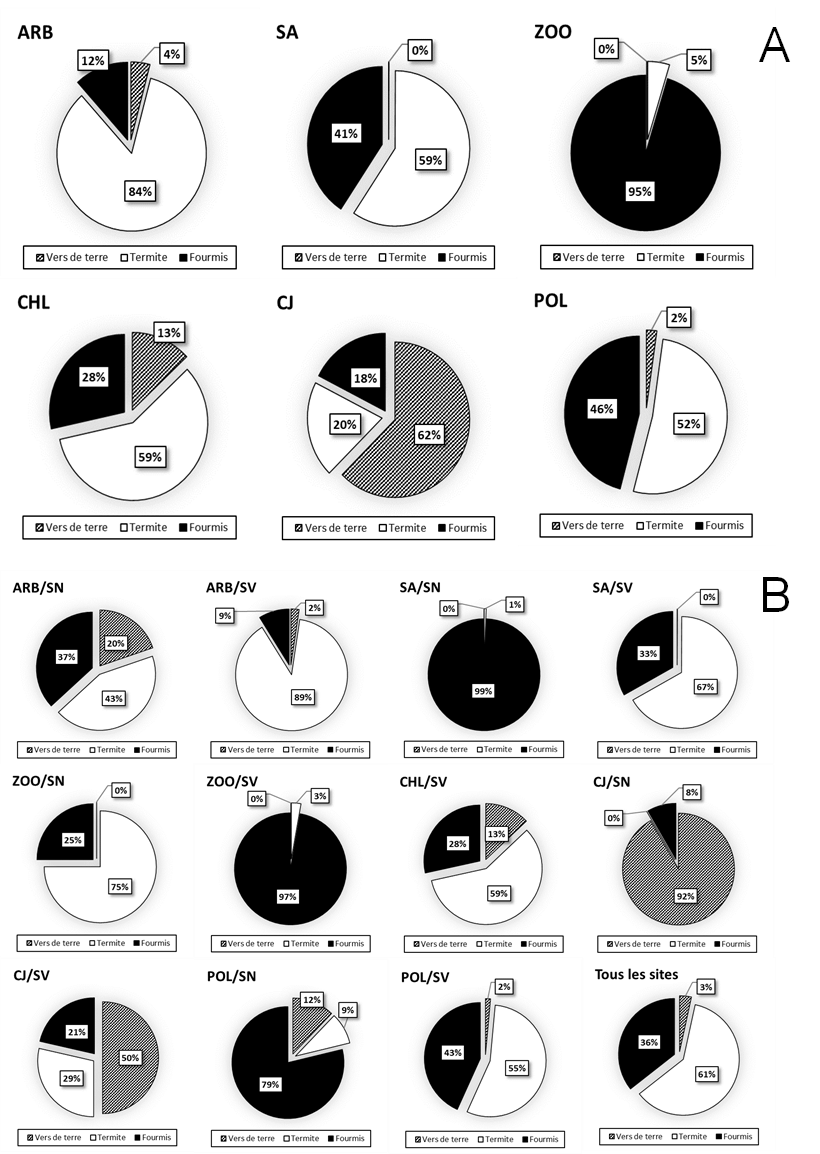
Figure 6. A) Pourcentage de différents groupes taxonomiques (vers de terre, termites et fourmis) dans l’abondance totale de la MFS au sein des différents EVU étudiés. B) Pourcentage de différents groupes taxonomiques (vers de terre, termites et fourmis) dans l’abondance totale de la MFS suivant l’occupation du sol (SN : sol nu ; SV : sol végétalisé) au sein des différents EVU étudiés.
Variation de composition taxonomique de la macrofaune entre sites et modalités de sol
27Les axes 1 et 2 de PCoA (figure 7) basés sur la composition taxonomique de la MFS (au niveau genre et espèces) sur les deux occupations des sols (SN et SV) expliquent 65.5% de la variation globale (PCoA1 = 43.4%, PCoA2 = 22.1%) (Figure 7). La répartition des occupations du sol des différents sites dans le plan factoriel montre un patron complexe dont on peut dégager une tendance principale. Les occupations de sol nus sont toutes positionnées le long des coordonnées positives de l’axe 1, alors que la majorité des occupations de sol végétalisées sont positionnées le long des coordonnées négatives de l’axe 1. Cette distribution suggère une distinction générale de la composition taxonomique de la macrofaune entre sols végétalisés et non végétalisés, distinction confirmée par le positionnement différencié des centroïdes de distribution des zones de sols végétalisés et non végétalisés le long de l’axe 1. Cette différenciation de composition taxonomique n’est toutefois pas généralisée à l’ensemble des situations. En effet les sols végétalisés de CJ et ARB sont rassemblés avec les occupations de sols nus de ZOO et POL (pour CJ végétalisé) et de CJ et CHL (pour ARB végétalisé). En outre, les sols non végétalisés se distinguent en deux groupes le long de l’axe 2 de la PcoA : POL et ZOO (coordonnées positive de l’axe 2) et CJ et CHL (coordonnées négatives de l’axe 2). SA du sol non végétalisé se rassemble avec POL du sol végétalisé (coordonnées positives de l’axe 1 et négative de l’axe 2). Les occupations de sol végétalisées qui présentent une faune différente des sols non végétalisés (coordonnées négatives de l’axe 1) sont caractérisées par les taxons suivants : Camponotus pennsylvanicum, Crematogaster scutellaris, Macrotermes sp., Lumbricus sp., Tetramorium caespitum, Monomorium propodeum, Odontermes sp. Les occupations du sol non végétalisés sont caractérisées par les taxons suivant : Eisenia sp, Bimastos sp., Cubitermes sp., Messor sp. et Aphoenogaster sp. (coordonnées positives de l’axe 1).
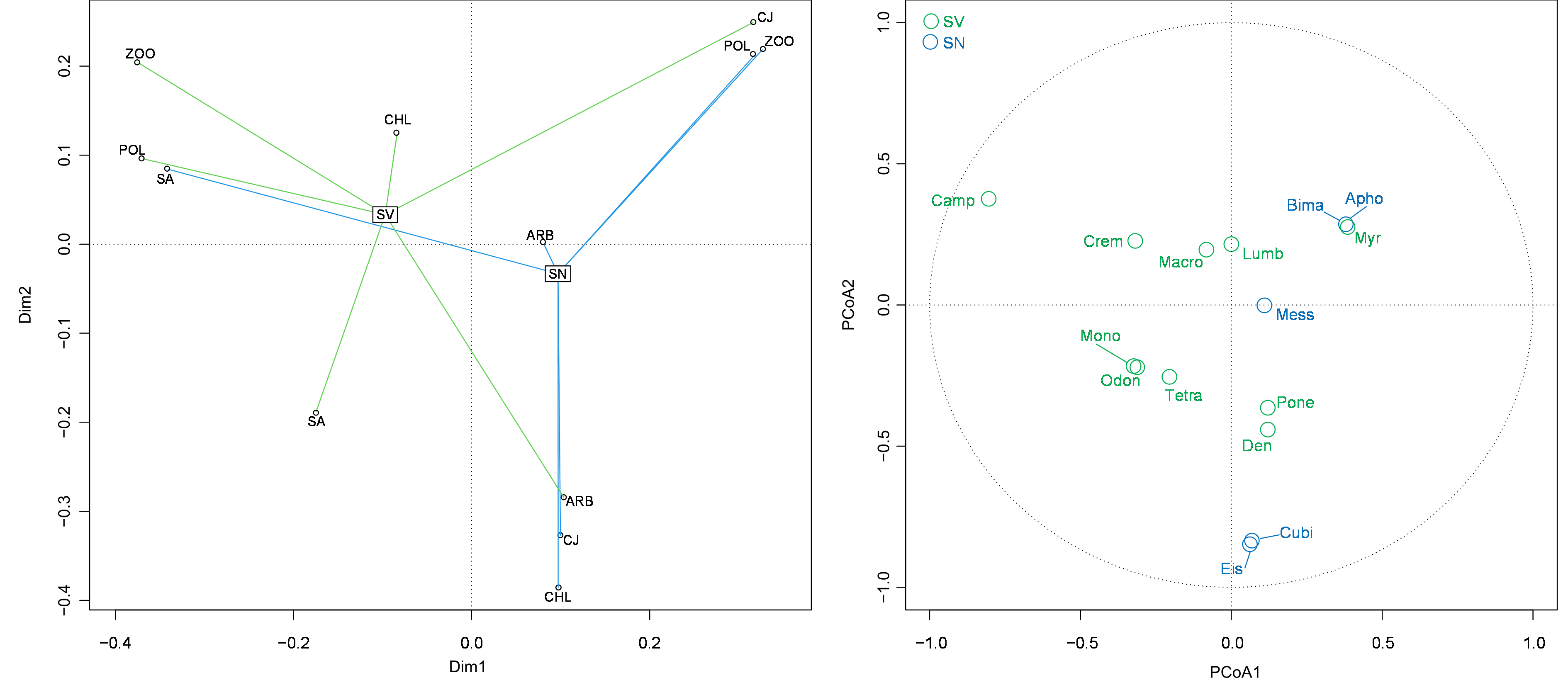
Figure 7. PCoA basé sur la composition spécifique de la MFS : A) Les ordispiders regroupent les espaces verts urbains (ARB : Arboretum de la Faculté des Science Agronomiques, SA : Complexe Safina-Salama, ZOO : jardin Zoologique de Lubumbashi, CHL : Cercle Hippique de Lubumbashi, CJ : Cité des Jeunes, POL : Faculté de Polytechnique) suivant l’occupation des sols (SN : Sol Nu, SV : Sol Végétalisé). B) Cercle de corrélation des espèces de la MFS (corrélation > 0,10 en valeur absolue avec l’un des deux axes de la PcoA)
Camp : Camponotus pennsylvanicum, Crem : Crematogaster scutellaris, Macro : Macrotermes sp., Lumb : Lumbricus sp.; Bima : Bimastos sp., Apho : Aphoenogaster subterranean, Myr : Myrmecina graminicola; Dan : Dandroboena sp., Cubi : Cubitermes sp., Pone : Ponera coarctata, Eise : Eisenia sp.; Tetra : Tetramorium caespitum, Mono : Monomorium propodeum, Odon : Odontermes sp.
Discussion
28La macrofaune du sol dans les espaces verts étudiés est dominée par le groupe de termites en terme d’abondance. Généralement, les termites sont très nombreux, en forêt comme en savane tropicales. Ils participent activement à la disparition des litières végétales (Bachelier, 1973), ce qui peut expliquer leur abondance élevée dans les sols des espaces verts de Lubumbashi dont une partie est constituée de reliquats de la forêt claire.
29Cette étude démontre que l’abondance totale de la macrofaune du sol est influencée par le niveaux de végétalisation des sols des espaces verts de la ville de Lubumbashi. L’abondance totale de la macrofaune du sol dans l’ensemble des sites étudiés est plus élevée dans les sols végétalisés que dans les sols nus. Les études antérieures des communautés de macrofaune du sol ont déjà démontré que les changements du couvert végétal influencent profondément la macrofaune, aussi bien en milieux tropicaux qu'en milieux tempérés (Goldsbrough et al., 2003).
30Cette étude prouve également que la composition taxonomique de la macrofaune du sol varie selon la composition floristique au sein des espaces verts de la ville de Lubumbashi. Cette variation se retrouve aussi bien lorsque l’on considère l’importance relative des trois groupes de macrofaune étudiés, que lorsque l’on examine la variation de la composition au niveau taxonomique du genre. A l’exception d’un site, la composition en genres de la macrofaune des sols végétalisés se différencie des sols non végétalisés par une série de genre qui leur sont liés Lumbrucus sp. et Dendroboena sp. pour le vers de terre ; Macrotermes sp. et Odonthotermes sp. pour les termites ; Camponotus sp., Myrmecina sp.,Tetramorium sp. et Crematogaster sp. pour les fourmis. Pour chaque groupe taxonomique, il existe au moins un genre (ou espèce au sein du genre) capable de se développer dans les milieux perturbés notamment le sol nu dans le milieu urbain. Il s’agit d’Eisenia sp., pour les vers de terre. Les vers de terre du genre Eisenia avec son espèce Eisenia hontensis, qui est une espèce appartenant au groupe des épigés, participe à la décomposition des déchets organiques tels que : les épluchures des fruits et légumes, les résidus de repas cuits et crus, le marc de café, les sachets de thé (dans la mesure où ceux-ci ne sont pas en plastique, ni en nylon, ni en polypropylène). Ils se nourrissent également des déchets carboniques tels que : le papier, le carton, sciure, le coquille de l’œuf. Ainsi, il est logique de trouver ce genre sur le sol nu en milieu urbain où les déchets ménagers sont abondants (Rodriguez-Campos et al., 2014). En ce qui concerne les fourmis, le genre Messor sp. a été retrouvé dans les sols nus. Ces résultats corroborent ceux de Barech (2020) qui a retrouvé ce genre dans le sol à texture sableuse, moyennement salé et pauvre en matière organique. Les fourmis du genre Messor sont pourvues d’un psammophore, qui est un caractère morphologique d’adaptation à la texture sablonneuse souvent rencontré chez certaines fourmis désertiques comme chez Messor arenarius et Messor caviceps (Barech, 2020). Les termites du genre Cubitermes sp. a été retrouvé sur les sols nus. Ceci pourrait s’expliquer par le fait qu’il y a des espèces capables de construire des nids et les autres non. Et donc, c'est possible de le trouver sur les sols nus à la recherche de la matière organique à la surface du sol (Eggleton, 2000).
31Globalement, la quantité de matière organique dans le sol influence l’abondance totale de la macrofaune dans les sites étudiés. Plusieurs auteurs montrent qu'il existe des relations privilégiées entre la litière et la faune du sol (Loranger et al., 2002). L’influence de la matière organique est confirmée en mésocosmes, il a été démontré que l'espèce de plante fournissant une grande quantité de litières influençait positivement le développement de la faune du sol (Frouz et al., 2007).
32Outre l’effet général du niveau de végétalisation sur la macrofaune, de grandes variations sont aussi observées entre les sites étudiés. Il apparait également que l’abondance et la composition de la macrofaune varient fortement d’un site à l’autre. Des conditions spécifiques aux sites peuvent influencer l’effet du couvert végétal sur la macrofaune en relation aux besoins écologique des différents groupes taxonomiques. Un facteur ayant une influence à la fois sur l’abondance et la composition de la macrofaune est la diversité et la composition de la végétation, dont la proportion d’espèces végétales natives/exotiques (Mathieu, 2004). De telles relations ne sont pas mises en évidence avec la caractérisation de la végétation sur les espaces verts de Lubumbashi. Les abondances globales de Macrofaune les plus élevées sont observées dans deux sites présentant une richesse en espèces arborée élevée (ARB : 14 espèces et SA :19 espèces) et un mélange d’espèces natives et exotiques (%individus d’arbres natifs : ARB : 63%, SA : 62%), alors que le site ZOO qui présente également la plus haute richesse spécifique d’arbres (20 espèces) et un mélange native exotique (52% d’arbres natifs) présente une abondance globale de la macrofaune parmi les plus faible. Le même patron est observé pour l’abondance des termites. L’abondance des fourmis ne présente aucun patron lié à la richesse ou à l’indigénat de la flore arborée.
33La forte variation des abondances de la macrofaune du sol d’un site à l’autre, ainsi que la forte variation de la différence d’abondance entre sol végétalisé ou nu selon les sites, devraient être mises en relation avec les besoins écologiques des groupes taxonomiques étudiés et un ensemble d’autres caractéristiques écologiques des sites. La majorité des espèces de fourmis possède la particularité d’habiter dans des nids, ce qui les rapprochent des plantes (López et al., 1994). Afin de nidifier par exemple, les fourmis ont besoin de conditions du sol ou d’abris assez spécifique, ainsi que des ressources alimentaires particulières dans leur environnent (Wu et al., 2010). En plus d’une atmosphère humide, les termites ont besoin de matériaux fins de type argileux pour l’édification de certaines parties de leurs termitières (Bachelier,1973). Leur abondance dépend aussi souvent de l’importance des débris végétaux (Bachelier, 1973). Ainsi il serait utile, à l’avenir, de caractériser des éléments tels que la présence de micro habitats, comme les souches d'arbre ou les cailloux, la structure de la végétation, la profondeur de sol, ou l’humidité (Goldsbrough et al., 2003) afin de mieux comprendre les patrons complexes d’abondance et de composition observés dans les espaces verts de la ville de Lubumbashi.
Conclusion
34Dans cette étude, nous avons montré que la présence des espaces verts urbains contribue à l’amélioration de la qualité biologique du sol. Spécifiquement, la présence de la végétation améliore la fertilité du sol et favorise le développement de la macrofaune. Par contre, la conversion des espaces verts en sol nu conduit à une réduction drastique de l’abondance et la diversité de la macrofaune ainsi que la perte de la fertilité du sol.
35La diversité végétale au sein des espaces et le mode de leur gestion sont des facteurs importants qui influencent la dynamique de la macrofaune au sein des espaces verts. Nous avons trouvé des indications qu’une grande diversité végétale et surtout une dominance des espèces végétales caractéristiques de la forêt claire de Miombo favoriseraient le développement de la macrofaune à cause de leur apport important en litière.
36Les différents groupes taxonomiques de la macrofaune diffèrent quant à la leur capacité à proliférer dans le sol nu en comparaison avec le sol végétalisé. Nous avons trouvé que les termites sont les plus abondants alors que les vers terre sont les moins abondants. L’abondance de la macrofaune est fortement corrélée à la matière organique.
37Au regard de nos résultats, les espaces verts urbains de Lubumbashi devraient être préservés et réhabilités vu différents services écosystémiques qu’ils peuvent rendre notamment l’amélioration des conditions édaphiques à travers les activités de la macrofaune (termites, fourmis, vers, etc.).
Remerciements
38Cette étude a été réalisée dans le cadre du projet ZORGLUB financé par l’ARES-CDD. Nous remercions l’Académie de recherche et d’Enseignement Supérieur (ARES-CCD) pour ses appuis financiers. Nos remerciements s’adressent au Professeur Gilles Colinet, coordinateur nord et au Professeur Ngoy Shutcha Mylor, coordinateur sud du projet ZORGLUB.
Bibliographie
Anderson P. M., Okereke C., Rudd A., & Parnell S., 2013. Regional assessment of Africa. In Urbanization, biodiversity, and ecosystem services: Challenges and opportunities (pp. 453-459). Springer, Dordrecht.
Bachelier G., 1973. Faune des sols et termites. Les sols ferralitiques, 107-142.
Barech G., Khaldi M., Espadaler X., & Cagniant H., 2020. Révision taxonomique du genre Messor (Hymenoptera, Formicidae) au Maghreb et description de Messor hodnii sp. n., une nouvelle espèce de fourmi trouvée en Algérie. Revue suisse de Zoologie, 127(1), 9-19.
Bignell D. E. 2009. Towards a universal sampling protocol for soil biotas in the humid tropics. Pesquisa Agropecuária Brasileira, 44, 825-834.
Bouillon A. & Mathot G., 1965. Quel est ce termite africain ? « Zooleo n°1 », 1-115. Editions de l’Université de Léopoldville.
Chotte J. L. et al., 2001. Jachère et biologie du sol en Afrique tropicale. Floret C. et Pontanier R., La jachère en Afrique tropicale, 2, 85-122.
Decaëns T. et al., 2006. The values of soil animals for conservation biology. European Journal of Soil Biology, 42, S23-S38.
Eggleton P., 2000. Global diversity patterns. In: Abe T, Bignell D.E. & Higashi M., eds. Termites: Evolution, sociality, symbiosis, ecology. Kluwer, Academic Publishers, 25-51.
Ferreira C. S., Walsh R.P & Ferreira A.J., 2018. Degradation in urban areas. Current Opinion in Environmental Science & Health, 5, 19-25.
Frouz J. et al., 2007. The effect of litter quality and soil faunal composition on organic matter dynamics in post-mining soil: a laboratory study. Applied soil ecology, 37(1-2), 72-80.
Goldsbrough C. L., Hochuli D. F., & Shine R., 2003. Invertebrate biodiversity under hot rocks: habitat use by the fauna of sandstone outcrops in the Sydney region. Biological Conservation ,109 :85-93.
Guilland C., Maron P. A., Damas O. & Ranjard L., 2018. La biodiversité des sols urbains au service des villes durables. Etude et Gestion des Sols, 25, 59-77.
Hooper D. U. et al., 2005. Effects of biodiversity on ecosystem functioning: a consensus of current knowledge. Ecological monographs, 75(1), 3-35.
Joimel S., 2015. Biodiversité et caractéristiques physico-chimiques des sols de jardins associatifs urbains français. Thèse de doctorat : Université de Lorraine.
López F., Serrano J. M., & Acosta F. J., 1994. Parallels between the foraging strategies of ants and plants. Trends in ecology & evolution, 9(4), 150-153.
Loranger G., Ponge J.-F., Imbert D., & Lavelle P., 2002. Leaf decomposition in two semi-evergreen tropical forests: influence of litter quality. Biology and Fertility of Soils 35:247-252.
Malaisse, F., 2010. How to live and survive in Zambezian open forest (Miombo ecoregion). Presses agronomiques de Gembloux.
Mathieu J., 2004. Etude de la macrofaune du sol dans une zone de déforestation en Amazonie du sud-est, au Brésil, dans le contexte de l'agriculture familiale. Thèse de doctorat : Université Pierre et Marie Curie.
McKinney M.L., 2008. Effects of urbanization on species richness: a review of plants and animals. Urban ecosystems, 11(2), 161-176.
Mougin C. et al., 2017. KITSOL : un kit d’analyse du sol au service des écosystèmes vivants. In : Journées annuelles 2017 du LabEX BASC (p. np).
Mujinya B.B. et al., 2011. The origin of carbonates in termite mounds of the Lubumbashi area, D.R. Congo. Geoderma 165, 95–105.
Ngongo M.L. et al., 2009. Guide des Sols en République Démocratique du Congo, Tome I: Etude et Gestion. Don Bosco, Lubumbashi.
Observatoire participative des vers de terre (OPVT), 2014. Clé d’identification de lombriciens en 4 0groupes fonctionnels. Université of Rennes 1/CNRS. OSUR. UMR Ecobio.
Passera L.& Aaron S., 2005. Les fourmis : comportement, organisation sociale et évolution. NRC Research Press.
Pey B. et al., 2013. Structure of earthworm burrows related to organic matter of a constructed Technosol. Geoderma, 202, 103-111.
Rodriguez-Campos J., Dendooven L., Alvarez-Bernal D. & Contreras-Ramos S. M., 2014. Potential of earthworms to accelerate removal of organic contaminants from soil: a review. Applied Soil Ecology, 79, 10-25.
Tresch S., 2019. Impacts of urban gardening on soil quality, soil fauna and soil multifunctionality. Thèse de doctorat : Université de Neuchâtel.
UNDESA, 2016. The world’s cities in 2016. Data Booklet (ST/ESA/SER.A/352). https://www.google.com/search?q=UNDESA%2C+2016.+The+world%E2%80%99s+cities+in+2016.+Data+Booklet+(ST%2FESA%2FSER.A%2F352).&rlz=1C1JZAP_frBE1039BE1040&oq=UNDESA%2C+2016.+The+world%E2%80%99s+cities+in+2016.+Data+Booklet+(ST%2FESA%2FSER.A%2F352).&aqs=chrome..69i57j69i60.1017j0j15&sourceid=chrome&ie=UTF-8, (13/04/2023).
Useni S. Y et al ., 2014. Effets de la date de semis et des écartements sur la croissance et le rendement du niébé (Vigna unguiculata L. Walp) à Lubumbashi, RD Congo [Effects of planting dates and spacing on growth and yield of cowpea (Vigna unguiculata L. Walp) in Lubumbashi, DR Congo]. International Journal of Innovation and Applied Studies, 6(1), 40.
Useni S. Y et al ., 2018. Changes in the spatial pattern and ecological functionalities of green spaces in Lubumbashi (the Democratic Republic of Congo) in relation with the degree of urbanization. Tropical Conservation Science, 11, 1940082918771325.
Useni S. Y. et al., 2019. Treediversity and structure on green space of urban and peri-urban zones: the case of Lubumbashi City in the Democratic Republic of Congo. Urban Forestry & Urban Greening, 41: 67-74.
Wu H., Wu D., Lu X. & Yin X., 2010. Spatial distribution of ant mounds and effects on soil physical properties in wetlands of the Sanjiang plain, China. Acta Ecologica Sinica, 30(5), 270-275.
Zirbes L. et al., 2009. Mise en relation de la diversité des vers de terre et des caractéristiques du sol de Thua Thien Hue (Centre Vietnam). Tropical Conservation Science, 2(3), 28.
Om dit artikel te citeren:
Over : Mashagiro Grace Queen*
Université de Liège, Gembloux Agro-Bio Tech, Unité Biodiversité et Paysage, 5030 Gembloux, Belgique.
Université de Lubumbashi, Faculté des Sciences Agronomiques, 1825 Lubumbashi, République Démocratique du Congo (RDC), gracemashagiro1@gmail.com
Over : Basile Mujinyanya Bazirake
Université de Lubumbashi, Unité Biogéochimie Ecologie des Sols et des Ecosystèmes Tropicaux, Faculté des Sciences Agronomiques, 1825 Lubumbashi, RDC
Over : Lucie Rivière
Université de Liège, Gembloux Agro-Bio Tech, Unité Biodiversité et Paysage, 5030 Gembloux, Belgique
Over : Grégory Mahy
Université de Liège, Gembloux Agro Bio-Tech, 5030 Gembloux, Belgique