- Accueil
- Volume 37 (2019)
- Numéro 2
- Incubation et éclosion des œufs de la crevette géante d’eau douce Macrobrachium vollenhovenii (Herklots, 1857) en captivité
Visualisation(s): 5639 (22 ULiège)
Téléchargement(s): 0 (0 ULiège)
Incubation et éclosion des œufs de la crevette géante d’eau douce Macrobrachium vollenhovenii (Herklots, 1857) en captivité

Notes de la rédaction
Réçu le 16.10.17 et accepté pour publication le 20.03.18
Résumé
La présente étude avait pour objectif de créer un environnement favorable à l’incubation et l’éclosion des œufs et de mesurer les variables qui déterminent les conditions optimales de reproduction. Un dispositif comprenant 20 bacs plastiques de 0,26 m3 disposés en 4 blocs a été mis en place sous écloserie. Chaque bac contenait 20 litres d’eau et un morceau de tuyau PVC, de 30 cm de hauteur et de 7,5 cm de diamètre, le tout étant couvert par un grillage anti-moustique. Dans chaque bac une femelle, grainée de poids moyen 23,32 ± 6,71 g portant des œufs de couleur tendant vers le marron, a été introduite. Au bout de 11 à 18 jours d’incubation, les œufs portés par les femelles ont éclos. Les paramètres physico-chimiques du milieu d’élevage présentaient des valeurs de 4,8 mg/L pour l’oxygène dissous; 7,61 pour le pH ; 26,7°C pour la température et 4‰ pour la salinité. Le taux d’éclosion a varié de 57% à 96%. Une observation à la loupe montrait des larves très translucides composées en partie d’individus sessiles se déplaçant sur le dos et d’individus se déplaçant sur de petites pattes ou sur des ébauches de pattes.
Abstract
Incubation and Hatching of Eggs of Giant Freshwater Shrimp Macrobrachium vollenhovenii (Herklots, 1857) in Captivity
The present study aimed to create an enabling environment for incubation and egg hatching and to measure the variables that determine optimum reproductive conditions. An experimental device comprising 20 plastic bins of 0.26 m3 arranged in 4 blocks was placed under hatchery. Each bin contained 20 liters of water and a piece of PVC pipe 30 cm high and 7.5 cm in diameter, all covered by a mosquito net. In each tray, a seeded female of average weight 23.32 ± 6.71 g carrying colored eggs tending to brown, was introduced. After 11 to 18 days of incubation, the eggs carried by the females hatched. The physico-chemical parameters of the culture medium were 4.8 mg/L for dissolved oxygen; 7.61 for pH, 26.7°C for the temperature and 4 ‰ for salinity. The hatching rate varied from 57% to 96%. An observation with a magnifying glass showed very translucent larvae composed partly of sessile individuals moving on their backs and individuals moving on small paws or rough paws.
Table des matières
1
Introduction
2Macrobrachium vollenhovenii est un crustacé décapode de la famille des Palaemonidae (27). Il figure parmi les crevettes géantes d’eaux douces africaines (28). Il est rencontré dans les eaux continentales telles que les fleuves, les rivières et les lagunes. Au Bénin, les populations riveraines des vallées du sud ont développé pendant la période des crues (juillet à novembre) diverses techniques pour la cueillette (33). A chaque saison des crues, les géniteurs envahissent les eaux saumâtres des lagunes pour se reproduire et remontent dès la fin de la saison (47, 48). La femelle porte plusieurs milliers d’œufs qui à l’éclosion libèrent des milliers de larves planctoniques en milieu naturel (25, 32). La masse corporelle et la forte fécondité de M. vollenhovenii sont en faveur de son élevage (18). L’espèce exotique Macrobrachium rosenbergii présente des caractéristiques similaires à M. vollenhovenii.
3Depuis une vingtaine d’années, les nombreux travaux de recherche ont permis la maîtrise totale de l’élevage de M. rosenbergii et de développer une politique de la production industrielle de cette espèce en Asie. Cependant tout comme en Asie, de hautes technologies ont été développées en Europe et en Amérique pour l’élevage des crevettes. Ces technologies se résument à l’induction artificielle de la maturation des gonades, à l’utilisation des hormones de croissance et des granulés hormonés, à l’élevage en masse des post-larves et à la construction des écloseries spécialisées pour la production intensive ou semi-intensive des crevettes (15).
4En Afrique, des études similaires ont timidement démarré sur l’espèce indigène M. vollenhovenii au Sénégal, au Nigéria, au Cameroun et en Côte d’Ivoire. Ces études demeurent encore à leur phase expérimentale (8).
5Au Bénin, les travaux récents de recherche ont abordé la caractérisation de l’habitat naturel, la survie des géniteurs et la croissance des juvéniles et des post-larves sauvages en captivité (12, 13). Les études sur la reproduction sont encore peu abordées au Bénin du fait du manque d’équipements adaptés et de la non maîtrise totale des techniques de reproduction. Dans le processus de domestication de Macrobrachium, la production des larves et de leur survie en captivité est une phase qui requiert beaucoup d’attention et d’application. Elle est subdivisée en deux sous phases : l’incubation et l’éclosion des œufs d’une part et la survie des larves d’autre part. La présente étude se propose de mettre en place des techniques simples et reproductibles pour réaliser l’incubation des œufs et l’éclosion des larves en captivité.
Matériel et méthodes
Acclimatation des géniteurs et couplage
6Les géniteurs de M. vollenhovenii ont été pêchés au moyen d’une nasse dans la lagune de Grand Popo dans les villages riverains de Hêvè et de Onkhouihoué dans le département du Mono au sud-Bénin (Figure 1). Ils sont transportés au Centre de Formation et de Recherche en Hydrobiologie et Aquaculture du Laboratoire d’Hydrobiologie et d’expérimentation en Aquaculture (CeFRHA/LHA) à l’aide des sacs plastiques transparents remplis d’eau au 1/3 et d’oxygène au 2/3 du volume. Cent vingt (120) géniteurs de M. vollenhovenii répartis en deux lots de soixante (60) individus mâles et femelles (ratio 1/2) ont été libérés dans deux bassins de 4 m3 remplis d’eau jusqu’à 30 cm de hauteur et protégés à moitié par des claies. Les bassins sont équipés de tuyaux d’entrée d’eau et d’air et de tuyau de sortie d’eau usée. L’eau des bassins provient d’un forage et est stockée et aérée durant cinq (5) jours au bout des desquels elle atteint un niveau de fertilisation et de pH acceptable. Les géniteurs sont nourris tous les deux jours à 3% de leur biomasse. L’aliment utilisé est un mélange de granulés fabriqués localement et de granulés achetés dans le commerce. Les paramètres de l’eau sont mesurés (pH, Oxygène, ions ammoniacaux) quotidiennement. L’eau est diluée par renouvellement lent tous les deux jours pour stabiliser le pH et réduire la concentration des ions ammoniacaux. La valeur moyenne du pH avoisine 8,06 ± 1,5 ; de l’oxygène dissous 4,73 ± 0,57 mg/L et de la température de l’eau 26,7 ± 1,0 °C. Les mortalités sont contrôlées et les cadavres enlevés chaque matin. S’il y a beaucoup d’accumulation de déchets au fond de l’eau, les crevettes sont transférées vers un nouveau bassin dont l’eau a été préalablement conditionnée. Le tuyau d’aération est soulevé chaque matin pour arrêter les mouvements de l’eau et identifier de profil les femelles grainées. Si la turbidité de l’eau est élevée rendant impossible la vue des femelles, quelques femelles sont pêchées au moyen d’une épuisette afin d’observer leur état de maturité.
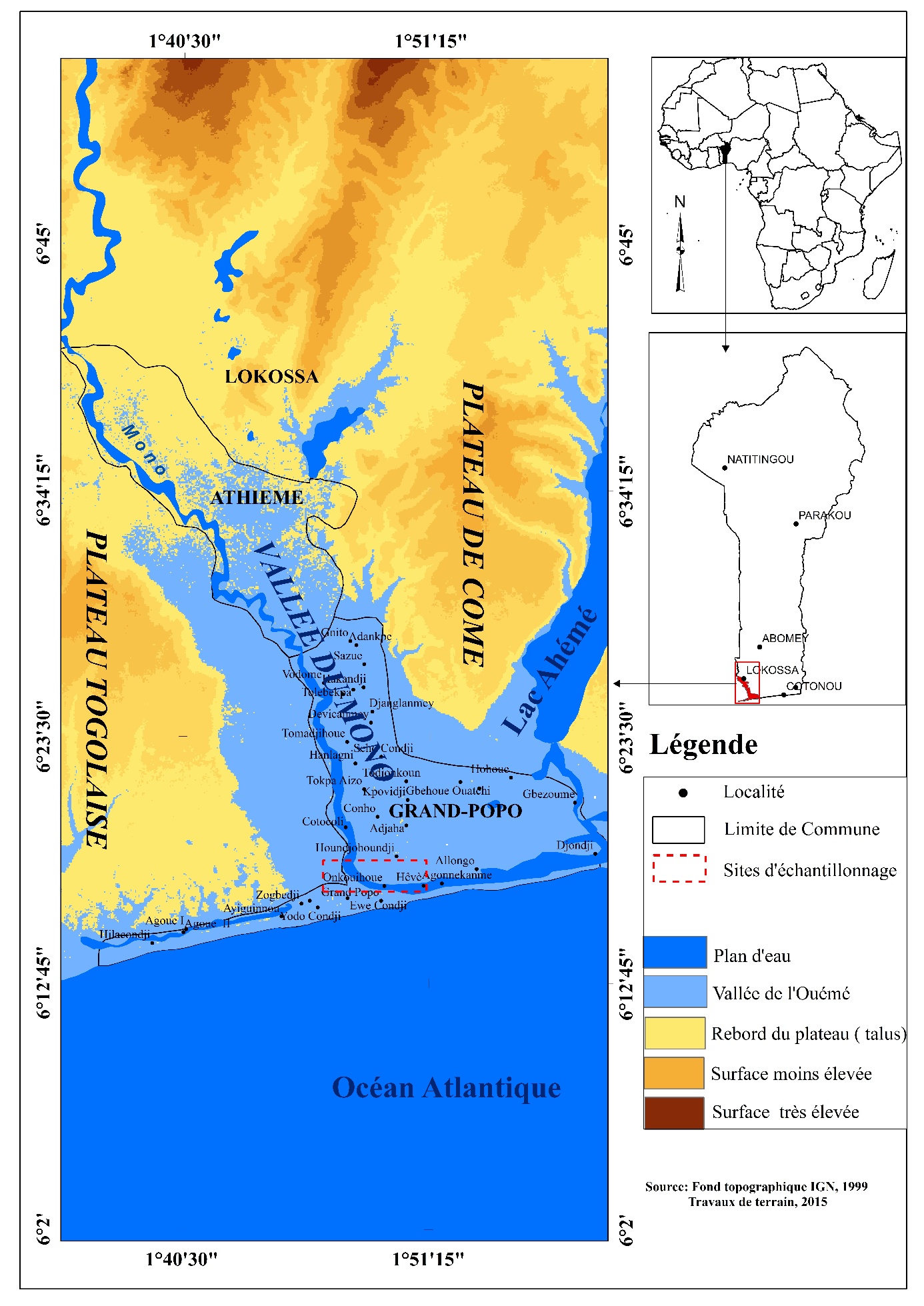
Figure 1 : Carte de la zone de collecte des géniteurs de crevette M. vollenhovenii
Dispositif expérimental
7Le dispositif expérimental (Figure 2) est constitué de quatre blocs (04) correspondant aux trois facteurs à tester : salinité, substrat, luminosité. Le premier bloc constitué par une gamme de salinité comprenait quatre modalités correspondant aux salinités 6‰, 9‰, 12‰ et 15‰ suivant une suite arithmétique de premier terme 6 et de raison 3. Le deuxième bloc est constitué de deux modalités, il s’agit de l’eau salée à 5‰ et de l’eau douce. Le troisième bloc est constitué du deuxième bloc auquel on a ajouté le facteur substrat qui n’est rien d’autre que du sable marin ayant couvert le fond des bacs. Le quatrième bloc est constitué du troisième auquel on a ajouté le facteur luminosité en protégeant les bacs de la lumière au moyen de sachets noirs. Dans chaque bloc, les traitements sont répétés deux fois. Au total vingt bacs plastiques de volume 0,26 m3 contenant chacun 20 litres d’eau sont utilisés. Tous les bacs sont couverts de grillage anti-moustique afin d’éviter la contamination de l’eau par des larves de moustique et la sortie des géniteurs des bacs pendant la nuit où leur activité est plus marquée. Chaque bac contient un morceau de tuyau PVC servant de cache pour les femelles grainées. Un compresseur d’air alimente en oxygène tous les bacs par l’intermédiaire d’un système de tuyauterie. Les bacs sont disposés à l’intérieur de l’écloserie sur des supports en bois.
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
15‰ |
12‰ |
9‰ |
6‰ |
5‰ |
Eau douce |
Eau douce + substrat |
5‰ + substrat |
Eau douce + substrat sans lumière |
5‰ + substrat sans lumière |
|
15‰ |
12‰ |
9‰ |
6‰ |
5‰ |
Eau douce |
Eau douce + substrat |
5‰ + substrat |
Eau douce + substrat sans lumière |
5‰ + substrat sans lumière |
|
20 |
19 |
18 |
17 |
16 |
15 |
14 |
13 |
12 |
11 |
Figure 2 : Dispositif expérimental des bacs d’incubation et d’éclosion des œufs de Macrobrachium vollenhovenii
Mise en charge des femelles grainées
8Des femelles actives et intactes portant des œufs de couleur tendant vers le marron ont été sélectionnées dans les bassins de géniteurs et sont pesées à l’aide d’une balance électronique (LUTRON GM-300P, portée 300 g, précision 10-2 g). Un échantillon d’œufs de 0,05 à 0,07 g a été prélevé avant leur transfert dans les bacs d’incubation. Chaque bac plastique a reçu une femelle qui est suivie pendant toute la période d’incubation des œufs.
9Suivi de l’incubation et de l’éclosion des œufs à l’écloserie
10Les granulés utilisés pour nourrir les crevettes sont préparés au laboratoire à partir des sous-produits locaux. Le rationnement est réparti tous les deux jours et l’aliment est distribué à chaque femelle par pincette. Les déchets sont siphonnés avant la distribution d’une nouvelle ration. L’eau des bacs est renouvelée tous les deux jours au 1/3 du volume tôt le matin à 8h. Les œufs sont observés chaque matin et chaque soir à travers les parois transparentes des bacs d’incubation.
Collecte des données physico-chimiques
11Le contrôle de la qualité de l’eau a consisté à la prise des caractéristiques physico-chimiques à l’aide d’un oxy-thermomètre (VOLTCRAFT DO-1OO) et d’un pH-mètre portable (ATC, précision 10-2). Les paramètres mesurés sont : la température de l’eau (Temp), l’oxygène dissous (O2), le potentiel d’Hydrogène (pH) et la concentration des ions azotés. La prise des paramètres tels que pH, oxygène dissous et température a été effectuée in situ tous les deux jours et deux fois par jour, soit matin et soir (7h et 18h) selon Griessinger et al. (15). Un échantillon d’eau des 20 bacs a été prélevé dans des bouteilles en plastique et transféré au laboratoire pour être analysé. Le dosage des ions azotés a été fait tous les 3 jours au laboratoire à l’aide du spectrophotomètre HACH (DR/2010) (14, 17). Il s’agit de l’ammonium (NH4-N), du nitrite (NO2-N) et du nitrate (NO3-N).
Collecte des données biologiques
-
Les poids des 20 femelles grainées ont été enregistrés. Les femelles gaies (femelles ayant libéré les œufs) sont pesées à nouveau dès la libération des larves et leurs poids sont à nouveau enregistrés.
-
Les œufs prélevés ont été comptés et les diamètres sont mesurés à l’aide du logiciel VistaMétrix 1.36.
-
A l’éclosion, l’eau de chaque bac a été brassée pour être homogénéisée légèrement et 10 ml d’eau ont été prélevés dans 10 piluliers soit au total 100 ml d’eau contenant en suspension des larves. Quelques gouttes de formol 5‰ ont été ajoutées aux piluliers. Dans chaque pilulier le nombre de larves a été compté.
-
Un échantillon de larves a été observé au microscope (NIKON, ECLIPSE E100) et quelques larves ont été photographiées afin de décrire leur morphologie et leur mouvement.
Analyse des données
12Les données collectées ont été encodées dans le tableur Excel (Excel 2013.Ink). Pour mesurer les variations des paramètres physico-chimiques de l’eau pendant l’incubation des œufs et pendant la phase larvaire, une série de méthodes a été utilisée. Il s’agit des tableaux regroupant les valeurs des paramètres physico-chimiques et biologiques des milieux d’élevage et du graphe. Le test de Levene (23) ou de Brown et Forsythe (4) a été utilisé pour tester l’homogénéité des variables issues des paramètres physico-chimiques et des variables biotiques correspondant aux différents bacs.
13Les moyennes sont comparées au seuil de 5%. Pour cela, l’analyse de variance à un critère de classification (ANOVA 1) (9, 42) et le LSD (Least significant Difference) de Fisher (41) ont été utilisés. Les histogrammes de fréquence et les tests statistiques ont été réalisés avec les logiciels StatView (SAS Institute, version 5.0.1).
14Afin d’étudier les paramètres de fécondité et d’éclosion, différentes expressions mathématiques ont été utilisées, elles sont les suivantes :
151°) La fécondité absolue (FA) est le nombre total des œufs portés par une femelle ovigère.
-
FA = N × PW/ P0 avec N = nombre d’œufs dans la fraction P0 en gramme (g) ; PW le poids total des œufs en g.
-
PW = PFG – Pgai avec PFG le poids en gramme (g) de la femelle grainée, PGai le poids en gramme (g) de la femelle gaie (femelle ayant libéré les œufs).
162°) La fécondité relative (FR) est le nombre d’œufs par unité de poids corporel.
-
FR = FA × 1/ Pt avec FA la fécondité absolue, Pt le poids corporel en gramme (g).
173°) Le nombre de larves écloses (NLE) est le nombre de larves en suspension dans l’eau.
-
NLE = V x n/100 ml avec V le volume en millilitre (ml) d’eau dans le bac, n le nombre de larves comptées dans 100 ml.
184°) Le taux d’éclosion des œufs (TEO) est la valeur en pourcentage du nombre de larves écloses (NLE) rapportée à la fécondité absolue (FA).
-
TEO = NLE/FA x 100
195°) Le taux d’éclosion relatif (TER) est la valeur en pourcentage du nombre de larves apparues après l’éclosion des œufs (NLE) rapportée au poids corporel Pt en gramme (g).
-
TER = NLE/Pt x 100
Résultats
Mue et accouplement des crevettes
20La mue est un phénomène qui prépare la crevette femelle à une phase d’accouplement et de fécondation des œufs. La mue (ou ecdysie) se manifeste par la dissolution progressive de l’ancienne carapace et la récupération de certains de ses éléments de manière à la libérer des tissus sous-jacents et à la rendre suffisamment fine pour être libérée. Après la mue, les crevettes sont particulièrement vulnérables aux substances toxiques, au manque d’oxygène et aux prédateurs. Sans l’exuvie (la carapace), les crevettes restent généralement cachées en attendant que leur carapace ait durci. La vieille carapace vide dénommée exuvie est abandonnée dans les bassins de stockage des géniteurs. Un peu avant l’accouplement, la femelle subit une mue (figure 3a). Un mâle dominant, après quelques mouvements de parade, tourne la femelle sur le dos et dépose un spermatophore à l’orifice génital femelle situé à la base de la 3è paire de péréiopodes (Figure 3a). Les ovules sont ainsi fécondés au fur et à mesure de leur ponte et sont dirigés vers la base de l’abdomen de la femelle pour former des œufs de couleur jaune orangé (Figure 3b). L’incubation des œufs donne des larves (Figure 3c et 3d).

Figure 3 : Succession de quelques événements biologiques avant l’éclosion des œufs de Macrobrachium vollenhovenii (observation réalisée au Microscope optique)
Aspect des œufs et comportement du géniteur au cours de l’incubation
21La figure 4 présente la distribution des diamètres des œufs. Celle-ci est uni modale et les œufs les plus fréquents du lot ont un diamètre de 0,45 mm. Les valeurs moyennes des diamètres des œufs sont situées entre 0,3 et 0,7 mm. Les femelles introduites dans les bacs au départ présentaient des œufs de couleur jaune orangé comme indiqué au niveau de la figure 5a. Cette coloration a évolué vers la couleur marron à la phase d’éclosion (Figure 5b) au niveau des bacs numérotés 6 ; 12 ; 15 ; 9 ; 14 et 7.
22Les femelles grainées battent sans cesse leurs pléopodes pour aérer les œufs au niveau de leur abdomen et les débarrasser des déchets. Elles sont plus actives la nuit que le jour où elles passent une bonne partie de leur temps dans les tuyaux PVC qui jouent le rôle de cache.
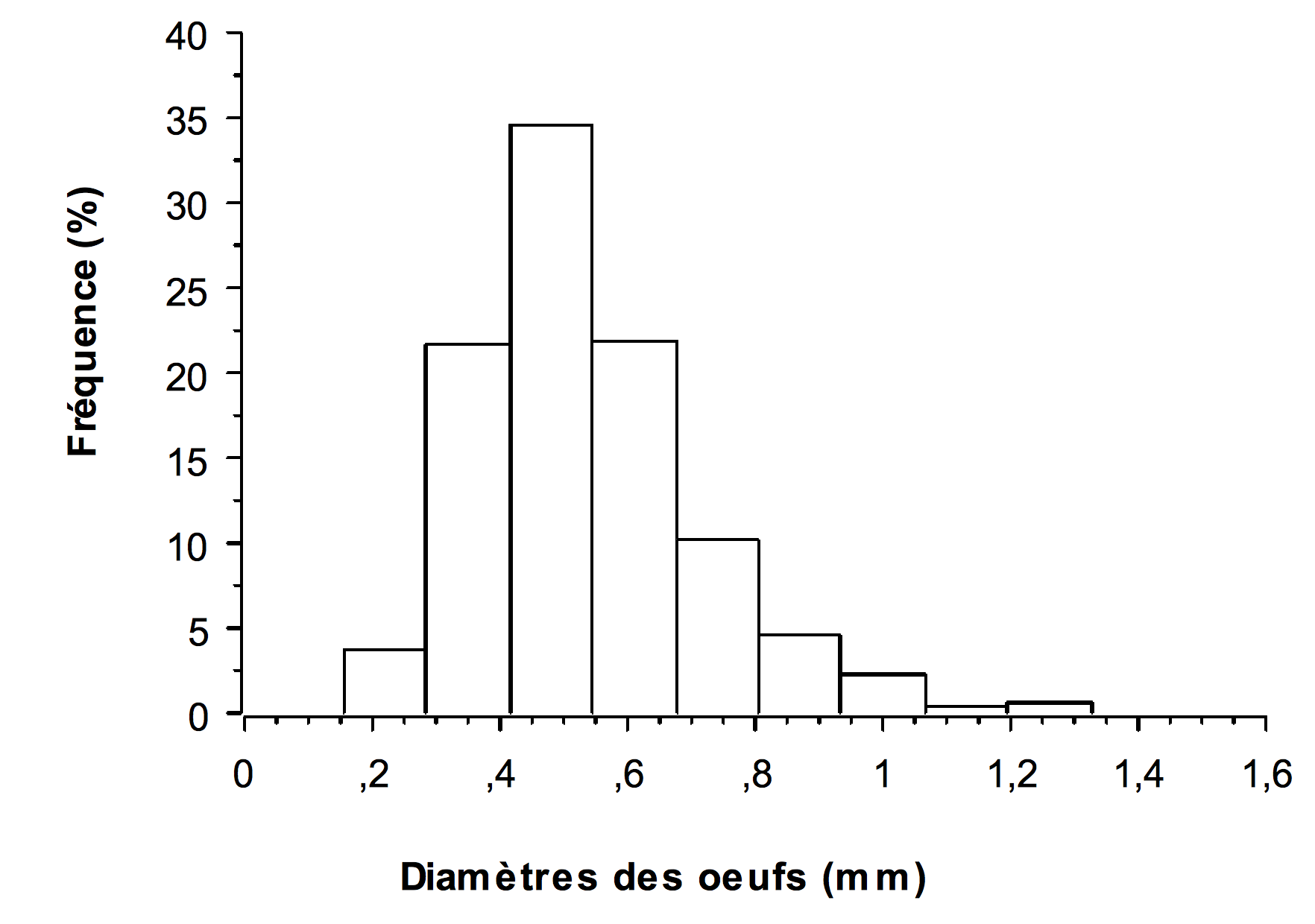
Figure 4 : Distribution des diamètres des œufs de Macrobrachium vollenhovenii mis en incubation.

Figure 5 : Aspect extérieur des œufs de Macrobrachium vollenhovenii (a = en début d’incubation, b = à l’éclosion).
Paramètres physico-chimiques
Salinité, substrat et luminosité
23Les valeurs des salinités utilisées dans cette expérimentation varient de 4‰ à 15‰ (Tableau 1). Il faut remarquer que seuls les bacs contenant de l’eau douce (salinité 4‰) avec ou sans substrat et lumière offrent les meilleures conditions d’incubation et d’éclosion. L’incubation et l’éclosion des œufs dans les milieux de salinité supérieure ou égale à 5‰ sont restées sans succès (Figure 2). L’éclosion des œufs ayant commencé généralement la nuit, se poursuivi et s’est étalée sur une durée de 24 h en eau douce Tableau 2). Pour ce qui concerne le substrat et la luminosité (Figure 2), ils n’ont pas constitué des facteurs limitants pour les dupliquas 7 et 9 (Figure 2).
Tableau 1 : Moyenne des paramètres physico-chimiques dans les bacs d’incubation pour M. vollenhovenii
|
N° Dupliqua (N° Bacs) |
O2 (mg/L) |
pH |
Temp (°C) |
NH4-N (mg/L) |
NO2-N (mg/L) |
NO3-N (mg/L) |
Salinité (‰) |
|
1 (1 et 20) |
4,5 ± 0,53 |
7,6 ± 0,28 |
26,9 ± 0,58 |
0,001 ± 0,0 |
0,001 ± 0,2 |
0,00 ± 0,0 |
15 |
|
2 (2 et 19) |
4,45 ± 0,44 |
7,57 ± 0,21 |
26,94 ± 0,67 |
0,00 ± 0,1 |
0,001 ± 0,1 |
0,00 ± 0,1 |
12 |
|
3 (3 et 18) |
4,36 ± 0,41 |
7,52 ± 0,29 |
26,85 ± 0,69 |
0,002 ± 0,2 |
0,001 ± 0,1 |
0,01 ± 0,1 |
9 |
|
4 (4 et 17) |
4,38 ± 0,44 |
7,5 ± 0,26 |
26,85 ± 0,71 |
0,001 ± 0,2 |
0,00 ± 0,1 |
0,001 ± 0,1 |
6 |
|
5 (5 et 16) |
4,38 ± 0,39 |
7,37 ± 0,35 |
26,72 ± 0,75 |
0,001 ± 0,1 |
0,00 ± 0,0 |
0,001 ± 0,2 |
5 |
|
6 (6 et 15) |
4,29 ± 0,21 |
7,56 ± 0,31 |
26,64 ± 0,79 |
0,0 ± 0,2 |
0,001 ± 0,1 |
0,002 ± 0,1 |
4 |
|
7 (7 et 14) |
4,27 ± 0,45 |
7,43 ± 0,30 |
26,56 ± 0,75 |
0,00 ± 0,1 |
0,00 ± 0,0 |
0,00 ± 0,1 |
4 |
|
8 (8 et 13) |
4,30 ± 0,43 |
7,44 ± 0,26 |
26,65 ± 0,74 |
0,003 ± 0,2 |
0,001 ± 0,2 |
0,001 ± 0,1 |
5 |
|
9 (9 et 12) |
4, 41 ± 0,34 |
7,6 ± 0,16 |
26,7 ± 0,71 |
0,00 ± 0,1 |
0,001 ± 0,1 |
0,00 ± 0,1 |
4 |
|
10 (10 et 11) |
4,29 ± 0,42 |
7,42 ± 0,27 |
26,60 ± 0,69 |
0,01 ± 0,2 |
0,001 ± 0,1 |
0,001 ± 0,1 |
5 |
O2 = Oxygène ; pH = Potentiel d’Hydrogène ; Temp = Température ; NH4-N = Ion ammonium ; NO2-N = Ion nitrite ; NO3-N = Ion nitrate
O2 = Oxygen; pH = potential of Hydrogen; Temp = Temperature; NH4-N = ammonium ion; NO2-N = nitrite ion; NO3-N = nitrate ion
Oxygène, température, pH
24Les valeurs des paramètres physico-chimiques de l’eau d’élevage sont présentées dans le tableau 1. De façon générale, l’oxygène dissous présente des moyennes qui oscillent entre 4,27 ± 0,45 à 4,50 ± 0,53 mg/L. Le pH oscille entre 7,37 ± 0,35 et 7,60 ± 0,28 tandis que la température s’abaisse jusqu’à 26,56 °C et remonte à 26,94°C au maximum pour tous les bacs. Une analyse de variance (Anova, P > 5%) entre ces différentes valeurs n’a montré aucune différence significative d’un bac à un autre. En ce qui concerne les concentrations des ions dérivés de l’azote, elles varient entre 0,001 ± 0,2 mg/L à 0,01 ± 0,1 mg/L. Au bout de 11 à 18 jours d’incubation (Tableau 2), seules les femelles des bacs 6 (eau douce), 12 (eau douce plus substrat sans lumière), 15 (eau douce), 9 (eau douce plus substrat sans lumière), 14 (eau douce plus substrat), 7 (eau douce plus substrat) ont donné successivement des larves dans les conditions ainsi décrites pour ces milieux d’élevage.
25A l’éclosion, des précisions ont été davantage portées sur les conditions réelles de l’eau des bacs en présence des larves. Le tableau 2 présente à l’éclosion les valeurs de l’oxygène, du pH et de la température qui sont respectivement de 4,75 à 4,8 mg/L ; 6,83 à 7,61 et de 26,2 à 26,7°C. Une comparaison de ces valeurs avec celles obtenues avant l’éclosion a montré que les conditions à l’éclosion dans les bacs ne diffèrent pas significativement de celles à l’incubation (Anova, P > 5%).
Tableau 2 : Moyenne des paramètres physico-chimiques à l’éclosion des œufs de M. vollenhovenii
|
N° Dupliqua (N° Bacs) |
Date |
Moment |
Durée d’incubation (j) |
Durée d’éclosion (h) |
O2 (mg/L) |
pH |
Temp (°C) |
|
|
6 (6 et 15) |
10 et 11 Sept 16 |
nuit |
11 à 12 |
24 |
4,8 ± 0 |
6,83 ± 0,53 |
26,2 ± 0,42 |
|
|
7 (7 et 14) |
12 et 17 Sept 16 |
nuit |
13 à 18 |
24 |
4,75 ± 0,21 |
7,61 ± 0,01 |
26,6 ± 0,21 |
|
|
9 (9 et 12) |
10 et 12 Sept 16 |
nuit |
11 à 13 |
24 |
4,75 ± 0,07 |
7,51 ± 0,33 |
26,7 ± 0,28 |
O2 = Oxygène ; pH = Potentiel d’Hydrogène ; Temp = Température ; j = jour ; h = heure
Paramètres d’appréciation de l’éclosion
26De façon générale, les femelles grainées utilisées ont un poids moyen de 23,32 ± 6,71 g (Tableau 3). Les poids varient entre 20 et 27 g pour les femelles ayant donné des larves. Les six bacs d’éclosion correspondent à ceux contenant de l’eau douce (avec ou sans substrat, avec ou sans lumière). La fécondité absolue varie entre 38766 et 75767 œufs. Les taux d’éclosion sont compris entre 50% et 96%. Les plus forts taux d’éclosion sont réalisés par les femelles de taille relativement petites (21,52 g et 23,69 g) correspondant respectivement à 58400 et 61800 larves et à 2714 et 2609 larves par gramme de poids corporel.
Tableau 3 : Paramètres relatifs à l’éclosion des œufs à l’écloserie de M. vollenhovenii
|
N° Dupliqua (N° Bacs) |
PMG (g) |
PFG (g) |
FA (œufs) |
FR (œufs/g) |
NLE (larves) |
TEO (%) |
TER (Larve/g) |
|
6 (6 et 15) |
23,32 ± 6,71 |
22,85 ± 1,89 |
49661,43 ± 15408,87 |
2208,27 ± 856,62 |
47700 ± 15132,09 |
95,94 ± 0,70 |
2121,66 ± 837,35 |
|
7 (7 et 14) |
24 ± 5 |
72863,57 ± 4106,27 |
3085,26 ± 472,48 |
41800 ± 3111,27 |
57,34 ± 1,04 |
1766,58 ± 238,87 |
|
|
9 (9 et 12) |
23,96 ± 0,37 |
60958,33 ± 18330,56 |
2551 ± 805,12 |
48900 ± 18243,36 |
79,30 ± 6,08 |
2047,54 ± 793,60 |
PMG = Poids Moyen Général ; PFG = Poids de la Femelle Grainée ; FA = Fécondité Absolue ; FR = Fécondité Relative ; NLE = Nombre de Larves Ecloses ; TEO = Taux d’Eclosion des Œufs ; TER = Taux d’Eclosion Relative
GAW = General Average Weight; GFW = Grained Female Weight; AF = Absolute fertility; RF = Relative fertility; NL = Number of Larvae; EHR = Egg Hatching Rate; RHR = Relative Hatching Rate
Description des larves à l’éclosion
27Une photographie réalisée dans les bacs d’éclosion montre une colonie de larves dont les comportements sont différents en fonction de leurs stades de développement et de leur environnement (Figure 6).
28Les larves d’un jour observées à la loupe dans une goutte d’eau déposée sur une lame, sont très actives (Figure 6a), le corps très transparent et présentant de gros yeux sessiles très noirs. A la rencontre de la plage lumineuse, ces larves adoptent un mouvement brusque de fuite vers les zones périphériques moins éclairées. Il existe dans le lot deux catégories de larves. Certaines larves du lot n’ont pas encore développé les péréiopodes (ou pattes), elles se déplacent avec la queue en avant et la face ventrale tournée vers le haut (Figure 6c). D’autres par contre ont développé de petites ébauches de péréiopodes leur permettant de vifs mouvements dans l’eau (Figure 6b). Les larves, malgré leur taille, sont très reconnaissables comme crevettes, il s’agit d’adultes en miniature. Le rostre, le céphalothorax, l’abdomen et la queue sont très tôt reconnaissables au microscope.
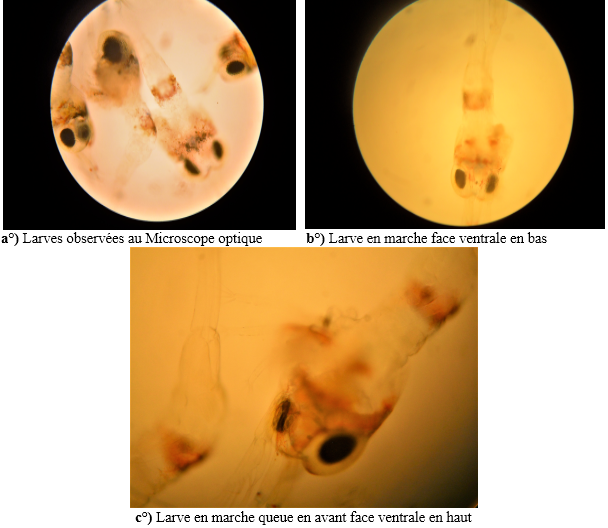
Figure 6 : Photos des larves d’un jour de Macrobrachium vollenhovenii observées au grossissement X40 au Microscope optique
Discussion
Caractéristiques des œufs
29La variabilité constatée au niveau des diamètres des œufs donne une structure hétérogène reflétant l’hétérogénéité de la colonie des futures larves et de la future population des crevettes adultes. En fait dans une cohorte de crevettes adultes, les mâles présentent une structure sociale très hétérogène (40), tandis que les femelles ont une structure homogène (29, 30). Cette structure hétérogène régule la population des crevettes suivant trois catégories de mâles : les mâles dominants, les subdominants et les petits mâles, chaque catégorie de mâles jouant un rôle précis au sein de la population pour la pérennisation de l’espèce. Les œufs sont très collants réunis en masse et difficilement séparables en raison du mucus gluant secrété par les glandes à la base des pléopodes (3). Leur diamètre est petit et la fécondité des femelles est élevée et est fonction de leur âge (25). Leur coloration varie de jaune orangé à marron et à gris noir juste avant l’éclosion (16). Dans ces conditions, une aération mécanique et continue du milieu d’élevage est nécessaire pour faciliter l’incubation et l’éclosion des œufs. Ce volume très réduit des œufs exprime aussi la quantité très réduite du vitellus. Chez l’espèce similaire M. rosenbergii, Revathi et al. (39) ont trouvé que ces œufs ont une teneur en vitelline, en protéine et en lipide 40 fois plus important que les ovules non fécondés. Selon Chang et Shih (6), ces réserves vitellines et protéiques sont puisées au niveau de l’hépathopancréas et transférées vers les gonades par l’hémolymphe pour la maturation des ovules. La vitellogenèse implique la synthèse de nombreuses composantes dans les ovocytes (21) donnant des ovules et plus tard des œufs fécondés. Les protéines et lipides synthétisés en molécules plus complexes sont diversement appelés la vitellogenine (7), la lipovitelline (36, 37) et la lipoprotéine de haute densité (22). Ils proviennent des aliments ingérés soit directement ou soit après stockage dans l'hépathopancréas. Ils doivent être transportés vers l'hémolymphe comme lipoprotéines (1) et enfin vers les gonades. Cette richesse en nutriments des ovules et des œufs fécondés met en exergue l’exigence des besoins alimentaires par les futures larves de crevette. Dans ces conditions, la qualité des œufs à incuber dépend de la richesse de l’alimentation des géniteurs mâles et femelles. Un sevrage réussi des larves nouvellement écloses pourrait garantir un bon taux de survie.
Fécondité des femelles grainées
30Les œufs dénombrés varient entre 38766 et 75767 pour un poids moyen de 23,32 ± 6,71 g. Ceci rejoint les observations faites par Ovie (34), qui fait état d'une gamme de 805 à 6.666 œufs ; Marioghae (26) parle de 3000 à 12000 œufs. Villé (45, 46), lui parle de 300 à 1000 œufs; Oyekanmi, (35) de 5.000 à 11.000 œufs. Le nombre d'œufs variant en fonction du poids des femelles et de leur âge. Ces variations ont également été observées chez d'autres crustacés comme les crabes (19). Selon Cavalli et al. (5), la fécondité décroit quand la taille corporelle augmente. Shailender et al. (43) ont fait les mêmes remarques chez M. rosenbergii où les jeunes femelles présentent une fécondité élevée par rapport aux femelles âgées. Les études réalisées par Rao (38) sur les populations sauvages de la même espèce en Sri Lanka et en Inde ont révélé que seuls les jeunes femelles de crevette présentent une forte fécondité relative. Ces auteurs ont rapporté également que la taille des œufs augmente avec la taille des femelles reproductrices, expliquant ainsi la faible fécondité des femelles âgées. Ces observations sont en adéquation avec les résultats de la présente étude qui ont montré que les plus forts taux d’éclosion sont réalisés par les femelles de taille relativement petites. Selon ces auteurs, la composition alimentaire peut probablement jouer aussi sur la performance de reproduction des femelles. Par exemple, Cavalli et al. (5) ont utilisé un complément en acide gras dans l’alimentation pour améliorer la performance de reproduction des géniteurs en élevage. Shailender et al. (43) ont utilisé un aliment commercial commun sans aucun complément. Dans la présente étude, nous avons utilisé un aliment préparé à partir des sous-produits locaux, cela suppose qu’il faut améliorer davantage l’alimentation des femelles en reproduction.
Paramètres physico-chimiques (pH, Oxygène, Température, Salinité, substrat, lumière)
31Selon Sipauba-Tavares (44), la température, la salinité, l'oxygène dissous, le pH de l'eau interfèrent souvent dans la reproduction, la distribution et la périodicité des organismes. Chez M. vollenhovenii, l'incubation semble être directement affectée par la température. Villé (45, 46) a observé que la durée d'incubation était plus courte à des températures entre 27°C et 29°C, et qu'elle a été allongée à des températures plus basses. A des températures plus élevées (>32 °C), une mortalité excessive des femelles ovigères est constatée dans le milieu d’élevage (31). Selon Willführ-Nast et al. (50), les valeurs optimales reconnues pour l’incubation et l’éclosion chez M. vollenhovenii sont de 7,82 pour le pH, 28,1°C pour la température, 4 mg/L à saturation pour l’oxygène et 0‰ pour la salinité. Dans une autre écloserie (11), les femelles grainées sont introduites dans une eau à salinité variable à 28°C et à pH 7-7,8 en circuit fermé. Selon les travaux de ces derniers, l’éclosion des œufs a eu lieu dans les eaux d'une salinité de 1 à 15‰ ; confirmant par-là les travaux d’Ovie (34) et de Nwosu et Wolfi (32) qui attestent que le processus d'éclosion ne semble en aucune façon être affecté par la salinité de l'eau. Par contre, la durée de la phase larvaire varie avec la salinité. Kavu (20) a travaillé sur deux groupes différents de juvéniles de M. vollenhovenii ; il a donné des taux de croissance spécifique à différentes salinités. Dans la présente étude, les paramètres physico-chimiques (Oxygène = 4,8 mg/l ; pH = 7,3 ; Température = 26,4°C ; Salinité = 4‰) réalisés à l’écloserie sont situés dans les intervalles des optima. Les salinités supérieures à 4‰ ont bloqué le processus de maturation des œufs qui sont restés colorés en jaune orangé durant toute la période d’incubation (21 jours) contrairement aux observations des auteurs précédemment cités. L’eau douce est le meilleur milieu pour favoriser la sortie des larves dans cette expérimentation. Suivant la même logique, dans une autre expérimentation de culture larvaire, Makombu et al. (24) ont obtenu l’éclosion des œufs à 7‰ en circuit fermé à 26,8°C. Ce résultat est bien contraire aux observations effectuées dans cette étude par rapport à la salinité du milieu. Les œufs ont éclos dans des bacs avec ou sans substrat et luminosité, ces derniers ne sont donc pas des facteurs limitants pour l’incubation et l’éclosion.
Durée d’incubation des œufs (11 à 18 jours)
32Malgré les fortes tendances de coloration, la durée d’incubation n’est pas la même, elle varie de 11 jours à 18 jours selon les bacs d’incubation. Les variations observées dans la durée d’incubation des œufs sont liées au stade de maturité des œufs, à l’âge des femelles, aux légères variations des conditions environnementales et aux stress dus aux manipulations. Selon Anetekhai et Fagade (2), les œufs sont retenus en suspension dans l’eau et incubés pendant 16-18 jours avant l'éclosion. Ils ont également signalé que l'éclosion des œufs se déroule la nuit (23h du soir à 1h du matin) et dure environ 12h à 24h. Villé (48, 49) a également donné 18 jours comme durée d'incubation des œufs chez M. vollenhovenii. Willführ-Nast et al. (50) ont signalé que le développement embryonnaire et larvaire de M. vollenhovenii dure 50 à 65 jours, alors que Villé (48, 49) parle de 30 à 45 jours. Les observations faites sur M. vollenhovenii permettent de penser que sa biologie présente beaucoup d’analogie avec celle de M. rosenbergii. Seulement, elle présente un grand nombre de stades larvaires (15 stades), comparée à M. rosenbergii (11 stades). Les œufs de M. vollenhovenii sont plus petits et nombreux que ceux de M. rosenbergii.
Taux d’éclosion des œufs
33Le bac N°14 comparé au bac N°15, présente un fort taux de fécondité (75767 œufs) contre un taux relativement faible d’éclosion (58%). Cela suppose une rigueur dans le choix de la femelle à incuber. Pendant l’incubation, une bonne partie des œufs est évacuée et ne parviennent pas à l’éclosion. Cavalli et al. (5) ont expliqué que la perte des œufs pendant l’incubation est due en partie à la consommation par des femelles par prédation, à la destruction constante des œufs mourants du fait des infestations épizootiques et à la nature lâche des œufs gris plus gros, ce qui les rendrait plus sujettes à des pertes physiques. Wickins et Beard (49) ont signalé que la perte d'œuf pendant l'incubation in vivo pouvait atteindre 31% des œufs initialement déposés dans les bacs d’incubation. En revanche, Damrongphol et al. (10) ont rapporté que l’incubation artificielle des œufs permet de libérer les femelles, ce qui augmente leur performance de reproduction et leur fréquence de ponte. Globalement le taux d’éclosion élevé observé dans la présente étude confirme les meilleures conditions de l’expérimentation.
Elevage larvaire
34Dans notre étude, la phase larvaire n’a pas été approfondie et la totalité des larves obtenues meurt au bout de 3 jours. Néanmoins certains chercheurs ont expliqué les conditions de réussite de l’élevage larvaire au niveau de leur écloserie. Doume Doume et al. (11) ont reporté que en circuit fermé à 28 °C, la moyenne d’œufs mis en incubation est de 5.428 œufs. La salinité de 2‰ lors de la ponte et de l'éclosion est montée jusqu'à 12‰ au stade 3 (stade myxis) après un palier de quelques jours à 8‰ (stades 1 et 2 c’est-à-dire nauplius et zoé). Elle est maintenue à 12‰ jusqu'à l'apparition de la première post larve et repassée alors à 2‰ après un palier de dix jours à 8‰. Les taux d’éclosion obtenus sont supérieurs à 62%. La valeur optimale du pH pour M. vollenhovenii se situe entre 7 et 8,8. Les valeurs à partir de 9 sont létales pour les post-larves. Les post larves formées 3 mois après la ponte se développent rapidement en eau douce. Et en 6 mois, ces post-larves sont devenues des adultes sexuellement matures. La taille moyenne obtenue à la 1ère éclosion larvaire a été de 2,05 mm pour un poids moyen de 0,356 mg (11), ce qui est légèrement inférieur à la taille de la première éclosion donnée par Ville (48, 49) et Ovie (34) et qui était respectivement de 2,2 mm et 2 mm. La Durée de la vie larvaire est de 65 jours et la métamorphose 3 semaines. L’optimum pour l’oxygène a été de 5 mg/L. A 2,3 mg/L d'oxygène, les larves cherchent à fuir le fond et se concentrent sur les bords des bacs d’élevage puis elles meurent. Enfin, en circuit fermé, Makombu et al. (24) ont obtenu l’éclosion des œufs à 7‰, la salinité a été remontée graduellement à 16‰ pour réaliser un bon taux de survie larvaire.
Conclusion
35Les paramètres environnementaux indispensables à l’éclosion des œufs sont l’oxygène, le pH, la température et la salinité. A l’écloserie, les œufs ont éclos dans les bacs plastiques qui sont les infrastructures adaptées. Toutes ces conditions réunies permettent d’obtenir des taux d’éclosion élevés. Toutefois le tri de la femelle grainée ou des œufs à incuber et l’alimentation des géniteurs requièrent beaucoup de rigueur.
Remerciements
36Les auteurs adressent leurs sincères remerciements aux autorités du Projet de Productivité Agricole en Afrique de l’Ouest (PPAAO) du Programme Cadre d’Appui à la Diversification Agricole (ProCAD) au Bénin et particulièrement aux Partenaires Techniques et Financiers de la Banque Mondiale qui ont mis en place ce financement pour la recherche sur les crevettes d’eau douce Macrobrachium. Le premier auteur de cette publication réalise ses recherches doctorales dans ce cadre.
Bibliographie
371. Allen W.V., 1972, Lipid transport in the Dungenes crab, Cancer magister. Comp. Biochem. Physiol., 43, 193-207.
382. Anetekhai M.A. & Fagade S.O., 1987, Induced spawning and laboratory rearing of the larvae of the African river prawn Macrobrachium vollenhovenii (Herklots) caught at Asejire Lake. Paper presented to the National Fisheries Development Committee meeting, 27-30 April, 1987, Port Harcourt, Nigeria.
393. Bile A.A., Atse B.C. & N'guetta A.S.P., 2011, Dimorphisme sexuel chez Macrobrachium vollenhovenii, espèce de crevette d'eau douce. F. Tech. Doc Vulg., 33-37.
404. Brown M.B., Forsythe A.B., 1974, Robust tests for equality of variances. J. Am. Stat. Assoc., 69, 364–367.
415. Cavalli R.O., Tamtin M., Lavens P. & Sorgeloos P., 2001, Variation in lipid classes and fatty acid content in tissues of wild Macrobrachium rosenbergii (De Man) females during maturation. Aquaculture, 193, 311-324.
426. Chang C.F. & Shih T.W., 1995, Reproductive cycle of ovarian development and vitellogenin profiles in the freshwater prawn Macrobrachium rosenbergii. Inverted Reproductive Dev., 27, 11-20.
437. Croisille Y., Junera H., Meusy J.J. & Charniaux-cotton H., 1974, The female specific protein (vitellogenin) in crustaceans with particular reference to Orchestia gammarella (Amphipoda). Amer. Zool., 14, 1219-1228.
448. CSAO, 2006, Etude régionale relative aux opportunités économiques de développement de la crevetticulture en Afrique de l’Ouest. Club du Sahel et de l’Afrique de l’Ouest. Le Seine St Germain. 4. Boulevard des Îles. 92130 ISSY. LES MOULINEAUX ; CEDEX. Paris. France. 53 p.
459. Dagnelie P., 1984, Théorie et méthodes statistiques. Applications agronomiques, Tome II. Les presses agronomiques de Gembloux, Gembloux, p. 463.
4610. Damrongphol P., Eangchuan N. & Poolsanguan B., 1991, Spawning cycle and oocyte maturation in laboratory-maintained giant freshwater prawns (Macrobrachium rosenbergii). Aquaculture, 95, 347-357.
4711. Doume Doume C.N., Toguyeni A., Yao S.S. & Tchepurnaya A., 2013, Culture en captivité et développement larvaire de Macrobranchium vollenhovenii. Int. J. Biol. Chem. Sci., 7, 2, 544-553.
4812. Gangbè L., Agadjihouèdé H., Achoh M. & Lalèyè P., 2016b, Survie et croissance de la crevette géante d’eau douce Macrobrachium vollenhovenii (Herklots, 1857) nourrie en captivité à base du tourteau du coprah, de la farine et du son de maïs, Afr. Sci., 12, 3, 126-143.
4913. Gangbè L., Agadjihouèdé H., Chikou A., Senouvo P., Mensah G.A. & Lalèyè P., 2016a, Biologie et perspectives d’élevage de la crevette géante d’eau douce Macrobrachium vollenhovenii (Herklots, 1857) : une revue. Int. J. Biol. Chem. Sci., 10, 2, 573-598.
5014. Greenberg A.E., Clesceri L.S., Eaton, A.D. & Franson M.A.H., 1992, "Standard methods for the examination of water and wastewater". 18th Edition. Am. Publ. Health Assoc., 4, 108-l13.
5115. Griessinger J.M., Lacroix D. & Gondouin P., 1991, Elevage de la crevette tropicale d’eau douce. ISBN 2-905434-31, 7, 394.
5216. Griessinger J.M., Lacroix D. & Godouin P., 1998, Elevage du Camaron (ou « Chevrette »). In : Arrignon J. C. V. 1990. Les crustacés tropicaux d’élevage. Coll. Technicien d’Agriculture Tropicale, CTA. Ed. Maisonneuve et Larose, Paris. Pp 1-28.
5317. Hach, 1991, Packaging guide. DREL/2010 Advanced Water Quality Laboratory. 205 p.
5418. Jimoh A.A., Clarke E.O., Whenu O.O., Anetekhai M.A. & Ndimele P.E., 2012, Morphological Characterization of Populations of Macrobrachium vollenhovenii and Macrobrachium macrobrachion from Badagry Creek, Southwest Nigeria. As. J. Biol. Sci., 5, 126-137.
5519. Jimoh A.A., Clarke E.O., Whenu O.O., Anetekhai M.A. & Ndimele P.E., 2012, Morphological Characterization of Populations of Macrobrachium vollenhovenii and Macrobrachium macrobrachion from Badagry Creek, Southwest Nigeria. As. J. Biol. Sci., 5, 126-137.
5620. Kavu B.W., 1985, Macrobranchium macrobranchion (Herklots 1851) its availability and the effect of salinity on the growth of its juveniles. M. Tech. Thesis Univ. of Sc. and Tech/Afri. Reg. Aquacult. Centre Port Harcourt Nigeria; 96 p.
5721. Krol R.M., Hawkins W.E. & Overstreet R.M., 1992, Reproductive components. In: Microscopical Analysis of Invertebrates. Harrison, F.W and Humes, A.G (Eds.). Wiley-Liss, New York, Pp: 295-343.
5822. Lee R.F. & Puppione D.L., 1988, Lipoprotein I and II from the hemolymph of the blue crab Callinectes sapidus: Lipoprotein II associated with vitellogenesis. J. Exp. Zool., 218, 278-289.
5923. Levene H., 1960, Robust tests for the equality of variance, in Contributions to Probability and Statistics, Ed Olkin I., editor. (Palo Alto, CA: Stanford University Press), 278-292.
6024. Makombu J.G., Oben P.M., Oben B.O., Gaudin G.L.P., Motto I.S., Makogea N., Syapzec J.K., Brownd J.H., Ngueguime J.R. & Mialhe E., 2014, Complete Larval Development of the Fresh Water Prawn Macrobrachium vollenhovenii in Cameroon, J. Appl. Aquaculture, 26, 4, 310-328.
6125. Marioghae I.E., 1982, Notes of the biology and distribution of Macrobrachium vollenhovenii and Macrobrachium macrobrachion in the Lagos Lagoon (Crustacea, decapoda, Palemonidae). Rev. Zool. Af., 94, 3, 493-508.
6226. Marioghae I.E., 1987, An appraisal of the cultivability of Nigerian Palaemonid prawns. African Regional Aquaculture Centre Working paper ARAC/87/WP/412p.
6327. Monod T., 1966, Crevettes et crabes de la Côte occidentale d’Afrique. Mémoire des Instituts Fondamentales Noires 77. Pp 103-234.
6428. N’zi G.K., Gooré Bi G., Kouamélan E.P., Koné T., Douba V.N. & Ollevier F., 2008, Influence des facteurs environnementaux sur la répartition spatiale des crevettes dans un petit bassin ouest africain–rivière Boubo –Côte d’Ivoire. Tropicultura, 26, 1, 17-23.
6529. Nagamine C., Knight A.W., Maggenti A. & Paxman G., 1980a, Effects of androgenic gland ablation on male primary and secondary sexual characteristics in the Malaysian prawn Macrobrachium rosenbergii (de Man) with first evidence of induced feminization in a non-hermaphroditic decapod. Gen. Comp. Endocrinol., 41, 423–441.
6630. Nagamine C., Knight A.W., Maggenti A. & Paxman G., 1980b, Masculinization of female Macrobrachium rosenbergii (de Man) (Decapoda, Palaemonidae) by androgenic gland implantation. Gen. Comp. Endocrinol., 41, 442–457.
6731. Nwosu F.M., 2013, Management implications of sex ratios of three palaemonid shrimps in the cross river estuary, south – East, Nigeria. J. Fish. Aquatic Sci., 8, 1, 291- 294.
6831. Nwosu F.M. & Wolfi M., 2006, Population dynamics of giant African river prawn Macrobrachium vollenhovenii Herklots 1857 (Crustacea, Palaemonidae) in the Cross River Estuary, Nigeria. West Afr. J.Appl. Ecology, 9, 11-18.
6933. Okogwu O.I., Ajuogu J.C. & Nwani C.D., 2010, Artisanal fishery of the exploited population of Macrobrachium vollenhovenii (Herklot 1857) (Crustacea; Palaemonidae) in the Asu River, southeast Nigeria. Acta Zoologica Lituanica, 20, 98–106.
7034. Ovie S.I., 1986, Some notes on the cultivation of live fish food. Proceedings of the 5th 553 annual conference on fisheries enterprises and information brochure. Fisheries Society of Nigeria. 11-76.
7135. Oyekanmi F.B., 2011, Bio-ecology of fresh water prawns Macrobrachium vollenhovenii (Herklots, 1857) and Caridina africana (Kingsley, 1822) at Asejire Lake and Erin-Ijesa waterfalls, Osun State, Nigeria. Ph.D. Thesis, University of Agriculture, Nigeria.
7236. Paulus J.E. & Laufer H., 1982, Vitellogenesis in the hepatopancreas and ovaries of Carcinus maenas. Biol. Bull., 163, 375-376.
7337. Powell C.B., 1980, The genus Macrobrachium in West Africa. In: M. thysi, a new large-egged species from Ivory Coast (Crustacea Decapoda Palaemonidae). Rev. Zool. Afr., 94, 317-326.
7438. Rao K.J., 1991, Reproductive biology of the giant freshwater prawn Macrobrachium rosenbergii (de Man) from Lake Kolleru (Andhra Pradesh). Indian J. Anim. Sci., 61, 780-787.
7539. Revathi P., Iyapparaj P., Munuswamy N. &Krishnan M., 2012, Vitellogenesis during the ovarian development in freshwater female prawn Macrobrachium rosenbergii (De Man), Int. J. Aqu. Sci., 3, 2, 13-27.
7640. Sagi A. & Ra’anan Z., 1988, Morphotypic differentiation of males of the fresh-water prawn Macrobrachium rosenbergii: changes in the midgut glands and the reproductive system. J. Crustacean Biol., 8, 1, 43-47.
7741. Saville D.J., 1990, Multiple comparaison procedures: the pratical solution. Am. Statistician, 44, 2, 174-180.
7842. Scherrer B., 1984, Biostatistique. Gaëtan Morin éditeur, Québec, p. 850.
7943. Shailender M., Krishna P.V., Suresh Babu C.H. & Srikanth B., 2012, Reproductive Performance and Offspring Quality of Giant Freshwater Prawn, Macrobrachium rosenbergii Broodstock from Different Regions, World J. Fish Marine Sci., 4, 6, 629-636.
8044. Sipauba Tavares L.H., Santeiro R.M., Coelho R.M. &Braga F.M., 2009, Effect of fertilization in water quality and in zooplankton community in open plankton-culture ponds. Biosci. J, Uberlandia, 25, 3, 172-180.
8145. Villé J.P., 1970a, Recherches sur la reproduction des Macrobrachium des lagunes ivoiriennes. I – La fécondité précoce chez les Macrobrachium de Côte d’Ivoire. Ann. Univ. Abidjan, Écologie, 3, 1, 253-262.
8246. Villé, J.P., 1970b, Recherches sur la reproduction des Macrobrachium des lagunes ivoiriennes. II – Migrations liées à la reproduction chez les Macrobrachium de Côte d’Ivoire. Ann. Univ. Abidjan, Écologie, 3, 1, 263-267.
8347. Villé J.P., 1971a, Ecologie des Macrobrachium de Côte d’Ivoire. I-Rôle de la température et de la salinité. Ann. Univ. Abidjan, Écologie, 4, 1, 317-324.
8448. Villé J.P., 1971b, Biologie de la reproduction des Macrobrachium de Côte d’Ivoire. III-Description des premiers stades larvaires de Macrobrachium vollenhovenii. Ann. Univ. Abidjan, Écologie, 4, 1, 325-341.
8549. Wickins J.F. & Beard, I.W., 1974, Observation on the breeding and growth of the giant freshwater prawn Macrobrachium rosenbergii (De Man) in the laboratory. Aquacult., 3, 159-174.
8650. Willführ-Nast J., Rosenthal H., Udo P.J. & Nast F., 1993, Laboratory cultivation and experimental studies of salinity effects on larval development in the African River prawn Macrobrachium vollenhovenii (Decapoda, Palaemonidae), Aquat. Living Resour., 6, 115-137.
Pour citer cet article
A propos de : L. Gangbè
Béninois, PhD, Enseignant-Chercheur, Université d’Abomey-Calavi, Faculté des Sciences Agronomiques, Cotonou, Bénin.
Email: gangluc02@yahoo.fr
A propos de : H. Agadjihouede
Béninois, PhD, Maître Assistant au CAMES, Enseignant Chercheur, Université Nationale d’Agriculture, Ecole d’Aquaculture de la Vallée, Kétou, Bénin.
A propos de : P.A. Laleye
Béninois, PhD, Professeur titulaire au CAMES, Directeur, Université d’Abomey-Calavi, Faculté des Sciences Agronomiques, Laboratoire d’Hydrobiologie et d’Aquaculture Cotonou, Bénin.