- Accueil
- Volume 18 (2014)
- Numéro 3
- Propriétés physico-chimiques et biologiques des substances humiques en relation avec le développement végétal (synthèse bibliographique)
Visualisation(s): 22814 (206 ULiège)
Téléchargement(s): 1235 (13 ULiège)
Propriétés physico-chimiques et biologiques des substances humiques en relation avec le développement végétal (synthèse bibliographique)

Notes de la rédaction
Reçu le 15 septembre 2013, accepté le 7 avril 2014
Résumé
Les substances humiques (SH) sont des composés organiques résultant de la transformation physique, chimique et microbiologique des résidus végétaux et animaux. Elles se retrouvent sous forme de macromolécules carbonées hétérogènes et complexes dans tous les écosystèmes au niveau des sols ainsi que des sédiments, des eaux de surface et des lixiviats de décharges. Elles sont issues de processus d’humification différents, générant ainsi des molécules variables et complexes composées principalement de carbone, d’hydrogène, d’oxygène, d’azote, de soufre et de groupements fonctionnels (COOH, OH, C=O). Ces substances sont connues pour influencer les propriétés du sol et interagir avec la croissance et le développement des plantes ou avec l’activité des micro-organismes. L’influence de la croissance des plantes s’exprime généralement de manière directe via la stimulation des processus biochimiques et métaboliques ou indirecte via l’amélioration de la nutrition minérale. Mais l’intensité de réponse reste dépendante de différents paramètres tels que l’origine, la nature de la matière organique initiale, les processus de transformation et la concentration des SH ainsi que des conditions expérimentales et des plantes traitées. Les mécanismes par lesquels les SH exercent leurs effets favorables sur les végétaux sont imprécis et généralement mal compris.
Abstract
Physical-chemical and biological properties of humic substances in relation to plant growth. A review. Humic substances (HS) are organic compounds resulting from the physical, chemical and microbiological transformation of plant and animal residues. Humic substances are heterogeneous and complex carbon macromolecules, which can be found in soils, sediments, surface water and leachates. They are derived from different humification processes, generating variable and complex molecules mainly composed of carbon, hydrogen, oxygen, nitrogen, sulfur and functional groups (COOH, OH, C = O). These substances are known to have an effect on soil properties, interacting with plant growth and development and with microorganism activity. The influence on plant growth is expressed directly through stimulation of biochemical and metabolic processes or indirectly through mineral nutrition improvement. But the intensity of the response is dependent on various parameters such as the origin, the nature of the initial organic matter, transformation processes, HS concentration, experimental conditions and plant species. The mechanisms by which HS cause their positive effects on plant growth are not yet fully understood.
Table des matières
1. Introduction
1La mise en décharge a constitué depuis longtemps la solution la plus simple pour éliminer les déchets. Elle demeure le moyen le plus économique et donc le plus utilisé comparativement à d’autres techniques (incinération, fermentation, pyrolyse). Cette pratique présente des effets néfastes sur l’environnement. La dégradation des matières organiques s’accompagne en effet de la production de biogaz, d’odeurs et de lixiviats. Les effluents ou liquides de percolation de la décharge (lixiviats) sont chargés bactériologiquement et surtout chimiquement de substances minérales (ions minéraux et métaux lourds) et organiques (acides gras volatils, substances humiques) qui risquent de contaminer les sols, les eaux de surface et souterraines (Thonart et al., 1998).
2La présence de substances humiques (SH), difficilement biodégradables dites aussi réfractaires, nécessite de les concentrer (fibres immergées) et/ou de les adsorber (charbon actif) par la mise en œuvre de procédés couteux (Berthe, 2006). Les gestionnaires de Centres d’Enfouissement Technique (CET) recherchent donc des alternatives permettant d’éliminer ou de valoriser ces substances. En tant que phytostimulant, elles présentent ainsi un potentiel intéressant dans le cadre du développement durable (recyclage de molécules, réduction d’intrants).
3Les substances humiques sont des mélanges complexes et hétérogènes de matériaux polydispersés résultant de la décomposition et de la transformation de la matière organique. Elles se trouvent naturellement de manière diffuse dans les sols, dans les eaux de surface et surtout dans les produits de transformation de matières organiques liées aux activités humaines comme le compost, le fumier, les décharges et le lixiviat. Elles sont aussi concentrées sous forme de gisements fossilisés comme la léonardite actuellement exploitée commercialement (Canellas et al., 2008a ; Xiaoli et al., 2008 ; Badis et al., 2009).
4Aux trois constituants de base que sont les humines, les acides humiques (AH) et les acides fulviques (AF) viendraient s’ajouter des substances présentant des activités biologiques spécifiques, notamment proches de celles des régulateurs de croissance comme les auxines, les cytokinines ou les polyamines (Young et al., 1997 ; Pizzeghello et al., 2013). Abondamment traitées de manière générale, en agriculture, en ce qui concerne la chimie et la fertilité des sols ou la physiologie végétale ainsi que dans les sciences de l'environnement, on leur reconnait un rôle majeur dans la rétention et la mobilité des éléments minéraux ou des composés hydrophobes présents dans le sol et, par conséquent, dans la biodisponibilité de ces éléments au bénéfice des plantes et des micro-organismes (Dangleterre, 2007).
5Des formulations à base de SH plus ou moins purifiées sont commercialisées depuis quelques années, mais toutes sont extraites de la léonardite. Bien que les effets généralement favorables au développement des végétaux soient quantifiables, les modalités d’expression des propriétés biologiques restent imprécises du fait de la complexité des interférences avec les processus de nutrition et de régulation. De plus, ces SH se révèlent phytotoxiques lorsqu’elles sont appliquées en excès.
6Ce document a pour objectif de faire le point des connaissances relatives aux propriétés physico-chimiques et biologiques des substances humiques en relation avec la croissance et le développement des végétaux.
2. Origines et processus de formation
7Les substances humiques résultent de mécanismes d’humification ou de genèse complexes (Stevenson, 1994 ; Berthe, 2006) impliquant une variété de réactions chimiques et de procédés de transformation biologiques. Parmi les nombreux facteurs qui les influencent, se trouvent l’origine et la nature de la matière organique, les micro-organismes qui en assurent la dégradation et la microfaune comme facteurs biologiques ainsi que le pH, la température, l’humidité et l’aération comme paramètres physiques.
8Les théories citées dans la littérature font intervenir la lignine, les composés phénoliques ou les polysaccharides dans la formation des SH en systèmes naturels (Figure 1) :
9– théorie de la lignine (voie 1) : la lignine est un bio-polymère difficilement biodégradable. Une fois modifiée partiellement par les micro-organismes, elle s’associe à des protéines synthétisées par ceux-ci pour former des SH selon la réaction suivante :
10(Lignine modifiée) - CHO + R - NH2 (Lignine modifiée) – CH = N - R + H2O
11Cette théorie se base sur l’existence de propriétés communes entre la lignine et les acides humiques telles que la solubilité en milieux alcalins, la présence de fonctions acides, des groupes méthoxyles et la faible dégradabilité (Waksman, 1936) ;
12– théorie des polyphénols (voie 2) : les polyphénols, provenant de la dégradation de la lignine et de synthèses dues à des micro-organismes, sont oxydés en quinones par des polyphénoloxydases. Par la suite, leur polymérisation ou association à des acides aminés ou des peptides conduisent à la formation d’AF puis d’AH (Calvet, 2003) ;
13- théorie de condensation amine-sucre (voie 3) : l’addition d’un groupement aminé à un groupement aldéhyde d’un sucre réducteur forme une glycosylamine-N substituée. Selon cette théorie, les sucres et les acides aminés issus du métabolisme microbien et de la dégradation des matières organiques se polymérisent par condensation pour former les SH (Calvet, 2003).
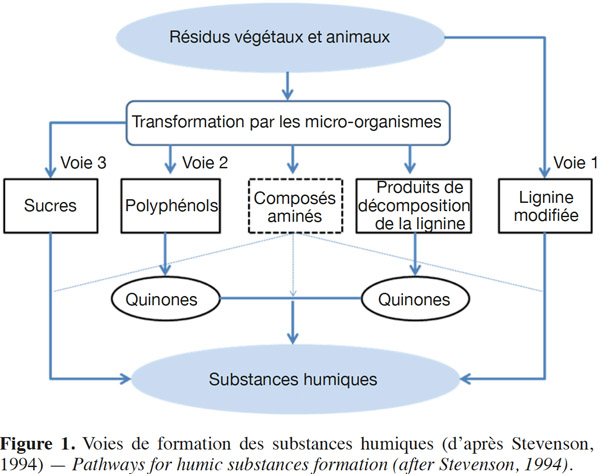
14D’autres théories existent comme celle des supramolécules. Cette théorie innovatrice suggère que les SH sont des supramolécules issues de la formation de liaisons faibles (Van der Waals et π-π) entre des petites molécules. Ces associations conduisent à la formation de véritables polymères pour donner les substances humiques (Piccolo, 2002).
15Ces différentes voies de formation des SH dans les systèmes naturels ne peuvent être directement transposées aux lixiviats des décharges. Les conditions y sont, en effet, très particulières (Thonart et al., 1998) : les matières organiques mises en décharge ne sont pas uniquement lignocellulosiques ; les teneurs en carbone, hydrogène, soufre sont plus élevées que dans les sols ; les conditions d’humidité et d’aération y sont hétérogènes ; la présence de xénobiotiques peut interférer sur les processus de dégradation et d’humification, de même que la concentration en sels (sulfates notamment). Plusieurs auteurs (Labanowski, 2004 ; Berthe, 2006) mettent en évidence la présence de fragments ligneux, de polyphénols, de nombreuses petites molécules issues de l’hydrolyse de la matière organique ainsi que de composés assimilables à des matières plastiques. Ce qui tend à démontrer que des processus différant des théories développées ci-avant peuvent intervenir au niveau des décharges.
3. Propriétés physico-chimiques des substances humiques
3.1. Composition et méthodes d’extractions
16La caractérisation des substances humiques nécessite avant tout leur extraction du substrat d’origine suivie de leur fractionnement. Les fractions sont alors analysées afin de comprendre leur genèse et leurs propriétés chimiques et biologiques respectives.
17L’extraction des SH se fait en solutions alcalines (NaOH, KOH ou Na4P2O7). Une phase insoluble correspondant aux humines est alors séparée d’une phase soluble (de couleur foncée) comportant les AF et les AH. L’acidification (HCl ou H2SO4) de cette dernière phase conduit à précipiter les AH, laissant les AF en solution dans le surnageant.
18Plusieurs procédures de fractionnement des AH et AF sont citées dans la littérature. Elles reposent sur :
19– des propriétés de solubilité (Canellas et al., 2008a), de sorption en colonne de résines ioniques (Leenheer, 1981) et/ou non ioniques (XAD) (Labanowski et al., 2011) ;
20– des techniques de séparation basées sur le poids moléculaire des constituants (chromatographie de perméation sur gel, HPLC, ultrafiltration) (Preuße et al., 2000 ; Lee et al., 2008) ;
21– des techniques mixtes couplant sorption et poids moléculaire (Newcombe et al., 1997).
22La méthodologie d’extraction et de séparation de référence appliquée aux lixiviats est celle éditée par la société internationale des substances humiques (IHSS : http://www.humicsubstances.org). Elle fait intervenir, d’une part, une résine Amberlite XAD (XAD-8 ou XAD-7) pour adsorber et pré-concentrer les SH et, d’autre part, du NaOH 0,1N pour les éluer ensuite (Kang et al., 2002 ; Xiaoli et al., 2008).
23Il n'existe aucune méthode définitive qui permet de séparer totalement les substances non humiques des substances humiques. Aucune des méthodes utilisées n’individualise les molécules, mais elles donnent des mélanges de molécules possédant des propriétés similaires (Nardi et al., 2009).
24Les trois principales fractions constitutives des SH, définies par l’IHSS, sont de poids moléculaire variant entre 1 000 daltons pour les SH aquatiques et 300 000 daltons pour les SH de sols. Elles se distinguent d’après leur polarité et leur solubilité dans l’eau : l’humine est insoluble, les acides humiques (AH ou fraction de haut poids moléculaire) sont solubles à pH alcalin et insolubles à pH acide (< 2), tandis que les acides fulviques (AF ou fraction de faible poids moléculaire) sont solubles dans l’eau quel que soit le pH. Alors que ces deux fractions (AH et AF) couvrent la majeure partie des SH, les frontières qui permettent de les séparer chimiquement ne sont pas encore clairement identifiées (Piccolo, 2002).
3.2. Caractérisation chimique et structurelle
25Des recherches sont menées depuis plusieurs dizaines d’années pour caractériser et déterminer la structure des SH en utilisant diverses méthodes spectroscopiques non destructives (RMN, IR, UV-Visible) ou des méthodes destructives (analyse élémentaire, pyrolyse, GC-MS, HPSEC). Celles-ci fournissent des informations qualitatives et quantitatives sur la structure moléculaire des SH. Mais la structure chimique des SH reste mal définie, principalement en raison de leurs divers processus de formation (Eyheraguibel, 2004 ; Canellas et al., 2008a ; Chung et al., 2011 ; Nasir et al., 2011). Des modèles moléculaires rapportés (Eyheraguibel, 2004 ; Trevisan, 2010), il est actuellement admis que les SH sont une association de molécules hétérogènes maintenues ensemble par des interactions hydrophobes de types van der Waals, π-π, ion-dipôle. Elles consistent en des noyaux aromatiques oxydés (phénols, méthoxyphénols, furanes, pyrroles et pyridine) liés par des chaines aliphatiques (alcanes, alcènes, acides, esters) comportant des groupements acides et alcools (Trevisan, 2010).
26Les différentes analyses montrent que, quelle que soit leur origine (sol, eaux ou lixiviats), les SH (AH et AF) sont composées principalement de carbone (C), d’hydrogène (H), d’oxygène (O), d’azote (N) et de groupements fonctionnels (COOH, OH, C=O). Le pourcentage et la concentration de ces éléments varient en fonction du type et de l’origine des SH (Tableau 1).
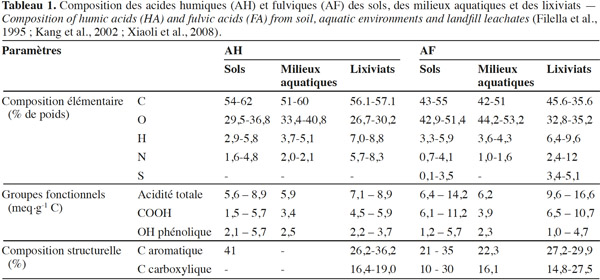
27La réactivité des SH est essentiellement liée à la présence d’une grande variété de ces groupements fonctionnels dont l’élément clé est l’oxygène. Ce dernier confère aux SH un caractère poly-électrolyte de type anionique dont résultent leurs propriétés réductrices, tensioactives et surtout leur pouvoir séquestrant (adsorbant, complexant, chélatant) vis-à-vis de composés organiques et minéraux (Eyheraguibel, 2004). Selon Milne et al. (2001), la teneur en groupements fonctionnels acides dans les substances humiques est généralement comprise entre 3 et 14 eq H+·kg-1 de SH. En plus de ces groupements acides, les SH présentent aussi des groupements fonctionnels de type amine, amide, carbonyle et quinone.
28Généralement, les AH sont plus riches en carbone qu’en oxygène (O/C = 0,6), tandis que les AF possèdent un taux de carbone relativement faible et un taux d’oxygène élevé (O/C = 1,1) (Figures 2 et 3). Cette relative richesse en oxygène des AF par rapport aux AH est due à la prépondérance de groupements fonctionnels de nature acide et une abondance d’hydrates de carbone (Chen et al., 2003). Les rapports atomiques montrent que les AH présentent des rapports faibles par rapport aux AF, notamment le rapport N/C (Figure 3).

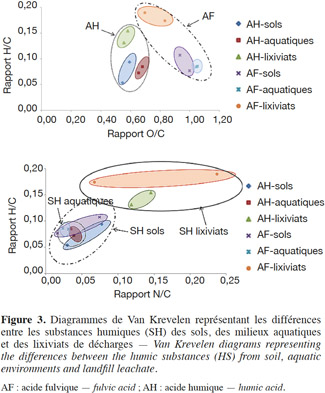
29La différence entre les SH de systèmes naturels et celles de lixiviats dépendraient de leurs conditions de formation (Tableau 1 et figure 3). En effet, les SH de lixiviats ont une faible aromaticité et moins d’oxygène par rapport au SH du sol et du milieu aquatique. Par contre, elles contiennent plus de carbone aliphatique, d’azote, de soufre et d’hydrogène (Kang et al., 2002 ; Zhang et al., 2009). D’après Nanny et al. (2002), les SH des lixiviats sont plus hydrophobes et ont un pouvoir complexant faible par rapport aux SH des milieux naturels du fait de fonctions oxygénées (COOH, OH) moins fréquentes.
4. Propriétés biologiques des substances humiques
30Les substances humiques (SH), spécifiquement les AH et AF d’origines différentes (sol, léonardite, compost), sont connues pour leurs effets bénéfiques sur le développement des plantes et la production végétale. Ces complexes hétérogènes peuvent induire des variations morphologiques, physiologiques ou biochimiques qui se manifestent au niveau de l’accroissement de la biomasse (Nardi et al., 2009), de la vitesse de germination (Chen et al., 1990), de la rhizogenèse (Canellas et al., 2002 ; Schmidt et al., 2007), du métabolisme auxinique (Muscolo et al., 2007 ; Trevisan et al., 2010), du métabolisme cellulaire (Nardi et al., 2009), de la nutrition minérale et donc sur le rendement des cultures (Verlinden et al., 2009) et la résistance au stress hydrique (García et al., 2014). La nature et l’intensité des réponses varient aussi selon la nature des espèces végétales traitées et les conditions expérimentales utilisées (Eyheraguibel, 2004). De ces effets positifs mis en évidence, il est toutefois difficile de distinguer les effets directs, parmi lesquels l’influence de la perméabilité des membranes, la stimulation de la synthèse des protéines, l’effet hormonal, l’accroissement de la photosynthèse, l’influence des activités enzymatiques, des effets indirects comprenant la solubilisation des oligo-éléments, la réduction de la toxicité de certaines molécules, l’augmentation de l'efficacité des engrais (Eyheraguibel, 2004 ; Nardi et al., 2009) liés à des facteurs extérieurs incontrôlés sur lesquels les micro-organismes de la rhizosphère jouent un rôle important.
31L’influence des SH sur la croissance et le développement des plantes a été largement étudiée chez différentes espèces. Les observations portent sur les mesures des poids frais et sec des pousses et des racines, du nombre de racines principales et latérales, la teneur en chlorophylle, la teneur des tissus en micro- et macro-éléments. Toutefois, les mécanismes d’interactions avec les processus cellulaires des racines ne sont pas totalement élucidés.
4.1. Effets physiologiques des substances humiques
32Les SH sont actives à tous les stades de développement des végétaux. En conséquence, les plantes traitées avec les SH présentent une morphologie différente des plantes non traitées (Trevisan et al., 2010). Au niveau des graines, les substances humiques biomimétiques accélèrent la germination du maïs sans en influencer le taux (Eyheraguibel, 2004). Cette stimulation serait liée à une activation d’enzymes telles que l’α-amylase, les peroxydases et l’AIA oxydase qui interviennent dans la germination des graines (Chen et al., 1990).
33Ces dernières années, de nombreuses études ont montré l’effet des SH d’origines différentes sur le développement du système racinaire. En effet, Canellas et al. (2002) ont montré que des semis de maïs (Zea mays L.) traités pendant 7 jours avec différentes concentrations d’AH extraits du compost, présentent une stimulation de l’allongement des racines et une augmentation du nombre de sites d’émergence de racines latérales. Chez Arabidopsis thaliana, l’application de SH extraites de la tourbe augmente significativement la densité des poils absorbants dans les régions sub-apicales des racines principales ; elle est accompagnée de la différenciation des cellules racinaires et de l’émergence de racines latérales (Schmidt et al., 2005). Toutefois, des effets négatifs sont signalés lorsque les SH sont appliquées à fortes concentrations. Ainsi, le traitement des plantules d’A. thaliana avec 5 mg C·l-1 de fractions de SH du sol inhibe fortement l’allongement des racines principales et secondaires (Muscolo et al., 2010).
34D’autres travaux traitant des changements morphologiques induits par les SH sont largement rapportés dans la littérature (Eyheraguibel, 2004 ; et al., 2009 ; Muscolo et al., 2013).
35L’amélioration de l’approvisionnement en éléments nutritifs (Kulikova et al., 2005) par solubilisation ou chélation (Stevenson, 1994) constitue un des mécanismes d’action des SH. En effet, l’assimilation des éléments minéraux majeurs (N, P, K, Mg, Ca, Fe, etc.) serait activée par certaines enzymes telles que la pompe H+ATPase, le Fe(III) chélate réductase (Quaggiotti et al., 2004 ; Aguirre et al., 2009). En effet, chez le maïs (Zea mays), l’application des AH du compost active la pompe H+ATPase racinaire, ce qui augmente le gradient électrochimique des protons qui peut être responsable de l’absorption des nitrates (Canellas et al., 2002 ; Nardi et al., 2009). Ceux-ci agissent comme signal pseudo-hormonal modifiant la répartition dans la plante de certaines cytokinines, de polyamines ainsi que de l’acide abscissique, ce qui par conséquent influence le développement des plantes (Garnica et al., 2009 ; Rubio et al., 2009 ; Mora et al., 2012).
36D’autre part, l'expression du gène Mha2 (gène codant pour la pompe H+ATPase) a montré une forte induction en termes d'accumulation de ses transcrits dans les racines de plantes de maïs traitées pendant 48 h avec des substances humiques de faible poids moléculaire extraites du sol (Quaggiotti et al., 2004).
37Chez le concombre, Aguirre et al. (2009) ont récemment montré que les activités du Fe(III) chélate-réductase et du transporteur racinaire du Fe(II) étaient induites après traitement avec des AH provenant de la léonardite. En fait, un traitement des racines pendant 72 h induit l’expression des gènes CsFRO1 et CsIRT1, codant respectivement pour l’enzyme et le transporteur racinaire. Par contre, l’expression de ces gènes est réduite après 96 h de traitement.
38De manière générale, l’absorption des macro- et micro-éléments varie en fonction de la concentration et de la composition des SH appliquées, des espèces végétales traitées et du pH du milieu (Chen et al., 1990 ; Chen et al., 2004 ; Nardi et al., 2009).
4.2. Métabolisme cellulaire et hormonal
39Il a été rapporté que l’absorption des SH par la plante peut expliquer les effets directs de ces substances sur le métabolisme cellulaire des végétaux (Nardi et al., 2009). En effet, une étude menée par Canellas et al. (2008b) a révélé que les acides organiques sécrétés par les racines du maïs fragmentaient les acides humiques de compost produit par les lombrics en petites molécules capables de franchir la paroi cellulaire.
40Les études de la cinétique d'absorption, l'utilisation d'inhibiteurs de la synthèse de protéines et les différentes conditions expérimentales suggèrent que les SH agissent au niveau de la paroi cellulaire ou au niveau du cytoplasme, influençant ainsi de manière générale la respiration, la photosynthèse, la synthèse protéique, les activités enzymatiques et l’expression de gènes (Nardi et al., 2007 ; Nardi et al., 2009 ; Trevisan et al., 2011 ; Muscolo et al., 2013).
41La photosynthèse est le processus métabolique de base de la cellule végétale qui permet à la plante de produire de la matière organique et de l’oxygène. Différentes études ont démontré que l’application des SH humiques sur des cultures se traduit par une augmentation du contenu en chlorophylle et la stimulation de l’activité des enzymes intervenant dans la photosynthèse (Ertani et al., 2011). Ainsi, des AH extraits de sols forestiers appliqués à des concentrations de 100 et 1 000 mg·l-1 stimulent l'activité photosynthétique et augmentent la teneur en chlorophylle et la conductance de cellules du mésophylle de la laitue (Lactuca sativa L.) (Haghighi et al., 2012).
42La stimulation de la photosynthèse implique que ces SH influencent également le métabolisme du carbone. Berbara et al. (2014) constatent que différentes fractions d’AH extraites du sol stimulent l'activité d’enzymes impliquées non seulement dans la glycolyse (glucokinase [GK], phosphoglucoisomérase [PGI], phosphofructokinase [PFK], pyruvate kinase [PK]), mais aussi dans le cycle de Krebs (citrate synthase [CS], malate déshydrogénase [MDH] et NADP+ isocitrate déshydrogénase [NADP+IDH]) chez le maïs. Cependant, des inhibitions d’activités enzymatiques de la GK, la PGI, la PK et l’aldolase (ALD) sont signalées, par ailleurs, dans des cals de Pinus laricio (Nardi et al., 2009). Ces observations tendraient à prouver que les SH agiraient différemment selon l’espèce végétale étudiée.
43Récemment, Schiavon et al. (2010) ont démontré que le traitement des plantes de maïs cultivées en hydroponie en présence de SH de haut poids moléculaire aussi extraites du sol, modifie le métabolisme secondaire associé à la synthèse des composés phénoliques. En fait, l’application de 1 mg C·l-1 de SH se traduit par un accroissement de l’activité de la phénylalanine/tyrosine ammonia-lyase et augmente le contenu en acides phénoliques, en flavonoïdes et en acides aminés (à l’exception de la phénylalanine et de la tyrosine).
44Des altérations de l’expression de gènes impliqués dans le métabolisme primaire de la croissance et du développement (formation des méristèmes, le cycle cellulaire, la cytokinèse) viennent d’être mises en évidence chez A. thaliana par la transcriptomique (Trevisan et al., 2011). Elles résulteraient d’interactions avec des SH de haut poids moléculaire extraites du sol.
45Les effets bénéfiques des substances humiques (SH) sur la croissance et le développement des plantes ont longtemps été attribués à une action hormonale (Chen et al., 1990 ; Nardi et al., 2009 ; Muscolo et al., 2013 ; Pizzeghello et al., 2013). Cacco et al. (1984) invoquent une augmentation de la concentration endogène en auxine suite à une stimulation de sa production ou bien à une inhibition de l’AIA oxydase, enzyme responsable de sa dégradation. Des structures moléculaires exprimant une activité auxinique de type acide indole 3-acétique (AIA) ont été détectées au sein de SH d’origines différentes par des méthodes immunologiques et la spectrométrie (Quaggiotti et al., 2004 ; Muscolo et al., 2007 ; Nardi et al., 2009).
46S’agissant plus particulièrement de l’acide indole-3-acétique (AIA), c’est le système racinaire du végétal qui serait directement ciblé via l’induction de l’expression de gènes codant pour la pompe membranaire H+ATPase (Sze et al., 1999). Cette activation conduit à une acidification de l’apoplaste par les protons H+ induisant l’augmentation de l’extension de la paroi cellulaire, ce qui facilite l’élongation cellulaire. Il a été démontré chez la tomate que les SH extraites du compost de lombrics favorisaient la croissance des racines d'une manière similaire à celle obtenue avec une concentration de 10-6 M d’AIA (Canellas et al., 2011). De même, les fractions AH et AF extraites du sol induisent la croissance de racines primaires et la formation de racines latérales chez Arabidopsis, principalement par le biais de leur activité auxinique (Dobbss et al., 2007). Ces auteurs ont également signalé l’existence d’une divergence et un chevauchement entre les SH et l’AIA dans les mécanismes de régulation de l’expression de deux gènes AUX/AIA. D’après Muscolo et al. (2007), l’AIA détecté dans les SH ne peut pas être considéré comme le seul facteur contribuant à l'activité biologique des SH et ils suggèrent donc l’importance des groupements fonctionnels des SH dans l’interaction plantes-sol. D’autres composantes inconnues de structure proche des SH seraient donc dotées d’activités de type auxinique.
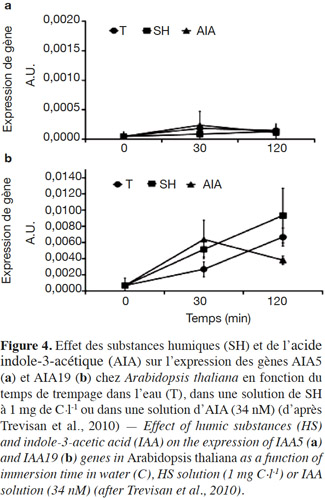
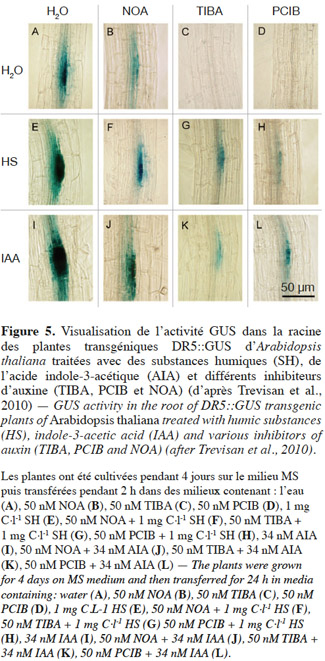
47L’utilisation des techniques de biologie moléculaire a permis de définir certains gènes spécifiques qui sont ciblés par les SH. En effet, le trempage de plantules d’A. thaliana dans une solution contenant 1 mg C·l-1de SH extraites du sol augmente l’expression des gènes AIA5 et AIA19 qui sont précocement induits par l’auxine lors de l’initiation des racines latérales (Trevisan et al., 2010) (Figure 4).
48Trevisan et al. (2010) ont également démontré l’activité auxinique présente dans les SH en utilisant des inhibiteurs de signalisation d’auxines et l’expression du gène rapporteur. Des lignées d’A. thaliana génétiquement modifiées avec le gène rapporteur DR5::GUS (marqueur visuel pour les auxines) ont ainsi été traitées avec de l’AIA (34 nM) et des fractions humiques de haut poids moléculaire (1 mg C·l-1) en présence ou non de divers inhibiteurs de signalisation d’auxines (TIBA, PCIB, NOA). Ces essais confirment la formation de racines latérales et l’activation du rapporteur synthétique d’auxine DR5::GUS (Figure 5).
5. Conclusion
49Mélange hétérogène et complexe de composés organiques, les substances humiques (SH) jouent un rôle important dans différents domaines, tels que l’environnement et l’agriculture. Le processus de formation de ces substances reste encore mal défini, complexe et influencé par la nature des matières organiques et les conditions biologiques et physiques du milieu qui assure leur dégradation. La caractérisation physico-chimique de la structure des SH a permis de déterminer certains groupements fonctionnels (carboxyles, hydroxyles, etc.) pouvant jouer un rôle majeur dans la détermination de leur activité. De même, la présence d’auxine (AIA) dans la structure des SH ne peut être considérée comme le seul facteur contribuant à l'activité biologique de ces substances, suggérant ainsi la présence d’autres molécules (sucres, acides phénoliques, acides gras) dotées d’activités qui peuvent être déterminées par fractionnement des SH au-delà des composantes principales (humines, acides humiques et acides fulviques) afin d’élucider les interactions intermoléculaires qui relient les composants humiques en associations supramoléculaires et de déterminer l'activité de ces substances en fonction de leur composition plus précise.
50La stimulation de la croissance et du développement des plantes sont les activités qui ont attiré l’attention de nombreux scientifiques sur les SH. L’effet stimulant de ces substances s’exprimait de manière directe via la stimulation des processus biochimiques et métaboliques ou indirecte via l’amélioration de la nutrition minérale. Mais il est toutefois difficile de distinguer les effets directs des effets indirects causés par des facteurs expérimentaux incontrôlés, parmi lesquels figurent notamment les micro-organismes de la rhizosphère qui interagissent à la fois avec les SH, les composantes du sol et les activités métaboliques des racines des plantes.
51La culture des tissus végétaux in vitro permettraient d’étudier l’influence des SH sur le système racinaire en éliminant l’interférence potentielle avec les micro-organismes du sol.
52L’utilisation des substances humiques d’origine anthropique comme biostimulants de la croissance végétale représente une potentialité intéressante en agriculture et se situe dans un cadre de recyclage de molécules organiques et de réduction d’intrants. Si leurs effets généralement favorables au développement végétatif sont quantifiables, les mécanismes d’action des SH ne sont généralement pas bien compris. Pour ces raisons, des études complémentaires sont nécessaires afin de mieux définir leurs activités biologiques en s’intéressant en parallèle à l’expression de gènes ciblés par les SH au cours des processus biologiques et des voies de signalisation au niveau de l’interaction SH-cellules végétales.
Bibliographie
Aguirre E. et al., 2009. The root application of a purified leonardite humic acid modifies the transcriptional regulation of the main physiological root responses to Fe deficiency in Fe-sufficient cucumber plants. Plant Physiol. Biochem., 47, 215-223.
Badis A. et al., 2009. Characterization and biodegradation of soil humic acids and preliminary identification of decolorizing actinomycetes at Mitidja plain soils (Algeria). Afr. J. Microbiol. Res., 3(13), 997-1007.
Berbara R.L.L. & García A.C., 2014. Humic substances and plant defense metabolism. In : Parvaiz A. & Mohd R.W., eds. Physiological mechanisms and adaptation strategies in plants under changing environment. Vol. 1. New York, USA: Springer, 297-319.
Berthe C., 2006. Étude de la matière organique contenue dans des lixiviats issus de différentes filières de traitement des déchets ménagers et assimilés. Thèse de doctorat : Université de Limoges (France).
Cacco G. & Dell'Agnolla D., 1984. Plant growth regulator activity of soluble humic substances complexes. Can. J. Soil Sci., 64, 225-228.
Calvet R., 2003. Le sol, propriétés et fonctions. Vol. 2 : Phénomènes physiques et chimiques. Paris : France agricole.
Canellas L.P., Olivares F.L., Okorokovha-Façanha F.A. & Façanha A.R., 2002. Humic acids isolated from earthworm compost enhance root elongation, lateral root emergence and plasma membrane H+ATPase activity in maize root. Plant Physiol., 130, 1951-1957.
Canellas L.P. et al., 2008a. Bioactivity and chemical characteristics of humic acids from tropical soils sequence. Soil Sci., 173(9), 624-637.
Canellas L.P. et al., 2008b. Humic acids cross interactions with root and organic acids. Ann. Appl. Biol., 153, 157-166.
Canellas L.P. et al., 2011. Probing the hormonal activity of fractionated molecular humic components in tomato auxins mutants. Ann. Appl. Biol., 159, 202-211.
Chen J., Le Boeuf E.J., Dai S. & Gu B., 2003. Fluorescence spectroscopic studies of natural organic matter fractions. Chemosphere, 50, 639-647.
Chen Y. & Aviad T., 1990. Effects of humic substance on plant growth. In: MacCarthy P., Clapp C.E., Malcolm R.L. & Bloom P.R., eds. Humic substances in soil and crop sciences: selected readings. Madison,WI, USA: American Society of Agronomy, Inc. & Soil Science Society of America, Inc.
Chen Y., De Nobili M. & Aviad T., 2004. Stimulatory effects of humic substances on plant growth. In: Magdoff F.R. & Weil R.R., eds. Soil organic matter in sustainable agriculture. Boca Raton, FL, USA: CRC Press, 103-129.
Chung T.L., Chen J.S., Chiu C.Y. & Tian G., 2011. 13C-NMR spectroscopy studies of humic substances in subtropical perhumid montane forest soil. J. For. Res., 17, 1-10.
Dangleterre L., 2007. Apport des spectroscopies moléculaires à l’étude des mécanismes de fixation des ions métalliques polluants par les substances humiques. Complexation de Al(III), Pb(II) et Zn(II) par des systèmes modèles. Thèse de doctorat : Université des Sciences et Technologies de Lille (France).
Dobbss L.B. et al., 2007. Changes in root development of Arabidopsis promoted by organic matter from oxisols. Ann. Appl. Biol., 151, 199-211.
Ertani A. et al., 2011. Effect of commercial lignosulfonate-humate on Zea mays L. metabolism. J. Agric. Food Chem., 59, 11940-11948.
Eyheraguibel B., 2004. Caractérisation des substances humiques biomimétiques : effet sur les végétaux. Thèse de doctorat : Institut National Polytechnique de Toulouse (France).
Filella M., Parthasarathy N. & Buffle J., 1995. Humic and fulvic compounds. Encycl. Anal. Sci., 2017-2027.
García A.C. et al., 2014. Potentialities of vermicompost humic acids to alleviate water stress in rice plants (Oryza sativa L.). J. Geochem. Explor., 136, 48-54.
Garnica M., Houdusse F., Yvin J.C. & Garcia-Mina J.M., 2009. Nitrate supply induces changes in polyamine content and ethylene production in wheat plants grown with ammonium. J. Plant. Physiol., 166, 363-374.
Haghighi M., Kafi M. & Fang P., 2012. Photosynthetic activity and N metabolism of lettuce as affected by humic acid. J. Veg. Sci., 18, 182-189.
Kang K.H., Shin H.S. & Park H., 2002. Characterization of humic substancs present in landfill leachates with different ages and implications. Wat. Res., 36(16), 4023-4032.
Kulikova N.A., Stepanova E.V. & Koroleva O.V., 2005. Mitigating activity of humic substances: direct influence on biota. In: Perminova I.B., Hatfield K. & Hertkorn N., eds. Use of humic substances to remediate polluted environments: from theory to practice. Dordrecht, The Netherlands: Springer, 285-309.
Labanowski J., 2004. Matière organique naturelle et anthropique : vers une meilleure compréhension de sa réactivité et de sa caractérisation. Thèse de doctorat : Université de Limoges (France).
Labanowski J. & Feuillade G., 2011. Dissolved organic matter: precautions for the study of hydrophilic substances using XAD resins. Wat. Res., 45, 315-327.
Lee H.H., Weng Y.H. & Li K.C., 2008. Electro-ultrafiltration study on Aldrich humic substances with different molecular weights. Sep. Purif. Technol., 63, 23-29.
Leenheer J.A., 1981. Comprehensive approach to preparative isolation and fractionation of dissolved organic carbon from natural waters and wastewaters. Environ. Sci. Technol., 15(5), 578-587.
Milne C.J., Kinniburgh D.J. & Tipping E., 2001. Generic NICA-donnan model paramaters for proton binding by humic substances. Environ. Sci. Technol., 35, 2049-2059.
Mora V. et al., 2012. The humic acid-induced changes in the root concentration of nitric oxide, IAA and ethylene do not explain the changes in root architecture caused by humic acid in cucumber. Environ. Exp. Bot., 76, 24-32.
Muscolo A. et al., 2007. The auxin-like activity of humic substances is related to membrane interactions in carrot cell cultures. J. Chem. Ecol., 33, 115-129.
Muscolo A., Sidari M., Logoteta B. & Panuccio M.R., 2010. Carboxyl and phenolic humic fractions alter the root morphology in Arabidopsis thaliana seedlings. Fresenius Environ. Bull., 19, 3146-3159.
Muscolo A., Sidari M. & Nardi S., 2013. Humic substance: relationship between structure and activity. Deeper information suggests univocal findings. J. Geochem. Explor., 129, 57-63.
Nanny M.A. & Ratasuk N., 2002. Characterization and comparison of hydrophobic neutral and hydrophobic acid dissolved organic carbon isolated from three municipal landfill leachates. Wat. Res., 36, 1572-1584.
Nardi S. et al., 2007. Relationship between molecular characteristics of soil humic fractions and glycolytic pathway and krebs cycle in maize seedlings. Soil Biol. Biochem., 39(12), 3138-3146.
Nardi S., Carletti P., Pizzeghello D. & Muscolo A., 2009. Biological activities of humic substances. In: Senesi N., Xing B. & Huang P.M., eds. Biophysico-chemical processes involving natural nonliving organic matter in environmental systems. Hoboken, NJ, USA: John Wiley & Sons, 305-339.
Nasir S. et al., 2011. Structural elucidation of humic acids extracted from Pakistani lignite using spectroscopic and thermal degradative techniques. Fuel Process. Technol., 92, 983-991.
Newcombe G., Drikas M., Assemi S. & Beckett R., 1997. Influence of characterised natural organic material on activated carbon adsorption: I. Characterisation of concentrated reservoir water. Wat. Res., 31(5), 965-972.
Piccolo A., 2002. The supramolecular structure of humic substances. A novel understanding of humus chemistry and implications in soil science. Adv. Agron., 75, 57-134.
Pizzeghello D. et al., 2013. Isopentenyladenosine and cytokinin-like activity of different humic substances. J. Geochem. Explor., 129, 70-75.
Preuße G., Friedrich S. & Salzer R., 2000. Retention behavior of humic substances in reversed phase HPLC. Fresenius J. Anal. Chem., 368, 268-273.
Quaggiotti S. et al., 2004. Effect of low molecular size humic substances on the expression of genes involved in nitrate transport and reduction in maize (Zea mays L.). J. Exp. Bot., 55, 803-813.
Rubio V. et al., 2009. Plant hormones and nutrient signaling. Plant Mol. Biol., 4, 361-373.
Schiavon M. et al., 2010. High molecular size humic substances enhance phenylpropanoid metabolism in maize (Zea mays L.). J. Chem. Ecol., 36, 662-669.
Schmidt W. et al., 2005. Water-extractable humic substances as nutrient acquisition signals for root hairs development in Arabidopsis. In: Hartmann A., Schmid M., Wenzel W. & Hinnsinger P., eds. Rhizosphere 2004 - Perspectives and Challenges. Neuherberg, Germany: GSF-Berich, 71.
Schmidt W., Santi S., Pinton R. & Varanini Z., 2007. Water-extractable humic substances alter root development and epidermal cell pattern in Arabidopsis. Plant Soil, 300, 259-267.
Stevenson F.J., 1994. Humus chemistry. Genesis, composition, reactions. 2nd ed. New York, USA: John Wiley & Sons.
Sze H., Li X. & Palmgren M.G., 1999. Energization on plant cell membranes by H+Pumping ATPases: regulation and biosynthesis. Plant Cell, 11, 677-689.
Thonart Ph., Steyer E., Drion R. & Hiligsmann S., 1998. La gestion biologique d’une décharge. Tribune Eau, 590/591, 3-12.
Trevisan S., 2010. A genomic approach for studying the biological activity of humic substances. Thèse de doctorat : Université de Padoue (Italie).
Trevisan S. et al., 2010. Humic substances induce lateral root formation and expression of the early auxin-responsive IAA19 gene and DR5 synthetic element in Arabidopsis. Plant Biol., 12, 604-614.
Trevisan S. et al., 2011. Humic substances affect Arabidopsis physiology by altering the expression of genes involved in primary metabolism, growth and development. Environ. Exp. Bot., 74, 45-55.
Verlinden G. et al., 2009. Application of humic substances results in consistent increases in crop yield and nutrient uptake. J. Plant Nutr., 32, 1407-1426.
Waksman S.A., 1936. Principles of soil microbiology. In: Humus. Origin, chemical composition and importance in mature. Baltimore, MD, USA: Williams & Wilkins Co.
Xiaoli C., Shimaoka T., Qiang G. & Youcai Z., 2008. Characterization of humic and fulvic acids extracted from landfill by elemental composition,13C CP/MAS NMR and TMAH-Py-GC/MS. Waste Manage., 28, 896-903.
Young C.C. & Chen L.F., 1997. Polyamines in humic acid and their effect on radical growth of lettuce seedlings. Plant Soil, 195, 143-149.
Zhang L. et al., 2009. Characterization and removal of dissolved organic matter (DOM) from landfill leachate rejected by nanofiltration. Waste Manage., 29, 1035-1040.





