- Portada
- volume 9 (2005)
- numéro 3
- Effet inhibiteur in vitro et in vivo du Trichoderma harzianum sur Fusarium oxysporum f. sp. radicis-lycopersici
Vista(s): 15007 (119 ULiège)
Descargar(s): 730 (10 ULiège)
Effet inhibiteur in vitro et in vivo du Trichoderma harzianum sur Fusarium oxysporum f. sp. radicis-lycopersici

Notes de la rédaction
Reçu le 15 septembre 2004, accepté le 12 mai 2005
Résumé
Les essais de confrontation directe, sur milieu de culture ou à distance, entre Fusarium oxysporum f. sp. radicis-lycopersici et Trichoderma harzianum ont révélé que ce dernier a pu inhiber la croissance mycélienne du F. oxysporum f. sp. radicis-lycopersici de plus de 65 % par rapport au témoin et ce après quatre jours d’incubation à 25 °C. De plus, au delà de cette période et au terme de six jours, le T. harzianum envahit les colonies de F. oxysporum f. sp. radicis-lycopersici sur lesquelles il sporule même, révélant ainsi son pouvoir hautement myco-parasitaire. Des résultats intéressants ont également été obtenus in vivo : en effet, le repiquage des plants de tomate dans un mélange de perlite inoculée par une suspension sporale de F. oxysporum f. sp. radicis-lycopersici et de T. harzianum a réduit l’incidence de la fusariose des racines et du collet comparativement aux plants repiqués uniquement dans de la perlite inoculée par le pathogène. Les plants repiqués dans de la perlite contenant le pathogène et l’antagoniste étudié, ne montrent aucune différence comparativement à ceux du témoin sain (non inoculé et non traité) ; mieux encore, les plants traités par le T. harzianum présentent une croissance végétative meilleure et un système racinaire vigoureux.
Abstract
In vitro and in vivo antagonistic effect of Trichoderma harzianum against Fusarium oxysporum f. sp. radicis-lycopersici. Tests of direct confrontation, on PDA medium or remote confrontation, between Fusarium oxysporum f. sp. radicis-lycopersici and Trichoderma harzianum, revealed that the latest has inhibited mycelial growth of the pathogen by more than 65% compared to the control and this after an incubation period of about four days at 25°C. Moreover, beyond this period and after six days, T. harzianum invades and also sporulates on F. oxysporum f. sp. radicis-lycopersici colonies revealing its high myco-parasitism. Some interesting results have also been obtained in vivo: indeed, transplantation of tomato seedlings in a mixture of perlite inoculated by F. oxysporum f. sp. radicis-lycopersici and T. harzianum reduced Fusarium crown and root rot incidence compared to seedlings planted in perlite only inoculated by the pathogen. Even better, seedlings planted in perlite containing the pathogen and the studied antagonist present a better vegetative growth and a vigorous root system compared to those of the healthy control (not inoculated and untreated).
Tabla de contenidos
1. Introduction
1Les Fusarium sont parmi les champignons telluriques les plus agressifs, causant des flétrissements et des pourritures sur de nombreuses espèces végétales cultivées.
2En dépit des pertes économiques qu’ils entraînent, le contrôle de ces pathogènes reste toujours limité à des mesures prophylactiques ; la désinfection du sol n’est jamais complète en raison d’une part, de la difficulté de sa réalisation (Benhamou et al., 1997) et d’autre part, à l’induction de souches résistantes.
3Dans le but de chercher d’autres alternatives de lutte contre ces champignons, entre autres par la lutte biologique, nous étudions dans ce travail l’interaction entre une espèce de Fusarium à savoir le F. oxysporum f. sp. radicis-lycopersici, signalé pour la première fois en Tunisie à l’exploitation “ Cinquième Saison ” durant la campagne 2000–2001 (El Mahjoub, communication personnelle, 2001 ; Hajlaoui et al., 2001), et un agent antagoniste actif en lutte biologique sur divers agents pathogènes : le Trichoderma harzianum (Elad et al., 1982 ; Daami-Remadi, El Mahjoub, 2001).
4Le présent travail consiste donc à étudier in vitro l’interaction entre F. oxysporum f. sp. radicis-lycopersici et T. harzianum et d’évaluer l’effet de ce dernier sur l’incidence de la maladie.
2. Matériels et méthodes
2.1. Matériels biologiques
5L’agent pathogène. Les isolats de Fusarium utilisés dans cette étude ont été obtenus à partir des plants de tomate présentant des symptômes de flétrissement et de pourriture du collet. Ces derniers ont été prélevés à l’exploitation “ Cinquième saison ” à Hammet Gabès où l’on pratique la culture de la tomate sous serres chauffées par les eaux géothermales.
6Ils ont été confirmés comme étant du Fusarium oxysporum f. sp. radicis-lycopersici Jarvis et Shoemaker (Hajlaoui et al., 2001 ; Hibar, 2002).
7Les isolats utilisés dans cette étude sont présentés dans le tableau 1.

8L’agent antagoniste. L’agent antagoniste utilisé pour lutter contre le F. oxysporum f. sp. radicis-lycopersici est le Trichoderma harzianum Rifai ; ce dernier a été isolé à partir d’un sol tunisien et il est cultivé sur PDA à 25 °C (Daami-Remadi, El Mahjoub, 2001).
9Les cultures utilisées pour ces essais sont âgées de 10 jours.
10Les cultivars de tomate. Les cultivars de tomate (Lycopersicon esculentum Mill. ‘Priscas’) à inoculer, sont choisis sur la base de leur résistance différentielle vis-à-vis des espèces et races de Fusarium oxysporum : Fusarium oxysporum f. sp. lycopersici Snyder et Hansen et de F. oxysporum f. sp. radicis-lycopersici (Benhamou et al., 1997).
11Les cultivars utilisés ainsi que leurs caractéristiques sont présentés dans le tableau 2.
2.2. Méthodologie de travail
12Activité antagoniste in vitro du T. harzianum vis-à-vis du F. oxysporum f. sp. radicis-lycopersici. L’activité antagoniste in vitro du T. harzianum a été étudiée selon deux méthodes.
13Confrontation par contact direct sur milieu de culture. Cette technique consiste à placer, dans la même boîte de Pétri contenant un milieu PDA, deux pastilles gélosées (6 mm de diamètre), l’une portant le T. harzianum et l’autre le F. oxysporum f. sp. radicis-lycopersici. Les deux pastilles sont placées suivant un axe diamétral à 3 cm et à équidistance du centre de la boîte (Figure 1A) ; les repiquages sont effectués en même temps (Benhamou, Chet, 1996).
14L’incubation est réalisée à 25 °C pendant six jours. Des notations concernant l’inhibition de la croissance diamétrale des colonies de F. oxysporum f. sp. radicis-lycopersici et leur envahissement par le mycélium du T. harzianum sont effectuées tous les deux jours. De plus, des observations microscopiques relatives à l’effet direct de l’agent antagoniste sur l’état du mycélium du F. oxysporum f. sp. radicis-lycopersici sont faites.
15Le témoin est constitué par un repiquage du pathogène au centre de la boîte.
16Confrontation à distance. Cette méthode consiste à repiquer l’antagoniste et le pathogène dans deux boîtes séparées ; par la suite, un assemblage est réalisé par superposition des deux boîtes, le Trichoderma en bas et le Fusarium en haut (Figure 1B).
17La jonction entre les deux boîtes est assurée par des couches de Parafilm afin d’éviter toute déperdition des substances volatiles (Daami-Remadi, El Mahjoub, 2001).
18Les conditions de culture sont identiques à celles de la confrontation par contact direct sur milieu de culture.
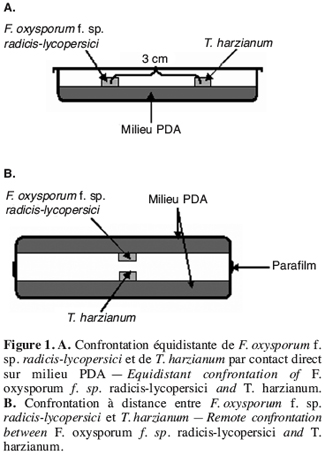
19Le témoin est formé par superposition de deux boîtes, celle du haut contenant une pastille de F. oxysporum f. sp. radicis-lycopersici, alors que celle du bas ne contient que le milieu PDA.
20La notation du diamètre moyen des colonies traitées est réalisée lorsque les filaments mycéliens atteignent la périphérie de la boîte dans les lots témoins.
21L’évaluation de l’inhibition exercée par T. harzianum est estimée par le calcul du pourcentage d’inhibition de la croissance mycélienne selon la formule suivante (Hmouni et al., 1996) :
22I (%) = (1- Cn/Co) x 100
23où
24Cn est le diamètre moyen des colonies en présence de l’antagoniste et Co le diamètre moyen des colonies témoins.
25Effet du T. harzianum sur l’expression de la maladie. Dans le but de tester l’effet antagoniste du T. harzianum sur F. oxysporum f. sp. radicis-lycopersici, un essai de lutte in vivo est mis en place, nécessitant les étapes suivantes.
26Multiplication du Fusarium. La multiplication de l’inoculum est réalisée dans des boîtes de Roux contenant chacune 600 cm3 de perlite et 200 ml de milieu PDB (Potato Dextrose Broth) préalablement autoclavés pendant 25 min sous une pression de 1 bar et une température de 120 °C, auxquelles nous avons ajouté 10 ml d’une culture liquide de F. oxysporum f. sp. radicis-lycopersici. Ces boîtes sont ensuite incubées à 25 °C pendant quatre semaines.
27Multiplication du Trichoderma. La multiplication du T. harzianum est réalisée de la même façon que pour le F. oxysporum f. sp. radicis-lycopersici, mais avec une durée d’incubation de trois semaines. Cela est expliqué par le fait que T. harzianum a une vitesse de croissance plus rapide que F. oxysporum f. sp. radicis-lycopersici.
28Préparation des plantules à inoculer. Les graines de chaque cultivar sont désinfectées superficiellement par trempage dans de l’éthanol absolu pendant cinq minutes, puis rincées abondamment à l’eau distillée stérile afin d’éliminer les restes de pesticides utilisés en traitement de semences (Benhamou et al., 1997).
29Après séchage, les graines sont mises aseptiquement dans des boîtes de Pétri stériles contenant des papiers filtres imbibés d’eau distillée stérile, à raison de 30 graines réparties uniformément sur toute la surface de la boîte ; la germination des graines est assurée suite à l’incubation de ces boîtes dans une étuve réglée à 20 °C pendant quatre à cinq jours.
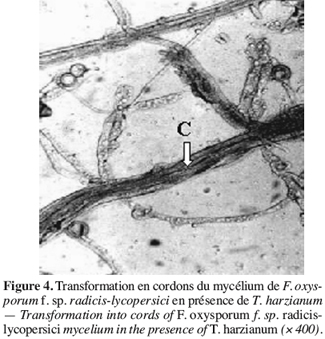
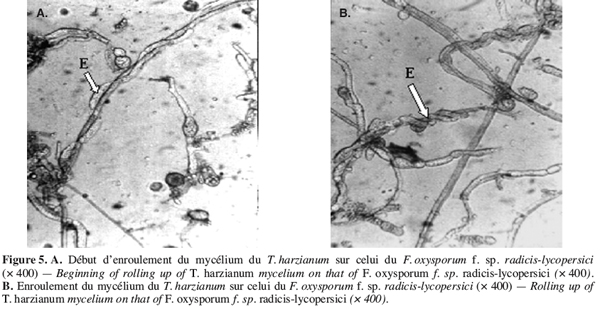
30Une fois celles-ci prégermées, le repiquage des graines est réalisé dans des plaques à alvéoles contenant de la tourbe préalablement désinfectée.
31L’élevage des plants est réalisé dans une cellule de serre vitrée sous une température d’environ 23 °C et une photopériode de 12 heures.
32Les plants sont irrigués régulièrement avec de l’eau distillée et fertilisés une fois par semaine à l’aide d’une solution nutritive dont la composition est la suivante : N : 150 ppm ; P : 50 ppm ; K : 150 ppm ; Ca : 150 ppm ; Mg : 30 ppm ; Fe : 3 ppm ; Mn : 1,5 ppm ; Zn : 0,20 ppm ; B : 0,4 ppm ; Cu : 0,1 ppm ; Mo : 0,05 ppm. L’élevage de ces plants a duré environ trois semaines.
33Traitement des plantules. Le repiquage des plantules de chaque cultivar de tomate est réalisé lorsque ces dernières atteignent le stade deux feuilles bien étalées (Woo et al., 1996).
34La transplantation des plantules est réalisée dans des sachets en polyéthylène (7,5 cm de diamètre et 12 cm de hauteur) remplis d’un mélange de 50 % de perlite inoculée par le T. harzianum et 50 % de perlite inoculée par le F. oxysporum f. sp. radicis-lycopersici.
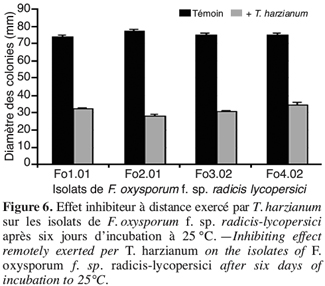
35Les plantules ainsi transplantées sont mises en croissance dans une cellule de serre vitrée sous une température d’environ 23 °C et une photopériode de 12 heures. Dix plants par traitement élémentaire ont été utilisés dans cet essai.
36Des plants de chaque cultivar de tomate transplantés dans de la perlite inoculée par le F. oxysporum f. sp. radicis-lycopersici ou dans de la perlite préalablement autoclavée ont servi respectivement de témoin inoculé non traité et de témoin sain.
37L’évaluation des symptômes est réalisée 30 jours après la transplantation des plantules (Woo et al., 1996) en se basant sur une échelle de notation de symptômes proposée par Vakalounakis et Fragkiadakis (1999) et qui comprend quatre valeurs allant de zéro à trois :
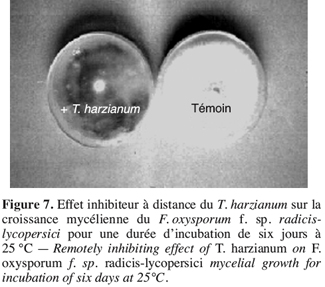
38– Zéro : plante saine,
39– Un : léger jaunissement, légère pourriture du pivot et des racines secondaires et pourriture du collet,
40– Deux : jaunissement important des feuilles avec ou sans flétrissement, rabougrissement des plantes, pourriture sévère du pivot et des racines secondaires, pourriture importante du collet et brunissement des vaisseaux de la tige,
41– Trois : mort de la plante.
42Sur base de ces notations, on a calculé l’indice de mortalité qui correspond à la moyenne des valeurs attribuées aux dix plants (nombre de répétition par traitement élémentaire). De plus le pourcentage des plants qui ont une notation des symptômes supérieure ou égale à deux est pris comme critère pour évaluer la sévérité des attaques de F. oxysporum f. sp. radicis-lycopersici.
3. Résultats et discussion
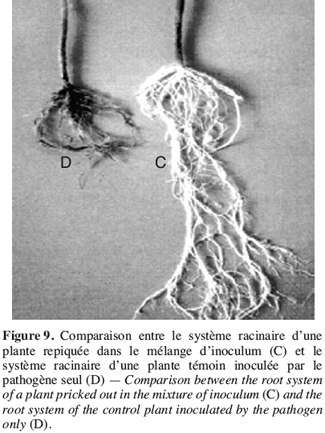
43Avant la mise en œuvre d’une stratégie de lutte contre les champignons phytopathogènes à l’aide de produits biologiques, il est nécessaire de connaître le comportement des agents antagonistes et leurs interactions avec le pathogène (Larkin, Fravel, 1999), c’est pourquoi un test d’activité antagoniste a été réalisé par confrontation entre T. harzianum et F. oxysporum f. sp. radicis-lycopersici.
3.1. Confrontation directe sur milieu de culture entre F. oxysporum f. sp. radicis-lycopersici et T. harzianum.
44Le repiquage simultané de T. harzianum et des isolats de F. oxysporum f. sp. radicis-lycopersici a montré une croissance plus rapide de T. harzianum que des isolats de F. oxysporum f. sp. radicis-lycopersici. Au bout de quatre jours d’incubation, la boîte est totalement envahie par l’antagoniste, alors que les isolats de F. oxysporum f. sp. radicis-lycopersici n’occupent qu’une surface de 20 mm de diamètre ; ce qui correspond à une inhibition de la croissance mycélienne supérieure à 65 %. Le témoin F. oxysporum f. sp. radicis-lycopersici cultivé seul occupe une surface d’environ 50 mm de diamètre (Figure 2).
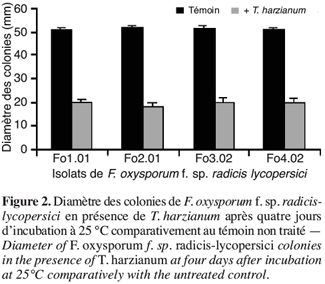
45Au delà de cette période et au terme de six jours, T. harzianum envahit les colonies de F. oxysporum f. sp. radicis-lycopersici et sporule même sur celles-ci, révélant ainsi son pouvoir hautement myco-parasitaire (Benhamou, Chet, 1996 ; Daami-Remadi, 2001 ; Daami-Remadi, El Mahjoub, 2001). L’envahissement du mycélium du pathogène par T. harzianum a également été observé par Benhamou et Chet (1997) en réalisant une confrontation directe sur milieu de culture entre cet antagoniste et un autre champignon tellurique, le Pythium ultimum et ce au bout de quatre à cinq jours après l’inoculation.
46Cependant, Daami-Remadi et El Mahjoub (2001) ont signalé, en testant l’activité antagoniste de T. harzianum vis-à-vis de deux espèces de Pythium, que pendant les trois premiers jours la boîte de Pétri est totalement envahie par Pythium spp. et que T. harzianum ne commence à exercer son activité antagoniste qu’à partir du 4e jour d’incubation.
47Des observations microscopiques réalisées au niveau de la zone de contact entre T. harzianum et F. oxysporum f. sp. radicis-lycopersici, montrent une modification profonde au niveau du mycélium du pathogène se marquant par une lyse importante (Figure 3), une transformation en cordons des filaments mycéliens (Figure 4) et un enroulement du mycélium du T. harzianum sur celui du F. oxysporum f. sp. radicis-lycopersici (Figures 5A et 5B).
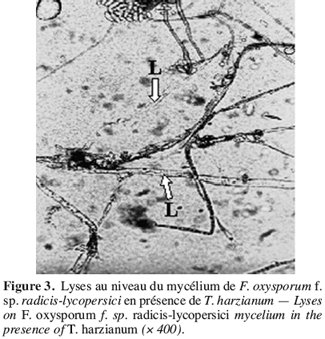
48Ce même isolat de T. harzianum a été testé par Daami-Remadi (2001) sur F. solani var coerulum, F. roseum var sambucinum et F. roseum var graminearum, responsables des pourritures sèches sur tubercules de pomme de terre envers lesquels ils induisent également une lyse importante au niveau du mycélium de ces pathogènes. Il en est de même des mycéliums de Pythium spp. en présence du même antagoniste (Daami-Remadi, El Mahjoub, 2001).
49Dans le même sens, Benhamou et Chet (1996) ont signalé une altération du mycélium de Sclerotinium rolfsii causée par T. harzianum, se traduisant par une agrégation, une rétraction et une vacuolisation du cytoplasme qui illustre bien le pouvoir hautement myco-parasitaire que possède T. harzianum.
50Des résultats similaires sont obtenus avec T. lignorum qui est capable de s’enrouler sur le mycélium du Rhizoctonia solani causant ainsi une dissolution du cytoplasme du pathogène (Howell, 2003).
3.2. Confrontation à distance entre FORL et T. harzianum
51Cette technique nous a permis de mettre en évidence l’effet inhibiteur même à distance du T. harzianum exercé sur les isolats de F. oxysporum f. sp. radicis-lycopersici ; cet effet est évalué par la mesure des diamètres des colonies de ce dernier cultivé en présence ou en absence de l’antagoniste.
52Les résultats obtenus (Figure 6) montrent une nette réduction du diamètre moyen des colonies de F. oxysporum f. sp. radicis-lycopersici en présence de T. harzianum par rapport au témoin non traité. Après six jours d’incubation à 25 °C, cette réduction atteint 48 mm pour l’isolat Fo2.01 traduisant une inhibition de l’ordre de 63 %.
53Dans ce même sens, Daami-Remadi (2001) a montré l’effet fortement antagoniste du même isolat de T. harzianum vis-à-vis des Fusarium responsables de la pourriture sèche sur des tubercules de pomme de terre. Cette inhibition était plus marquée (près de 93 %) si l’antagoniste était apporté sous forme d’une suspension de spores dans le milieu de culture.
54Dans le cas de Pythium spp. qui possède une vitesse de croissance plus importante que T. harzianum, cette inhibition n’était pas bien marquée, toutefois, une lyse plus ou moins importante est observée au niveau des filaments mycéliens du Pythium spp. (Daami-Remadi, El Mahjoub, 2001).
55Il ressort que, malgré l’absence d’un contact direct entre les isolats de Fusarium testés et T. harzianum, ce dernier a pu exercer une activité inhibitrice sur le développement des colonies de F. oxysporum f. sp. radicis-lycopersici (Figure 7). Ceci s’expliquerait par l’aptitude de Trichoderma à produire des substances volatiles qui sont capables de limiter et même de stopper le développement de l’agent pathogène.
56Des observations microscopiques réalisées au niveau du mycélium de F. oxysporum f. sp. radicis-lycopersici en présence de T. harzianum ont révélé la présence d’une lyse importante et une transformation en cordons du mycélium du pathogène et ce comparativement au témoin non traité. Cela confirme les observations de la confrontation directe illustrées aux figures 3 et 4.
57Ces résultats rejoignent ceux obtenus par Chérif et Benhamou (1990) qui ont signalé la présence d’altérations avec une perte cytoplasmique du mycélium de F. oxysporum f. sp. radicis-lycopersici suite à l’action du T. harzianum, malgré l’absence de contact direct entre les deux champignons.
3.3. Effet de T. harzianum sur l’incidence de la maladie.
58Le repiquage des plants de tomate dans un mélange de perlite inoculée par le F. oxysporum f. sp. radicis-lycopersici et par le T. harzianum a engendré une faible attaque de ces derniers ; en effet l’indice de mortalité, pour ces plants, n’a pas dépassé 0,2 et le pourcentage des plants ayant une notation des symptômes supérieure ou égale à deux est nul (Tableau 3).
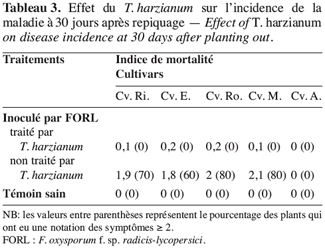
59Cependant, pour les plants repiqués uniquement dans de la perlite inoculée par le pathogène, cette valeur (Deux) est observée sur au moins 70 % des plants des cultivars sensibles.
60Mieux encore, l’observation de l’état des plants repiqués dans le mélange de perlite inoculée par le pathogène et par l’antagoniste, comparativement à ceux du témoin sain (non inoculé et non traité), montre que les plants traités par T. harzianum présentent un développement végétatif plus important (Figure 8).

61De même, la comparaison du système racinaire des plants traités par l’antagoniste et le pathogène à celui des plants témoins inoculés par le pathogène seul, montre une nette différence entre les deux (Figure 9). En effet, pour les plants traités avec le T. harzianum, le système racinaire se développe normalement et aucun brunissement ou pourriture ne sont observés.
62L’effet bénéfique du T. harzianum a été signalé aussi par Sivan et al. (1987) qui ont montré que l’enrobage des semences de tomate à l’aide de cet antagoniste a réduit de 80 % l’attaque de la fusariose des racines et du collet de la tomate. De plus l’application de T. harzianum dans le substrat de culture réduit significativement l’incidence de la maladie durant la saison de culture et par conséquent une augmentation significative (de 18,8 %) du rendement total est obtenue.
63Des résultats similaires ont été obtenus par Hjeljord et al. (2001), qui ont montré que l’application des conidies quiescentes de T. harzianum sur les fleurs de fraisier permettait la réduction de plus de 85 % des attaques de Botrytis cinerea à une température de 24 °C.
64Cet effet bénéfique est obtenu même en absence de tout agent pathogène. En effet, Windham et al. (1986) ont montré que l’addition de T. harzianum et de T. koningii à un sol préalablement autoclavé a augmenté le pourcentage de germination des semences de tomate et du tabac en le comparant au témoin et que l’application de ces deux espèces de Trichoderma au substrat de culture a amélioré le poids sec des racines ainsi que de la partie aérienne de ces deux espèces qui représentait 213 % à 291 % de celui du témoin non traité.
65Dans ce même sens, Yedidia et al. (1999) ont rapporté que l’application de T. harzianum à une culture hydroponique de melon a entraîné un meilleur développement des plants traités par rapport aux plants non traités par le Trichoderma. Cela s’explique par une activation du système de défense de la plante, une augmentation de l’activité chitinase et peroxidase et un accroissement de l’activité enzymatique dans les feuilles induisant ainsi une résistance systémique chez ces plants.
4. Conclusion
66Cette étude a montré l’effet nettement antagoniste du T. harzianum vis-à-vis du F. oxysporum f. sp. radicis-lycopersici, agent responsable de la pourriture des racines et du collet de la tomate.
67En effet, les essais de confrontations entre F. oxysporum f. sp. radicis-lycopersici et T. harzianum, que ce soit d’une façon directe sur milieu de culture ou bien à distance, ont révélé une inhibition de la croissance mycélienne du pathogène testé. S’il y a contact direct entre les deux champignons, T. harzianum envahit les colonies de F. oxysporum f. sp. radicis-lycopersici et y sporule même au bout de six jours d’incubation.
68Dans le cas de la confrontation à distance, malgré l’absence d’un contact direct entre les deux champignons, une réduction du diamètre des colonies de F. oxysporum f. sp. radicis-lycopersici est observée par rapport au témoin non traité, surtout pour l’isolat F02.01. Cela prouve qu’en plus de son pouvoir mycoparasitaire, T. harzianum peut agir par la sécrétion de substances volatiles qui sont capables de stopper à distance le développement de l’agent pathogène.
69L’apport de cet antagoniste au substrat de culture utilisé pour l’élevage des plants de tomate a empêché l’expression du F. oxysporum f. sp. radicis-lycopersici et par conséquent a fortement réduit l’incidence de la maladie.
70En effet, dans le cas des plants traités par le T. harzianum, l’indice de mortalité n’a pas dépassé 0,2. Mieux encore, l’addition de cet agent au substrat de culture a stimulé la croissance végétative des plants de tomate.
71En se basant sur ces résultats, il est d’intérêt primordial d’utiliser le T. harzianum en tant qu’agent de lutte biologique contre la fusariose des racines et du collet de la tomate causée par F. oxysporum f. sp. radicis-lycopersici d’autant plus que les produits chimiques actifs contre ce pathogène sont en nombre relativement réduit.
Bibliographie
Benhamou N., Chet I. (1996). Parasitism of sclerotia of Sclerotium rolfsii by Trichoderma harzianum: ultrastructural and cytochemical aspects of the interaction. Phytopathology 86, p. 405–416.
Benhamou N., Chet I. (1997). Cellular and molecular mechanisms involved in the interaction between Trichoderma harzianum and Pythium ultimum. Appl. Environ. Microbiol. 63, p. 2095–2099.
Benhamou N., Rey P., Cherif M., Hockenhull J., Tirilly Y. (1997). Treatment with the mycoparasite Pythium oligandrum triggers induction of defence-related reactions in tomato roots when challenged with Fusarium oxysporum f. sp. radicis-lycopersici. Phytopathology 87, p. 108–121.
Chérif M., Benhamou N. (1990). Cytochemical aspects of chitin breakdown during the parasitic action of a Trichoderma sp. on Fusarium oxysporum f. sp. radicis-lycopersici. Phytopathology 80, p. 1406–1414.
Daami-Remadi M. (2001). Lutte biologique contre les Fusarium spp. agents pathogènes responsables de la pourriture sèche des tubercules de pomme de terre. Mémoire de Diplôme d’études Approfondies en Protection des Plantes et Environnement. Tunisie : Ecole supérieure d’Horticulture et d’élevage de Chott Mariem, 72 p.
Daami-Remadi M., El Mahjoub M. (2001). Lutte biologique contre la pourriture aqueuse des tubercules de pomme de terre par Trichoderma harzianum. Ann. l’INRAT 74, p. 167–186.
Elad Y,. Chet I., Henis Y (1982). Degradation of plant pathogenic fungi by Trichoderma harzianum. Can. J. Microbiol. 28, p. 719–725.
Hajlaoui MR., Hamza N., Gargouri S., Guermech A. (2001). Apparition en Tunisie de Fusarium oxysporum f. sp. radicis-lycopersici, agent de la pourriture des racines et du collet de la tomate. OEPP/EPPO Bull. 31, p. 505–507.
Hibar K. (2002). La fusariose du collet et des racines de la tomate : pathogénicité et moyens de lutte. Mémoire de Diplôme d’études approfondies en Protection des Plantes et Environnement. Tunisie : Ecole supérieure d’Horticulture et d’élevage de Chott Mariem, 54 p.
Hjeljord GL., Stensvand A., Tronsmo A. (2001). Antagonism of nutrient-activated conidia of Trichoderma harzianum (atroviride) P1 against Botrytis cinerea. Phytopathology 91, p. 1172–1179.
Hmouni A., Hajlaoui MR., Mlaiki A. (1996). Résistance de Botrytis cinerea aux benzimidazoles et aux dicarboximides dans les cultures abritées de tomate en Tunisie. OEPP/EPPO Bull. 26, p. 697–705.
Howell CR. (2003). Mechanisms employed by Trichoderma species in the biological control of plant diseases: the history and evolution of current concepts. Plant Dis. 87, p. 4–10.
Larkin RP., Fravel DR. (1999). Mechanisms of action and Dose-Response relationships governing biological control of Fusarium wilt of Tomato by non-pathogenic Fusarium spp. Phytopathology 89, p. 1152–1161.
Sivan A., Ucko O., Chet I. (1987). Biological control of Fusarium crown rot of tomato by Trichoderma harzianum under field conditions. Plant Dis. 71, p. 587–592.
Vakalounakis DJ., Fragkiadakis GA. (1999). Genetic diversity of Fusarium oxysporum isolates from cucumber: differentiation by pathogenicity, vegetative compatibility and RAPD fingerprinting. Phytopathology 89, p. 161–168.
Windham MT., Elad Y., Baker R. (1986). A mechanism for increased plant growth induced by Trichoderma spp. Phytopathology 76, p. 518–521.
Woo SL., Zoina A., Del Sorbo G., Lorito M., Nanni B., Scala F., Noveiello C. (1996). Characterization of Fusarium oxysporum f. sp. phaseoli by pathogenic races, VCGs, RFLPs, and RAPD. Phytopathology 86, p. 966–972.
Yedidia I., Benhamou N., Chet I. (1999). Induction of defense responses in cucumber plants (Cucumis sativus L.) by biocontrol agent Trichoderma harzianum. Appl. Environ. Microbiol. 65, p. 1061–1070.





