- Home
- Volume 14 (2010)
- numéro spécial 2
- Détermination de la cellulose, des hémicelluloses, de la lignine et des cendres dans diverses cultures lignocellulosiques dédiées à la production de bioéthanol de deuxième génération
View(s): 13794 (215 ULiège)
Download(s): 1440 (22 ULiège)
Détermination de la cellulose, des hémicelluloses, de la lignine et des cendres dans diverses cultures lignocellulosiques dédiées à la production de bioéthanol de deuxième génération

Résumé
De nombreuses cultures lignocellulosiques sont actuellement testées à des fins de production de vecteurs énergétiques renouvelables tels que le bioéthanol de deuxième génération. L'efficience de la valorisation de ces cultures dépend en grande partie de leur culture, de leur teneur en principaux composés constitutifs (cellulose, hémicelluloses, lignine, cendres) et du procédé de production du bioéthanol de deuxième génération. Les cultures lignocellulosiques analysées dans notre étude sont les suivantes : le miscanthus (Miscanthus x giganteus J.M.Greef & Deuter ex Hodk. & Renvoize), le panic érigé (Panicum virgatum L.), la fétuque (Festuca arundinacea Schreb.), le sorgho fibre (Sorghum bicolor (L.) Moench), le maïs fibre (Zea mays L.), le mélange « dactyle-luzerne » (Dactylis glomerata L. – Medicago sativa L.) la consoude (Symphytum officinale L.), le topinambour (partie aérienne) (Helianthus tuberosus L.) et le chanvre (Cannabis sativa L.). Pour ces différentes espèces, les principaux composés constitutifs que sont la cellulose, les hémicelluloses et la lignine ont été déterminés par la méthode de Van Soest. Les cendres ont également été quantifiées. Les cultures lignocellulosiques avec le meilleur potentiel théorique de production de bioéthanol de deuxième génération en se basant sur leur composition chimique (en considérant que les rendements d'hydrolyse et de fermentation de la cellulose et des hémicelluloses sont égaux à 100 %) sont, par ordre décroissant, le miscanthus, le panic érigé, la fétuque, le sorgho fibre, le maïs fibre et le chanvre. Elles sont en effet composées de quantités élevées de cellulose et d'hémicelluloses et les quantités de lignine et de cendres y sont faibles. Une analyse en composantes principales a permis de mettre en évidence un clivage clair entre les espèces appartenant à la famille des monocotylédones comméniloïdes par rapport aux dicotylédones.
Abstract
Cellulose, hemicelluloses, lignin, and ash contents in various lignocellulosic crops for second generation bioethanol production. Various green energy crops are available for the production of renewable energy vectors such as second generation bioethanol. The efficiency of the energy recovery potential of these lignocellulosic crops depends on the crop husbandry, their content of main components (cellulose, hemicelluloses, lignin, ash) and on the second generation bioethanol production process. The lignocellulosic crops investigated in this study are miscanthus (Miscanthus x giganteus J.M.Greef & Deuter ex Hodk. & Renvoize), switchgrass (Panicum virgatum L.), fescue (Festuca arundinacea Schreb.), fiber sorghum (Sorghum bicolor (L.) Moench), fiber corn (Zea mays L.), “cocksfoot-alfalfa” mixture (Dactylis glomerata L. – Medicago sativa L.), comfrey (Symphytum officinale L.), jerusalem artichoke (aerial part) (Helianthus tuberosus L.) and hemp (Cannabis sativa L.). The samples came from different energy crop trials and their content in cellulose, hemicelluloses and lignin was quantified using the Van Soest method. The ash content has also been quantified. The lignocellulosic crops with the best theoretical potential to produce second generation bioethanol based on their biochemical composition (with a yield of 100% for the hydrolysis and the fermentation of cellulose and hemicelluloses) are in decreasing order miscanthus, switchgrass, fescue, fiber sorghum, fiber corn and hemp. On one hand, these crops are composed of high amounts of cellulose and hemicelluloses and, on the other hand, the lignin and ash concentration are low. A principal component analysis showed that commeniloïd monocotyledonous and dicotyledonous lignocellulosic crops formed two differentiated categories.
Table of content
1. Introduction
1L'étude et la production d'énergies renouvelables telles que les biocarburants de deuxième génération, dont fait partie le bioéthanol de deuxième génération, s'inscrit dans le cadre de la directive européenne 2003/30/CE. Cette directive vise à ce que la part prise par les énergies renouvelables par rapport à la consommation totale d'énergie et à la consommation totale d'énergie de transport soit respectivement de 20% et de 10% d'ici à 2020. Le but poursuivi par l'Union européenne (Union européenne, 2003 ; Fernandez, 2009) en mettant en œuvre ces mesures est de :
2– réduire sa production de gaz à effet de serre,
3– garantir sa sécurité d'approvisionnement en énergie,
4– produire des sources énergétiques durables, compétitives et diversifiées,
5– créer de l'emploi, innover et être compétitive dans le domaine des énergies renouvelables.
6Le bioéthanol de deuxième génération est produit à partir de substrats non valorisables en alimentation humaine comme les cultures lignocellulosiques dédiées (miscanthus, panic érigé, fétuque, sorgho fibre, maïs fibre, mélange de « dactyle-luzerne », etc.). L'efficience de la valorisation énergétique de ces cultures dépend en grande partie de leur productivité et de leur dépendance/réponse vis-à-vis des intrants ; ceux-ci vont également conditionner la pression environnementale exercée par ces cultures. L'efficience énergétique dépend aussi des teneurs de la biomasse en principaux composés constitutifs (cellulose, hémicelluloses, lignine et cendres) et du procédé de production du bioéthanol de deuxième génération mobilisé.
7L'objectif poursuivi lors de la valorisation énergétique des cultures en biocarburants vise à optimiser le ratio existant entre l'énergie apportée par la production et l'utilisation de ces biocarburants, d'une part, et l'énergie nécessaire à la production de ces biocarburants, d'autre part, de même que le bilan des gaz à effet de serre et l'impact environnemental lié à la production et l'utilisation de ces biocarburants (Houghton et al., 2006).
8Dans le cas du bioéthanol de deuxième génération, l'efficience de la valorisation énergétique des cultures lignocellulosiques (c'est-à-dire le potentiel théorique de production de bioéthanol de deuxième génération) est améliorée par des teneurs élevées en cellulose et en hémicelluloses et par des teneurs basses en lignine pour les raisons suivantes (Carpita et al., 2000 ; Houghton et al., 2006) :
9– le bioéthanol provient de la fermentation des monosaccharides fermentescibles issus de l'hydrolyse de la cellulose et des hémicelluloses,
10– l'hydrolyse des polysaccharides structuraux est négativement affectée par la lignine qui imprègne le réseau de cellulose-hémicelluloses. Les composés dérivés de la lignine ont également une action inhibitrice sur les micro-organismes responsables de la fermentation.
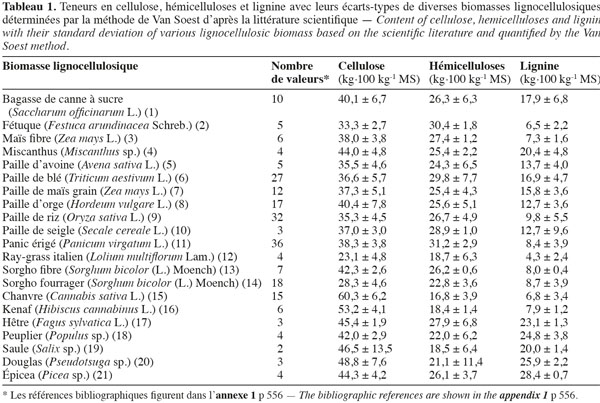
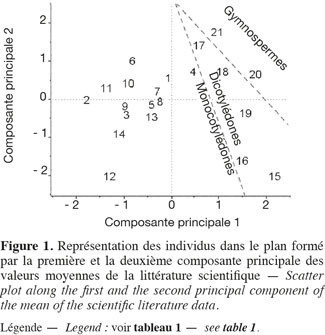
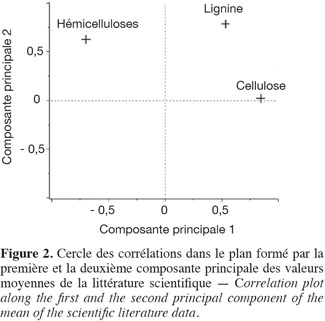
11Les teneurs moyennes en cellulose, en hémicelluloses et en lignine de diverses biomasses lignocellulosiques, déterminées par la méthode de Van Soest et al. (1985), disponibles dans la littérature scientifique, sont reprises dans le tableau 1. Les biomasses lignocellulosiques contiennent également, en moyenne, 5 à 10 % de protéines structurales (Vermerris, 2008). D'après le tableau 1, les teneurs en cellulose, en hémicelluloses et en lignine des biomasses lignocellulosiques sont variables tant entre espèces qu'au sein d'une même espèce, ce qui nécessite dès lors d'identifier les espèces les plus propices à la production de bioéthanol de deuxième génération ainsi que la conduite à appliquer à leur culture afin d'en optimiser la valorisation. L'analyse en composantes principales basée sur les teneurs en cellulose, en hémicelluloses et en lignine des valeurs moyennes de la littérature des cultures lignocellulosiques du tableau 1 est illustrée par la représentation des individus (Figure 1) et le cercle des corrélations (Figure 2) dans le plan formé par les première et deuxième composantes principales. Les scores au niveau de la première composante principale de cette analyse montre un clivage entre les espèces appartenant au groupe des monocotylédones comméniloïdes, des dicotylédones et des gymnospermes (Figure 1). D'après le cercle des corrélations dans le plan formé par la première et la deuxième composante principale (Figure 2), la teneur en cellulose, positivement corrélée avec cette première composante principale, explique le clivage des monocotylédones comméniloïdes par rapport aux dicotylédones et aux gymnospermes (Figure 1). Le miscanthus est la seule espèce monocotylédone située à la limite de ce clivage (Figure 1). La séparation entre les dicotylédones et les gymnospermes (Figure 1) s'explique par la teneur en lignine et en hémicelluloses d'après le cercle des corrélations dans le plan formé par la première et la deuxième composante principale (Figure 2). D'après ce cercle de corrélations, le clivage entre les dicotylédones herbacées et feuillues s'explique par la teneur en hémicelluloses (Figure 1).
12L'objectif de la présente étude est de déterminer et comparer à partir des teneurs en cellulose, en hémicelluloses, en lignine et en cendres le potentiel de production de bioéthanol de deuxième génération qui peut être attendu de différentes biomasses lignocellulosiques. Les biomasses suivantes ont été évaluées : miscanthus, panic érigé, fétuque, sorgho fibre, maïs fibre, mélange de « dactyle-luzerne », chanvre, topinambour (partie aérienne) et consoude. Ces espèces ont été cultivées, à l'exception du panic érigé, dans une zone de grandes cultures (Herchies, Belgique) dans des conditions pédoclimatiques caractéristiques de zones de moyenne-montagne (Libramont, Belgique) à 500 m d'altitude, conditions peu propices à la conduite de grandes cultures.
2. Matériel et méthodes
2.1. Matériel végétal
13Les cultures lignocellulosiques dont la composition chimique a été analysée dans cette étude sont le miscanthus (Miscanthus x giganteus J.M.Greef & Deuter ex Hodk. & Renvoize ; nombre d'échantillons (n) = 9), le panic érigé (Panicum virgatum L. ; n = 7), la fétuque (Festuca arundinacea Schreb. ; n = 26), le sorgho fibre (Sorghum bicolor (L.) Moench ; n = 16), le maïs fibre (Zea mays L. ; n = 21), un mélange de dactyle (Dactylis glomerata L.) et de luzerne (Medicago sativa L.) (n = 9), la consoude (Symphytum officinale L. ; n = 4), le topinambour (partie aérienne) (Helianthus tuberosus L. ; n = 14) et le chanvre (Cannabis sativa L. ; n = 15). Les cultures de sorgho fibre, de topinambour et de chanvre ont été récoltées à maturité en octobre, en 2007 et 2008, à Libramont, Belgique (49°55′N, 05°22′E ; altitude : 500 m ; température moyenne annuelle : 7,5 °C ; précipitation moyenne : 1 084 mm). Le maïs fibre et la consoude ont été récoltés, en 2008, sur ce même site. Le mélange dactyle-luzerne et la fétuque ont été récoltés, respectivement, en juillet 2007 et en mai 2009 sur ce même site. La culture de miscanthus a été réalisée en 2008 et récoltée, en sec, en mars 2009 sur ce même site. La culture de panic érigé a été réalisée en 2008 et récoltée, en sec, en mars 2009 à Herchies, Belgique (50°31′N, 03°51′E ; température annuelle moyenne : 9 °C ; précipitation moyenne : 772 mm). Les échantillons issus de ces récoltes ont été sèchés à 60 °C pendant 72 h et broyés par un broyage marteau (FOSS) avec une grille de 4 mm suivi d'un broyage à couteaux (Cyclotec, FOSS) avec une grille de 1 mm.
2.2. Analyses chimiques
14Les paramètres chimiques quantifiés sur tous les échantillons issus des cultures précitées sont les teneurs en cellulose, en hémicelluloses, en lignine par la méthode de Van Soest, en cendres et en matière sèche. Toutes les mesures ont été réalisées en double. Les résultats pour les différents paramètres chimiques sont exprimés par rapport à la matière sèche (MS). La matière sèche analytique a été mesurée dans une étuve ventilée à 103 °C ± 1 °C pendant 4 h. La teneur en cendres a été effectuée dans un four à moufle à 550 °C pendant 3 h. La cellulose, les hémicelluloses et la lignine ont été déterminées par la méthode de Van Soest (Van Soest et al., 1985) à partir du résidu insoluble au détergent neutre (NDF), du résidu insoluble au détergent acide (ADF) et du résidu insoluble au détergent acide et au H2SO4 72 % (p/p) (ADL). La teneur en cellulose est égale à l'ADF moins l'ADL, la teneur en hémicelluloses est égale au NDF moins l'ADF et la teneur en lignine est égale à l'ADL moins les cendres contenues dans l'ADL. Les composés chimiques qui ne sont ni de la cellulose, ni des hémicelluloses, ni de la lignine, ni des cendres sont appelés la fraction « autres ». Cette fraction est constituée de polysaccharides solubles (tels que les pectines, l'amidon et les fructanes), de sucres solubles, d'acides organiques, de protéines, de lipides et de lignine soluble au détergent acide et au H2SO4 72 % (p/p). Dans le cas du maïs fibre, de la fétuque et du mélange « dactyle-luzerne », les paramètres chimiques ont été prédits par spectrométrie dans le proche infrarouge (NIRSytem 5000, FOSS). La distance de Mahalanobis (H) des échantillons analysés par rapport à la base de référence était toujours inférieure à 3, ce qui souligne la validité de l'analyse (Shenk et al., 1991).
2.3. Analyses statistiques
15Une analyse de la variance suivie d'une comparaison multiple de Tukey-Kramer (avec α = 0,05) a été effectuée entre les moyennes des cultures lignocellulosiques pour chaque paramètre mesuré (cellulose, hémicelluloses, lignine et cendres) (Dagnelie, 2006). Une analyse en composantes principales et de corrélation entre les paramètres mesurés a été réalisée (Bertrand et al., 2008). Les analyses statistiques ont été réalisées avec le logiciel JMP 7.0.1 de SAS.
3. Résultats et discussion
3.1. Composition chimique des cultures lignocellulosiques
16Les résultats pour les teneurs en cellulose, en hémicelluloses, en lignine par la méthode de Van Soest et en cendres des cultures lignocellulosiques sont repris au tableau 2. Le miscanthus possède moins de lignine, le sorgho fibre a un profil plus proche du sorgho fourrager que du sorgho fibre, le maïs fibre possède moins de cellulose et le chanvre possède moins de cellulose et d'hémicelluloses par rapport aux teneurs des constituants pariétaux des biomasses lignocellulosiques de la littérature scientifique (Tableau 1). L'analyse de la variance pour les teneurs en cellulose, en hémicelluloses, en lignine et en cendres des cultures lignocellulosiques sont très hautement significativement différentes (p < 0,001) pour chaque paramètre mesuré. Les résultats pour la comparaison multiple de Tukey-Kramer qui a été réalisée entre les moyennes des cultures lignocellulosiques pour chaque paramètre mesuré (cellulose, hémicelluloses, lignine, cendres) sont les suivants :
17– chacun des ensembles miscanthus – chanvre, sorgho fibre – « dactyle-luzerne » et « dactyle-luzerne » – maïs fibre ne présente pas des teneurs significativement différentes en cellulose (Tableau 2).
18– chacun des ensembles miscanthus – fétuque – sorgho fibre et sorgho fibre – maïs fibre ne présente pas des teneurs significativement différentes en hémicelluloses (Tableau 2).
19– chacun des ensembles miscanthus – chanvre, chanvre – panic érigé – consoude, fétuque – « dactyle-luzerne » et « dactyle-luzerne » – maïs fibre – sorgho fibre ne présente pas des teneurs significativement différentes en lignine (Tableau 2).
20– chacun des ensembles fétuque – sorgho fibre – « dactyle-luzerne » – chanvre et panic érigé – maïs fibre ne présente pas des teneurs significativement différentes en cendres (Tableau 2).
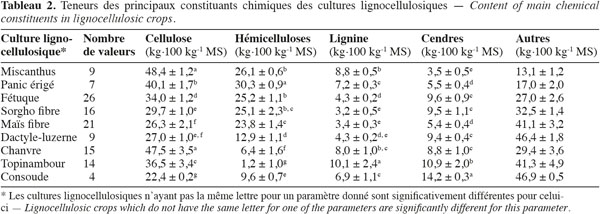
21L'amplitude de la différence entre les cultures lignocellulosiques sont plus grandes pour les teneurs en cellulose et en hémicelluloses que pour les teneurs en lignine et en cendres.
22Les cultures lignocellulosiques avec le meilleur potentiel théorique de production de bioéthanol de deuxième génération en se basant sur leur composition chimique (en considérant que les rendements d'hydrolyse et de fermentation de la cellulose et des hémicelluloses sont égaux à 100 %) sont principalement des monocotylédones comméniloïdes (le miscanthus, le panic érigé, la fétuque, le sorgho fibre, le maïs fibre) et une des dicotylédones (le chanvre). Ceci s'explique, d'une part, par le fait que pour ces cultures, la somme des teneurs en cellulose et en hémicelluloses est élevée et, d'autre part, la somme des teneurs en lignine et en cendres est basse. Afin d'affiner la prédiction du potentiel théorique de production de bioéthanol de deuxième génération et d'en optimiser le procédé de production, il est nécessaire de déterminer la composition monosaccharidique des hémicelluloses. L'importance de la nature monosaccharidique des hémicelluloses vient du fait que les hémicelluloses des espèces monocotylédones comméniloïdes sont principalement de type glucuronoarabinoxylane (hémicelluloses très riches en pentoses), alors que celles des espèces dicotylédones et monocotylédones non comméniloïdes sont principalement de type xyloglucane (hémicelluloses composées tant de pentoses que d'hexoses) (Carpita et al., 2000). Les hexoses issus des polysaccharides structuraux sont fermentés en éthanol avec des rendements supérieurs à 90 % du rendement de conversion théorique d'hexoses en éthanol (3 C6H12O6 → 6 C2H5OH + 6 CO2 ; 0,511 g d'éthanol par g d'hexose) alors que, jusqu'à présent, pour les pentoses issus des polysaccharides structuraux, ce rendement est inférieur à 90 % du rendement de conversion théorique de pentoses en éthanol (3 C5H10O5 → 5 C2H5OH + 5 CO2 ; 0,511 g d'éthanol par g de pentose) (Houghton et al., 2006). Les pentoses peuvent également être utilisés pour la production d'autres biocarburants, tels que le butanol et l'hydrogène. À ce jour, ces filières sont moins efficientes que celles de production d'éthanol à partir des pentoses mais elles ont encore une très grande marge de progression (Fortman et al., 2008).
23L'efficience de la valorisation énergétique des cultures lignocellulosiques en bioéthanol de deuxième génération dépend également de la productivité de ces cultures et de leur dépendance/réponse vis-à-vis des intrants ainsi que du procédé de production de bioéthanol de deuxième génération mis en œuvre (prétraitement, hydrolyse, fermentation, concentration de l'éthanol). La dépendance/réponse des cultures vis-à-vis des intrants va également conditionner la pression environnementale exercée par ces cultures.
3.2. Analyse en composantes principales et des corrélations des paramètres chimiques mesurés
24Les résultats de l'analyse en composantes principales des teneurs des principaux constituants chimiques des cultures lignocellulosiques sont illustrés par la représentation des individus (Figure 3) et le cercle des corrélations (Figure 4) dans le plan formé par les première et deuxième composantes principales des valeurs expérimentales. La représentation des individus (Figure 3) montre que, d'après les teneurs des principaux constituants chimiques, chaque espèce forme un groupe différencié, excepté dans le cas du maïs fibre et du sorgho fibre. La dispersion importante des individus pour le groupe du chanvre et du topinambour s'explique par une variabilité importante de la teneur en hémicelluloses due à la faible teneur en hémicelluloses de ces cultures. L'analyse en composantes principales montre que les espèces appartenant au groupe des dicotylédones sont séparées des monocotylédones comméniloïdes de par leurs scores au niveau de la première composante principale (Figure 3). D'après le cercle des corrélations dans le plan formé par la première et la deuxième composante principale (Figure 4), la teneur en hémicelluloses, négativement corrélée avec cette première composante principale, explique le clivage entre ces groupes. En effet, les dicotylédones ont des parois cellulaires riches en pectines et pauvres en hémicelluloses par rapport aux monocotylédones comméniloïdes, dont font partie les Poales, dont les parois cellulaires sont pauvres en pectines et riches en hémicelluloses (Carpita et al., 2000). Notons que le mélange « dactyle-luzerne » est un mélange de monocotylédones comméniloïdes et de dicotylédone. D'après la représentation des échantillons dans le plan formé par la première et la deuxième composante principale (Figure 3), cette culture est plus proche des monocotylédones comméniloïdes que des dicotylédones, ce qui souligne la plus grande richesse du mélange en dactyle qu'en luzerne.
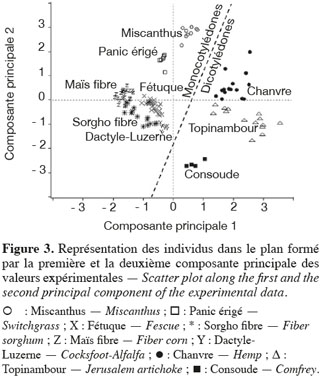
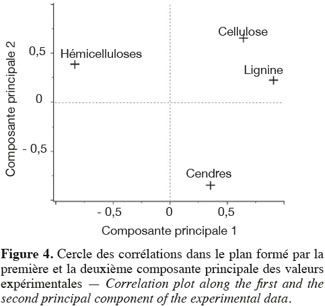
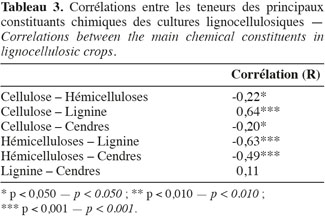
25Les résultats de l'analyse des corrélations entre les teneurs des principaux constituants chimiques des cultures lignocellulosiques sont illustrés au tableau 3. Cette analyse des corrélations fait ressortir une corrélation négative significative entre cellulose-hémicelluloses, hémicelluloses-lignine, hémicelluloses-cendres et une corrélation positive significative entre cellulose-lignine et cellulose-cendres. Ces corrélations sont confirmées par le cercle des corrélations dans le plan formé par la première et la deuxième composante principale (Figure 4) où elles sont également observées.
4. Conclusion
26Dans le cadre de la production de bioéthanol de deuxième génération, le miscanthus, le panic érigé, la fétuque, le sorgho fibre et le maïs fibre semblent particulièrement intéressants vu leurs teneurs élevées en cellulose et en hémicelluloses. Pour le chanvre, vu les faibles teneurs en hémicelluloses, seule la transformation de la cellulose en bioéthanol de deuxième génération est intéressante.
27Cependant, le choix de l'une ou l'autre de ces espèces sera modulé par leur capacité à former de la biomasse en mobilisant de faibles besoins en intrants, ce qui permettra d'accroître l'efficience énergétique et environnementale de ces cultures, ainsi que par leur capacité à être facilement conditionnée et transformée en bioéthanol (prétraitement et hydrolyse des polysaccharides structuraux, fermentation des monosaccharides, concentration de l'éthanol).
28Remerciements
29Les auteurs remercient D. Mahin pour son apport technique et le CRA-W pour le financement du projet BIOETHA2, ainsi que les fonds FEDER et la Région wallonne pour le financement du projet ENERBIOM.
Bibliographie
Bertrand D. & Dufour E., 2008. La spectroscopie infrarouge et ses applications analytiques. Paris : Éditions Tec & Doc Lavoisier.
Carpita N. & McCann M., 2000. The cell wall. In: Buchanan B., Gruissem W. & Jones R., eds. Biochemistry and molecular biology of plants. Rockville, IN, USA: American Society of Plant Physiologists, 52-108.
Dagnelie P., 2006. Statistiques théoriques et appliquées. 2. Inférence statistique à une et à deux dimensions. 2e éd. Bruxelles : Éditions De Boeck.
Fernandez M., 2009. Biorefineries in FP7: an European perspective. In: Fernandez M., ed. Actes des Sixièmes rencontres de la biomasse : le bioraffinage des matériaux lignocellulosiques, 21 October 2009, Gembloux, Belgique.
Fortman J. et al., 2008. Biofuel alternatives to ethanol: pumping the microbial well. Trends Biotechnol., 26(7), 375-381.
Houghton J., Weatherwax S. & Ferrell J., 2006. Breaking the biological barriers to cellulosic ethanol: a joint research agenda. In: Houghton J., Weatherwax S. & Ferrell J., eds. A research roadmap resulting from the biomass to biofuels workshop, 7-9 December 2005, Rockville, Maryland, USA.
Shenk J. & Westerhaus M., 1991. Population definition, sample selection and calibration procedures for near infrared reflectance spectroscopy. Crop Sci., 31, 469-474.
Union européenne, 2003. Directive 2003/30/CE du Parlement européen et du Conseil du 8 mai 2003 visant à promouvoir l'utilisation de biocarburants ou autres carburants renouvelables dans les transports. J. Off. Union Eur., L 123, 42-46.
Van Soest P. & Robertson J., 1985. Analysis of forages and fibrous foods. Ithaca, NY, USA: Department of Animal Science, Cornell University.
Vermerris W., 2008. Composition and biosynthesis of lignocellulosic biomass. In: Vermerris W., ed. Genetic improvement of bioenergy crops. New York, USA: Springer-Verlag, 89-142.
To cite this article
About: Bruno Godin
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Biomasse, Bioproduits et Énergies. Chaussée de Namur, 146. B-5030 Gembloux (Belgique). E-mail : b.godin@cra.wallonie.be – Université catholique de Louvain (UCL). Unité de Génie biologique. Croix du Sud, 2/19. B-1348 Louvain-la-Neuve (Belgique).
About: François Ghysel
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Biomasse, Bioproduits et Énergies. Chaussée de Namur, 146. B-5030 Gembloux (Belgique).
About: Richard Agneessens
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Technologies de la Transformation des Produits. Rue de Serpont, 100. B-6800 Libramont (Belgique).
About: Thomas Schmit
Centre wallon de Recherches agronomiques (CRA-W). Département Productions et Filières. Unité Stratégies phytotechniques. Rue du Bordia, 4. B-5030 Gembloux (Belgique).
About: Sébastien Gofflot
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Technologies de la Transformation des Produits. Rue de Serpont, 100. B-6800 Libramont (Belgique).
About: Stéphane Lamaudière
Université catholique de Louvain (UCL). Unité de Génie biologique. Croix du Sud, 2/19. B-1348 Louvain-la-Neuve (Belgique).
About: Georges Sinnaeve
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Technologies de la Transformation des Produits. Rue de Serpont, 100. B-6800 Libramont (Belgique).
About: Jean-Pierre Goffart
Centre wallon de Recherches agronomiques (CRA-W). Département Productions et Filières. Unité Stratégies phytotechniques. Rue du Bordia, 4. B-5030 Gembloux (Belgique).
About: Patrick A. Gerin
Université catholique de Louvain (UCL). Unité de Génie biologique. Croix du Sud, 2/19. B-1348 Louvain-la-Neuve (Belgique).
About: Didier Stilmant
Centre wallon de Recherches agronomiques (CRA-W). Département Agriculture et Milieu naturel. Unité Systèmes agraires, Territoires et Technologie de l'Information. Rue de Serpont, 100. B-6800 Libramont (Belgique).
About: Jérôme Delcarte
Centre wallon de Recherches agronomiques (CRA-W). Département Valorisation des Productions. Unité Biomasse, Bioproduits et Énergies. Chaussée de Namur, 146. B-5030 Gembloux (Belgique).





