- Home
- Volume 92 - Année 2023
- Numéro 1
- La caféine, une ressource naturelle renouvelable pour la synthèse de catalyseurs biosourcés
View(s): 2667 (62 ULiège)
Download(s): 94 (4 ULiège)
La caféine, une ressource naturelle renouvelable pour la synthèse de catalyseurs biosourcés

Attached document(s)
original pdf fileRésumé
Les catalyseurs interviennent dans de nombreux aspects de notre vie quotidienne mais leur véritable nature reste méconnue de la majorité du grand public. Cet article vise à expliquer ce que sont réellement les catalyseurs et à présenter certaines de leurs applications pratiques. Traditionnellement, les catalyseurs sont principalement issus de l'industrie pétrolière. Cet article met en lumière les principes de la chimie verte qui prônent l'utilisation de ressources respectueuses de l'environnement et leur application au domaine de la catalyse. Nous nous concentrons ici sur une partie des recherches menées au sein du Laboratoire de Catalyse de l'Université de Liège focalisées sur l'utilisation de la caféine comme matière première renouvelable pour la synthèse de catalyseurs biosourcés.
Abstract
Catalysts are involved in many aspects of our daily life, but their true nature remains unknown to the majority of the general public. This article aims to explain what catalysts really are and to present some of their practical applications. Traditionally, catalysts have mainly come from the petroleum industry. This article highlights the principles of green chemistry, which advocates the use of environmentally-friendly resources and their application to the field of catalysis. We focus here on part of the research carried out in the Laboratory of Catalysis at the University of Liège dealing with the use of caffeine as a renewable raw material for the synthesis of biobased catalysts.
Table of content
Manuscrit reçu le 29 mai 2023 et accepté le 30 octobre 2023
Publié selon les termes de la licence Creative Commons CC-BY 4.0
Cet article a reçu un des deux Prix Annuels 2023 de la Société Royale des Sciences de Liège. This paper was awarded one of the two Annual Prizes 2023 of the Société Royale des Sciences de Liège.
1. Introduction
1.1. Généralités sur la chimie organique
1La chimie organique est une branche de la chimie consacrée aux molécules à base de carbone. Elle est omniprésente dans notre quotidien et joue un rôle essentiel dans notre société moderne. Les polymères, tels que le plastique, les fibres synthétiques et les matériaux composites, sont des produits usuels issus de la chimie organique. Ils sont utilisés dans la fabrication de vêtements, de meubles, d'emballages, d'appareils électroniques et bien plus encore. La chimie organique permet également la synthèse de nombreuses molécules présentes dans les médicaments, les vitamines et les produits d’hygiène corporelle, contribuant ainsi à l'amélioration de notre santé et de notre bien-être. Elle est également cruciale dans le domaine de l'énergie, sujet d’actualité en cette période de réchauffement climatique. En effet, la chimie organique est étroitement liée à la recherche et au développement de nouvelles sources d'énergie, telles que les biocarburants et les cellules solaires organiques. Les combustibles fossiles que nous utilisons pour nos voitures et nos appareils de chauffage sont également des composés organiques. La chimie organique est nécessaire pour leur extraction, leur raffinage et leur transformation en divers carburants. Par ailleurs, la chimie organique joue un rôle central dans la protection de l'environnement. Elle est notamment impliquée dans de nombreuses technologies de dépollution, telles que les catalyseurs et les procédés de traitement des eaux usées. Ce sont aussi les innovations en chimie de synthèse qui permettent la création de matériaux respectueux de l'environnement, tels que les produits de nettoyage écologiques et les matériaux de construction durables.
2En résumé, bien que souvent perçue très négativement par l’opinion publique qui la considère polluante, l’industrie de la chimie organique est essentielle pour notre société. Elle joue un rôle clé dans la fabrication de produits du quotidien, dans le développement de nouvelles sources d'énergie, dans la protection de l'environnement et dans les avancées scientifiques et technologiques. Elle est omniprésente dans notre vie quotidienne, même si nous ne nous en rendons pas toujours compte. Des actions de sensibilisation et d’éducation du grand public aux enjeux de l’industrie chimique sont nécessaires pour faire comprendre qu’en plus d’être déjà présente dans tous les domaines, c’est d’elle que viendra en partie les solutions aux défis qui nous attendent pour lutter contre le réchauffement climatique, à travers l’innovation.
1.2. L’importance des catalyseurs au sein de notre société
3Les catalyseurs sont des substances qui participent à une réaction chimique sans être consommés par celle-ci. Ils agissent en abaissant l'énergie d'activation requise pour que la réaction se produise, conduisant ainsi à des cinétiques plus rapides dans des conditions moins contraignantes (température moins élevée, temps de chauffage plus court, …), ce qui permet entre autres des économies d’énergie. Les catalyseurs peuvent être utilisés dans une grande variété de processus allant de la production d'énergie à la fabrication de produits chimiques, en passant par la purification de l'air et de l'eau. Les catalyseurs jouent par exemple un rôle crucial dans la conversion et le stockage de l'énergie. Vous avez sans doute déjà entendu parler d’hydrogène comme source d’énergie, n’est-ce pas ? Mais savez-vous exactement com-ment s'effectue la transformation ? Eh bien, dans les piles à combustible, des catalyseurs permettent la réaction entre l'hydrogène et l'oxygène générant ainsi in fine de l'électricité avec une efficacité supérieure à celle des méthodes conventionnelles.[1] Certains panneaux photo-voltaïques qui convertissent l’énergie solaire en électricité contiennent eux aussi des catalyseurs indispensables à leur bon fonctionnement.[2]
4Dans l'industrie chimique, les catalyseurs sont utilisés pour faciliter la synthèse de produits chimiques complexes à partir de matières premières simples. Ils permettent à la fois d'optimiser les rendements de production, de minimiser la formation de déchets et d'écono¬miser des ressources précieuses. Par exemple, dans l'industrie pétrochimique, les catalyseurs sont utilisés pour convertir le pétrole brut ou le gaz naturel en produits tels que les polymères, les carburants et les composés chimiques de spécialité.[3] De plus, dans l'industrie pharma-ceutique, les catalyseurs sont essentiels pour la synthèse de nombreux médicaments, accélérant les réactions et permettant la production à grande échelle de précieuses substances biologiquement actives.[4]
5En dehors de l'énergie et de l'industrie chimique, les catalyseurs jouent également un rôle crucial dans d'autres domaines. Dans l'industrie automobile, par exemple, ils sont à la base des pots catalytiques utilisés pour réduire les émissions de gaz polluants provenant des moteurs à combustion interne.[5] En matière de protection de l'environnement, les catalyseurs sont utilisés pour le traitement des eaux usées et la dégradation des polluants.[6]
6En conclusion, les catalyseurs jouent un rôle essentiel dans de nombreux domaines scientifiques et industriels. Leur faculté d'accélérer les réactions chimiques et d'améliorer l'efficacité des processus de transformation des matières premières leur confère une très grande utilité et contribuent de manière significative aux progrès technologiques et au développement durable. Vous n’êtes toujours pas convaincu de l'intérêt des catalyseurs ? Sachez simplement que de nombreux prix Nobel ont récompensé des chimistes pour leur travaux concernant la catalyse ! Le dernier en date étant celui attribué en 2021 à Benjamin List et David MacMillan pour leurs travaux sur l’organocatalyse asymétrique.[7]
7Mais comment sont créés les catalyseurs ? Quelles sont leurs structures chimiques ? Sont-ils élaborés à partir de ressources renouvelables ? Et si non, est-il possible de les synthétiser de manière plus « verte » ? Est-il possible de valoriser des substances naturelles et renouvelables, peu chères et abondantes pour en faire des catalyseurs ? Nous allons répondre à toutes ces questions dans cet article.
2. Caractéristiques, synthèse et applications des catalyseurs
8De nombreux catalyseurs sont constitués à partir de métaux nobles, tels que le palladium, le platine, le ruthénium, le rhodium ou l’or. En particulier, les catalyseurs à base de palladium et de ruthénium jouent un rôle crucial en chimie organique. Les premiers sont utilisés dans de nombreuses réactions de couplage, telles que les couplages croisés de Suzuki-Miyaura et les couplages de Heck.[8] Ces réactions permettent de créer de nouvelles liaisons carbone-carbone entre deux composés organiques, ouvrant ainsi la voie à la synthèse de molécules complexes difficilement accessibles autrement. Les couplages de Suzuki-Miyaura s'effectuent généra-lement entre un acide boronique et un halogénure d’aryle pour conduire à la formation de biaryles (Figure 1). Ces réactions font partie des transformations les plus fréquemment utilisées par l’industrie pharmaceutique.[9] Akira Suzuki a d’ailleurs été récompensé du Prix Nobel de Chimie en 2010, conjointement avec Richard F. Heck et Ei-ichi Negishi.[7]
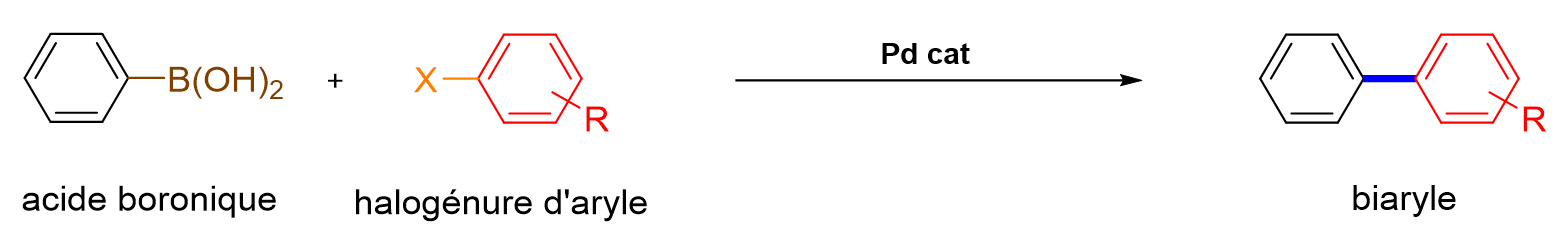
Figure 1. Réaction de couplage de Suzuki-Miyaura
9Des catalyseurs à base de palladium et de ruthénium sont aussi utilisés dans les réactions d'hydrogénation, où de l'hydrogène est ajouté à des substrats organiques, ce qui permet de transformer certains groupements chimiques en d’autres grâce à des réactions dites de réduction.[8,10] Certains catalyseurs permettent des réactions d'hydrogénation sélectives, rapides et efficaces conduisant à la synthèse de composés clés pour l'industrie pharmaceutique, la synthèse organique et la chimie des matériaux.
10Enfin, les catalyseurs de palladium et de ruthénium trouvent des applications en synthèse asymétrique pour préparer des composés chiraux de haute pureté énantiomérique.[8,10] La chiralité est extrêmement importante dans les médicaments car elle peut influencer leur activité biologique et leur interaction avec les récepteurs cellulaires. Les molécules chirales existent sous deux formes dites énantiomères, qui sont des images l'une de l'autre dans un miroir et non-superposables. Chaque énantiomère peut avoir des effets biologiques extrême¬ment différents. Par conséquent, la séparation et l'utilisation de la forme chirale appropriée peuvent optimiser l'efficacité et surtout la sécurité des médicaments, comme l'a montré l'exemple tragique de la thalidomide. Dans les années 1950 et 1960, cette molécule chirale a été commercialisée sous forme de mélange racémique, c'est-à-dire contenant les deux énantio-mères en proportions identiques, comme sédatif et pour le traitement des nausées matinales chez les femmes enceintes (Figure 2). L'énantiomère R était efficace pour soulager les nausées. Malheureusement, l'énantiomère S s'est avéré être la cause d'effets tératogènes graves, provoquant des malformations congénitales chez les nouveau-nés.[11]
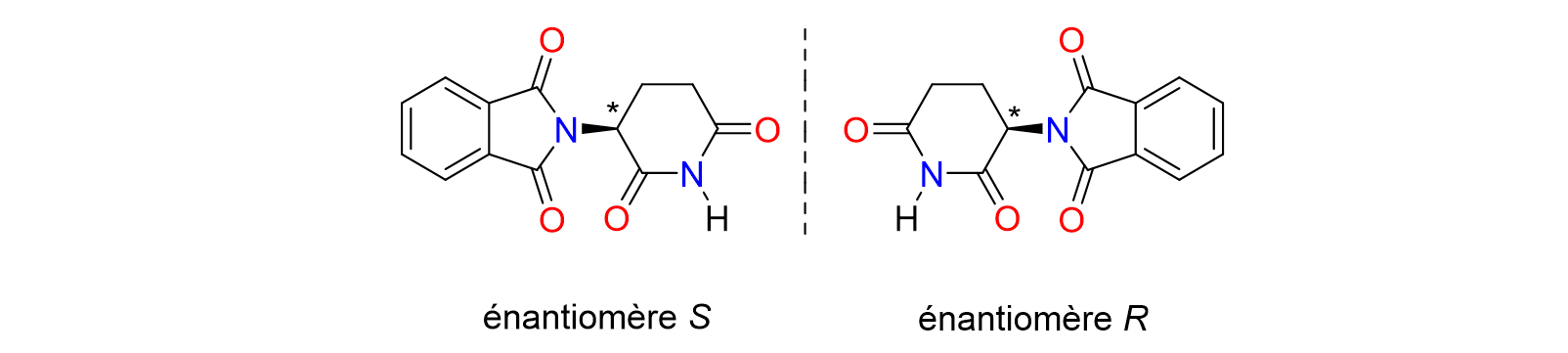
Figure 2. Les deux énantiomères de la thalidomide
11Les dommages causés par la thalidomide ont mis en évidence l'importance cruciale de la chiralité dans les médicaments. La séparation et l'utilisation spécifique de l'énantiomère souhaité peuvent faire la différence entre des propriétés thérapeutiques bénéfiques et des effets indésirables graves. Depuis cette catastrophe, des réglementations plus strictes ont été mises en place pour garantir la caractérisation et le contrôle de la chiralité dans le développement et la commercialisation des médicaments. La séparation de deux énantiomères étant souvent fastidieuse [12], des voies de synthèses permettant de former uniquement un seul d'entre eux sont très recherchées. On parle alors de synthèse asymétrique. Les catalyseurs peuvent, dans certains cas spécifiques, faciliter la synthèse de molécules chirales complexes de manière énantiosélective très efficace.
12En résumé, les catalyseurs sont d'une importance capitale en chimie organique. Leur utilisation dans de nombreuses réactions notamment en synthèse asymétrique permet de produire des composés chimiques clés dans divers domaines industriels avec des rendements et des sélectivités remarquables.
2.1. Quelles sont les propriétés des « bons catalyseurs » ?
13Les catalyseurs sont intéressants lorsqu’ils possèdent une activité élevée, c’est-à-dire qu’une seule molécule de catalyseur doit permettre de convertir un maximum de substance de départ (appelée substrat) en produit. Il est évident qu’un catalyseur permettant de convertir seulement une dizaine de molécules de substrat est intéressant mais qu’un autre permettant d’en convertir un million est bien meilleur ! La sélectivité est également une caractéristique essentielle des catalyseurs. En effet, il est fréquent que des sous-produits soient formés lors d’une transformation chimique (Figure 3). La sélectivité de la réaction envers le composé d’intérêt est donc cruciale. Par exemple, si on souhaite convertir A en B (produit d’intérêt) et qu’un catalyseur permet de convertir toutes les molécules de A en produits B ou C, C étant un sous-produit indésirable, son activité sera bonne. Toutefois, si le produit majoritaire en fin de réaction est C et non B, sa sélectivité sera (très) mauvaise. Par conséquent, les catalyseurs avec une activité élevée mais une mauvaise sélectivité présentent peu d’intérêt.
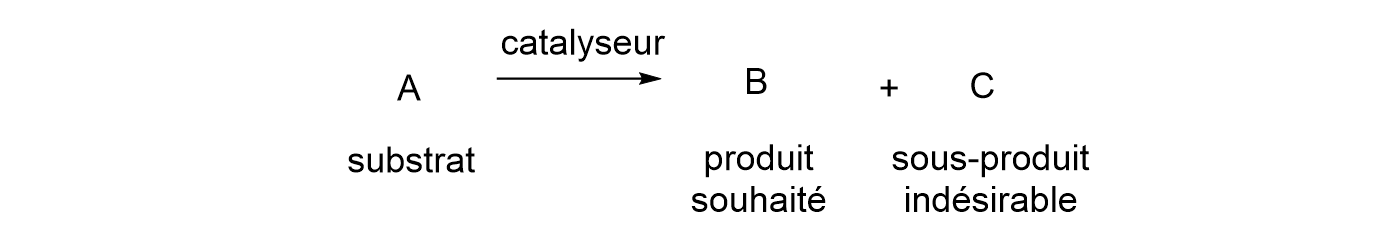
Figure 3. Schéma d’une réaction chimique impliquant un catalyseur
14D’autres caractéristiques sont également à prendre en considération pour évaluer l'attrait d'un catalyseur. Par exemple, leur recyclabilité ou la facilité avec laquelle ils peuvent être séparés des réactifs et des produits en fin de réaction. A cet égard, les catalyseurs dits hétérogènes sont particulièrement appréciés de l’industrie car ils permettent de réduire les coûts de production. Enfin, on peut également citer la possibilité de synthétiser les catalyseurs avec des méthodes respectueuses de l’environnement.
2.2. Voies de synthèse usuelles des catalyseurs
15Nous allons maintenant aborder les procédés de synthèse des catalyseurs et rentrer dans des détails un peu plus techniques. Nous nous intéresserons plus particulièrement aux catalyseurs de type PEPPSI pour « Pyridine-Enhanced Precatalyst Preparation, Stabili¬zation and Initiation ». Ces complexes à base de palladium ont été découverts dans les années 2010 et se sont imposés comme catalyseurs de choix pour les réactions de couplage car ils possèdent une activité catalytique élevée dans des conditions aérobiques. De plus, comme ils sont stables à l’air, leur conservation et leur stockage s'en trouvent facilitées.[13]
16Les catalyseurs de type PEPPSI sont constitués d’un atome de palladium entouré de ligands. Le terme ligand désigne toutes les molécules et les ions qui sont attachées à un métal. Dans le cas des catalyseurs PEPPSI, les ligands sont deux ions halogénures (en général des chlorures), une molécule de pyridine et un carbène N-hétérocyclique (N-Heterocyclic Carbene ou NHC en anglais). Chaque ligand joue un rôle spécifique dans l'activité du catalyseur mais c’est le ligand NHC que l’on peut modifier le plus aisément pour ajuster la réactivité et la sélectivité du centre métallique. En modifiant la taille du ligand ou la nature de ses groupements fonctionnels, on peut en effet moduler ses propriétés stériques et/ou électro¬niques. C’est le principe de l’ingénierie catalytique.
17Des complexes de ruthénium contenant des ligands NHC ont aussi été synthétisés dès la fin des années 1990 et se sont révélés extrêmement efficaces pour catalyser une réaction appelée la métathèse des oléfines. Cette réaction est remarquable car elle permet la formation de polymères et joue également un rôle essentiel dans la synthèse de certains médicaments.[16] Les travaux de Robert H. Grubbs, Yves Chauvin et Richard R. Schrock sur la métathèse des oléfines ont été récompensés par l’attribution du Prix Nobel de Chimie en 2005.[7]
18Le nombre de publications contenant les termes « N-Heterocyclic Carbene » a littéralement explosé à partir des années 2000 suite à la découverte de nombreux complexes porteurs de ligands NHC présentant une activité catalytique extrêmement élevée. Une centaine d’articles consacrés aux NHCs ont été publié en l’an 2000 alors que l’année dernière, en 2022, il y en a eu quasiment 7000 (Figure 4).[15]
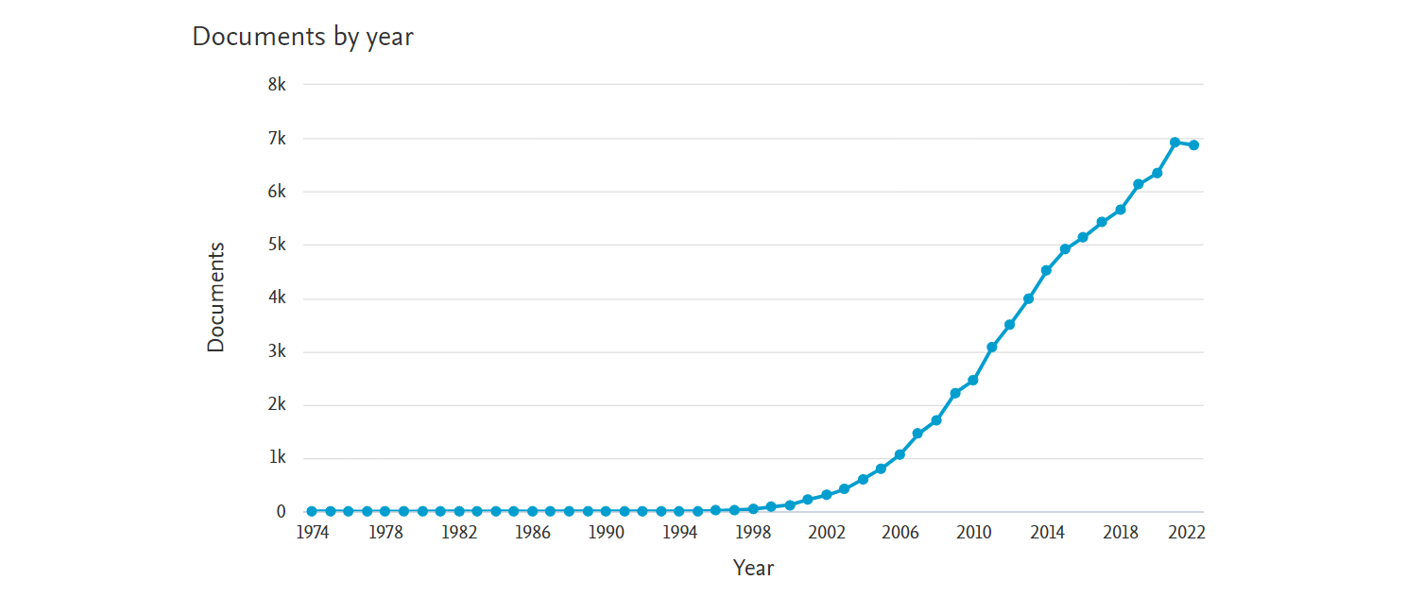
Figure 4. Evolution du nombre d’utilisation des termes « N-Heterocyclic Carbene »
dans les articles de recherche au fil du temps
19Vous l’aurez compris, la catalyse repose aujourd’hui grandement sur les ligands de type NHC. C’est donc la synthèse de ces derniers qui va nous intéresser. En effet, avant d’accrocher ces ligands au métal, il est nécessaire de les synthétiser en plusieurs étapes, ce qui, dans certains cas, peut être long et fastidieux et implique souvent l'utilisation de réactifs peu respectueux de l’environnement. Nous allons résumer brièvement les principales étapes de ces synthèses en utilisant des termes un peu techniques et en essayant de ne pas trop rentrer dans les détails. Nous limiterons notre discussion au cas des NHCs les plus courants obtenus à partir de sels d’imidazolium ou d’imidazolinium.
20Les sels d'imidazolium sont préparés en mélangeant deux équivalents d'un réactif de la famille des amines et un équivalent d'un autre composé appelé le glyoxal. La réaction aboutit à la formation d'une diimine. Cet intermédiaire peut ensuite être cyclisé facilement au cours d'une réaction d’électrocyclisation passant par un dipôle-1,5 pour donner le sel d'imidazolium final qui peut être isolé et purifié (Figure 5).[17]
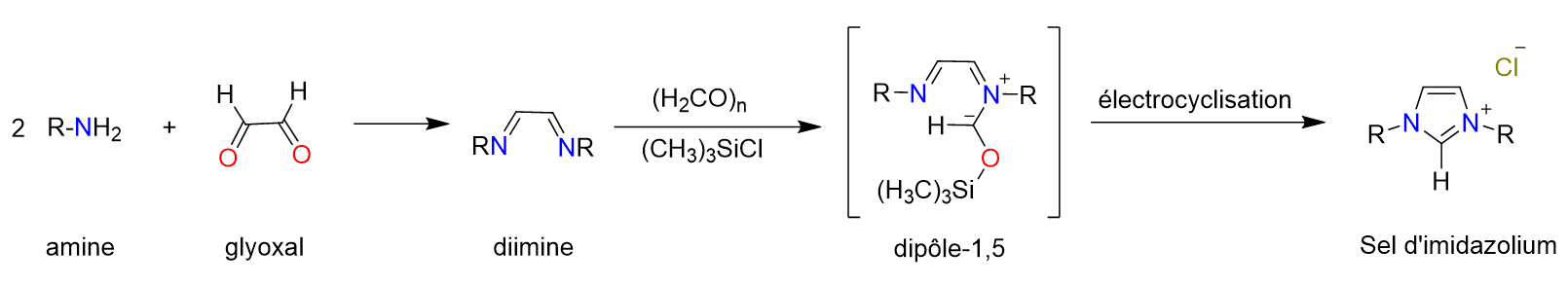
Figure 5. Schéma de synthèse usuel de sels d’imidazolium
21La synthèse de sels d’imidazolinium est assez similaire à celle des sels d'imidazolium puisqu'elle débute également par la formation d'une diimine mais cette fonction est ensuite réduite en fonction amine avec du NaBH4 pour donner un composé appelé sel de diammonium après acidification du milieu par de l'acide chlorhydrique. Une dernière étape de cycli-sation aboutit au produit désiré (Figure 6).[18]
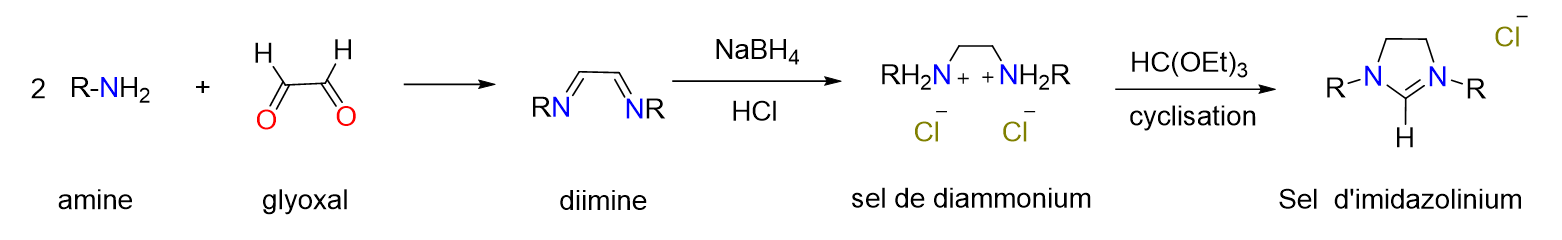
Figure 6. Schéma de synthèse usuel de sels d’imidazolinium
22La différence principale entre les sels d'imidazolium et ceux d'imidazolinium réside dans la présence ou non d'une double liaison carbone-carbone au sein de leur hétérocycle. Cette petite différence sur le papier peut induire de grandes variations d’activité catalytique des complexes portant ces ligands. Les groupements R situés sur les atomes d’azote du produit final sont ceux déjà présents sur l’amine de départ. Leur sélection judicieuse par le chimiste permet de changer les propriétés des NHCs. Une limitation des deux méthodes de synthèse présentées ci-dessus est qu'elles conduisent à des produits symétriques porteurs de deux groupements R identiques. D'autres stratégies ont toutefois émergé pour préparer des sels d’imidazol(in)ium avec des groupements R différents, ce qui offre davantage de possibilités pour affiner leurs propriétés stériques et électroniques.[19]
2.3. La chimie « verte », qu’est-ce que c’est ?
23La chimie verte, également connue sous le nom de chimie durable ou chimie écolo-giquement responsable, est une branche de la chimie qui vise à concevoir des produits chimiques et des procédés respectueux de l'environnement, sûrs pour la santé humaine et économiquement viables. Le concept de chimie verte a été introduit dans les années 1990. Son objectif principal est de réduire ou d'éliminer les substances chimiques dangereuses intervenant dans les formulations et les procédés de fabrication, tout en minimisant les déchets toxiques générés. La chimie verte se concentre aussi sur l'utilisation efficace des ressources naturelles et sur la réduction de la consommation d'énergie. Elle encourage l'utilisation de matières premières renouvelables plutôt que de ressources épuisables comme le pétrole. Elle favorise l'utilisation de solvants non toxiques, la prévention de la pollution et la conception de produits chimiques biodégradables. Pour atteindre ces objectifs, la chimie verte s'appuie sur plusieurs principes fondamentaux, dont entre autres :
24- la prévention qui vise à concevoir des voies de synthèse générant le moins de déchets possibles, plutôt que de les éliminer après leur formation,
25- l'économie d'atomes qui encourage l'utilisation efficace des matières premières en minimisant le nombre d'étapes de transformation chimique nécessaires et en maximisant la conversion des réactifs en produits chimiques finaux,
26- le recours à des catalyseurs pour augmenter l'efficacité et la sélectivité des réactions chimiques, réduisant ainsi la quantité d'énergie nécessaire et les sous-produits indésirables,
27- le choix de solvants organiques non toxiques ou d'alternatives à base d'eau, réduisant ainsi les risques pour la santé et l'environnement. De nombreux guides ont été publiés à l'intention des chimistes pour leur indiquer quels sont les solvants les plus verts et ceux à proscrire.[20-22]
28En adoptant les principes de la chimie verte, il est donc possible de réduire l'impact environnemental de l'industrie chimique tout en favorisant le développement de solutions plus durables et respectueuses de l'environnement.
3. Les catalyseurs biosourcés à base de caféine
29Est-il possible de former des NHCs de façon biosourcée ? Si oui, ce serait un bon exemple d’application des principes de la chimie verte. Examinons dans un premier temps la structure de la molécule de caféine et de ses dérivés représentés à la Figure 7.
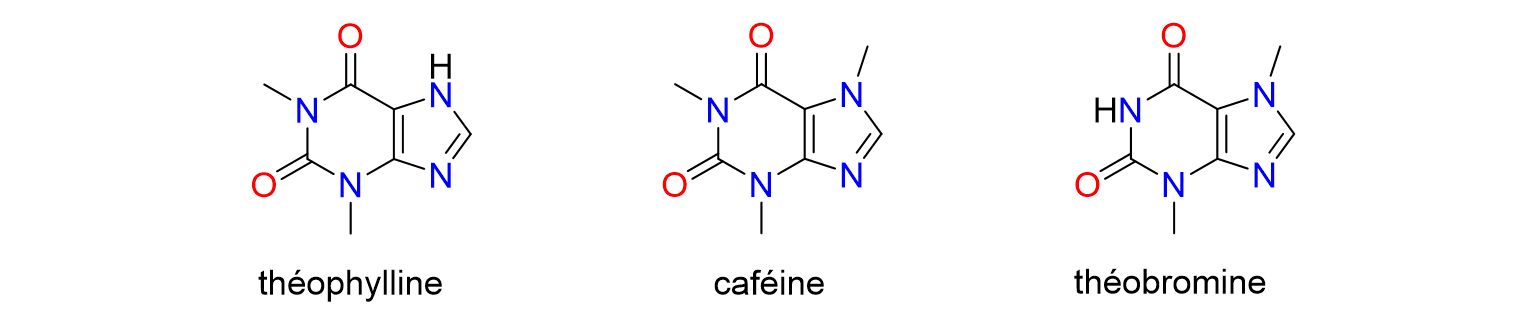
Figure 7. Structures chimiques de la théophylline, la caféine et la théobromine
30La caféine fait partie de la famille des xanthines, des substances naturelles présentes dans certains végétaux. Les dérivés de la xanthine se composent d'un cycle pyrimidinedione à 6 chaînons et d'un cycle imidazole à 5 chaînons (Figure 8). Il est donc possible, en modifiant la structure chimique des xanthines, de former des sels d’imidazolium.
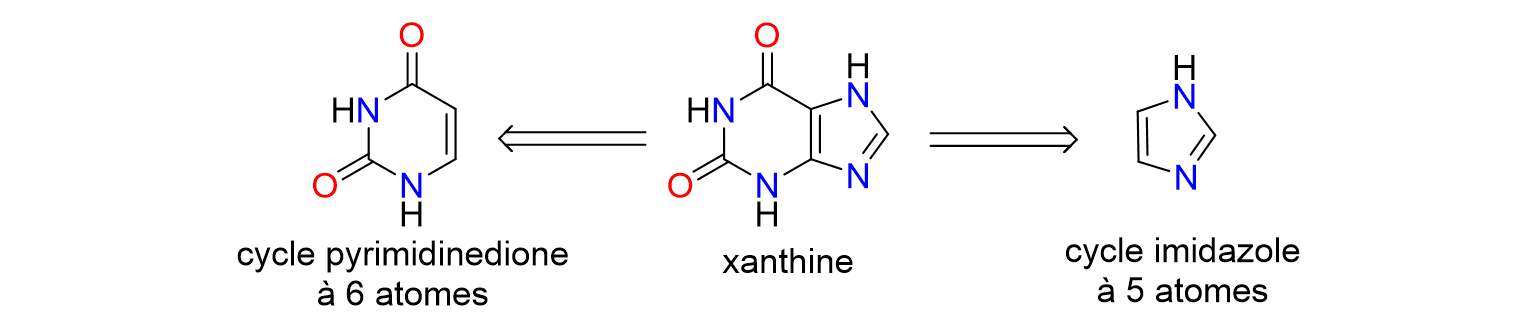
Figure 8. Représentation des cycles à 5 et 6 atomes présents dans les xanthines
31Le choix de la caféine ou de la théophylline comme matière première pour la synthèse de sels d'imidazolium présente de multiples avantages. D’un point de vue purement chimique, un cycle imidazole est déjà présent dans ces molécules, ce qui évite de devoir l'assembler. Il faut savoir que les chimistes cherchent toujours à réduire au maximum le nombre d’étapes de synthèse pour former un produit. Cela permet de gagner du temps, d'optimiser l’utilisation de réactifs, de réduire la production de déchets et de diminuer les coûts. En corollaire, cela permet aussi de réduire l’empreinte écologique de la synthèse.
32Les xanthines sont des ressources renouvelables disponibles en très grande quantité à faible coût. Ce sont des composés solides, faciles à manipuler et moins dangereux que des réactifs liquides volatils. Les xanthines sont aussi peu toxiques (sauf en cas d’ingestion de fortes doses, évidemment). Contrairement aux transformations mises en œuvre dans l’industrie pétrolière, l’extraction des xanthines est un procédé très respectueux de l’environnement. Nous verrons plus loin qu’il est possible d'obtenir des NHCs à partir des xanthines, d’ajuster leurs propriétés stériques en variant les substituants sur les atomes d’azote, éventuellement de manière non symétrique. En considérant tous ces éléments, il est aisé de comprendre que les xanthines sont des substrats de choix pour les chimistes.
33Nous allons maintenant voir en quoi le procédé d’extraction des xanthines est respectueux de l’environnement. Ces substances naturelles sont présentes en abondance dans des produits agricoles durables tels que les feuilles de thé et les fèves de cacao (Figure 9). Les feuilles de thé renferment les trois types de xanthines: la caféine, la théophylline et la théobromine. La caféine représente environ 6,2% de la matière sèche des feuilles de thé, tandis que la teneur en théobromine varie de 0,01% à 0,26% et celle en théophylline est comprise entre 0,01% et 0,15%.[23] Dans les fèves de cacao, la caféine représente 0,6% de la masse totale, tandis que la théobromine et la théophylline sont présentes en plus grandes proportions (4,2% et 0,02%, respectivement).[24]

Figure 9. Café soluble et feuilles de thé broyées (haut), caféine et théophylline (bas)
34La technique utilisée pour extraire les xanthines des feuilles de thé ou des grains de café fait appel à du gaz carbonique sous haute pression à une température spécifique. Il s’agit en fait de CO2 supercritique. C’est un état dans lequel les phases liquide et gazeuse de la matière perdent leurs distinctions et deviennent indiscernables. Un fluide supercritique possède à la fois les propriétés des gaz et des liquides. Son comportement gazeux lui permet de pénétrer profondément dans les grains de café, tandis que ses propriétés liquides lui permettent de jouer le rôle de solvant en dissolvant la quasi-totalité des xanthines. Le CO2 est d'abord pompé dans le matériau végétal pour en extraire les xanthines. Ce processus n'est pas sélectif, ce qui signifie qu'il extrait les trois xanthines de façon simultanée. L’avantage de cette méthode est que l’extraction des xanthines est quasi-totale. Après cette étape d'extraction, il suffit de diminuer la température pour que le fluide supercritique redevienne gazeux en laissant un résidu solide contenant les trois xanthines. Le CO2 est récupéré afin d’extraire les xanthines d’autres échantillons tandis que le résidu solide est dissous dans de l’eau pour permettre la séparation de ses constituants. Pour cela, on utilise une technique appelée l'échange anionique. La différence d’acidité des trois xanthines (due à des hydrogènes légèrement acides pour la théophylline et la théobromine) permet de les séparer facilement sur une colonne échangeuse d'ions par l'action d’acides et de bases qui modifieront le pH de l’eau utilisée comme éluant. Grâce à cette méthode utilisant le solvant avec l’impact environnemental le plus faible, il est possible d'extraire de manière sélective et quantitative chaque xanthine.[25-26] Ce procédé est donc très respectueux de l’environnement, puisqu’il ne nécessite que très peu de réactifs et que ceux-ci ont un faible impact environnemental (du CO2 qui est recyclé, des acides, des bases et de l’eau).
4. Synthèse et applications de catalyseurs biosourcés dérivés de la caféine et de la théophylline
35Une simple réaction d’alkylation sur l’atome d’azote numéro 9 de la caféine permet de former le sel d’imidazolium correspondant, qu'on appelle aussi sel de xanthinium puisqu’il dérive d'une xanthine. Pour la théophylline, deux réactions d’alkylation successives sont nécessaires, d’abord sur l’atome d’azote 7 puis sur l’azote numéro 9, avant d'arriver au sel désiré (Figure 10).
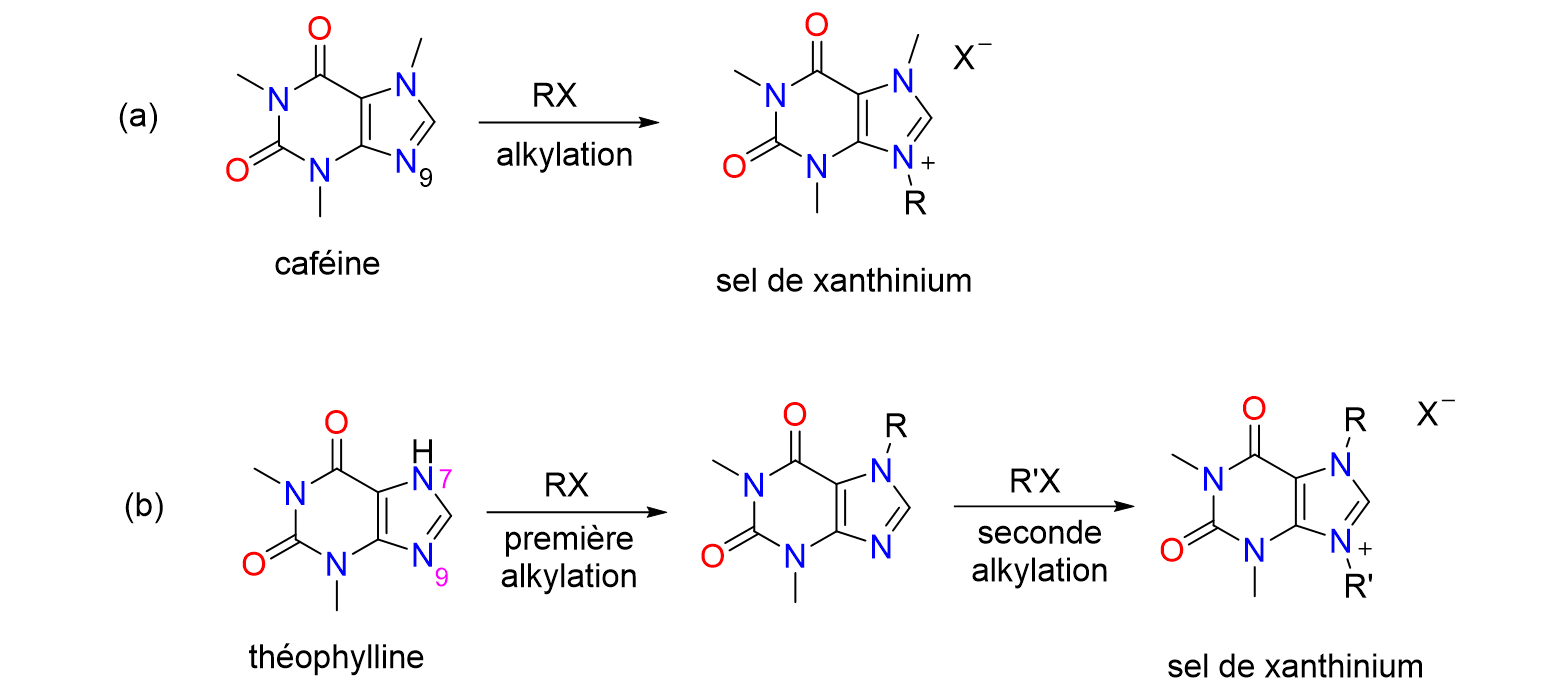
Figure 10. Synthèse de sels de xanthinium à partir de la caféine (a) et de la théophylline (b)
36Les sels de xanthinium peuvent être convertis en NHCs qui seront ensuite greffés sur des métaux afin de les transformer en catalyseurs. Plusieurs groupes de recherche à travers le monde ont déjà exploité cette stratégie. Ainsi, Luo et Lo ont lié du palladium à deux ligands de type NHC dérivés de la caféine (Figure 11, catalyseur A). Les propriétés catalytiques du complexe obtenu ont été testées dans différentes réactions, dont les couplages de Suzuki-Miyaura et les couplages de Heck (cf. Figure 1). Les réactions ont été effectuées avec une charge catalytique de 1 mol% ce qui correspond à une 1 molécule de catalyseur pour 100 molécules de substrat à transformer en produit. Cette proportion est relativement importante d'autant plus que des températures élevées et des temps de réaction prolongés se sont avérées nécessaires pour obtenir des conversions satisfaisantes.[27] Le complexe B décrit en 2016 par Mohammadi et Movassagh offre l’avantage d’être un catalyseur hétérogène solide greffé sur du polystyrène (PS). Il peut être récupéré en fin de réaction pour être réutilisé plusieurs fois. Son activité a été déterminée pour une charge catalytique d’environ 1 mol%.[28] Le complexe C synthétisé en 2017 par Canovese, Paganelli et leurs collaborateurs a montré une bonne activité catalytique pour les réactions de Suzuki-Miyaura dans l'eau, le meilleur des solvants verts. Cependant, sa synthèse a nécessité l'intervention de sels d'argent et le complexe de palladium choisi comme point de départ est très coûteux.[29]
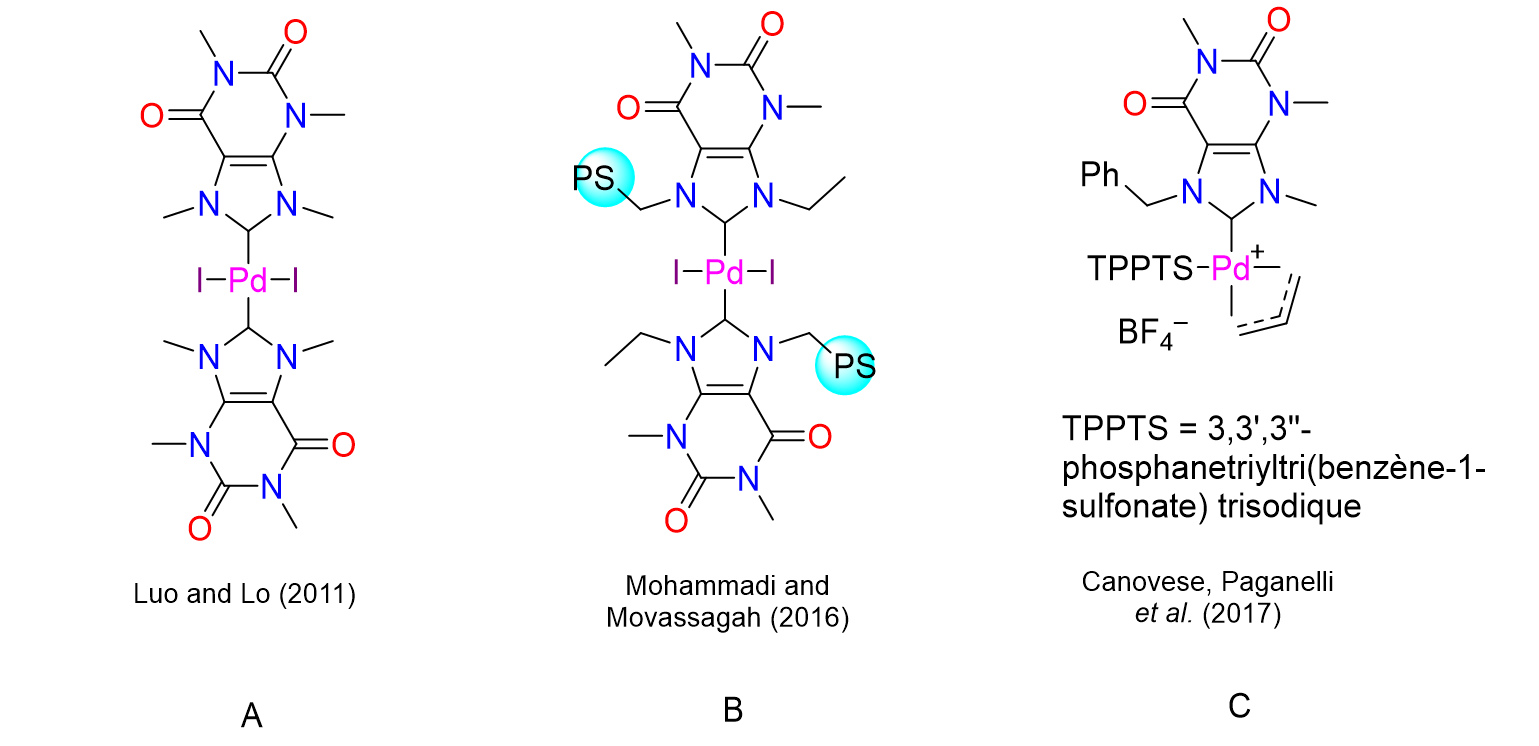
Figure 11. Complexes de palladium porteurs de ligands NHC dérivés de xanthines
37Pour tenter d'améliorer les systèmes catalytiques décrits ci-dessus, nous avons décidé de synthétiser des complexes de type PEPPSI avec des ligands NHCs dérivés des xanthines. Deux complexes à base de caféine et un troisième préparé à partir de théophylline ont ainsi été obtenus. Les différences entre ces trois catalyseurs sont entourées en rouge dans la Figure 12. Les deux premiers, Pd-1 et Pd-2, nous ont permis d'étudier l’influence de l’ion halogénure (chlorure ou iodure) sur l’activité catalytique, alors que le troisième, Pd-3, a permis de moduler la taille du substituant présent sur l'atome d’azote N7. Il convient de souligner qu'ils ont tous les trois été isolés avec de bons rendements.[30] Ce point est important car ils sont à base de palladium, un métal précieux dont l’extraction est polluante.
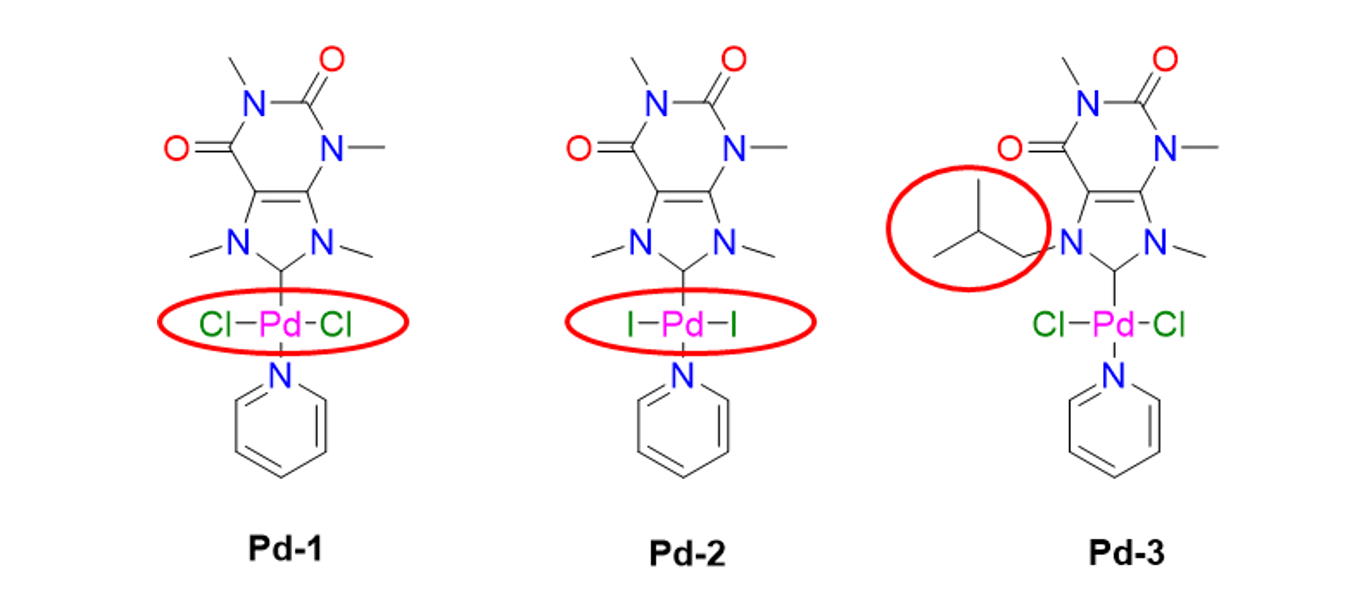
Figure 12. Catalyseurs Pd-PEPPSI porteurs de ligands NHC biosourcés synthétisés au Laboratoire de Catalyse de l'Université de Liège
38Nous avons évalué l'activité catalytique des complexes Pd-1, Pd-2 et Pd-3 dans la réaction de Suzuki-Miyaura en testant un grand nombre de substrats afin de déterminer la portée de notre système et de mieux appréhender ses limites. En effet, l'efficacité d'un catalyseur dépend de la nature des réactifs avec lesquels il doit interagir. Il était donc opportun de vérifier que nos trois complexes étaient capables de convertir une large gamme de substrats aux propriétés très différentes avec des rendements élevés. Nous avons réussi à former plus de 30 produits différents avec des rendements atteignant jusqu’à 93% dans des conditions respectueuses de l’environnement impliquant une faible charge catalytique, une température basse, des temps de réactions courts et le tout dans un mélange de solvants verts.[30] Nous avons en effet optimisé les conditions expérimentales en tenant compte des principes fondamentaux de la chimie verte exposés dans la section 2.3. La température de réaction était de seulement 40°C et la charge catalytique lors de nos essais ne dépassait pas 0,25 mol%. Le temps de réaction était limité à 2 heures. Le solvant utilisé était un mélange composé d’eau à 75% et d’isopropanol (un des solvants organiques les plus verts) à hauteur de 25%.
39Au vu des bons résultats obtenus avec les complexes Pd-1, Pd-2 et Pd-3 dans la réaction de Suzuki-Miyaura, nous avons aussi testé leur activité catalytique dans d’autres types de couplage, tels que les couplages de Heck, où ils ont à nouveau démontré leur grande efficacité.[31] Nous avons aussi étendu nos travaux à d’autres complexes métalliques porteurs de ligands NHC dérivé des xanthines afin de catalyser des transformations chimiques pour lesquelles le palladium ne convient pas. Nous nous sommes intéressés plus particulièrement à des complexes de type ruthénium-arène connus pour promouvoir des réactions aussi diverses que des oxydations, des réductions ou la synthèse d'esters d’énol. Les complexes Ru-1 et Ru-2, porteurs de ligands NHC dérivés de la caféine et de la théophylline ont ainsi été synthétisés avec succès en présence d’air (Figure 13).[32] La présence d'air et d’humidité doit généralement être proscrite lorsqu’on travaille avec des catalyseurs organométalliques car beaucoup d'entre eux sont sensibles à l’oxygène et à l’eau et se dégradent rapidement. Les complexes Pd-PEPPSI et Ru-arene constituent une exception à cette règle et possèdent une stabilité remarquable qui permet leur synthèse, leur conservation et leur manipulation sans précautions particulières.
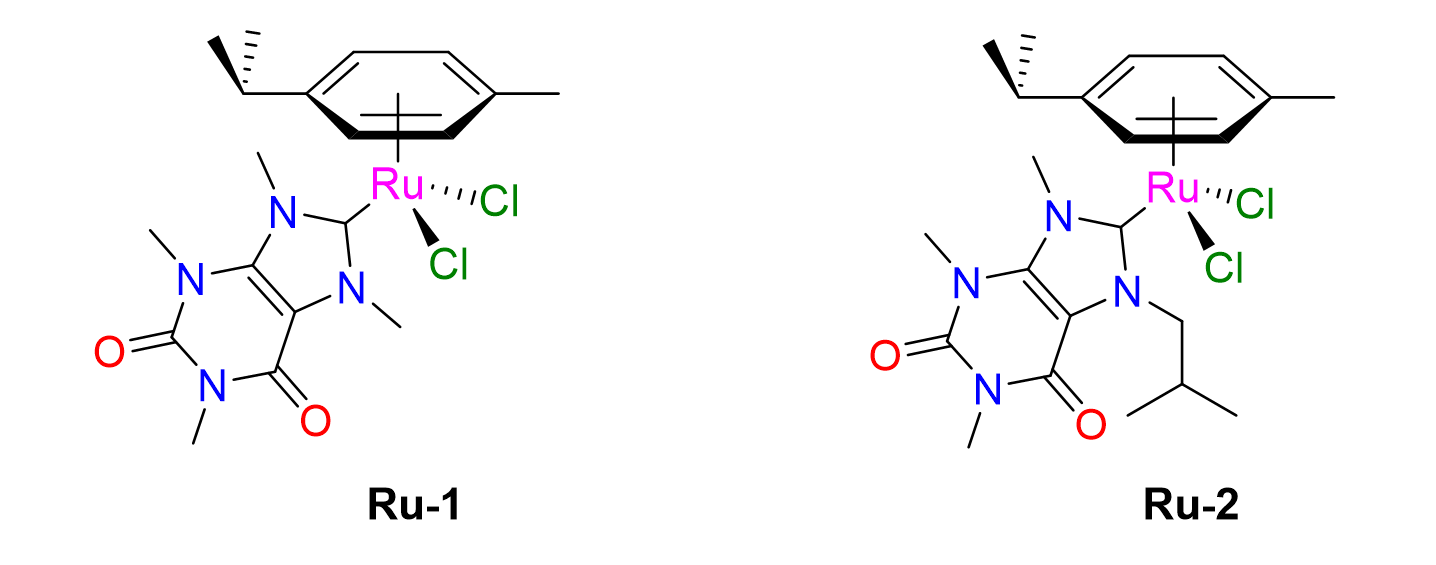
Figure 13. Complexes Ru-arène porteurs de ligands NHC biosourcés synthétisés au Laboratoire de Catalyse de l'Université de Liège
40Les complexes Ru-1 et Ru-2 se sont montrés particulièrement actifs pour les réactions de réduction avec une charge catalytique de 1 mol% à 80 °C pendant 24 heures dans l’isopropanol, un solvant vert. Dix des onze substrats que nous avons testés ont été réduits avec des conversions supérieures à 89%. Parmi ces composés insaturés, figuraient neuf cétones, un aldéhyde et une imine, ce qui a permis de prouver la polyvalence de nos catalyseurs (Figure 14).[32]
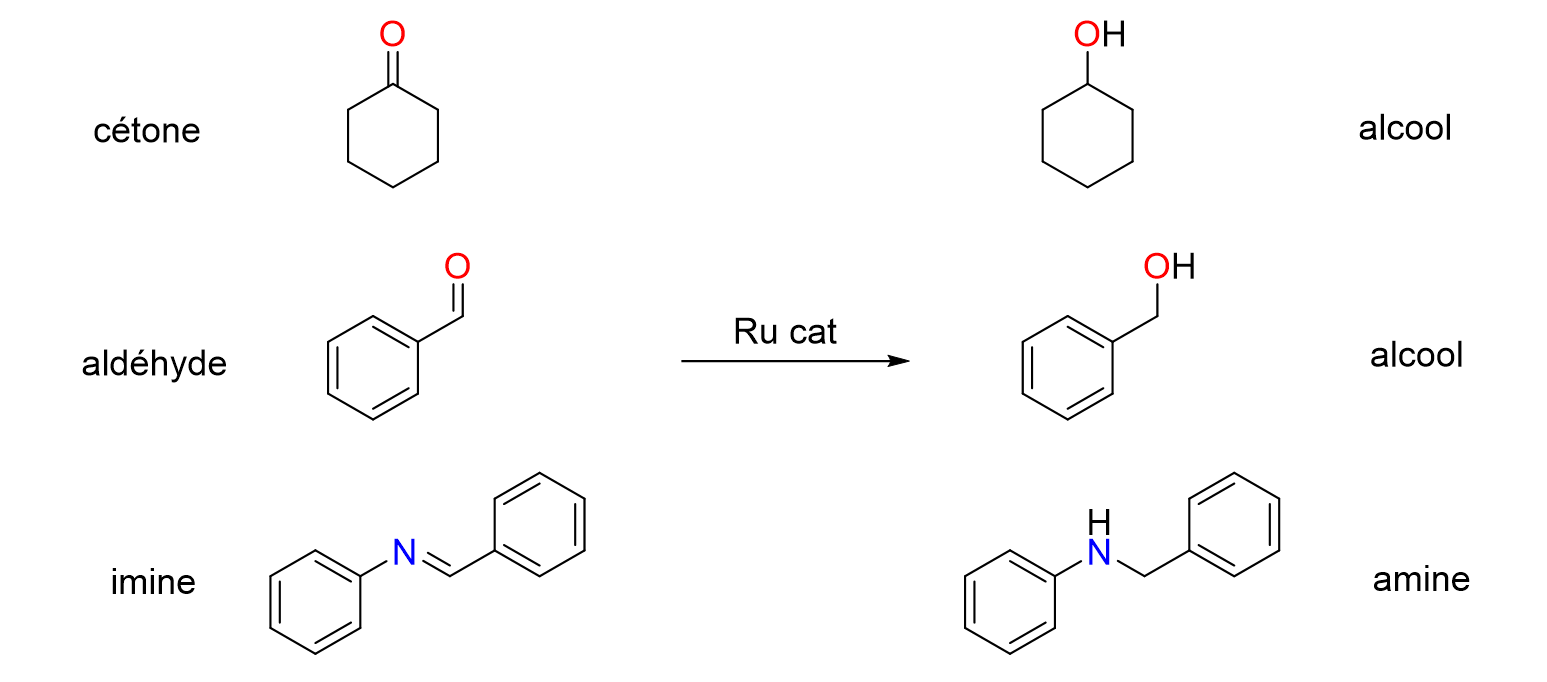
Figure 14. Réduction de fonctions cétone, aldéhyde et imine catalysée par du ruthénium
41Les complexes Ru-1 et Ru-2 ont aussi servi à catalyser des réactions d’oxydation d’alcènes par le periodate de sodium (Figure 15). Ces réactions ont été effectuées dans des solvants verts, l'eau et l'acétone. Elles ont permis d'atteindre une conversion de 100%. Nous avons observé une grande sélectivité de nos catalyseurs pour former les fonctions chimiques appelées acides carboxyliques. La sélectivité observée était de 93%, le reste étant le composé porteur de deux fonctions aldéhydes. L’oxydation d’un alcène dérivé du styrène a donné une fonction cétone.[32]
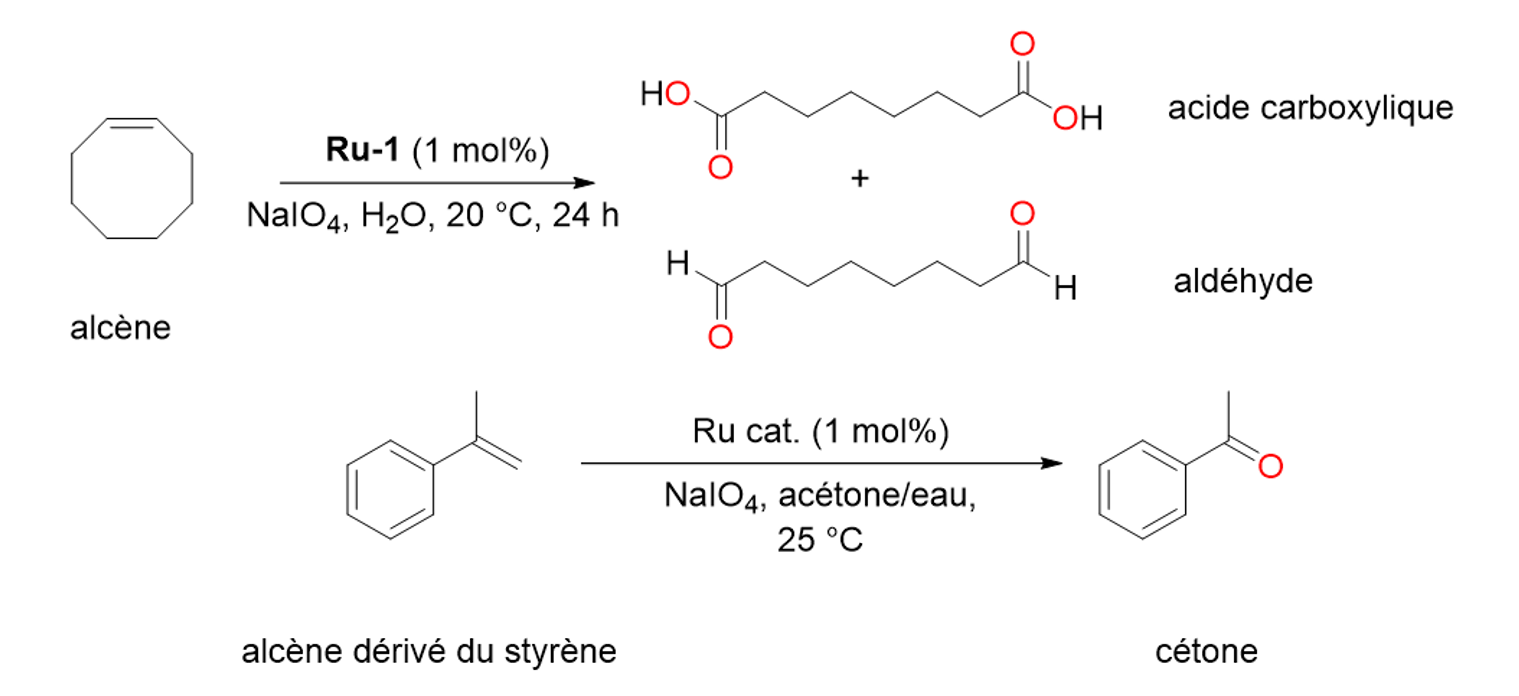
Figure 15. Oxydation d’alcènes catalysés par du ruthénium
42Enfin, les catalyseurs Ru-1 et Ru-2 ont été utilisés pour la synthèse d'esters d'énol à partir d'un acide carboxylique et d'un alcyne (Figure 16) Les deux complexes ont mené à des conversions quantitatives. Cependant, trois produits très similaires, des isomères, ont été formés au cours de la réaction. Nous avons obtenu une meilleure sélectivité en faveur du premier produit avec le catalyseur Ru-1 (72%) qu'avec le catalyseur Ru-2, ce qui démontre l'intérêt de moduler la structure du ligand NHC pour influencer l'activité catalytique du métal sur lequel il est greffé.[32]
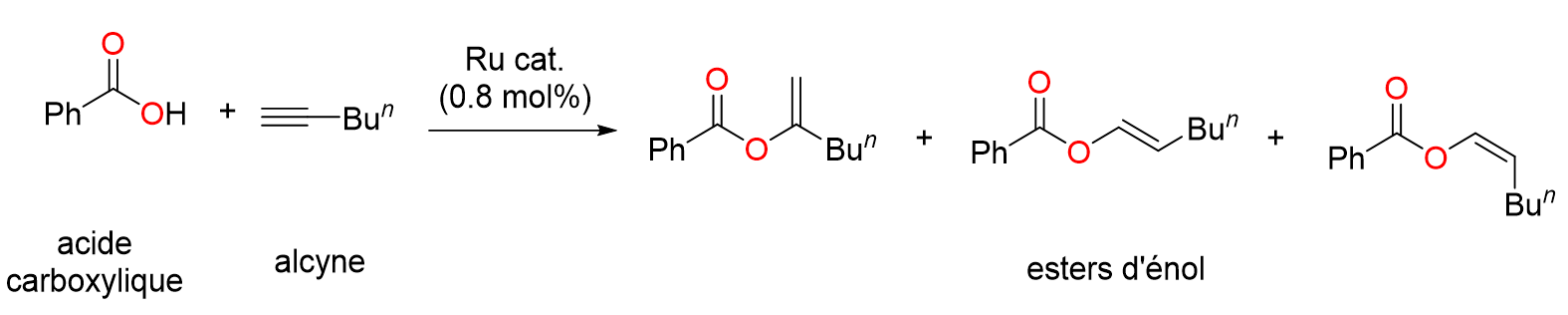
Figure 16. Synthèse d'esters d’énol catalysée par un complexe de ruthénium
5. Conclusion
43Notre société moderne ne peut se passer de la chimie organique qui joue un rôle crucial dans tous les aspects de la vie quotidienne. En introduction à cet article, nous avons souligné l’importance de la catalyse pour effectuer rapidement et sélectivement de nombreuses trans-formations chimiques dans des conditions douces. Nous avons ensuite brièvement présenté le mode d'action des catalyseurs et leur synthèse en prenant comme exemples les complexes de palladium et de ruthénium porteurs de ligands carbènes N-hétérocycliques. Enfin, nous avons évoqué les principes fondamentaux de la chimie verte mis en œuvre par l'industrie chimique pour réduire son impact environnemental et contribuer à un dévelop¬pement plus durable.
44Au cours de nos travaux de recherche menés au Laboratoire de Catalyse de l'Université de Liège, nous avons eu l'occasion de mettre au point des catalyseurs biosourcés pour diverses réactions organiques. La caféine et la théophylline ont été utilisées comme matières premières abondantes, peu chères et renouvelables pour obtenir de nouveaux complexes de palladium et de ruthénium. Ceux-ci ont été utilisés avec succès pour promouvoir des réactions de couplage, d'oxydation ou de réduction ainsi que pour la synthèse d'esters d'énol. Dans la plupart des cas, ces transformations se déroulaient dans des conditions respectueuses de l’environnement impliquant une faible charge catalytique, une température basse, des temps de réactions courts et des solvants verts.
45Nous espérons avoir prouvé à travers notre modeste contribution que l’industrie chimique est nécessaire à la société et qu’elle essaie au mieux de respecter les principes de la chimie verte afin de limiter au maximum son empreinte écologique.
Remerciements
46L'auteur tient à remercier le Professeur Lionel Delaude pour ses conseils avisés et la relecture attentive et critique de ce manuscrit.
Informations complémentaires
Déclaration relative aux conflits d’intérêt
47L'auteur déclare l’absence de tout conflit d’intérêt.
Références
Bibliographie
[1] Borup, R. L.; Kusoglu, A.; Neyerlin, K. C.; Mukundan, R.; Ahluwalia, R. K.; Cullen, D. A.; More, K. L.; Weber, A. Z.; Myers, D. J. Recent Developments in Catalyst-Related PEM Fuel Cell Durability. Curr. Opin. Electrochem. 2020, 21, 192–200. https://doi.org/10.1016/j.coelec.2020.02.007
[2] Wang, X.; Zhao, B.; Kan, W.; Xie, Y.; Pan, K. Review on Low-Cost Counter Electrode Materials for Dye-Sensitized Solar Cells : Effective Strategy to Improve Photovoltaic Performance. Adv. Mater. Interfaces 2022, 9, 2101229. https://doi.org/10.1002/admi.202101229.
[3] Chem, A. J.; Lamb, A. C.; Lee, A. A. F.; Wilson, K. Recent Advances in Heterogeneous Catalyst Design for Biorefining. Aust. J. Chem. 2020, 73, 832–852. https://doi.org/https://doi.org/10.1071/CH19558
[4] Reyes-rodr, G. J.; Rezayee, N. M.; Vidal-albalat, A.; Jørgensen, K. A. Prevalence of Diarylprolinol Silyl Ethers as Catalysts in Total Synthesis and Patents. Chem. Rev. 2019, 119, 4221–4260. https://doi.org/10.1021/acs.chemrev.8b00583
[5] Dey, S.; Mehta, N. S. Resources , Environment and Sustainability Automobile Pollution Control Using Catalysis. Resour. Environ. Sustain. 2020, 2, 100006. https://doi.org/10.1016/j.resenv.2020.100006
[6] Sharma, V. K.; Feng, M. Water Depollution Using Metal-Organic Frameworks-Catalyzed Advanced Oxidation Processes : A Review. J. Hazard. Mater. 2019, 372, 3–16. https://doi.org/10.1016/j.jhazmat.2017.09.043
[7] All Nobel Prizes in Chemistry. https://www.nobelprize.org/prizes/lists/all-nobel-prizes-in-chemistry/ (accessed October 26, 2023).
[8] Morales-Morales, D. Cross-Coupling Reactions Catalysed by Palladium Pincer Complexes . A Review of Recent Advances. J. Organomet. Chem. 2019, 893, 39–51. https://doi.org/10.1016/j.jorganchem.2019.04.021
[9] Boström, J.; Brown, D. G.; Young, R. J.; Keserü, G. M. Expanding the Medicinal Chemistry Synthetic Toolbox. Nat. Rev. Drug Discov. 2018, 17, 709–727. https://doi.org/10.1038/nrd.2018.116
[10] Axet, M. R.; Philippot, K. Catalysis with Colloidal Ruthenium Nanoparticles. Chem. Rev. 2020, 120, 1085–1145. https://doi.org/10.1021/acs.chemrev.9b00434
[11] Melchert, M.; List, A. The Thalidomide Saga. Int. J. Biochem. Cell Biol. 2007, 39, 1489–1499. https://doi.org/10.1016/j.biocel.2007.01.022
[12] Pinto, M. M. M.; Fernandes, C. Chiral Separations in Preparative Scale : A Medicinal Chemistry Point of View. Molecules 2020, 25, 1931–1947. https://doi.org/https://doi.org/10.3390/molecules25081931
[13] Valente, C.; Çalimsiz, S.; Hoi, K. H.; Mallik, D.; Sayah, M.; Organ, M. G. The Development of Bulky Palladium NHC Complexes for the Most-Challenging Cross-Coupling Reactions. Angew. Chem., Int. Ed. 2012, 51, 3314–3332. https://doi.org/10.1002/anie.201106131
[14] Therrien, B. Functionalised η6-Arene Ruthenium Complexes. Coord. Chem. Rev. 2009, 253, 493–519. https://doi.org/10.1016/j.ccr.2008.04.014
[15] Nombre d’articles de recherche contenant le mot “NHC” https://www.scopus.com/term/analyzer.uri?sid=e4925b27bdb9f695f29dbbb799714970&origin=resultslist&src=s&s=N-heterocyclic+carbene&sort=plf-f&sdt=a&sot=a&sl=22&count=76683&analyzeResults=Analyze+results&txGid=acafbb99e150b81d5f5808381065084b (accessed October 26, 2023).
[16] Trnka, T. M.; Grubbs, R. H. The Development of L2X2Ru=CHR Olefin Metathesis Catalysts : An Organometallic Success Story. Acc. Chem. Res. 2001, 34, 18–29. https://doi.org/10.1021/ar000114f .
[17] Hintermann, L. Expedient Syntheses of the N-Heterocyclic Carbene Precursor Imidazolium Salts IPr·HCl, IMes·HCl and IXy·HCl. Beilstein J. Org. Chem. 2007, 3, 22. https://doi.org/10.1186/1860-5397-3-22 .
[18] Hans, M.; Lorkowski, J.; Demonceau, A.; Delaude, L. Efficient Synthetic Protocols for the Preparation of Common N-Heterocyclic Carbene Precursors. Beilstein J. Org. Chem. 2015, 11, 2318–2325. https://doi.org/10.3762/bjoc.11.252 .
[19] Tarrieu, R.; Dumas, A.; Thongpaen, J.; Vives, T.; Roisnel, T.; Dorcet, V.; Cre, C.; Basle, O.; Mauduit, M. Readily Accessible Unsymmetrical Unsaturated 2,6- Diisopropylphenyl N ‑ Heterocyclic Carbene Ligands. Applications in Enantioselective Catalysis. J. Org. Chem. 2017, 82, 1880–1887. https://doi.org/10.1021/acs.joc.6b02888 .
[20] Alder, C. M.; Hayler, J. D.; Henderson, R. K.; Redman, A. M.; Shukla, L.; Shuster, E.; Sneddon, H. F. Updating and Further Expanding GSK’s Solvent Sustainability Guide. Green Chem. 2016, 18, 3879–3890. https://doi.org/10.1039/c6gc00611f .
[21] Jordan, A.; Hall, C. G. J.; Thorp, L. R.; Sneddon, H. F. Replacement of Less-Preferred Dipolar Aprotic and Ethereal Solvents in Synthetic Organic Chemistry with More Sustainable Alternatives. Chem. Rev. 2022, 122, 6749–6794. https://doi.org/10.1021/acs.chemrev.1c00672 .
[22] Prat, D.; Hayler, J.; Wells, A. A Survey of Solvent Selection Guides. Green Chem. 2014, 16, 4546–4551. https://doi.org/10.1039/c4gc01149j .
[23] Friedman, M.; Levin, C. E.; Choi, S. H.; Kozukue, E.; Kozukue, N. HPLC Analysis of Catechins, Theaflavins, and Alkaloids in Commercial Teas and Green Tea Dietary Supplements: Comparison of Water and 80% Ethanol/Water Extracts. J. Food Sci. 2006, 71, 328–337. https://doi.org/10.1111/j.1750-3841.2006.00090.x .
[24] Lo Coco, F.; Lanuzza, F.; Micali, G.; Cappellano, G. Determination of Theobromine, Theophylline, and Caffeine in by-Products of Cupuacu and Cacao Seeds by High-Performance Liquid Chromatography. J. Chromatogr. Sci. 2007, 45, 273–275. https://doi.org/10.1093/chromsci/45.5.273 .
[25] Dockendorff, B.; Holman, D. A.; Christian, G. D.; Ruzicka, J. Automated Solid Phase Extraction of Theophylline by Sequential Injection on Renewable Column. Anal. Commun. 1998, 35, 357–359. https://doi.org/10.1039/a806471g .
[26] Saldan, M. D. A.; Mohamed, R. S.; Baer, M. G.; Mazzafera, P. Extraction of Purine Alkaloids from Maté (Ilex Paraguariensis) Using Supercritical CO2. J. Agric. Food Chem. 1999, 47, 3804–3808. https://doi.org/10.1021/jf981369z .
[27] Luo, F.-T.; Lo, H.-K. Short Synthesis of Bis-NHC-Pd Catalyst Derived from Caffeine and Its Applications to Suzuki, Heck, and Sonogashira Reactions in Aqueous Solution. J. Organomet. Chem. 2011, 696, 1262–1265. https://doi.org/10.1016/j.jorganchem.2010.11.002 .
[28] Mohammadi, E.; Movassagh, B. Synthesis of Polystyrene-Supported Pd(II)-NHC Complex Derived from Theophylline as an Efficient and Reusable Heterogeneous Catalyst for the Heck-Matsuda Cross-Coupling Reaction. J. Mol. Catal. A: Chem. 2016, 418–419, 158–167. https://doi.org/10.1016/j.molcata.2016.03.045 .
[29] Scattolin, T.; Canovese, L.; Canton, P.; Demitri, N. Synthesis of Novel Allyl Palladium Complexes Bearing Purine Based NHC and a Water Soluble Phosphine and Their Catalytic Activity in the Suzuki-Miyaura Coupling in Water. Appl. Organomet. Chem. 2018, 32, e4034. https://doi.org/10.1002/aoc.4034 .
[30] Mazars, F.; Zaragoza, G.; Delaude, L. Caffeine and Theophylline as Sustainable, Biosourced NHC Ligand Precursors for Efficient Palladium-Catalyzed Suzuki–Miyaura Cross-Coupling Reactions. J. Organomet. Chem. 2022, 978, 122489. https://doi.org/10.1016/j.jorganchem.2022.122489 .
[31] Mazars, F.; Sénam Etsè, K.; Zaragoza, G.; Delaude, L. Pd-PEPPSI Catalysts Bearing N-Hetero¬cyclic Carbene Ligands Derived from Caffeine and Theophylline for Mizoroki–Heck and C(sp2)–H Arylation Reactions. J. Organomet. Chem. 2023, sous presse. https://doi.org/10.1016/j.jorganchem.2023.122928
[32] Mazars, F.; Delaude, L. “Greening” Ruthenium–Arene Catalyst Precursors with N-Heterocyclic Carbene Ligands Derived from Caffeine and Theophylline. Organometallics, 2023, 42, 1589-1597. https://doi.org/10.1021/acs.organomet.3c00166