- Accueil
- Volume 92 - Année 2023
- Numéro 1
- À l’écoute des profondeurs des récifs coralliens de Polynésie : le décryptage du whoot
Visualisation(s): 2188 (46 ULiège)
Téléchargement(s): 84 (1 ULiège)
À l’écoute des profondeurs des récifs coralliens de Polynésie : le décryptage du whoot

Document(s) associé(s)
Version PDF originaleRésumé
Les paysages acoustiques englobent des sons d’origine biologique, anthropique et géophysiques. Le monitoring par acoustique passive des écosystèmes marins utilise ces sons pour obtenir des informations sur ces environnements. Les récifs coralliens tropicaux profonds, également connus sous le nom de mésophotiques, sont des habitats peu explorés qui abritent une grande diversité d'espèces de poissons. Les poissons récifaux émettent une variété de sons, dont certains restent encore peu compris. Dans le cadre de cette étude, des enregistrements acoustiques ont été réalisés dans les récifs coralliens mésophotiques de Polynésie française. L'objectif était de caractériser le cycle jour/nuit d’un son particulier préalablement découvert, appelé whoot. L'expédition « Under The Pole III » a offert l’opportunité de collecter des données à l'aide d’enregistreurs acoustiques couplés à des hydrophones, positionnés à différentes profondeurs (−60 m et −120 m) à Bora-Bora, Mangareva, Moorea, Rangiroa, Raroia et Tikehau. Les enregistrements ont ensuite été analysés afin de détecter et de caractériser le cycle jour/nuit du son whoot. Des différences entre les deux profondeurs étudiées et entre les différentes îles étudiées ont été mises en évidence. En général, ce son était principalement présent en début et en fin de nuit, mettant ainsi en évidence son caractère nocturne acoustique chez l’espèce produisant les whoots. Ce résultat devrait contribuer à l’identification de l’espèce de poisson responsable de ce son caractéristique de la scène musicale sous-marine profonde polynésienne, et aider à une meilleure compréhension des populations de poissons des récifs coralliens mésophotiques par l’acoustique passive.
Abstract
Soundscapes include sounds of biological, anthropogenic, and geophysical origin. Passive acoustic monitoring of marine ecosystems utilizes these sounds to gather information about these environments. Deep tropical coral reefs, also known as mesophotic reefs, are understudied habitats that harbor a high diversity of fish species. Reef fish produce a variety of sounds, some of which remain poorly understood. In this study, acoustic recordings were conducted in the mesophotic coral reefs of French Polynesia. The objective was to characterize the diel cycle of a specific previously discovered sound, known as the whoot. The "Under The Pole III" expedition provided the opportunity to collect data using acoustic recorders coupled with hydrophones, positioned at different depths (−60 m and −120 m) in Bora-Bora, Mangareva, Moorea, Rangiroa, Raroia, and Tikehau. The recordings were subsequently analyzed to detect and characterize the day/night cycle of the whoot sound. Differences between the two studied depths and among the different islands were identified. Generally, this sound was predominantly present during the early and late night, highlighting its nocturnal acoustic nature among the species producing the whoot. This result should contribute to the identification of the fish species responsible for this characteristic sound in the deep Polynesian underwater music scene and help improve the understanding of fish populations in mesophotic coral reefs through passive acoustics.
Table des matières
Manuscrit reçu le 29 mai 2023 et accepté le 30 octobre 2023
Publié selon les termes de la licence Creative Commons CC-BY 4.0
Cet article a reçu un des deux Prix Annuels 2023 de la Société Royale des Sciences de Liège. This paper was awarded one of the two Annual Prizes 2023 of the Société Royale des Sciences de Liège.
1. Un monde du silence pas si silencieux
1Un paysage peut être défini comme la représentation de l’ensemble des éléments d’un lieu donné. Bien que moins connue que sa composante visuelle, le paysage inclut également la scène acoustique du territoire en question. Les paysages acoustiques, également connus sous le terme de "soundscapes" ou paysages sonores, regroupent l’ensemble des sons présents dans un environnement spécifique (Krause 1987). Au fil des années, les scientifiques ont observé et analysé les différentes composantes des paysages acoustiques, à savoir la géophonie, l'anthropophonie et la biophonie. La géophonie englobe les sons d'origine non biologique, tandis que l'anthropophonie comprend les sons produits par les êtres humains. La biophonie regroupe les sons émis par les animaux, qui jouent un rôle crucial dans leur survie et leur communication (Au and Hastings 2008).
2Dans l’océan, les paysages acoustiques sont influencés par divers facteurs, tels que le bruit thermique généré par l'agitation thermique de l'eau, les sources hydrodynamiques telles que les bulles oscillantes, les gouttes d'eau ou la grêle, les vagues de surface et la turbulence (Mellen 1952; Wenz 1962; Hildebrand 2009), ainsi que les phénomènes sismiques (Tolstoy and Ewing 1950; Shurbet 1955). En plus de la géophonie, l’anthropophonie, principalement causée par les activités humaines telles que le trafic maritime, les activités industrielles (par exemple, le battage de pieux, le martelage et le rivetage) et l'utilisation de sonars, a un impact significatif sur les paysages acoustiques marins (Wenz 1962; Ross 1976).
3Enfin, la biophonie représente les sons produits par les animaux marins, tels que les bivalves (Di Iorio et al. 2012), les oursins (Radford et al. 2008), les crustacés (Johnson et al. 1947), les cétacés (Thomas and Kastelein 1990; Dawbin and Cato 1992; Lammers and Au 1996; Bazua-Duran 1997; McDonald and Moore 2002; Au and Hastings 2008; Risch et al. 2014; Cerchio et al. 2015; Dominello and Širović 2016), les pinnipèdes (Schevill et al. 1966; Schusterman et al. 1967; Watkins and Ray 1977; Stirling et al. 1987; Rogers et al. 1995; Au and Hastings 2008), les siréniens (Hartman 1979; Nishiwaki and Marsh 1985) et les poissons (Ἀριστοτέλης (Aristote) 343AC; Rice et al. 2022; Au and Hastings 2008), qui jouent un rôle essentiel dans la biodiversité marine (Figure 1). Ces derniers produisent des sons généralement sous 2 kHz (Cato 1978) dans des contextes comportementaux tels que la reproduction et les comportements agonistiques (comportements liés aux confrontations entre individus) (Tavolga 1971, 1976). Les mécanismes utilisés par les poissons pour produire ces sons sont variés (Ladich and Fine 2006). Cependant, il est possible de distinguer deux grands groupes : les poisons utilisant des muscles soniques et ceux utilisant des mécanismes de stridulation (c’est-à-dire le frottement de deux structures dures l’une contre l’autre) (Fine and Parmentier 2015). Cependant, d’autres mécanismes existent également, comme par exemple chez les Balistidae où c’est le mouvement en alternance des nageoires pectorales qui enfoncent un système d’écailles modifiées dans la paroi de la vessie natatoire qui produit le son (Raick 2015; Parmentier et al. 2017; Raick et al. 2018).
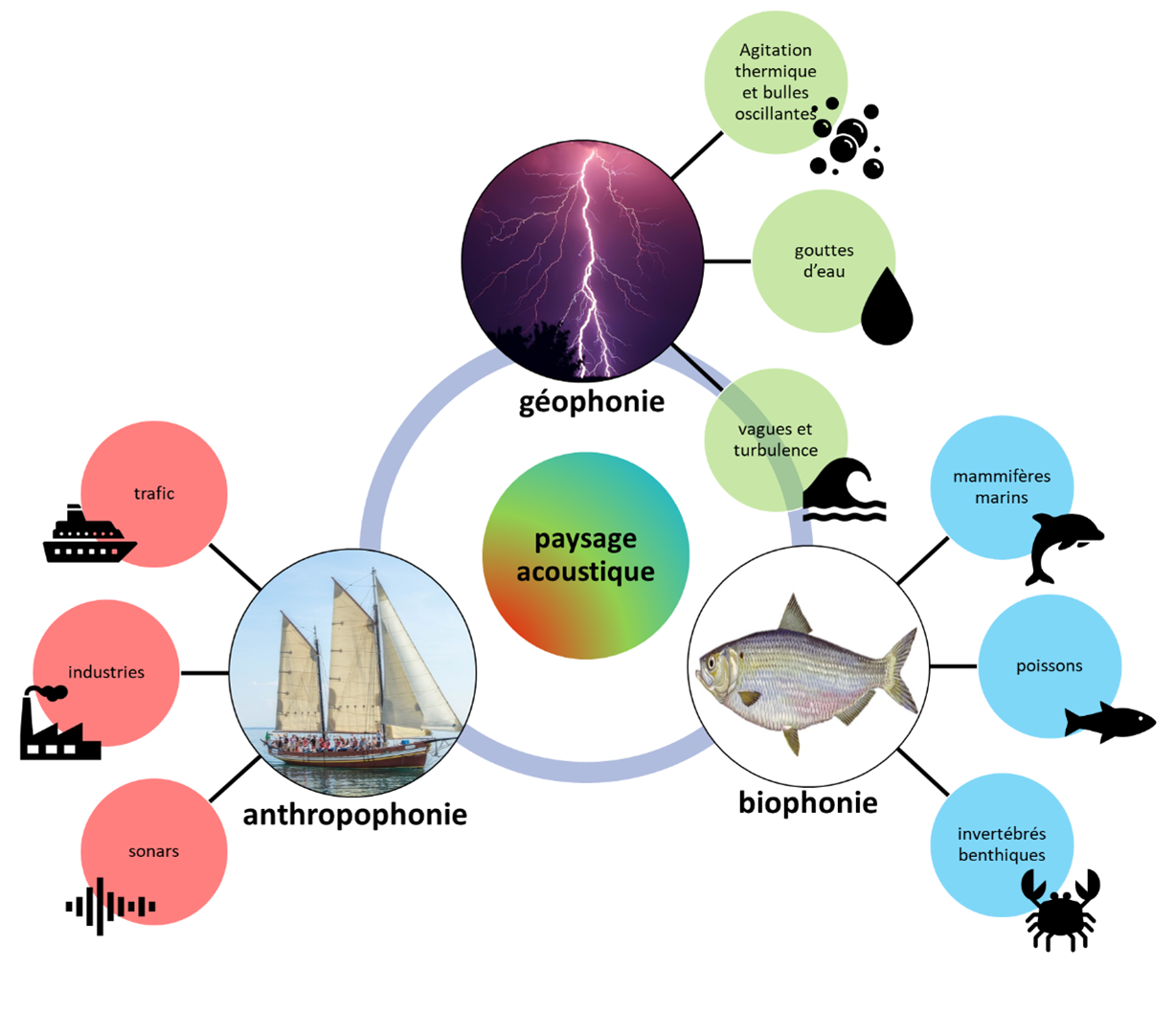
Figure 1. Schématisation de la division du paysage acoustique en ses trois composantes : la géophonie, la biophonie et l’anthropophonie, qui correspondent respectivement aux sources d’origine géophysique, biologique et anthropique. Les sources principales (non exhaustives) de chaque composante sont également illustrées.
4L'utilisation de techniques telles que le Monitoring par Acoustique Passive, plus connu sous le nom anglais Passive Acoustic Monitoring (PAM), permet d'explorer et de quantifier les paysages acoustiques. Cela offre ainsi des opportunités de suivre la biodiversité marine (e.g., suivi d’espèces migratrices ou détection de la présence d’espèces), d'étudier les comportements des espèces (e.g., reproduction) et d'identifier des habitats importants pour leur conservation (Mooney et al. 2020). Cette approche non invasive présente des avantages uniques pour l'étude des écosystèmes marins, notamment lorsqu’il y a une visibilité limitée comme la nuit ou dans les eaux troubles (Lammers et al. 2008; McCauley et al. 2017). En comprenant et en caractérisant les paysages acoustiques marins, il est possible de mieux appréhender les interactions entre les différentes composantes de l'écosystème et développer des stratégies de gestion et de conservation plus efficaces (Hughes 2003; Mooney et al. 2020).
2. Direction la Polynésie française
5La Polynésie française, située dans le Pacifique central et méridional, est constituée de 118 îles réparties en cinq archipels : les Australes, les Gambier, les Marquises, les Tuamotu et la Société (Rancher and Rougerie 1994; Rougerie et al. 1997) (Figure 2). Les îles de la Polynésie française, notamment celles de la Société et des Tuamotu, abritent des récifs coralliens d'une grande richesse et diversité (Spalding and Grenfell 1997). Ces régions sont des zones d'étude privilégiées pour la recherche sur les récifs coralliens en raison de leur état relativement préservé et des connaissances scientifiques accumulées grâce à la présence de plusieurs centres de recherche internationaux (Chevalier and Kuhlmann 1983; Bouchon 1985; Trapon et al. 2011; Purkis et al. 2017). La Polynésie française abrite également une grande variété d'espèces de poissons (Siu et al. 2017), dont de nombreuses ont des modes de vie structurés avec des stades larvaires pélagiques et des stades benthiques/sédentaires sur le récif (Leis and McCormick 2002; Myrberg and Fuiman 2002). Notre compréhension des écosystèmes coralliens reste toutefois limitée, en particulier en ce qui concerne les communautés de poissons en profondeur (Pichon 2019).
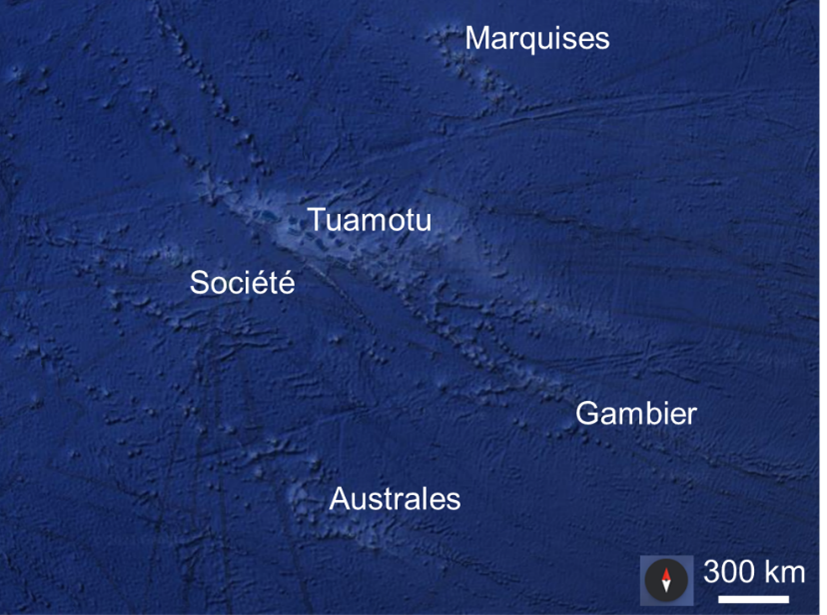
Figure 2. Carte de la Polynésie française et de ses cinq archipels : les Australes, les Gambier, les Marquises, la Société et les Tuamotu. Cette figure illustre l’étendue géographique considérable de la Polynésie française et permet de visualiser la répartition des différents archipels dans la région. Sources : SIO, NOAA, U.S. Navy, LDEO-Columbia, NSF (Google Earth).
6La partie profonde du récif, également appelée mésophotique ou écosystèmes coralliens mésophotiques (MCEs) de l’anglais Mesophotic Coral Ecosystems, s’étend généralement de −30 à −40 m jusqu’à plus de −150 m (Pyle et al. 2016; Baldwin et al. 2018). Cette profondeur maximale est définie comme le seuil auquel la quantité de lumière n’est plus suffisante pour permettre la photosynthèse et, par conséquent, la croissance de coraux hermatypiques (Bongaerts et al. 2010; Rouzé et al. 2021). Les MCEs sont eux-même divisés en une partie supérieure (au-dessus de −60 à −90 m) et une partie inférieure (en dessous de −60 à −90 m) en raison des variations dans les assemblages faunistiques (Kahng et al. 2016; Pinheiro et al. 2016).
3. Le whoot : un son bien mystérieux
7De nombreuses espèces de poissons vocaux sont répertoriées dans les MCEs. Ainsi, le monitoring par acoustique passive apparait clairement comme une méthode idéale pour étudier les communautés de poissons dans ces environnements difficilement accessibles (Raick et al. 2023). Bien que les cycles journaliers des poissons des récifs photiques soient relativement bien connus, nous disposons de peu d’informations concernant les émissions sonores produites par les poissons des MCEs (Raick et al. 2023; Bertucci et al. 2017; Lin et al. 2021).
8La Polynésie française est l’un des endroits au monde où nous disposons d’informations sur l’ambiance sonore tant des récifs photiques que des MCEs. En effet, une grande diversité de sons émis par les poissons a été récemment mise en évidence dans l’archipel de la Société (Bertucci et al. 2016, 2017, 2020; Raick et al. 2023; Minier et al. 2023), ainsi que dans plusieurs autres archipels de la Polynésie française (Jublier et al. 2020; Raick et al. 2023). Ces sons présentent des variations temporelles (Bertucci et al. 2020; Raick et al. 2021a) et spatiales, à la fois à une échelle horizontale (Raick et al. 2021a) et verticale (Raick et al. 2023). Ces dernières différences sont généralement liées au type d’habitat (par exemple, récif frangeant vs récif barrière ou bien mangrove vs zone sableuse) (Minier et al. 2023).
9 Les sons émis par les poissons dans les récifs coralliens proviennent de nombreux groupes taxonomiques connus pour leurs vocalisations, tels que les poissons demoiselles (Mann and Lobel 1995; Parmentier et al. 2022), les balistes (Raick 2015; Parmentier et al. 2017; Raick et al. 2018), les rascasses (Hallacher 1974; Raick et al. 2017; Di Iorio et al. 2018), les poissons coffres (Parmentier et al. 2019, 2021), les mérous (Mann et al. 2009; Nelson et al. 2011) et les poissons perles (Parmentier et al. 2006; Kéver et al. 2014). Grâce à des études en aquarium (Raick et al. 2020, 2021b), ou bien grâce à des études morpho-anatomiques (Hallacher 1974; Fine et al. 1993), il devient possible d’associer un type de son à une espèce de poisson. Dans certains cas, cette association peut être plus précise, permettant de déterminer le comportement de l’espèce qui vocalise (Desiderà et al. 2022). Cependant, parfois il n’est possible d’identifier que le genre ou la famille des poissons qui vocalisent (Di Iorio et al. 2018; Raick et al. 2022), notamment dans les écosystèmes coralliens mésophotiques où nos connaissances sont moins développées que près de la surface (Bertucci et al. 2017; Raick et al. 2023). Dans de tels cas, les scientifiques utilisent des termes tels que « série de pulsations », « modulation de fréquence », « train rapide d’impulsions » etc. (Di Iorio et al. 2018, 2021; Desiderà et al. 2019). Les sons de poissons appartenant à la catégorie des modulations de fréquences sont plus rares dans les récifs photiques que dans la partie profonde du récif (Raick et al. 2023). En Polynésie française, le son de modulation de fréquence le plus abondant est appelé whoot (Raick et al. 2023). Sur un spectrogramme (représentation de la fréquence en fonction du temps), ce son se présente sous la forme de motifs harmoniques répétés, caractérises par une augmentation graduelle de la fréquence, suivie d’une diminution rapide, puis d’une augmentation finale rapide de la fréquence (Raick et al. 2023) (Figure 3). La durée moyenne de ce son est de 940.02 ± 174.39 ms (moyenne ± écart type) avec un ensemble de pics dont la période est de 4.94 ± 0.29 ms (Raick et al. 2023). Entre −20 et −120 m de profondeur, la présence de ce son est croissante avec l’augmentation de la profondeur (Raick et al. 2023). Ainsi, ce son pourrait être utile pour fournir des informations sur les MCEs (Raick et al. 2023). Pour mieux comprendre ce son, l’objectif de cette étude est de déterminer son cycle jour/nuit.
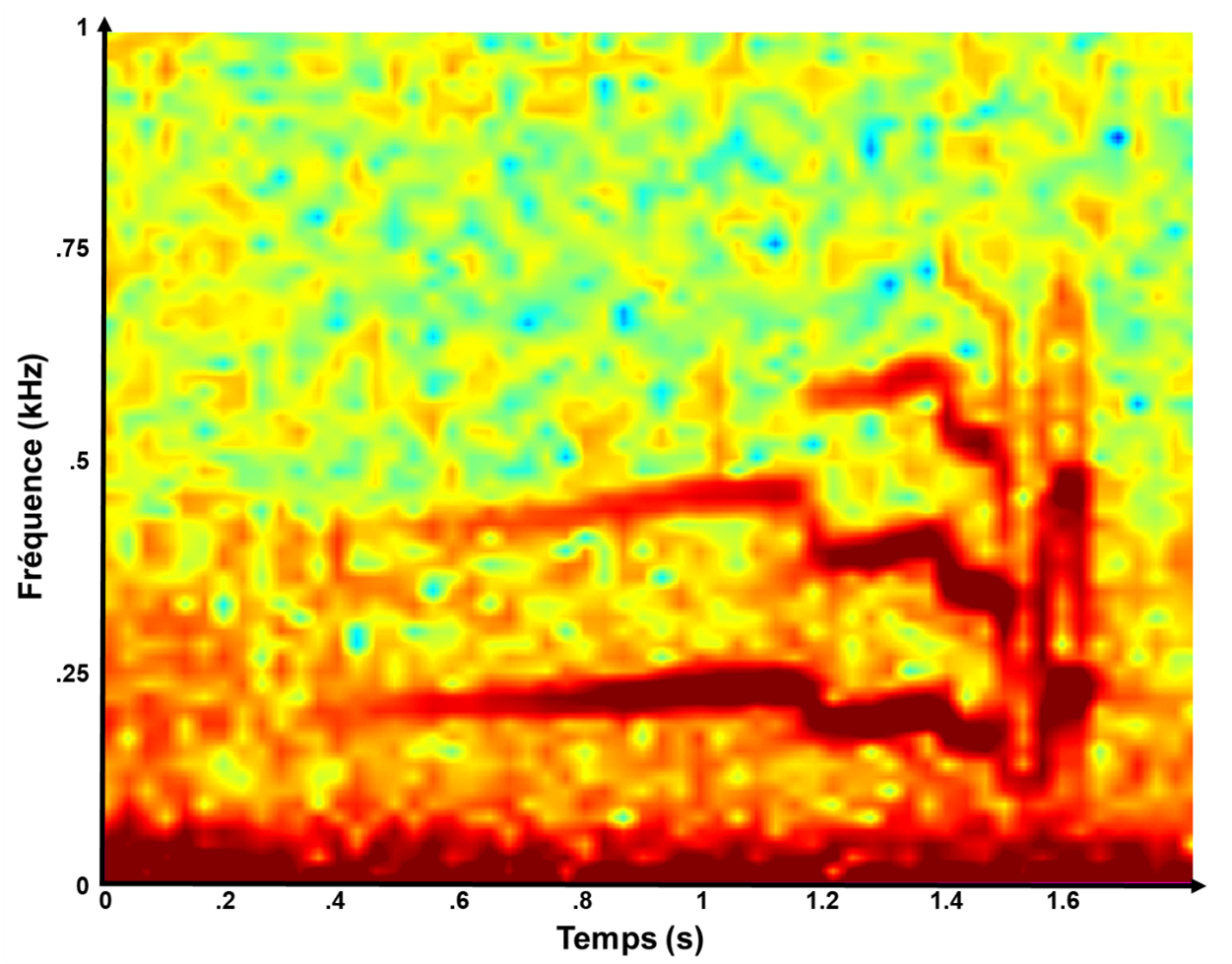
Figure 3. Spectrogramme d’un son de type whoot avec une FFT de 256 points. Le whoot apparait comme une répétition de motifs harmoniques (composés d’une augmentation de fréquence graduelle suivie d’une diminution de fréquence rapide) suivis d’une augmentation de fréquence rapide.
4. Investigation
10Les expéditions Under The Pole (UTP) (Concarneau, France ; https://underthepole.org) sont une série d’explorations menées par une équipe de plongeurs et de scientifiques. La mission UTP III a réalisé plusieurs plongées techniques sur différentes îles de Polynésie française entre début 2018 et début 2019 (Figure 4). Sur six de ces îles, des enregistreurs acoustiques de type SNAP (Loggerhead Instruments, Sarasota, FL, États-Unis d’Amérique), connectés à des hydrophones HTI-96 (16 bits, gain de 2.05 dB, fréquence d’échantillonnage de 44.1 kHz, sensibilité entre −169.7 et −170.5 dB re 1 V, réponse en fréquence plate entre 2 Hz et 30 kHz), ont été installés à des profondeurs de −20, −60 et −120 m. Les îles étudiées comprennent deux îles de l’archipel de la Société (Bora-Bora et Moorea), une île de l’archipel des Gambier (Mangareva) et trois îles de l’archipel des Tuamotu (Rangiroa, Raroia et Tikehau). Cependant, une contrainte technique a empêché l’acquisition de données acoustiques à la profondeur de −120 m à Mangareva. Les sons ont été enregistrés pendant une minute toutes les dix minutes et ce pendant 62 h.

Figure 4. Illustration de la mission Under The Pole (UTP) III. A Vue aérienne de Tikehau dans l’archipel des Tuamotu © Maxime HORLAVILLE / UNDER THE POLE. B Plongeurs équipés de recycleurs et de scooters sous-marins à −60 m à Bora Bora © Franck GAZZOLA / UNDER THE POLE / Zeppelin Network. C La pente externe de l’île de Tikehau © Franck GAZZOLA / UNDER THE POLE / Zeppelin Network. D. Plongeurs évoluant le long de la pente externe à l’île de Moorea, illustrant la grande verticalité des fonds © Ghislain BARDOUT / UNDER THE POLE.
11L’ensemble des données a été sous-échantillonné à 4 kHz sous MatLab® R2014b (MathWorks, Natick, MA, États-Unis d’Amérique). Pour cette étude, nous avons analysé uniquement les enregistrements réalisés dans les MCEs, c’est-à-dire à −60 m et −120 m. Le logiciel Raven Lite 2.0.3 (Laboratoire d’ornithologie, Ithaca, NY, États-Unis d’Amérique) a été utilisé pour visualiser les spectrogrammes avec une FFT de 256 points afin de compter l’occurrence des whoots. À partir de ces occurrences (plus de 2 000 sons individuels ont été identifiés), des séries temporelles ont été créées pour visualiser la présence ou l’absence de cycles jour/nuit. Le nombre de sons entre les deux profondeurs étudiées a été comparé à l’aide du test de Wilcoxon, tandis que le test de Kruskal-Wallis suivi du test post-hoc de Dunn a été utilisé pour comparer les différentes îles étudiées. Ces tests ont été choisis car les conditions de normalité et/ou d’homoscédasticité des variances n’étaient pas respectées. Ces conditions ont été vérifiées au préalable à l’aide des tests de Shapiro-Wilk et du test F d’égalité de deux variances, respectivement. Toutes les analyses statistiques ont été effectuées sur R 4.0.5. (R Core Team, 2021) avec un seuil alpha de 0.05. Enfin, la méthode de Benjamini-Hochberg a été utilisée pour corriger les valeurs p lorsque cela était nécessaire.
5. Décryptage du whoot
12L’occurrence des sons whoot variait en fonction de la profondeur étudiée (−60 m et −120 m), de l’île (Bora-Bora, Mangareva, Moorea, Rangiroa, Raroia et Tikehau) et du cycle jour/nuit. Pour la plupart des îles, davantage de whoots ont été enregistrés à −120 m qu’à −60 m (p < 0,01, test de Wilcoxon). Cependant, ce résultat n’a pas été observé sur l’île de Tikehau dans l’archipel des Tuamotu, où aucune différence significative n’a été observée entre les deux profondeurs (p = 0,7, test de Wilcoxon), ni sur l’île de Moorea dans l’archipel de la Société (p < 0,0001, test de Wilcoxon), où plus de whoots ont été enregistrés à −60 m qu’à −120 m (Figure 5).
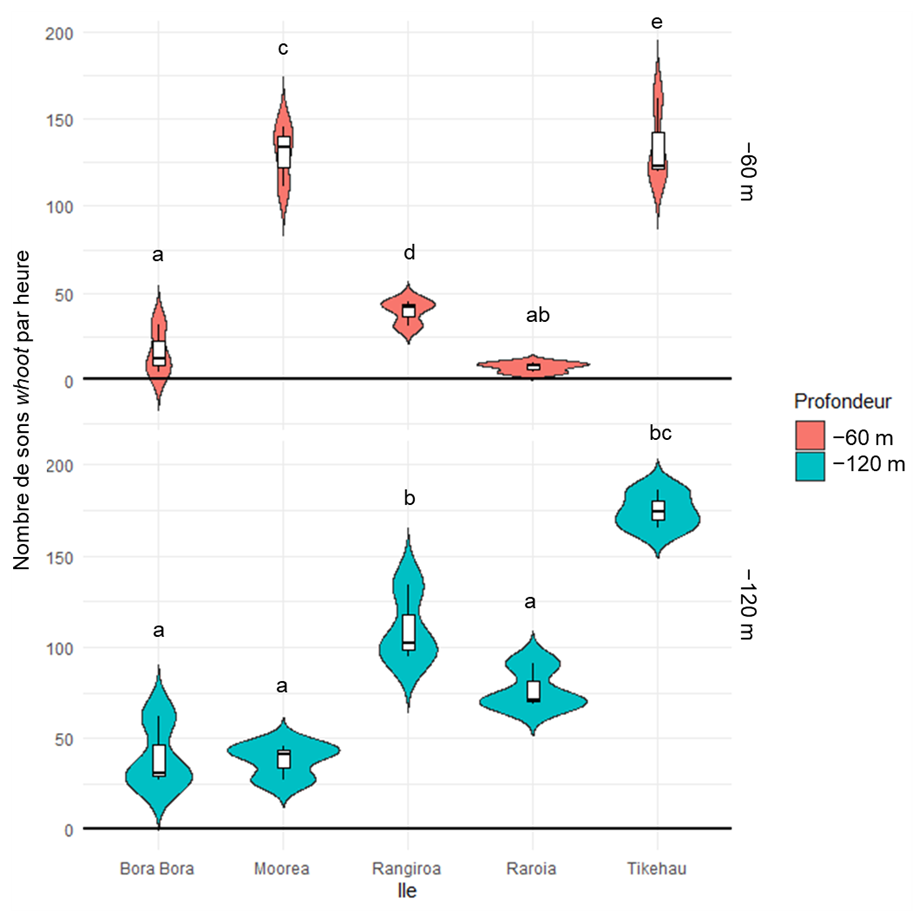
Figure 5. Nombre de sons whoot entre 17h et 7h par île à −60 m (en rouge, en haut) et à −120 m (en bleu, en bas). Trois réplicas ont été utilisés pour chaque profondeur et île. L’île de Mangareva n’a pas été incluse dans la figure car seules des données à −60 m étaient disponibles pour ce site. Les lettres représentent les différences statistiquement significatives observées lors de la comparaison entre les îles (−60 m à Mangareva = « b »). Les boites à moustache représentent la médiane (ligne épaisse), le premier quartile et le troisième quartile, tandis que la longueur des « moustaches » représente 1,5 fois l’écart interquartile. Les violons illustrent la distribution et la densité des données.
13À −60 m, aucun whoot n’a été enregistré à l’île de Mangareva (archipel des Gambier). En revanche, c’est à l’île de Tikehau (χ2 = 282, ddl = 5, p < 0,0001, test de Kruskal-Wallis ; −11 < Z < −6, p < 0,0001, test post-hoc de Dunn) et à l’île de Moorea (−13 < Z < 11, p < 0,0001, test post-hoc de Dunn) que le plus grand nombre de sons a été enregistré. Le nombre de whoots enregistrés était minimal l’après-midi (12h à 16h59, 0,7 ± 1,2 sons par heure, moyenne ± écart type) puis il augmentait au coucher du soleil (17h à 18h59, 140 ± 100 sons par heure) et en première partie de nuit (19h à 23h59, 403 ± 72 sons par heure) avant de diminuer en seconde partie de nuit (0h à 4h59, 189 ± 31 sons par heure), au lever du soleil (5h à 6h59, 20 ± 13 sons par heure) et le matin (7h à 11h59, 7 ± 13 sons par heure) (Figure 6).
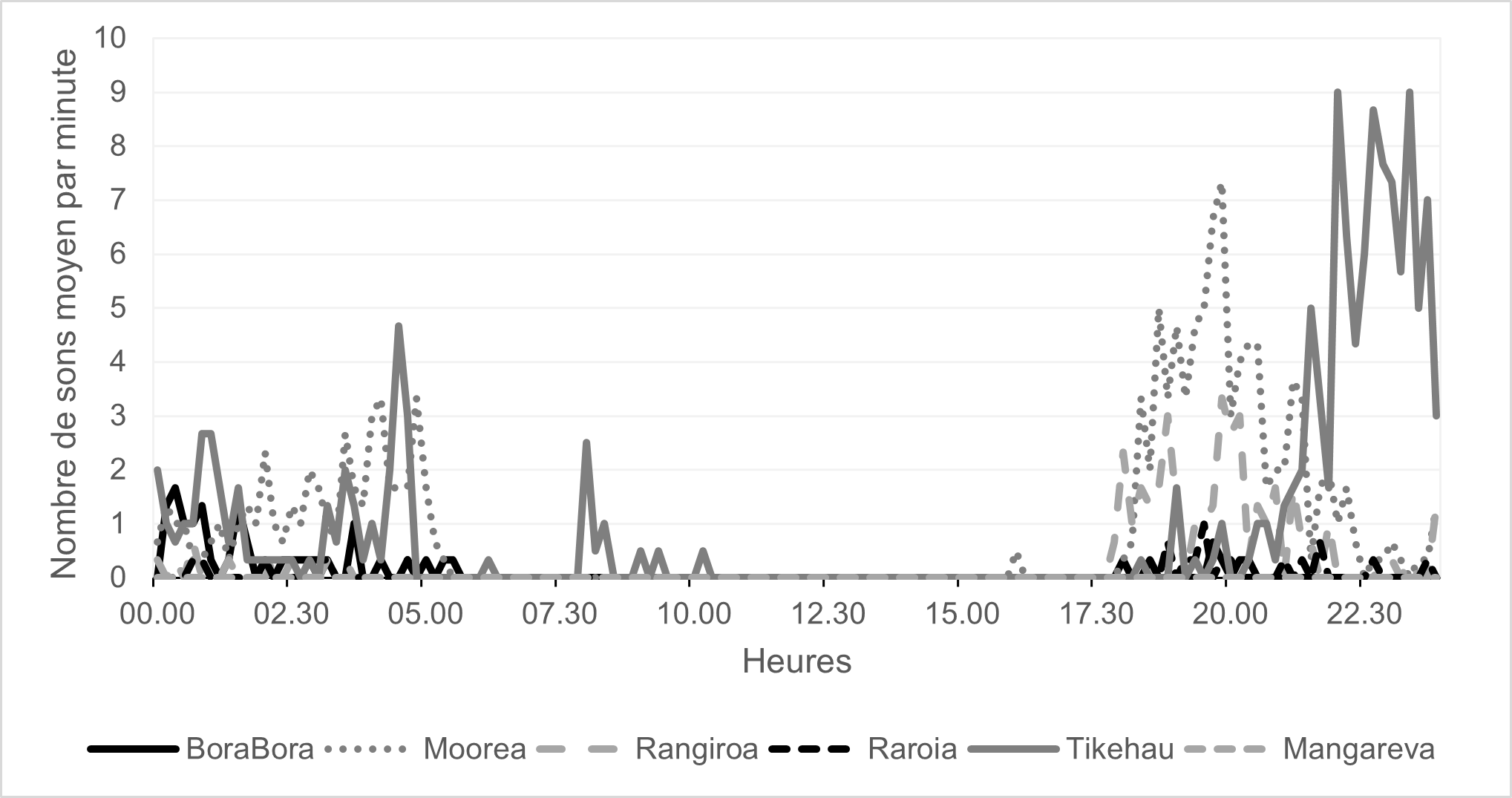
Figure 6. Cycle jour/nuit du nombre de sons whoot enregistrés à une profondeur de −60 m par minute pour chaque île étudiée. L’aspect nocturne de ces émissions est clairement visible.
14À −120 m, le plus grand nombre de whoots a été enregistré à l’île de Tikehau (χ2 = 38, ddl = 4, p < 0,0001, test de Kruskal-Wallis ; −5 < Z < −3, p < 0,001, test post-hoc de Dunn) et à l’île de Rangiroa (−4 < Z < 3, p < 0,01, test post-hoc de Dunn), deux atolls voisins dans l’archipel des Tuamotu. Aucun whoot n’a été enregistré l’après-midi (12h à 16h59). Ensuite, le nombre augmentait au coucher du soleil (17h à 18h59, 272 ± 50 sons par heure) et en première partie de nuit (19h à 23h59, 595 ± 6 sons par heure) avant de diminuer en seconde partie de nuit (0h à 4h59, 173 ± 53 sons par heure), au lever du soleil (5h à 6h59, 10 ± 5 sons par heure) et en matinée (7h à 11h59, 0,7 ± 1,2 sons par heure) (Figure 7).
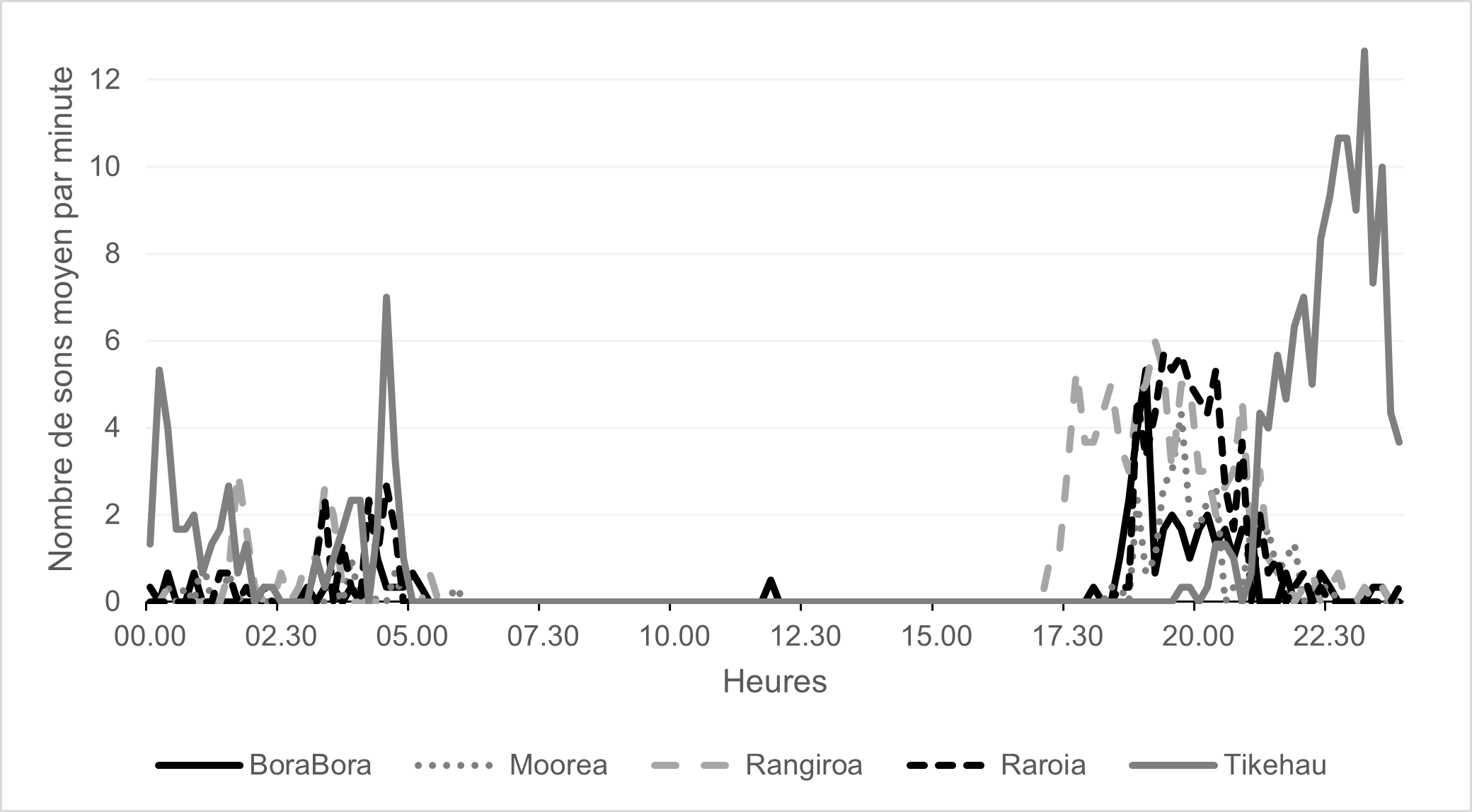
Figure 7. Cycle jour/nuit du nombre de sons whoot enregistrés à une profondeur de −120 m par minute pour chaque île étudiée. L’aspect nocturne de ces émissions est clairement visible.
6. Discussion
15Lorsque la présence et l’occurrence géographique des whoots à −120 m en Polynésie française est examinée de manière approfondie, deux groupes d’îles peuvent être distingués. Le premier groupe est composé d’îles basses, également appelées atolls, de l’archipel des Tuamotu. Quant au deuxième groupe, il est constitué d’îles hautes de l’archipel de la Société. Les îles de Rangiroa, Raroia et Tikehau font partie du premier groupe, tandis que celles de Moorea et de Bora-Bora font partie du deuxième. On observe que ces îles se différencient par deux facteurs (archipel et type d’île). Alors que toutes les îles des Tuamotu sont des atolls, toutes les îles de l’archipel de la Société ne sont pas nécessairement des îles hautes. Malheureusement, aucun atoll de l’archipel de la Société n’a été enregistré lors de la mission UTP III. Une autre approche permettant de séparer ces deux facteurs serait d’étudier une île appartenant à un autre archipel. L’île de Mangareva, dans l’archipel des Gambier, répond parfaitement à ce critère, car c’est une île haute située à proximité de l’archipel des Tuamotu. Bien que cette île ait été échantillonnée lors de la mission UTP III, nous disposons uniquement de données à −20 et −60 m pour cette île en raison d’un problème technique. Une autre explication de l’hétérogénéité de la répartition géographique des sons whoot pourrait résider dans des différences temporelles. En effet, compte tenu de l’immensité de la Polynésie française (dont la taille est souvent comparée à celle de l’Europe), les comparaisons entre îles ne peuvent pas être réalisées simultanément, contrairement aux comparaisons entre les différentes profondeurs au sein d’une même île.
16En termes de profondeur, cette étude confirme la prédominance profonde des whoots, à l’exception de l’île de Moorea, île qui est également celle où des whoots avaient été brièvement enregistrés dans le récif euphotique (Bertucci et al. 2020). Dans cette étude de Bertucci et al. (2020), ces sons avaient été enregistrés entre 19h et 21h. Cette observation correspond à la période pendant laquelle le plus grand nombre de sons whoot a été enregistré dans notre étude (19h à 23h59). Étant donné que les whoots sont des sons présentant plusieurs modulations de fréquence, il est cohérent qu’ils soient émis principalement la nuit. En effet, les poissons qui vocalisent pendant la journée utilisent principalement leurs sons pour compléter des signaux visuels, signaux qui ne sont pas présents la nuit. Lorsqu’on considère la période regroupant le coucher du soleil et la nuit (entre 17h et 4h59), le nombre de whoot est cinquante fois supérieur à celui observé pendant la journée et au lever du soleil (entre 5h et 16h59). Ce résultat démontre clairement le caractère nocturne des émissions acoustiques de l’espèce produisant les whoots, une espèce encore non identifiée à ce jour. Bien que le whoot soit particulier dans la scène musicale sous-marine polynésienne, il présente des similitudes avec d’autres sons harmoniques (De Jong et al. 2007; Parmentier et al. 2011; Kéver et al. 2016; Mélotte et al. 2019; Raick et al. 2020, 2021b) et d’autres sons modulés en fréquence (Tower 1908; Bass et al. 1999; Rice and Bass 2009), deux caractéristiques que l’on retrouve chez les sons des poissons crapauds de la famille des Batrachoididae… une famille absente en Polynésie française. Davantage d’investigations sont donc nécessaires pour continuer à percer à jour les secrets du whoot, et les futurs chercheurs sont invités à se concentrer sur la période en début de nuit dans la partie inférieure des MCEs polynésiens.
Remerciements
17Des remerciements s’imposent envers le Professeur Éric Parmentier, directeur du Laboratoire de Morphologie Fonctionnelle et Évolutive de l’Université de Liège, promoteur de ma thèse de doctorat. Je tiens également à remercier le Docteur Lucia Di Iorio, chercheuse au Centre de Formation et de Recherche sur les Environnements Méditerranéens (CEFREM), de l’Université de Perpignan Via Domitia), co-promotrice de ma thèse de doctorat. Mes remerciements vont également à mes (anciens) étudiants qui ont contribué, de près ou de loin, sur ce projet : Pierre Collet de l’Université de Lille et Julien Campisi de l’Université de Liège. L’échantillonnage n’aurait pas été possible sans le consortium Under The Pole, et je tiens à remercier tout particulièrement les plongeurs d’Under The Pole (UTP) ainsi que tous les membres de l’équipage de l’expédition UTP III. Je suis également reconnaissant envers le Professeur David Lecchini, chercheur au Centre de Recherches Insulaires et Observatoire de l'Environnement (CRIOBE), et le Docteur Frédéric Bertucci, chercheur à l’Institut de Recherche pour le Développement (IRD) pour leur aide précieuse sur ce projet.
Informations complémentaires
Identifiant ORCID de l’auteur
18X.R. : 0000-0002-1977-0289
Déclaration relative aux conflits d’intérêt
19L'auteur déclare l’absence de tout conflit d’intérêt.
Déclaration de disponibilité des données
20Des données relatives à cette étude peuvent être trouvées sur le répertoire Zenodo (doi : 10.5281/zenodo.7940933).
Références
Bibliographie
Au WWL, Hastings MC (2008) Principles of Marine Bioacoustics. Springer US, New York, NY
Baldwin CC, Tornabene L, Robertson DR (2018) Below the Mesophotic. Sci Rep 8:4920. https://doi.org/10.1038/s41598-018-23067-1
Bass AH, Bodnar DA, Marchaterre MA (1999) Complementary explanations for existing phenotypes in an acoustic communication system. In: Hauser M, Konishi M (eds) Neural Mechanisms of Communication. MIT Press, Cambridge, pp 493–514
Bazua-Duran MC (1997) Comparisons of whistls among different groups dolphins (Tursiops truncates) from the Gulf of Mexico. Universidad Nacional Autonoma de Mexico
Bertucci F, Maratrat K, Berthe C, et al (2020) Local sonic activity reveals potential partitioning in a coral reef fish community. Oecologia 193:125-134. https://doi.org/10.1007/s00442-020-04647-3
Bertucci F, Parmentier E, Berthe C, et al (2017) Snapshot recordings provide a first description of the acoustic signatures of deeper habitats adjacent to coral reefs of Moorea. PeerJ 2017:e4019. https://doi.org/10.7717/peerj.4019
Bertucci F, Parmentier E, Lecellier G, et al (2016) Acoustic indices provide information on the status of coral reefs: An example from Moorea Island in the South Pacific. Sci Rep 6:1–9. https://doi.org/10.1038/srep33326
Bongaerts P, Ridgway T, Sampayo EM, Hoegh-Guldberg O (2010) Assessing the “deep reef refugia” hypothesis: Focus on Caribbean reefs. Coral Reefs 29:1–19. https://doi.org/10.1007/s00338-009-0581-x
Bouchon C (1985) Quantitative study of Scleractinian Coral communities of Tiahura Reef, Moorea Island, French Polynesia. In: The Fifth International Coral. Tahiti, 27 May -1 June. C. Gabrie and M. Harmelin. Vol. 6. pp. 279-284.
Cato DH (1978) Marine biological choruses observed in tropical waters near Australia. J Acoust Soc Am 64:736. https://doi.org/10.1121/1.382038
Cerchio S, Andrianantenaina B, Lindsay A, et al (2015) Omura’s whales (Balaenoptera omurai) off northwest Madagascar: ecology, behaviour and conservation needs. R Soc Open Sci 2:150301. https://doi.org/10.1098/rsos.150301
Chevalier J-P, Kuhlmann DHH (1983) Les scléractiniaires de Moorea. Ile de la Société (Polynésie française). J Soc Ocean 77:55–75
Dawbin WH, Cato DH (1992) Sounds of a pygmy right whale (Caperea Marginata). Mar Mammal Sci 8:213–219. https://doi.org/10.1111/j.1748-7692.1992.tb00405.x
De Jong K, Bouton N, Slabbekoorn H (2007) Azorean rock-pool blennies produce size-dependent calls in a courtship context. Anim Behav 74:1285–1292. https://doi.org/10.1016/j.anbehav.2007.02.023
Desiderà E, Guidetti P, Panzalis P, et al (2019) Acoustic fish communities: Sound diversity of rocky habitats reflects fish species diversity. Mar Ecol Prog Ser 608:183–197. https://doi.org/10.3354/meps12812
Desiderà E, Mazzoldi C, Navone A, et al (2022) Reproductive Behaviours and Potentially Associated Sounds of the Mottled Grouper Mycteroperca rubra: Implications for Conservation. Diversity 14:318. https://doi.org/10.3390/d14050318
Di Iorio L, Audax M, Deter J, et al (2021) Biogeography of acoustic biodiversity of NW Mediterranean coralligenous reefs. Sci Rep 11:16991. https://doi.org/10.1038/s41598-021-96378-5
Di Iorio L, Gervaise C, Jaud V, et al (2012) Hydrophone detects cracking sounds: Non-intrusive monitoring of bivalve movement. J Exp Mar Bio Ecol 432–433:9–16. https://doi.org/10.1016/j.jembe.2012.07.010
Di Iorio L, Raick X, Parmentier E, et al (2018) ‘Posidonia meadows calling’: a ubiquitous fish sound with monitoring potential. Remote Sens Ecol Conserv 4:248–263. https://doi.org/10.1002/rse2.72
Dominello T, Širović A (2016) Seasonality of Antarctic minke whale (Balaenoptera bonaerensis) calls off the western Antarctic Peninsula. Mar Mammal Sci 32:826–838. https://doi.org/10.1111/mms.12302
Fine ML, Bernard B, Harris TM (1993) Functional morphology of toadfish sonic muscle fibers: relationship to possible fiber division. Can J Zool 71:2262–2274. https://doi.org/10.1139/z93-318
Fine ML, Parmentier E (2015) Mechanisms of Fish Sound Production. In: Ladich F (ed) Sound Communication in Fishes. Springer Vienna, Vienna, pp 77–126
Hallacher LE (1974) The Comparative Morphology of Extrinsic Gasbladder Musculature in the Scorpionfish Genus Sebastes (Pisces: Scorpaenidae). Proc Calif Acad Sci Fourth Ser 40:59–86
Hartman DS (1979) Ecology and behavior of the Manatee (Trichechus manatus) in Florida. American Society of Mammalogists, [Pittsburgh, Pa.]
Hildebrand J (2009) Anthropogenic and natural sources of ambient noise in the ocean. Mar Ecol Prog Ser 395:5–20. https://doi.org/10.3354/meps08353
Hughes TP (2003) Climate Change, Human Impacts, and the Resilience of Coral Reefs. Science 301:929–933. https://doi.org/10.1126/science.1085046
Johnson MW, Everest FA, Young RW (1947) The role of snapping shrimp (Crangon and Synalpheus) in the production of underwater noise in the sea. Biol Bull 93:122–138. https://doi.org/10.2307/1538284
Jublier N, Bertucci F, Kéver L, et al (2020) Passive monitoring of phenological acoustic patterns reveals the sound of the camouflage grouper, Epinephelus polyphekadion. Aquat Conserv Mar Freshw Ecosyst 30:42–52. https://doi.org/10.1002/aqc.3242
Kahng S, Copus JM, Wagner D (2016) Mesophotic Coral Ecosystems, In: Rossi, S., Bramanti, L., Gori, A., Orejas , C. (eds) Marine Animal Forests. Springer, Cham. https://doi.org/10.1007/978-3-319-17001-5_4-1
Kéver L, Colleye O, Lugli M, et al (2014) Sound production in Onuxodon fowleri (Carapidae) and its amplification by the host Shell. J Exp Biol 217:4283–4294. https://doi.org/10.1242/jeb.109363
Kéver L, Lejeune P, Michel LN, Parmentier E (2016) Passive acoustic recording of Ophidion rochei calling activity in Calvi Bay (France). Mar Ecol 37:1315–1324. https://doi.org/10.1111/maec.12341
Krause B (1987) Bioacoustics: Habitat Ambience & Ecological Balance. Whole Earth Rev 57:14–16
Ladich F, Fine ML (2006) Sound-generating mechanisms in fishes: a unique diversity in vertebrates. In: Collin S, Moller P, Kappor B (eds) Communication in Fishes. Science Publishers, Enfield, pp 3–34
Lammers MO, Au WWL (1996) Broadband recording of social acoustic signals of the Hawaiian spinner and spotted dolphins. J Acoust Soc Am 100:2609–2609. https://doi.org/10.1121/1.417642
Lammers MO, Brainard RE, Au WWL, et al (2008) An ecological acoustic recorder (EAR) for long-term monitoring of biological and anthropogenic sounds on coral reefs and other marine habitats. J Acoust Soc Am 123:1720–1728. https://doi.org/10.1121/1.2836780
Leis JM, McCormick MI (2002) The Biology, Behavior, and Ecology of the Pelagic, Larval Stage of Coral Reef Fishes. In: Coral Reef Fishes. Pp 171–199
Lin TH, Akamatsu T, Sinniger F, Harii S (2021) Exploring coral reef biodiversity via underwater soundscapes. Biol. Conserv. 253:108901. https://doi.org/10.1016/j.biocon.2020.108901
Mann D, Locascio J V, Coleman FC, Koenig CC (2009) Goliath grouper Epinephelus itajara sound production and movement patterns on aggregation sites. Endanger Species Res 7:229–236. https://doi.org/10.3354/esr00109
Mann DA, Lobel PS (1995) Passive acoustic detection of sounds produced by the damselfish, Dascyllus albisella (Pomacentridae). Bioacoustics 6:199–213. https://doi.org/10.1080/09524622.1995.9753290
McCauley RD, Thomas F, Parsons MJG, et al (2017) Developing an Underwater Sound Recorder: The Long and Short (Time) of It... Acoust Aust 45:301–311. https://doi.org/10.1007/s40857-017-0113-8
McDonald MA, Moore SE (2002) Calls recorded from North Pacific right whales (Eubalaena japonica) in the eastern Bering Sea. J Cetacean Res Manag 4:261–266
Mellen RH (1952) The Thermal-Noise Limit in the Detection of Underwater Acoustic signals. J Acoust Soc Am 24:478-480. https://doi.org/10.1121/1.1906924
Mélotte G, Raick X, Vigouroux R, Parmentier E (2019) Origin and evolution of sound production in Serrasalmidae. Biol J Linn Soc 128:403-414. https://doi.org/10.1093/biolinnean/blz105
Minier L, Raick X, Gairin E, et al (2023) ‘Habitat-associated soundscape’ hypothesis tested on several coral reefs within a lagoon (Bora-Bora Island, French Polynesia). Mar Biol 170:61. https://doi.org/10.1007/s00227-023-04206-3
Mooney TA, Di Iorio L, Lammers M, et al (2020) Listening forward: Approaching marine biodiversity assessments using acoustic methods: Acoustic diversity and biodiversity. R Soc Open Sci 7:201287. https://doi.org/10.1098/rsos.201287
Myrberg AA, Fuiman LA (2002) The Sensory World of Coral Reef Fishes. Elsevier Science (USA)
Nelson M, Koenig CC, Coleman FC, Mann DA (2011) Sound production by red grouper (Epinephelus morio) on the West Florida Shelf. Aquat Biol 12:97–108. https://doi.org/10.3354/ab00325
Nishiwaki M, Marsh H (1985) Dugong Dugong dugon (Müller, 1776). In: Ridgway SH, Harrison R (eds) Handbook of Marine Mammals Vol. 3. Academic Press, London, pp 1–31
Parmentier E, Fine M, Vandewalle P, et al (2006) Sound production in two carapids (Carapus acus and C. mourlani) and through the sea cucumber tegument. Acta Zool 87:113–119. https://doi.org/10.1111/j.1463-6395.2006.00221.x
Parmentier E, Marucco Fuentes E, Millot M, et al (2021) Sound production, hearing sensitivity, and in-depth study of the sound-producing muscles in the cowfish (Lactoria cornuta). J Anat 238:956-969. https://doi.org/10.1111/joa.13353
Parmentier E, Raick X, Lecchini D, et al (2017) Unusual sound production mechanism in the triggerfish Rhinecanthus aculeatus (Balistidae). J Exp Biol 220:186–193. https://doi.org/10.1242/jeb.146514
Parmentier E, Scalbert R, Raick X, et al (2022) First use of acoustic calls to distinguish cryptic members of a fish species complex. Zool J Linn Soc 195:964-975. https://doi.org/10.1093/zoolinnean/zlab056
Parmentier E, Solagna L, Bertucci F, et al (2019) Simultaneous production of two kinds of sounds in relation with sonic mechanism in the boxfish Ostracion meleagris and O. cubicus. Sci Rep 9:4962: 1–13. https://doi.org/10.1038/s41598-019-41198-x
Parmentier E, Vandewalle P, Brié C, et al (2011) Comparative study on sound production in different Holocentridae species. Front Zool 8:12. https://doi.org/10.1186/1742-9994-8-12
Pichon M (2019) French Polynesia. In: Loya Y, Puglise KA, Bridge TCL (eds) Marine Animal Forests: The Ecology of Benthic Biodiversity Hotspots, Springer. pp 425–444
Pinheiro HT, Goodbody-Gringley G, Jessup ME, et al (2016) Upper and lower mesophotic coral reef fish communities evaluated by underwater visual censuses in two Caribbean locations. Coral Reefs 35:139–151. https://doi.org/10.1007/s00338-015-1381-0
Purkis S, Dempsey A, Carlton RD, et al (2017) Global Reef Expedition: French Polynesia. Final Report
Pyle RL, Boland R, Bolick H, et al (2016) A comprehensive investigation of mesophotic coral ecosystems in the Hawaiian Archipelago. PeerJ 2016:1–45. https://doi.org/10.7717/peerj.2475
Radford C, Jeffs A, Tindle C, Montgomery JC (2008) Resonating sea urchin skeletons create coastal choruses. Mar Ecol Prog Ser 362:37–43. https://doi.org/10.3354/meps07444
Raick X (2015) Production de sons chez le baliste Picasso Rhinecanthus aculeatus (Linnæus, 1758). Master thesis, University of Liege, 67p. https://hdl.handle.net/2268/221057
Raick X, Di Iorio L, Gervaise C, et al (2021a) From the Reef to the Ocean: Revealing the Acoustic Range of the Biophony of a Coral Reef (Moorea Island, French Polynesia). J Mar Sci Eng 9:420. https://doi.org/10.3390/jmse9040420
Raick X, Di Iorio L, Lecchini D, et al (2023) Fish sounds of photic and mesophotic coral reefs: variation with depth and type of island. Coral Reefs, 42:285-297. https://doi.org/10.1007/s00338-022-02343-7
Raick X, Gervaise C, Hermand J-P (2017) Comparative analysis of /kwa/ fish sounds recorded during an early ecoacoustics experiment in a Posidonia oceanica seagrass meadow (Ustica Island, 1999). J Acoust Soc Am 141:3864–3864. https://doi.org/10.1121/1.4988633
Raick X, Huby A, Kurchevski G, et al (2020) Use of bioacoustics in species identification: piranhas from genus Pygocentrus (Teleostei: Serrasalmidae) as a case study. PLoS One 15:e0241316. https://doi.org/10.1371/journal.pone.0241316
Raick X, Koussa A, Zawadzki CH, et al (2022) Sounds and associated morphology of Hypostomus species from South-East Brazil. J Zool 317:77-91. https://doi.org/10.1111/jzo.12967
Raick X, Lecchini D, Kéver L, et al (2018) Sound production mechanism in triggerfish (Balistidae): a synapomorphy. J Exp Biol 221:jeb168948. https://doi.org/10.1242/jeb.168948
Raick X, Rountree R, Kurchevski G, et al (2021b) Acoustic homogeneity in the piranha Serrasalmus maculatus. J Fish Biol 98:1303-1307. https://doi.org/10.1111/jfb.14662
Rancher J, Rougerie F (1994) L’environnement océanique de l’archipel des Tuamotu (Polynésie Française). Oceanol Acta 18:43–60
Rice AN, Bass AH (2009) Novel vocal repertoire and paired swimbladders of the three-spined toadfish, Batrachomoeus trispinosus: Insights into the diversity of the Batrachoididae. J Exp Biol 212:1377–1391. https://doi.org/10.1242/jeb.028506
Rice AN, Farina SC, Makowski AJ, et al (2022) Evolutionary Patterns in Sound Production across Fishes. Ichthyol. Herpetol. 110:1-12. https://doi.org/10.1643/i2020172
Risch D, Gales NJ, Gedamke J, et al (2014) Mysterious bio-duck sound attributed to the Antarctic minke whale (Balaenoptera bonaerensis). Biol Lett 10:20140175. https://doi.org/10.1098/rsbl.2014.0175
Rogers T, Cato DH, Bryden MM (1995) Underwater vocal repertoire of the leopard seal (Hydrurga leptonyx) in Prydz Bay, Antartica. In: Kastelein RA, Thomas JA, Nachtigall PE (eds) Sensory Systems of Aquatic Mammals. De Spil, Woerden, The Netherlands, pp 223–236
Ross D (1976) Mechanics of underwater noise. Pergamon Press, New York
Rougerie F, Fichez R, Déjardin P (1997) Geomorphology and hydrogeology of selected islands of French Polynesia: Tikeahau (atoll) and Tahiti (barrier reef). In: Geology and Hydrogeology of Carbonate Islands. Developments in Sedimentology 54. pp 475–502
Rouzé H, Galand PE, Medina M, et al (2021) Symbiotic associations of the deepest recorded photosynthetic scleractinian coral (172 m depth). ISME J 15:1564–1568. https://doi.org/10.1038/s41396-020-00857-y
Schevill WE, Watkins WA, Ray CG (1966) Analysis of underwater Odobenus calls with remarks on the develoment and function of the pharyngeal pouches. Zoologica 51:103–106
Schusterman RJ, Gentry RL, Schmook J (1967) Underwater sound production by captive California sea lions, Zalophus californianus. Zool Sci Contrib New York Zool Soc 52:21–24. https://doi.org/10.5962/p.203257
Shurbet DH (1955) Bermuda T phases with large continental paths. Seism Soc Am Bull 45:23–25
Siu G, Bacchet P, Bernardi G, et al (2017) Shore fishes of French Polynesia. Cybium 41:245–278
Spalding MD, Grenfell AM (1997) New estimates of global and regional coral reef areas. Coral Reefs 16:225–230. https://doi.org/10.1007/s003380050078
Stirling I, Calvert W, Spencer C (1987) Evidence of stereotyped underwater vocalization of male Atlantic walruses (Odobenus rosmarus). Can J Zool 65:2311–2321
Tavolga WN (1971) Acoustic orientation in the sea catfish Galeichthys felis. Ann N Y Acad Sci 188:80–97
Tavolga WN (1976) Acoustic obstacle detection in the sea catfish Arius felis. In: Schuijf A, Hawkins AD (eds) Sound Reception in Fish. Elsevier, Amsterdam, pp 185–204
Thomas J, Kastelein R (eds) (1990) Acoustic behavior of mysticete whales. In: Sensory Abilities of Cetaceans. Plenum, New York, pp 571–583
Tolstoy I, Ewing M (1950) The T phase of shallow-focus earthquakes. Bull Seismol Soc Am 40:25–51. https://doi.org/10.1785/BSSA0400010025
Tower RW (1908) The production of sound in the drumfishes, the sea-robin and the toadfish. Ann N Y Acad Sci 18:149–180. https://doi.org/10.1111/j.1749-6632.1908.tb55101.x
Trapon ML, Pratchett MS, Penin L (2011) Comparative Effects of Different Disturbances in Coral Reef Habitats in Moorea, French Polynesia. J Mar Biol 2011:1–11. https://doi.org/10.1155/2011/807625
Watkins WA, Ray GC (1977) Underwater sounds from ribbon seal, Phoca (Histriophoca) fasciata. Fish Bull 75:450–453
Wenz GM (1962) Acoustic Ambient Noise in the Ocean: Spectra and Sources. J Acoust Soc Am 34:1936–1956. https://doi.org/10.1121/1.1909155
Ἀριστοτέλης (Aristote) (343AC) Περὶ τὰ ζῷα ἱστορίαι (Histoire des Animaux) IX