- Portada
- Volume 89 - Année 2020
- Articles
- Étude de l'évolution de la capacité anti-radicalaire du fruit de l'Arbutus unedo L. à différents stades de maturation
Vista(s): 6577 (12 ULiège)
Descargar(s): 245 (0 ULiège)
Étude de l'évolution de la capacité anti-radicalaire du fruit de l'Arbutus unedo L. à différents stades de maturation

Documento adjunto(s)
Version PDF originaleRésumé
La présente étude a pour objectif d’évaluer l’effet du stade de maturation sur le contenu en substances bioactives, en particulier les composés antioxydants de nature phénolique extraites par des solutions hydroéthanoliques et l’estimation de l'évolution de l’activité antioxydante du fruit de l'Arbousier (Arbutus unedo L.).
Les fruits de l'Arbousier ont été classés en 4 stades, le premier stade est quand le fruit est de couleur verte, le stade 2 comprend les fruits jaunes, le troisième stade est lorsque le fruit devient orange, alors que le stade 4 représente le dernier stade où les fruits sont en pleine maturité c'est à dire rouges. Quatre extraits sont obtenus, les fruits à maturité; fruits oranges et fruits rouges ont donné des quantités élevées en terme de rendement d'extraction par le solvant hydroalcoolique.
Les différents extraits ont été testés pour leur teneur en composés phénoliques totaux, flavonoïdes, tannins condensés, chlorophylle et caroténoïdes, ainsi que leur activité antioxydante (anti-radicalaire). Les résultats obtenus montrent que le stade de maturation affecte significativement la teneur en antioxydants ainsi que l’activité antioxydante. On observe une réduction des tannins au cours de la maturation; de 124,9 mgCE/g dans le fruit non mûrs à 63,8 mgCE/g dans les fruits en pleine maturité. A l'opposé, le contenu en flavonoïdes augmente; de 11,5 mgRE/g dans le fruit vert à 38,9mgRE/g dans le fruit orange. Les anthocyanes sont présentes dans le fruit à maturité et atteignent un seuil élevé en pleine maturité (12,7 µg/g). Nos résultats sur l'activité antiradicalaire montrent que le stade de maturation affecte sensiblement le pouvoir anti-radicalaire du fruit. Tous les fruits ont la capacité de piéger efficacement le radical libre DPPH, mais le potentiel antioxydant le plus puissant (EC50: 0,5 mg/ml) est observé quand le fruit arrive à sa pleine maturation.
Abstract
The objective of this study is to evaluate the effect of the ripening stage on phytochemical composition, in particular the phenolic antioxidant compounds and antioxidant activity of Arbutus unedo L. fruits.
The fruits of the strawberry tree have been classified in 4 stages, the first stage is when the fruit is green, stage 2 includes yellow fruits, the third stage is when the fruit turns orange, while stage 4 represents the last stage where the fruit so ripe, i.e. red. Four extracts are obtained, the ripe orange and red fruits yielded high amounts in terms of extraction yield by a hydroethanolic solvent.
Extracts were tested for their content of total phenolic, flavonoids, condensed tannins, chlorophyll, and carotenoids, as well as their antiradical activity. The results obtained show that the ripening stage significantly affects antioxidant content as well as antiradical activity. Tannins are reduced during the ripening period; 124,9 mgCE/g in unripe fruit to 63,8 mgCE/g in fully ripe fruit. In contrast, the content of flavonoids increases; 11,5 mgRE/g in green fruit to 38,9 mgRE/g in orange fruit. Anthocyanins are present in the ripe fruit and reach a high value at the full ripe stage (12,7 µg/g). Our results on antiradical activity show that the ripening stage significantly influences the antiradical power of the fruit. All the fruits have the ability to scavenge free radical DPPH, whereas the most potent antiradicalar potential (EC50: 0,5mg/ml) is observed when the fruit reaches full ripe stage.
Tabla de contenidos
1. Introduction
1L’être humain a toujours apprécié les vertus apaisantes et analgésiques des plantes et à travers les siècles, les traditions humaines ont su développer la connaissance et l’utilisation des plantes médicinales dont les deux tiers de la pharmacopée ont recours à leurs propriétés curatives (Iserin, 2001).
2Beaucoup de chercheurs s’intéressent aux plantes médicinales en raison de leur réservoir immense en composés potentiels et en molécules bioactives. A coté des métabolites primaires, elles accumulent fréquemment des métabolites dits secondaires (Kreif, 2003), qui se caractérisent par une grande diversité de structure chimique et un très large éventail d’activités biologiques (Wills et al., 2000) et demeurent l’objet de nombreuses recherches in vitro et in vivo (Marc et al., 2004; Huang et al., 2005; Popovici et al., 2009).
3Arbutus undo L. a longtemps été utilisé en médecine populaire, dans tous les pays méditerranéens, avec l'emploi de presque toutes les parties de cette plante: feuilles, fruits, écorces et racines. L'application de ces parties comme remèdes traditionnels découle de plusieurs caractéristiques favorisant la santé; plusieurs composés présents dans différentes parties de la plante comme des flavonoïdes, des acides phénoliques et des caroténoïdes, peuvent être liés à ces propriétés, à savoir anti-inflammatoires, anti-hypertension et dans le traitement des problèmes gastro-intestinaux et urologiques et les maladies cardiaques (Oliveira et al., 2011).
4Le fruit de l'Arbousier est appelé Arbouse; c'est une petite baie sphérique, de couleur rouge orangé à maturité. Les arbouses mettent presque un an pour arriver à maturité. Elles sont de taille de 1cm à 2cm, charnues, et ressemblent aux fraises chinoises, Myrica rubra Sieboid & Zucc. Comme toutes les baies, l'Arbouse est un puissant allié pour la santé, utilisée par la population locale pour rétablir la tension, pour traiter les maladies rénales et les troubles digestifs. Au cours de sa maturation et développement, le fruit subit plusieurs changements de saveur, texture et couleur en raison de variations qualitatives et quantitatives dans la composition phytochimique y compris les substances bioactives qu'il contient.
5Les fruits non mûrs sont généralement durs en consistance, acides dans la saveur et astringents. Ils deviennent savoureux, sucrés, moins astringents, moins acides, et bien aromatisés à la suite de la maturation, donc de plus en plus agréables au goût à la consommation humaine. Pendant la maturation une série de réactions affectent la formation de composés phénoliques, de caroténoïdes et d'autres composés volatils conduisant au développement des caractéristiques finales et à la saveur distincte d'un fruit mûr (Bashir et Abu-Goukh, 2003; Jain et al., 2003; Gull et al., 2012).
6La capacité antioxydante du fruit mûr et d'autres activités comme l'activité antimicrobienne ont été rapportée (Tavares et al., 2010; Akay et al., 2011; Ben Salem et al., 2018; Takwa et al., 2018). Ce présent travail a pour objectif de suivre l'évolution de la capacité antioxydante (anti-radicalaire) de ce fruit à différents stades de sa maturation.
2. Matériel et Méthodes
2.1. Matériel végétal
7Les fruits d'Abutus unedo L. (Figure 1) sont collectés sur les monts de la commune de Fellaoucene ( 35° 02' 06" nord, 1° 36' 21" ouest), ville de Tlemcen, située au Nord-Ouest de l'Algérie.

Figure 1: Arbuste d'Arbutus unedo de la forêt de Fillaoucene
(photo prise le 13 octobre 2018)
8Les fruits sont récoltés à différents stades de maturations, puis sont triés et partagés en 4 lots en se basant sur un critère biochimique et visuel: la pigmentation (couleur du fruit) :
9 - stade1: stade fruit vert
10 - stade 2: stade fruit jaune
11 - stade 3: stade fruit orange
12 -stade 4: stade fruit rouge
13Dans chaque stade de maturation, le fruit présente un certain nombre de caractéristiques qui sont décrites dans le tableau 1.
Tableau 1 : Caractéristiques des fruits d'Arbutus unedo L. aux quatre stades de maturation
|
Stade |
1 |
2 |
3 |
4 |
|
Couleur |
verte |
jaune |
orange |
rouge |
|
Photo du fruit |
|
|
|
|
|
Consistance |
dure à très dure |
dure |
ferme à molle |
molle à très molle |
|
Maturité |
immature |
immature |
mature |
pleine maturité |
|
Consommation |
non comestible |
non comestible |
comestible |
comestible |
2.2. Méthode d'extraction
14Les extraits secs des fruits d'Arbutus unedo L. à différents stades de maturation sont obtenus par des solutions hydroalcooliques selon le schéma d'extraction ci-dessous (Figure 2). Pour chaque fruit, une masse de 100 g est macérée à froid pendant 12 heures dans de l'éthanol aqueux (70 %). Le mélange est filtré sur papier Whatman N°.1, puis filtré sous vide sur papier Whatman 0,45µm. Le filtrat est concentré sous pression réduite à la température de 50 °C dans un évaporateur rotatif, puis laissé à sécher dans une étuve à la température de 50 °C jusqu'à l'obtention d'un extrait sec. Les extraits secs obtenus sont appelés extraits bruts hydroéthanoliques. Ces extraits sont récupérés, pesés pour déterminer le rendement d'extraction en pourcentage, puis stockés à 4 °C dans un réfrigérateur dans des récipients opaques en verre.
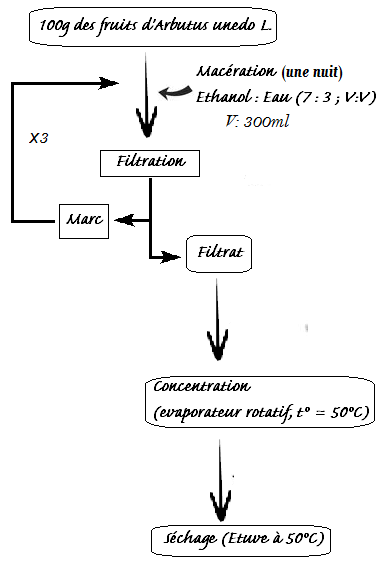
Figure 2: Schéma du protocole d'extraction des substances bioactives des fruits de l'Arbousier
2.3. Dosage des métabolites
2.3.1. Dosage des pigments chlorophylliens
15L'estimation quantitative de la teneur en chlorophylle est réalisée par la méthode d'Arnon, décrite par Chandran et Indira (2016). Une quantité connue d''extrait est solubilisée dans 10 ml acétone 80%. La solution est filtrée, puis le filtrat est ajusté à 5 ml avec de l'acétone 80 %. L'absorbance est lue à deux longueurs d'onde 645 nm et 663 nm contre un blanc contenant de l'acétone. La quantité de chlorophylle présente dans l'échantillon est calculée selon la formule d'Arnon.
16Chl a (mg/g) = [(12,7 × A663) - (2,6 × A645)] × ml acetone / mg extract
17Chl b (mg/g) = [(22,9 × A645) - (4,68 × A663)] × ml acetone / mg extract
18Total Chl = Chl a + Chl b.
2.3.2. Dosage du β-carotène
19Une masse (g) de l'extrait est récupérée dans du chloroforme, l'absorbance est mesurée au spectrophotomètre à la longueur d'onde de 450 nm. La teneur en β-carotènes est calculée par la relation ci-dessous (Fikselová et al., 2008) :
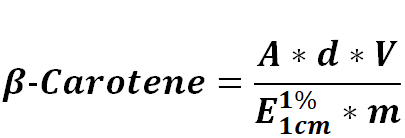
20Où :
21A : absorbance
22d: dilution
23E1 %1 cm : coefficient d'absorption (2396)
24m : masse de l'extrait (g)
25V : volume (ml)
2.3.3. Dosage des polyphénols
26Les teneurs en polyphénols sont déterminées par la méthode de Folin-Ciocalteu, décrite par Deepika et al. (2018). Une solution stock de 1mg/ml est préparée pour chaque échantillon. Un volume de 500 µl de réactif Folin-Ciocalteu (dilué 10 fois) est ajouté à 100 µl de la solution d'extrait, puis 400 µl de carbonate de sodium (7,5 %) sont ajoutés. Le mélange est incubé à l'obscurité pendant 30 minutes à température ambiante. Ensuite, l'absorbance est mesurée à 765 nm au spectrophotomètre UV/Vis. La même procédure est répétée pour la solution standard de l'acide gallique (0 à 500 µg/ml) pour établir la courbe d'étalonnage. La teneur en polyphénols (TPC) est exprimée en mg équivalent acide gallique (GAE) par g d'extrait sec (mgGAE/g).
27
2.3.4. Dosage des flavonoïdes
28La méthode colorimétrique de Chang et al. (2002) est utilisée pour déterminer la teneur en flavonoïdes. Des solutions d'extraits d'une concentration de 1mg/ml ont été préparées dans du méthanol 70 %. Un volume de 50 µl de chaque solution d'extrait est prélevé et mélangé à 150 µl d'éthanol 95 %, 10 µl de solution à 10 % de chlorure d'aluminium, 10 µl de tampon acétate de potassium 1M et 280 µl eau distillée. Après incubation dans l'obscurité à la température ambiante pendant 30 min, l'absorbance du mélange est mesurée au spectrophotomètre à 415 nm. Pour déterminer la teneur en flavonoïdes, 1 mg de rutine est dissoute dans 70 % éthanol, puis dilué pour obtenir différentes concentrations (de 0 à 300 µg/ml). Une courbe d'étalonnage de rutine est tracée et les résultats sont exprimés en mg d'équivalent rutine par gramme d'extrait (mgRE/g).
2.3.5. Dosage des tannins
29Le contenu en tannins (tannins condensés) est déterminé par la méthode à la vanilline décrite par Broadhurst et al (1978), en utilisant la catéchine comme référence pour le calcul. Cette méthode dépend de la réaction de la vanilline avec le groupement terminal des tannins condensés. Un volume de 200 μl de chaque extrait est ajouté à 1,5 ml solution de vanilline (4 % dans du méthanol), puis mélangé vigoureusement. Ensuite, un volume de 0,75 ml d'acide chlorhydrique concentré (HCl) est introduit délicatement. Le mélange obtenu est laissé à réagir à température ambiante pendant 15 min. L’absorbance est lue au spectrophotomètre à 500 nm. Pour la courbe d’étalonnage, différentes concentrations comprises entre 0 et 300 µg/ml sont préparées à partir d’une solution mère de 1mg/ml de catéchine. La teneur en tannins est exprimée en mg d'équivalent catéchine (EC)/g extrait.
2.3.6. Dosage des anthocyanes
30La teneur en anthocyanes est déterminée par la méthode spectrophotométrique des pH différentiels, selon la procédure décrite par Horwitz et Latimer (2005). Une masse d' extrait (51 mg) est introduite dans une fiole jaugée de 25 ml, le volume est ajusté avec de l'eau distillée. 500 µl de cette solution sont prélevés et introduits dans un tube sec, le volume est ajusté à 5 ml par une solution tampon KCl/HCl à pH 1,0. La même procédure est répétée avec une solution tampon acétate de sodium à pH 4,5. Les absorbances sont lues à 520 et à 700 nm. La teneur en pigments anthocyanes dans l'extrait brut est calculée à l'aide de l'équation suivante:
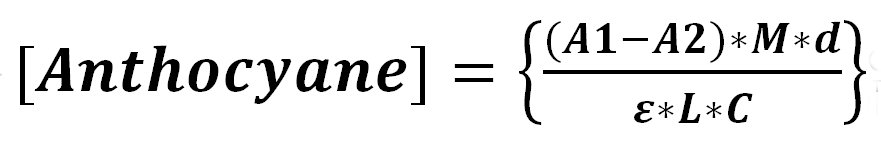
31où
32A1= (A520 - A700)pH1,0
33A2= (A520 - A700)pH4,5
34A: Absorbance
35M: poids moléculaire de la cyanidin-3-glucoside (449,2 g mol-1)
36d: facteur de dilution utilisé,
37ε: coefficient d'extinction molaire de la cyanidin-3-glucoside
38 (26900 l.mol-1.cm-1)
39L : 1,0 cm
40C: la concentration de l'extrait en mg par ml.
2.4. Activité antioxydante
41L'activité antioxydante est estimée par la méthode de piégeage du radical libre
DPPH (1,1-diphenyl-2-picryl-hydrazyl; M=394g/mol), selon le protocole de Brand-williams et al. (1995). Dans ce test, les antioxydants réduisent le diphényl picryl-hydrazyl ayant une couleur violette en un composé jaune. Un volume de 500 µl d'extrait à différentes concentrations est mélangé avec 500 µl de solution éthanolique de DPPH 0,2 mM. La lecture de l’absorbance est mesurée à 517 nm après 30 min d’incubation à l’obscurité et à température ambiante. Le contrôle négatif est constitué par de l'éthanol et le DPPH. Le contrôle positif est représenté par une solution d’un antioxydant standard, l’acide ascorbique à différentes concentrations, dont l’absorbance est mesurée dans les mêmes conditions que les échantillons (extraits). L’activité anti-radicalaire est calculée par l’équation ci-dessous :
42Inhibition (%)= [(A (Contrôle négatif ) – A (échantillon) / A (Contrôle négatif)] x 100
43Les valeurs EC50 sont ensuite déterminées graphiquement par la régression linéaire. EC50 ou concentration effectrice 50 %, exprime la concentration de l'échantillon qui produit 50 % d'effet anti-radicalaire (piège 50% de DPPH). Les valeurs EC50 et les données de tous les résultats obtenus expérimentalement sont exprimées en moyenne ± SD (n = 3).
3. Résultats et Discussion
44Les rendements d'extraction enregistrés varient entre 4,7 % et 11,4 % (figure 3). Les fruits rouges et oranges ont donné des rendements élevés par rapport aux fruits des autres stades de maturation. L'éthanol aqueux à 70 % représente un bon solvant et un bon extracteur pour les métabolites des fruits d'Arbutus unedo quand ces derniers sont à maturité. Avant la maturité, les fruits donnent des rendements faibles avec le solvant hydroéthanolique.
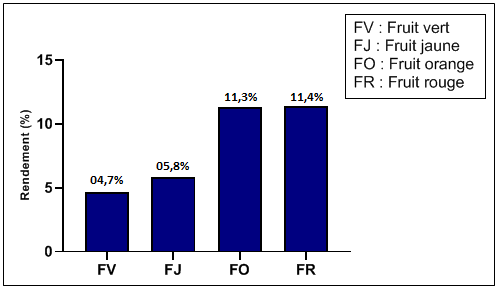
Figure 3: Rendement en extrait sec du fruit de l'Arbousier à différents stades de maturité.
45L'augmentation du taux d'extraction avec le stade de maturation a été aussi observé par Gull et al. (2012). Ces Auteurs ont utilisé du méthanol 80 % dans l'extraction des composés antioxydants et ont révélé qu'à mesure que la maturité des fruits de la goyave progressait, le pourcentage du rendement en extrait hydrométhanolique augmentait et que les fruits pleinement mûris avaient les plus hauts rendements en extraits.
46La chlorophylle est présente chez tous les organismes photosynthétiques, à l'origine de leur couleur verte. Les formes de chlorophylles présentes chez les végétaux supérieurs sont la chlorophylle a et la chlorophylle b. La chlorophylle a est le pigment qui convertit l’énergie lumineuse en énergie chimique. La chlorophylle b participe directement à la photosynthèse en transférant l’énergie absorbée à la chlorophylle a (Féret, 2009 ; Nayek et al., 2014).
Tableau 2: Teneurs en chlorophylles
|
Chl a (µg/g) |
Chl b (µg/g) |
Total Chl (µg/g) |
|
|
Fruit vert |
31,6 ± 0,1 |
61,9 ± 5,3 |
93,5 ± 1,4 |
|
Fruit jaune |
35,1 ± 2,0 |
55,1 ± 9,2 |
90,2 ± 2,2 |
|
Fruit orange |
- |
- |
- |
|
Fruit rouge |
- |
- |
- |
47- : Absence de pigment
48Les valeurs sont exprimées en moyenne ± SD (n = 3)
49Le tableau 2 permet de constater une légère baisse de la chlorophylle totale quand le fruit passe du stade fruit vert (93,5 µg/g) au stade fruit jaune (90,2 µg/g) avec une différence dans la distribution des deux types de chlorophylles aux deux stades. Dans les deux stades, la chlorophylle b est plus représentée que la chlorophylle a. Cette observation est faite aussi par Ait Braham et Belhamel (2016). Des études sur la pigmentation des fruits à divers stades de maturation ont montré que les chlorophylles diminuaient généralement à mesure que les caroténoïdes totaux augmentaient pendant la maturation (Trudel et Ozbun, 1970), ce qui est le cas pour le fruit d'Arbutus unedo L. De plus, le processus de différenciation du plastide vert en chromoplaste a été aussi décrit (Trudel et Ozbun, 1970) : le pigment chlorophyllien baisse durant les premiers stades et disparaît lorsque le fruit commence à devenir mature; il est absent dans les fruits à maturité, ce qui explique son absence dans le fruit orange et rouge.
50La figure 4 montre l'évolution de la teneur du β-carotène dans le fruit de l'Arbousier à différents stades de maturation; à l'inverse du pigment chlorophyllien, le β-carotène, à l'origine de la couleur allant de jaune à orange, est présent durant tous les stades et augmente quantitativement au cours du processus de maturation du fruit, pour atteindre un maximum de 136,0±3,6 µg/g au stade fruit orange. La teneur la plus faible en β-carotène est constatée au premier stade (63,4±1,8 µg/g) quand le fruit est encore vert. Les teneurs enregistrées font classer l'Arbouse parmi les fruits les plus riches en caroténoïdes (20 µg/g). Ces résultats concordent avec les travaux de Delgado-Pelayo et al. (2016), qui ont prouvé par analyse détaillée sur les caroténoïdes du fruit de l'Arbousier à maturité que la teneur dépassait le seuil de 20 µg/g. Ces auteurs ont enregistré une teneur en caroténoïdes totale de 340 µg/g.
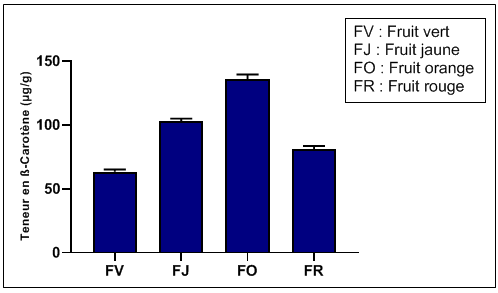
Figure 4: Teneur en β-carotène dans les extraits durant les 4 stades de maturation.
51Dix-sept caroténoïdes ont été identifiés par ces mêmes auteurs dans le fruit à maturité, dont le β-carotène est le seul carotène identifié avec un niveau élevé. Parmi les autres caroténoïdes identifiés, on cite: (E) violaxanthine, 9Z-violaxanthine, (E)-néoxanthine, 9'Z-néoxanthine, (E)-anthéraxanthine, lutéine 5,6-époxyde, (E)-lutéine, (E)-zéaxanthine.
52Les résultats de la figure 5 montrent la richesse du fruit de l'Arbousier en composés phénoliques à tous les stades de maturation. Fruits immatures ou matures contiennent des polyphénols avec des teneurs notables. Ces teneurs sont dans un intervalle compris entre un minimum de 155,7±5,4 mgGAE/g pour le fruit rouge et un maximum de 205,6±10,2 mgGAE/g pour le fruit orange. Les stades fruit vert et jaune ont à peu près des valeurs similaires : respectivement de 181,1±3,5 mgGAE/g et de 185,1±6,0 mgGAE/g.
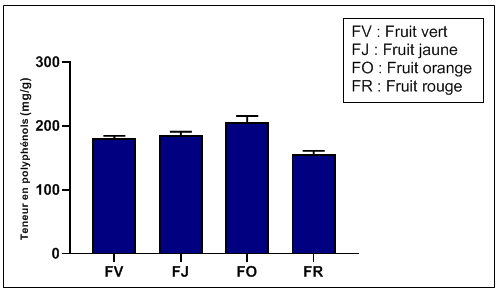
Figure 5: Evolution du contenu phénolique total dans les extraits durant les stades de la maturation du fruit.
53Les résultats du contenu phénolique total rapportés dans d'autres fruits soutiennent également nos constatations qui ont montré qu'au fur et à mesure que la maturation des fruits se poursuivait d'un stade mûr à trop mûr, une diminution est observée dans le contenu phénolique total (Rop et al., 2011; Gull et al., 2012). Ces auteurs suggèrent que la diminution est due à l'activité de la polyphénol oxydase. La diminution peut être liée aux variations dans la composition chimique en différents groupes de composés phénoliques durant le stade pleine maturité.
54Les résultats de la distribution des teneurs en flavonoïdes par rapport aux étapes de maturation des fruits sont exposés dans la figure 6. Comme pour les polyphénols, le fruit au stade orange présente aussi des teneurs élevées en flavonoïdes.
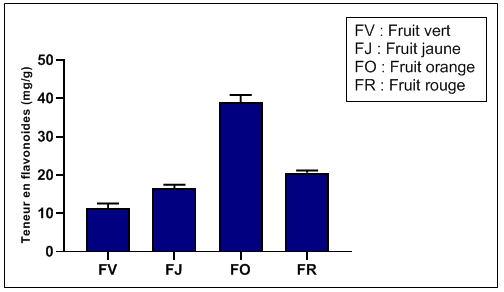
Figure 6: Variation de la teneur des flavonoïdes avec le stade de maturation du fruit.
55La figure 6 montre très clairement une hausse importante des flavonoïdes, au cours des étapes de maturation du fruit, mais une diminution de ce groupe de composés bioactifs est constatée quand le fruit atteint le stade de pleine maturité, qui reste élevé par rapport au fruit non mûr. Les teneurs enregistrées sont dans l'ordre suivant: fruit orange (38,9±2,0 mgER/g) fruit rouge (20,6±0,6 mgER/g) fruit jaune (16,0±0,8 mg/g) fruit vert (11,5± 1,2 mg/g). En passant du stade non mûr au stade mûr, le fruit s'enrichit en flavonoïdes, substances bioactives à usages thérapeutiques multiples d'où l'usage en médecine traditionnelle de l'Arbutus unedo et en particulier de ses fruits.
56Les résultats du dosage des tannins condensés (Figure 7) révèlent la richesse des fruits d'Arbousier en ces composés bioactifs. Les teneurs en tannins diminuent progressivement avec la maturation du fruit jusqu'au stade fruit orange, ensuite la quantité des tannins condensés chute brutalement à peu près de moitié lorsque le fruit est en pleine maturité. La teneur passe de 115,5±6,1 mgEC/g (fruit orange) à une valeur moyenne de 63,8±6,0 mgEC/g (fruit rouge). Malgré cette réduction, le fruit de l'arbousier reste une bonne source en tannins condensés. La réduction des tannins condensés peut être expliquée par les changements des composés phénoliques entre les étapes de maturité et explique que l'astringence du fruit due aux tannins diminue. Alarcão-E-Silva et al. (2001) ont dosé les tannins à deux stades de maturité et ont aussi observé une baisse de la quantité de tannins au fur et à mesure de la maturation du fruit.
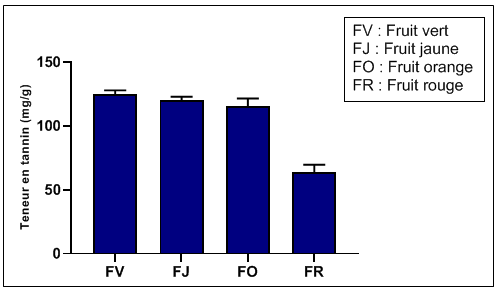
Figure 7: Teneur en tannins condensés à différents stades de maturation du fruit.
57Les anthocyanes sont des pigments naturels responsables des couleurs bleues, violettes, rouges et oranges de nombreux fruits et légumes (Castaneda‐Ovando et al., 2008). Ces composés sont présents dans les fruits à maturité, c'est à dire aux deux derniers stades (tableau 3). La teneur en anthocyanes est de 8,3±0,3 µg/g dans le fruit orange et atteint une valeur considérable de 12,7±0,5 µg/g lorsque le fruit devient d'apparence rouge. Proliac et Raynaud (1981) ont rapporté que les caroténoïdes peuvent être responsables de la couleur jaune dans la chair des fruits, et que la couleur rouge externe est principalement due à la présence d'autres pigments phénoliques, identifiés comme la 3-glucosylcyanidine. Les autres anthocyanes rencontrés et identifiés dans les fruits mûrs sont: delphinidine-3-galactoside, cyanidine-3-arabinoside et cyanidine-3 galactoside (Pawlowska et al., 2006; Pallauf et al., 2008).
Tableau 3: Teneurs en anthocyanes (µg/g extrait)
|
Fruit vert |
Fruit jaune |
Fruit orange |
Fruit rouge orangé |
|
- |
- |
8,3 ± 0,3 |
12,7 ± 0,5 |
58- : Absence
59Les valeurs sont exprimées en moyenne ± SD (n = 3)
60Les composés phénoliques sont des molécules bioactives très recherchées pour leurs propriétés biologiques. Les polyphénols démontrent diverses activités biologiques attribuées à leur capacité de piégeage des radicaux, ou activité antioxydante et la régulation de la fonction mitochondriale (Tavares et al., 2010). L'activité antioxydante des extraits a été testé contre le radical DPPH. Ce test est une méthode directe et fiable pour déterminer l'action de piégeage des radicaux libres.
61Les valeurs EC50 calculées à partir des régressions linéaires ont permis d’évaluer, de classer et de comparer l’efficacité des extraits vis à vis de l'antioxydant de référence, l'acide ascorbique (Figure 8). Plus la valeur de EC50 est petite, plus l’activité antioxydante à piéger les radicaux libres est élevée. L'activité antioxydante des fruits de l'Arbousier est classée dans l'ordre suivant: stade fruit rouge (0,5±0,04 mg/ml) stade fruit vert (0,6±0,03 mg/ml) stade fruit jaune (0,8±0,02 mg/ml) fruit orange (1,0±0,03 mg/ml). Tous les extraits ont manifesté une bonne activité anti-radicalaire avec des valeurs EC50 1 mg/ml, avec une activité très élevée, exercée par l'extrait du fruit en pleine maturité. Heinrich (2005) a testé l'activité antioxydante de 127 espèces végétales y compris les fruits mûrs de l'Arbutus unedo L. Ces résultats expérimentaux ont révélé une activité antioxydante élevée sur le radical libre DPPH. De plus, l'histogramme de comparaison des EC50, montre cependant une activité anti-radicalaire potentielle de l'acide ascorbique qui est supérieure (0,04±0.01 mg/ml) à tous les extraits du fruit d'Arbutus unedo L.
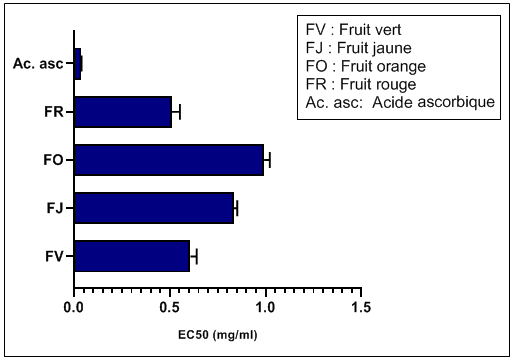
Figure 8: Les valeurs EC50 des extraits des fruits de l'Arbousier et de l'acide ascorbique.
62L’extrait des fruits mûrs d'Arbutus unedo L. au stade fruit rouge constitue donc un bon piégeur des radicaux libres en comparant avec les autres extraits. La capacité antioxydante élevée du fruit rouge, testée par la méthode de DPPH est reliée, non seulement à la quantité, mais surtout à la qualité des composés antioxydants présents dans ce fruit lorsqu'il atteint le stade pleine maturité, un stade marqué par la coloration rouge. Les résultats du dosage des composés antioxydants énoncés plus haut ont démontré un contenu très remarquable en anthocyanes, qui sont connues pour leur forte capacité antioxydante (Peňa-Sanhueza et al., 2017). De plus nos résultats concordent avec ceux rapportés par Isbilir et al. (2012), qui ont déclaré que la capacité antioxydante des extraits des fruits était plus élevée lorsqu'ils sont entièrement rouges. La richesse du fruit en anthocyanes explique en partie le pouvoir antiradicalaire élevé du fruit à ce stade. Les propriétés antioxydantes remarquables des anthocyanes sont à l'origine de leur rôle vital dans la prévention de maladies neuronales, cardiovasculaires, diabète et cancer (Peña-Sanhueza, 2017). Ce pouvoir est renforcé par d'autres constituants antioxydants présents dans ce fruit, à savoir les caroténoïdes et les autres composés phénoliques. En revanche, les caroténoïdes sont des antioxydants puissants et ont un effet piégeur des radicaux libres (Schreck et al., 1992). Leur présence (β-carotène) dans le fruit rouge, à coté des flavonoïdes, qui sont des composés phénoliques avec des propriétés antioxydantes significatives (Heim et al., 2002) explique le potentiel antioxydant important du fruit à ce stade, en association avec la présence d'autres substances antioxydantes différentes de nature phénolique et non phénolique, qui agissent en synergie avec les anthocyanes, les flavonoïdes et le β-carotène.
4. Conclusion
Nous avons évalué et suivi l’activité antioxydante (anti-radicalaire) des extraits d'un fruit tout au long de sa maturation, le fruit d'un arbuste de la famille des Ericaceae "Arbutus unedo L.", très fréquent en Algérie et largement utilisé dans la médecine traditionnelle. Au cours de sa maturation, le fruit s'enrichit en composés phénoliques, à savoir les flavonoïdes et les anthocyanes, alors qu'on assiste à une diminution de son contenu en tannins. En même temps qu'on assiste à une modification quantitative dans le contenu antioxydant, le développement du fruit est accompagné par un changement dans sa couleur. Le fruit vert riche en chlorophylle perd sa coloration verte avec la disparition de la chlorophylle, en revanche, d'autres pigments sont synthétisés, en particulier les anthocyanes, d'où la coloration rouge. Les extraits ont tous manifesté une activité anti-radicalaire par la méthode de piégeage du radical libre DPPH, qui est une méthode largement utilisée pour évaluer et cribler les activités antioxydantes des extraits des plantes. Nous avons constaté que l'extrait contenant le plus d'anthocyanes possède le potentiel anti-radicalaire le plus puissant, c'est à dire quand le fruit est à son stade pleine maturité. Enfin, nous pouvons dire que cet arbuste peu exploité, qui pousse à l'état sauvage et dont ses fruits sont peu consommés, représente un réservoir de substances bioactives naturelles très intéressantes pour la prévention et le traitement d'un grand nombre de pathologies.
Références
-
Ait Braham, S., Belhamel C. Propriétés antioxydantes d’extraits d’une plante médicinale : Urtica dioica L. Mèmoire de Master, Spécialité: Bioprocédés et technologies alimentaires. Université Abderrahmane Mira-Bejaia. 2016, 60p.
-
Akay S., Alpak I., Yesil-Celiktas O. Effects of process parameters on supercritical CO2 extraction of total phenols from strawberry (Arbutus unedo L.) fruits: An optimization study. J. Sep. Sci. 2011, 34: 1925-1931.
-
Alarcão-E-Silva M.L.C.M.M., Leitão A.E.B., Azinheira H.G., Leitão M.C.A. The Arbutus berry: studies on its color and chemical characteristics at two mature stages. Journal of Food Composition and Analysis. 2001, 14: 27-35.
-
Bashir H.A., Abu-Gouk, A.A. Compositional changes during guava fruit ripening. Food Chem. 2003, 80: 557-563.
-
Ben Salem I., Ouesleti S., Mabrouk Y., Landolsi A., Saidi M., Boulila A. Exploring the nutraceutical potential and biological activities of Arbutus unedo L. (Ericaceae) fruits. Industrial Crops and Products. 2018, 122: 726-731.
-
Brand-williams W., Cuvelier M.E., Berset C.Use of free radical method to evaluate antioxidant activity. Lebensmittel Wissenschaft and Technologie. 1995, 28(1): 25-30.
-
Broadhurst R.B., Jones W.T. Analysis of condensed tannins using acidified vanillin. Journal of the Science of Food and Agriculture. 1978, 48(3): 788-794.
-
Castaneda‐Ovando A., Pacheco‐Hernandez M., Paez‐Hernandez M., Rodriguez J., Galan‐Vidal C. Chemical studies of anthocyanins: a review. Food Chemistry. 2008, 113: 859-871.
-
Chandran K.C.I., Indira G. Quantitative estimation of total phenolic, flavonoids, tannin and chlorophyll content of leaves of Strobilanthes Kunthiana (Neelakurinji). Journal of Medicinal Plants Studies. 2016, 4(4): 282-286.
-
Chang C.C., Yang M.H, Wen H.M., Chern J.C. Estimation of total flavonoid content in propolis by two complementary colorimetric methods. Journal of Food and Drug Analysis. 2002, 10: 178-182.
-
Deepika R., Singh J., Kaur N. Comparison of Total Phenolic Content, Total Flavonoid Content, Antioxidant capacity and Free Radical Scavenging Activity of Leaves of Elaeocarpus sphaericus and Roots of Pelargonium zonale. Int.J.Curr.Microbiol.App.Sci. 2018, 7(2): 2846-2854.
-
Delgado-Pelayo R., Gallardo-Guerrero L., Hornero-Méndez D. Carotenoid composition of strawberry tree (Arbutus unedo L.) fruits. Food Chemistry. 2016, 199: 165-175.
-
Féret J-B. Apport de la modélisation pour l’estimation de la teneur en pigments foliaires par télédétection. Thèse de Doctorat, Spécialité: Mesures Physiques en Télédétection. Sciences de l’Environnement d’Ile de France. Université Pierre et Marie Curie. 2009, 214p.
-
Fikselová M. , Šilhár S., Mareček J., Frančáková H. Extraction of Carrot (Daucus carota L.) Carotenes under Different Conditions. Czech J. Food Sci. 2008, 26(4): 268-274.
-
Gull J., Sultana B., Anwar F., Naseer R. Ashraf M., Ashrafuzzaman M. Variation in Antioxidant Attributes at Three Ripening Stages of Guava (Psidium guajava L.) Fruit from Different Geographical Regions of Pakistan. Molecules. 2012, 17: 3165-3180.
-
Heim E.K., Tagliaferro A.R., Bobilya D.J. Flavonoid antioxidants: chemistry, metabolism and structure-activity relationships. The Journal of Nutritional Biochemistry. 2002, 13(10): 572-584.
-
Heinrich M. Understanding local Mediterranean diets: a multidisciplinary pharmacological and ethnobotanical approach. Pharmacol Res. 2005, 52(4): 353-366.
-
Horwitz W., Latimer G.W. Official Methods of Analysis of the AOAC International, 18th ed. Gaithersburg M.D: AOAC International. Maryland, USA. 2005. 771p.
-
Huang D., Ou B., Prior R.L. The Chemistry behind antioxidant capacity assays. Agricultural Food Chemistry. 2005, 53(6): 1841-1856.
-
Isbilir S.S., Orak H.H., Yagar H., Ekinci N. Determination of antioxidant activities of strawberry tree (Arbutus unedo L.) flowers and fruits at different ripening stages. Acta Sci. Pol. 2012, 11: 223-237.
-
Iserin P. Encyclopédie des Plantes Médicinales: Identification, Préparation, Soins. Larousse. 2001. 336p.
-
Jain N., Dhawan K., Malhotra S., Singh R. Biochemistry of fruit ripening of guava (Psidium guajava L.) compositional and enzymatic changes. Plant Foods Hum. Nutr. 2003, 58: 309-315.
-
Kreif S. Métabolites secondaires des plantes et comportement animal : surveillance sanitaire et observations de l’alimentation des chimpanzés (Pan troglodytes schweinfurthii) en Ouganda. Activités biologiques et étude chimique de plantes consommées. Thèse de Doctorat, Spécialité: Ecologie et chimie des substances naturelles, Muséum national d’histoire naturelle. 2003, 348p.
-
Marc F., Davin A., Deglène-Benbrahim L., Ferrand C., Baccaunaud M., Fritsch P. Méthodes d’évaluation du potentiel antioxydant dans les aliments. Médecine Sciences. 2004, 20(4): 1-24.
-
Nayek S., Choudhury I.H., Jaishee N., Roy S. Spectrophotometric Analysis of Chlorophylls and Carotenoids from Commonly Grown Fern Species by Using Various Extracting Solvents. Research Journal of Chemical Sciences. 2014, 4(9): 63-69.
-
Oliveira I., Baptista P., Malheiro R., Casal S., Bento A., Pereira J. Influence of strawberry tree (Arbutus unedo L.) fruit ripening stage on chemical composition and antioxidant activity. Food Research International. 2011, 44(5): 1401-1407.
-
Pallauf K., Rivas-Gonzalo J.C., Castillo M.D., Cano M.P., Pascual-Teresa S. Characterization of the antioxidant composition of strawberry tree (Arbutus unedo L.) fruits. Journal of Food Composition and Analysis. 2008, 21: 273-281.
-
Pawlowska A.M., Leo M., Braca A. Phenolics of Arbutus unedo L. (Ericaceae) fruits: Identification of anthocyanins and gallic acid derivatives. J. Agric. Food Chem. 2006, 54: 10234-10238.
-
Peña-Sanhueza D., Inostroza-Blancheteau C., Ribera-Fonseca A., Reyes-Díaz M. Anthocyanins in Berries and Their Potential Use in Human Health. chapter 8. In: Superfood and Functional Food - The Development of Superfoods and Their Roles as Medicine. Intech publisher. 2017. 20p.
-
Popovici C., Saykova I., Tylkowski B. Evaluation de l’activité antioxydant des composés phénoliques par la réactivité avec le radical libre DPPH. Revue de génie industriel. 2009, 4: 25-39.
-
Proliac A., Raynaud J. Anthocyanin pigments of fruits from Arbutus unedo L. (Ericaceae). Plant. Med. Phytother. 1981, 15(2): 109-112.
-
Rop O., Sochor J., Jurikova T., Zitka O., Skutkova H., Mlcek J., Salas P., Krska B., Babula P., Adam V., Kramarova D., Beklova M., Kizek R. Effect of five different stages of ripening on chemical compounds in medlar (Mespilus germanica L.). Molecules. 2011, 16(1): 74-91.
-
Schreck R., Grassman R., Fleckenstein B., Baeuerle P.A. Antioxidants Selectivity Suppress Activation of NF-kappa B by Human T-cell Leukemia Virus I Tax Protein. J. Virol. 1992, 66(11): 6288-6293.
-
Takwa S., Caleja C., Barreira J.C.M., Sokovic M., Achour L., Barros L., Ferreira I.C.F.R. Arbutus unedo L. and Ocimum basilicum L. as sources of natural preservatives for food industry: A case study using loaf bread. LWT - Food Science and Technology. 2018, 88: 47-55.
-
Tavares L., Fortalezas S., Carrilho C., McDougall G.J., Stewart D., Ferreira R.B., Santos C. Antioxidant and antiproliferative properties of strawberry tree tissues. Journal of Berry Research, 2010, 1(1): 3-12.
-
Trudel M.J., Ozbun J.L. Relationship between Chlorophylls and Carotenoids of Ripening Tomato Fruit as Influenced by Potassium Nutrition. Journal of Experimental Botany. 1970, 21(69): 881-886.
-
Wills R.B.H., Bone K., Morgan M. Herbal products: active constituents, modes of action and quality of control. Nutrition Research Reviews. 2000, 13: 47-77.