- Portada
- Volume 71 (2018)
- Détermination par piégeage de la diversité et de l’abondance des familles d’insectes associées à la culture de tomate (Solanum lycopersicum L.) au Burkina Faso
Vista(s): 3630 (23 ULiège)
Descargar(s): 1460 (11 ULiège)
Détermination par piégeage de la diversité et de l’abondance des familles d’insectes associées à la culture de tomate (Solanum lycopersicum L.) au Burkina Faso

Notes de la rédaction
Reçu le 20 novembre 2017, accepté le 4 février 2018
Résumé
Au Burkina Faso, la production de tomate est effectuée dans des conditions de forte pression des d’insectes ravageurs. Malheureusement, aucune étude ne s’est intéressée à la diversité de ces insectes ni à l’évaluation de leur abondance. Dans cette étude, l’objectif était d’établir une liste des familles d’insectes ravageurs et d’auxiliaires capturés à l’aide de pièges à eau de couleur jaune dans les cultures de tomate au Burkina Faso. Durant les années 2015, 2016 et 2017, un inventaire de l’entomofaune a été réalisé grâce aux captures dans les parcelles de 12 producteurs de tomate. Au total, 1447 insectes ont été collectés, classés dans 42 familles différentes. Pour les insectes ravageurs, les principales familles représentées et classées par ordre alphabétique incluent les Acrididae, les Agromyzidae, les Aleyrodidae, les Aphididae, les Arctiidae, les Gelechiidae, les Noctuidae et les Tephritidae. Des ennemis naturels (insectes) ont été aussi retrouvés en faible abondance dans les pièges. Ils appartiennent aux familles des Coccinellidae, Ichneumonidae, Pompilidae, Reduviidae et Sphecidae. On note une évolution presque similaire des auxiliaires et des ravageurs dans l’ensemble des sites : les pics de population des ravageurs sont observés entre le 14ème et le 28ème jour après repiquage (JAR) et celui des auxiliaires entre le 28ème et le 35ème JAR.
Abstract
In Burkina Faso, tomato production is carried out in the heavy pressure conditions of insect pests. Unfortunately, no study did not care at the diversity of these insects or the assessment of their abundance. In this study, the objective was to establish a list of families of insect pests and auxiliaries captured using a yellow water traps in tomato crops in Burkina Faso. During the years 2015, 2016 and 2017, an inventory of the entomofauna was carried out thanks to the catches in the plots of 12 tomato producers. In total, 1447 insects were collected, classified into 42 different families. For the insect pests, the main families represented and listed in alphabetical order include Acrididae, Agromyzidae, Aleyrodidae, Aphididae, Arctiidae, Gelechiidae, Noctuidae and Tephritidae. Natural enemies (insects) have also been found in low abundance in traps. They belong to the families of Coccinellidae, Ichneumonidae, Pompilidae, Reduviidae and Sphecidae. We notice an almost similar evolution of the auxiliaries and pests in all sites: the pest population peaks are observed between 14th and 28th day after transplanting (DAT) and that of auxiliaries between 28th and 35th DAT.
Tabla de contenidos
Introduction
1Au Burkina Faso, la culture de la tomate (Solanum lycopersicum L.) occupe la deuxième place après l’oignon avec une production de 289.572 tonnes sur une superficie de 11.766 ha (MARHASA, 2014). Sa production génère de nombreux emplois et des revenus intéressants pour les habitants des zones rurales et urbaines (MAHRH, 2007). Source d’échanges commerciaux avec les pays voisins (Bénin, Côte d’Ivoire, Ghana, Togo), la tomate contribue de manière significative à la croissance économique du pays (MAHRH, 2007). Cependant, sa productionest confrontée à de nombreuses contraintes biotiques et abiotiques, parmi lesquelles les attaques des insectes ravageurs (IFDC, 2007). En effet, ces ravageurs induisent des pertes allant de 50 à 100% de la récolte, conduisant les producteurs de certains sites maraîchers du pays à renoncer à la culture de la tomate (IFDC, 2007). A notre connaissance, aucune étude n’a évalué la diversité ou l’abondance des insectes associés à la production de tomate au Burkina Faso. De plus, suite au signalement de Tuta absoluta M. (Lepidoptera : Gelechiidae) dans la zone nord du Burkina Faso en 2016 (Son et al., 2017a), il y avait lieu de réaliser un monitoring de sa présence dans certains sites maraîchers du pays. Outre l’insuffisance d’informations publiées sur les principaux ravageurs des cultures maraîchères au Burkina Faso, peu d’études ont été menées sur les insectes prédateurs et parasitoïdes des principaux ravageurs des cultures maraîchères au Burkina Faso. Pourtant, ceux-ci jouent un rôle essentiel dans le contrôle des ravageurs et permettent de réduire la fréquence d'apparition de pics de populations impliquant des dégâts économiquement dommageables (Gerling et al., 2001; Kennedy, 2003; Chailleux et al., 2013; Zappalà et al., 2013). Cette insuffisance d’informations rend compliquées l’élaboration et la planification de stratégies raisonnées de lutte, avec l’établissement de seuils d’intervention.
2Dans cette étude, il a donc été question d’établir un inventaire des familles d’insectes ravageurs et auxiliaires présentes dans les cultures de tomate dans l’Ouest du Burkina Faso.
Matériel et méthodes
Sites d’étude et méthodologie de collecte d’insectes
3L’étude a été menée dans les sites maraîchers localisés dans les communes de Kouka (Lièkonon) et de Bobo-Dioulasso (Kuinima, Kodéni et Sonsogona) respectivement dans les provinces de Banwa et du Houet (Figure 1). Elle s’est déroulée dans les parcelles maraichères de 12 producteurs de tomate. Le climat local est du type soudanien et les sols de type argilo-sableux. Les températures moyennes relevées au moyen d’un thermo-hygromètre (TFA Dostmann 30.5007 "Pocket" / Thermo-Hygrometer digital) de décembre à mai, sont de 31,3 ± 4,0°C dans la commune de Kouka et de 29,2 ± 5,0°C dans la commune de Bobo-Dioulasso. Les insectes ont été collectés hebdomadairement à l’aide des pièges jaunes à eau ("von Moericke", Ø = 27 cm, h = 10 cm) (Mignon et al., 2003; Lozano et al., 2013; Yattara & Francis, 2013) pendant la grande saison de production maraîchère allant de décembre à mai et durant les saisons de cultures 2015, 2016 et 2017, à raison de cinq dates d’observation par parcelle. Dans chaque parcelle d’environ 1.500 m², trois pièges jaunes ont été installés sur des piquets, à la hauteur des plantes, en triangle et à égale distance. Chaque piège a été rempli d’eau additionnée de quelques gouttes de savon liquide jusqu’à la jauge (Figure 2a). En périodes de fortes chaleurs, le niveau a été maintenu par des apports réguliers et l’eau a été renouvelée à chaque collecte. Les insectes récupérés dans les pièges ont été conservés dans une solution d’éthanol à 70% de concentration. Pour les deux premières années de l’étude (2015, 2016), les collectes ont été effectuées sur les sites de production maraîchère de Kouka et de Kuinima. En 2017, les sites de Kodéni et de Sonsogona ont été échantillonnés afin d’avoir une idée sur la répartition spatiale de l’entomofaune de la tomate dans les périmètres maraîchers. En 2015, les pièges jaunes ont été installés dans les parcelles de tomate où aucun traitement phytosanitaire n’a été effectué, tandis que les années suivantes de collecte (2016 et 2017) les pièges ont été placés dans les parcelles qui ont subi des traitements phytosanitaires pour évaluer l’impact des pesticides (souvent non sélectifs) sur les insectes bénéfiques. Des pièges delta à glu avec la phéromone sexuelle de Tuta absoluta (PHERODIS Tuta absoluta, KOPPERT, Biological systems) (Figure 2b) ont été également installés de décembre 2016 à avril 2017 dans certains sites maraîchers (Kodéni, Leguema et Sonsogona) (Figure 1) afin d’évaluer la présence de cette mineuse de la tomate dans ces sites. Les collectes ont été hebdomadaires, à raison de neuf dates
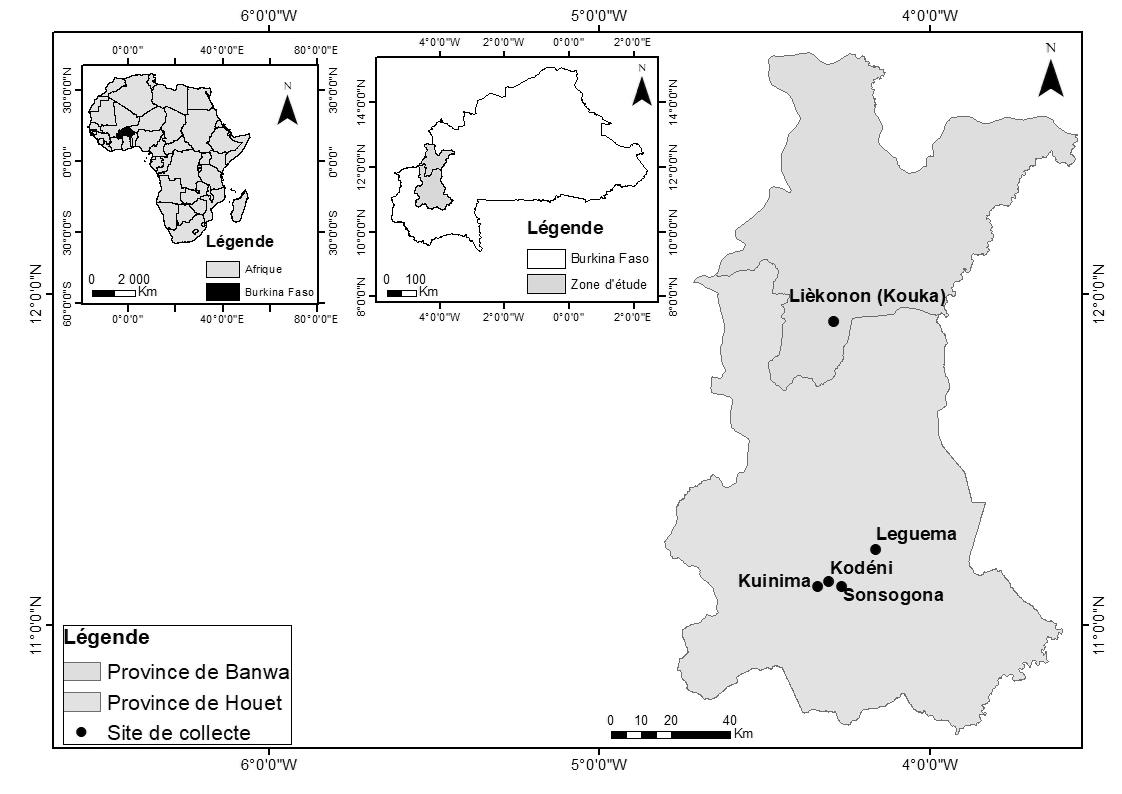
4Figure 1 : Localisation des sites de collecte d’entomofaune de la tomate dans l’Ouest du Burkina Faso


5Figure 2 : Types de pièges utilisés lors de la collecte de l’entomofaune de la tomate : (a) piège jaune à eau ; (b) piège Delta avec capsule à phéromone sexuelle de T. absoluta (Photos SON D.)
6d’observation par parcelle, et les insectes récupérés dans les pièges ont été conservés dans une solution d’éthanol à 70% de concentration.
7Les insectes collectés ont été identifiés jusqu’au niveau taxonomique de la famille en se basant sur des caractères morphologiques décrits dans différentes clés de systématique entomologique (Delvare & Aberlenc, 1989; Autrique & Ntahimpera, 1994; Chinery, 2012; Dino, 2014; Mignon et al., 2016)et ouvrages techniques (Bordat & Arvanitakis, 2004; Poutouli et al., 2011). Les insectes identifiés ont été regroupés en cinq groupes fonctionnels : ravageurs, pollinisateurs, prédateurs, parasitoïdes et divers (composé de fourmis et de certains diptères non ravageurs). Les aleurodes et les pucerons collectés beaucoup trop abondants dans les pièges (plus de 1.000 individus), n’ont pas pu être dénombrés.
Analyse des données collectées
8La diversité des familles d’insectes présents sur la tomatea été évaluée au moyen de trois indices: l’indice de Shannon, l’indice d’équitabilité et l’indice de Simpson. L’indice de diversité spécifique de Shannon a été calculé comme suit (Marcon, 2010):
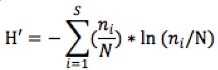
9Avec : ni = nombre d'individus d’un niveau taxonomique considéré (ici la famille) ;
10 i= une famille présente dans le milieu, allant de 1 à S (le nombre total de familles observées), et N est l’effectif total des individus capturés dans les pièges.
11Quand la valeur de H’ est faible, le milieu est considéré comme pauvre en familles. Par contre, si cet indice est élevé, cela indique une grande diversité de familles dans le milieu.
L’indice d’équitabilité (E) a été calculé comme suit (Marcon, 2010) :
Résultats
Abondances de l’entomofaune
12Sur les trois années d’étude, 1.447 insectes ont été collectés au total dans les pièges jaunes à eau ; 571 individus soit 39,5% du total en 2015, 440 soit 30,4% en 2016 et 436 soit 30,1% en 2017. Les Hyménoptères, les Hémiptères, les Coléoptères et les Diptères sont les ordres les plus abondants (Figure 3). Les insectes inventoriés appartiennent à 42 familles. L’abondance relative de chaque famille est présentée dans le Tableau 1. Les principales familles de ravageurs de la tomate (en plus des Aleyrodidae et des Aphididae) sont les Acrididae, les Agromyzidae, les Arctiidae, les Gelechiidae, les Noctuidae et les Tephritidae.
Diversité entomologique des familles d’insectes capturés dans les pièges placés dans les parcelles de tomate
13L’indice de diversité de Shannon montre une diversité des familles d’insectes collectées dans les champs de tomate en fonction des sites et des années de collecte (Figure 4). Cette diversité est la plus faible dans le site de Kouka-2015 (1,80) et la plus élevée dans le site de Kodéni-2017 (2,99). Par contre, dans tous les sites, les indices d’équitabilité et de Simpson sont sensiblement similaires, montrant une diversité maximale et une équirépartition des individus dans les diverses familles d’insectes capturés.
Groupes fonctionnels des insectes collectés
14La Figure 5 montre une prédominance dans les captures des insectes pollinisateurs (53% du total) en 2015. Par contre, les ravageurs ont été les plus nombreux sur les parcelles de tomate en 2016 (55%) et en 2017 (43%). La proportion des insectes prédateurs est cependant presque identique sur les trois années.
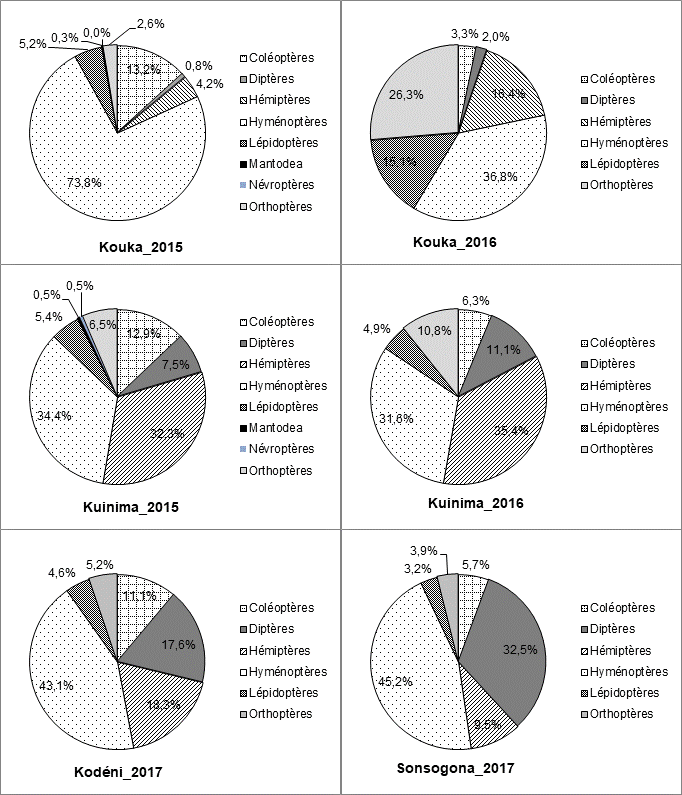
15Figure 3 : Répartition des principaux ordres d’insectes collectés durant trois années (2015, 2016 et 2017) en culture
16En tenant compte des localités et des années de collectes, la répartition de ces groupes fonctionnels montre qu’à l’exception du site de Kouka dominé par la présence des pollinisateurs en 2015, les ravageurs constituent le groupe le plus important sur tous les sites quelle que soit l’année de collecte (Figure 6).
17Tableau 1 : Abondances relatives des familles d’insectes collectés durant trois années (2015, 2016 et 2917) dans les champs de tomate pendant la grande saison de production (de décembre à mai) dans l’Ouest du Burkina Faso (abon = abondance ; F(%) = fréquence
|
2015 |
2016 |
2017 |
||||||||||||||||||
|
Kouka |
Kuinima |
Total |
Kouka |
Kuinima |
Total |
Kodéni |
Sonsogona |
Total |
||||||||||||
|
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
abon |
F(%) |
|||
|
Ravageurs |
54 |
14 |
90 |
48 |
144 |
25 |
80 |
53 |
162 |
56 |
242 |
55 |
59 |
39 |
130 |
46 |
189 |
43 |
||
|
Chrysomelidae |
5 |
1 |
2 |
1 |
7 |
1 |
1 |
1 |
1 |
0 |
2 |
0 |
1 |
1 |
2 |
1 |
3 |
1 |
||
|
Curculionidae |
1 |
0 |
7 |
4 |
8 |
1 |
0 |
0 |
1 |
0 |
1 |
0 |
2 |
1 |
1 |
0 |
3 |
1 |
||
|
Agromyzidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
8 |
3 |
8 |
2 |
7 |
5 |
82 |
29 |
89 |
20 |
||
|
Anthomyiidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Diopsidae |
1 |
0 |
1 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
1 |
0 |
2 |
0 |
||
|
Tephritidae |
2 |
1 |
1 |
1 |
3 |
1 |
0 |
0 |
9 |
3 |
9 |
2 |
11 |
7 |
5 |
2 |
16 |
4 |
||
|
Coreidae |
4 |
1 |
26 |
14 |
30 |
5 |
2 |
1 |
49 |
17 |
51 |
12 |
2 |
1 |
0 |
0 |
2 |
0 |
||
|
Lygaeidae |
7 |
2 |
8 |
4 |
15 |
3 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
2 |
0 |
||
|
Pentatomidae |
4 |
1 |
7 |
4 |
11 |
2 |
13 |
9 |
7 |
2 |
20 |
5 |
6 |
4 |
11 |
4 |
17 |
4 |
||
|
Pyrrhocoridae |
0 |
0 |
16 |
9 |
16 |
3 |
1 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Scutelleridae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
41 |
14 |
41 |
9 |
14 |
9 |
6 |
2 |
20 |
5 |
||
|
Arctiidae |
16 |
4 |
1 |
1 |
17 |
3 |
20 |
13 |
8 |
3 |
28 |
6 |
1 |
1 |
1 |
0 |
2 |
0 |
||
|
Gelechiidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
2 |
0 |
||
|
Noctuidae |
4 |
1 |
9 |
5 |
13 |
2 |
3 |
2 |
6 |
2 |
9 |
2 |
6 |
4 |
6 |
2 |
12 |
3 |
||
|
Acrididae |
6 |
2 |
12 |
6 |
18 |
3 |
31 |
20 |
31 |
11 |
62 |
14 |
8 |
5 |
10 |
4 |
18 |
4 |
||
|
Gryllidae |
3 |
1 |
0 |
0 |
3 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Pyrgomorphidae |
1 |
0 |
0 |
0 |
1 |
0 |
9 |
6 |
0 |
0 |
9 |
2 |
0 |
0 |
1 |
0 |
1 |
0 |
||
|
Pollinisateurs |
248 |
64 |
55 |
30 |
303 |
53 |
2 |
1 |
35 |
12 |
37 |
9 |
30 |
21 |
86 |
30 |
116 |
27 |
||
|
Andrenidae |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
7 |
2 |
7 |
2 |
1 |
1 |
0 |
0 |
1 |
0 |
||
|
Anthophoridae |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
0 |
2 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Apidae |
30 |
8 |
12 |
6 |
42 |
7 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Collitidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
7 |
2 |
7 |
2 |
4 |
3 |
29 |
10 |
33 |
8 |
||
|
Halictidae |
214 |
56 |
42 |
23 |
256 |
45 |
2 |
1 |
16 |
6 |
18 |
4 |
24 |
16 |
57 |
20 |
81 |
19 |
||
|
Megachilidae |
3 |
1 |
0 |
0 |
3 |
1 |
0 |
0 |
3 |
1 |
3 |
1 |
1 |
1 |
0 |
0 |
1 |
0 |
||
|
Prédateurs |
74 |
19 |
29 |
16 |
103 |
18 |
58 |
38 |
61 |
21 |
119 |
27 |
42 |
27 |
40 |
14 |
82 |
19 |
||
|
Coccinellidae |
45 |
12 |
15 |
8 |
60 |
11 |
4 |
3 |
16 |
6 |
20 |
5 |
14 |
9 |
13 |
5 |
27 |
6 |
||
|
Asilidae |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
2 |
6 |
2 |
9 |
2 |
3 |
2 |
4 |
1 |
7 |
2 |
||
|
Reduviidae |
1 |
0 |
3 |
2 |
4 |
1 |
9 |
6 |
5 |
2 |
14 |
3 |
6 |
4 |
8 |
3 |
14 |
3 |
||
|
Eumenidae |
0 |
0 |
0 |
0 |
0 |
0 |
6 |
4 |
9 |
3 |
15 |
3 |
3 |
2 |
8 |
3 |
11 |
3 |
||
|
Pompilidae |
4 |
1 |
0 |
0 |
4 |
1 |
16 |
11 |
6 |
2 |
22 |
5 |
7 |
5 |
2 |
1 |
9 |
2 |
||
|
Sphecidae |
3 |
1 |
0 |
0 |
3 |
1 |
17 |
11 |
18 |
6 |
35 |
8 |
6 |
4 |
3 |
1 |
9 |
2 |
||
|
Vespidae |
20 |
5 |
9 |
5 |
29 |
5 |
3 |
2 |
1 |
0 |
4 |
1 |
3 |
2 |
2 |
1 |
5 |
1 |
||
|
Hymenopodidae |
1 |
0 |
1 |
1 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Ascalaphidae |
0 |
0 |
1 |
1 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Parasitoïdes |
6 |
2 |
0 |
0 |
6 |
1 |
11 |
7 |
22 |
7 |
33 |
8 |
17 |
12 |
27 |
9 |
44 |
9 |
||
|
Braconidae |
0 |
0 |
0 |
0 |
0 |
0 |
2 |
1 |
1 |
0 |
3 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Chalcididae |
2 |
1 |
0 |
0 |
2 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
1 |
0 |
||
|
Chrysididae |
1 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Gasteruptiidae |
0 |
0 |
0 |
0 |
0 |
0 |
3 |
2 |
4 |
1 |
7 |
2 |
5 |
3 |
15 |
5 |
20 |
5 |
||
|
Ichneumonidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
15 |
5 |
15 |
3 |
5 |
3 |
10 |
4 |
15 |
3 |
||
|
Mutillidae |
3 |
1 |
0 |
0 |
3 |
1 |
6 |
4 |
2 |
1 |
8 |
2 |
1 |
1 |
1 |
0 |
2 |
0 |
||
|
Scoliidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
4 |
3 |
1 |
0 |
5 |
1 |
||
|
Stephanidae |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
1 |
1 |
0 |
0 |
1 |
0 |
||
|
Divers |
3 |
1 |
12 |
6 |
15 |
3 |
1 |
1 |
8 |
3 |
9 |
2 |
5 |
3 |
0 |
0 |
5 |
1 |
||
|
Stratiomyidae |
0 |
0 |
12 |
6 |
12 |
2 |
0 |
0 |
8 |
3 |
8 |
2 |
5 |
3 |
0 |
0 |
5 |
1 |
||
|
Formicidae |
3 |
1 |
0 |
0 |
3 |
1 |
1 |
1 |
0 |
0 |
1 |
0 |
0 |
0 |
0 |
0 |
0 |
0 |
||
|
Total |
385 |
100 |
186 |
100 |
571 |
100 |
152 |
100 |
288 |
100 |
440 |
100 |
153 |
100 |
283 |
100 |
436 |
100 |
||
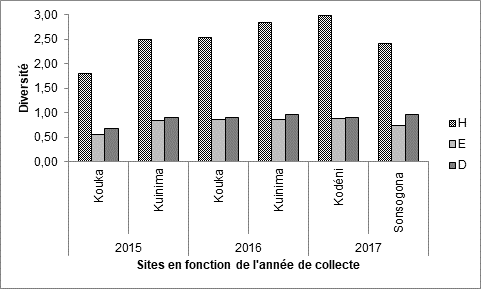
18Figure 4 : Indices de mesure de la diversité des familles d’insectes recensées sur culture de tomate, en fonction de l’année de collecte et des localités. H = indice de Shannon, E =indice d’équitabilité D = indice de Simpson
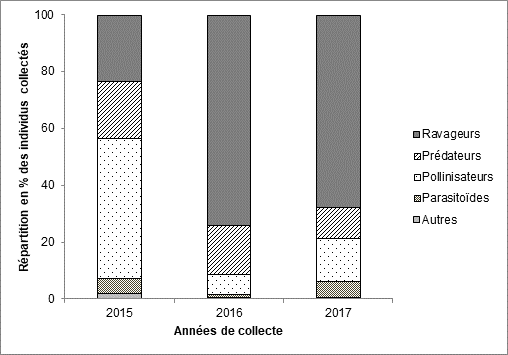
19Figure 5 : Répartition des différents groupes fonctionnels parmi les insectes collectés dans les champs de tomate dans l’Ouest du Burkina Faso en fonction de l’année de collecte
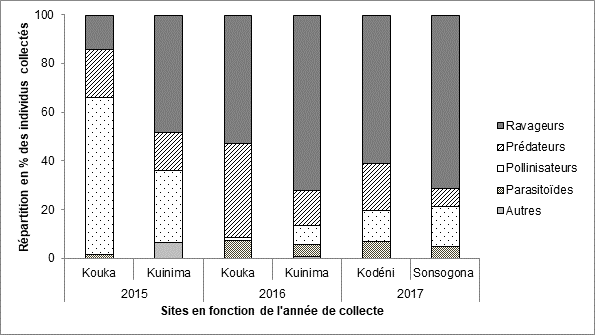
20Figure 6 : Répartition des différents groupes fonctionnels parmi les insectes collectés dans les champs de tomate dans l’Ouest du Burkina Faso en fonction des sites et de l’année de collecte
Dynamique des ravageurs et auxiliaires collectés dans les champs de tomate
21La Figure 7 montre l’évolution des ravageurs et auxiliaires (prédateurs et parasitoïdes) dans les pièges jaunes à eau en fonction du temps.
22Dans le site de Kouka, les ravageurs ont atteint leur pic de population au 21ème jour après repiquage (JAR) en 2015 et au 14ème JAR en 2016. Tandis que le pic de population des prédateurs a été observé au 28ème JAR, en 2015 comme en 2016. Par ailleurs, leur nombre est resté supérieur à celui des ravageurs (hors comptage des pucerons et aleurodes) durant toutes les périodes d’observation en 2015. En ce qui concerne les parasitoïdes, ils ont été observés en faibles effectifs en 2015 et 2016.
23Au niveau du site de Kuinima, les ravageurs ont atteint leur pic de population au 28ème JAR en 2015 et au 14ème JAR en 2016, année au cours de laquelle leur nombre est resté supérieur à celui des auxiliaires durant toute la période d’observation. La population des prédateurs a évolué de manière disparate jusqu’au 35ème JAR en 2015 avant de connaître une baisse jusqu’à la fin des observations. Leur pic de population a été observé au 35ème JAR en 2015 et au 21ème JAR en 2016. Aucun parasitoïde n’a été collecté en 2015. En 2016, le pic de population a été observé au 28ème JAR.
24Dans le site de Kodéni, les pics de population des ravageurs et des parasitoïdes ont été atteints au 14ème JAR, alors que celui des prédateurs a été observé au 35ème JAR.
25Au niveau du site de Sonsogona, les ravageurs ont atteint leur pic de population au 21ème JAR avant de connaître une baisse. Tout comme les prédateurs, deux pics de population ont été observés pour les parasitoïdes au 14ème et 35ème JAR.
26On note donc une évolution presque similaire des auxiliaires et des ravageurs dans l’ensemble des sites : les pics de population des ravageurs sont observés entre le 14ème et le 28ème JAR et celui des auxiliaires entre le 28ème et le 35ème JAR.
27Parmi les ravageurs de la tomate, les familles les plus observées du 14ème au 28ème JAR, sont les Acrididae, les Agromyzidae et les Cicadellidae. Du 28ème au 42ème JAR, ce sont les familles des Gelechiidae, des Noctuidae et des Tephritidae. Quant aux prédateurs et parasitoïdes, les familles les plus observées du 14ème au 28ème JAR sont les Coccinellidae, les Ichneumonidae, les Reduviidae et les Sphecidae. Du 28 au 42ème JAR, ce sont les familles des Asilidae, des Pompilidae et des Reduviidae qui ont été dominantes.
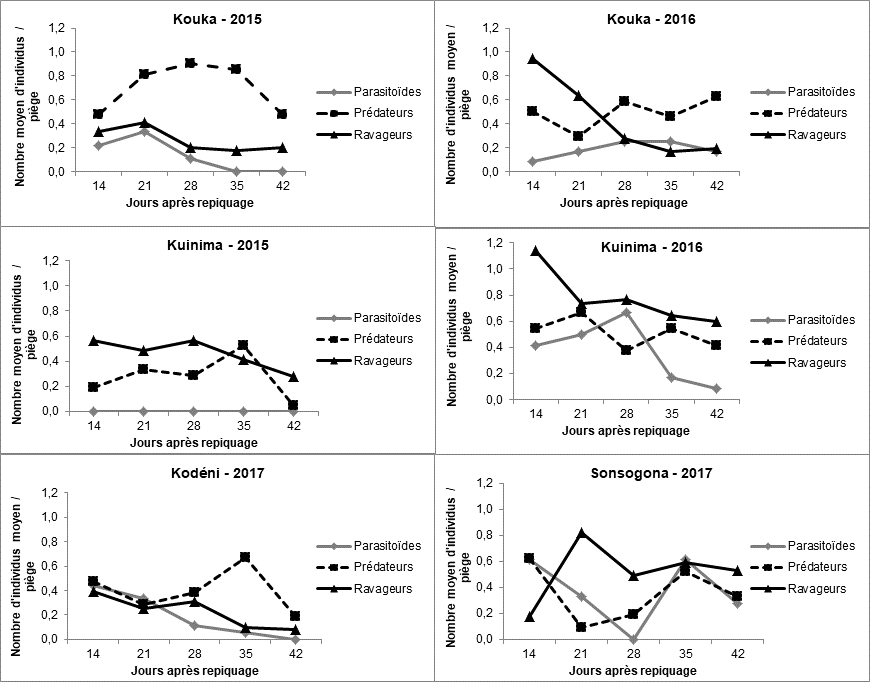
28Figure 7 : Dynamique des ravageurs, des prédateurs et des parasitoïdes observés dans les champs de tomate dans l’Ouest du Burkina Faso en fonction du temps.
Surveillance spécifique de Tuta absoluta
29Le Tableau 2 donne la répartition des populations de Tuta absoluta par site. Aucune différence significative (F = 1,72 ; p = 0,19 ; ddl = 3) n’a été observée entre les sites. Les valeurs les plus élevées ont été observées dans les sites de Leguema (169 individus capturés) et de Sonsogona (170 individus capturés). Une évolution croissante des populations est constatée depuis le début des observations jusqu’au 28ème JAR dans tous les sites (Figure 8). Après cette date, les populations diminuent jusqu’à la fin des observations. Par ailleurs, deux pics majeurs de population ont été observés (28ème et 42ème JAR).
30Tableau 2: Évolution du nombre moyen par sites des populations de Tuta absoluta (± l’écart type).
|
Sites d’observation |
Total |
Nombre d’observation |
Moyennes / sites (± écarts types) |
|
Kodéni |
130 |
9 |
14,44 ± 7,44 |
|
Kuinima |
156 |
9 |
17,33 ± 8,35 |
|
Leguema |
169 |
9 |
18,78 ± 10,92 |
|
Sonsogona |
170 |
9 |
18,89 ± 10,36 |
|
Signification |
F = 1,72 P = 0,19 ddl = 3 |
31 F =valeur de Fisher ; P = probabilité ; ddl = degré de liberté
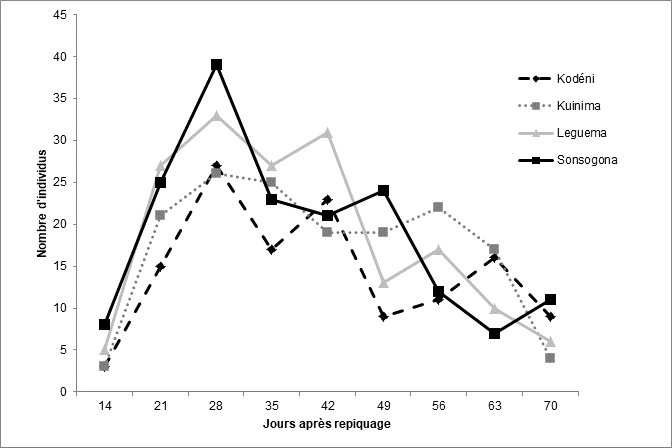
32Figure 8 : Evolution de Tuta absoluta dans les champs de tomate en fonction du temps
Discussion
33Huit familles d’insectes nuisibles (Acrididae, Agromyzidae, Aleyrodidae, Aphididae, Arctiidae, Gelechiidae, Noctuidae et Tephritidae) ont été observées dans les parcelles de production de la tomate dans l’Ouest du Burkina Faso. Ces résultats sont conformes à ceux obtenus au Bénin (Chougourou et al., 2012), au Nigeria (Mailafiya et al., 2014) et au Ghana (Ofori et al., 2014) qui montrent que la culture de tomate abrite une multitude d’insectes ravageurs appartenant à diverses familles. Parmi ces familles, les plus inféodées à la culture de la tomate sont les Agromyzidae, les Aleyrodidae, les Aphididae, les Gelechiidae et les Noctuidae . La majorité de ces ravageurs sont présents au stade végétatif de la plante et affecte gravement sa croissance et son développement.
34Les résultats démontrent également qu’à côté des ravageurs, beaucoup d’insectes utiles (pollinisateurs, prédateurs et parasitoïdes) cohabitent dans la culture de tomate. A commencer par les insectes pollinisateurs qui jouent un rôle primordial pour la productivité (Klein et al., 2007). Quant aux auxiliaires (prédateurs et parasitoïdes), leur présence contribue significativement à la diminution des effectifs des populations de ravageurs, réduisant ainsi le besoin d’intervenir pour maîtriser leur développement (Gerling et al., 2001; Chailleux et al., 2013; Zappalà et al., 2013). En termes de diversité, les indices d’équitabilité et de Simpson montrent une diversité maximale des familles d’insectes capturés, mais entre les sites, ces deux indices sont sensiblement les mêmes.
35En 2015, plus d’insectes bénéfiques ont été collectés que les deux dernières années de collecte (2016 et 2017). Cela pourrait s’expliquer par le recours répété des producteurs aux pesticides non sélectifs qui ont dû nuire à la survie et au développement d’insectes utiles. Ainsi, dans l’île de La Réunion (France), Ryckewaert & Fabre (2001) avaient observé une augmentation des populations d’aleurodes et des mouches mineuses sur une culture de tomate traitée avec des pesticides comparativement à celle non traitée. Selon ces auteurs, les taux de parasitisme dépassaient les 80% sur la parcelle sans traitement alors qu’ils atteignaient à peine 40% sur la parcelle traitée. Cela démontre l’intérêt de protéger les insectes auxiliaires tout d’abord en identifiant les mesures culturales et d’aménagement du territoire favorisant leur installation, leur maintien et leur développement et ensuite, en cas de recours aux traitements phytosanitaires, par une gestion raisonnée et raisonnable de ces derniers.
36D’après nos observations, les captures ont été plus importantes pendant les phases développement-fructification de la tomate avant de connaitre une réduction jusqu’à la fin du cycle complet de la tomate. Un même constat a été effectué par Ofori et al. (2014) et Son et al. (2016). La baisse de la prolifération des ravageurs à partir du 28ème JAR pourrait s’expliquer par l’intervention des insectes auxiliaires dont le pic de population survient au 28ème JAR, qui ont pu limiter le taux de croissance de certains ravageurs à travers des mécanismes de parasitisme et de prédation (Ofori et al., 2014).
37Il ressort également de cet inventaire que T. absoluta, déjà signalé au Nord du pays (Son et al., 2017a) et qui est un organisme nuisible règlementé en Europe (OEPP, 2005), est présent aussi dans l’Ouest du Burkina Faso. Le nombre moyen d’adultes de T. absoluta capturés dans cette étude reste supérieur à celui enregistré en 2001 (10 individus) au Venezuela (Salas, 2007), mais inférieur par rapport à ceux enregistrés au mois de mars (30 individus) et d’avril (110 individus) en Algérie (Allache et al., 2012). Plus significatif, les captures réalisées dans les sites maraîchers du Burkina Faso sont largement inférieures à celles enregistrées dans les sites de Mbour et de Sud Niayes au Sénégal où la plus faible moyenne des captures était de 50 individus (Sylla et al., 2015). En ce qui concerne l’évolution de T. absoluta en fonction du cycle cultural de la tomate, l’étude indique une baisse de la population vers la fin du cycle de production contrairement aux observations de Allache et al. (2012) en Algérie, qui signalent une croissance du nombre d’individus en fin de cycle de production.
38Il faut noter que, selon la littérature (Bloem & Spaltenstein, 2011; Wyckhuys et al., 2013; Sylla et al., 2015), cette mineuse de la tomate s’attaque également à d'autres Solanacées citées dans la littérature : pomme de terre (Solanum tuberosum Linnaeus), aubergine (Solanum melongena Linnaeus), poivron (Capsicum annum Linnaeus). Sa présence constitue donc une problématique pour la culture des solanacées en général, et de la tomate en particulier, car les dégâts peuvent atteindre 100% de perte de rendement (OEPP, 2005; Bloem & Spaltenstein, 2011; Wyckhuys et al., 2013). Il apparaît donc que la gestion de ce ravageur est compliquée par sa résistance à la plupart des insecticides aujourd’hui sur le marché (Siqueira et al., 2000, 2001; Lietti et al., 2005; Silva et al., 2011), dont une bonne partie (indoxacarbe, abamectine, deltaméthrine) employée couramment au Burkina Faso (Lehmann et al., 2016; Son et al., 2017b). Par conséquent, les prédictions du modèle d'impact de T. absoluta vont dans le sens d’une augmentation des dommages aux cultures par ce ravageur en Afrique en raison de son climat chaud (Tonnang et al., 2015). Il faut donc s’attendre dans un proche avenir à des applications encore accrues des pesticides, augmentant le risque de résistance des ravageurs, d'exposition des producteurs, de pollution de l'environnement et de dépassements encore plus fréquents des limites maximales de résidus de pesticides recommandées par le Codex Alimentarius sur les légumes.
Conclusion
39La contrainte principale à laquelle est confrontée la production de la tomate au Burkina Faso est la forte pression parasitaire engendrée essentiellement par les populations d’insectes ravageurs. Malheureusement, il existe une pénurie d'information concernant l'abondance, la diversité et la dynamique de développement de ces insectes nuisibles. Les résultats de l’étude menée dans les périmètres maraichers constituent une première base de données importante sur les principales familles d’insectes ravageurs et auxiliaires de la tomate au Burkina Faso. Néanmoins, des études approfondies sont nécessaires sur les principales espèces afin d’adapter les schémas de protection des cultures en fonction des ravageurs et des auxiliaires effectivement présents et de leurs évolutions respectives. Dans le cas de T. absoluta, il serait nécessaire de suivre sa progression à l'échelle du Burkina Faso, d’étudier la dynamique de ses populations dans les différents bassins maraichers du pays, de recenser les plantes hôtes qui permettent son maintien et la multiplication de ses populations et d'identifier si possible ses ennemis naturels indigènes.
Remerciements
40Cette étude a été réalisée avec le soutien financier de ARES-CDD (Projet PIC «Renforcement des capacités de diagnostic et de gestion intégrée des problèmes phytosanitaires au Burkina Faso », UCL-ULg-IDR / UPB).
Bibliographie
Allache F., Houhou M.A., Osmane I., Naili L. & Demnati F., 2012. Suivi de l’évolution de la population de Tuta absoluta Meyrick (Gelichiidae), un nouveau ravageur de la tomate sous serre à Biskra (Sud-Est d’Algérie). Entomologie Faunistique – Faunistic Entomology.,65, 149–155.
Autrique A. & Ntahimpera L., 1994. Atlas des principales espèces de pucerons rencontrées en Afrique Sud-Saharienne. Administration générale de la coopération au développement (AGCD), 78 p.
Bloem S. & Spaltenstein E., 2011. New pest response guidelines. Tomato leafminer (Tuta absoluta). Animal and Plant Health Inspection Service, Plant Protection and Quarantine, United States Department of Agriculture, 176 p.
Bordat D. & Arvanitakis L., 2004. Arthropodes des cultures légumières d’Afrique de l’Ouest, centrale, Mayotte et Réunion. Montpellier (France): CIRAD-FLHOR, 291 p.
Chailleux A., Bearez P., Pizzol J., Amiens-Desneux E. & Ramirez-Romero R.D.N., 2013. Potential for combined use of parasitoids and generalist predators for biological control of the key invasive tomato pest Tuta absoluta. Journal of Pest Science.,86(3), 533–541.
Chinery M., 2012. Insectes de France et d’Europe occidentale. Guide nature. Editions Flammarion., 320 p.
Chougourou D.C., Agbaka A., Adjakpa J.B., Koutchika R.E., Kponhinto U.G. & Adjallan E.J.N., 2012. Inventaire préliminaire de l’entomofaune des champs de tomates (Lycopersicon esculentum Mill) dans la Commune de Djakotomey au Bénin. International Journal of Biological and Chemical Sciences.,6(4), 1798–1804.
Delvare G. & Aberlenc H.P., 1989. Les insectes d’Afrique et d’Amérique tropicale : clé de reconnaissance des familles d’insectes. CIRAD-GERDAT, Montpellier, France, 302 p.
Dino J.M., 2014. Insects of East Africa. Strink, 152 p.
Gerling D., Alomar O. & Arnó J., 2001. Biological control of Bemisia tabaci using predators and parasitoids. Crop Protection.,20(9), 779–799.
IFDC, 2007. Problématique de l’utilisation des produits phytosanitaires en conservation des denrées alimentaires et en maraîchage urbain et péri urbain au Burkina Faso : cas de Bobo Dioulasso, Ouahigouya et Ouagadougou, 51 p.
James B., Atcha-Ahowé C., Godonou I., Baimey H., Goergen G., Sikirou R. & Toko M., 2010. Gestion intégrée des nuisibles en production maraîchère : Guide pour les agents de vulgarisation en Afrique de l’Ouest. Cotonou, Bénin, 125 p.
Kennedy G.G., 2003. Tomato, pests, parasitoids, and predators: tritrophic interactions involving the Genus lycopersicon. Annual Review of Entomology.,48(1), 51–72.
Klein A-M., Vaissière B.E., Cane J.H., Steffan-Dewenter I., Cunningham S.A., Kremen C. & Tscharntke T., 2007. Importance of pollinators in changing landscapes for world crops. Proceedings of the Royal Society B: Biological Sciences.,274(1608), 303–313.
Lehmann E., Fargues M., Congo N., Konaté Y. & De Alencastro L.F., 2016. Pesticide application in gardening : assessment of resulting impact on water resources quality using grab samples and pocis, case study of Loumbila lake, Burkina Faso. 9th European Conference on Pesticides and Related Organic Micropollutants in the Environment (4th-7th October - Santiago de Compostela, Spain).
Lietti M.M.M., Botto E. & Alzogaray R.A., 2005. Insecticide resistance in Argentine populations of Tuta absoluta (Meyrick) (Lepidoptera: Gelechiidae). Neotropical Entomology.,34(1), 113–119.
Lozano D.P., Bosquée E., Lopes T., Chen J., Fa C.D., Yong L., Fang-Quiang Z., Haubruge E., Bragard C. & Francis F., 2013. Evaluation de la diversité des pucerons et de leurs ennemis naturels en cultures maraîchères dans l'est de la Chine. Entomologie Faunistique – Faunistic Entomology.,66, 27–37.
MAHRH, 2007. Analyse de la filière maraichage au Burkina Faso. Ministère de l’Agriculture, de l’Hydraulique et des Ressources Halieutiques, Ouagadougou, Burkina Faso, 127 p.
Mailafiya D.M., Degri M.M., Maina Y.T., Gadzama U.N. & Galadima I.B., 2014. Preliminary studies on insect pest incidence on tomato in Bama , Borno State , Nigeria. International Letters of Natural Sciences.,5, 45–54.
Marcon E., 2010. Mesures de la biodiversité. Bruxelles, Entropie 58 p.
MARHASA, 2014. Superficies et production maraîchère par région (campagne 2013-2014). Ministère de l’Agriculture, des Ressources Halieutiques, de l’Assainissement et de la Sécurité Alimentaire, Ouagadougou, Burkina Faso.
Mignon J., Colignon P., Haubruge E. & Francis F., 2003. Effet des bordures de champs sur les populations de chrysopes [Neuroptera: Chrysopidae] en cultures maraîchères. Phytoprotection.,84(2), 121–128.
Mignon J., Haubruge E. & Francis F., 2016. Clé d’identification des principales familles d’insectes d’Europe. Gembloux (Belgique): Presses Agronomiques de gembloux, 87 p.
OEPP, 2005. Fiches informatives sur les organismes de quarantaine: Tuta absoluta. EPPO Bulletin.,35, 434–435.
Ofori E.S.K., Yeboah S., Nunoo J., Quartey E.K., Torgby-Tetteh W., Gasu E.K. & Ewusie E.A., 2014. Preliminary studies of insect diversity and abundance on twelve accessions of tomato, Solanum lycopersicon L. grown in a coastal savannah agro ecological zone. Journal of Agricultural Science.,6(8), 72–82.
Poutouli W., Silvie P. & Aberlenc H.P., 2011. Hétéroptères phytophages et prédateurs d’Afrique de l’Ouest. CTA, 79 p.
Ryckewaert P. & Fabre F., 2001. Lutte intégrée contre les ravageurs des cultures maraîchères à La Réunion. Food and Agricultural Research. Council, 99–103.
Salas J., 2007. Presencia de Phthorimaea operculella y Tuta absoluta (Lepidoptera : Gelechiidae), capturados en trampas con feromonas, en cultivos de tomate en Quibor, Venezuela. Bioagro.,19(3), 143–147.
Schiffers B., 2011. Itinéraire technique de la tomate cerise (Lycopersicon esculentum). COLEACP/PIP, 46 p.
Silva G.A., Picanço M.C., Bacci L., Crespo A.L.B., Rosado F.J. & Guedes R.N.C., 2011. Control failure likelihood and spatial dependence of insecticide resistance in the tomato pinworm, Tuta absoluta. Pest Management Science.,67(8), 913–920.
Siqueira H.A.A., Guedes R.N.C. & Picanco M.C., 2000. Insecticide resistance in populations of Tuta absoluta (Lepidoptera: Gelechiidae). Agricultural and Forest Entomology.,2(2), 147–153.
Son D., Somda I., Legreve A. & Schiffers B., 2016. Comparison of efficiency and selectivity of three bio-insecticides for the protection of tomatoes in Burkina Faso. Communications in Agricultural and Applied Biological Sciences Ghent University.,81/3, 289–297.
Son D., Bonzi S., Somda I., Bawin T., Boukraa S., Verheggen F., Francis F., Legreve A. & Schiffers B., 2017a. First Record of Tuta absoluta (Meyrick, 1917) (Lepidoptera: Gelechiidae) in Burkina Faso. African Entomology.,25(1), 259–263.
Son D., Somda I., Legreve A., Schiffers B., 2017b. Pratiques phytosanitaires des producteurs de tomates du Burkina Faso et risques pour la santé et l’environnement. Cahiers Agricultures.,26(2).
Sylla S., Brévault T. & Diarra K., 2015. Invasion de la mineuse de la tomate, Tuta absoluta, au Sénégal: dynamique des populations, plantes-hôtes et ennemis naturels. Dakar : UCAD, 1 poster. In: Séminaire DIVECOSYS Sur la gestion agroécologique des bioagresseurs en Afrique de l’Ouest. Dakar, Sénégal, 2 Juin 2015/4 Juin 2015.
Tonnang H.E.Z., Mohamed S.F., Khamis F. & Ekesi S., 2015. Identification and risk assessment for worldwide invasion and spread of Tuta absoluta with a focus on Sub-Saharan Africa: Implications for phytosanitary measures and management. PLoS One10(8), 1–19.
Wyckhuys K., Bordat D., Desneux N. & Quintero L.S.F., 2013. Tuta absoluta. Un ravageur invasif des cultures maraîchères pour l’Afrique sub-saharienne. COLEACP/PIP, 1-14.
Yattara A.A.A. & Francis F., 2013. Impact des méthodes de piégeage sur l’efficacité de surveillance des pucerons : illustration dans les champs de pommes de terre en Belgique. Entomologie Faunistique – Faunistic Entomology.,66, 89–95.
Zappalà L., Biondi A., Alma A., Al-Jboory I.J., Arno J., Bayram A., Chailleux A., El-Arnaouty A., Gerling D., guenaoui Y., Shaltiel-Harpaz L., Siscaro G., Stavrinides M., Tavella L., Aznar R.V., Urbaneja A. & Desneux N., 2013. Natural enemies of the South American moth, Tuta absoluta, in Europe, North Africa and Middle East, and their potential use in pest control strategies. Journal of Pest Science.,86, 635–647.