- Portada
- Volume 72 (2019)
- Abondance et cycle biologique de Taphronota ferruginea (Orthoptera: Pyrgomorphidae) dans la zone de forêts humides du sud-Cameroun
Vista(s): 936 (17 ULiège)
Descargar(s): 65 (0 ULiège)
Abondance et cycle biologique de Taphronota ferruginea (Orthoptera: Pyrgomorphidae) dans la zone de forêts humides du sud-Cameroun

Documento adjunto(s)
Version PDF originaleNotes de la rédaction
Reçu le 15 mai 2018, accepté le 22 février 2019.
Résumé
Taphronota ferruginea (Fabricius 1781) (Orthoptera: Pyrgomorphidae) est un ravageur des plantes cultivées et d’espèces ligneuses dont l'aire de répartition s'étend principalement en Afrique de l'Ouest et du Centre. Dans le cadre de cette recherche, nous avons étudié la phénologie de T. ferruginea dans un sous-bois cacaoyer et dans un champ mixte de cultures vivrières du village Nkongoa, dans le sud-Cameroun. Dans chaque site, nous avons mené des captures hebdomadaires de 30 min, de novembre 2016 à novembre 2017. Les différents stades larvaires collectées ont été dénombrés et identifiés à l’aide de clés appropriées. T. ferruginea a été présente durant toute l’année avec une population univoltine. Les adultes ont été observés toute l’année et ont coexisté en faible nombre avec les larves de stade 1. Les larves (stades 1-6) de T. ferruginea ont été plus abondantes pendant la petite saison pluvieuse alors que les adultes l’ont été pendant la grande saison des pluies. L’abondance des jeunes larves (stades 1-3) n’a pas été corrélée à la pluviosité. Seules les abondances des adultes ont été corrélées à l’humidité relative. Les effectifs des jeunes larves et des adultes ont été positivement corrélés à la température. Le cycle biologique de T. ferruginea est différent de celui de T. thaelophora décrit dans l’ouest du Cameroun et de Atractomorpha acutipennis (Guérin-Méneville 1844), Pyrgomorpha vignaudii (Guérin-Méneville 1849) et Zonocerus variegatus (Linnaeus 1758) décrits dans la zone de forêts humides du sud-Cameroun.
Abstract
Taphronota ferruginea (Fabricius 1781) (Orthoptera: Pyrgomorphidae) is a crop and tree pest whose distribution extends mainly in West and Central Africa. As part of this research, we studied the phenology of T. ferruginea in cocoa undergrowth and in a mixed food crop field in Nkongoa village, in Southern Cameroon. In each site, we conducted weekly 30-minutes capture from November 2016 to November 2017. Nymphal stages collected were counted and identified using appropriate keys. T. ferruginea has been present throughout the year as a univoltine population. Adults were observed throughout the year and coexisted in small number with the first stage larvae from early February to mid-April. T. ferruginea larvae (1-6) were more abundant during the short rainy season (from mid-March to June) while adults were abundant during the long dry season. Abundances of young larvae (stage 1-3) were not correlated with rainfall. Only adult abundances were correlated with relative humidity. Young larvae and adult abundance were positively correlated with temperature. The life cycle of T. ferruginea is different from that of T. thaelophora described in the Western Cameroon and those of Atractomorpha acutipennis (Guérin-Méneville 1844), Pyrgomorpha vignaudii (Guérin-Méneville 1849), Zonocerus variegatus (Linnaeus 1758) described in the humid forest Zone of Southern-Cameroon.
Tabla de contenidos
INTRODUCTION
1Taphronota ferruginea (Fabricius 1781) (Orthoptera: Pyrgomorphidae) est un ravageur des cultures (Nonveiller, 1984 ; Seino et al., 2012) et d'arbres dont l'aire de répartition s'étend principalement en Afrique de l'Ouest et du Centre. Il a été signalé au Bénin, au Cameroun, au Congo (RDC), en Côte d'Ivoire, au Gabon, au Ghana, en Guinée, au Libéria, au Nigeria, en Sierra Leone, au Togo et en République Centrafricaine (Dirsh, 1965 ; Mestre & Chiffaud, 2006). Au Cameroun, cet acridien est connu dans les hautes terres de l’Ouest (Seino et al., 2012) et dans la zone forestière du sud (Kekeunou et al., 2018). Dans cette aire de répartition, T. ferruginea attaque les feuilles de Amaranthus hybridus L. 1753, Ipomoea batatas (L.) Lam. 1793, Manihot esculenta Crantz 1766, Solanum nigrum L. 1753, Solanum tuberosum L. 1753, Thea sinensis (L.) Kuntze 1887 (Seino et al., 2012), Vernonia amygdalina Delile 1826 et Voacanga africana Stapf ex Scott-Elliot 1894 (Seino et al., 2012 ; Kekeunou et al., 2018). Hormis les insecticides qui sont utilisés contre l’acridien au moment de la lutte contre Zonocerus variegatus, aucune stratégie réelle de protection des cultures, spécifique à T. ferruginea, n'est connue dans la littérature.
2Le développement d'une stratégie de contrôle efficace et écologiquement durable de T. ferruginea dépend nécessairement de la disponibilité des données bio-écologiques. Les seules données disponibles dans la littérature sur la bio-écologie de cette espèce sont contenues dans Seino et al. (2012) et Kekeunou et al. (2018). Il apparait dans cette littérature que : le développement post-embryonnaire de T. ferruginea passe par six stades larvaires ; la durée totale du développement larvaire varie de 105 à 137 jours et celle de chaque stade larvaire est rapportée par Kekeunou et al. (2018). Les femelles adultes mettent en moyenne 42,6 ± 6,3 jours pour commencer l'accouplement ; la ponte a lieu en moyenne 45,8 ± 4,7 jours après le premier accouplement ; chaque femelle pond une seule oothèque et le nombre d'œufs par oothèque est en moyenne de 30,4 ± 5,1 (Kekeunou et al., 2018). Dans la Région de l’ouest (Cameroun), deux populations distinctes de T. thaelephora (Synonyme de T. ferruginea ferruginea) sont connues ; elles comprennent la population de saison sèche qui est présente dans la nature de novembre à février et la population de la saison humide, rencontrée entre avril et juin (Seino et al., 2012). On ne sait rien de l’abondance et du cycle biologique de T. ferruginea dans la zone forestière du Cameroun. Pourtant, ces données sont importantes : (1) dans la recherche de stratégies de lutte efficaces contre les ravageurs puisqu’elles rentrent dans la connaissance de leurs bio-écologies ; (2) dans l’application efficiente des méthodes de lutte mises sur pied, puisqu’elles permettent de savoir à quels moments appliquer avec efficacité, les produits développés contre un stade de développement donné.
3Cette étude ambitionne donc d’évaluer les fluctuations numériques des différents stades de développement de T. ferruginea dans une région de forêts humides du Cameroun. Nous voulons déterminer (1) la période de présence et d'abondance de T. ferruginea au cours d’une année et (2) caractériser le cycle biologique de l’acridien dans les zones dégradées de Nkongoa.
MATERIEL ET METHODES
2.1 Site d’étude
4Des captures ont été réalisées de novembre 2016 à novembre 2017 à Nkongoa (3°48'134” N and 11°36 '67” E) (Figure 1). Nkongoa, située dans une zone de forêt semi-décidue, est affecté par le défrichement des activités agricoles et pastorales. Nkongoa est sous l'influence d'un climat équatorial guinéen avec quatre saisons : une grande saison sèche (de mi-novembre à mi-mars); une petite saison des pluies (de mi-mars à juin); une petite saison sèche (de juillet à août) et une grande saison des pluies (de septembre à mi-novembre) (Bruneau, 1999 ; Fomekong et al., 2010). Dans cette zone, les précipitations varient de 1800 à 2000 mm par an et les températures entre 22 et 29 °C (Santoir & Bopda, 1995). Les captures ont eu lieu sur deux sites : (1) dans un champ mixte de cultures vivrières contenant des Amaranthaceae (Amaranthus cruentus), Anacardiaceae (Mangifera indica), Apocynaceae (Voacanga africana), Arecaceae (Elaeis guineensis), Burseraceae (Dacryodes edulis), Caricaceae (Carica papaya), Euphorbiaceae (Manihot esculenta), Fabaceae (Arachis hypogaea, Phaseolus vulgaris), Lauraceae (Persea americana), Musaceae (Musa spp.), Myrtaceae (Psidium guajava), Poaceae (Zea mays, Saccharum officinarum), Asteraceae (Vernonia amygdalina) et (2) dans le sous-bois d’une plantation cacaoyère, contenant des Anacardiaceae
5(Mangifera indica), Apocynaceae (Voacanga africana), Arecaceae (Elaeis guineensis), Musaceae (Musa spp.), Myrtaceae (Psidium guajava), Malvaceae (Theobroma cacao) et Asteraceae (Vernonia amygdalina).
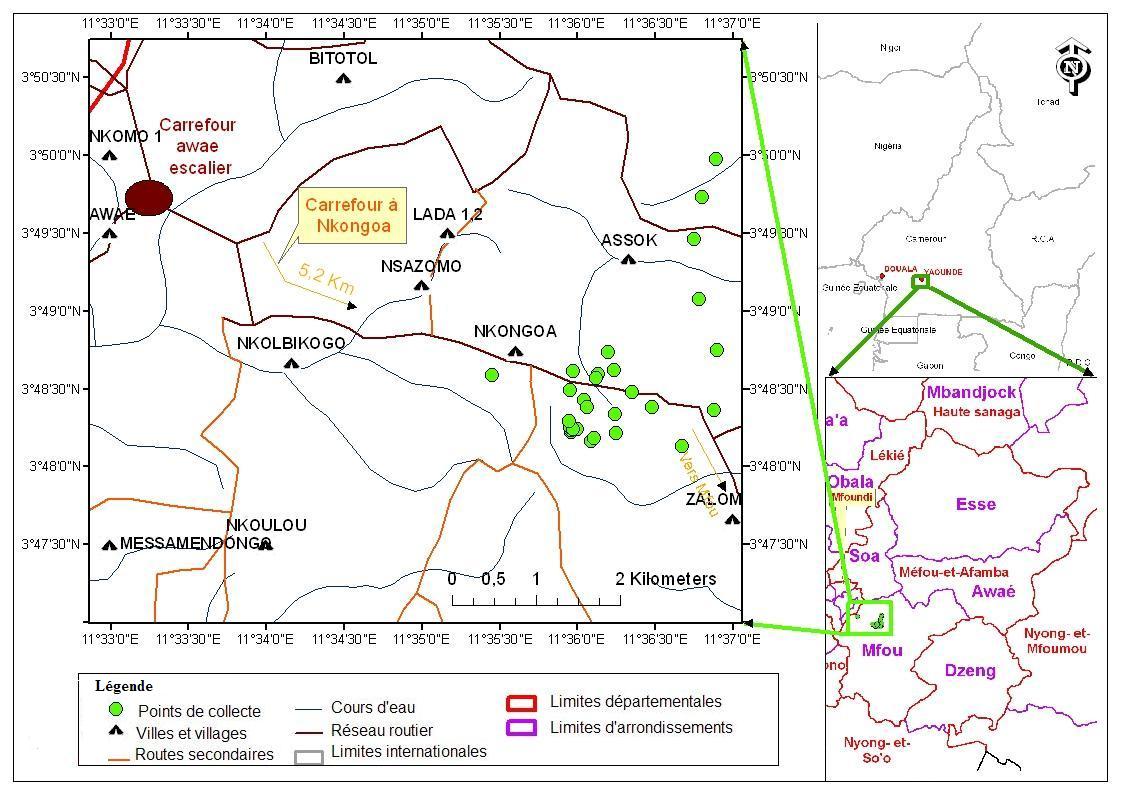
6Figure 1 : Localisation de Nkongoa (Arrondissement de Mfou, Cameroun) (Kekeunou et al., 2018).
2.2 Echantillonnage
7Des échantillons de T. ferruginea ont été collectés par fauchage dans un champ mixte de cultures vivrières et dans le sous-bois d’une plantation cacaoyère pendant 30 min ; les deux sites étant distants d'environ 2 km. Dans chaque site, nous avons effectué des collectes et des observations à pas réguliers (une fois tous les 7 jours), de novembre 2016 à novembre 2017. Toutes les captures ont débuté à partir d'un point fixe et ont été étalée sur l'ensemble du site. Au cours de la collecte, tous les cas d’accouplements et d'ovipositions ont été enregistrés. Les individus recueillis ont été conservés dans des sacs aérés, et comptés par stade (larves et adultes) et par sexe sur le terrain. Après identification et observation, ils ont été libérés sur le site de capture.
2.3 Identification des larves
8L'identification des larves a été réalisée sur le site grâce aux clés de Kekeunou et al. (2018). Les larves ont été identifiées à l’œil nu ou à l’aide d'une loupe portable, ceci en fonction des différents stades larvaires (jeunes et âgés).
2.4 Collecte de données météorologiques
9La température, les précipitations et l'humidité relative mentionnées dans ce travail proviennent du Centre des Forêts Humides de l’Institut International d’Agriculture Tropicale (CFH-IITA). Pendant la capture, l'humidité relative a varié de 71,5 à 98,9% avec une moyenne de 85,6% ; décembre a été le mois le moins humide alors que mai a été le plus humide. La température a varié entre 21,2 °C en août 2017 et 35,1 °C en février avec une moyenne de 24,4 °C. Les précipitations ont varié de 0 à 48,3 mm, avec une moyenne de 4,5 mm (Figures 2-3).
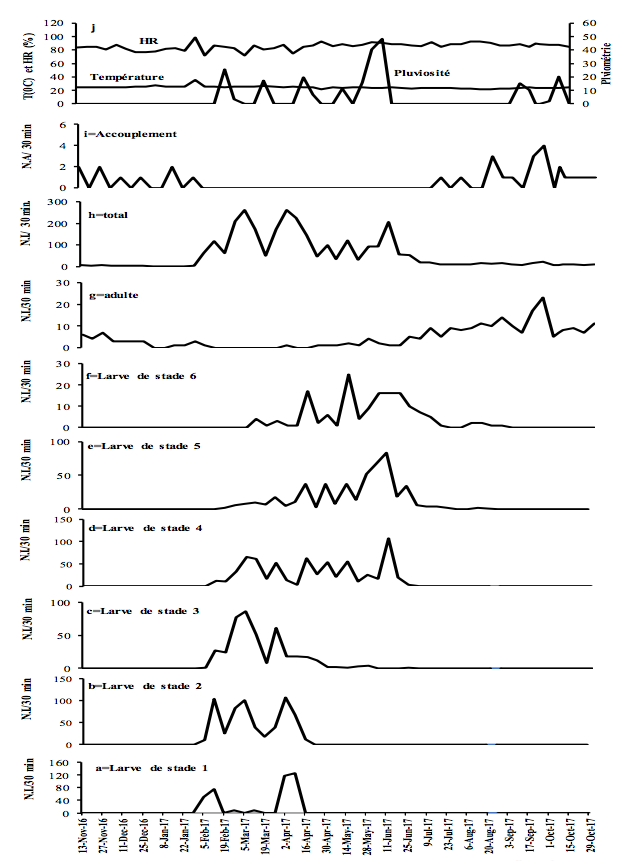
10Figure 2 : Fluctuations temporelles des précipitations, de l'humidité relative (HR), de la température et de l'abondance de Taphronota ferruginea (capture de 30 minutes / semaine) dans le sous-bois d’une plantation cacaoyère à Nkongoa (Yaoundé-Cameroun), de novembre 2016 à novembre 2017. N.A. = Nombre d’Accouplements, N.I. = Nombre d'Individus.
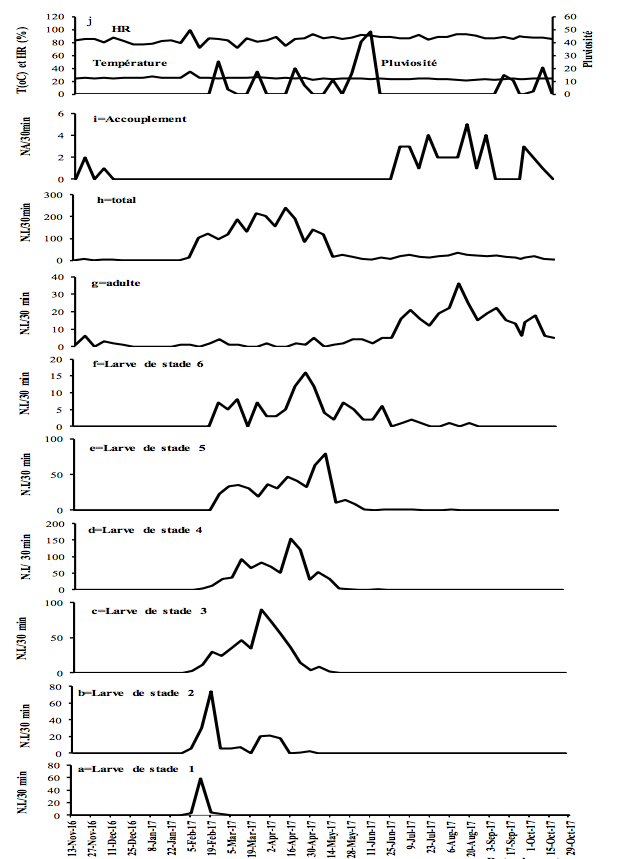
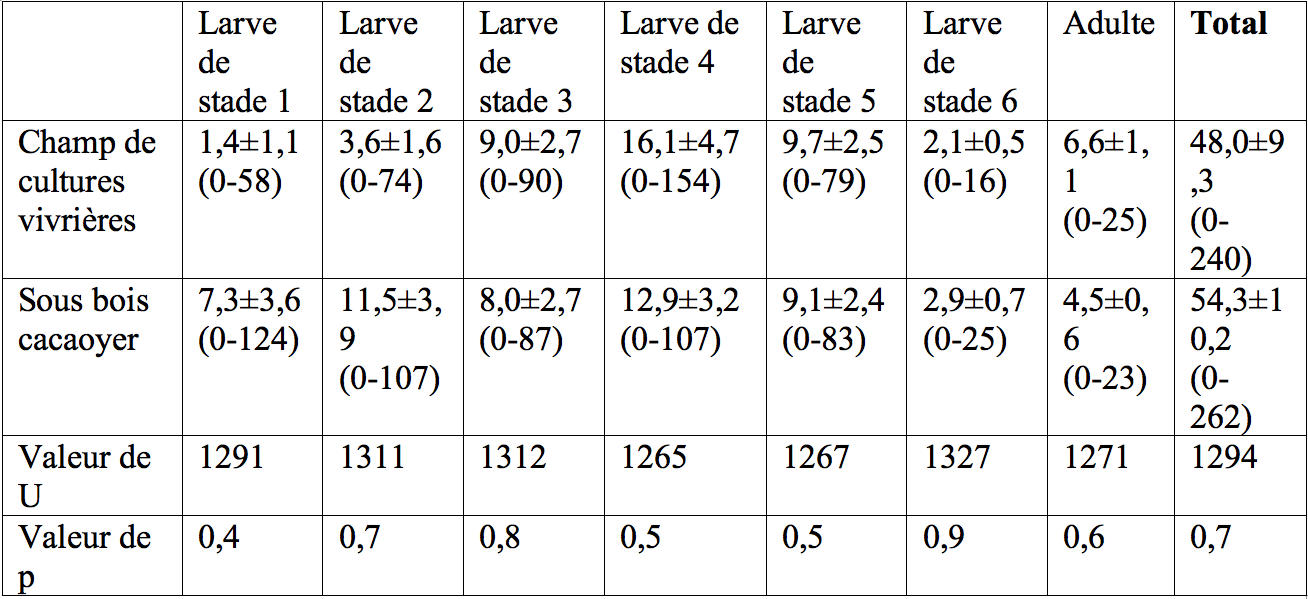
11Figure 3 : Fluctuations temporelles des précipitations, de l'humidité relative (HR), de la température et de l'abondance de Taphronota ferruginea (capture de 30 minutes / semaine) dans un champ mixte de cultures vivrières à Nkongoa (Yaoundé-Cameroun), de novembre 2016 à novembre 2017. N.A. = Nombre d’Accouplements, N.I. = Nombre d'Individus.
2.5 Analyse statistique des données
12L'abondance de la population de T. ferruginea a été analysée en utilisant la version 9.1 de SAS. En raison des données de comptage et de l'absence de normalité des distributions (vérifiée par le test de Shapiro-Wilk), nous avons utilisé le test H de Kruskal-Wallis et le test U de Mann-Withney pour comparer l'abondance des stades de développement post-embryonnaires entre les sites, les sexes et les saisons. Les différences ont été jugées significatives lorsque p <0,05.
RESULTATS
3.1 Présence et absence de Taphronota ferruginea dans la nature
13T. ferruginea a été présente de façon permanente tout au long de l'année, avec une période d'accouplement et une période de présence de chaque stade de développement post-embryonnaire (Figures 2-3).
14T. ferruginea est apparue dans la nature en début février et a disparu en début février de l'année suivante (près de 12 mois) (Figures 2-3). Les différents stades de développement post-embryonnaires ont été présents entre début février et mi-avril (près de 2,5 mois) pour les larves de stade 1; début février et fin avril (près de trois mois) pour les larves de stade 2 ; début février et fin mai (près de 4 mois) pour les larves de stade 3 ; mi-février et début de juillet (près de 3,5 mois) pour les larves de stade 4; fin février et fin juillet (près de 4 mois) pour les larves de stade 5; fin février et fin août (près de 5 mois) pour les larves de stade 6; début avril et début mai de l'année suivante (près de 12 mois) pour les adultes (Figures 2-3). Les adultes ont été présents tout au long de l'année, avec un pic d’abondance entre juillet et novembre (Figures 2g et 3g). Les adultes de T. ferruginea ont coexisté avec les jeunes larves (stades 1-3), en période de faibles abondances des adultes (Figures 2-3).
3.2 Abondance de Taphronota ferruginea dans la nature
15Dans le milieu naturel, 48,04±9,32 (0-240) et 54,39±10,26 (0-262) individus de T. ferruginea ont été capturés en 30 min dans le champ mixte de cultures vivrières et dans le sous-bois de la plantation cacaoyère respectivement, avec une abondance égale entre les deux sites (Tableau 1). Le stade larvaire 4 (champ de cultures vivrières) et les stades larvaires 2 et 4 (sous-bois cacaoyer), ont été les plus abondants (Tableau 1).
16Le sex-ratio a été proche de 1 dans tous les stades de développement post-embryonnaire du champ de cultures vivrières et du sous-bois cacaoyer (p> 0,05).
17L'accouplement a été observé de mi-juillet à fin janvier de l'année suivante (près de 6,5 mois) (Figures 2-3). Le nombre d'accouplements observés a été en moyenne de 7,0 ± 4,9 par 30 minutes (Figures 2-3).
18En général, une variation saisonnière de l'abondance a été observée dans les deux sites avec de fortes abondances pendant la petite saison des pluies. En considérant individuellement chaque stade post-embryonnaire, les larves des stades 1 et 2 de T. ferruginea ne sont apparues abondantes que pendant la grande saison sèche et pendant la petite saison des pluies ; les larves des stades 3-6 ont été plus abondantes pendant la petite saison des pluies ; le stade adulte a été abondant pendant la grande saison des pluies (Tableau 2).
3.3 Relations linéaires entre l'abondance de T. ferruginea et certains facteurs abiotiques
19L'abondance des jeunes larves (stades 1-3) de T. ferruginea n'a pas été corrélée aux précipitations (-0,06<r<0,19 ; p>0,05). Cette corrélation a été significative chez les larves des stades 4, 5 et les adultes dans le sous-bois cacaoyer alors qu’elle ne l’a été que chez les larves de stade 6 du champ de cultures vivrières (Tableau 3). Seules les abondances des adultes ont été corrélées à l'humidité relative. Les abondances des jeunes larves (1-3) et des adultes ont été positivement corrélées à la température. L’abondance des accouplements a diminué avec l'augmentation de la température (r> -0,33, p <0,001) (Tableau 3).
DISCUSSION
20La présente étude a montré que T. ferruginea est présente tout au long de l'année dans la zone de forêts humides du sud-Cameroun, avec une population univoltine. Ces résultats sont différents de ceux de Seino et al. (2012) obtenus sur la même espèce (T. thaelophora, synonyme de T. ferruginea ferruginea) dans les végétations naturelles de la Région de l’ouest du Cameroun, où ces auteurs ont noté la présence de deux populations annuelles distinctes, présentes de novembre à février (population de saison sèche) et d'avril à juin (populations de saison humide). Cette différence de type de cycle notée chez cette espèce entre les deux régions (ouest et centre) montre que T. ferruginea a un cycle de type modulable et peut s'expliquer par les différences de conditions écologiques et climatiques qui existent entre les deux régions. T. ferruginea répondrait à ces différences par un ajustement de ses effectifs aux conditions du milieu naturel. En fait, l'ouest du Cameroun est une zone de montagne dominée par des hautes herbes, avec un climat équatorial et un régime pluviométrique uni-modal, tandis que la région du centre est une zone forestière dominée par un climat équatorial avec un régime pluviométrique bimodal.
21La présence permanente de T. ferruginea dans la nature n’est pas un phénomène nouveau, elle a également été observée chez d’autres espèces de Pyrgomorphidae en zone forestière telles que Z. variegatus (Messi et al., 2006 ; Kekeunou et al., 2014), Pyrgomorpha vignaudii (Kekeunou et al., 2016) et Atractomorpha acutipennis (Duranton et al., 1987 ; Braud et al., 2014) et serait une caractéristique des espèces de cette famille en milieu forestier humide. Elle peut s’expliquer par la disponibilité permanente des plantes-hôtes principales de cette espèce (Voacanga africana et Vernonia spp.) dans la nature qui, selon Toye-Afolabi (1982) et Rao et al. (2000), affecterait fortement la présence, l’abondance et la capacité de survie des populations acridiennes et leurs cycles biologiques.
22La présence permanente d'adultes de T. ferruginea durant l'année a également été observée chez Z. variegatus dans les zones guinéennes du Togo (De Gregorio, 1987). Cette situation paraît étrange pour une espèce à population univoltine et peut s'expliquer soit par (1) la présence permanente de conditions favorables (plantes-hôtes) aux adultes tout le long de l’année, (2) soit par l'existence d'une seconde population ou d’une seconde génération de cet acridien, de très faible taille que les techniques d'échantillonnages utilisées ne permettraient pas de mettre en évidence au niveau larvaire. Cette dernière hypothèse indiquerait l'existence de deux populations univoltines d'abondances inégales, comme chez T. thaelophora de l’ouest-Cameroun et Z. variegatus (Kekeunou et al., 2014) ou d’une population bivoltine comme chez P. vignaudii (Kekeunou et al., 2016).
23Le décalage observé entre les pics d'abondances des différents stades de développement post-embryonnaires de T. ferruginea dans la nature est un phénomène fréquent chez les acridiens. Il peut être lié :(1) soit aux différences de durées de développement qui existent entre les différents stades de développement post-embryonnaires de T. ferruginea (Kekeunou et al., 2018) ; (2) soit à une réponse différente des différents stades de développement post-embryonnaires de l’acridien aux changements temporels qui affectent la structure biophysique du milieu naturel.
24La coexistence des adultes et des jeunes larves de T. ferruginea a été aussi notée par Messi et al. (2006), Kekeunou et al. (2014) chez Z. variegatus et Kekeunou et al. (2016) dans les populations de P. vignaudii dans la zone de forêts humides du sud-Cameroun. Cependant, T. ferruginea a une population univoltine contrairement à Z. variegatus et P. vignaudii qui ont respectivement deux populations univoltines et une population bivoltine. Ceci pose la nécessité d'étudier les arrêts de développement embryonnaire, larvaire et adulte chez T. ferruginea ; ceci pourrait nous aider à comprendre le caractère univoltin des populations naturelles de cet acridien.
25L’étude montre que la variation de l'ombrage et de la composition de la végétation entre les deux sites (Tableau 1) n'affecte pas l'abondance de T. ferruginea dans la nature. Cela peut s'expliquer par la présence de plantes-hôtes majeures de T. ferruginea dans les deux sites (Voacanga africana et Vernonia spp.). Les deux populations subiraient des pressions environnementales similaires dans les deux sites d'étude (conditions abiotiques, ennemis naturels, mêmes stratégies de dispersion ou efficacité des techniques d'échantillonnages).
26Le sex-ratio a été proche de 1 dans toutes les populations larvaires et adultes des deux sites (p> 0,05), suggérant que cette espèce a un sex-ratio non-biaisé qui serait lié à des facteurs tels que : (1) une réponse identique des populations des deux sexes face aux fluctuations des conditions environnementales ou face à la pression des ennemis naturels ; (2) le développement d’une même stratégie de dispersion ; (3) le filet fauchoir, dont l’usage ne modifierait pas la probabilité de capture des individus des deux sexes (Belovsky & Slade, 1993 ; Sword et al., 2008 ). Le dimorphisme sexuel (Kekeunou et al., 2018) qui existe chez T. ferruginea ne modifierait pas le comportement des prédateurs de cette espèce et par conséquent le sex-ratio, car dans la nature les prédateurs vertébrés et les ennemis naturels ont tendance à choisir les acridiens de plus grande taille et réussissent ainsi à modifier la composition sexuelle des populations (Belovsky & Slade, 1993 ; Gardner & Thompson, 1998). Ce résultat pose la nécessité d’étudier l’effet de la prédation et du parasitisme sur le sex-ratio chez T. ferruginea.
27La diminution saisonnière de l'activité d'accouplement notée dans cette étude est un phénomène fréquent chez les Acridiens. Ceci serait lié au caractère univoltin du cycle de T. ferruginea car selon Reinhardt et al. (2001), l'occurrence de l'accouplement chez les sauteriaux peut changer considérablement dans l'espace et dans le temps en fonction du type de cycle biologique.
28La variation saisonnière de l'abondance de T. ferruginea observée dans les deux sites serait une réponse aux changements des conditions abiotiques (température, humidité relative, précipitations) et biotiques (types de végétations). La forte abondance durant la saison des pluies suggère que T. ferruginea serait peu susceptible aux infections fongiques, ce qui pourrait hypothéquer les succès d’une possibilité d'utilisation des champignons contre T. ferruginea si des recherches étaient entreprises dans ce sens (lutte biologique par les biopesticides).
29En général, la variation spatio-temporelle des effectifs chez les acridiens est liée aux fluctuations des conditions biotiques et abiotiques du milieu. Lorsque les conditions d’environnement s’éloignent de celles qui sont optimales pour une espèce, soit parce qu’un facteur écologique clé devient limitant, soit parce que les combinaisons de facteurs déterminants pour l’espèce ne sont plus optimales, les performances démographiques se dégradent et certains processus de survie à des conditions adverses se mettent en place (Launois et al., 1996).
30Tableau 1 : Abondance moyenne de Taphronota ferruginea dans un champ mixte de cultures vivrières et dans le sous-bois d’une plantation cacaoyère de Nkongoa dans la zone de forêt humide du sud du Cameroun.
31N=52 captures, les valeurs du tableau représentent la moyenne ± l’Erreur Standard (SE). Les valeurs entre parenthèses représentent les nombres maximum et minimum d’individus. ‘p’ représente la probabilité associée au test U de Mann-Withney.
32Tableau 2 : Variation saisonnière de l'abondance moyenne de Taphronota ferruginea dans un champ mixte de cultures vivrières et dans le sous-bois d’une plantation cacaoyère de Nkongoa dans la zone de forêt humide du sud du Cameroun.
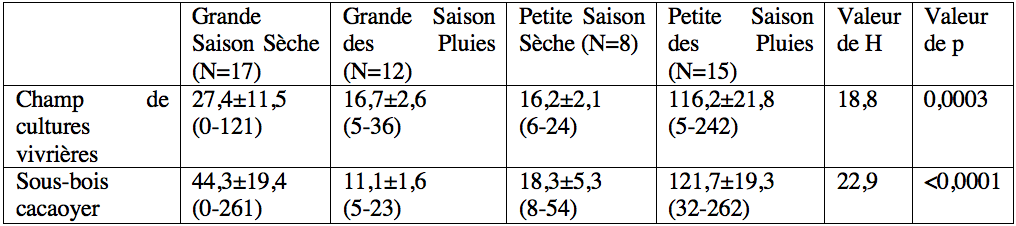 Les valeurs du tableau représentent la moyenne ± l’Erreur Standard (SE). Les valeurs entre parenthèses représentent les nombres maximums et minimums d’individus. ‘p’ représente la probabilité associée au test H de Kruskal-Wallis.
Les valeurs du tableau représentent la moyenne ± l’Erreur Standard (SE). Les valeurs entre parenthèses représentent les nombres maximums et minimums d’individus. ‘p’ représente la probabilité associée au test H de Kruskal-Wallis.
33Tableau 3 : Relation linéaire entre l'abondance moyenne de Taphronota ferruginea, l'humidité relative et la température dans le sous-bois d’une cacaoyère et dans un champ mixte de cultures vivrières de Nkongoa dans la zone de forêt humide du sud du Cameroun.
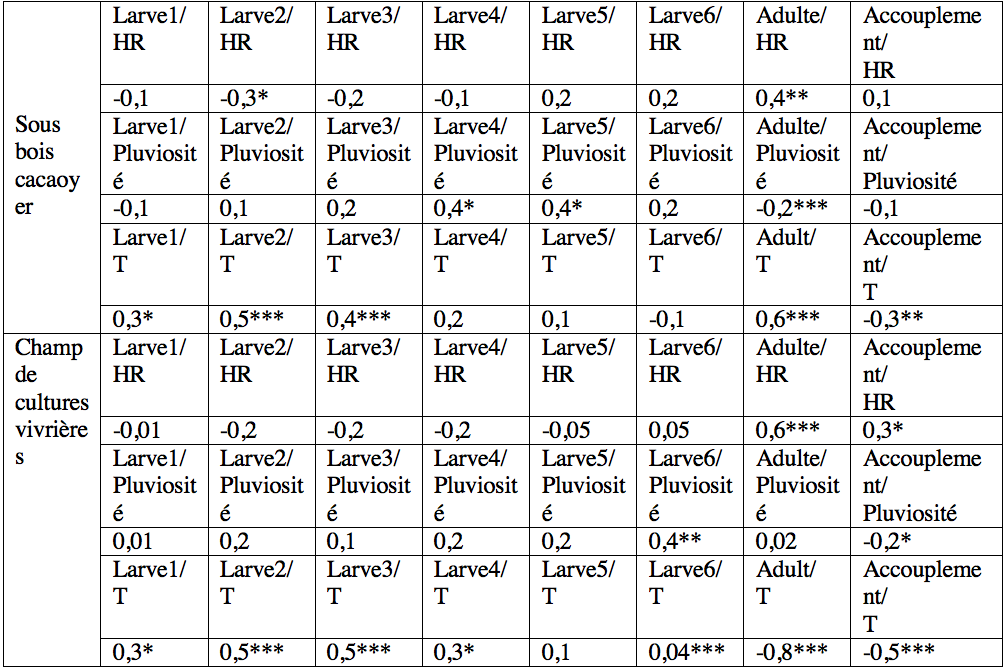 Les valeurs du tableau représentent les valeurs du coefficient de corrélation de Spermann (rρ), HR=Humidité relative, T=température, * valeur de rρ significative ; **= valeur de rρ hautement significative, *** valeur de rρ très hautement significative.
Les valeurs du tableau représentent les valeurs du coefficient de corrélation de Spermann (rρ), HR=Humidité relative, T=température, * valeur de rρ significative ; **= valeur de rρ hautement significative, *** valeur de rρ très hautement significative.
CONCLUSION
34T. ferruginea est présente durant toute l’année sous la forme d’une population univoltine dans la partie forestière du sud-Cameroun. La période d'apparition de chaque stade de développement de T. ferruginea dans la nature est connue. Il est maintenant possible d’appliquer un traitement (insecticide ou biologique) spécifique contre un ou plusieurs stades de développement de cet acridien. La présence permanente des adultes de T. ferruginea dans la nature pose la nécessite d'étudier les arrêts de développement, ce qui pourrait nous aider à comprendre le caractère univoltin des populations naturelles de cet acridien et de mieux expliquer les différences entre le cycle décrit dans cette étude et celui décrit dans l’ouest du Cameroun.
REMERCIEMENTS
35Ce travail a été financé par le ministère de l'Enseignement Supérieur à travers l’appui trimestriel à la modernisation de la recherche. Nous remercions l'équipe de protection des végétaux du Laboratoire de Zoologie de la Faculté des Sciences (Université de Yaoundé 1) pour son aide dans la collecte des données.
Bibliographie
Belovsky G.E. & Slade J.B. 1993. The role of vertebrate and invertebrate predators in a grasshopper community. Oikos, 68, 193–201.
Braud Y., Franc A. & Gay P.E. 2014. Les acridiens des formations herbeuses de Madagascar, FAO, Rome.
Bruneau J.C., 1999. Le Cameroun, une Afrique en miniature. Dans: Vicat, J.P. et BILONG, P. (eds) Géologie et environnement au Cameroun, pp.1-8. Presses de l'Université de Yaoundé.
De Gregorio R., 1987. Zonocerus variegatus (Orthoptera, Pyrgomorphidae) : caractéristiques morphologiques et biométriques des larves des populations des saisons sèche et humide. Bulletin de la société d’histoire naturelle de Toulouse, 123, 29-44.
Dirsh V.M., 1965. The African Genera of Acridoidea. Cambridge University press, London (Great Britain’s). p. xiii + 579.
Duranton J.F., Launois M., Launois-Luong M.H., Lecoq M. & Rachadi T., 1987. Guide antiacridien du Sahel. Ministère de la Coopération, Paris (France).
Fomekong A., Messi J., Kekeunou S. & Tamesse J.L., 2010. Développement, morphologie et reproduction de Coridius xanthopterus (Heteroptera: Dinidoridae), ravageur de concombre Cucumeropsis mannii dans le Sud-Cameroun. Entomologie faunistique, 62 (4), 153-163.
Gardner K.T. & Thompson D.C., 1998. Influence of avian predation on a grasshopper (Orthoptera: Acrididae) assemblage that feeds on threadleaf snakeweed. Population Ecology, 27, 111–116.
Kekeunou S., Yetchom-Fondjo A., Yana W., Missoup A.D., Heumou C., Yengek F. & Prombo C., 2014. Life Cycle of Zonocerus variegatus (Orthoptera: Pyrgomorphidae) in the Areas of Equatorial Climate of Cameroon with Uni-and Bimodal Distribution of Rainfall. Academic Journal of Entomology, 7 (3), 88-101.
Kekeunou S., Kemtchouan C.W., Wandji A.C. & Baleba-Soh S., 2016. Abundance and Life Cycle of Pyrgomorpha vignaudii (Orthoptera: Pyrgomorphidae) in the Humid Forest Zone of Southern Cameroon. Journal of Entomological Research Society, 18, 95-104.
Kekeunou S., Wandji A.C. & Oumarou Ngoute O., 2018. Morphology, post-embryonic development and reproduction of Taphronota ferruginea (Fabricius, 1781) (Orthoptera: Pyrgomorphidae). Tropical Zoology, 31, 54-68.
Launois M., Launois-Huong M. H. & Lecoq M., 1996. Sécheresse et survie des sautériaux du Sahel ouest-Africain. Sécheresse, 7, 119-127.
Mestre J. & Chiffaud J., 2006. Catalogue et atlas des acridiens de l'Afrique de l'Ouest.
Messi J., Kekeunou S. & Weise S., 2006. Abundance and life cycle of Zonocerus variegatus (Orthoptera: Pyrgomorphidae) in the humid forest zone of southern Cameroon. Entomological Science, 9(3), 23-30.
Nonveiller G., 1984. Catalogue des Insectes du Cameroun d'intérêt Agricole. Montpellier: PRIFAS (France).
Santoir C. & Bopda A., 1995. Atlas régional Sud-Cameroun. Office de la Recherche Scientifique et Technique Outre-Mer, Paris (France).
Rao M.R., Singh M.P., Day R., 2000. Insect pest problem in tropical agroforestry systems. Contributory factors and strategies for management. Agroforestry Systems, 50, 243–277.
Reinhardt K., Samietz J., Wagner G., Opitz S. & Köhler G., 2001. Diel and seasonal mating peaks in grasshopper populations (Caelifera: Acrididae). Journal of Orthoptera Research, 10 (2), 263-269.
Seino R.A., Dongmo I.T. & Yacouba M., 2012. Cytogenetic characterization of Taphronota thaelephora Stal. 1873. (Orthoptera: Pyrgomorphidae) from Cameroon. II. Description of mitotic chromosomes. International Journal of Biological and Chemical Sciences, 6 (4), 1624 -1632.
Sword G.A., Lorch P.D. & Gwynne D.T., 2008. Radiotelemetric analysis of the effects of prevailing wind direction on Mormon cricket migratory band movement. Environmental Entomology, 37, 889–896.
Toye-Afolabi S., 1982. Studies on the biology of the grasshopper pest Zonocerus variegatus (L.) (Orthoptera: Pyrgomorphidae) in Nigeria: 1911–1981. Insect Science and its Application, 3, 1–7.