- Accueil
- Volume 73 (2020)
- Diversité et agressivité de la culicidofaune dans la ville de Douala, Cameroun
Visualisation(s): 1808 (49 ULiège)
Téléchargement(s): 96 (0 ULiège)
Diversité et agressivité de la culicidofaune dans la ville de Douala, Cameroun

Document(s) associé(s)
Version PDF originaleNotes de la rédaction
Document soumis le 09-04-2019, accepté le 10-01-2020, mis en ligne 24-06-2020
Résumé
La présente étude détermine la diversité, le cycle nocturne d’agressivité et la distribution spatio-temporelle de la culicidofaune agressive à l’Homme dans trois quartiers écologiquement différents de la ville de Douala (Cameroun).
Les moustiques adultes étaient collectés à Logbessou, Yansoki et Ndogbati grâce aux captures nocturnes sur les volontaires en utilisant les tubes à hémolyse. Ces captures avaient lieu pendant trois trimestres de l’année 2017 (du mois de février au mois de novembre), de 18 heures à 6 heures, au rythme de 3 nuits consécutives par trimestre. Elles ont été effectuées à l’intérieur et à l’extérieur de trois habitations choisies dans chaque quartier en fonction de leur proximité avec un point d’eau. Les moustiques capturés étaient identifiés sur la base des critères morphologiques.
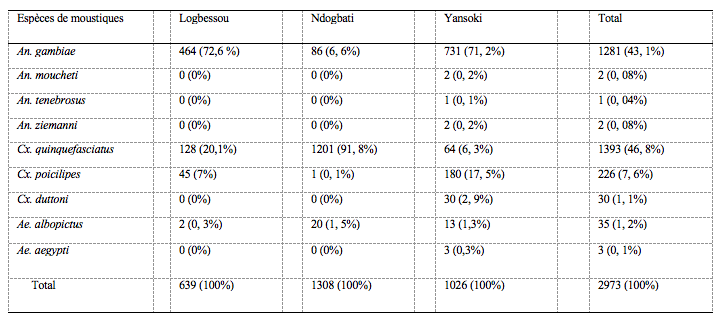
Durant l’étude, 2973 moustiques étaient capturés. Les études taxonomiques ont permis d’identifier neuf espèces dans les 3 sites : Anopheles gambiae sl Giles (43,1%), An. moucheti Evans (0,08%), An. tenebrosus Doenitz (0,04%), An. ziemannii Gruenberg (0,08%), Culex quinquefasciatus Say (46,8%), Cx. poicilipes Théobald (7,6%), Cx. duttoni Théobald (1,1%), Aedes albopictus Skuse (1,2%), Ae. aegypti Linnaeus (0,1%). Yansoki (quartier rural) (neuf espèces) avait une richesse spécifique plus forte que Ndogbati (quartier mal urbanisé) (quatre espèces) et Logbessou (quartier semi-urbain en plein essor) (quatre espèces). Les densités agressives étaient présentes durant tous les mois d’étude (février, août, novembre) avec cependant une recrudescence en août à Yansoki et Ndogbati. Anopheles sl et Cx. quinquefasciatus étaient essentiellement exophages et pouvaient piquer en dehors des heures de sommeil.
Les populations concernées devraient arrimer leurs mesures de prévention aux comportements trophiques des vecteurs pour éviter les maladies transmises par la faune culicidienne locale.
Abstract
This study was aimed at determining the diversity, the nocturnal cycle of aggressiveness and the spatio-temporal distribution of the aggressive culicidofauna feeding on man in 3 ecologically different districts of Douala (Cameroon).
Adult mosquitoes were captured for 3 trimesters of the year 2017 (between February and November) in Logbessou, Yansoki and Ndogbati through human landing catch, using test tubes. Captures were performed from 6.00 p.m. to 6.00 a.m., for 3 consecutive nights each trimester, in and outside 3 houses selected in each district based on their proximity with breeding sites. Mosquitoes were identified to species based on morphological criteria.
A total of 2973 adult female mosquitoes were captured in the 3 districts. Overall, 9 species were identified namely, Anopheles gambiae sl Giles (43.1%), An. moucheti Evans (0.08%), An. tenebrosus Doenitz (0.04%), An. ziemannii Gruenberg (0.08%), Culex quinquefasciatus Say (46.8%), Cx. theobald poicilipes (7.6%), Cx. duttoni Theobald (1.1%), Aedes albopictus Skuse (1.2%), Ae. aegypti Linnaeus (0.1%). Yansoki (9 species of mosquitoes identified, including 4 Anopheles) which is a rural district had a higher specific diversity than Ndogbati (4 species of mosquitoes identified, including 1 Anopheles) which is poorly urbanized and Logbessou (4 species of mosquitoes identified, including 1 Anopheles) which is a fast growing suburb. Aggressive density was always present but there was a sharp upsurge in August in Yansoki and Ndogbati. Anopheles gambiae sl and Cx. quinquefasciatus were mostly exophagous and could bite out of sleeping hours.
Populations should align their preventive measures with vector trophic behaviors in order to avoid diseases that can be transmitted by the local culicidian fauna.
Table des matières
1. Introduction
1La ville de Douala, à l’image de plusieurs villes d’Afrique subsaharienne a connu une urbanisation anarchique et mal contrôlée. Si le schéma de construction de la ville tel que défini par les services compétents de la communauté urbaine a été suivi dans certains quartiers, il convient de noter qu’il l’a été moins dans d’autres. Conséquence, Douala présente au jour d’aujourd’hui un visage hétérogène, caractérisé par cinq typologies de quartiers : les quartiers bien urbanisés, les quartiers mal urbanisés, les quartiers semi-urbains, les quartiers agricoles et des quartiers ruraux ou périphériques. De nombreux auteurs ont montré que la distribution des maladies à transmission vectorielle est fonction des différents faciès écologiques rencontrés dans la ville (Dossou-Yovo et al., 1998). A chaque faciès écologique correspond une modalité particulière de la transmission de la maladie. Bien plus, la composition des vecteurs peut varier d’un faciès écologique à un autre, de même que l’éthologie et la capacité vectorielle de ceux-ci. Cette variabilité, au-delà des considérations éco-climatiques propres à chaque quartier, peut également être liée aux habitudes quotidiennes des populations humaines et animales (Mbida et al.,2016). De récentes études menées dans la ville de Douala ont montré des résultats de l’île de Manoka (quartier balnéaire de Douala) qui tranchaient complètement avec ceux de Ndogbong. A Manoka, le système vectoriel était composé d’Anopheles coluzzii, Anopheles melas et Anopheles tenebrosus. L’activité agressive nocturne de ces anophèles était fortement corrélée aux habitudes des habitants. Le pic d’agressivité des anophèles était enregistré à 4h, heure à laquelle les habitants majoritairement pêcheurs, étaient de retour de la pêche (Mbida et al.,2016). Par contre à Ndogbong, le système vectoriel était composé d’Anopheles coluzzii. Le cycle d’agressivité montrait plutôt un pic entre 2h-4h. Cette tranche horaire correspondait à la période de la nuit pendant laquelle l’homme profondément endormi devenait une proie facile pour le moustique. La perte de l’insecticide par la moustiquaire, les multiples déchirures présentées par celle-ci ou alors le mauvais enfilage de celle-ci par le propriétaire sont autant de facteurs susceptibles de favoriser le contact homme-vecteur durant cette tranche horaire (Akono et al.,2017). Dans la ville de Bouaké en Côte d’Ivoire, le scénario semble être le même. Les études menées par Dossou Yovo et al. (1998) ont montré une différence significative en termes de richesse spécifique, de l’abondance et du comportement des vecteurs entre les quartiers rizicoles et ceux de bas-fonds de maraîchage. Cette variabilité des paramètres entomologiques d’un quartier à l’autre au sein d’une même ville rend complexe la mise en œuvre d’une stratégie de lutte antivectorielle efficiente et durable. Il s’avère donc nécessaire de tenir compte des spécificités propres à chaque quartier (faciès éco-climatique) si l’on veut mettre sur pied une stratégie de lutte antivectorielle qui garantisse le mieux la santé des populations. Logbessou, Yansoki et Ndogbati sont trois quartiers de la ville de Douala différents au plan écologique et obéissant chacun à l’un des typologies des quartiers des villes africaines. De toutes les enquêtes entomologiques menées dans la ville de Douala, aucune de ce type ne s’est déroulée dans ces quartiers. Pourtant, les particularités écologiques présentées par chacun de ces quartiers ainsi que les activités menées par les populations qui y vivent sont susceptibles d’avoir un impact sur la qualité, l’abondance ainsi que le comportement trophique de la faune culicidienne agressive locale. La présente étude fait le point sur la diversité de la culicidofaune agressive à Logbessou, Yansoki et Ndogbati dans l’optique de mettre sur pied une stratégie de lutte antivectorielle en adéquation avec les spécificités de chaque quartier.
2. Matériel et méthodes
2.1. Sites d’étude
2Les études avaient lieu à Logbessou, Yansoki et Ndogbati trois quartiers de la ville de Douala, écologiquement différents. Douala est considéré comme la plus grande ville du pays avec une conférence superficielle de 923 km2 pour une population de plus de 3 millions d’habitants (2,7 millions en 2010) (BUCREP, 2010). La ville est située à 1 mètre au-dessus de la mer et baigne dans un climat chaud et humide ; avec une température annuelle moyenne de 27°C et une humidité moyenne de 85¨% (WMO, 2012, Weather base, 2012). Les précipitations sont abondantes, de l’ordre de 3600 mm de pluies par an. Le réseau hydrographique est constitué du fleuve Wouri, lequel est encadré par la Sanaga, la Dibamba, le Moungo et le Nyong. La végétation est celle de la forêt ombrophile de basse altitude.
3Ndogbati (4°29' N, 9°51' E) est un quartier du district de santé de Deido. Il peut être considéré comme l’un des quartiers classiques de la ville. Le plan d’urbanisation est moins bien respecté. Les maisons d’habitations sont construites en matériaux définitifs (mûrs faits en parpaings). Les chambres sont dotées de moustiquaires imprégnées (MII). En plus des MII, certains domiciles utilisent les serpentins fumigènes pour se protéger des moustiques. Les routes secondaires sont non bitumées et pourvues de nids de poules susceptibles d’héberger les larves de moustiques en saisons pluvieuses. L’on note plusieurs points de vente et de réparation des pneumatiques d’occasion qui constituent les gîtes préférentiels des moustiques du genre Aedes.
4Logbessou (4°05’N, 09°46’E), est un quartier du district de santé de Deido. C’est un quartier périphérique en plein essor. Le plan d’urbanisation est bien respecté. Les maisons sont de type ‘haut standing’. L’on note par ailleurs la présence de plusieurs chantiers de construction de maisons. Les fosses septiques, les puisards, les égouts ainsi que les traces de roues de camions de sable servant à ravitailler les chantiers peuvent en saison pluvieuse, constitués les gîtes préférentiels de larves d’anophèles.
5Yansoki (3°58 ‘N, 09°47 E) est un quartier périphérique à aspect rural. L’environnement est encore naturel. C’est un quartier limitrophe à un bloc forestier. L’élevage des porcs et des poulets y est pratiqué. Ce quartier est traversé par la Dibamba, un cours d’eau susceptible d’héberger les larves de moustiques.
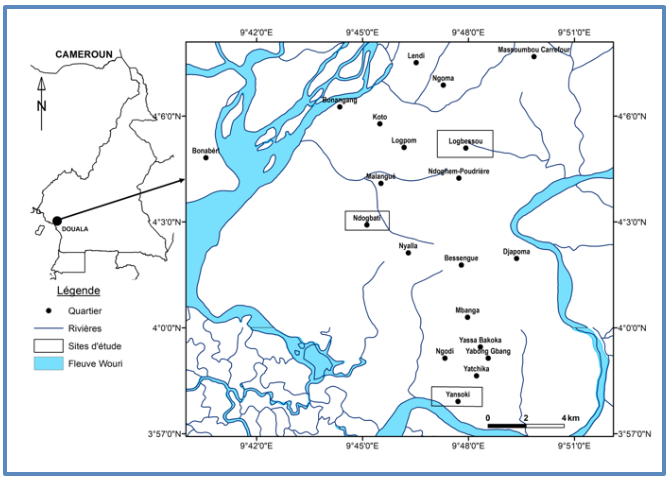 Figure 1. Localisation des sites d’études
Figure 1. Localisation des sites d’études
2.2. Capture et traitement des moustiques
6Les femelles de moustiques adultes étaient collectées de février à novembre 2017 en utilisant les tubes à hémolyse. La méthode utilisée est celle de captures nocturnes sur les volontaires préalablement vaccinés contre la fièvre jaune et soumis à une prophylaxie contre le paludisme à travers l’administration de 3 comprimés de sulfadoxine-pyriméthamine 500 mg/25 mg. Ces captures avaient lieu de 18 heures à 6 heures pendant 3 trimestres, au rythme de 3 nuits consécutives par trimestre, à l’intérieur et à l’extérieur de 3 habitations choisies en fonction de leur proximité avec un point d’eau dans les 3 sites d’étude. Chaque habitation utilisait 2 volontaires par nuit de capture, dont l’un positionné à l’intérieur et l’autre positionné à l’extérieur. Les moustiques capturés ont été dépouillés par maison de capture et par tranche horaire puis identifiés sur la base des critères morphologiques (Jupp, 1996 ; Gillies et Coetzee, 1987 ; Gillies et De Meillon, 1968).
2.3. Analyse des données
7Les données étaient reportées dans le tableur Excel. Le logiciel SPSS (version 20) a été utilisé pour les analyses statistiques, notamment le test H de Kruskall-Wallis pour comparer les densités agressives et les taux de capture par mois de capture et par sites d’étude. Le test de Mann-Whitney a permis de comparer le nombre de moustiques exophages de ceux endophages dans chaque site de capture.
3. Résultats
3.1. Diversité et fluctuations mensuelles de la culicidofaune agressive à l’homme
8Un total de 2973 moustiques femelles adultes repartis en 9 espèces était obtenu en 81 hommes-nuits de capture dans les 3 sites d’étude. La faune culicidienne agressive globale était dominée par Cx. quinquefasciatus (n = 1393 ; 46,8 %) suivi d’An. gambiae s.l (n = 1281 ; 43, 1%), An. tenebrosus (n = 1 ; 0,04 %) représentait la tranche de la population la moins importante. An. gambiae s.l. était l’espèce la plus représentée à Logbessou (n=464 ; 72,6 %) et Yansoki (n= 731; 71, 2%) alors que Cx. quinquefasciatus (n=1201 ; 91, 8%) l’était à Ndogbati. Yansoki avait la plus forte richesse spécifique (S=9), suivi des 2 autres sites avec 4 espèces chacun. Anopheles gambiae s.l., Cx. quinquefasciatus, Cx. poicilipes, Ae. albopictus étaient des espèces communes aux 3 sites. Aedes aegypti, Cx. duttoni, An. moucheti, An. tenebrosus et An. ziemannii étaient des espèces supplémentaires retrouvées à Yansoki (tableau 2). Les densités des moustiques enregistrées à Ndogbati (n=1308) et Yansoki (n=1026) étaient significativement supérieures à celles enregistrées à Logbessou (n=639) (p=0,002).
Tableau 1. Diversité de la culicidofaune dans les sites d’études
9A Yansoki et à Ndobati, les densités des espèces de moustiques étaient significativement élevées au mois d’août par rapport aux mois de février et de novembre (p˂0,05)
Tableau 2. Densité agressives mensuelles par sites de capture
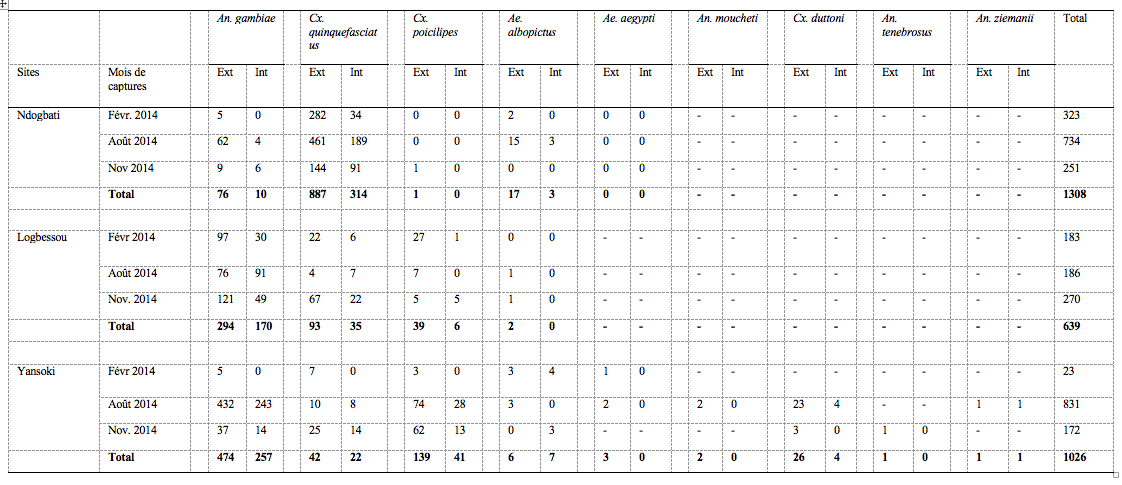 Ext = Extérieur des habitations ; Int = Intérieur des habitations
Ext = Extérieur des habitations ; Int = Intérieur des habitations
3.2. Comportement trophique
10De façon générale, l’on notait une forte tendance à l’exophagie des espèces présentes dans les sites d’étude. Un total de 2103 (70,7%) moustiques était capturé à l’extérieur des habitations alors que 870 (29,3%) moustiques étaient capturés à l’intérieur. Le test de Mann-Whitney montre que les moustiques exophages étaient significativement plus abondants que les moustiques endophages (p= 0,003). Cette observation était la même à Logbessou (p= 0,02), Ndogbati (p= 0,001) et Yansoki (p= 0,03).
3.3. Taux de piqûres
11Le taux moyen global d’agressivité enregistré durant la période d’étude était de 18,4 p/H/n. Culex quinquefasciatus (8,6 p/H/n) était responsable de 46,7% de cette agressivité suivi d’An. gambiae s.l. (7,9 p/H/n) (42,9%). A Logbessou, le taux moyen global d’agressivité était de 11,8 p/H/n. Ce taux était de 24,2 p/H/n et 19 p/H/n respectivement à Ndogbati et Yansoki. Anopheles gambiae s.l. était l’espèce la plus agressive à Logbessou et Yansoki avec des taux de piqûres de 8,6 p/H/n et 13,5 p/H/n respectivement. Culex quinquefasciatus était l’espèce la plus agressive à Ndogbati (22,2 p/H/n). Les taux de piqûres étaient significativement plus élevés à l’extérieur par rapport à l’intérieur des maisons dans les 3 sites d’étude (p˂0,05).
3.4. Rythme horaire d’agressivité d’An. gambiae sl et Cx. Quinquefasciatus
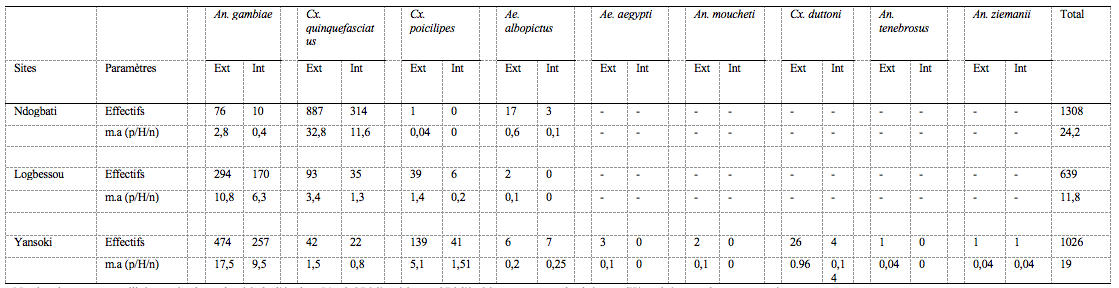
12A Ndogbati, un total de 314 spécimens de Cx. quinquefasciatus a été capturé à l’intérieur des habitations contre 887 à l’extérieur au cours des enquêtes. Les figures 2A et 2A’ indiquent un rythme horaire d’agressivité de cette espèce se découpant en 2 grandes périodes. A l’intérieur des habitations, les femelles présentaient une activité agressive en nette évolution entre 18h et minuit, pour atteindre le pic entre 22h et minuit. Ensuite, à partir de minuit/2h, l’agressivité chutait progressivement jusqu’au matin. A l’extérieur des habitations, la tendance était la même avec cependant un décalage du pic d’agressivité vers la tranche horaire minuit/2h.
13Anopheles gambiae sl était l’espèce la plus agressive à Logbessou (6,3 p/H/n à l’intérieur des habitations contre 10,8 p/H/n à l’extérieur) et Yansoki (9,5 p/H/n à l’intérieur des habitations contre 17,5 p/H/n à l’extérieur).
Tableau 3. Taux de piqures de la faune culicidienne agressive dans les sites d’étude
 Nombre de captureurs par site durant la période d’étude = 54 soit 27 à l’extérieur et 27 à l’intéireur. m.a = taux de piqures ;
Nombre de captureurs par site durant la période d’étude = 54 soit 27 à l’extérieur et 27 à l’intéireur. m.a = taux de piqures ;
p/H/n = piqures par homme par nuit
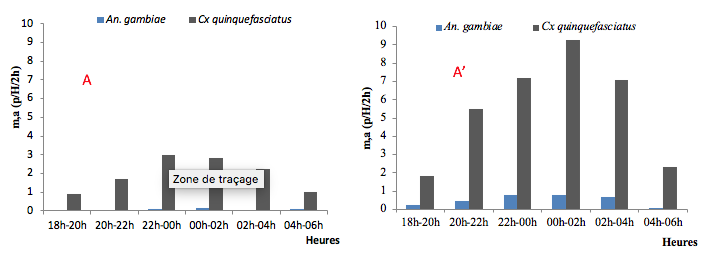 Figure 2. Cycles nocturnes d’agressivité des espèces de moustiques les plus agressives à l’homme
Figure 2. Cycles nocturnes d’agressivité des espèces de moustiques les plus agressives à l’homme
A : Intérieur des habitations de Ndogbati ; A’ : extérieur des habitations de Ndogbati
14A l’intérieur des habitations de Logbessou, le rythme horaire d’agressivité d’An.gambiae sl était semblable à celui de Cx. quinquefasciatus précédemment décrit à Ndogbati avec un pic situé dans la tranche minuit/2h. Par contre à l’extérieur des habitations, le tracé était caractérisé par 2 pics d’agressivité, l’un entre minuit et 2h et l’autre entre 4h et 6h (figures 3B et 3B’).
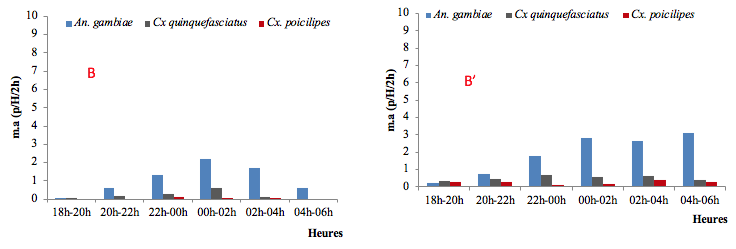 Figure 3. Cycles nocturnes d’agressivité des espèces de moustiques les plus agressives à l’homme
Figure 3. Cycles nocturnes d’agressivité des espèces de moustiques les plus agressives à l’homme
B : Intérieur des habitations de Logbessou ; B’ : Extérieur des habitations de Logbessou
15A Yansoki, le rythme horaire d’agressivité d’An gambiae sl était aussi semblable à celui de Cx. quinquefasciatus précédemment décrit à Ndogbati avec cependant un pic situé dans la tranche 2h/4h à l’intérieur des habitations et minuit/2h à l’extérieur des habitations. A l’extérieur des habitations, l’agressivité restait néanmoins maximale et stable entre minuit et 4h avant de chuter jusqu’au matin (figures 4C et 4C’).
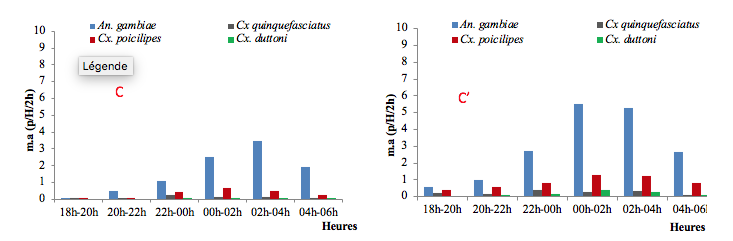
Figure 4. Cycles nocturnes d’agressivité des espèces de moustiques les plus agressives à l’homme
C : Intérieur des habitations de Yansoki ; C’ : Extérieur des habitations de Yansoki
4. Discussion
16Cette étude avait pour objectif de déterminer la diversité de la faune culicidienne agressive dans quelques quartiers de la ville de Douala, présentant des différences écologiques les uns par rapport aux autres. Les résultats obtenus ont montré que la faune de moustiques anthropophiles dans cette ville est riche et diversifiée et la répartition spatiotemporelle des espèces ainsi que leur abondance est étroitement liées aux caractéristiques écologiques de leurs sites de captures. Cette observation a également été faite par Dossou-Yovo et al. (1998) dans une zone rizicole à Bouake en Côte-d’Ivoire. Le complexe d’espèces Anopheles gambiae s.l. était le plus représenté à Yansoki et Logbessou. Les espèces appartenant à ce complexe sont reconnues comme étant héliophiles, affectionnant les gîtes ensoleillés, temporaires, et très pauvres en matières organiques dissouts (Mouchet et Gariou, 1961 ; Fontenille et al., 2003).Yansoki et Logbessou sont encore très peu anthropisés comparativement aux autres quartiers de la ville. L’environnement est naturel, et l’on note l’absence de sociétés industrielles susceptibles de déverser les polluants chimiques et organiques dans la nature. Bien plus, certains chantiers de maisons d’habitations et d’édifices publics contribuant significativement à la mise en place des gîtes de ponte d’anophèles sont visibles. Des recherches similaires, mettant en exergue l’apport des chantiers de construction de maisons en périphérie des villes sur la prolifération des anophèles ont déjà été menés dans plusieurs sites urbains en Afrique (Akono et al., 2015). Par ailleurs, des études récentes ont montré qu’An. gambiae s.s. est la seule espèce du complexe gambiae qui se développe préférentiellement dans les gîtes peu pollués des périphéries des villes comparativement à l’espèce An. coluzzii qui semble s’adapter aux gîtes pollués des sites urbains en Afrique (Tene et al., 2015 ; Etang et al., 2016). Cette observation, qui a été par ailleurs confirmée par les travaux menés au Cape Coast (Ghana) par Kudom (2015), permet de suggérer que les femelles d’An. gambiae s.l. collectées à Yansoki et Logbessou étaient de l’espèce An. gambiae s.s. alors que celles capturées à Ndogbati étaient probablement de l’espèce An. coluzzii. Une identification moléculaire devrait néanmoins être menée pour confirmer cette hypothèse ainsi qu’une analyse minutieuse des œufs. Anopheles ziemanni, An. moucheti et An. tenebrosus ont uniquement été capturés à Yansoki. Ce quartier côtoie un important massif forestier et est traversé par le fleuve Dibamba. Anopheles ziemanni et An. moucheti sont des espèces affectionnant des cours d’eau au sud-Cameroun alors qu’An. tenebrosus est une espèce typiquement forestière (Mouchet et Gariou, 1961). Culex quinquefasciatus constitue la principale nuisance culicidienne dans les villes africaines (Baldet, 1995). Sa capture à des proportions assez considérables dans les 3 sites d’étude malgré leurs différences écologiques relève de sa forte plasticité écologique acquise au fil du temps. Primitivement, cette espèce culicinienne se développait préférentiellement dans les sites urbains notamment dans les gîtes temporaires, herbeux et pollués (Baldet, 1995). Sa présence de plus en plus visible dans les sites péri-urbains et ruraux relèverait d’une adaptation secondaire. En outre, le quartier Ndogbati est caractérisé par la présence de plusieurs sociétés de vente de pneumatiques d’occasion. Selon Hawley (1988), les pneus constituent un site d’oviposition attractif pour les femelles d’Aedes albopictus. L’on pourrait donc ainsi comprendre l’abondance de cette espèce de moustique à Ndogbati plus que dans d’autres sites.
17Les densités des espèces de moustiques étaient élevées au mois d’août dans les quartiers Ndogbati et Yansoki. Ce mois correspond dans la région du littoral-Cameroun à la saison des pluies. Les pluies offrent une large gamme de gîtes de ponte aux femelles de moustique comparativement à la saison sèche durant laquelle les gîtes sont plus ou moins asséchés. A Logbessou, le scénario n’est pas le même. Les densités étaient moins élevées au mois d’août. Ce résultat serait lié à la situation géographique de ce quartier qui est la seule localité de forte altitude de la ville. Dans ce contexte, de fortes précipitations entrainent le lessivage des gîtes de ponte de moustiques et par conséquent une baisse des densités agressives.
18Anopheles gambiae s.l. et Cx. quinquefasciatus étaient les espèces les plus agressives à l’homme dans les quartiers considérés. Le comportement trophique de ces espèces était semblable, piquant l’hôte préférentiellement à l’extérieur des habitations. Les observations similaires ont été réalisées antérieurement dans les régions de savanes d’Afrique de l’ouest (Hamon, 1963). La forte tendance exophagique de ces moustiques trouverait son explication sur des propriétés des moustiquaires imprégnées d’insecticides à longue durée d’action (MILDA) gratuitement distribuées sur l’ensemble du territoire camerounais et majoritairement utilisées par les foyers de la ville de Douala. Ces moustiquaires étaient imprégnées de l’alphacyperméthrine (200mg/m2), un insecticide de la famille des pyréthrinoïdes qui exerce une action exicto-répulsive sur ces moustiques en les contraignant d’adopter un comportement plutôt exophage (Carnevale et al., 2009). En revanche, les spécimens endophages dans les sites d’étude malgré l’utilisation des moustiquaires seraient probablement ceux ayant développé une résistance soit génétique, soit métabolique vis-à-vis de l’insecticide d’imprégnation.
19Les cycles horaires d’agressivité, tel que nous les avons observés dans les sites d’étude montraient une activité maximale des espèces An. gambiae s.l. et Cx. quinquefasciatus entre 24h et 4h. Cette tranche horaire correspond à la période de la nuit pendant laquelle l’homme est endormi. Ceci permet de penser que ces espèces de moustiques régulent leur activité agressive en fonction des habitudes de l’homme. Cette activité agressive demeure intense lorsque l’homme endormi est pratiquement inconscient et ne peut par conséquent pas se défendre contre les piqûres. Cette observation est conforme à celles faites dans la plupart des villes africaines et exige un bon entretien et un meilleur mode d’emploi des moustiquaires pendant les heures de sommeil si l’on veut être protégé contre les piqûres de moustiques (Dossou- Yovo et al., 1998 ; Akono et al., 2015). Cependant, cette observation tranche avec celle faite à Manoka, une petite île de la ville de Douala essentiellement piscicole.
20Le pic d’agressivité d’An. coluzzii, vecteur majeur de Plasmodium sp dans cette localité était situé à 4h du matin correspondant à l’heure pendant laquelle les pêcheurs sont de retour de la pêche (Mbida et al., 2016). De cet exemple, il ressort que les moustiques piquent et peuvent transmettre les parasites en dehors des heures de sommeil. Ce comportement des vecteurs a également été signalé dans nos sites d’étude.
5. Conclusion
21La présente recherche démontre qu’au regard des espèces de moustiques identifiées, les populations des sites d’études sont exposées de façon pérenne aux maladies telles que la malaria, les filarioses et les arboviroses. Le comportement trophique de ces moustiques préconise que l’usage de la moustiquaire imprégnée d’insecticide soit renforcé par des méthodes de protection complémentaires.
Bibliographie
Akono N.P. et al., 2015. Anopheles gambiae, major malaria vector in Logbessou, a peri-urban area of Douala (Cameroon). Bulletin de la Société Pathologique Exotique, 108, 360-368.
Akono N.P. et al., 2017. Transmission du paludisme et sensibilité aux insecticides de la faune culicidienne agressive (Deido, Douala, Cameroun). Médecine et Santé Tropicales, 27, 82-89.
Baldet T. 1995. Etude comparative de deux stratégies de lutte contre Culex quinquefasciatus Say, 1823 par Bacillus sphaericus Neide, 1904 dans la ville de Maroua (Nord-Cameroun). Thèse de Doctorat : Université de Montpellier (France).
BUCREP 2010. Troisième recensement général de la population et de l’habitat. Third general population and housing census Cameroun. Rapport de présentation des résultats définitifs République du Cameroun, 1-65.
Carnevale P. & Robert V. 2009. Les Anophèles – Biologie, Transmission du Plasmodium et Lutte Antivectorielle. Marseille : IRD éditions.
Dossou-yovo J. et al., 1998. Impact d’aménagement des rizières dans la ville de Bouaké, Côte- d’Ivoire. Bulletin de la Société Pathologique Exotique, 91, 327-333.
Etang J. et al., 2016. Anopheles coluzzii larval habitat and insecticide resistance in the island area of Manoka, Cameroon. Bmc Infectious Diseases, 16, 217.
Fontenille D. et al., 2003. Systématique et biologie des anophèles vecteurs de plasmodiums en Afrique, Données récentes, Médecine Tropicale, 63, 247-253.
Gillies M.T. & Coetzee M. 1987. A supplement to the Anophelinae of Africa south of the Sahara, Saimr, 55, 1-143.
Gillies M.T. & De Meillon B. 1968. The Anophelinae of Africa south of the Sahara. Saimr, 54, 1-343.
Hamon J. 1963. Les moustiques anthropophiles de la région de Bobo-Dioulasso (République de Haute-volta).Cycles d’agressivité et variations saisonnières, Annales de la Société Entomologique de France, 132, 85-144.
Hawley A. H. 1988. The biology of Aedes albopictus. Journal of American Mosquito Control Association, 4, 40 p.
Jupp P.G. 1996. Mosquitoes of Southern Africa: Culicinae and Toxorhynchitinae. Hartebeespoort : Ekogilde Publishers
Kudom A.A. 2015. Larval ecology of Anopheles coluzzii in Cape Coast, Ghana: water quality, nature of habitat and implication for larval control, Malaria Journal, 14, 447.
Mbida M.A. et al., 2016. Preliminary investigation on aggressive culicidae fauna and malaria transmission in two wetlands of the Wouri river estuary, Littoral-Cameroon, Journal of Entomology and Zoology Studies, 4,105-110.
Mouchet J. & Gariou J. 1961. Répartition géographique et écologique des anophèles au Cameroun, Bulletin de la Société Pathologique Exotique, 54, 102-118.
Tene F.B. et al., 2015. Habitat segregation and ecological character displacement in cryptic African malaria mosquitoes. Evolutionary Applications, 8, 326-345.
Weather base 2012. Historical Weather for Douala, Cameroun. Retrieved. https://www.weatherbase.com/weather/weather.php3?s=1946&cityname=Douala%2C+Littoral%2C+Cameroon
WMO (World Meteorological Organization) 2012. World weather information service - Douala. WorldMeteorological Organization, Douala, Cameroon.