- Accueil
- Volume 76 (2023)
- Caractérisation des gîtes larvaires de moustiques en saison des pluies à l’intérieur et autour du périmètre universitaire de Korhogo (Côte d’Ivoire)
Visualisation(s): 4817 (6 ULiège)
Téléchargement(s): 186 (0 ULiège)
Caractérisation des gîtes larvaires de moustiques en saison des pluies à l’intérieur et autour du périmètre universitaire de Korhogo (Côte d’Ivoire)

Document(s) associé(s)
Version PDF originaleAbstract
The control of the pathogenic agent vectors necessarily involves knowing their breeding sites. This study aimed to identify the breeding sites of mosquitoes inside and around the University of Korhogo (Ivory Coast). The methodological approach consisted to carry out larval surveys for three months (July, August, September) covering the rainy season. A total of 83 larval breeding sites were identified inside the university and 165 larval breeding sites in the peripheral areas. Inside, only puddles of water and cement mixers were identified as larval breeding sites of mosquitoes, puddles of water being the most productive. On the contrary, around the university, a multiplicity of larval breeding sites (bowls, tires, cans, buckets, cans, flowerpots, canaries, kettles and puddles) was identified. Puddles of water were the most encountered lodgings. On the other hand, tires and canaries were the most productive larval breeding sites respectively. All the collected larvae during the study period, belong to three genera of mosquitoes Aedes (Meigen, 1818), Culex (Linnaeus, 1758) and Anopheles (Meigen, 1818). Aedes was the most abundant in number of individuals. Inside the university, five species Aedes aegypti (Linnaeus, 1762), Culex quinquefasciatus (Say, 1823), Culex nebulosus (Theobald, 1901), Culex tigripes (de Grandpré & d'Emmerez de Charmoy, 1900) and Anopheles gambiae s.l. (Giles 1902) were identified. In the peripheral areas of university, eight species Aedes aegypti, Culex quinquefasciatus, Culex nebulosus, Culex tigripes, Culex decens (Theobald, 1901), Culex Cinereus (Theobald, 1901), Anopheles gambiae s.l. and Anopheles funestus (Giles, 1900) were identified. The findings are very relevant because they could be used in vector-borne disease control strategies in the event of an epidemic.
Table des matières
Reçu le 25 novembre 2022, accepté le 25 juillet 2023.
Cet article est distribué suivant les termes et les conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
La lutte contre les vecteurs d’agents pathogènes passe nécessairement par la connaissance de leurs lieux de reproduction. L’objectif de cette étude était d’identifier les gîtes larvaires de moustiques dans l’espace universitaire de Korhogo (Côte d’Ivoire). L’approche méthodologique a consisté à faire des prospections larvaires pendant trois mois (juillet, août, septembre) au cours de la saison des pluies. Au total, 83 gîtes larvaires ont été identifiés à l’intérieur et 165 gîtes dans les zones périphériques de l’université. A l’intérieur, seules les flaques d’eau et les bétonneuses ont été identifiées comme gîtes larvaires de moustiques, les flaques d’eau étant les plus productives. Par contre, dans les zones périphériques, une multiplicité de gîtes larvaires (cuvettes, pneus, boîtes de conserves, seaux, bidons, pots de fleurs, canaris, bouilloires et flaques d’eau) a été identifiée. Les gîtes les plus nombreux sont les flaques d’eau et les plus productives sont respectivement les pneus et les canaris. Toutes les larves prélevées au cours de l’étude appartiennent à trois genres Aedes (Meigen, 1818), Culex (Linnaeus, 1758) et Anopheles (Meigen, 1818)). Le genre Aedes est le plus abondant en nombre d’individus. A l’intérieur de l’université, cinq espèces Aedes aegypti (Linnaeus, 1762), Culex quinquefasciatus (Say, 1823), Culex nebulosus (Theobald, 1901), Culex tigripes (de Grandpré & d'Emmerez de Charmoy, 1900) et Anopheles gambiae s.l. (Giles 1902) ont été identifiées. Dans les zones périphériques de l’université, huit espèces Aedes aegypti, Culex quinquefasciatus, Culex nebulosus, Culex tigripes, Culex decens (Theobald, 1901), Culex Cinereus (Theobald, 1901), Anopheles gambiae s.l. et Anopheles funestus (Giles, 1900) ont été identifiées. Les résultats obtenus sont assez pertinents parce qu’ils peuvent être utilisés dans les stratégies de lutte contre les maladies à transmission vectorielle en cas d’épidémie.
1
INTRODUCTION
2Plus de 85% des espèces animales appartiennent à l’embranchement des arthropodes qui comprend plus de 1,3 million d’espèces d’insectes décrites (Peter, 2012). Parmi ces insectes, plusieurs rendent d’énormes services à l’Homme et à l’environnement. D’autres, par contre, représentent des risques potentiels pour l’Homme en raison des agents pathogènes de maladies qu’ils véhiculent. C’est le cas des moustiques qui sont responsables de nombreuses maladies. Ces dernières représentent 17% des maladies infectieuses et causent plus de 700 000 décès par an (OMS, 2020). Quoique présentes dans toutes les régions du monde, ces maladies concernent particulièrement les zones tropicales qui demeurent les plus durement touchées. Actuellement, les moustiques évoluent dans des systèmes écologiques naturels mais également dans des systèmes modifiés par l’Homme (Makanga, 2016). Dans de nombreuses régions du monde, ils créent, par leurs piqûres, une nuisance considérable et peuvent transmettre à l’Homme divers agents infectieux dont un bon nombre peut se révéler pathogènes. Dans le cas de la dengue et la chikungunya, l’agent pathogène transmis par un moustique du genre Aedes est un arbovirus du groupe des flavivirus. Pour le paludisme, l’agent pathogène est transmis par la femelle d’un moustique du genre Anopheles. C’est l’une des maladies les plus répandues au monde et particulièrement en Afrique. En 2021, le nombre de cas de paludisme dans le monde était de 247 millions causant environ 619 000 décès (OMS, 2022). En plus, la décennie de 2010 à 2020 a été marquée par l’émergence de nombreuses épidémies d’arboviroses : zika, dengue, chikungunya. Ces épidémies, si elles semblent parfois maitrisées, attirent tout de même l’attention des scientifiques sur les risques potentiels pour la santé des populations et sur l’importance de s’en prémunir (Bechini, 2017). Dès lors, elles sont devenues une préoccupation majeure de santé mondiale, d’autant plus qu’elles entraînent des pertes économiques considérables dans plusieurs pays. Bien que la majorité des maladies à transmission vectorielle se produisent dans des régions endémiques tropicales et subtropicales, les voyages internationaux ainsi que l’urbanisation et la mondialisation en plein essor ont augmenté leur prévalence dans de nouveaux territoires jusqu’à présents indemnes. Outre la transmission de maladies, les moustiques peuvent être à l’origine de nuisances et perturber les activités de plein air. Les piqûres peuvent également entraîner des infections secondaires telles que démangeaisons, irritations et réactions allergiques (Pingen et al., 2017). Pour limiter les risques d’infection, le moyen le plus efficace reste la prophylaxie d’exposition aux piqûres de moustiques. Celle-ci consiste à réduire le nombre de moustiques dans l’environnement immédiat par la lutte antivectorielle et par la protection individuelle avec l’utilisation des moustiquaires imprégnées d’insectes à longue durée d’action (MIILDA). La lutte antivectorielle repose sur des méthodes physiques (élimination des gîtes larvaires), biologiques (utilisation de prédateurs de vecteurs), génétiques (réduction du potentiel reproducteur des vecteurs) et biocides (emploi d’insecticides et de répulsifs) (Bawin et al., 2015). Cependant, dans le contexte de démoustication, l’approche la plus efficace demeure celle basée sur l’élimination ou la réduction des gîtes larvaires de moustiques (Djogbenou, 2009). C’est dans ce cadre que l’étude se propose d’inventorier les gîtes potentiels de moustiques au sein de l’université Peleforo Gon Coulibaly de Korhogo (Côte d’Ivoire). En effet, cette institution abrite une forte communauté humaine (Enseignants-Chercheurs, personnel administratif et technique, étudiants…) qui constitue un foyer à risque de maladies à transmission vectorielle. En plus, cette densité humaine favorise la multiplication des gîtes larvaires de moustiques à travers des modes de gestion variés de l’environnement. La connaissance de la bio-écologie des larves de moustiques permettrait de contribuer à la lutte contre ces vecteurs. L’objectif de cette étude est de connaitre les gîtes larvaires de moustiques dans l’espace universitaire de Korhogo afin de les intégrer dans une matrice plus large de lutte antivectorielle.
MATERIEL ET MÉTHODES
Site d’étude
3Cette étude a été réalisée dans la ville de Korhogo, au Nord de la Côte d’Ivoire. Cette zone appartient au climat de type soudano-guinéen caractérisé par deux grandes saisons. Une saison sèche, qui s’étend généralement d’octobre à mai, précède la saison des pluies (juin-septembre) marquée par deux pics pluviométriques dont l'un en juin et l'autre en septembre. La pluviométrie varie entre 1200 mm et 1400 mm. La végétation est celle de la savane arborée caractérisée par des arbustes et des arbres tels que le Karité (Vitellaria paradoxa C.F.Gaertn., 1807), le Néré (Parkia biglobosa (Jacq.) R.Br. ex G.Don, 1830) et l’Anacardier (Anacardium occidentale L. 1753). Les données ont été collectées pendant trois mois à l’intérieur et dans les zones périphériques de l’université Peleforo Gon Coulibaly (Fig. 1). Le choix de l’université a été motivé par le fait qu’elle abrite une forte communauté humaine composée d’enseignants-chercheurs, de chercheurs, du personnel administratif et technique et d’étudiants. Elle abrite également, dans ses périphéries, des habitations humaines avec l’ensemble des activités qui s’y déroulent. Toutes les activités quotidiennes à l’intérieur et dans les zones périphériques de l’université sont susceptibles de créer des gîtes favorables à la reproduction des moustiques, exposant les occupants à des risques de maladies à transmission vectorielle telles que le paludisme et la fièvre jaune.
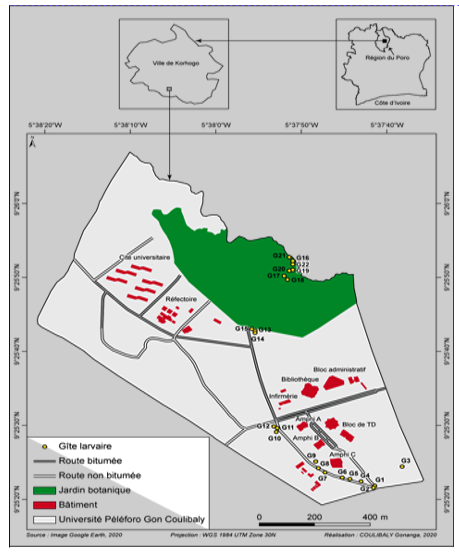
Figure 1a : Localisation des gites larvaires à l’intérieur
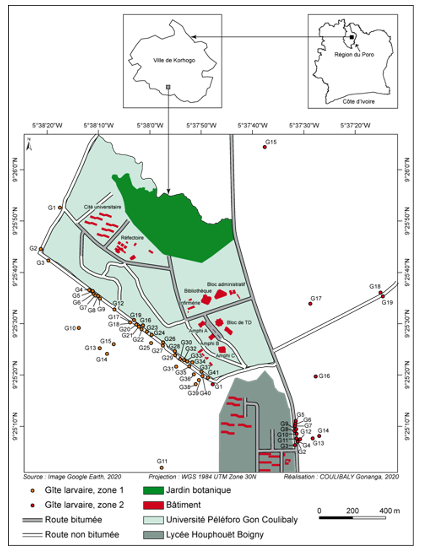
Figure 1b : Localisation des gites larvaires autour de l’université
Prospection larvaire
4La prospection larvaire s’est déroulée pendant la saison des pluies en juillet, août et septembre de l’année 2022. Elle a consisté à rechercher et identifier, une fois par mois, tous les gîtes larvaires potentiels de moustiques puis à effectuer des prélèvements de larves dans les gîtes positifs (Tia et al., 2016). Les gîtes naturels ont été distingués des gîtes artificiels ainsi que les gîtes positifs des gîtes négatifs. En effet, tout gîte contenant au moins une larve était considéré « positif », et, le cas échéant, était considéré « négatif ». Ainsi, à chaque séance, les collections d’eau susceptibles d’héberger des stades pré-imaginaux de moustiques ont été prospectées (Coffinet et al., 2009). Les larves et les nymphes ont été prélevées par la méthode de ‘‘Dipping’’ (Coffinet et al., 2009 ; Talipouo et al., 2017). A l’aide d’une louche à manche, l’eau du gîte était prélevée et le contenu était reversé dans un bocal. Lorsque le volume d’eau du gîte était faible (cas des sténo-gîtes), tout le contenu était alors prélevé et renversé dans un bocal. Le contenu du bocal était filtré au moyen d’une passoire et rincé avec de l’eau distillée. Les larves étaient comptées et classées par genre afin d’éviter la prédation. En effet, les larves de Culex tigripes et celles des moustiques du genre Toxorhynches s’attaquent aux autres larves dont celles d’Aedes et Anopheles.
Élevage des larves et identification des moustiques
5Les larves et nymphes prélevées ont été mises en élevage jusqu’à l’obtention des moustiques adultes (Koné et al., 2013; Tia et al., 2016). Elles ont été identifiées morphologiquement sous une loupe binoculaire (Akono et al., 2017) et à l’aide de la clé de détermination de Baldacchino et Paupy (2010) et du logiciel de détermination des Culicidae de l’ORSTOM.
Analyse des données
6Les données ont été analysées à l’aide des logiciels Statistica (Version 7.1) et Past (Version 1.0). La distribution normale des données a été vérifiée en utilisant le test de normalité de Shapiro-Wilk. L’analyse des variances a servi à comparer les abondances des larves. Le test de Newman-Keuls, au seuil de 5 %, a été utilisé pour comparer et classer les abondances. L’Analyse en Composante Principale a permis de caractériser les gîtes larvaires. Le Modèle Linéaire Généralisé a été utilisé pour tester les effets site et types de gîtes sur la distribution des larves.
RÉSULTATS
Caractérisation des gîtes larvaires
A l’intérieur de l’université
7Au total, 83 gîtes larvaires ont été identifiés à l’intérieur de l’université. 82 gîtes soit 98,80% sont des gîtes artificiels. Parmi ces gîtes 25,30% sont permanents et 74,70% sont temporaires. Les flaques d’eau (95,66%) et les bétonneuses (4,34%) constituent la majorité de ces gîtes (Figure 2). Par ailleurs, 22 gîtes (26,50%) seulement sont positifs et les flaques d’eau sont les plus productives avec 25,60% des larves prélevées. Le taux de positivité des gîtes est élevé au mois d’août (52,3%) par rapport aux mois de juillet et septembre qui enregistrent respectivement des taux de positivité plus faibles de 21,68 % et 19,27%.

Figure 2a : Gites larvaires-flaque d’eau

Figure 2b : Gites larvaires-bétonneuse
Dans les zones périphériques de l’université
8Au total, 165 gîtes larvaires ont été identifiés dans les zones périphériques de l’université. Les gîtes recensés sont composés de cuvettes, de pneus, de boîtes de conserve, de seaux, de bidons, de pots de fleurs, de canaris d’eau, de bouilloires et de flaques d’eau (Figure 3). Les 66 flaques d’eau (40%) sont les gîtes les plus rencontrés. Ensuite, les gîtes moyennement représentés sont les 25 seaux (15,15%), les 21 bidons (12,72%) et les 15 pneus (9,09%). Enfin, les autres gîtes comme les pots de fleurs, les canaris d’eau, les bouilloires, les boîtes de conserves et les cuvettes sont faiblement représentés. Sur l’ensemble des gîtes recensés, 60 (36,37%) seulement sont positifs. Le taux de positivité des gîtes est élevé dans les bouilloires (60%), les pneus (57,14%), les canaris d’eau (57,14%), les boites de conserve (44,44%), les cuvettes (37,50%), les bidons (13,13%) et les pots de fleurs (22,22%). Par ailleurs, les pneus et les canaris d’eau sont plus productifs avec respectivement 32,1% et 28,4% des larves prélevées. Le taux de positivité des gîtes est élevé au mois d’août (18,18%) par rapport aux mois de juillet et septembre qui enregistrent respectivement des taux de positivité de plus faibles (8,48% et 9,69%).

Diversité des larves de moustiques
Richesse taxonomique
A l’intérieur de l’université
9Au total, cinq espèces de moustiques Aedes aegypti (Linnaeus, 1762), Culex quinquefasciatus (Say, 1823), Culex nebulosus (Theobald, 1901), Culex tigripes (de Grandpré & d'Emmerez de Charmoy, 1900) et Anopheles gambiae s.l. (Giles 1902) ont été identifiées à l’intérieur de l’université. Ces espèces appartiennent à trois genres : Aedes (Meigen, 1818), Culex (Linnaeus, 1758) et Anopheles (Meigen, 1818). Le genre Culex comprenant trois espèces était plus riche en espèces de moustiques par rapport aux genres Anopheles (une espèce) et Aedes (une espèce).
Dans les zones périphériques de l’université
10Les moustiques identifiés dans les zones périphériques de l’université comprennent huit espèces : Aedes aegypti, Culex quinquefasciatus, Culex nebulosus, Culex tigripes, Culex decens (Theobald, 1901), Culex Cinereus (Theobald, 1901), Anopheles gambiae s.l. et Anopheles funestus (Giles, 1900). Elles appartiennent à trois genres (Aedes, Culex et Anopheles). Le genre Culex comprenant cinq espèces était également plus riche en espèces de moustiques par rapport aux genres Anopheles (deux espèces) et Aedes (une espèce).
Abondance des larves de moustiques
A l’intérieur de l’université
11Au total, 4149 larves de moustiques ont été collectées à l’intérieur de l’université. Le genre Aedes 2212 (53,31%) est le plus abondant suivi des genres Culex 1505 (36,27%) et Anopheles 432 (10,41%) (Fig. 4). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques (Aedes GLM : ddl = 1 ; f = 37,26 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 18,19 ; p < 0,05 et Anopheles GLM : ddl = 1 ; f = 5,99 ; p < 0,05).
12Les flaques d’eau (3336 larves) contiennent le plus grand nombre de larves. Celles-ci, représentent 80,40% des larves collectées. Elles se composent des larves d’Aedes (1710 larves), de Culex (1300 larves) et d’Anopheles (326 larves). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques dans les flaques d’eau (Aedes GLM : ddl = 1 ; f = 34,51 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 16,31 ; p < 0,05 et Anopheles GLM : ddl = 1 ; f = 3,94 ; p < 0,05). Au niveau spécifique, Aedes aegypti (1710 larves) est l’espèce la plus abondante. C’est la seule espèce du genre Aedes collectée dans les flaques d’eau. Elle est suivie respectivement, de Culex quinquefasciatus (858 larves), d’Anopheles gambiae s.l. (326 larves), de Culex nebulosus (247 larves) et de Culex tigripes (195 larves). L’analyse des variances ne révèle aucune différence significative entre l’abondance moyenne des larves de Aedes aegypti et de Culex quinquefasciatus (Aedes aegypti GLM : ddl = 1 ; f = 14,33 ; p > 0,05 ; Culex quinquefasciatus GLM : ddl = 1 ; f = 10,89 ; p > 0,05). Cependant, il existe une différence significative entre l’abondance moyenne de ces deux espèces et celle des autres espèces de moustiques (Anopheles gambiae s.l. GLM : ddl = 1 ; f = 9,45 ; p < 0,05) ; Culex nebulosus GLM : ddl = 1 ; f = 4,11 ; p < 0,05 ; Culex tigripes GLM : ddl = 1 ; f = 2,38 ; p < 0,05).
13Concernant les bétonneuses, elles contiennent 813 larves de moustiques, soit 19,60% des larves collectées à l’intérieur de l’université. Elles se composent de 502 larves d’Aedes, 205 larves de Culex et 106 larves d’Anopheles. L’analyse des variances révèle également une différence significative entre l’abondance moyenne des larves des différents genres de moustiques dans les bétonneuses (Aedes GLM : ddl = 1 ; f = 27,81 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 11,23 ; p < 0,05 et Anopheles GLM : ddl = 1 ; f = 4,75 ; p < 0,05). Au niveau spécifique, Aedes aegypti (502 spécimens) est la seule espèce du genre Aedes et la plus abondante dans les bétonneuses. Elle est suivie respectueusement, de Culex quinquefasciatus (135 larves), d’Anopheles gambiae s.l. (106 larves), de Culex nebulosus (39 larves) et de Culex tigripes (31 larves). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves de Aedes aegypti et celle des autres espèces de moustiques (Aedes aegypti GLM : ddl = 1 ; f = 18,47 ; p < 0,05 ; Culex quinquefasciatus GLM : ddl = 1 ; f = 8,22 ; p < 0,05) ; Anopheles gambiae s.l. GLM : ddl = 1 ; f = 3,16 ; p < 0,05; Culex nebulosus GLM : ddl = 1 ; f = 2,57 ; p < 0,05; Culex tigripes GLM : ddl = 1 ; f = 1,13 ; p < 0,05).
Dans les zones périphériques de l’université
14Au total, 11.420 larves de moustiques ont été collectées dans les zones périphériques de l’université. Le genre Aedes 8061 (70%) est le plus abondant suivi des genres Culex 2376 (21%) et Anopheles 983 (9 %) (Fig. 4). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques (Aedes GLM : ddl = 1 ; f = 56,22 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 21,22 ; p < 0,05 et Anopheles GLM : ddl = 1 ; f = 2,04 ; p < 0,05).
15Les flaques d’eau (3232 larves) contiennent le plus grand nombre de larves de moustiques. Celles-ci représentent 28,30% des larves collectées. Elles se composent des larves d’Aedes (1930 larves), de Culex (721 larves) et d’Anopheles (581 larves). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques (Aedes GLM : ddl = 1 ; f = 39,22 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 17,41 ; p < 0,05 et Anopheles GLM : ddl = 1 ; f = 6,82 ; p < 0,05). Au niveau spécifique, Aedes aegypti (1930 larves) est l’espèce la plus abondante dans les flaques d’eau. Elle est suivie respectivement, d’Anopheles gambiae s.l. (502 larves), de Culex quinquefasciatus (450 larves), de Culex nebulosus (193 larves), d’Anopheles funestus (76 larves), de Culex cinereus (67 larves), de Culex decens (8 larves) et de Culex tigripes (3 larves). L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves de Aedes aegypti et celle des larves des autres espèces de moustiques (Aedes aegypti GLM : ddl = 1 ; f = 27,33 ; p < 0,05).
16Les pneus (2269 larves) et les seaux (2028 larves) occupent le deuxième palier des gîtes les plus abondants après les flaques d’eau. Elles se composent des larves d’Aedes (pneus : 1518 larves ; seaux : 1338 larves), de Culex (pneus : 623 larves ; seaux : 540 larves) et d’Anopheles (pneus : 128 larves ; seaux : 150 larves). Dans les pneus comme dans les seaux, l’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques (pneus : Aedes GLM : ddl = 1 ; f = 27,33 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 16,89 ; p < 0,05, Anopheles GLM : ddl = 1 ; f = 27,33 ; p < 0,05 et seaux : Aedes GLM : ddl = 1 ; f = 27,33 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 16,89 ; p < 0,05, Anopheles GLM : ddl = 1 ; f = 27,33 ; p < 0,05). Au niveau spécifique, Aedes aegypti (pneus : 1518 larves ; seaux : 1338 larves) est l’espèce la plus abondante dans les pneus et les seaux. Dans les pneus, elle est suivie respectivement, de Culex quinquefasciatus (423 larves), de Culex nebulosus (145 larves), d’Anopheles gambiae s.l. (77 larves), d’Anopheles funestus (51 larves), de Culex cinereus (45 larves), de Culex decens (7 larves) et de Culex tigripes (3 larves). Dans les seaux, elle est suivie respectivement, de Culex quinquefasciatus (387 larves), de Culex nebulosus (112 larves), d’Anopheles gambiae s.l. (110 larves), d’Anopheles funestus (40 larves), de Culex cinereus (32 larves), de Culex decens (7 larves) et de Culex tigripes (2 larves). Dans les deux types de gîtes, l’analyse des variances révèle une différence significative entre l’abondance moyenne des larves de Aedes aegypti et celle des larves des autres espèces de moustiques (pneus : Aedes aegypti GLM : ddl = 1 ; f = 31,23 ; p < 0,05 ; seaux : Aedes aegypti GLM : ddl = 1 ; f = 29,42 ; p < 0,05).
17Les cuvettes (813 larves), les bidons (774 larves), les boîtes de conserve (696 larves), les pots de fleurs (207 larves) et les bouilloires (206 larves) occupent le troisième palier des gîtes les plus abondants. Elles se composent des larves d’Aedes (cuvette : 685 larves ; bidons : 643 larves ; boîtes de conserve 644 larves ; pots de fleurs 162 larves ; bouilloires 143 larves), de Culex (cuvette : 94 larves ; bidons : 108 larves ; boîtes de conserve 44 larves ; pots de fleurs 38 larves ; bouilloires 55 larves) et d’Anopheles (cuvette : 34 larves ; bidons : 23 larves ; boîtes de conserve 8 larves ; pots de fleurs 7 larves ; bouilloires 8 larves). Dans tous ces gîtes, l’analyse des variances révèle une différence significative entre l’abondance moyenne des larves des différents genres de moustiques (cuvettes : Aedes GLM : ddl = 1 ; f = 21,25 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 14,52 ; p < 0,05) ; Anopheles GLM : ddl = 1 ; f = 11,71 ; p < 0,05), bidons : Aedes GLM : ddl = 1 ; f = 16,08 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 12,33 ; p < 0,05) ; Anopheles GLM : ddl = 1 ; f = 9,66 ; p < 0,05), boîtes de conserve : Aedes GLM : ddl = 1 ; f = 17,75 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 14,11 ; p < 0,05) ; Anopheles GLM : ddl = 1 ; f = 10,09 ; p < 0,05), pots de fleurs : Aedes GLM : ddl = 1 ; f = 13,33 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 11,41 ; p < 0,05) ; Anopheles GLM : ddl = 1 ; f = 8,92 ; p < 0,05), bouilloires : Aedes GLM : ddl = 1 ; f = 12,20 ; p < 0,05 ; Culex GLM : ddl = 1 ; f = 10,27 ; p < 0,05) ; Anopheles GLM : ddl = 1 ; f = 8,88 ; p < 0,05). Au niveau spécifique, Aedes aegypti (cuvettes : 685 larves ; bidons : 643 larves ; boîtes de conserve : 644 larves ; pots de fleurs : 162 larves ; bouilloires : 143 larves) est l’espèce la plus abondante. L’analyse des variances révèle une différence significative entre l’abondance moyenne des larves de Aedes aegypti et celle des larves des autres espèces de moustiques dans chacun des gîtes recensés (p < 0,05)(Figures 4).
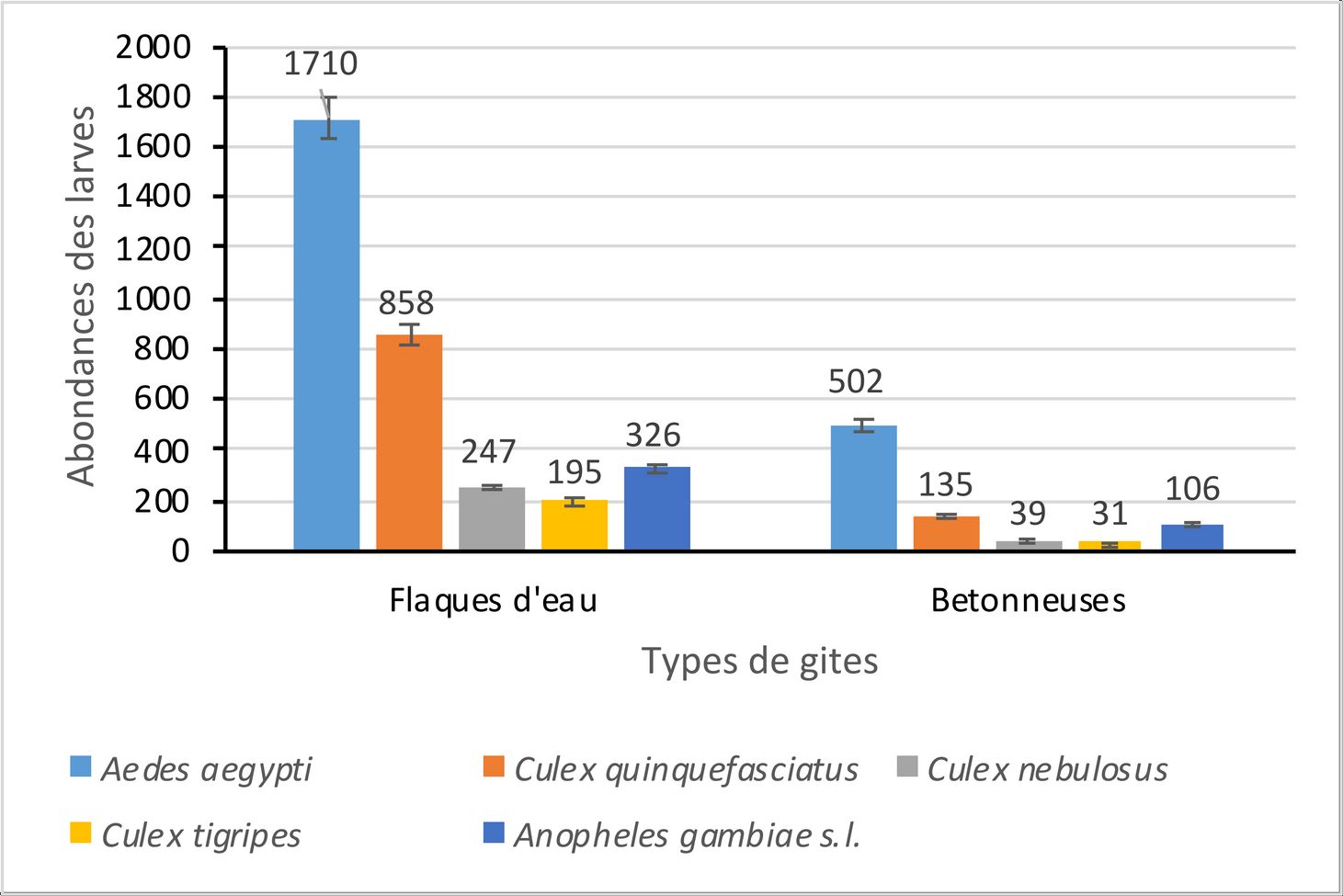
Figure 4a : Variation de l’abondance relative des larves de moustiques à l’intérieur
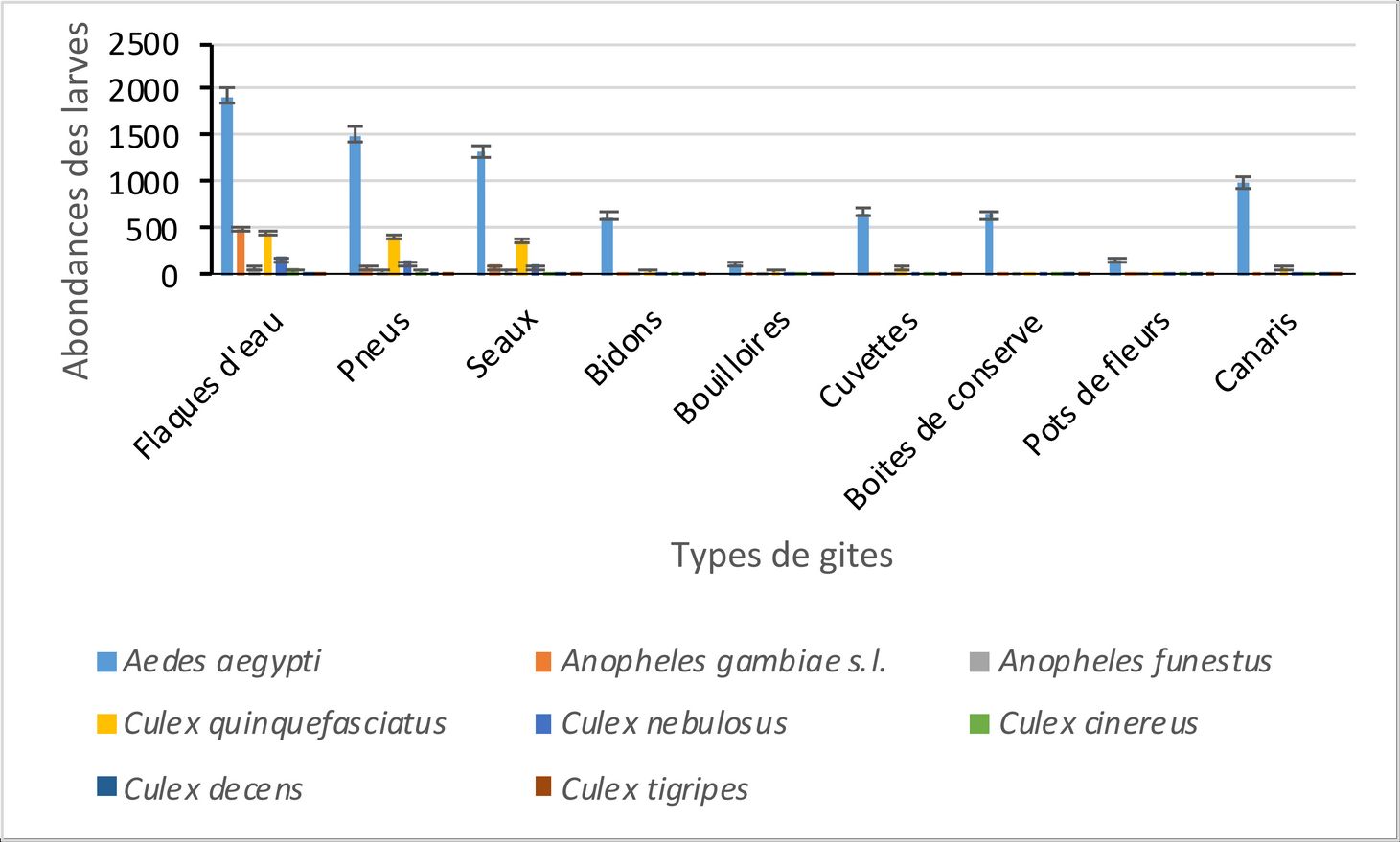
Figure 4b : Variation de l’abondance relative des larves de moustiques dans les zones périphériques de l’université
Distribution des larves de moustiques en fonction des gîtes
A l’intérieur de l’université
18L’étude de la distribution spatiale des larves de moustiques réalisée à partir de l’Analyse en Composante Principale permet de distinguer deux grands groupes (Figures 5). Dans le premier groupe, les espèces Anopheles gambiae s.l. et Aedes aegypti sont associées à la bétonneuse alors que les autres espèces de larves sont reliées aux flaques d’eau. Le Modèle Linéaire Généralisé révèle que le type de gîtes influence la distribution des espèces de larves de moustiques (GLM : ddl = 1, W = 65.95 ; p = 0,01).
Dans les zones périphériques de l’université
19L’étude de la distribution spatiale des larves de moustiques, réalisée à partir de l’Analyse en Composante Principale, permet de distinguer deux grands groupes (Figures 5). En effet, au-dessus de l’axe 1, Culex tigripes, Culex decens, Aedes aegypti et Anopheles funestus sont associées aux gîtes comprenant les bouilloires, les boîtes de conserve et les pots de fleurs. Les autres espèces de moustiques (Culex cinereus, Culex quinquefasciatus, Anopheles gambiae s.l. et Culex nebulosus) ont pour gîtes larvaires, les canaris d’eau, les bidons, les seaux, les flaques d’eau et les cuvettes. Le Modèle Linéaire Généralisé confirme ces observations. Il indique que le type de gîtes influence la distribution des espèces de moustiques (GLM : ddl = 8 ; F = 2,63 ; p = 0,015).
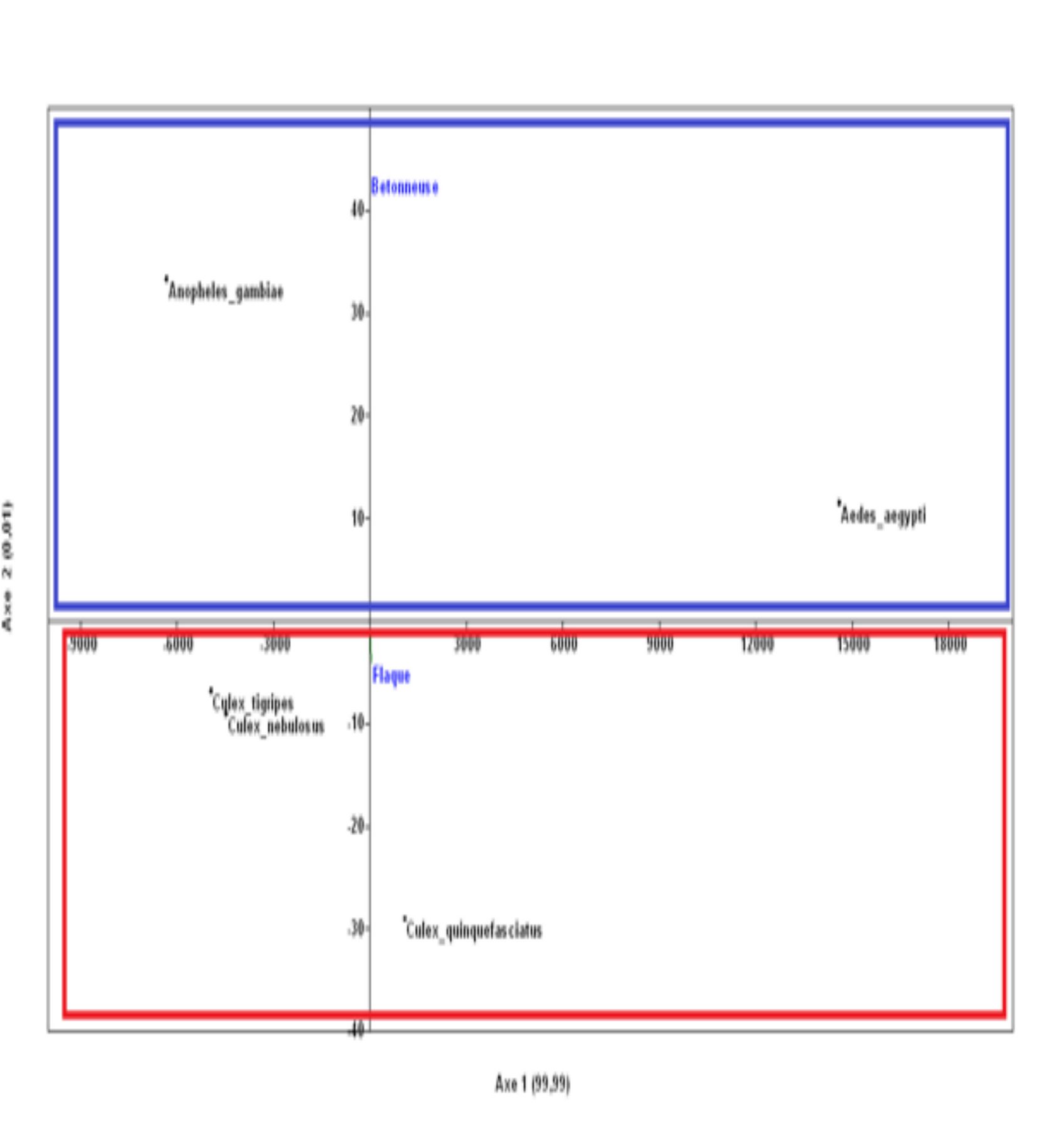
Figure 5a : Distribution des larves de moustiques en fonction des types de gîtes à l’intérieur
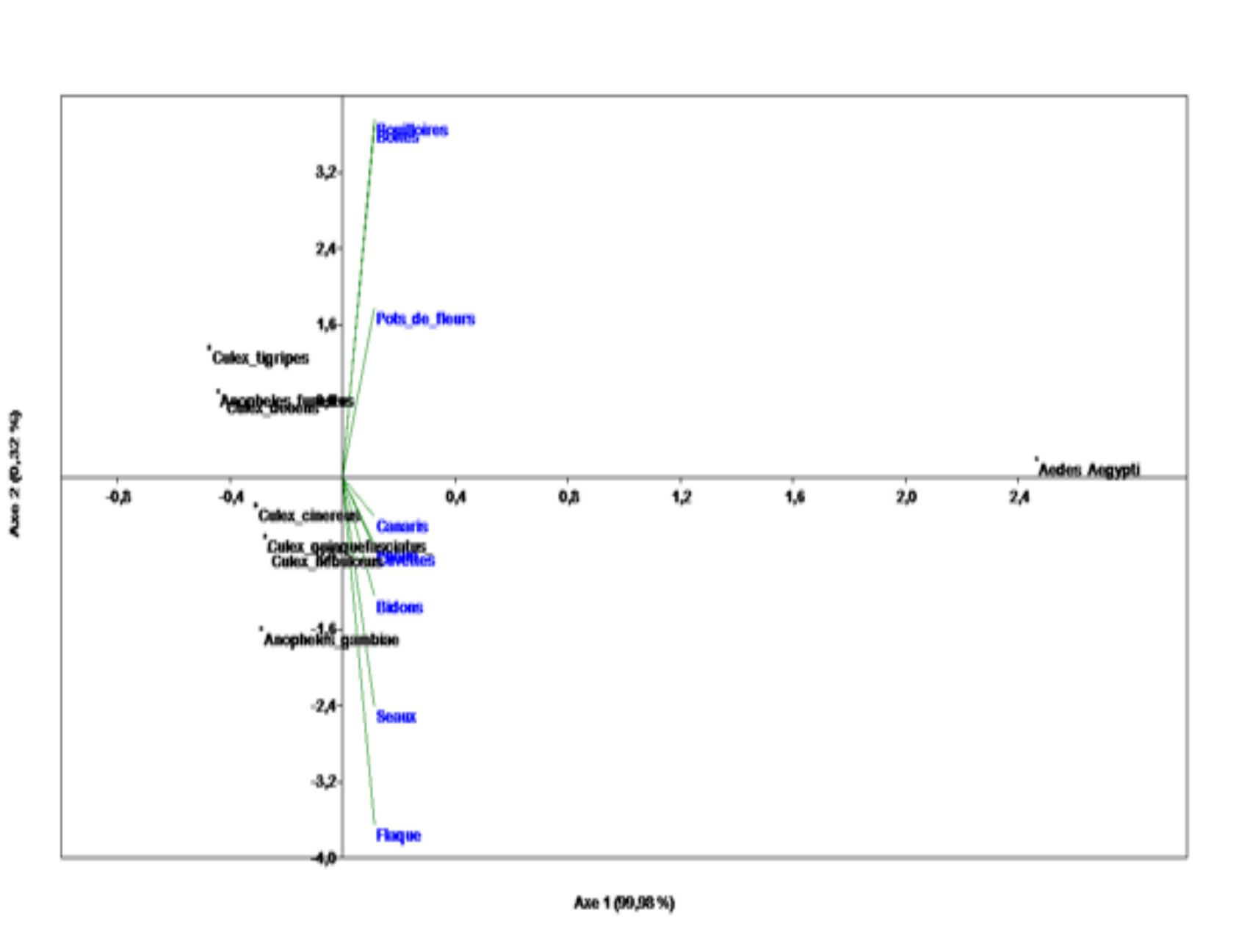
Figure 5b : Distribution des larves de moustiques dans les zones périphériques de l’université
DISCUSSION
20Notre étude révèle que les gîtes larvaires présents en milieu universitaire et dans les zones périphériques sont en majorité des gîtes artificiels. La grande partie de ces gîtes larvaires a été créée par l’homme du fait de ses activités. En effet, l’Homme, par la modification de son environnement et son mode de vie, favorise la formation et la multiplication des gîtes larvaires (Grard et al., 2014 ; Sy et al., 2016; Tia et al., 2016). Ces gîtes sont propices au développement des moustiques notamment les genres Culex, Aedes et Anopheles responsables de nombreuses pathologies dont le paludisme, la fièvre jaune, les filarioses, la dengue, le virus zika (Rodhain, 2015). Ces résultats sont similaires à ceux de Tia et al. (2016) qui ont montré la responsabilité des habitants dans la mise en place des conditions propices au développement et au maintien des moustiques via la création de leurs habitats larvaires.
21Les flaques d’eau sont les gîtes les plus rencontrés à l’intérieur et dans les zones périphériques de l’université du fait de la période de l’échantillonnage qui se situe en saison des pluies. En effet, la fréquence des pluies occasionne de nombreux points d’eau temporaires qui disparaissent progressivement pendant la saison sèche. Ces points d’eau sont considérés comme des gîtes potentiels de moustiques parce qu’ils sont susceptibles d’abriter des larves.
22A l’intérieur comme à l’extérieur du périmètre universitaire, le pourcentage de gîtes positifs est relativement faible. En effet, pendant la saison des pluies, les gîtes sont lessivés par la fréquence des précipitations entrainant ainsi une baisse drastique, voire une rareté, de larves.
23Deux sous-familles de moustiques (Anophelinae et Culicinae) ont été identifiées au cours de l’étude avec une prédominance des larves de Culicinae. Cette abondance des individus de Culicinae pourrait s’expliquer par la nature des gîtes larvaires et par la capacité de résilience des larves de Culicinae. Ces observations sont similaires à celles faites par Korba et al. (2016) en Algérie qui ont montré que les espèces de moustiques appartenant aux Culicinae présentent des fortes capacités d’adaptation leur permettant de se développer dans plusieurs types d’habitats.
24Ainsi l’abondance des larves du genre Aedes pourrait s’expliquer par le fait que la majorité des gîtes larvaires identifiés (pneus, canaris, pots de fleurs, boîtes de conserve, bétonneuses…) sont des gîtes traditionnellement connus pour abriter les larves de ce moustique. A l’intérieur de l’université, les larves issues des bétonneuses appartiennent essentiellement au genre Aedes. Dans les zones périphériques de l’université, si de nombreux gîtes ont été inventoriés, les canaris et surtout les pneus restent tout de même les plus productifs. Dans une étude similaire réalisée sur les gîtes larvaires de moustiques à Abidjan, Koné et al. (2013) ont montré que les pneus constituent les gîtes les plus favorables à la pullulation d'Aedes Aegypti.
25Par contre, l’abondance élevée des larves de Culex serait due à leur capacité de résilience et d’adaptation aux différents habitats du fait de leur plasticité (Saotoing et al., 2014 ; Korba et al., 2016). Des résultats identiques ont été obtenus par Saotoing et al. (2011) qui ont relevé que les stades immatures du genre Culex ont une grande élasticité écologique et sont capables de coloniser différents milieux.
26Quant à la faible quantité des larves du genre Anopheles, elle semble être est liée à leur bio écologie et au fait que les gîtes larvaires identifiés dans la zone d’étude ne présentent pas toutes les conditions requises pour leur développement. Selon les travaux conduits par Betsi et al. (2012) et Sy et al. (2016), les femelles d’Anopheles gambiae s.l. préfèrent pondre leurs œufs dans les collections d’eau ensoleillées et dépourvues de végétation.
CONCLUSION
27Cette étude révèle que les moustiques peuvent se reproduire et se développer dans tous les types de points d’eau considérés comme gîtes larvaires. Cependant, les gîtes artificiels sont plus nombreux, mettant à mal la responsabilité de l’Homme dans la gestion de son environnement. Les larves prélevées dans les différents gîtes appartiennent essentiellement à trois genres de moustiques (Aedes, Culex et Anopheles) qui sont responsables des maladies à transmission vectorielle les plus redoutables telles que le paludisme et la fièvre jaune. L’assainissement de nos milieux de vie pourrait contribuer à réduire la densité des moustiques dans nos lieux d’habitation.
Contribution des auteurs et conflit d’intérêt :
DC et MLY ont conceptualisé l’étude. EGA et EPVO ont collecté les données sur le terrain et procédé à leur analyse. DC a écrit et produit le premier draft. MK et YT ont participé à la correction du manuscrit en apportant leurs observations. Tous les auteurs ont contribué à la version finale du manuscrit. Les auteurs déclarent qu’il n’existe aucun conflit d’intérêts lié à la présente étude.
28
Bibliographie
Akono N.P., Mbouangoro A., Mbida-Mbida A., Ndo C., Peka-Nsangou M.F., Kekeunou S. 2017. Le complexe d’espèces Anopheles gambiae et le gène de résistance Kdr en périphérie de Douala, Cameroun. Bulletin de la Société de Pathologie Exotique, 110 : 122-129.
Baldacchino F., Paupy C. 2010. Clé de détermination des Culicidae présents en Afrique Centrale et au Gabon. Document de travail. IRD/CIRMF, 108 p.
Bawin T., Seye F., Boukraa S., Zimmer J., Delvigne F., & Francis F. 2015. La lutte contre les moustiques (Diptera: Culicidae): Diversité des approches et application du contrôle biologique. The Canadian Entomologist, 147 (4), 476-500. doi:10.4039/tce.2014.56.
Bechini L. 2017. Piqures de moustiques, un risque sanitaire à ne pas négliger, Thèse de Doctorat, faculté de pharmacie, Université Aix Marseille, France, 134 p.
Betsi A.N., Tchicaya E.S., Koudou BG. 2012. Forte prolifération de larves d’An. gambiae et An. funestus en milieux rizicoles irrigués et non irrigués dans la région forestière ouest de la Côte-d’Ivoire. Bulletin de la Société de Pathologie Exotique, 105 : 220-229. doi: 10.1007/s13149-012-0219-z.
Coffinet T., Rogier C., Pages F. 2009. Évaluation de l’agressivité des anophèles et du risque de transmission du paludisme, méthodes utilisées dans les armées françaises. Médecine Tropicale, 69 : 109-122.
Djogbenou L. 2009. Lutte antivectorielle contre le paludisme et résistance des vecteurs aux insecticides en Afrique. Méd Trop, 69 (2) : 160-164.
Grard G., Caron M., Mombo I., Nkoghe D., Mboui-Ondo S., Jiolle D., Fontenille D., Paupy C., Leroy E.M. 2014. Zika Virus in Gabon (Central Africa)-2007: A new threat from Aedes albopictus? PLoS Neglected Tropical Diseases, 8 (2): 1-6. e2681. doi: 10.1371.
Koné A.B., Konan Y.L., Coulibaly Z.I., Fofana D., Coulibaly N., Diallo M., Doannio J.M.C., Ekra K.D., Koudou P. 2013. Évaluation entomologique du risque d’épidémie urbaine de fièvre jaune survenue en 2008 dans le district d’Abidjan, Côte d’Ivoire. Médecine et Santé Tropicales, 23 : 66-71. doi: 10.1684/mst.2013.0153.
Korba R.A., Alayat M.S., Bouiba L., Boudrissa A., Bouslama Z., Boukraa S., Francis F., Failloux A.B., Boubidi S.C. 2016. Ecological differentiation of members of the Culex pipiens complex, potential vectors of West Nile virus and Rift Valley fever virus in Algeria. Parasites & Vectors, 9 : 455-465. doi: 10.1186/s13071-016-1725-9.
Lagadic L., Darriet F., Delorme R., Deparis X., Devillers J., Jean Philipe J., Lagneau C., Lapied B., Quiqiou F., Yebakima A., Yamada O., Briand O., Charles S., Medjo-Byabot A., Thibaut L. et Tilloy A. 2011. Rapport d’expertise collective : Recherche d’insecticides potentiellement utilisables en lutte antivectorielle. ANSES, 141 p.
Makanga B.K. 2016. Ecologie de la transmission des Plasmodium simiens au Gabon. Thèse de 3ème cycle, Ecole Doctorale Régionale de Franceville, Franceville, 191 p.
OMS 2022. Dossier d’information. Principaux messages. Rapport 2022 sur le paludisme dans le monde, 22 p.
OMS 2020. Maladies à transmission vectorielle : Faits essentiels.
Peter H.R., Linda R.B., David M.H. 2012. Environment, John Wiley & Sons, 326 p.
Pingen M., Schmid M.A., Harris E. et McKimmie C.S. (2017). Mosquito Biting Modulates Skin Response to Virus Infection. Trends Parasitol. 33 (8): 645-457.
Rodhain F. 2015. Le parasite, le moustique, l’homme et les autres : Essai sur l’épidémiologie des maladies à vecteurs, Edition Dorcas, 440 p.
Saotoing P., Njan-Nloga A.M., Tchuenguem Fohouo F.N., Yaya O., Messi J. 2011. Bio écologie des larves de Culicidae (Diptera) dans la ville de Maroua, Extrême-Nord du Cameroun. Sciences et Médecines en Afrique, 3 (1): 417-422.
Saotoing P., Fohouo T.F.N, et Njan N.A.M. 2014. Enquête entomologique sur la faune culicidienne de la ville de Maroua, Région de l’Extrême- Nord Cameroun. International Journal of Innovation and Applied Studies, Vol. 9, No. 1, 438-448.
Sy O., Konaté L., Ndiaye A., Dia I., Diallo A., Taïrou F., Bâ E.L., Gomis J.F., Ndiaye J.L., Cissé B., Gaye O., Faye O. 2016. Identification des gîtes larvaires d’anophèles dans les foyers résiduels de faible transmission du paludisme « hotspots » au centre-ouest du Sénégal. Bulletin de la Société de Pathologie Exotique, 109 : 31-38. doi: 10.1007/s13149-016-0469-2.
Talipouo A., Ntonga-Akono P., Tagne D., Mbida-Mbida A., Etang J., TchoffoFobasso R., Ekoko W., Binyang J., Dongmo A. 2017. Comparative study of Culicidae biodiversity of Manoka island and Youpwe mainland area, Littoral, Cameroon. International Journal of Biosciences, 10 (4): 9-18. doi: http://dx.doi.org/10.12692/ijb/10.4.9-18.
Tia E., Gbalegba N.G.C., M’Bra K.R., Kaba A., Boby O.A.M., Koné M., Chouaibou M., Koné B., Koudou G.B. 2016. Etude du niveau de production larvaire d’Anopheles gambiae s.l. (Diptera : Culicidae) dans les différents types de gîtes à Oussou-yaokro au Centre-Ouest et à Korhogo, au Nord (Côte d’Ivoire). Journal of Applied Biosciences, 105 : 10170-10182. doi: http://dx.doi.org/10.4314/jab.v105i1.13.
(22 Réf.)