Nidification du chimpanzé de savane (Pan troglodytes verus) dans la zone non protégée de Bantankiline (Kédougou, Sénégal)
Résumé
Le chimpanzé d'Afrique de l'Ouest (Pan troglodytes verus) est inscrit sur la liste des espèces « en danger critique d'extinction » de l’Union Internationale pour la Conservation de la Nature depuis 2016, suite au déclin de ses effectifs. Ce travail se focalise sur la nidification du chimpanzé dans la savane boisée, chaude et sèche de Bantankiline. Son objectif est d’améliorer l’état des connaissances sur la nidification du chimpanzé au Sénégal par : 1) l’identification des dortoirs du chimpanzé à Bantankiline ; 2) l’identification des espèces végétales les plus utilisées pour construire les nids de repos ; 3) la détermination de la hauteur des nids par rapport au sol et 4) l’identification des menaces sur la survie du chimpanzé dans ce site. Pour cela, nous avons recensé au total 809 nids de chimpanzé et parcouru 155,1 kilomètres répartis entre 37 transects, soit une moyenne de 4,19 kilomètres par transect. Les nids ont été recensés au cours des années 2018, 2020 et 2021. Les résultats montrent que la majorité des nids (environ 655 nids, soit 80,96 % des observations) est portée principalement par 6 espèces végétales : Pterocarpus erinaceus, Parkia biglobosa, Anogeissus leiocarpus, Diospyros mespiliformis, Cola cordifolia, Hexalobus monopetalus. Khaya senegalensis, Piliostigma thonningii et Adansonia digitata sont faiblement utilisés par les chimpanzés pour la nidification à Bantankiline. L’inventaire quantitatif des espèces végétales par la méthode des plots nous a permis de recenser au total 3582 pieds d’arbres répartis entre 50 espèces le long des transects. Nous avons noté la prédominance de 4 espèces végétales lors du recensement : Hexalobus monopetalus, Pterocarpus erinaceus, Combretum glutinosum et Combretum micranthum. Parkia biglobosa est peu abondante dans le site d’étude mais elle est la deuxième espèce végétale la plus utilisée par les chimpanzés pour la nidification après P. erinaceus. La hauteur moyenne des arbres utilisés comme supports de nids est de 13 m et la hauteur moyenne des nids se situe à 9,91 m. Ces informations scientifiques sont d’une importance capitale pour l’élaboration des documents de gouvernance de ces sites par les services techniques et la prise de décisions pour la conservation du chimpanzé et de ses espèces sympatriques au Sénégal.
Abstract
The West African chimpanzee (Pan troglodytes verus) is now registered on the redlist of the International Union of Conservation for Nature (UICN) as a “Critically Endangered” species (since 2016) due to significant decline in population. Our work focuses on the nesting behavior of the West African chimpanzee in the hot and dry savanna-woodland in Bantankiline, Senegal. We aim to improve the state of knowledge on chimpanzee nesting in Senegal by: 1) identifying chimpanzee nests in Bantankiline; 2) identifying the plant species selected by chimpanzees here to build their nests; 3) determining the height of nests in relation to the ground and 4) identifying threats to chimpanzee survival in this area. We recorded 809 chimpanzee nests while walking a total distance of 155.1 km distributed along 37 recce transects, which averaged 4.19 km per transect. Nests were recorded during 2018, 2020 and 2021. Results indicate that the majority of the nests (80 %) are in six tree species, namely Pterocarpus erinaceus, Parkia biglobosa, Anogeissus leiocarpus, Diospyros mespiliformis, Cola cordifolia, Hexalobus monopetalus. P. erinaceus and P. biglobosa are the most heavily used species. Khaya senegalensis, Piliostigma thonningii and Adansonia digitata are rarely used by chimpanzees to build nests in Bantankiline. Data on tree species abundance were collected using quadrats. We counted 3,582 trees distributed between 50 species along the prospected transects. The most abundant tree species at Bantankiline are H. monopetalus, P. erinaceus, Combretum glutinosum and C. micranthum. One of the two most frequently used tree species for chimpanzees nesting in this site, P. biglobosa, is low in abundance. The average height of trees bearing chimpanzee’s nests is 13 m and the average nest height is 9.91 m. This scientific information is important for informing governance documents for sites such as Bantankiline and for decision making regarding the protection of resources relative to the conservation of the chimpanzee and sympatric species in Senegal.
Manuscrit reçu le 7 avril 2022 et accepté le 20 août 2022
Publié selon les termes de la licence Creative Commons CC-BY 4.0
1. Introduction
1Le chimpanzé commun (Pan troglodytes) est classé parmi les espèces « en danger » sur la liste des espèces menacées de l'Union Internationale pour la conservation de la nature (UICN) (Oates et al., 2008). Le chimpanzé d'Afrique de l'Ouest (P. t. verus), appelé parfois chimpanzé de savane au Sénégal, est la sous-espèce la plus menacée de toutes (Kormos et Boesch, 2003). C’est ce qui justifie son classement parmi les espèces « en danger critique d'extinction » depuis 2016, suite au déclin de ses effectifs (Humle et al., 2016 ; Kühl et al., 2017). Pour renforcer son statut de protection, le chimpanzé d’Afrique de l’Ouest est aussi classé dans l’Appendix 1 de la Convention sur le commerce international des espèces de faune et de flore sauvages menacées d’extinction (CITES) (CITES, 2018) et dans les annexes I et II de la Convention sur les espèces migratrices de faune sauvage (CMS) en 2017 (UNEP/CMS/COP 12, 2017).
2La conservation des grands singes nécessite une bonne compréhension de la taille des populations, de leur répartition spatiale et de leurs tendances démographiques. Cependant, il est généralement difficile d'observer les grands singes dans leurs habitats naturels. Ainsi, le dénombrement des nids est couramment utilisé par les chercheurs pour estimer la taille des populations, en particulier le chimpanzé, et pour identifier les sites et espèces végétales qu’ils utilisent pour la nidification. Il permet aussi d’avoir des informations sur l’alimentation, le repos nocturne, les couloirs de migration empruntés, etc… (Pruetz et al., 2002 ; Kühl et al., 2008 ; Hernandez-Aguilar, 2009 ; Ukpong et al., 2013 ; Hakizimana et al., 2015 ; Dutton et al., 2016 ; McGrew, 2007).
3La construction de nid de repos nocturne est un comportement commun aux quatre espèces de grands singes, mais absent chez tous les autres primates anthropoïdes (Kormos et al., 2004). Chez les chimpanzés, tous les individus matures construisent un nid chaque soir pour le repos nocturne. Parfois, un ancien nid peut être réutilisé (Goodall, 1962). En cas de réutilisation, l'ancien nid est généralement renforcé avec du nouveau matériel végétal du même arbre support pour plus de confort et de commodité (Anderson, 2000 ; Kormos et al., 2004). Ces nids de repos nocturne sur les arbres permettent aux chimpanzés de se protéger des défis et hostilités environnementaux (Stewart 2011; Stewart & Pruetz, 2013). La construction de nids se fait généralement dans le feuillage des arbres, le plus souvent près de la canopée (Goodall, 1962). La structure des nids varie du niveau rudimentaire et superficiel (cas des nids du jour), au très élaboré et stable pour les nids nocturnes (Kormos et al., 2004). Les chimpanzés utilisent en général un seul arbre pour la nidification ; mais il leur arrive parfois de rassembler du matériel végégal provenant de différentes espèces en association pour fabriquer leurs nids (Kormos et al., 2004). Le nombre le plus important relevé à ce jour est de 7 espèces d’arbres intégrés dans un seul nid, à Seringbara en Guinée (Humle, 2003). Parfois, les chimpanzés font des nids au sol (Ham, 1998 ; Koops et al., 2007; Pruetz et al., 2008; Badji et al., 2018). Ce comportement est rarement observé au Sénégal. Il a été décrit ces dernières années par Badji et al. (2018) à Bagnomba. Ndiaye PI & Ndiaye YA (donnée non publiée) ont aussi observé un nid au sol constitué de matériel végétal provenant de Diospyros mespiliformis dans la zone du permis d’exploitation aurifère de Massawa. Plusieurs études ont montré que le comportement de nidification des chimpanzés est soumis à plusieurs facteurs intrinsèques (l’âge de l’individu, le sexe, la position sociale, l’état physiologique) et extrinsèques comme le type d’habitat, la végétation, le climat, la présence ou l’absence de prédateurs, entre autres (Lehman & Fleagle, 2006 ; Kamilar, 2009 ; Baldwin et al., 1982 ; Groves & Sabater Pi, 1985 ; Sept et al,, 1992 ; Pruetz et al., 2008 ; Badji et al., 2018 ; Badji, 2019). La topographie du milieu et la phénologie des espèces végétales peuvent aussi jouer un rôle déterminant sur la distribution et la nidification des chimpanzés (Furuichi & Hashimoto, 2004 ; Ndimuligo, 2007). Il a été également constaté que les chimpanzés ont des préférences pour les espèces végétales utilisées comme arbres supports des nids, mais aussi pour la hauteur des nids par rapport au sol (Wrogemann, 1992 ; Fleury-Brugière, 2001; Badji et al., 2018; Badji, 2019). Les facteurs anthropiques comme l’orpaillage et les activités agricoles peuvent aussi influencer le choix des sites de nidification par les chimpanzés (Potts et al., 2011).
4Le comportement de nidification des chimpanzés a fait l’objet de plusieurs publications. En plus de celles décrites précédemment, d’autres auteurs ont affirmé que les chimpanzés sélectionnent certaines espèces d’arbres pour la nidification (Furuichi & Hashimoto, 2004 ; Standford & O’Malley, 2008 ; Koops et al., 2012 ; Ndiaye et al., 2013b ; Diallo, 2018). D’autres ont pu démontrer que cette préférence se justifie par les propriétés physiques de ces arbres (solidité et élasticité). Ces propriétés permettent d’avoir des nids confortables et stables (Stewart et al., 2017 ; Ndiaye et al., 2013a ; Samsom & Hunt, 2014 ; Badji et al., 2018).
5Au Sénégal, des études ont montré que les chimpanzés utilisent plus Pterocarpus erinaceus (Venn) pour la nidification (Ndiaye, 1999 ; Ndiaye et al., 2013a ; Ndiaye et al., 2018a ; Badji et al., 2018 ; Diallo, 2018 ; Badji, 2019). On sait aussi que P. erinaceus est l’une des espèces les plus exploitées par les populations humaines comme bois d’œuvre et de consolidation des trous d’orpaillage traditionnel (Badji, 2013 ; Ndiaye et al., 2018a ; Badji, 2019). Aujourd’hui, avec la nouvelle orientation économique de la zone liée aux métiers de l’exploitation aurifère (exploitation industrielle comme l’exploitation artisanale) à laquelle s’ajoute le surpâturage et l’arrivée massive de populations humaines des pays limitrophes, on assiste de plus en plus à une dégradation des écosystèmes terrestres sous l’effet de plusieurs pressions anthropiques (déboisement, rareté des ressources alimentaires, pollution liée aux produits chimiques utilisés par les orpailleurs, bruits et poussières, construction de nouvelles d’infrastructures, etc.). C’est ce qui implique la nécessité de mettre en place des mesures de restriction et de conservation pour éviter d’éventuelles pertes d’espèces animales (chimpanzé) et végétales (P. erinaceus, Khaya senegalensis ou khaye). Ces menaces anthropiques tendent aussi à réduire et à fragmenter l’habitat des chimpanzés dans la région de Kédougou, constituant ainsi une réelle menace à sa survie. Des facteurs identiques ont entrainé une importante diminution de l’effectif des chimpanzés en Sierra Leone, où seule une petite proportion de la couverture forestière originale subsiste encore dans un paysage dominé par de petites exploitations agricoles traditionnelles sur brûlis (Brncic et al., 2010). D'autres études font état de situations similaires en République de Guinée (Hockings et al., 2009), en Guinée-Bissau (Torres et al., 2010) et en Ouganda (McLennan, 2008). Junker et al. (2012) ont révélé des déclins beaucoup plus importants pour P. paniscus et les trois taxons de gorilles que pour P. troglodytes. La perte d’habitats du chimpanzé dans le monde et au Sénégal (Kédougou) en particulier est loin de connaitre son apogée à cause des besoins croissants de l’homme à améliorer son statut économique (Pruetz et al., 2002 ; Pruetz, 2006 ; Badji, 2013). On assiste à une réduction significative de la population de chimpanzé au cours des 20 à 30 dernières années, suite à la destruction progressive de leurs habitats. Cette réduction se poursuivra pendant les 30 à 40 prochaines années (Humle et al., 2016 ; Heinicke et al., 2019a, b). Ainsi, de toutes ces menaces qui pèsent sur la survie du chimpanzé et de son habitat, comprendre les espèces végétales sélectionnées pour la nidification de même que la distribution des nids de chimpanzés dans l’espace nous permettra d’avoir des informations sur les préférences pour la nidification et les habitats de prédilection. C’est pour cette raison que nous nous sommes fixé les objectifs suivants pour cette étude : 1) l’identification des dortoirs du chimpanzé à Bantankiline ; 2) l’identification des espèces végétales les plus utilisées à Bantankiline pour porter les nids de chimpanzé ; 3) la détermination de la hauteur des nids par rapport au sol et 4) l’identification des menaces sur la survie du chimpanzé.
2. Matériel et Méthode
2. 1. Zone d’étude
6Notre étude s’est déroulée dans la savane chaude, sèche et ouverte de Bantankiline entre juillet et octobre 2018 et entre octobre 2020 et octobre 2021. Cette zone non protégée est située dans la région de Kédougou à environ une trentaine de kilomètres du Parc National du Niokolo Koba (PNNK), dans la partie sud-est du Sénégal (Figure 1).
7Bantankiline est proche du village de Marougounding près du hameau de Fongoli où se trouve le seul groupe de chimpanzés habitués à la présence humaine au Sénégal (Pruetz et al., 2008). Sa végétation est constituée en grande partie de Khaya senegalensis, Erytrophleum guineensis, Pterocarpus erinaceus, Bombax costatum, Diospyros mespiliformis, Spondias mombin et de diverses combrétacées. Le sous-bois est dominé par le Bambou (Oxynanthera abyssinica). Le climat est de type soudano-guinéen avec deux grandes périodes de régime thermique. La période de basses températures s’étend entre juillet et février avec plus de fraicheur en décembre - janvier. La période de hautes températures est située entre mars et juin (Pruetz et al., 2008). Pendant la saison des pluies, les forêts galeries et les vallées sont inondées. Les températures sont généralement élevées avec des maxima qui varient entre 34° et 42° et des minima entre 21° et 25° (Diallo, 2018). La moyenne annuelle de pluviométrie est comprise entre 900 et 1100 mm (Pruetz et al., 2008 ; Bertolani & Pruetz, 2011).
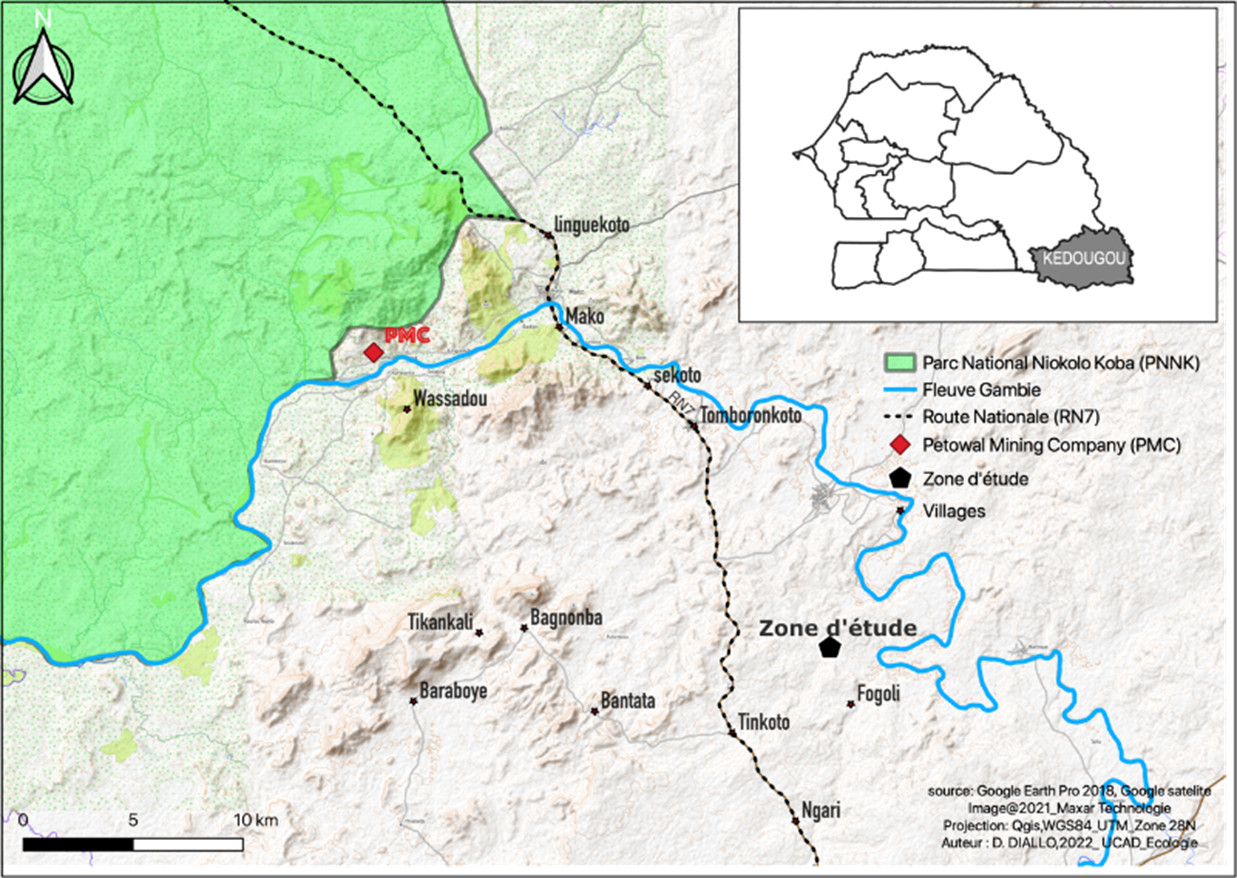
Figure 1.
Localisation de la zone de Bantankiline
2. 2. Collecte de données
8Les données ont été collectées au cours de plusieurs missions effectuées en 2018, 2020 et 2021, essentiellement par la méthode des transects de reconnaissance (Figure 2). Cette methode consiste à marcher suivant une direction prédéterminée le long du transect. Elle permet de dévier de la direction principale préétablie pour suivre les endroits où la probabilité de rencontrer des indices de présence de chimpanzés est plus élevée (Kühl et al., 2008 ; Ross & Reeve, 2011 ; Ndiaye et al., 2018a). Tenant compte de l’éloignement du site d’étude à notre campement à Fongoli (2-5km), nous avons effectué les prospections à pied, très tôt le matin (à partir de 06h au plus tard) jusqu’en début d’après-midi (généralement entre 15h et 16h) avec parfois des pauses d’une dizaine de minutes. La vitesse de progression pendant la marche était d’environ 1,5 km par heure. Pour chaque nid observé, nous avons relevé les coordonnées géographiques, l’heure d’observation, l’identité de l’arbre support, la hauteur par rapport au sol, la hauteur de l’arbre support, l’âge du nid (frais, récent, ancien, décomposé) suivant la classification de Tutin et Fernandez (1984) et les impacts d’origine anthropique qui menacent la survie des chimpanzés dans cet environnement. Nous avons utilisé un télémètre (Bushnel) pour mesurer les hauteurs des nids et des arbres supports. Tenant compte du fait que les habitats de prédilection des chimpanzés dans cette zone sont particulièrement les galeries forestières et galeries de rebords de plateaux ou de collines (Ndiaye et al., 2013b, 2018a,b), nous avons focalisé nos prospections le long de ces galeries.
9Pour déterminer l’abondance relative des espèces végétales, nous avons effectué le recensement des arbres supposés être de potentiels supports des nids de chimpanzés suivant des plots disposés le long des transects prospectés. Nous avons déterminé, dans un premier temps, l’aire minimale par la méthode des surfaces emboîtées. Cela nous a permis de déterminer une surface représentative pour effectuer l’inventaire de la formation végétale. Ensuite, nous avons délimité des quadras mesurant chacun 20 x 20 m et relevé toutes les espèces végétales dont le diamètre du tronc est ≥ 10 cm à hauteur de poitrine. L’identification des espèces végétales a été effectuée par des personnes expérimentées de l’équipe de terrain et/ou par l’utilisation de clés de détermination avec la confirmation de spécialistes en botanique de l’Université Cheikh Anta Diop de Dakar.
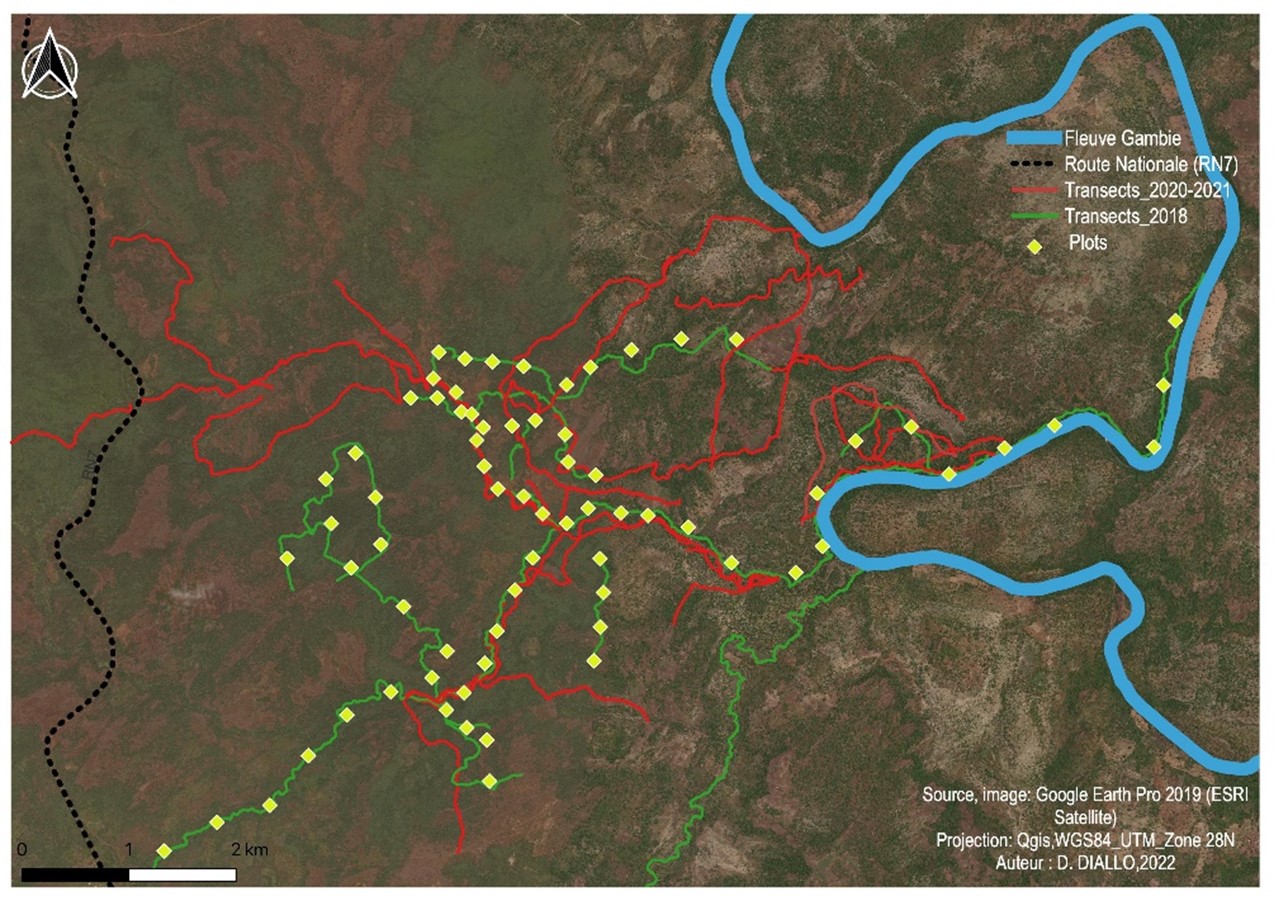
Figure 2.
Cartographie des transects de reconnaissance prospectés et des plots d’inventaires botaniques
2. 3. Traitement et analyse des données
10Nous avons conçu une base de données sur Excel pour stocker les données collectées au cours de cette étude et avons utilisé les « tableaux dynamiques croisés » pour l’analyse des données. Les données ont été cartographiées à l’aide du logiciel libre « Qgis 2.18.28 ». Les tests statistiques ont été effectués avec le logiciel R.
3. Résultats et discussion
3. 1. Résultats
11Nous avons répertorié au total 809 nids de chimpanzé (Tableau 1) sur une distance totale de 155,1 km repartis entre 37 transects (Figure 3), soit une moyenne de 4,19 kilomètres par transect.
Tableau 1. Répartition des nids en fonction de la période et des âges
|
Âge nid |
2018 |
2020 |
2021 |
|||||
|
En nbre |
En (%) |
En nbre |
En (%) |
En nbre |
En (%) |
Total |
||
|
Frais |
32 |
3,95 |
0 |
0 |
0 |
0 |
32 |
3,95% |
|
Récent |
33 |
4,07 |
16 |
1,97 |
29 |
3,58 |
78 |
9,62% |
|
Ancien |
106 |
13,10 |
48 |
5,93 |
28 |
3,46 |
182 |
22,49% |
|
Décomposé |
201 |
24,84 |
117 |
14,46 |
199 |
24,59 |
517 |
63,89% |
|
Total |
372 |
45,98 |
181 |
22,37 |
256 |
31,64 |
809 |
100% |
En nbre = en nombre; En (%) = en pourcentage
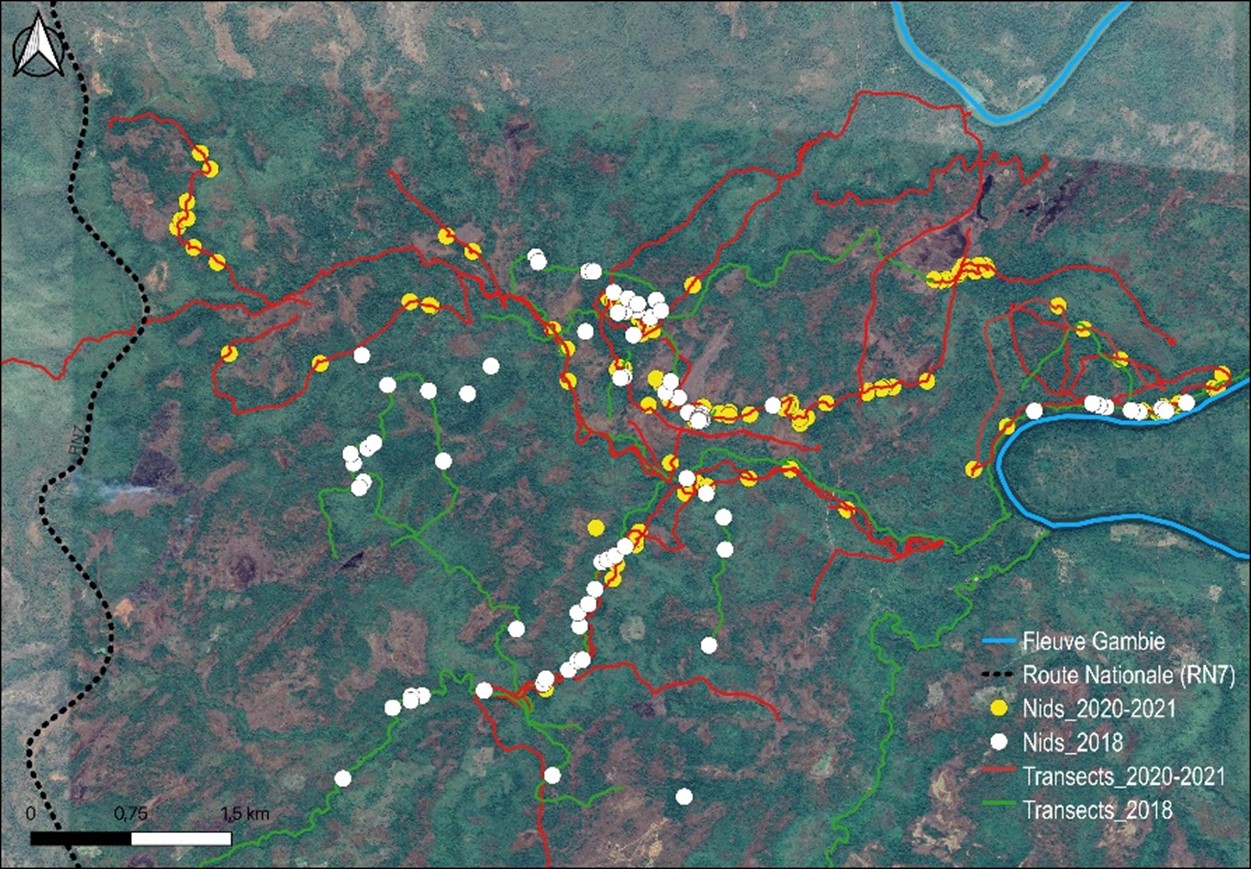
Figure 3.
Distribution géographique des nids de chimpanzé recensés
12Les données indiquées dans le Tableau 2 montrent que les nids étaient répartis principalement entre six types d’habitats que sont : la savane boisée (N=386 ; 47,71%), la forêt galerie (N=302 ; 37,33%), la forêt claire (N=72 ; 8,9%), la savane arborée (N=28 ; 3,46%), la savane arbustive (N=11 ; 1,36%) et la forêt de bambou (N=10 ; 1,24%). La grande majorité se trouvait au niveau des galeries forestières et de la savane boisée (85,04 % du total des nids relevés).
Tableau 2. Répartition des nids en fonction des habitats
|
Habitats |
Nbre de nids observés |
Pourcentage (%) |
Distance totale prospectée (km) |
|
Forêt galerie |
302 |
37,33 |
47,3 |
|
Savane boisée |
386 |
47,71 |
42,4 |
|
Savane arbustive |
11 |
1,36 |
25 |
|
Savane arborée |
28 |
3,46 |
11 |
|
Forêt de bambou |
10 |
1,24 |
20,4 |
|
Forêt claire |
72 |
8,9 |
9 |
|
Total |
809 |
100 |
155,1 |
13La Figure 4 indique la répartition des nids de chimpanzé en fonction des espèces d’arbres supports. Ces résultats montrent qu’au moins 34 espèces végétales portaient des nids de chimpanzé à Bantankiline.
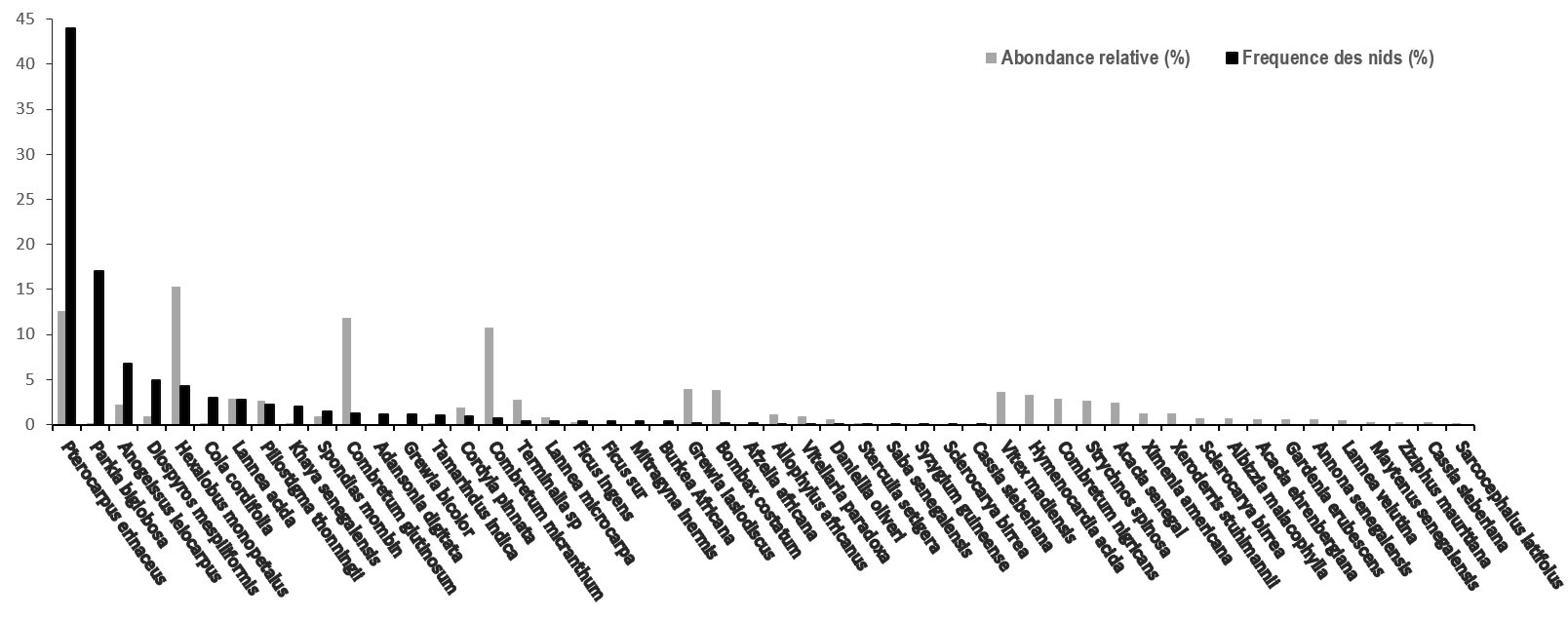
Figure 4.
Fréquence des nids de chimpanzés par espèce végétale support et abondance des espèces susceptibles de porter les nids.
14Environ 655 nids (soit 80,96%) étaient portés principalement par 6 espèces végétales : P. erinaceus (N=972 ; 44 %) ; Parkia biglobosa (N=145 ; 17,92%) ; Anogeissus leiocarpus (N=55 ; 6,79%) ; Diospyros mespiliformis (N=40 ; 4,94 %) ; Cola cordifolia (N=24 ; 2,92%) ; Hexalobus monopetalus (N=35 ; 4,32%). Khaya senegalensis (N=16 ; 1,97%) et Piliostigma thonningii (N=18 ; 2,22%) sont faiblement utilisés par les chimpanzés pour la nidification à Bantankiline (Figure 4).
15L’étude sur l’abondance a permis de recenser au total 3582 pieds d’arbre appartenant à 50 espèces végétales. Nous avons remarqué la prédominance de 4 espèces végétales: Hexalobus monopetalus (N=547 ; 15,27%), Pterocarpus erinaceus (N=452 ; 12,61%), Combretum glutinosum (N=426 ; 11,89%) et Combretum micranthum (N=384 ; 10,71%). Parkia biglobosa était faiblement représenté (N=7 ; 0,19%) mais elle était la deuxième espèce végétale la plus utilisée pour la nidification des chimpanzés après P. erinaceus dans la zone d’étude.
16Les espèces comme : Vittelaria paradoxa (N=34 ; 0,94%), Sclerocarya birrea (N=260 ; 72%), Ficus sur (N=3 ; 0,08%), Tamarindus indica (N=5 ; 0,14%), Cola cordifolia (N=4 ; 0,11%), Adansonia digitata (N=1 ; 0,03%) et Spondias mombin (N=33 ; 0,92%) étaient faiblement présentes dans la zone.
3.1.1. Hauteurs des nids de chimpanzé en fonction des arbres supports
17Les mensurations effectuées sur les arbres supports nous ont permis de connaître la hauteur moyenne de nidification (HN=9,91 m) et la hauteur moyenne des arbres supports (HA=13 m) dans la zone d’étude. Ainsi, sur les 809 nids recensés, 15% ont une hauteur supérieure à 16 m ; 22% se trouvaient à des hauteurs comprises entre 14 et 16 m ; 23% étaient entre 12 et 14 m ; 12% à des hauteurs comprises entre 10 et 12m, 11 % à des hauteurs comprises entre 8 et 10 m et 12% sont à une hauteur inférieure à 8 m. Les données représentées en histogramme montrent que la majeure partie des espèces végétales utilisées pour la construction de nids avaient une hauteur comprise entre 6 et 14 m et la plupart des nids construits par les chimpanzés se situaient à une hauteur comprise entre 12 et 16 m (Figure 5). Ces résultats montrent que la hauteur de nidification dépend de celle des arbres supports des nids.
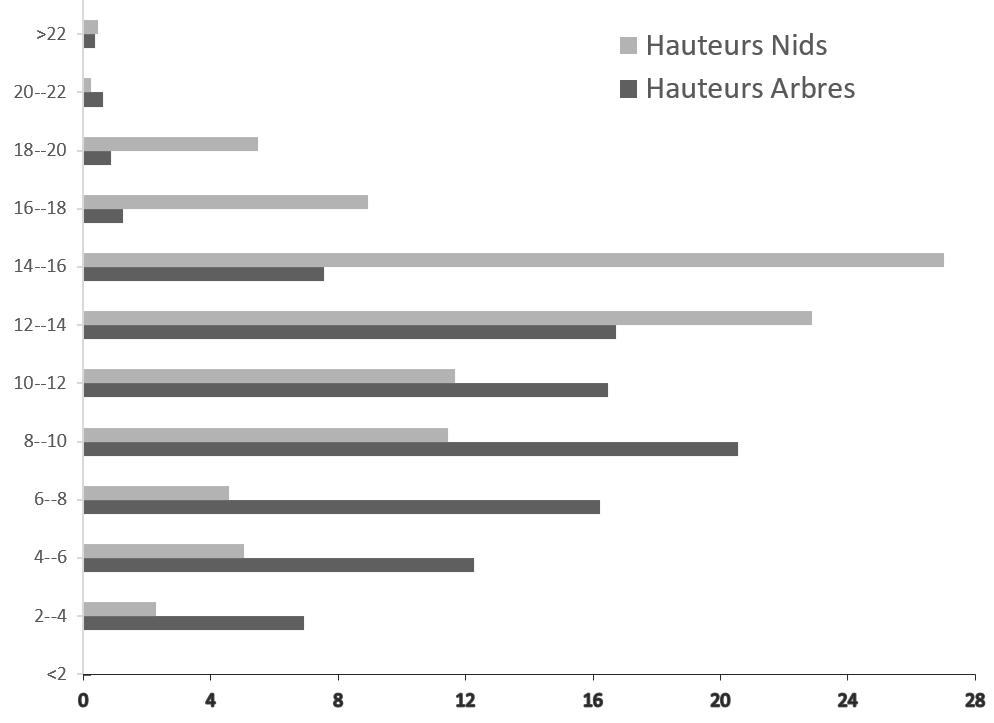
Figure 5.
Variation de la hauteur des nids (HN) de chimpanzés et des arbres supports (HA) selon des classes de taille (N=813 arbres support). L’axe des abscisses indique le nombre de nids en pourcentage en fonction de la hauteur ; l’axe des ordonnées indique la hauteur des nids ou des arbres supports de nids en mètres
3.1.2. Relation entre la hauteur des nids et celle des arbres
18La régression linéaire entre la hauteur des nids (HN) et celle des arbres (HA) montre une corrélation statistiquement significative entre HN et HA et 57 % de la variabilité de l’échantillon est expliquée par la régression (r=0,750 ; N=809 ; P < 0,05). Ceci montre donc que la hauteur des nids est étroitement liée à celle des arbres supports. En d’autres termes, la hauteur des nids augmente en fonction de celle des arbres supports (Figure 6).
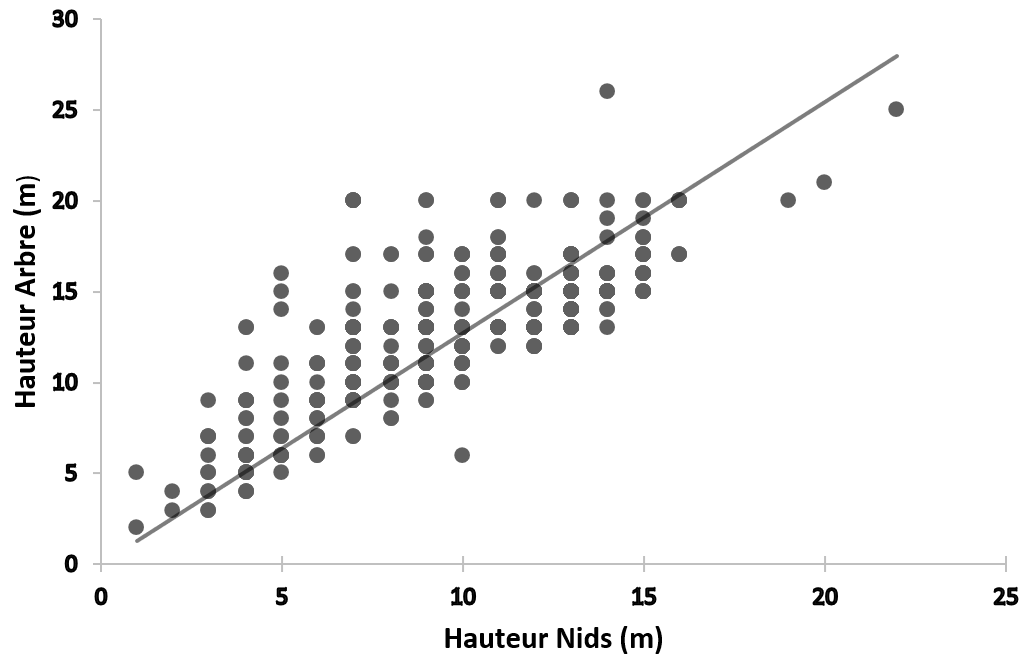
Figure 6.
Droite de régression linéaire entre la hauteur des nids et celle des arbres supports.
3.1.3. Menaces à la survie du chimpanzé
19La plupart des menaces enregistrées au cours de notre étude étaient liées à des activités anthropiques directes et/ou indirectes (Figures 7 et 8). Les menaces directes s’exerçaient sur l’espèce et les menaces indirectes contribuaient à la destruction de son habitat. Les impacts des menaces directes sont presque négligeables à Bantankiline mais peuvent constituer un grand danger pour les chimpanzés. Par contre, les menaces indirectes étaient plus visibles et se manifestaient sous plusieurs formes. Elles se manifestaient par la dégradation, puis l’élimination des habitats des chimpanzés. Par exemple, le déboisement lié à l’exploitation du bois pour la menuiserie, la construction, la consolidation des puits d’orpaillage, la production de charbon de bois et autres types d’usages et à la transhumance, constituaient les menaces indirectes les plus fréquentes dans la zone de Bantankiline. L’orpaillage artisanal n’est pas encore très développé dans la zone, mais le risque d’accélération du processus est élevé.

Figure 7.
Preuves de facteurs anthropiques nuisibles pour l’habitat des chimpanzés et pour la biodiversité en général : (a) déboisement lié à la transhumance ; (b) déboisement lié à la production du charbon de bois.
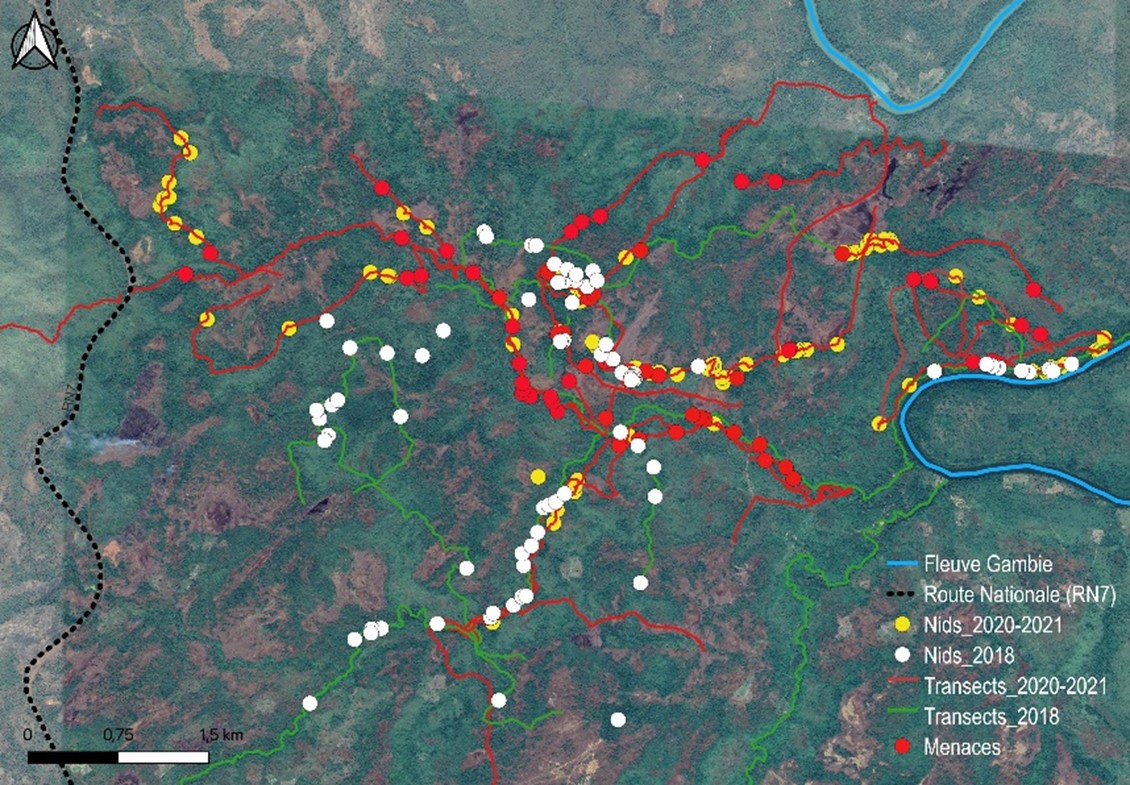
Figure 8.
Distribution des indices des menaces relevées dans la zone de Bantankiline et environs
20Le déboisement est actuellement très marqué à Bantankiline. Les principales causes sont la production de charbon de bois et l’utilisation du bois pour la consolidation des trous d’orpaillage communément appelées « Diouras » en langue locale. Le déboisement entraine une destruction des habitats des chimpanzés, en particulier les dortoirs. Les coupes d’arbre se font jusqu’au niveau des galeries forestières qui constituent le cœur des sites de nidification et d’alimentation des chimpanzés à Bantankiline. Diallo (2018) avait recensé et géolocalisé plusieurs troncs d’arbres coupés par les exploitants le long des galeries forestières de Bantankiline. Nous avons constaté qu’en général les espèces végétales ciblées par les exploitants sont aussi très souvent utilisées par les chimpanzés pour la nidification. Ce sont principalement Pterocarpus erinaceus, Khaya senegalensis, Anogeissus leiocarpus et Diospyros mespiliformis. Ces espèces sont donc très importantes pour la nidification des chimpanzés au Sénégal.
21Un facteur anthropique qui a connu une accélération ces dernières années et qui impacte de façon très négative sur les habitats du chimpanzé au Sénégal est la transhumance. Les transhumants coupent les essences qui ont une grande valeur fourragère même si elles sont situées dans les habitats des chimpanzés (forêts galeries ; galeries de rebords de plateaux, collines, corridors de migration, etc.). Les espèces les plus ciblées pour l’alimentation du bétail sont P. erinaceus, Ficus sp. et K. senegalensis. Or, ces espèces végétales sont identifiées comme étant des maillons importants pour la nidification et l’alimentation des chimpanzés. Les transhumants remontent jusque dans les zones d’accès difficiles au niveau des collines et des galeries forestières pour les exploiter.
3. 2. Discussion
22La répartition des nids de chimpanzés en fonction des âges a montré que le cumul de nids anciens et décomposés était plus élevé que les autres. Il correspond à un pourcentage de 86,4%, soit un total de 699 nids sur 808 recensements. Cela signifie que l’essentiel des nids a été construit depuis au moins une semaine. Un tel résultat a été obtenu par Pruetz et al. (2002) sur des chimpanzés vivant à l’extérieur du Parc National de Niokolo Koba (à Tomboronkoto/Cobo et Kédougou Sud) et par Thiam (2015) dans la zone non protégée de Diaguiri. La faiblesse de la proportion de nids frais et récents (13,6% ; N=110) permet de suggérer que seuls quelques individus de chimpanzé ont utilisé les habitats prospectés pendant la période de nos travaux, ce qui justifie aussi l’absence d’observations directes.
23Nous avons constaté également que les espèces végétales les plus utilisées par les chimpanzés pour la nidification à Bantankiline sont au nombre de six. Ces espèces sont Pterocarpus erinaceus, Parkia biglobosa, Anogeissus leiocarpus; Diospyros mespiliformis; Cola cordifolia et Hexalobus monopetalus. Elles portaient 80,96% des nids relevés pour un échantillon de 655 nids. Diallo (2018) avait fait le même constat à Bantankiline. Des observations similaires ont été effectuées par Badji et al. (2018) lors d’une étude réalisée dans la colline de Bagnomba et ses alentours (au sud-est du Sénégal). Ces auteurs avaient décrit environ 81% des nids de chimpanzés sur quatre espèces d'arbres : D. mespiliformis, P. erinaceus, A. leiocarpus et K. senegalensis. Nos résultats sont semblables aussi à ceux de Ndiaye et al. (2013a) qui avaient décrit pratiquement les mêmes espèces végétales préférées pour la nidification au niveau de plusieurs dortoirs de chimpanzés dispersés dans la région de Kédougou : 25,42% des nids de chimpanzé sur P. erinaceus ; 11,4% sur D. mespiliformis ; 11,17% sur P. biglobosa ; 9,22% sur A. leiocarpus et 7,60% sur C. cordifolia.
24Piliostigma thonningii, Khaya senegalensis et Adansonia digitata sont très peu utilisés par les chimpanzés pour la nidification à Bantankiline, avec respectivement des pourcentages de 2,22%, 1,97% et 1,11%. En comparant le nombre de nids portés par Khaya senegalensis pour notre étude (1,97%) avec celui trouvé par Diallo (2018) dans la même zone (3%), on voit une nette diminution avec le temps. Cette diminution peut être liée à la faiblesse de la disponibilité de K. senegalensis dans la zone d’étude au moment de notre travail. Cela est probablement dû à la forte pression exercée par les transhumants et les exploitants de bois sur cette espèce à cause de sa grande taille et la qualité de son bois. Pourtant, elle est inscrite sur la liste rouge des espèces protégées de l’Union Internationale pour la Conservation de la Nature dans la catégorie « Vulnérable » (VU). C’est surtout ce qui avait motivé Diallo (2018) à répertorier et géolocaliser tous les pieds coupés de K. senegalensis le long des galeries forestières de Bantankiline. On peut donc dire que ce faible taux de nid de chimpanzés relevé sur K. senegalensis à Bantankiline est lié à la forte pression sur l’espèce qui est devenue de plus en plus rare dans la zone. Fort de ce constat, on peut dire que K. senegalensis risque de disparaître de la flore de Bantankiline si des mesures de gestion adéquate ne sont pas prises pour sa protection.
25En se basant sur l’étude de Badji (2019), on voit que parmi les espèces prioritaires pour la nidification du chimpanzé à Bantankiline, certaines sont impliquées dans son alimentation. C’est le cas du P. erinaceus (consommation des écorces à certaines périodes de l’année), du P. biglobosa (fruits), de H. monopetalus (fruits) etc. En général, les espèces végétales choisies par les chimpanzés pour la nidification sont caractérisées, entre autres, par des propriétés physiques comme l’élasticité et la dureté du bois (Fruth & Hohmann, 1993; Stewart et al., 2007; Ndiaye et al., 2013a; Samson & Hunt, 2014; Badji et al., 2018). Ces affirmations sur les espèces utilisées pour la nidification sont aussi soutenues par l’étude de Brownlow et al. (2001), effectuée dans la forêt de Budongo (en Ouganda). Selon ces auteurs, les espèces végétales préférées par les chimpanzés pour la fabrication des nids sont généralement des espèces à bois dur. D’autres auteurs affirment que les chimpanzés préfèrent nidifier dans des arbres fruitiers (Basabose & Yamagiwa, 2002). En Ouganda, dans le parc national de Bwindi, Stanford & O’Malley (2008) ont relevé 93 % des nids de chimpanzé dans les arbres fruitiers. Des observations semblables ont aussi été rapportées par Koops et al (2012) à Seringbara (Mont Nimba, République de Guinée. Tous ces auteurs assurent que l’occurrence de fruits peut influencer le choix des arbres supports de nuits de repos par les chimpanzés. Par contre, selon Goodall (1962), n’importe quel type d’arbre peut être utilisé pour la nidification, à condition qu’il ait une hauteur d’environ 6 m ou plus, des branches raisonnablement souples et un feuillage plus ou moins touffu. Par contre, les arbres dont les branches sont à moins de 3 m au-dessus du sol sont généralement évités pour la nidification. Ces affirmations sont en phase avec les résultats de notre étude. Nous avons trouvé un pourcentage relativement élevé de nids de chimpanzés sur Anogeissus leiocarpus (6,50%) qui n’est pas consommé par les chimpanzés. Selon Humle (2003), le choix du site de nidification varie d’une population et/ou communauté de chimpanzés à l’autre et dépend de la structure de l’habitat, de la distribution des ressources, des niveaux de prédation et du niveau de perturbation par l’homme.
26Les études effectuées dans la zone de Kédougou sur la nidification du chimpanzé ont montré, pour la majorité, que P. erinaceus, D. mespiliformis, P. biglobosa, H. monopethalus et C. cordifolia constituent les espèces les plus utilisées par le chimpanzé au Sénégal pour la nidification. Ceci peut s’expliquer par leurs propriétés biomécaniques et/ou leurs implications dans l’alimentation. L’importante utilisation d’A. leiocarpus (espèce végétale non consommée par le chimpanzé) est liée à sa dureté et/ou à sa disponibilité dans la zone d’étude. Cependant, des études beaucoup plus approfondies sur les caractéristiques physiques de ces espèces, leur disponibilité et leurs périodes de production de fruits sont nécessaires pour une meilleure compréhension des raisons de leur choix par les chimpanzés.
27Nous avons répertorié dans le Tableau 3, la hauteur moyenne de nidification des chimpanzés au niveau de quelques sites du Sénégal et de la République de Guinée.
Tableau 3. Répertoire des hauteurs moyennes de nidification du chimpanzé au niveau de quelques dortoirs situés au Sénégal et en République de Guinée.
|
Hauteur moyenne de nidification en mètres |
Site d’étude |
Pays |
Référence |
|
7,90 |
Bagnomba |
Sénégal |
Badji (2019) |
|
8,33 |
Fongoli |
Sénégal |
Pruetz et al. (2008) |
|
9,91 |
Bantankiline |
Sénégal |
Présente étude |
|
9,96 |
Bantankiline |
Sénégal |
Diallo (2018) |
|
10,50 |
Tomboronkoto |
Sénégal |
Badji (2019) |
|
10,9 |
Diaguiri |
Sénégal |
Ndiaye et al. (2018b) |
|
11,2 |
Assirick |
Sénégal |
Baldwin (1979) |
|
11,3 |
Seringbara |
République de Guinée |
Koops et al. (2012) |
28Les informations du Tableau 3 montrent que la hauteur des nids de chimpanzé varie selon les localités et les types d’habitats. Signalons que la distribution des nids en fonction de la hauteur peut être sous l’influence de divers facteurs comme : le sexe (Brownlow et al., 2001), la prédation (Hernandez‐Aguilar et al., 2013), la thermorégulation (Koops et al., 2012) et d’autres facteurs environnementaux (Baldwin et al., 1981). En comparant la moyenne des hauteurs des arbres supports des nids (13 m), la moyenne des hauteurs des nids (9,91m) et le pourcentage élevé de nid se trouvant entre 10 et 16 m (57%), on peut dire que les chimpanzés de la zone de Bantankiline fabriquent leurs nids à une hauteur relativement élevée (12 à 16 m). Ceci peut se justifier par plusieurs facteurs comme l’anthropisation du milieu suite à une forte présence humaine (Lindshield et al., 2017) et la présence de prédateurs comme la hyène (Crocuta crocuta) et la panthère (Panthera pardus). Des indices de présence de ces grands carnivores ont été relevés au cours de l’étude. La hauteur des nids à Bantankiline est inférieure à celle décrite à Assirik (dans le PNNK). Cela se justifie par la configuration des habitats (végétation dense et sempervirente) et par la présence de carnivores comme le lion et la panthère (Pruetz et al., 2008).
4. Conclusions
29Ce travail montre une importante présence du chimpanzé à Bantankiline qui se manifeste à travers le nombre élevé de nids relevés. Ces nids se trouvent essentiellement dans les galeries forestières. Les espèces végétales les plus utilisées par le chimpanzé dans cette zone pour l’élaboration de ses nids de repos nocturne sont : Pterocarpus erinaceus, Parkia biglobosa, Anogeissus leiocarpus, Diospyros mespiliformis, Cola cordifolia et Hexalobus monopetalus. Mais, il y a un risque élevé de perturbation de cet écosystème par des facteurs anthropiques caractérisés essentiellement par un déboisement excessif, notamment P. erinaceus, Ficus sp, Khaya senegalensis et D. mespiliformis. La hauteur de nidification des chimpanzés est généralement comprise entre 8 et 19 m avec une hauteur moyenne de 9,91m. On peut penser que cette variation de la hauteur moyenne de nidification peut être liée aux prédateurs ou bien à la hauteur des espèces végétales disponibles pour la nidification. Les informations issues de ce travail permettent de mettre en exergue la situation du chimpanzé et des menaces pour sa survie dans cette zone. Ces informations seront également très utiles pour alimenter les plans d’action et de gestion des ressources naturelles dans cette zone et les prises de décision par les autorités administratives et les gestionnnaires des ressources naturelles pour la mise en place de bonnes politiques de conservation de la biodiversité, en particulier le chimpanzé et ses habitats.
Remerciements
30Les auteurs de ce travail remercient profondément les autorités administratives et académiques des Universités Cheikh Anta Diop de Dakar (Sénégal), Texas State University (Etats-Unis) et Iowa State University (Etats-Unis). Sont également associés à ces remerciements nos partenaires techniques et financiers, respectivement la Direction des Eaux et Forêts, Chasse et de la Conservation des Sols ; la Direction des Parcs Nationaux et Petowal Mining Company SA. Une mention spéciale est réservée aux populations locales de Bagnomba, Tomboronkoto, Fongoli, Djendji et aux agents du projet Fongoli Savanna Chimpanzee avec qui nous partageons le quotidien pendant les travaux de terrain.
Informations complémentaires
31Identifiants ORCID des auteurs
32Jill D. Pruetz: 0000-0002-9151-8571
33Papa Ibnou Ndiaye: 0000-0002-9978-564X
34Dame Diallo : 0000-0002-2072-7720
35Kristine Micheletti : 0000-0003-1623-7750
36Contribution des auteurs
37Ce travail est le résultat d’une collaboration étroite et fructueuse entre les auteurs depuis la planification du travail à la rédaction du manuscrit. Les auteurs se sont impliqués chacun en fonction de ses capacités, sa disponibilité et ses possibilités dans le contexte de pandémie liée au COVID-19. PIN et JDP ont conçu l’étude et mis en place le dispositif de travail. PIN, DD, BD, KM et LD ont collecté les données. Les auteurs ont tous contribué à la rédaction du manuscrit.
38Déclaration relative aux conflits d’intérêts
39Les auteurs déclarent l’absence de tout conflit d’intérêt.
Bibliographie
Anderson, J. (2000). Sleep-related behavioural adaptations in free-ranging anthropoid primates. Sleep Medicine Reviews 4:355–373. doi: 10.1053/smrv.2000.0105.
Badji, L. (2019). Écologie du chimpanzé d’Afrique de l’Ouest, Pan troglodytes verus, dans la commune de Tomboronkoto (Kédougou, Sénégal) : habitats, régime alimentaire et menaces. Thèse de doctorat unique d’Écologie et Gestion des Écosystèmes, Faculté des Sciences et Techniques, Universite Cheikh Anta Diop de Dakar, 112 pp.
Badji, L. (2013). Contribution à l’étude du régime alimentaire du chimpanzé, Pan troglodytes verus (primate : hominidae) à Fongoli (Kédougou, sénégal). Mémoire de Master ; Université Cheikh Anta Diop de Dakar, 39 p.
Badji, L., Ndiaye, P.I., Lindshield, S. M., Ba, C. T. et Pruetz, J. D. (2018). Savanna chimpanzee (Pan troglodytes verus) nesting ecology at Bagnomba (Kédougou, Sénégal). Primates, 59:235–241. doi: 10.1007/s10329-017-0647-2.
Baldwin, P. (1979). The natural history of the chimpanzee (Pan troglodytes verus) at Mt. Assirik, Senegal. University of Stirling, Stirling. Thesis doctoral of the University of Sterling, 284 pp.
Baldwin, P., Sabater, P., McGrew, W. et Tutin, C. (1981). Comparisons of nests made by different populations of chimpanzees (Pan troglodytes). Primates 22:474–486. doi: 10.1007/BF02381239.
Baldwin, P., McGrew, W. et Tutin, C. (1982). Wide ranging chimpanzees at Mt. Assirik, Senegal. International Journal of Primatology, 3:367–385. doi : 10.1007/BF02693739.
Basabose, A. K. et Yamagiwa, J. (2002). Factors affecting nesting site choice in chimpanzees at Tshibati, Kahuzi-Biega National Park: influence of sympatric gorillas. International Journal of Primatology, 23(2):263-282. doi: 10.1023/A:1013879427335.
Brownlow, A., Plumptre, A. J., Reynolds, V. et Ward, R. (2001). Sources of variation in the nesting behavior of chimpanzees (Pan Troglodytes schweinfurthii) in the Budongo Forest, Uganda. American Journal of Primatology, 55(1):49-55. doi: 10.1002/ajp.1038
Brncic, T.M., Amarasekaran, B. et McKenna, A. (2010). Final report of the Sierra Leone National Chimpanzee Census Project. Tacugama Chimpanzee Sanctuary, Freetown, Sierra Leone, 118 pp.
Diallo, B. (2018). Etude du comportement de nidification du chimpanzé de l’Afrique de l’Ouest, Pan troglodytes verus, à Bantankiline (Kédougou, Sénégal). Mémoire de master en Écologie et Gestion des Ecosystemes, Départemet de Biologie animale, Faculté des Sciences et Techniques de l’Universite Cheikh Anta Diop Daka (Sénégal), 34 pp.
Dutton, P., Moltchanova, E. et Chapman, H. (2016). Nesting ecology of a small montane population of the Nigerian/Cameroon chimpanzee (Pan troglodytes ellioti) in Nigeria. Folia Primatologica, 87:361–374. doi: 10.1159/000454921.
Fleury-Brugière, M. (2000). Estimation préliminaire de la population de chimpanzés de la Zone Intégralement Protegée-Mafou du Parc National du Haut Niger, République de Guinée. Rapport de Projet de la Composante Parc National du Haut Niger du Programme AG.
Fruth, B. et Hohmann, G. (1993). Ecological and behavioral aspects of nest building in wild bonobos (Pan paniscus). Ethology, 94:113-126. doi: 10.1111/j.1439-0310-1993.tb00552.
Furuichi, T. et Hashimoto, C. (2004). Botanical and Topographical Factors Influencing Nesting-Site Selection by Chimpanzees in Kalinzu Forest, Uganda. International Journal of Primatology, 25:755–765. doi: 10.1023/B:IJOP.0000029121.25284.7f.
Goodall, J. (1962). Nest building behavior in the free ranging chimpanzee. Annals of New York Academy of Sciences, 102:455–467. doi: 10.1111/j.1749-6632.1962.tb13652.x
Groves, C. et Sabater, P. (1985). From ape's nest to human fix-point. Man, 20:22–47. doi: 10.2307/2802220
Hakizimana, D., Buckers, A., Brotcorne, F. et Huynen, M. (2015). Characterization of nest sites of chimpanzees (Pan troglodytes schweinfurthii) in Kibira National Park, Burundi. African Primates 10:1–12. https://hdl.handle.net/2268/188392
Ham, R. (1998). Nationwide chimpanzee survey and large mammal survey, Republic of Guinea. Unpublished report for the European Union, Guinea-Conakry, 115 pp.
Heinicke, S., Mundry, R., Boesch, C., Amarasekaran, B., Barrie, A. et al. (2019a). Advencing conservation planning for werstern chimpanzees using IUCN SSC A.P.E.S.- the case of a taxon-specific database. Environmental Research Letters, 14:064001. doi: 10.1088/1748-9326/ab1379.
Heinicke, S., Mundry, R., Boesch, C., Hockings, K.J., Kormos, R., Ndiaye, P.I., Tweh, C.G., Williamson, E.A., Kühl, H.S. (2019b). Towards systematic and evidence – based conservation planning for western chimpanzees. American Journal of Primatology, 81:1-13. doi: 10.1002/ajp.23042.
Hernandez-Aguilar, R. (2009). Chimpanzee nest distribution and site reuse in a dry habitat: implications for early hominin ranging. Journal of Human Evolution, 57: 350–364. doi: 10.1016/j.jhevol.2009.03.007.
Hernandez‐Aguilar, R., Moore, J. et Stanford, C. (2013). Chimpanzee Nesting Patterns in Savanna Habitat: Environmental Influences and Preferences. American Journal of Primatology, 75:979–994. doi:10.1002/ajp.22163.
Hockings, K.J., Anderson, J.R. et Matsuzawa, T. (2009). Use of wild and cultivated foods by chimpanzees at Bossou, Republic of Guinea: feeding dynamics in a human-influenced environment. American Journal of Primatology, 71:636–646. doi: 10.1002/ajp.20698.
Humle, T. (2003). "Culture and variation in wild chimpanzee behaviour: A study of three communities in West Africa". PhD. Dissertation, University of Stirling, Scotland, UK.
Humle, T., Boesch, C., Campbell, G., Junker, J., Koops., K., Kuehl, H. et Sop, T. (2016). Pan troglodytes ssp. verus (errata version published in 2016). The IUCN Red List of Threatened Species 2016: e. T15935A102327574. doi:10.2305/IUCN.UK.2016-2.RLTS.T15935A17989872.en.
Junker J., Blake S., Boesch C., Campbell G., du Toit L., et al. (2012). Recent decline in suitable environmental conditions for African great apes. Diversity and Distributions, 18:1077–1091. doi: 10.1111/ddi.12005.
Kamilar, J. (2009). Environmental and geographic correlates of the taxonomic structure of primate communities. American Journal of Physical Anthropology, 139: 382–393. doi: 10.1002/ajpa.20993.
Koops, K., McGrew, W., De Vries, H. et Matsuzawa, T. (2012). Nest-Building by Chimpanzees (Pan troglodytes verus) at Seringbara, Nimba Mountains: Antipredation, Thermoregulation, and Antivector Hypotheses. International Journal of Primatology, 33:356–380. doi: 10.1007/s10764-012-9585-4.
Koops, K., Humle, T., Sterck, E. et Matsuzawa, T. (2007). Ground-nesting by the chimpanzees of the Nimba Mountains, Guinea: environmentally or socially determined? American Journal of Primatology, 69:407–419. doi: 10.1002/ajp.20358.
Kormos, R., Boesch, C., Bakarr, M. et Butynski, T. (2004). Chimpanzés d'Afrique de l'Ouest. Etat de conservation de l'espèce et plan d'action. Groupe de spécialistes des primates de la CSE de l'UICN, Gland, Suisse et Cambridge, Royaume-Uni. ix + 2.
Kormos, R. et Boesch, C. (2003). Regional Action Plan for the Conservation of Chimpanzees in West Africa. IUCN/SSC Action Plan. Washington, Conservation International, 25 pp.
Kühl, H.S., Sop, T., Williamson, E.A., Mundry, R., Brugiere, D., et al. (2017). The Critically Endangered western chimpanzee declines by 80%. American Journal of Primatology, 79:1–15. doi: 10.1002/ajp.22681.
Kühl, H., Maisels, F., Ancrenaz, M. et Williamson, E. (2008). Best Practice for Surveys and Monitoring of Great Ape Population. Gland, IUCN SSC Primate Specialist Group, 27 pp.
Lehman, S. et Fleagle, J. (2006). Biogeography and Primates. In A Review of Primate Biogeography. Springer US, 58 pp. doi: 10.1007/0-387-31710-4_1.
Lindshield, S., Danielson, B., Rothman, J. et Pruetz, J. (2017). Feeding in fear? How adult male western chimpanzees (Pan troglodytes verus) adjust to predation and savanna habitat pressures. American Journal of Physiology and Anthropology, 163:480–496. doi: 10.1002/ajpa.23221.
McGrew, W. (2017). Field studies of Pan troglodytes reviewed and comprehensively mapped, focusing on Japan’s contribution to cultural primatology. Primates, 58:237–258. doi:10.1007/s10329-016-0554.
McLennan, M.R. (2008). Beleaguered chimpanzees in the agricultural district of Hoima, Western Uganda. Primate Conservation, 23:45–54. doi: 10.1896/052.023.0105.
Ndiaye, P.I., Lindshield, S.M., Badji, L., Pacheco, L., Wessling, E.G., Boyer, K.M. et Pruetz, J.D. (2018a). Survey of chimpanzees (Pan troglodytes verus) outside protected areas in southeastern Senegal. African Journal of Wildlife Research, 48(1): 1–14. doi: 10.3957/056.048.013007.
Ndiaye, P., Badji, L., Lindshield, M. et Pruetz, D. (2018b). Nest-Building Behaviour by Chimpanzees (Pan troglodytes verus) in the Non-Protected Area of Diaguiri (Kedougou, Senegal): Implications for Conservation. Folia Primatologica, 89:316‐326. doi: 10.1159/000490945.
Ndiaye, P., Galat, G., Galat-Luong, A. et Nizinski, G. (2013a). Note on the seasonal use of lowland and highland habitats by the West African Chimpanzee Pan troglodytes verus (Schwarz, 1934) (Primates: Hominidae): Implications for its conservation. Journal of Threatened Taxa. 5(2):3697-3700. doi: 10.11609/JoTT.o3229.3697-700.
Ndiaye, P., Galat-Luong, A., Galat, G. et Nizinski, G. (2013b). Endangered West African Chimpanzees Pan troglodytes verus (Schwarz, 1934) (Primates: Hominidae) in Senegal prefer Pterocarpus erinaceus, a threatened tree species, to build their nests: implications for their conservation. Journal of Threatened Taxa, 5(17):5266-5272. doi: 10.11609/JoTT.o3603.5266-72.
Ndiaye PI (1999). Biogéographie et éléments d’écologie du chimpanzé, Pan troglodytes verus, au Sénégal. Mémoire de Diplôme d’Etudes Approfondies de l’Université Cheikh Anta Diop de Dakar (Sénégal), 61pp.
Ndimuligo, S. (2007). Assessment of chimpanzee (Pan troglodytes) population and habitat in kwitanga forest, western Tanzania. Master of Science in Resource Conservation Biology. University of Witwatersrand, Johannesburg, South Africa:76.
Oates, J.F., Tutin., C.E.G., Humle, T., Wilston, M.L., Baillie, J.E.M., et al. (2008). Pan troglodytes. In IUCN 2012. IUCN Red List of Threatened Species. Version 2012.2. www.iucnredlist.org (accessed February 2017).
Potts, K., Watts, D. et Wrangham, R. (2011). Comparative Feeding Ecology of Two Communities of Chimpanzees (Pan troglodytes) in Kibale National Park, Uganda. International Journal of Primatology. 32:669–690. doi: 10.1007/s10764-011-9494-y.
Pruetz, J. (2006). Feeding ecology of savanna. Cambridge University Press:161–182.
Pruetz, J.D., Fulton, S.J., Marchant, L.F., McGrew, W.C., Schiel, M. et Waller, M. (2008). Arboreal nesting as anti-predator adaptation by Savanna Chimpanzees (Pan troglodytes verus) in southeastern Senegal. American Journal of Primatology, 70:393–401. doi: 10.1002/ajp.20508.
Pruetz, J. D., Marchant, L. F., Arno, J. et McGrew, W. C. (2002). Survey of savanna chimpanzees (Pan troglodytes verus) in southeastern Senegal. American Journal of Primatology, 58(1):35-43. doi: 10.1002/ajp.10035.
Ross, C. et Reeve, N. (2011). Survey and census methods: population distribution and density. In J.M. Setchell & D.J. Curtis (Eds), Field and laboratory methods in primatology: a practical guide, 2nd edn (pp. 111-132). Cambridge, U.K.: Cambridge University Press.
Samson, D. et Hunt, K. (2014). Chimpanzees Preferentially Select Sleeping Platform Construction Tree Species with Biomechanical Properties that Yield Stable, Firm, but Compliant Nests. PLoS ONE, 9(4):e95361. doi: 10.1371/journal.pone.0095361.
Sept, J.M., King, B.J., McGrew, W.C., Moore, J., Paterson, J.D., Strier, K.B., Uehara, S., Whiten, A. et Wrangham, R.W. (1992). Was there no place like home? A new perspective on early hominid archaeological sites from the mapping of chimpanzee nests. Current Anthropology 33:187-207. doi :10.1086/204050
Stanford, C. et O’Malley, R. (2008). Sleeping tree choice by Bwindi chimpanzees. American Journal of Primatology, 70:642–649. doi:10.1002.ajp.20539.
Stewart, F. (2011). Brief communication: Why sleep in a nest? empirical testing of the function of simple shelters made by wild chimpanzees. American Journal of Physical Anthropology, 146:313–318. doi:10.1002/ajpa.21580.
Stewart, F. et Pruetz, J. (2013). Do Chimpanzee Nests Serve an Anti-Predatory Function?: Anti-Predatory Nest Function. American Journal of Primatology, 75:593–604. doi: 10.1002/ajp.22138
Stewart, F., Pruetz, J. et Hansell, M. (2007). Do Chimpanzees Build Comfortable Nests? American Journal of Primatology, 69:1–10. doi: 10.1002/ajp.20432
Thiam, A.I. (2015). Contribution au suivi des nids de chimpanzé, Pan troglodytes verus (Schwarz, 1934) dans la zone non protégée de Diaguiri (Kédougou, Sénégal). Mémoire de master de la Faculté des Sciences et Techniques de l’Université Cheikh Anta Diop de l’Université Cheikh Anta Diop de Dakar, 34pp.
Torres, J., Brito, J.C., Vasconcelos, M.J., Catarino, L., Gonçalves, J. et Honrado, J. (2010). Ensemble models of habitat suitability relate chimpanzee (Pan troglodytes) conservation to forest and landscape dynamics in Western Africa. Biological Conservation, 143:416–425. doi: 10.1016/j.biocon.2009.11.007
Ukpong, E.E., Jacob, D.E., Ibok, P.B., et Nelson, I. (2013). Nest building behavior of chimpanzee (Pan troglodytes Blumenbach, 1799) at Filinga Range of Gashaka Gumti National Park, Nigeria. ARPN Journal of Science and Technology, 3:714-717.
Wrogemann, D. (1992). "Wild chimpanzees in Lopé, Gabon: Census method and habitat use". PhD. Dissertation, University of Bremen, Germany.

