- Accueil
- Volume 90 - Année 2021
- Articles
- Diversité des lichens du Parc National de Djurdjura (Algérie)
Visualisation(s): 3729 (10 ULiège)
Téléchargement(s): 224 (0 ULiège)
Diversité des lichens du Parc National de Djurdjura (Algérie)
Diversity of lichens in Djurdjura National Park (Algeria)

Document(s) associé(s)
Version PDF originaleRésumé
Le but de l'étude est d'inventorier les lichens (corticoles, saxicoles et terricoles) du secteur de Tikjda, dans le Parc National du Djurdjura (PND) qui comprend des cédraies pures, et une réserve de Pinus nigra ssp. Mauretanica (espèce endémique de pin noir).
Les résultats montrent qu'il existe 70 taxons répartis en 10 ordres, 21 familles et 39 genres. Les familles les plus riches sont celles des Collemataceae et des Physciaceae avec 9 taxons et 5 genres chacune, notamment deux espèces rares : Bryoria fuscescens (Gyeln.) Brodo & D.Hawksw, rencontrée dans une seule station et sur un seul phorophyte : Cedrus atlantica et Leptogium cyanescens (Nyl, ex Crombie) Degel, nouvelle espèce non encore signalée en Algérie.
Abstract
The purpose of the study is to take an inventory of the lichens (corticolous, saxicolous and terricolous) of the Tikjda sector, in the Djurdjura National Park (DNP), which includes pure cedar groves, and a reserve of Pinus nigra ssp. mauretanica (endemic species of black pine). We collected lichens.
The results show that there are 70 taxa divided into 10 orders, 21 families and 39 genera. The richest families are those of Collemataceae and Physciaceae with 9 taxa and 5 genera each, with in particular two rare species : Bryoria fuscescens (Gyeln.) Brodo & D. Hawksw, found in a single station and on a single phorophyte: Cedrus atlantica and Leptogium cyanescens (Nyl, ex Crombie) Degel, a new species not yet reported in Algeria.
Table des matières
1. Introduction
1La région méditerranéenne s'individualise par de nombreuses originalités physiques et écologiques qui confèrent à sa biodiversité une valeur patrimoniale mondiale (Daki, 2004). D’ailleurs, près de la moitié de la superficie occupée par la forêt méditerranéenne au Maghreb est dominée par la forêt à conifères (Le Houérou, 1990), notamment l'essence endémique et emblématique, en l’occurrence, le cèdre de l'Atlas (Cedrus atlantica), qui existe à l'état spontané en Afrique du Nord (Maire, 1926), comme c’est le cas dans la région de Tikjda (Massif central du Djurdura) (PND).
2Les forêts, offrent aux lichens de nombreuses niches écologiques et même s’ils ne constituent qu’une part relativement faible de la biomasse, la diversité de ces derniers n’en est pas moindre pour autant (Scheidegger et Clerc, 2002) car les forêts naturelles ou proches de l’état naturel, peuplées de vieux et de très vieux arbres, se trouvant dans des zones non polluées, voire modérément polluées, de même que les anciens peuplements forestiers répartis en bouquets comme ceux des parcs, sont des habitats d’une valeur particulière pour les lichens épiphytes (Wirth et al. 1996).
3Selon le Ministère de l’Aménagement du Territoire et de l’Environnement (MATE), il n’existe que quelques rares travaux qui ont abordé la végétation lichénique algérienne MATE (2014) : Nylander (1854), Flagy (1888, 1891a, 1891b, 1892, 1895, 1896), Zahlbroukmer (1904), Warner (1949), Faurel et al. (1954), Werner (1955). Néanmoins on signale récemment la mise à jour de l’inventaire des lichens d’Algérie d’Aït Hammou et al. (2014) ainsi que la synthèse historique et bibliographique de l’exploration lichénologique en Algérie d’Amrani et al. (2015) ; Amrani et al. (2018). Aussi, des inventaires de la richesse lichénique de différentes régions d’Algérie ont été réalisés : Semadi et al. (1997), Rebbas et al. (2011), Serradj et al. (2013), Khedim (2014), Boutabia et al. (2015), Merabti et al. (2018), Ali Ahmed et al. (2017), Hamralaine et al. (2019), Yahia et Marniche (2019)… et c’est dans ce sens que notre article se veut d’apporter sa contribution à l’études des lichens d’Algérie et plus précisément dans le Parc national du Djurdjura (PND), considéré comme une réserve de la biosphère en abordant aussi bien les lichens épiphytes, c’est à dire corticoles, que les lichens saxicoles et terricoles de la région de Tikjda (PND), surtout que depuis la découverte d’Amygdalaria tellensis par Esnault et Roux (1987), aucune autre publication scientifique n’a été réalisée sur les lichens de ce parc, qui semble contenir près de 52 espèces lichéniques sur son territoire (PND, 2015).
2. Site d’étude
4Le Parc National du Djurdjura (PND) est situé au nord de l'Algérie, dans la région de la Grande Kabylie à 140 km au sud-est d'Alger et à 50 km de la mer Méditerranée. Le territoire de ce parc est aménagé selon un tronc d'arc, orienté d'Est en Ouest sur 50 km de long et sur 03 à 10 km de large (figure 1).
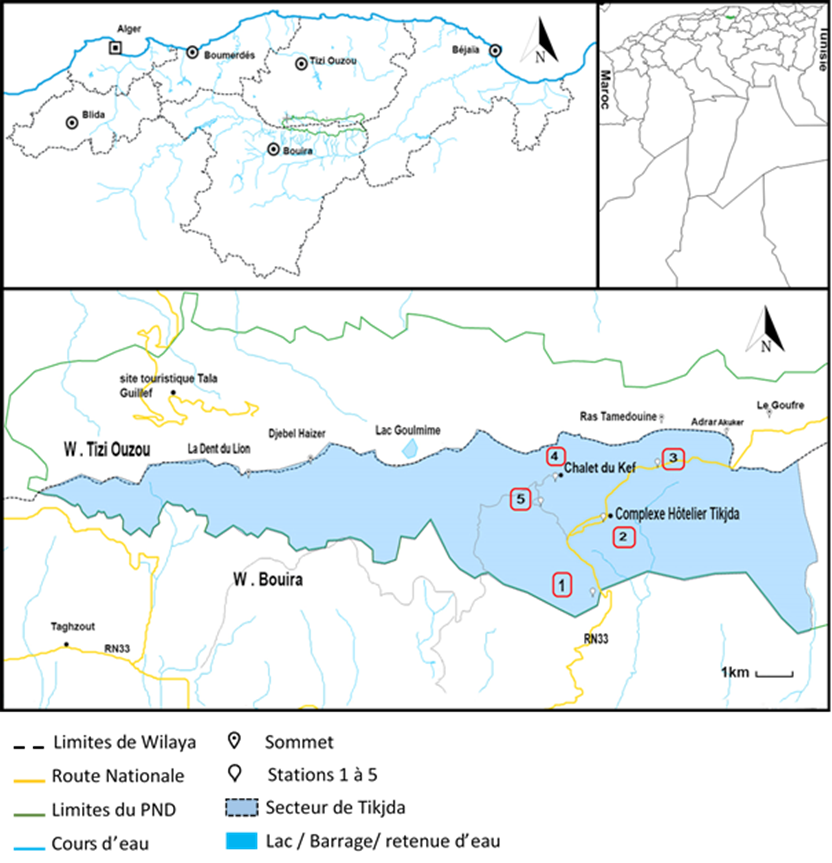
Figure 1 : Carte géographique représentant le Parc national de Djurdjura (en vert) : la partie bleue représente le secteur de Tikjda, les stations visitées sont indiquées (de 1 à 5) sur la carte (site 3).
5Il est considéré comme un bassin de biodiversité. D'une superficie de 18 550 ha, il occupe à la fois une partie importante des deux wilayas, en l'occurrence Tizi Ouzou avec 10 000 ha et Bouira avec une extension de 8 000 ha. Officiellement, il a été désigné parc national par le décret présidentiel n ° 83-460 du 23 juillet 1983 et érigé en réserve de biosphère et patrimoine naturel par l'UNESCO en 1997. Occupant la région centrale du Tellien, le parc national de Djurdjura est un écosystème important. Il est divisé en cinq secteurs dont le secteur de Tikjda sur lequel se porte notre étude (PND, 2015).
6La région de Tikjda est située dans le bioclimat humide avec une variante fraîche, en raison de son emplacement sur le versant sud du Djurdjura, la région est directement influencée par les vents chauds (siroco) et la période de neige peut atteindre quatre mois dans les meilleures années (Asmani, 2003). L'absence de stations météorologiques dans la réserve rend la caractérisation du climat difficile. Il a une période de sécheresse de 4 mois (juin à septembre) et une pluviométrie moyenne estimée à 719,7 mm / an quant aux températures mensuelles, elles varient de 7,7 °C à 24,5 °C (site 3).
7Cinq stations ont été prospectées ; dont les principales caractéristiques sont consignées dans le tableau 1.
Tableau 1 : Principales caractéristiques des cinq stations prospectées
|
Stations |
Localisation |
Orientation générale |
Longitude |
Latitude |
Altitude (en mètres) |
Support |
|
1 |
Lisière de forêt |
Versant Sud/Est |
4.1265 |
36.4247 |
1230 |
Chêne vert, genévrier et cèdre de l’Atlas |
|
2 |
Musée de Tikjda, complexe hôtelier de Tikjda |
Versant Sud/Est |
4.12634 |
36.447352 |
1433 |
Cèdre de l’Atlas |
|
3 |
Falaise de Tikjda |
Versant Nord |
4.143108 |
36. 460195 |
1646 |
Roches et dalles calcaires ensoleillées en été mais qui subissent des écoulements assez prolongés car elles sont recouvertes de neige durant l’hiver |
|
4 |
Auberge de Taghzart (chalet du Kef) |
Versant Nord/Ouest |
4.111642 |
36.4569 |
1564 |
Vieux Cèdres de l’Atlas, terre et roches ombragées calcaires |
|
5 |
Route de Taghzart |
Versant Sud/Ouest |
4.107253 |
36.451108 |
1481 |
Vieux cèdres de l’Atlas, vieux pins noirs de la réserve de Tigounatine, rochers et pierres calcaires (lit d’une rivière temporaire) |
3. Méthodologie
8Sur terrain, les lichens sont d’abord repérés, de manière à ce qu’on choisisse les spécimens dont le thalle est propre et bien développé avec des fructifications typiques claires et non altérées. Ils sont ensuite collectés à la main et ce pour les lichens de type foliacé (Van Haluwyn et al., 2013), mais également pour les lichens terricoles (Van Haluwyn et al., 2012). Quant aux lichens corticoles, il est utile de se munir d’une lame de couteau pour retirer délicatement un morceau d'écorce qui supporte le thalle (Van Haluwyn et al., 2013). Quand il s’agit d’un lichen de type saxicole, on prend même un morceau de roche en se servant d’un burin et un marteau (Asta et al., 2016). Les lichens ainsi récoltés seront emballés individuellement dans du papier absorbant et mis dans de petites boîtes en plastique sur lesquelles on notera la date, le site (et station) ainsi que le support (Thiévant, 2001 ; Van Haluwyn et al., 2012 ; Van Haluwyn et al., 2013 ; Asta et al., 2016).
9L’identification des lichens s’effectue sur terrain et est amendée par l’identification au laboratoire à l’aide d’une loupe binoculaire et les réactions thallines (en utilisant des réactifs chimiques). Il est parfois nécessaires de réaliser des coupes transversales des thalles et de les observer au microscope optique (grossissement X100 et X400).
10Les références suivantes (guides et sites) ont été utilisées pour l'identification des lichens :
11Guide des Lichens de France, Lichens des sols (Van Haluwyn et al., 2012). Guide des Lichens de France, Lichens des arbres (Van Haluwyn et al., 2013). Guide des Lichens de France, Lichens des roches (Asta et al., 2016). Guide des Lichens, 359 espèces de lichens d’Europe (Tiévant, 2001), Images of British Lichens (Silverside, 2008). http://www.lichens.lastdragon.org/ (site 1), https://www.afl-lichenologie.fr (site 2). Les lichens identifiés (Tableau 2) suivent la nomenclature de Roux et al. (2017).
4. Résultats
12Les résultats relatifs à la flore lichénique du Parc national de Djurdjura dans le secteur de Tikjda sont exprimés selon le type de support (lichens corticoles, saxicoles ou terricoles) ; selon la physionomie (type de thalle : foliacé, crustacé etc.) et selon la classification systématique (ordres, familles et genres). Certaines déterminations de terrain ont été amendées lors des vérifications à la loupe binoculaire, et un nombre important de taxons supplémentaires (non identifiables sur place) ont pu être identifiés grâce à leur étude au laboratoire pour arriver à un total de 70 espèces classées par ordre alphabétique (Tableau 2).
Tableau 2 : Liste des taxons recensés au Parc national de Tikjda
|
# |
Nom |
Ordre |
Famille |
Type de thalle |
Substrat |
Station |
Support |
|
1 |
Acarospora glaucocarpa var. cervina (A. Massal) Cl. Roux |
Lecanorales |
Acarosporaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
2 |
Amandinea punctata (Hoffm.) Coppins & Scheid. |
Caliciales |
Caliciaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica, P. nigra |
|
3 |
Anaptychia ciliaris (L.) Körb ex. A. Massal |
Teloschistales |
Physciaceae |
Fructiculeux |
Corticole |
1; 4 |
Q. ilex; C. atlantica |
|
4 |
Aspicilia calcarea (L.) Mudd |
Pertusariales |
Megasporaceae |
Crustacé |
Saxicole |
5 |
Roche calcaire |
|
5 |
Aspicillia candida (Anzi) Hue |
Pertusariales |
Megasporaceae |
Crustacé |
Saxicole |
3; 4 |
Roche calcaire |
|
6 |
Bacidia rubella (Hoffm.) Massal |
Lecanorales |
Ramalinaceae |
Crustacé |
Corticole |
4 |
C. atlantica |
|
7 |
Bagliettoa calciseda (DC) Gueidan et Cl. Roux |
Verrucariales |
Verrucariaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
8 |
Bryoria fuscescens (Gyeln.) Brodo & D. Hawksw. |
Lecanorales |
Parmeliaceae |
Fructiculeux |
Corticole |
4 |
C. atlantica |
|
9 |
Caloplaca cerina (Ehrh. ex Hedw.) Th. Fr. |
Teloschistales |
Teloschistaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
10 |
Caloplaca crenulatella (Nyl.) H. Olivier |
Teloschistales |
Teloschistaceae |
Crustacé |
Saxicole |
3; 4 |
Roche calcaire |
|
11 |
Caloplaca flavescens (Huds.) Laundon |
Teloschistales |
Teloschistaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
12 |
Caloplaca flavorivescens (Wulfen) Dalla torre et Sarnth. |
Teloschistales |
Teloschistaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
13 |
Caloplaca flavorubescens (Huds.) J.R. Laundon |
Teloschistales |
Teloschistaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
14 |
Caloplaca pyracea (Ach.) Th. Fr Fam. |
Teloschistales |
Teloschistaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
15 |
Caloplaca teicholyta (Wedd.) Du Rietz |
Teloschistales |
Teloschistaceae |
Crustacé |
Saxicole |
4 |
Substrat artificiel |
|
16 |
Candelariella aurella (Hoffm.) Zahlbr. |
Candelariales |
Candelariaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
17 |
Cladonia digitata (L.) Hoffm. |
Lecanorales |
Cladoniaceae |
Complexe |
Corticole |
5 |
P. nigra |
|
18 |
Cladonia fimbriata (L.) Fr. |
Lecanorales |
Cladoniaceae |
Complexe |
Terricole |
4 |
Q. ilex; C. atlantica |
|
19 |
Collema crispum (Huds.) Weber ex. F. H. Wigg. |
Peltigerales |
Collemataceae |
Subfoliacé |
Terricole |
4 |
Roche calcaire |
|
20 |
Collema furfuraceum (Arnold) Du Rietz. |
Peltigerales |
Collemataceae |
Foliacé |
Corticole |
1; 2; 4 |
Q. ilex; C. atlantica |
|
21 |
Dermatocarpon miniatum (L.) W. Mann. |
Verrucariales |
Verrucariaceae |
Foliacé Umbiliqué |
Saxicole |
4 |
Roche calcaire |
|
22 |
Enchylium tenax (SW.) Gray |
Peltigerales |
Collemataceae |
Foliacé +/- Crustacé |
Terricole |
3; 4; 5 |
Roche calcaire |
|
23 |
Enchylium tenax var. ceranoides (Borrer) Degel. |
Peltigerales |
Collemataceae |
Foliacé globuleux |
Terricole |
4 |
Roche calcaire |
|
24 |
Lathagrium auriforme (With.) Otàlora et coll. |
Peltigerales |
Collemataceae |
Foliacé |
Saxicole |
5 |
Roche calcaire |
|
25 |
Lathagrium cristatum (L.) Othàlora et coll. |
Peltigerales |
Collemataceae |
Foliacé |
Saxicole |
3; 4; 5 |
Roche calcaire |
|
26 |
Lathagrium endulatum var. granulosum (Flot) Otàlora et coll. |
Peltigerales |
Collemataceae |
Foliacé |
Saxicole |
3 |
Roche calcaire |
|
27 |
Lecanora allophana Nyl. |
Lecanorales |
Lecanoraceae |
Crustacé |
Corticole |
2; 4 |
C. atlantica, P. nigra |
|
28 |
Lecanora cenisa Ach. |
Lecanorales |
Lecanoraceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
29 |
Lecanora chlarotera Nyl. |
Lecanorales |
Lecanoraceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
30 |
Lecanora conizaeoïdes Nyl. ex Comb. |
Lecanorales |
Lecanoraceae |
Crustacé |
Corticole |
2; 4 |
C. atlantica |
|
31 |
Lecanora crenulata Hook. |
Lecanorales |
Lecanoraceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
32 |
Lecanora dispersa (Pers.) sommerf. |
Lecanorales |
Lecanoraceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
33 |
Lecanora muralis subsp. versicolor (Pers.) Cl. Roux |
Lecanorales |
Lecanoraceae |
Crustacé |
|
3 |
Roche calcaire |
|
34 |
Lecidella eleochroma (Ach.) M. Choisy |
Lecideales |
Lecideaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
35 |
Lepraria membranacea (Dicks.) Vain. |
Lecanorales |
Stereocaulaceae |
Lepreux |
Saxicole |
5 |
Mousse |
|
36 |
Leprocaulon microscopicum (Vill.) Gams |
Teloschistales |
Leprocaulaceae |
Lepreux |
Terricole |
4 |
Roche calcaire |
|
37 |
Leptogium cyanescens (Rabenh.) Körb. |
Peltigerales |
Collemataceae |
Foliacé |
Saxicole |
4 |
Roche lit oued |
|
38 |
Lobothallia radiosa (Hoffm.) Hafellner chémo. radiosa |
Pertusariales |
Megasporaceae |
Crustacé |
Saxicole |
4 |
Roche calcaire |
|
39 |
Parmelina tilliacea (Hoffm.) Hale |
Lecanorales |
Parmeliaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
C. atlantica |
|
40 |
Pertusaria albescens (Huds.) M. Choisy & Werner var. albescens |
Pertusariales |
Pertusariaceae |
Crustacé |
Corticole |
1; 2; 4; 5 |
C. atlantica |
|
41 |
Pertusaria albescens (Huds.) M. Choisy & Werner var. corallina |
Pertusariales |
Pertusariaceae |
Crustacé |
Corticole |
5 |
P. nigra |
|
42 |
Parmelia saxatilis (L.) Ach. |
Lecanorales |
Parmeliaceae |
Foliacé |
Corticole |
5 |
P. nigra |
|
43 |
Peltula euploca (Ach.) Poelt |
Lichinales |
Peltulaceae |
Squamuleux ombiliqué |
Saxicole |
4 |
Roche calcaire |
|
44 |
Phaeophyscia orbicularis (Neck.) Moberg. |
Lecanorales |
Physciaceae |
Foliacé |
Corticole |
2; 4 |
C. atlantica |
|
45 |
Physcia biziana (Massal.) Zahlbr. |
Lecanorales |
Physciaceae |
Foliacé |
Corticole |
2; 4; 5 |
C. atlantica |
|
46 |
Physcia leptalea (Ach.) DC. |
Lecanorales |
Physciaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
47 |
Physconia distorta (With.) J. R. Laundon |
Caliciales |
Physciaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
48 |
Physconia grisea (Lam.) Poelt |
Caliciales |
Physciaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
49 |
Physconia perisidiosa (Erichsen) Moberg |
Caliciales |
Physciaceae |
Foliacé |
Corticole |
4 |
C. atlantica |
|
50 |
Physconia venusta (Ach.) Poelt |
Caliciales |
Physciaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
51 |
Placidium rufescens (Ach.) A. Massal. |
Verrucariales |
Verrucariaceae |
Squamuleux |
Saxicole |
5 |
Roche calcaire |
|
52 |
Placidium squamulosum (Ach.) Breuss. |
Verrucariales |
Verrucariaceae |
Squamuleux |
Terricole |
4 |
Roche calcaire |
|
53 |
Placynthiella uliginosa (Schrad.) Coppins et James |
Baeomycetales |
Trapeliaceae |
Granuleux+/- Gelatineux |
Terricole |
4 |
Roche calcaire |
|
54 |
Placynthium nigrum (Huds.) Gray |
Peltigerales |
Placynthiaceae |
Crustacé |
Saxicole |
3 |
Roche calcaire |
|
55 |
Pleurosticta acetabulum (Necker) Elix & Lumbosch var. acetabulum |
Lecanorales |
Physciaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
|
56 |
Pseudevernia furfuracea (L.) Zopf |
Lecanorales |
Parmeliaceae |
Fructiculeux |
Corticole |
2; 4; 5 |
C. atlantica |
|
57 |
Psora vallesiaca (Schaer.) Timbal |
Lecanorales |
Psoraceae |
Squamuleux |
Saxiterricole |
4 |
Terre nue |
|
58 |
Ramalina farinacea (Hoffm.) Fürnrohr |
Lecanorales |
Ramalinaceae |
Fructiculeux |
Corticole |
1; 4 |
C. atlantica |
|
59 |
Scytinium lichenoides (L.) Otàlora et coll. |
Peltigerales |
Collemataceae |
Foliacé Gelatineux |
Saxicole |
4 |
Roche calcaire |
|
60 |
Squamarina cartilaginea (With.) P. James |
Lecanorales |
Squamarinaceae |
Squamuleux |
Saxicole |
3; 4 |
Roche calcaire |
|
61 |
Squamarina concrescens (Müll. Arg.) Poelt subsp. concrescens |
Lecanorales |
Squamarinaceae |
Squamuleux |
Saxicole |
5 |
Roche calcaire |
|
62 |
Squamarina lentigera (Weber) Poelt |
Lecanorales |
Squamarinaceae |
Squamuleux |
Terricole |
4 |
Terre moussues |
|
63 |
Squamarina oleosa (Zahlbr.) Poelt |
Lecanorales |
Squamarinaceae |
Squamuleux |
Saxicole |
5 |
Roche calcaire |
|
64 |
Toninia aromatica (Sm.) A. Massal |
Lecanorales |
Ramalinaceae |
Squamuleux Verruqueux |
Saxicole |
3; 4 |
Roche calcaire |
|
65 |
Toninia candida (Weber) Th. Fr. |
Lecanorales |
Ramalinaceae |
Squamuleux Verruqueux |
Saxicole |
3 |
Roche calcaire |
|
66 |
Toninia physaroides (Opiz) Zahlbr. |
Lecanorales |
Ramalinaceae |
Squamuleux Verruqueux |
Saxiterricole |
5 |
Roche calcaire |
|
67 |
Toninia rosulata (Anzi) H. Olivier |
Lecanorales |
Ramalinaceae |
Squamuleux Verruqueux |
Saxiterricole |
3; 4 |
Roche calcaire |
|
68 |
Toninia sedifolia (Scop.) Timdal |
Lecanorales |
Ramalinaceae |
Squamuleux Verruqueux |
Saxiterricole |
3; 4 |
Roche calcaire |
|
69 |
Verrucaria nigrescens Pers. |
Verrucariales |
Verrucariaceae |
Crustacé |
Saxicole |
3; 4 |
Roche calcaire, substrats artificiels |
|
70 |
Xanthoria parietina (L.) Th. Fr. |
Teloschistales |
Teloschistaceae |
Foliacé |
Corticole |
1; 2; 4; 5 |
Q. ilex; C. atlantica |
13Les lichens identifiés sont principalement soit corticoles, soit saxicoles, avec respectivement 30 taxons pour les saxicoles et 28 pour les corticoles (figure 2), suivis de 8 taxons terricoles qui se développent soit aux pieds des arbres, soit sur les mousses. On note aussi la présence de 4 taxons saxi-terricoles qui se trouvent sur les fissures des roches calcaires. Cependant selon le type de thalle, les lichens crustacés saxicoles sont les plus répandus (16 taxons par rapport aux 11 taxons crustacés corticoles (Tableau 2), suivis par les lichens foliacés et squamuleux avec respectivement 21 et 13 taxons. Quelques lichens sont fruticuleux (4 taxons) mais peu sont granuleux, lépreux ou complexes
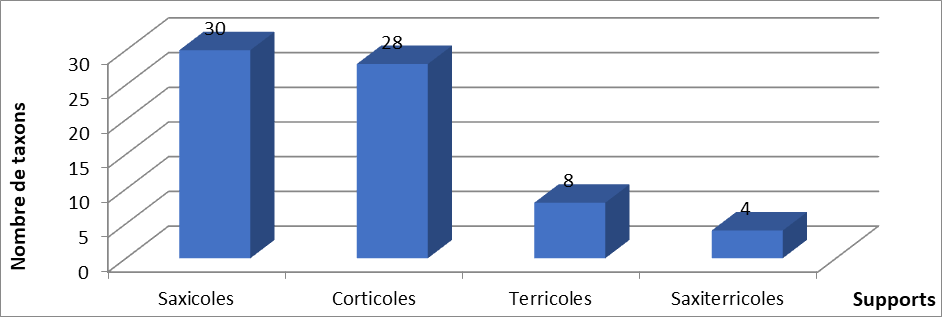
Figure n° 2 : Répartition des taxons recensés à Tikjda (Parc national de Djudjura) par type de support.
14Les lichens recensés à Tikjda (PND) sont répartis en 10 ordres, 21 familles. On observe, la dominance des lichens de l’ordre des Lecanorales qui représentent plus de 41% des lichens totaux, soit 29 taxons. Viennent par la suite les Peltigerales et les Teloschistales, qui représentent chacun, 14% des lichens. Les ordres les moins représentés, avec seulement un taxon, sont les Baeomycetales, Candelariales, Lecideales et Lichinales. Les familles les plus répandues (9 taxons chacune) sont les Collemataceae et des Physiaceae suivies par les Teloschistaceae, les Lecanoraceae ainsi que les Ramalinaceae. Certaines familles sont très peu représentées (1,7% des lichens totaux), telles que les Psoraceae, Peltulaceae, Trapeliaceae etc, avec un seul taxon par famille.
15Les 39 genres recensés dans la région de Tikjda démontrent la diversité des lichens de cette dernière. Les genres les plus répandus sont : Caloplaca et Lecanora avec respectivement 7 taxons chacun. Suivis par le genre Toninia (5 taxons), ensuite Physconia et Squamarina (4 taxons chacun). Il y aurait 26 genres qui sont représentés par un seul taxon tel que : Leprocaulon, Placynthium, Ramalina ou Leptogium.
5. Discussion
16Sur les 70 taxons recensés à Tikjda (PND), 29 taxons appartiennent aux Lecanorales, ordre connu pour être le plus riche en champignons lichénisés en termes de familles, de genres et d'espèces (Aït Hammou, 2015). Plus de 42% des 21 familles recensées sont de l’ordre des Lecanorales.
17Les thalles des lichens étudiés diffèrent par leur forme, 21 taxons sont foliacés bien plaqués sur les écorces pour la plupart comme les Physcia, Physconia, Phaeophyscia, ou Parmelia, Pleurosticta et Xanthoria. D’autres lichens sont foliacés ombiliqués (Dermatocarpon miniatum), foliacés gélatineux (Scytinium lichenoides), subfoliacés (Collema crispum ; Lathagrium cristatum et L. endulatum var. granulosum) ou foliacés globuleux (Enchylium tenax var. ceranoides) (Tableau 2). Squamarina concrescens subsp. concrescens est peu commune et ne possède pas ou rarement d’apothécies, a été trouvée dans la réserve de Pin noir (Tigounatine), station chaude, protégée, mais exposée au soleil. Psora vallesiaca est une espèce terricole qui n’a été rencontrée que dans la station 4, seul endroit de tout le parc National de Tikjda. C’est le cas aussi de Squamarina lentigera (Tableau 2).
18Du fait de la variation du paysage de la région de Tikjda entre forêts, principalement de cèdres et falaise de roche calcaire, il a été noté une prédominance des lichens saxicoles (30 taxons), suivis des lichens corticoles (28 taxons). On distingue ainsi ; les lichens crustacés (Aspicillia candida et A. calcarea), bien incrustés dans la roche, dalles et falaises calcaires, inclinées et bien ensoleillées en été mais qui se recouvrent de neige durant tout l’hiver notamment dans les stations 4 et 3 ; Verrucaria nigrescens qui envahit les roches avec la présence d’autres lichens encroûtants tels que Caloplaca crenulatella ou Placynthium nigrum, ce dernier, est facilement reconnaissable avec son hypothalle bien développé de couleur bleu-vert qui entoure le thalle crustacé non lobé au pourtour, ayant jusqu’à 12 cm de diamètre, formé de coussinets à granulations coralloïdes de teinte noire ou brun très foncé ayant l’aspect d’isidies. Placynthium nigrum est un lichen saxicole, plus ou moins calcicole, s’établissant sur des roches ou des substrats diversement calcaires, souvent peu élevés au-dessus du sol, soumis à des dépôts de rosée fréquents ou à des écoulements ou suintements d’eau temporaires postérieurs aux pluies et fontes des neiges, dans des stations à découvert, exactement comme il a été observé dans la station 3; toutefois ce lichen est capable de se développer aussi bien à l’ombre qu’au soleil (Asta et al., 2016 ; Tiévant, 2001).
19L’abondance des lichens crustacés saxicoles est due, d’une part au fait que le calcaire (nature des roches de ces stations), compact, ne se laisse envahir que par des lichens capables de s’y incruster, et d’autre part parce qu’il n’y a pas de concurrence sérieuse des autres types de lichens, exceptés ceux qui viennent s’installer dans les fissures ou les bases des roches, en l’occurrence, les lichens terricoles squamuleux verruqueux ou juste squamuleux tels que Enchylium tenax, Placidium squamulosum, Psora vallesiaca, Squamarina cartilaginea, Squamarina concrescens, Squamarina lentigera ou les Toninia.
20Quant à l’espèce crustacée saxicole Caloplaca teicholyta (Wedd.) Du Rietz, qui est un lichen commun, elle a été trouvée dans la station 4, sur un support artificiel (vieille bâtisse en béton) ; il a même été observé des apothécies saillantes d’un rouge rouillé à rebord propre et distinct, alors que selon la littérature, celles-ci sont le plus souvent absentes (Asta et al., 2016). Justement du fait que ce soit une littérature européenne qui a été utilisée pour identifier les espèces, et en l’absence d’analyse moléculaire, il n’est pas à écarter que certains taxons morphologiquement similaires présents en Algérie pourraient représenter d’autres espèces, peut-être même nouvelles pour la science.
21Les lichens sont souvent des colonisateurs ; ils contribuent au développement d'une ébauche de sol. D’après Vust et al. (2015), 8% de la surface terrestre sont couverts d'une végétation dominée par les lichens, non seulement dans la toundra arctique et dans les montagnes, mais aussi dans les pays semi-arides, où ils forment une croûte biologique qui protège le sol de l'érosion du vent, contribuent de façon importante à la biodiversité et participent à la rétention de l'eau de pluie. D’ailleurs même à Tikjda (PND), ils ont une large répartition et le nombre de lichens terricoles ou saxi-terricoles n’est pas négligeable : 8 et 4 taxons respectivement.
22Comme l’explique Bricaud (2006), les lichens sont présents dans la plupart des milieux terrestres de notre environnement. Dépourvus de tout organe leur permettant de capter et de transporter l’eau, ils sont essentiellement tributaires de la disponibilité de celle-ci. Ce facteur est prépondérant dans la distribution des espèces, et domine les autres facteurs climatiques, comme l’éclairement ou la température, lesquels interviennent de façon indirecte en compensation ou aggravation du facteur hydrique. Toutefois, concernant les lichens corticoles, la nature de l’essence servant de support (phorophyte) a un rôle également déterminant pour leur distribution. Cette action est notamment liée aux facteurs physicochimiques des écorces, comme l’acidité ou la porosité du substrat (Bricaud, 2006). Ainsi, les essences résineuses sont nettement plus acides comme les Pinus, les Quercus sont modérément acides, Populus et Juglus sont à écorces peu ou pas acides.
23C’est ainsi que la flore lichénique corticole de la réserve Tigounatine au Djurdjura appelée aussi la réserve de Pins noirs, est nettement pauvre comparée à la végétation présente sur les rhytidomes des essences feuillues rencontrées dans la station de Tikjda. Ceci est dû d’une part à l’acidité des écorces résineuses comme celle des divers Pinus, et d’autre part du fait que leur écorce se détache, ne favorisant pas l’installation d’une flore lichénique dont la croissance est connue pour être très lente. Mais bien que le pin noir de Tigounatine soit très pauvre en lichens, il abrite toutefois la var. corallina de l’espèce Pertusaria albescens (Huds.) M. Choisy & Werner, qui n’a été rencontrée que sur ce phorophyte lui-même présent que dans cette station.
24Selon Vust et al. (2015), les vieux arbres sont très intéressants car ils présentent plusieurs micro-habitats favorables aux lichens corticoles. Ils ont une écorce épaisse, profondément crevassée, parfois couverte de mousses, parfois imprégnée de poussière. Certaines parties profondes de ces fissures sont à l'abri de l'écoulement de la pluie ; si l'arbre est penché, c'est tout un flanc qui est en surplomb (Vust et al., 2015). L'arbre peut aussi présenter des parties mortes ou être creux, sans être mort pour autant. Il présente alors du bois mort spongieux. Enfin, selon l'endroit où se trouve l'arbre, en forêt ou en campagne, les espèces ne seront pas les mêmes (Vust et al., 2015). D’ailleurs 89% des lichens corticoles recensés ont été rencontré sur les vieux cèdres de Tikjda (PND).
25Bricaud en 2006, lors de sa prospection de la forêt de Saint Dumas en France et de deux sites voisins afin d’en inventorier les espèces de lichens et de donner des éléments sur les groupements qu’ils y forment, avait rapporté que la porosité du substrat influait grandement sur la composition des groupements lichéniques, et qu’ainsi les espèces lichéniques exigeantes en humidité avaient souvent du mal à s’installer, notamment dans les régions sèches, alors qu’elles ont été trouvées sur les arbres à écorces altérées voisines. Face à ces constatations, Bricaud (2006) a rapporté que d’une façon générale, la question de la spontanéité ou du caractère « climacique » du phorophyte est secondaire, mais il a constaté aussi que, les essences introduites à la suite de reboisements, montrent des groupements lichéniques nettement plus pauvres que les essences locales. Ceci est, par exemple, le cas pour les feuillus : les écorces d’Ailanthus altissima par rapport à celles de Quercus pubescens ou pour les espèces résineuses : Cupressus sempervirens ou Pinus nigra austratica par rapport à Pinus sylvestris.
26L’espèce fruticuleuse Pseudevernia furfuracea est présente dans des milieux à atmosphère dépourvue de tout apport azoté et de pollution comme c’est le cas à Tikjda, elle a été récoltée sur des phorophytes très acidophiles, à savoir, les grands et vieux cèdres. Elle caractérise souvent les zones de fonds de vallons dans les secteurs à formation fréquente de brouillards, ce qui correspond au site de Tikjda. Pseudevernia furfuracea, est une espèce photophile localisée à la canopée des arbres (difficile d’accès d’ailleurs), elle disparait totalement en sous-étage (figure 3).

Figure 3 : Pseudevernia furfuracea localisée à la canopée des arbres de cèdre à Tikjda (Parc national de Djurdjura) à gauche et à droite un specimen de Bryoria fuscescens (Gyeln.) Brodo & D. Hawksw., mesurant plus d’une quatorzaine de centimètres, trouvé sur Cèdre, à Tikjda (Parc national de Djurdjura).
27La présence de Pseudevernia furfuracea est favorisée par l’utilisation de bois de conifères montagnards (vieux cèdres de Tikjda), ces bois étant porteurs de diaspores, celles-ci se sont dispersées et ont trouvé les conditions favorables à leur développement.Les lichens ont été utilisés pour la momification il y a plus de trois millénaires. D’ailleurs des échantillons de l’espèce fruticuleuse, Pseudevernia furfuracea ont été prélevés sur des momies et se trouvent dans des collections du monde entier ; présentée comme offrande, cette grande découverte a été trouvée par E. Brugsch en 1881, dans la tombe cachée de la XXIe dynastie à Dez el bahari, à Thebe en Egypte (Seaward et Sipman, 2006). Toutefois Seaward et Sipman (2006) pensent que P. furfuracea pourrait bien avoir été importé, probablement de Grèce car l’habitat optimal de cette espèce dans la région méditerranéenne, serait la forêt de montagne.
28Il a été noté cependant, une autre espèce à thalle fruticuleux, rencontrée dans une seule station : la cédraie au-dessus de l’auberge de Tikjda ; il s’agit de Bryoria fuscescens (figure 4). Cette espèce lichénique est propre à des phorophytes âgés, que sont les grands cèdres de cette station (de plus de 3 mètres de diamètre). Espèce absente dans la région de l’Est Algérien d’ailleurs (Serradj et al. (2013), Boutabia al. (2015)) et qui mériterait une protection particulière puisqu’il n’a été observé qu’une petite population d’une dizaine d’individus et qu’à une seule station dans tout le Parc National de Djurdjura. Rencontrée dans une ambiance forestière assez sombre et confinée, cette espèce nécessite plusieurs décennies d’évolution de l’écorce pour s’installer, et toute modification de son biotope bloquerait ou empêcherait son évolution au bénéfice d’autres lichens (Cuny et al., 2003). Le vieillissement des arbres et de leur écorce est un facteur important qui influe sur la dynamique et la composition des groupements lichéniques car de nombreuses espèces forestières sont substrato-hygrophiles et n’apparaissent que sur de très vieux phorophytes (Bricaud, 2006). Mais la protection des lichens, comme disent Vust et al., (2015) est une affaire de longue haleine. Avec des organismes se développant lentement, les effets de mesure de conservation peuvent prendre du temps jusqu'à ce qu'ils soient visibles.
29Dans cette étude nous signalons également un nouveau taxon pour la flore lichénique algérienne, puisqu’il s’agit d’une espèce jamais relevée auparavant (Rebbas et al., 2011 ; Serradj et al., 2013 ; Ait Hammou et al. 2014 ; Khedim, 2014, Boutabia al., 2015), en l’occurrence Leptogium cyanescens (Rabenh.) Körb., 1855. Espèce saxicole (figure 3) trouvée sur des roches périodiquement inondées (lit d’une rivière à la station n° 4), dont les coordonnées sont les suivantes : 36,456827 ° N et 4,111212 ° E. Cette espèce a déjà été rencontrée, au cours de notre étude, dans un autre site du parc national de Djurdjura (Aït Ouabane) à la base de troncs d’arbres. D’ailleurs Bungartz (2008), Silverside (2013) et Thüs et Schultz (2009) indiquent que l'habitat de Leptogium cyanescens peut être corticole et parfois saxicole, poussant sur des roches, abritées, de barrage et sur roche siliceuse ou basique humide, moussue ou nue, plus rarement calcaire, également sporadiquement ou périodiquement inondée au bord des rivières.

Figure n °4 : Thalle de Leptogium cyanescens observé sous une loupe binoculaire: a: isidies formant une croûte continue tout au long du périmètre du lobe, ainsi que la présence d'isidies laminales; b: image montrant la différence entre le thalle largement divisé de Scytinium lichenoides à gauche et le thalle +/- profondément lobé de Leptogium cyanescens à droite; c: image au microscope optique de la coupe transversale d'un thalle de Leptogium cyanescens (grossissement X40) observée dans du rouge congo ; d: image au microscope optique du cortex supérieur dans un fragment de thalle (grossissement X40) observée dans de l’eau. e : détail d'un fragment de thalle humide.
30Leptogium cyanescens a un thalle de type foliaire, noir grisâtre lorsqu'il est sec (fig. 4 a) ou vert olive à l’état humide (fig. 4 e). Ses lobes jamais enflés, très fins, à contour ± orbiculaire ; distincts, allongés, ± élargis et aplatis, s'étendant régulièrement ; ce qui correspond à la description donnée par Bungartz (2008). On observe des isidies denses (fig. 4 a, b et e), laminales à marginales, généralement cylindriques à aplaties et pouvant devenir lobulées, simples mais se ramifiant généralement, concolores au thalle ou plus sombres, pouvant former une croûte continue sur les lobes âgés. Les apothécies sont inconnues (non observées).
31Otálora et al. (2014) ont fourni une clé pour les genres de la famille des Collemataceae, utilisant la présence / l'absence d'un eu-cortex. Ce critère était auparavant utilisé comme caractère cardinal définissant les genres de la famille et est toujours utilisé, mais uniquement en combinaison avec d'autres traits tels que la taille du thalle et du lobe, la structure anatomique du thalle et la préférence d'habitat (Otálora et al. 2014).
32Au sein de la famille des Collemataceae, il existe deux genres de lichens foliacés contenant des cyanobactéries, à savoir Collema et Leptogium. Selon l'anatomie du thalle et la présence du cortex, sachant que contrairement aux Collema, seuls les Leptogium ont un cortex cellulaire bien différencié, (cortex supérieur et inférieur constitués de couche unique de cellules ± isodiamétriques (fig. 4 c et e) comme il a été rapporté par Thüs et Schultz (2009), et en plus d’une médulle non paraplectenchymateuse et du Nostoc en chaîne (fig. 4 c), et également selon la description morphologique et l'habitat donnés ci-dessus ; nous pouvons établir que nous sommes bel et bien en présence de Leptogium cyanescens (Rabenh.) Körb. = Leptogium caesium = Leptogium tremelloides. Notons les contours des groupes de cellules (exemple entouré d'une ligne pointillée dans la figure 4 d), qui suggèrent une subdivision par des septa (cloisons) adjacents de l’espèce Leptogium cyanescens comme le rapportent Sanders et De los Ríos (2019). Remarquons également les lobes translucides lorsqu'ils sont mouillés (fig. 3 e), comme le signale Thüs et Schultz (2009) dans leur travail sur les clés de certaines espèces ainsi que leurs descriptions.
33Bungartz (2008), décrit les isidies de l’espèce Leptogium cyanescens comme étant nombreuses, de forme et de taille assez variables, cylindriques et généralement ramifiées ou aplaties, en écailles ou en lobules (phyllidies), abondantes sur la surface du thalle, mais de temps en temps le long du bord du thalle ; concernant les apothécies, selon lui, elles seraient rares, d’ailleurs nous ne les avons pas observées sur notre échantillon. Cependant, d’après le même auteur Leptogium cyanescens est facilement reconnue comme espèce à lobes larges (fig. 4 a, b) avec des isidies abondantes, rarement avec des apothécies.
34Le thalle du lichen gélatineux présente une morphologie spécifique, dite homéomère, une simple coupe dans le thalle nous avait permis de le vérifier (fig. 4 c et d). Mais l’existence de cortex permet de différencier le genre Leptogium qui en possède un, du genre Collema qui lui, au contraire, n’en possède pas. La vérification de l’existence d’autres organes reproducteurs (tel que les apothécies) ou non reproducteurs (tel que le tomentum ou les isidies) permet quant à elle l’identification de l’espèce (Bungartz, 2008 ; Otálora et al., 2014).
6. Conclusion et perspectives
35Le massif âgé de Tikjda nous a montré des taxons intéressants et où l’abondance de ces derniers est très variable : certains comme Pseudevernia furfuracea sont très abondants dans leur station alors que d’autres au contraire, montrent des populations bien adaptées (plus d’une dizaine de centimètres de long) mais limitées à quelques rares thalles, tel est le cas de Bryoria fuscescens. Les vieux boisements de Tikjda nous laissent espérer que de nouvelles espèces lichéniques intéressantes pourraient s’y installer. D’ailleurs il conviendrait comme le recommandent plusieurs lichénologues (Bricaud et Bauvet 2006) de laisser vieillir certains massifs pour augmenter les espèces caractéristiques de ce type de milieu, éviter de planter des essences étrangères à la région et proscrire toute exploitation forestière de ces bois, surtout les vieux arbres difformes qui sont un milieu d’élection pour certaines espèces rares, et ils doivent être préservés, de même que tous les bois morts sur pied ou tombés au sol ; pareil pour les arbres inclinés qui présentent des conditions écologiques différentes favorisant le développement de certaines espèces (Cuny et al., 2003). Il serait intéressant de cartographier certaines espèces qu’on pourrait qualifier comme espèces d’intérêt patrimonial vu leur rareté, ce qui pourrait permettre de suivre à long terme l’évolution de ces lichens.
7. Références
36Aït hammou M., 2015. Analyses Taxonomique et Écologique des Lichens de la Région de Tiaret. Thèse de Doctorat es sciences, Spécialité : Biologie, Option : Écologie, Université d’Oran Ahmed Ben Bella, 303p.
37Aït hammou M., Miara M. D., Rebbas K., Slimani R., Ravera S., Hamer El Ain S., 2014. Mise à jour de l’inventaire des lichens d’Algérie. Revue Ecologie- Environnement (10) : 75-103, Tiaret, Algérie.
38Ali Ahmed M., Brakni R., Hamel T., 2017. Lichen diversity of the Edough Peninsula, North East of Algeria. Bot.complut. 42 : 9-18.
39Amrani S., Nacer A., Noureddine N.-E., Seaward M. R. D., 2015. Lichenological exploration of Algeria: historical overview and annotated bibliography, 1799–2013. Willdenowia 45 (1) : 15–34.
40Amrani S., Seaward M.R.D., Sipman H.J.M., Feuerer T., 2018. Lichenological exploration of Algeria II: Checklist of lichenized, lichenicolous and allied fungi. Herzogia 31 : 817-892.
41Asmani A., 2003. Playdoyer pour le Pin Noir d’Algérie (Pinus nigra Arnold ssp. mauritanica Maire et Peyerimhff). Peuplements menacés. XII World Forestry Congress, Quebec, Canada.
42Asta J., Van Haluwyn C., Bertrand M., 2016. Guide des Lichens de France, Lichens des roches. Éditions Belin, 383 p.
43Cuny D., Davranche L., Van haluwyn C., Dossin M., Silvie J.P., Pailleux N., Vandamme L., Caous A.S., 2003. Apports de la cartographie des impacts de la pollution atmosphérique sur l’environnement à l’aide des lichens épiphytes dans le cadre de l’étude sentinelle. Air pur 64: 31-37.
44Boutatabia L., Telailia S., De Bélair G., 2015. Corticolous Lichen Flora on Quercus Suber L. in the wetlands of El Kala National Park (North-Eastern Algeria). Advances in Environmental Biology, 9 (4) : 360-372.
45Bricaud, O., 2006. Aperçu de la végétation lichénique du site de Saint Daumas (Var) et de deux stations de la plaine des Maures. Rapport WWF- Marseille, Tetra Park, CEEP-Var. Étude AFL. 49 pages + annexes.
46Bricaud, O., Bauvet, C., 2006. Apperçu de la végétation lichénique du bois de Païolive (Ardèche). Rapport AFL. 36 pages + annexes.
47Bungartz F., 2008. Cyanolichens of the Galapagos Islands- The genera Collema and Leptogium. Sauteria 15 : 139-158.
48Esnault J. ; Roux C., 1987. Amygdalaria tellensis (Lichens), nouvelle espèce du Tell algérien. Anales Jard. Bot. Madrid 44 (2) : 211-225.
49Faurel L., Ozenda P., Schotter G., 1954. Matériaux pour la flore lichénologique d’Algérie et de la Tunisie III (arthoniaceae, Dirinaceae, Roccellaceae). Bulletin de la Société d’Histoire Naturelle de l’Afrique du Nord 45 : 275-298, 2 plates. Records of c. 30 lichens, including two (Arthonia caesiella, A. pinastri) that were new to Algeria and North Africa.
50Flagey C., 1888. Herborisation lichénologique dans les environs de Constantine (Algérie). Rev. Mycol. (Toulouse) 1888 : 126–134.
51Flagey C. 1891a. Lichenes algerienses exsiccati. Rev. Mycol. (Toulouse) 1891 : 83–87.
52Flagey C. 1891b. Lichenes algerienses. Rev. Mycol. (Toulouse) 1891 : 107–117.
53Flagey C. 1892. Lichenes algerienses exsiccati. Cent. II. Rev. Mycol. (Toulouse) 1892 : 70–79.
54Flagey C. 1895. Lichenes algerienses. Rev. Mycol. (Toulouse) 1895 : 101–115.
55Flagey C. 1896. Catalogue des lichens d'Algérie. In : Battandier J. & Trabut L., Flore de l'Algérie 3 (1, 1). Alger : Adolphe Jourdan.
56Daki M., 2004. Étude De Faisabilité d'un Plan d'Aménagement Côtier en Méditerranée Marocaine, rapport final du Département de L’environnement. Ministère de L’aménagement du Territoire, de l’Eau et de L’Environnement, Rabat. Maroc, 6-113.
57Hamralaine A.S., Benhassaini H., Miara M.D., Aït Hammou M., Hamralaine O., 2019. Species diversity, chorology and conservation of the lichen flora in Tessala Montains forest (North-West Algeria). Fl. Medit. 29 : 75-91.
58Khedim R., 2014. À la découverte de la diversité lichénique : Contribution à l’étude des Lichens épiphytes du Parc National de Theniet-El-Had (Tissemsilt, Algérie). Ed. pof, 120 p.
59Le Houérou H.N., 1990. La forêt et l’utilisation des terres dans le bassin méditerranéenen 2050. Le modèle de circulation mondial « global change ». Forêt méditerranéenne, XII ; 3, pp 225-224.
60Maire R., 1926. Notice de la carte phytogéographique de l'Algérie et de la Tunisie. Gouv. gén. alg., Serv. carto., Bacconnier, Alger, 78 p.
61MATE, 2014. 5 ème Rapport National sur la mise en œuvre de la convention sur la diversité biologique au niveau National. MATE, GEF. PNUD, et CBD. Algérie, 128p.
62Merabti K., Rebbas K., Beddiar A., Aït Hammou M., Boutabia L., 2018. Inventaire des lichens de la region Est d’Alger et leur utilisation comme bioindicateurs de la pollution atmosphérique. Revue Ecologie- Environnement, 42 : 9-18.
63Nylander W., 1854. Études sur les lichens de l'Algérie. Mém. Soc. Sci. Nat. Cherbourg 2 : 305–344.
64Otálora M., Jørgensen P., Wedin M., 2014. A revised generic classification of the jelly lichens, Collemataceae. Fungal diversity, 64 : 275-293.
65PND, 2015. Plan de gestion et développement du Parc national du Djurdjura. Rapport interne, Parc national du Djurdjura, PND.
66Rebbas K., Boutabia L., Touazi Y., Gharzouli R., Djellouli y., Alatou D., 2011. Inventaire des lichens du Parc National de Gouraya (Béjaïa, Algérie). Phytothérapie, 4 (9) : 225-233.
67Roux C. et coll., 2017. Catalogue des lichens et champignons lichénicoles de France métropolitaine. 2e édition revue et augmentée (2017). Édit. Association française de lichénologie (A.F.L.), Fontainebleau, 1581p.
68Sanders W. B., De los Ríos A., 2019. The cellular cortex in Collemataceae (lichenized Ascomycota) participates in thallus growth and morphogenesis via parenchymatous cell divisions. Mycologia, 1-11
69Seaward M.R.D., Sipman H.J.M., 2006. An updated checklist of lichenized and lichenicolous fungi of Egypt. Willedenowia 36 (1) : 537-555.
70Semadi A., Tahar A., Fadel D., Benoit- Guyod J.L., 1997. The behaviour of some Lichens species in Annaba Area (Algeria). Synthèse, 2 : 17-22.
71Serradj A.A.M., El Oualidi J., Slimani A., Boumedris Z., 2013. Contribution à l'inventaire des lichens du lac Oubeira (NE de l'Agérie). Bulletin de l’Institut Scientifique, Rabat, Section Sciences de la Vie, n°35 : 15-17.
72Silverside A.J., 2008. Images of British Lichens. http://www.lichens.lastdragon.org/
73Thiévant P., 2001. Guide des Lichens, 350 espèces de lichens d’Europe. Éditions Delachaux et Niestlé, 304 p., France
74Thüs H., Schultz M., 2009. Keys to the Species and Species Profiles (in alphabetic order). 35–186. In: Fungi. In Fungi. Süßwasserflora von Mitteleuropa, vol 21. Spektrum Akademischer Verlag. https://doi.org/10.1007/978-3-8274-2299-6_4
75Van Haluwyn C., Asta J., Boissière J.C., Clerc P., 2012. Guide des Lichens de France, Lichens des sols. Éditions Belin, 224 p., France.
76Van Haluwyn C., Asta J., Gavériaux J.P., 2013. Guide des Lichens de France, Lichens des arbres. Éditions Belin, 240 p., France.
77Vust, M.,Clerc, P., Habashi, C., Mermilliod, J.-C., 2015. Liste rouge des lichens du canton de Genève. Hors-serie n° 16. Conservatoire et Jardin botaniques de la Ville de Geneve.
78Werner R. G. 1949. Les origines de la flore lichénique de l'Algérie d'après nos connaissances actuelles. Mém. Soc. Hist. Nat. Afrique N., Hors Sér. 2 : 299–312.
79Werner R. G. 1955. Étude sur la migration de quelques lichens. Bulletin de la société des Sciences de Nancy 14 : 104-115, 1 map. A discussion on the migration of lichens based on the distribution of eight species, of which three (Evernia prunastri, Parmelia saxatilis, Umbilicaria cylindrica) occur in Algeria.
80Wirth V., Schöller H., Scholz P., Ernst G., Feuerer T., Gnuchtel A., Hauck M., Jacobsen P., John V., Litterski B., 1996. Rote Liste der Flechten (Lichenes) der Bundesrepublik Deutschland. Schriftenreihe für Vegetationskunde 28 : 307–368.
81Yahia N., Marniche F., 2019. Inventaire des espèces lichéniques et estimation de la qualité de l’air dans le massif forestier de Chréa. Revue des Bioressources 9 : 38-50.
82Zahlbruckner A. 1904. Lichenes oranenses hochreutinerani. Pp. 244–247 In : Hochreutiner B. P. G., Le Sud-Oranais. Études floristiques et phytogéographiques faites au cours d'une exploration dans le sud-ouest de l'Algérie en 1901. Annuaire Conserv. Jard. Bot. Genève 7–8 : 22–276.
83Sites web :
84Site 1 : www.afl-lichenologie.fr
85Site 2 : http://www.lichens.lastdragon.org/
86Site 3 : https://www.scribblemaps.com/