- Home
- Volume 86 - Année 2017
- Articles
- Cinétique des interactions huile essentielle-antifongique
View(s): 5890 (20 ULiège)
Download(s): 207 (0 ULiège)
Cinétique des interactions huile essentielle-antifongique
Kinetics of the essential oil-antifungal interactions

Attached document(s)
original pdf fileRésumé
L’objectif de ce travail, en plus de l’étude phyto-chimique et antifongique, est d’étudier la cinétique des interactions anti-candidosiques de l’huile essentielle (H.E) de Melaleuca alternifolia et de deux antifongiques : l'amphotéricine B (Amph B) et le fluconazole (Fluc).
L’huile essentielle de Melaleuca alternifolia a été extraite des feuilles et des tiges terminales à l’aide d’un dispositif de type Clevenger, analysée par chromatographie en phase gazeuse couplée à la spectrométrie de masse. L’activité anti-candidosique a été évaluée selon deux techniques ; la technique de l’aromatogramme et la technique de microdilution. La souche microbienne est un lot de l’ATCC (American Type Culture Collection 90029) de Candida albicans. Le pourcentage et la zone d’inhibition, les concentrations minimales inhibitrices (CMI) et fongicides (CMF) et les indices de concentrations fractionnaires inhibitrices (ICFI) et fongicides (ICFF) ont été déterminés.
Le rendement de l’extraction était de 1,98 %. Les composés majoritaires étaient : Le terpinène-4-ol (31,15 %), l’-terpinène (12,02 %) et le -terpinéol (8,12 %). Le diamètre d’inhibition de l’huile essentielle était de 24,52 ± 0,9 mm. Le taux d’inhibition de la pousse de Candida albicans était de 97,35 ± 2,16 %. On a noté une variation des valeurs des CMI et des CMF en fonction des concentrations d’association entre l’huile essentielle et les antifongiques étudiés. Les plus faibles valeurs des ICFI des associations H.E/Amph B et H.E/Fluc ont été respectivement 0,493 et 0,432, celles des ICFF ont été de l’ordre de 0,862 et 0,798.
L’huile essentielle de Melaleuca alternifolia est un excellent fongicide. Son activité anti-candidosique majeure in vitro pourrait faire l’objet d’autres études plus soutenues in vivo afin d’enrichir l’arsenal antifongique tout en réduisant les effets médicamenteux indésirables.
Abstract
The objective of this work, in addition to the phyto-chemical and antifungal study, is to investigate the kinetics of anti-candidiasis interactions of the essential oil (E.O) of Melaleuca alternifolia and two antifungals: Amphotericin B (Amph B) and fluconazole (Fluc).
The essential oil of Melaleuca alternifolia was extracted from the leaves and terminal stems using a Clevenger-type device, analyzed by gas chromatography coupled with mass spectrometry. The anti-Candida activity was assessed using two techniques; the technique of aromatogramme and microdilution technique. The microbial strain is a lot of ATCC (American Type Culture Collection 90029) of Candida albicans. The percentages and the inhibition zones, the minimum inhibitory concentration (MIC) and fungicidal (MFC) and thefractional inhibitory concentration(FICI) and fungicidal (FFCI) index were determined.
The extraction yield was 1.98 %. The major compounds were: terpinen-4-ol (31.15%), the -terpinene (12.02 %) and -terpineol (8.12 %). The inhibition diameter of essential oil was 24.52 ± 0.9 mm. The inhibition rate of the growth of Candida albicans was 97.35 ± 2.16 %. There was a variation of MIC values and MFC versus concentrations of association between the essential oil and antifungal studied. The lowest values of the FICI combinations E.O / Amph B and E.O / Fluc were 0.493 and 0.432 respectively, those of FFCI were of the order of 0.862 and 0.798.
The essential oil of Melaleuca alternifolia is an excellent fungicide. Its major anti-Candida activity in vitro could be subject to other studies in vivo to enrich the antifungal arsenal while minimizing adverse drug reactions.
Introduction :
1Face au problème soulevé depuis plusieurs années par les candidoses, la seule alternative fiable à l'usage des antifongiques semble être celle des huiles essentielles. Connue de façon empirique depuis des siècles, leur efficacité anti-infectieuse a été scientifiquement démontrée in vitro et in vivo [1-4].
2Candida albicans est un microorganisme commensal qui fait partie des flores microbiennes endogènes gastro‑intestinale, oropharyngée et génitale féminine [5]. Cependant, il s’agit aussi chez l’humain d’un pathogène opportuniste pouvant causer des affections potentiellement mortelles chez les sujets immunodéprimés comme immunocompétent [6-7].
3Ce travail permet, en plus de l’étude phyto-chimique, d’évaluer l’activité anticandidosique de l’huile essentielle de Melaleuca alternifolia et de déceler certaines interactions synergique avec l’amphotéricine B et le fluconazole à différentes concentrations.
4Matériel et méthodes :
5Matériel végétal :
6Espèce végétale:
7Noms communs : Arbre à thé, Tea tree, Mélaleuque à feuilles alternées.
8Nom latin : Melaleuca alternifolia (Maiden et Betche (en)) Cheel.
9Classification
10Règne : Plantae
11Sous-règne : Tracheobionta
13Classe : Magnoliopsida
16Partie distillée : Feuilles et tiges terminales.
17Origine: Australie.
18Description botanique : L’arbre à thé (à ne pas confondre avec le théier (Camellia sinensis), le cajeput (Melaleuca leucadendron) et le niaouli (Melaleuca quinquenervia)) est un grand arbuste ou un petit arbre d’environ 5 à 8 m avec une couronne touffue. Le tronc est bien droit et son écorce est blanchâtre en forme de lanières. Les feuilles, riches en huile essentielle, sont duveteuses et de couleur vert vif, disposées de manière irrégulière, dispersées ou moulées, de 10 à 35 mm de longueur et de 1 mm de largeur. Les fleurs sont blanches, solitaires, chacune dans une bractée, et ont des pétales de 2 à 3 mm de long. Les étamines apparaissent en faisceau de 30 à 60 et le style est de 3 à 4 mm de long. Le fruit est boisé avec de nombreuses graines sous forme de capsule en forme de coupe de 2 à 3 mm de diamètre [8].
19Huile essentielle: L’huile essentielle a été obtenue par hydrodistillation qui s’est accomplie à l’aide d’un dispositif de type Clevenger [9]. Un ballon de 2 litres contenant 200 g de matériel végétal et 1 litre d’eau distillée a été chauffé pendant 3 h.
20L’huile essentielle a été conditionnée dans des flacons propres et secs en verre teinté et conservée à l’abri de la lumière dans une température de 4 °C [10]. La densité a été déterminée selon le rapport volume masse.
21Analyse chromatographique:L'analyse qualitative et quantitative des composants des huiles essentielles a été déterminée par chromatographie en phase gazeuse couplée à la spectrométrie de masse comme décrit par El Alama et al.[11].
22Antifongiques: « L'amphotéricine B est un antibiotique antifongique de la famille des polyènes, extrait de Streptomyces nodosus et qui démontre une activité contre Candida albicans, indiquée dans le traitement des infections systémiques fongiques, les atteintes muqueuses ORL ou digestives, en particulier les candidoses [12] ».
23« Le fluconazole est agent antifongique triazolé, de la famille des imidazolés indiqué dans le traitement des candidoses des muqueuses, les candidoses buccales atrophiques chroniques, Les candidoses vaginales, aiguës ou récidivantes et la balanite candidosique. Il est aussi indiqué dans la prophylaxie de récidive de la candidose oropharyngée ou œsophagienne chez les patients infectés par le VIH et qui présentent un risque élevé de rechute, de récidives de candidose vaginale et d’infections à Candida chez les patients avec une neutropénie prolongée [12] ».
24Souche de Candida albicans (Berkhout) : Les levures proviennent d’une souche de référence Candida albicans ATCC 90029.
25Classification [13] :
26Règne:Fungi
27Division:Ascomycota
28Classe:Saccharomycetes
29Ordre:Saccharomycetales
30Famille: Saccharomycetaceae
31Milieu de culture : Le milieu de culture utilisé est celui de Sabouraud dextrose Agar [14].
32Aromatogramme: Il a les mêmes propriétés que l’antifongigramme, des disques de papier de 6 mm sont imbibés de 15µl huile essentielle, pour les antifongique on a utilisé des disques de concentration de 20 µg pour l’amphotéricine B et 25 µg pour le fluconazole. L’incubation s’est faite à 37 °C pendant 48 h [14]. Après incubation on a mesuré la zone d’inhibition qui a été exprimée en mm. Chaque test a été effectué trois fois.
33Taux d’Inhibition en (%) :
34Le taux d’inhibition est calculé en comptant le nombre de levures par mm3 sur une cellule de Malassez après incubation à 37 °C pendant 48 h et homogénéisation sur Vortex.
35La formule de calcul est la suivante :
36[(N0 - N)/N0] x 100
37où :
38N0 : nombre de levures dans le tube témoin à temps zéro.
39N: nombre de levures dans le tube avec l’HE ou l’antibiotique testés, après 48 h d’incubation.
40Concentrations minimales inhibitrice (CMI) et fongicide (CMF): La CMI a été déterminée selon la méthode de microdilution sur plaque ELISA stérile de 96 puits en polystyrène pur de haute qualité hautement transparente. Des solutions mères ont été préparées en introduisant 100µl d’huile essentielle, d’amphotéricine B ou de fluconazole dans 100 µl de milieu Sabouraud liquide. On a effectué une série de dilutions à partir de ces solutions mères dans chaque puits contenant dans 100 μl de milieu Sabouraud liquide, puis on a rajouté 100 µl de suspension de levure de concentration connue (105 UFC/ml). L’incubation s’est faite à 37 °C pendant 48 h. On a utilisé le tétrazolium comme indicateur coloré, une coloration bleue violette était le signe d’une croissance fongique [15,16].
41La CMF a été déterminée à l’aide d’un transfert, sur des boites de Petri contenant la Sabouraud Dextrose Agar, de 100 µl de chaque puits n’ayant présenté aucune croissance fongique, l’incubation s’est faite à 37 °C pendant 48 h [15].
42Évaluation de l’activité synergique entre l’huile essentielle et les antifongiques :
43Une série de rapport huile essentielle/antifongique a été réalisée afin de déterminer les interactions huile essentielle/antifongique en fonction des concentrations. Les indices de concentrations fractionnaires inhibitrices (ICFI) et fongicides (ICFF) ont permis d’évaluer la nature de l’interaction. Il s’agit des rapports entre les CMI ou CMF des produits en association et celles des produits utilisés seuls [17].
Résultats :
44Huile essentielle : L’huile essentielle obtenue est un liquide limpide d’une densité de 0,897, de couleur blanche qui vire vers le jaune, avec une odeur fraiche plus au moins agréable, légèrement épicée. Le rendement obtenu est de 1,98 %.
45L’analyse chromatographique a montré que deux familles biochimiques sont majoritaires; les monoterpènols et les monoterpènes (tableau 1).
Tableau 1 : Composition chimique de l’huile essentielle de Melaleuca alternifolia
|
Famille biochimique |
Composé |
Pourcentage (%) |
||||||||||||||||||||||||||
|
Monoterpènols 50,62% |
|
|||||||||||||||||||||||||||
|
Monoterpènes 37,68% |
|
|||||||||||||||||||||||||||
|
Sesquiterpènes 3,82% |
|
|||||||||||||||||||||||||||
|
Sesquiterpènols 1,52% |
|
|||||||||||||||||||||||||||
|
Oxydes Monoterpèniques 5,21% |
|
|||||||||||||||||||||||||||
|
Total |
98,85 |
|||||||||||||||||||||||||||
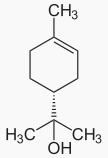
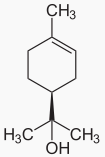
46L’et-terpinéol, l’-terpinènesont les composés majoritaires, les terpinéols, ou terpinols ou encore terpinoles, sont des alcools monoterpéniques (monoterpénols) monocycliques insaturés de formule brute C10H18O (figures 1 et 2).
|
|
|
|
(a) |
(b) |
Figure 1: Structure chimique du (R)-(+)-α-terpinéol (a) et (S)-(−)-α-terpinéol (b)
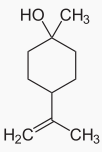
Figure 2: Structure chimique du β-terpinéol
47Les terpinènes sont trois hydrocarbures isomériques qui sont classés parmi les monoterpènes, de formule brute C10H16, chacun a la même formule chimique et la même structure mais ils diffèrent dans la position d'une double liaison carbone-carbone (figure 3).
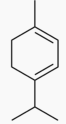
Figure 3: Structure chimique du -terpinène
48L’aromatogramme a montré une forte activité antifongique de l’huile essentielle que ce soit au niveau de la zone ou le pourcentage d’inhibition, l’association de l’amphotéricine B et le fluconazole à l’huile essentielle a permis d’augmenter leur activité (tableau 2).
Tableau 2 : Diamètres et pourcentages d’inhibition des produits seuls et en association
|
Diamètre d’inhibition (mm) |
Pourcentage d’inhibition (%) |
|
|
Huile essentielle |
24,52±0,9 |
97,35±2,16 |
|
Amphotéricine B |
19,36±0,6 |
92,04±0,83 |
|
Fluconazole |
20,07±0,7 |
98,25±1,63 |
|
Association H.E / Amphotéricine B |
21,21±1,2 |
98,04±1,85 |
|
Association H.E / Fluconazole |
25,37±1,1 |
99,75±0,01 |
49(H.E = Huile essentielle)
50Les CMI et CMF des trois produits ont montré qu’ils ont un pouvoir fongistatique et fongicide puissant en fonction des concentrations utilisées (tableau 3).
Tableau 3 : CMI et CMF des trois produits
|
CMI (µg/ml) |
CMF (µg/ml) |
||||
|
Huile essentielle |
Amphotéricine B |
Fluconazole |
Huile essentielle |
Amphotéricine B |
Fluconazole |
|
0,125 |
0,5 |
0,25 |
0,125 |
0,75 |
0,5 |
|
Rapport CMF/CMI |
|||||
|
Huile essentielle |
Amphotéricine B |
Fluconazole |
|||
|
1 |
1,5 |
2 |
|||
51L’association de l’amphotéricine B et du fluconazole à l’huile essentielle de Melaleuca alternifolia amontré une synergie bactériostatique et un effet additif fongicide (tableau 4).
Tableau 4 : ICFI et ICFB de l’association de l’huile essentielle aux antifongiques étudiés
|
ICFI |
ICFB |
||
|
H.E+Amph B |
H.E+Fluc |
H.E+Amph B |
H.E+Fluc |
|
0,493 |
0,432 |
0,862 |
0,798 |
52(H.E= Huile essentielle ; Amph B= Amphotéricine B ; Fluc= Fluconazole)
53Les figures 4 et 5 montrent les variations des ICFI et ICFF en fonction du rapport huile essentielle/antifongique.
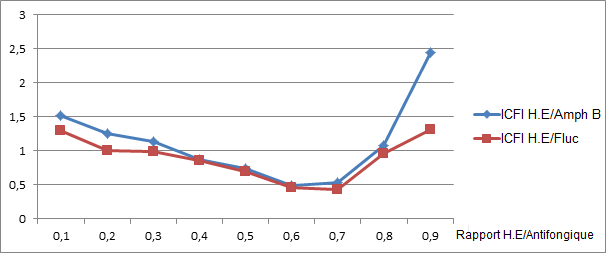
Figure 4: Évolution des ICFI en fonction des rapports H.E/Antifongique
(H.E = Huile essentielle ; Amph B = Amphotéricine B ; Fluc = Fluconazole)
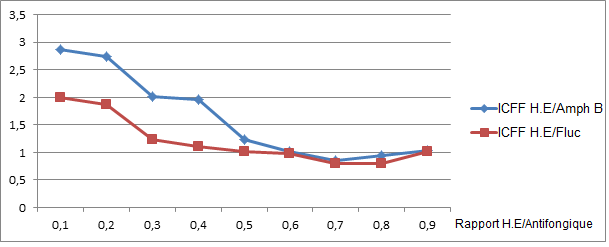
Figure 5: Evolution des ICFF en fonction des rapports H.E/Antifongique
(H.E = Huile essentielle ; Amph B = Amphotéricine B ; Fluc = Fluconazole)
Discussion :
54Le rendement obtenu est très performant (1,98 %), les rendements usuels varient de 1 à 2 % mais souvent calculés par rapport à la matière humide [18]. Ce rendement est dû à la qualité biologique de l’échantillon qui appartient à une culture biologique ainsi au respect des recommandations internationales lors des deux phases; préanalytique et analytique.
55La composition phytochimique de notre échantillon répond aux normes ISO 4730 (International Organization for Standardization standard no. 4730), qui exige des teneurs en terpinen-4-ol supérieure ou égale à 30%, 10 à 28 % en γ-terpinène, 5 à 13 % en -terpinène, 1,5 à 5 % en terpinolène et un pourcentage inférieur à 15 % en 1,8-cinéole [18].
56Les plantes de la famille des Myrtacées sont connues par leurs feuilles riches en terpènes dont la variation qualitative et quantitative varie considérablement selon l'identité taxonomique et la région, le climat et la saison de récolte. Le genre Melaleuca contient une centaine de composés chimiques différents, les composés volatils ont une importance économique et médicinale [19].L’huile essentielle de l’arbre à thé est connue pour ses propriétés antimicrobiennes et surtout fongicides [20].
57Les familles phytochimiques responsables de l’activité antifongique des huiles essentielles sont les aldéhydes aliphatiques et aromatiques, les phénols, les oxydes et les lactones sesquiterpéniques [10].
58Certains travaux ont démontré l’effet synergique entre les huiles essentielles et les médicaments [11, 17, 21, 22], pour mieux connaitre cet effet synergique, il faut comprendre le mécanisme et les sites d’action des huiles essentielles et des médicaments antifongiques.
59Les huiles essentielles agissent à différents niveaux [23] :
-
Altération de la paroi cellulaire;
-
Altération des protéines de la membrane;
-
Dégradation de la membrane cytoplasmique;
-
Fuite du contenu de la cellule;
-
Coagulation cytoplasmique;
-
Épuisement de la force du mouvement des protons.
60L’huile essentielle de Melaleuca alternifolia agit sur la perméabilité et les propriétés de membrane de Candida albicans. Elle inhibe la respiration d’une façon dose-dépendante ainsi elle inhibe l’induction de glucose par acidification due en grande partie à uneexpulsion de protons par l'ATPase de la membrane plasmatique, qui est alimentée par l'ATP provenant de la mitochondrie. L'inhibition de cette fonction suggère que les membranes cytoplasmiques et/ou mitochondriales ont été lésées.Elle inhibe la formation des tubes de germination ou la conversion mycélienne. Le retard de formation de ces tubes indique que cette huile essentielle exerce un effet post-antifongique [18].
61« L'amphotéricine B se fixe sur des stérols de la membrane cellulaire de champignons sensibles, la rendant perméable et provoquant sa lyse membranaire. Elle se fixe à un stérol contenu dans les membranes des champignons, l'ergostérol (alors les membranes cellulaires humaines contiennent du cholestérol) ce qui la rend sélective. L'amphotéricine B agit par contact direct (fongistatique et fongicide si la concentration est élevée) [12] ».
62« Le fluconazole inhibe la déméthylation en 14-alpha du lanostérol médiée par le cytochrome P 450, une étape essentielle dans la biosynthèse de l'ergostérol fongique. L'accumulation de stérols méthylés en 14-alpha est corrélée avec la perte subséquente d'ergostérol dans la membrane cellulaire fongique[12] ».
63L’association synergique peut être expliquée par l’action simultanée de l'amphotéricine B ou du fluconazole et celle de l’huile essentielle sur la membrane cellulaire de Candida albicans ce qui facilite l’entrée de l’huile essentielle qui exerce son effet sur les différents constituants de Candida albicans comme décrit précédemment.
64Cette synergie est un véritable gain pour la thérapie anti-Candida albicans vue le cout et la durée de traitement qui peut atteindre des mois, les effets indésirables et l’apparition de résistance aux médicaments antifongiques.
Conclusion :
65La forte synergie entre l’huile essentielle et les deux antifongiques étudiés (amphotéricine B et fluconazole) représente un véritable arsenal thérapeutique contre Candida albicans ainsi contre d’autre champignons sensibles à ces associations. Il reste à essayer d’autres huiles essentielles en association avec d’autres antifongiques contre d’autres souches plus résistantes. Le véritable défi est la modélisation d’une forme galénique avec une meilleure biodisponibilité, une bonne tolérance et plus de sécurité.
66Conflit d’intérêt : Aucun
Références :
67[1] Naeini A, Naderi NJ, Shokri H. Analysis and in vitro anti-Candida antifungal activity of Cuminum cyminum and Salvadora persica herbs extracts against pathogenic Candida strains. Journal of Medical Mycology. 2014;24(1):13‑8.
68[2] El Amri J, Elbadaoui K, Zair T, Bouharb H, Chakir S, Alaoui T. Étude de l’activité antibactérienne des huiles essentielles de Teucrium capitatium L et l’extrait de Silene vulgaris sur différentes souches testées. Journal of Applied Biosciences. 2014;82(1):7481‑92.
69[3] Aouni M, Pelen F, Soulimani R. Étude de l’activité antimicrobienne d’un mélange de 41 huiles essentielles et domaines d’application. Phytothérapie. 2013;11(4):225‑36.
70[4] Mondello F, De Bernardis F, Girolamo A, Salvatore G, Cassone A. In vitro and in vivo activity of tea tree oil against azole-susceptible and-resistant human pathogenic yeasts. Journal of Antimicrobial Chemotherapy. 2003;51(5):1223‑9.
71[5] Ryan K. J. Candida, Aspergillus, and Other Opportunistic Fungi. In Ryan, K.J. and Ray, C.G. (Ed.), Sherris Medical Microbiology: An introduction to infectious diseases.Arizona: McGraw-Hill USA; 2004.659-68.
72[6] Gauzit R. Épidémiologie et facteurs de risque des candidoses systémiques en réanimation. In Elsevier; 2001.394‑9.
73[7] Kett DH, Azoulay E, Echeverria PM, Vincent J-L. Candida bloodstream infections in intensive care units: analysis of the extended prevalence of infection in intensive care unit study. Critical care medicine. 2011;39(4):665‑70.
74[8] Jammy R, Japar S, Shah MKM. Review: Tea Tree (Melaleuca Alternifolia) As A New Material For Biocomposites. Journal of Applied Science & Agriculture. 2015;10(3):21‑39.
75[9] Clevenger J. Apparatus for volatile oil determination, Description of New Type. American Perfumer & Essential Oil Review. 1928;467‑503.
76[10] Kaloustian J, Hadji-Minaglou F. La connaissance des huiles essentielles: qualitologie et aromathérapie: Entre science et tradition pour une application médicale raisonnée. Springer Science & Business Media; 2013.210.
77[11] El Alama H, El Aissami A, Ait Haj Said A, El Alaoui-Faris F-E. Antistaphylococcal synergistic interaction between the essential oil of Rosmarinus officinalis L. and ciprofloxacin. J. Chem. Pharm. Res. 2015;7(10):285-89.
78[12] Vidal 2014 : le dictionnaire. 90ème édition. Paris: Vidal, 2014.
79[13] Krause J, Geginat G, Tammer I. Prostaglandin E2 from Candida albicans Stimulates the Growth of Staphylococcus aureus in Mixed Biofilms. Seneviratne CJ, ed. PLoS ONE. 2015;10(8):e0135404.
80[14] Saigal S, Bhargava A, Mehra S, Dakwala F. Identification of Candida albicans by using different culture medias and its association in potentially malignant and malignant lesions. Contemporary clinical dentistry. 2011;2(3):188.
81[15] Chebaibi A, Marouf Z, Rhazi-Filali F, Fahim M, Ed-Dra A. Évaluation du pouvoir antimicrobien des huiles essentielles de sept plantes médicinales récoltées au Maroc. Phytothérapie. 2016;14(6):355‑62.
82[16] Eloff J. A sensitive and quick microplate method to determine the minimal inhibitory concentration of plant extracts for bacteria. Planta medica.1998;64(8):711‑3.
83[17] Jarrar N, Abu-Hijleh A, Adwan K. Antibacterial activity of Rosmarinus officinalis L. alone and in combination with cefuroxime against methicillin-resistant Staphylococcus aureus. Asian Pacific Journal of Tropical Medicine. 2010;3(2):121‑3.
84[18] Carson C, Hammer K, Riley T. Melaleuca alternifolia (tea tree) oil: a review of antimicrobial and other medicinal properties. Clinical microbiology reviews. 2006;19(1):50‑62.
85[19] Barbosa LCA, Silva CJ, Teixeira RR, Meira RMSA, Pinheiro AL. Chemistry and biological activities of essential oils from Melaleuca L. species. Agriculturae Conspectus Scientificus (ACS). 2013;78(1):11‑23.
86[20] L.Markham J. Biological activity of tea tree oil. In Tea Tree: The Genus Melaleuca: Medicinal and Aromatic Plants - Industrial Profiles. UK: Taylor & Francis; 2005.165-85.
87[21] Giordani R, Kaloustian J. Action anticandidosique des huiles essentielles: leur utilisation concomitante avec des médicaments antifongiques. Phytothérapie. 2006;4(3) : 121‑4.
88[22] Goetz P, Ghédira K. Phytothérapie anti-infectieuse. Paris : Springer-Verlag France; 2012.382.
89[23] El Alama H, El Aissami A, Ait Haj Said A, El Alaoui-Faris F-E. Evaluation of anti-Candida albicans activity of essential oils of six medicinal plants: Synergy concept. Journal of Chemical and Pharmaceutical Research. 2015;7(10) : 281‑4.