- Home
- Volume 75 (2022)
- Asilidae et Diopsidae collectés en 2018-2019 sur le Mont Tonkoui en Côte d’Ivoire (Diptères)
View(s): 1606 (13 ULiège)
Download(s): 76 (0 ULiège)
Asilidae et Diopsidae collectés en 2018-2019 sur le Mont Tonkoui en Côte d’Ivoire (Diptères)

Attached document(s)
original pdf fileRésumé
Un lot de 27 Asilidae et de 7 Diopsidae a été collecté en 2018-2019 sur le Mont Tonkoui en Côte d’Ivoire. Les Asilidae se répartissent en 7 genres et 9 espèces dont 4 espèces sont nouvelles pour le pays et une est nouvelle pour la science Ommatius tonkouii sp.nov. Les 7 spécimens de Diopsidae sont étonnamment des espèces différentes et toutes sont nouvelles pour la Côte d’Ivoire.
Abstract
A batch of 27 Asilidae and 7 Diopsidae from Mt Tonkoui in Ivory Coast has been collected in 2018-2019. The specimens of Asilidae belong to 7 genera and 9 species of which 2 genera and 4 species are new for this country and Ommatius tonkouii sp.nov. The specimens of Diopsidae belong to 3 genera and 7 species which are new for this country.
Table of content
Reçu le 10 août 2021, accepté le 28 octobre 2021
Cet article est distribué suivant les termes et conditions de la licence CC-BY (http://creativecommons.org/licenses/by/4.0/deed.fr)
INTRODUCTION
1En 2018, Tomasovic terminait sa Contribution à la connaissance des Asilidae de la Côte d’Ivoire en émettant le souhait de ne plus attendre 50 ans avant d’avoir une nouvelle étude portant sur ce pays (Tomasovic, 2018). Voici son vœu partiellement exaucé. La présente étude est en effet le résultat de l’examen d’un petit lot d’Asilidae récolté au piège Malaise sur le Mont Tonkoui (Côte d’Ivoire), avec la contribution de notre collègue Yves Braet. Parmi les Asilidae se trouvaient par hasard 7 spécimens de Diopsidae.
2Le Mont Tonkoui fait partie du massif le plus méridional de la Dorsale Guinéenne, dont il est relativement isolé. La campagne de piégeage a été menée au sommet d’une forêt qualifiée de forêt des brumes ou de forêt des brouillards. C’est une forêt d’altitude à Parinari excelsa Sabine d’Afrique occidentale, remarquable par l’abondance d'épiphytes, mousses, lichens, fougères, orchidées, ficus et lianes (Da Lage & Métailié, 2015). Du fait des difficultés d'accès dues aux fortes pentes, la partie supérieure de la forêt classée du Tonkoui est restée une forêt primaire de montagne. Moretto et al. (2021) en font une remarquable description illustrée. A ce jour, les cultures ne sont présentes que dans le bas de la montagne, mais elles ont tendance à remonter les pentes (communication personnelle de Y. Braet).
3Auparavant, les Asilidae étaient décrits comme vivant préférentiellement en milieux ensoleillés, chauds et secs. De récents travaux ont démontré qu’une grande diversité se retrouvait également dans des biotopes qui ne sont a priori pas leurs milieux préférés. C’est ainsi qu’ils ont récemment été retrouvés dans des milieux humides des forêts tropicales de la République du Congo (Tomasovic & Bakker, 2010), de la Guyane française (Vieira, Camargo, Pollet & Dikow, 2019) ainsi que dans les mangroves entourant Singapour (Tomasovic & Grootaert, 2010) ou Hong Kong (Tomasovic, Constant & Grootaert, 2020).
4La présente note, consacrée au Mont Tonkoui, permet à nouveau d’étudier les Asilidae d’un milieu particulièrement humide. Tomasovic (2018) en a précédemment signalé 11 espèces.
5Avec moins de 200 espèces connues, la famille des Diopsidae pourrait paraître anecdotique. Elle est cependant remarquable de par la morphologie de la capsule céphalique de ses représentants et il est bien difficile de rester indifférent à ces curieuses mouches. En effet, la particularité des Diopsidae est d’avoir les yeux et les antennes disposés à l’extrémité de longs pédoncules. Le lecteur francophone trouvera une belle description de cette famille dans l’article de synthèse rédigé par Delfosse (2006). Les espèces de cette famille sont de tailles plutôt réduites, variant de 4 à 12 mm. Leur coloration est majoritairement d’orange jaunâtre ou rougeâtre, de brun ou de noir. De nombreuses espèces possèdent un tubercule ou une épine pleurale ainsi que deux fortes épines scutellaires dirigées vers la partie postérieure du corps. Certaines espèces ont la particularité d’avoir les fémurs antérieurs épaissis. Les larves sont phytophages et certaines sont reconnues comme nuisibles.
MATÉRIEL ET MÉTHODES
6Les échantillons ont été récoltés en 2018 et 2019 à l’aide d’un piège Malaise, placé à 1200m d’altitude, sur le Mont Tonkoui (Côte d’Ivoire), à proximité de la ville de Man (07°27’N 07°38’14’’W). Sauf mention spéciale, les captures ont été réalisées par Yves Braet et Arsène Gué. Les Asilidae ont été épinglés et les genitalia mâles disséqués et collés sur une paillette placée sous les étiquettes de capture et d’identification. Le matériel relatif aux Asilidae a été identifié par les auteurs puis déposé au conservatoire de Gembloux Agro-Bio Tech (ULiège, Belgique). Les Diopsidae ont été identifiés par les époux Hans et Cobi Feijen. Les 7 spécimens ont été placés dans leur collection (Naturalis Biodiversity Center ; Leiden, Netherlands) après avoir été photographiés par J. Mignon.
RÉSULTATS
Asilidae
7Parmi les 32 individus de notre échantillon se trouvaient 15♂ et 17♀. Neuf espèces ont été identifiées, dont deux sont nouvelles pour la science.
8Sous-Famille des Apocleinae Papavero 1973
9Genre Philodicus Loew 1847
10Le genre présente 23 espèces en région afrotropicale.
11Philodicus fraternus (Wiedemann 1819)
12Déja citée du Mt Tonkoui (Tomasovic, 2018)
13Matériel : 1♂, 14-21.X.2019, rec. Y. Braet & A. Gué
14Sous-Famille des Asilinae Latreille 1802
15Genre Heligmonevra Bigot 1858
16Vingt-quatre espèces du genre sont recensées en région afrotropicale.
17Heligmonevra lamtoensis Tomasovic & Dekoninck 2014
18Localité type de l’espèce, Ivory Coast, Lamto N.R. Eco Rest Stat. 6.22N 5.03W, Light trap, 15-17.IX.2013, Leg. W. Dekoninck & T. Delsinne, IG 32505, GTI Ant course, IRSNB (Tomasovic & Dekoninck, 2014).
19Matériel : 1♂, 16-22.VII.2019, rec. Y. Braet & A. Gué
20Sous-Famille des Dasypogoninae Macquart 1838
21Genre Pegesimallus Loew 1858
22Le genre renferme près de 50 espèces en région afrotropicale. Londt (1980) fournit la clé d’identification pour 46 espèces afrotopicales et Tomasovic (2008) présente une clé des 14 espèces de l’Ouest et du Centre Afrique. L’espèce P. oldroydi Londt 1980 est déjà citée du Mt Tonkoui (Tomasovic, 2018).
23Pegesimallus oralis (Wulp 1884)
24L’espèce est renseignée de Côte d’Ivoire (Tomasovic, 2008) mais oubliée par le même auteur dans sa contribution de 2018.
25Matériel : 2♂, 13-20.I.2019 ; 1♂, 3.II.2019 ; rec. Y. Braet & A. Gué
26Pegesimallus pedunculatus (Loew,1858)
27Matériel nouveau pour la Côte d’Ivoire : 1♂, 26.IV-10.V.2019 ; 1♂, 28.IV-5.V.2019 ;1♂, 10.XI.2019 ; rec. Y. Braet & A. Gué
28Sous-Famille des Laphriinae
29Genre Smeryngolaphria Hermann 1912
30Le genre renferme 10 espèces dont 3 sont afrotropicales : S. bromleyi Londt 1989 (Nigeria), S. pallida Bromley 1935 (République démocratique du Congo) et S. bicolora Tomasovic 2003 (Madagascar) (Tomasovic, 2003, p. 49-52).
31Smeryngolaphria bromleyi Londt 1989. (Figure 1)
32Cette belle espèce originale par sa couleur jaune n’était connue à ce jour que par 2 spécimens : 1♂ et 1♀, Nigeria, Sapoba, 6°06’N : 5°53’E, 17.IV.1946, M.A. Cornes, Forest, 6622 (NMWC) (Londt, 1989, p. 155).
33Distribution : Nigeria. Le genre et l’espèce sont nouveaux pour la Côte d’Ivoire.
34Matériel : 1♂, 20-27.X.2019, rec. Y. Braet & A. Gué

Figure 1 : Smeryngolaphria bromleyi Londt 1989 ♂
35Sous-Famille des Ommatiinae Hardy 1927
36Genre Ommatius Wiedemann 1821
37Ce genre, largement répandu, renferme près de 250 espèces de moyennes à grandes tailles. Près de 70 espèces sont observées en région afrotropicale (Londt, 2018). Oldroyd (1968) décrit 4 espèces d’Ommatius de Côte d’Ivoire : O. canicoxa Speiser 1913 (p. 390, fig. 5), O. lurismus Oldroyd 1968 (p. 393-395, fig. 8 en p. 394), O. orus Oldroyd 1968 (p. 392-393, fig. 7 en p. 392) et O. bingeri Oldroyd 1968. Scarbrough & Marascia (2003) placent ensuite l’espèce O. bingeri dans le sous-genre Pygommatius Scarbrough & Marascia 2003 (p. 20-21, figs 3, 52, 70-77). Celui-ci a ensuite été élevé au niveau du genre par Scarbrough & Hill (2005).
38Ommatius lurismus Oldroyd 1968 (p. 393-395, figs 8-9 en p. 394, fig. 12 en p. 395)
39Localité type : Côte d’Ivoire: Bingerville, X.1962 (Oldroyd, 1968).
40Matériel : 1♂ 14-21.IV.2019 ; 1♂ 9-16.VI.2019 ; 1♀ 25.XI-02.XII.2018 ; 1♀ 22.V-04.VI.2018 ; 1♀ 16-23.VI.2018 ; 1♀ 4-10.II.2019 ; 1♀ V.2018 ; rec. Y. Braet & A. Gué
41Ommatius tonkouii sp nov. (Figure 2)
42L’espèce se distingue des autres Ommatius par la forme des genitalia mâles.
43Matériel : Type : 1 ♂, 26.IV-10.V.2018 , Man Mt Tonkoui, 7°27’N-7°38’W, 1200m, rec. Eylon Orbach
44Paratypes : 1♂, 4.X.2019 ; 1♀, 18-25.XI.2018 ; 1♀, 19-26.V.2019 ; 1♀, 15-22.IX.2019 - piège Malaise, rec. Y. Braet & A. Gué

Figure 2 : Ommatius tonkouii sp.nov.
45Description
46Mâle, longueur 13 mm.
47Tête. Face légèrement renflée couverte d’une pruinosité blanchâtre. Mystax formée de longues et fines soies blanches avec quelques noires sur la partie supérieure. Antennes. Scape et pédicelle petits et jaunes, pédicelle légèrement plus court que le scape avec de courtes soies noires, flagellum noir et ovale, plus court que le scape et pédicelle réunis, style près de 5 fois plus long que le post-pédicelle. Front à fine pruinosité brune. Calus ocellaire avec 2 fines soies noires. Occiput à pruinosité blanchâtre, soies post-oculaires noires, longues, fines et courbées vers l’avant. Proboscis brun. Palpes bruns à fins poils clairs.
48Thorax. Scutum et scutellum à pruinosité grisâtre, calus post-alaire plus clair. Soies longues et noires, 2 notopleurales, 2 supra-alaires, 1 post-alaire, 3 paires de fines dorso-centrales, 2 scutellaires. Les pleures gris-jaunâtres, soies jaunes, longues et fines : 1 anepimerale, 2 metepisternales, 6 katatergales. Ailes brunies. Pattes entièrement jaunes à soies fines, longues et jaunes, fémurs postérieurs avec 1 rang de soies courtes, fortes et noires sur la partie ventrale et 3 soies longues, fortes et noires sur la partie interne.
49Abdomen. Tergites brun-rouge à marge postérieure noire, des soies longues, jaunes et fines, latérales ; sur le centre postérieur, des soies courtes, fines et noires. Sternites jaunes à rares et fines soies jaunes.
50La structure des genitalia de notre spécimen se différencie nettement de celle des autres espèces connues. Genitalia bruns (Figure 3) : A= epandrium, triangulaire portant 2 longues et fortes soies noires. B= gonocoxite, allongé sur l’apex, une structure en S à pointe effilée. C= phallus, apodème long et mince, paramères à extrémité arrondie, fourreau court et large avec 1 rang de microspinules sur la partie dorsale, endophallus en forme de V à extrémité arrondie, distisphallus indistinguable.
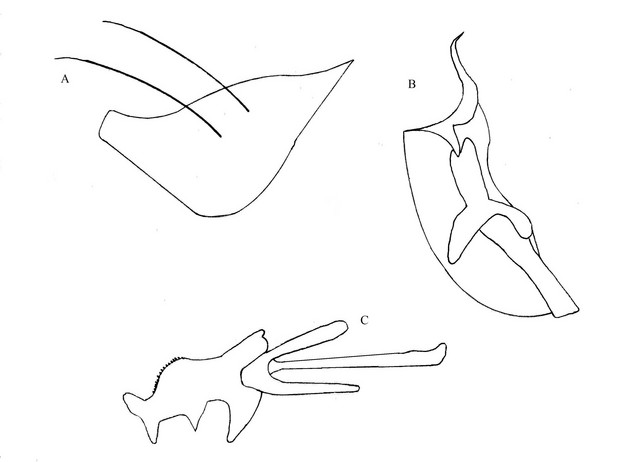
Figure 3 : Genitalia d’Ommatius tonkouii sp.nov. (A. epandrium, B. gonocoxite, C. phallus)

51Genre Pygommatius Scarbrough & Marascia 2003
52Ce genre de 39 espèces s’observe en régions afrotopicale et orientale. Scarbrough & Marascia (2003) fournissent une clé d’identification des 25 espèces afrotropicales ainsi que l’illustration des genitalia mâles. Parmi celles-ci, 4 espèces sont en Côte d’Ivoire : P. bingeri Oldroyd 1868 (p. 20-21, figs 70-74) ; P. brevicornis Curran 1927 (p. 22-24, figs 4, 23, 30, 78-85) ; P. porticus Scarbrough & Marascia 2003 (p. 52-54, figs 18, 45, 189-196) et P. talus Scarbrough & Marascia 2003 (p. 58-60, figs 21, 218-225). Autrefois sous-genre des Ommatius Wiedemann, Pygommatius a été élevé au niveau du genre par Scarbrough & Hill (2005).
53Pygommatius porticus Scarbrough & Marascia 2003
54Localité type de l’espèce, Côte d’Ivoire, Banco Nat. Park N. Abidjan / S. side 23-27.IV.89 / 05°224N:04°03W / JGH Londt edge of wide tract / in forest, Scarbrough & Marascia (2003)
55Matériel : 2 ♂, 6-13.X.2019 ; 1♀, 29.VII-5.VIII.2018 ; 1♀, 18-25.XI.2018 ; 1♀, 2-9.XII.2018 ; 1♀, 26.V-9.VI.2019 ; 1♀, 16-23.VI.2019 ; 1♀, 7-14.VII.2019 ; 1♀ , 8-15.IX.2019 ; 1♀, 10.XI.2019 ; rec. Y. Braet & A. Gué
56Genre Michotamia Macquart 1838
57Le genre Michotamia se distingue principalement des autres genres d’Ommatiinae par la forme des antennes dont le post-pedicelle est au moins 1 fois et demie plus long que le scape et le pédicelle réunis. Hull (1962, p. 619, figs 305A-305B); Scarbrough & Hill (2000, p. 383, fig. 1) et Scarbrough (2010, p. 5, fig. 4) en fournissent une illustration.
58Scarbrough (2010) note pour le genre « Michotamia remains relatively unchanged since its original description. No species has been reported from Africa. Michotamia coarctata is only from Madagascar ». Cette information est reprise par Londt & Dikow (2017).
59Il est à noter qu’Oldroyd (1970) crée le genre Thallosia (p. 314-317, figs 79-82-83), genre monotypique confiné à l’Afrique Centrale (Démocratique République du Congo) avec le post-pédicelle plus grand que le scape et le pédicelle réunis et avec une face présentant une forte gibbosité. Il ajoute que ce genre se distingue par une antenne de forme intermédiaire entre les genres Ommatius et Michotamia et que les genitalia mâles ressemblent à ceux du genre Cophinopoda Hull 1958.
60Michotamia n.sp. (Figures 4-6)
61Matériel : 1♀, 23-31.III.2019, rec. Y. Braet & A. Gué
62Diagnose
631♀, longueur 9 mm. Espèce noire. Face à pruinosité blanche, mystax à soies blanches, antennes noires, scape 1,3 mm, pédicelle 1,1mm, post-pédicelle 5,5mm, style 3mm. Thorax noir, calus huméral brun-rouge. Pattes noires à marques jaunes. Ailes brunies. Abdomen noir brillant.
64Remarque : Aucun Michotamia n’a pour l’instant été observé en Afrique (Scarbrough, 2010). Le post-pédicelle plus de deux fois plus long que le scape et le pédicelle réunis semble indiquer une première observation sur le continent africain. Malheureusement, nous n’avons pour étude qu’un exemplaire femelle et seule une étude des genitalia d’un mâle pourra confirmer ou infirmer l’appartenance au genre. Dans l’attente, nous préférons ne pas nommer cette nouvelle espèce.

Figure 4 : Michotamia sp. nov. en vue latérale

Figure 5 : Michotamia sp. nov. en vue dorsale

Figure 6 : Michotamia sp. nov.– détail de l’antenne
Diopsidae
65Les 7 individus trouvés dans nos échantillons ont été identifiés comme étant 7 taxons différents (Figures 7-13), 4♂ et 3♀.
66Genre Trichodiopsis Séguy 1955
67Trichodiopsis pulchella (Eggers 1916) (avec pour synonyme junior Trichodiopsis interrupta Curran 1931) (Figure 7)
68Matériel : 1♀, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 16-23.IX.2018, Y. Braet & A. Gué

Figure 7 : Trichodiopsis pulchella (Eggers 1916)
69Trichodiopsis exquisita (Brunetti 1928)
70Matériel : 1♂, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 7-14.VII.2019, Y. Braet & A. Gué

Figure 8 : Trichodiopsis exquisita (Brunetti 1928)
71Genre Diasemopsis Rondani 1875
72Diasemopsis villiersi Séguy 1955
73Matériel : 1♂, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 22.V.-4.VI.2018, Y. Braet & A. Gué
74Lindner (1962) a désigné cette espèce comme synonyme de Diasemopsis conjuncta Curran 1931. Il n’a cependant pas examiné le type de villiersi, lequel a été vu par les Feijen qui confirment la validité de l’espèce (Feijen, communication personnelle : So Diasemopsis villiersi is a correct name. The synonymy proposed by Lindner and followed by Cogan & Shillito (1980) is rejected. Steyskal (1972) completely forgot Dias. villiersi in his catalogue. We examined the type of villiersi in Paris).

Figure 9 : Diasemopsis villiersi Séguy 1955
75Diasemopsis signata (Dalman 1817)
76Matériel : 1♂, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 22.V.-4.VI.2018, Y. Braet & A. Gué
77Cette espèce est mieux connue sous le nom de son synonyme junior Diasemopsis fasciata (Gray 1832).

Figure 10 : Diasemopsis signata (Dalman 1817)
78Diasemopsis silvatica Eggers 1916
79Matériel : 1♂, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 15-22.IX.2019, Y. Braet & A. Gué

Figure 11 : Diasemopsis silvatica Eggers 1916
80Diasemopsis thaxteri species-group
81Matériel : 1♀, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 14-21.X.2018, Y. Braet & A. Gué

Figure 12 : Diasemopsis thaxteri species-group
82Genre Diopsis Linnaeus 1775
83Diopsis ichneumonea species-group
84Matériel : 1♀, Ivory Coast, Man, Mt Tonkoui, 07°27’N 07°38’14’’W, 1200m, 14-21.X.2018, Y. Braet & A. Gué
85Remarque sur l’étiquette d’identification : Black collar.

Figure 13 : Diopsis ichneumonea species-group
DISCUSSION
Asilidae
86A ce jour, 45 espèces d’Asilidae ont été recensées de Côte d’Ivoire et parmi ces dernières, vingt sont renseignées sur le Mont Tonkoui. Elles appartiennent à 13 genres différents.
87Liste actualisée des Asilidae recensés sur le Mt Tonkoui :
88Genre Choerades Walker 1851
89Choerades aurifera (Ricardo 1925)
90Choerades lateralis (Fabricius 1805)
91Genre Damalis Fabricius 1805
92Damalis scutellata (Oldroyd 1970)
93Genre Euscelidia Westwood 1850
94Euscelidia lucida Oldroyd 1939
95Euscelidia procula (Walker 1849)
96Genre Heligmonevra Bigot 1858
97Heligmonevra lamtoensis Tomasovic & Dekoninck 2014
98Genre Leptogaster Meigen 1803
99Leptogaster sp.
100Genre Lobus Martin 1972
101Lobus janssensi Martin 1972
102Genre Michotamia Macquart 1838
103Michotamia n.sp.
104Genre Nannolaphria Londt 1977
105Nannolaphria sp.
106Genre Ommatius Wiedemann 1821
107Ommatius lurismus Oldroyd 1968
108Ommatius tonkoui n.sp.
109Genre Pegesimallus Loew 1858
110Pegesimallus kossouienis Tomasovic 2008
111Pegesimallus longicornis (Curran 1927)
112Pegesimallus oldroydi Londt 1982
113Pegesimallus oralis (Wulp 1884)
114Pegesimallus pedunculatus (Loew 1858)
115Genre Philodicus Loew 1847
116Philodicus fraternus (Wiedemann 1819)
117Genre Pygommatius Scarbrough & Marascia 2003
118Pygommatius porticus Scarbrought & Marascia 2003
119Genre Smeryngolaphria Hermann 1912
120Smeryngolaphria bromleyi Londt 1989
121Cette liste de vingt espèces est à mettre en relation avec la diversité observée dans les 5 autres relevés réalisés précédemment en milieu tropical humide : 15 espèces observées dans une forêt néotropicale humide du Panama (Barro Colorado Island) (Shelly, 1985) ; 9 espèces dans une savane tropicale chaude et humide, subéquatoriale du Congo Brazzaville (Réserve des Gorilles de Lésio-Louna) (Tomasovic, 2009) ; 5 espèces dans une forêt dense ombrophile en République démocratique du Congo (Réserve de la Biosphère de Luki) (Tomasovic & De Bakker, 2010) ; 16 espèces dans une forêt pluviale de plaine en Guyane française (Mitaraka) (Vieira, Camargo, Pollet & Dikow, 2019) ; 12 espèces dans les mangroves de Hong Kong (Tomasovic, Constant & Grootaert, 2020).
122A la lecture de ces relevés, le Mt Tonkoui constitue le site le plus riche en diversité d’espèces. Pas moins de 13 genres y ont été relevés. N’oublions cependant pas que de nombreux facteurs influencent la collecte des insectes comme la durée de l’enquête, l’effort d’échantillonnage et les types de piège utilisés.
123La diversité en Asilidae semble plus importante en forêt tropicale sèche (forêt caducifoliée). Notons à titre d’exemple qu’une campagne de collecte, réalisée au Mexique à l’aide de 8 pièges Malaise sur une période de 3 ans (2015-2018), a permis de relever 36 espèces d’Asilidae dont 11 nominales et 25 morpho-espèces. Étonnamment, c’est la saison des pluies qui a été la plus riche en diversité spécifique (Bello-Morales et al., 2020). Les identifications n’ayant pas toutes été poussées jusqu’à l’espèce, il convient cependant d’être également prudent dans l’exploitation de ces résultats.
Diopsidae
124Sur base du présent relevé et de la littérature, la liste actualisée des espèces de Côte d’Ivoire comporte 19 taxons. Il ne faut en aucun cas se fier à cette liste pour tenter d’identifier un spécimen de Côte d’Ivoire, tant cette liste semble peu exhaustive, au regard de l’impressionnante diversité d’espèces rencontrées dans notre échantillon anecdotique.
125Espèces citées précédemment de Côte d’Ivoire
126(Séguy, 1955 ; Steyskal, 1972 ; Feijen, 1978 ; Feijen, 1981 ; Feijen, 1983 ; Feijen & Feijen, 2012)
127Genre Centrioncus Speiser 1910
128Centrioncus decellei Feijen 1983
129Genre Diopsina Curran 1928
130Diopsina africana (Shillito 1940)
131Genre Diopsis Linnaeus 1775
132D. apicalis Dalman 1817
133D. collaris Weswood 1831
134D. macrophthalma Dalman 1817
135D. fumipennis Westwood 1837
136D. ornata Westwood 1837
137Genre Diasemopsis Rondani 1875
138D. meigenii (Westwood 1837)
139D. elegantula Brunetti 1926
140D. siderata (Séguy 1955)
141D. thomyris (Séguy 1955)
142Genre Trichodiopsis Séguy 1955
143T. minuta Seguy, 1955
144Nouvelles espèces pour la Côte d’Ivoire
145Genre Diasemopsis Rondani 1875
146Diasemopsis villiersi Séguy 1955
147Diasemopsis signata (Dalman 1817)
148Diasemopsis silvatica Eggers 1916
149Diasemopsis thaxteri (groupe d’espèces)
150Genre Diopsis Rondani 1875
151Diopsis ichneumonea (groupe d’espèces)
152Genre Trichodiopsis Séguy 1955
153Trichodiopsis pulchella (Eggers 1916)
154Trichodiopsis exquisita (Brunetti 1928)
CONCLUSION
155Une récente publication, d’une vingtaine d’auteurs, vient confirmer que le Mont Tonkoui constitue un milieu naturel présentant une biodiversité remarquable (botanique, ornithologique et entomologique) mais aussi qu’il assure des fonctions écologiques et socioculturelles très particulières. Cette étude de Moretto et al. (2021) s’inscrit dans la perspective d’un renforcement du statut de protection du site et invite à ce qu’il soit classé comme réserve naturelle.
156La diversité des Asilidae et des Diopsidae présentée ici plaide également en faveur d’une protection du site. N’est-il pas remarquable qu’un échantillon résiduel de 7 Diopsidae soit constitué d’autant d’espèces ? Nous avons également vu que le site présente actuellement la plus grande diversité en Asilidae observée en milieu tropical humide. Puisse donc ce biotope être protégé et valorisé dans les années à venir.
Remerciements
157Merci à Yves Braet, qui a participé à la campagne d’échantillonnage et nous a transmis les spécimens capturés. Nous tenons aussi particulièrement à remercier les époux Hans et Cobi Feijen pour l’identification des Diospidae retrouvés dans ces échantillons.
Bibliographie
Bello-Morales F.A., Sandoval-Ruiz C.A. & Estrada, A., 2020. Diversity of robber flies (Diptera: Asilidae) in a tropical deciduous forest of central Mexico. Acta Zoológica Mexicana (nueva serie), 36, 1–13. https://doi.org/10.21829/azm.2020.3612281
Cogan B.H. & Shillito J.F., 1980. Family Diopsidae. In : CROSSKEY R.W. Catalogue of the Diptera of the Afrotropical region. British Museum, London, 583-587.
Da Lage A. & Métailié G., 2015. Dictionnaire de biogéographie végétale. CNRS Editions, 962p.
Delfosse E., 2006. Les Mouches de la famille des Diopsidae (Insecta : Diptera). Le Bulletin d’Arthropoda, 27, 31-38.
Feijen H., 1978. Diopsidae (Diptera: Acalyptratae) from Togo and Zaïre. Stuttgarter Beiträge zur Naturkunde. A (Biologie), 318, 1-25.
Feijen H., 1981. A review of Diopsina Curran, 1928 (Diptera: Diopsidae), with a note on Cyrtodiopsis. Annals of the Natal Museum, 24, 465-482.
Feijen H., 1983. Systematics and phylogeny of Centrioncidae, a new afromontane family of Diptera (Schizophora). Zoologische Verhandelingen, 202(1), 1-137.
Feijen H. & Feijen C., 2012. A New Species of Diopsis L. (Diptera: Diopsidae) from South Africa and Swaziland, and brief review of African species with a large apical wing spot. African Invertebrates, 53(1), 125-142. https://doi.org/10.5733/afin.053.0107
Lindner E., 1962. Studien an afrikanischen Diopsiden (Dipt.). Stuttgarter Beiträge zur Naturkunde, 94, 1-18.
Londt J.G.H., 1989. Afrotropical Asilidae (Diptera) 18. The genus Smeryngolaphria Hermann, 1912 (Laphriinae). Annals of the Natal Museum, 30, 147-157.
Londt J.G.H. & Dikow T., 2017. 48. Asilidae (Assassin Flies or Robber Flies). In : Kirk-Spiggs, A.H. & B.J. Sinclair (eds), Manual of Afrotropical Diptera, vol. 2. Nematocerous Diptera and lower Brachycera. Suricata 5, SANBI, Pretoria, 1097-1182.
Moretto P., Cosson B., Takano H., Basquin P., Bordat P., Boucher S., Bouyer T., Danflous S., Dérozier V., Eitschberger U., Juhel P., Leroy É., Limbourg P., Massa B., Meunier J.-Y., Miles W., Orbach E., Robiche G., Rojkoff S. & Silvestre G., 2021. Un refuge forestier menacé : La forêt d’altitude à Parinari du Mont Tonkoui en Côte d’Ivoire. Évaluation de la biodiversité entomologique, botanique et ornithologique. Valeurs de conservation du site. Catharsius La Revue, Hors-série n°1, 1-123.
Oldroyd H., 1968. Contibutions à la connaissance de la faune entomologique de la Côte d’Ivoire (J. Decelle, 1961-1964). Première partie. XXV.- Diptera Asilidae. Annales du Musée royal de l’Afrique centrale, Sciences zoologiques, 165, 381-395.
Scarbrough A.G. & Marascia C.G., 2003. Revision of Ommatius Wiedemann (Diptera : Asilidae). IV. Pygommatius subgen. nov. with twenty-five Afrotropical species. Zootaxa, 228(1), 1-94. https://doi.org/10.11646/zootaxa.228.1.1
Scarbrough A.G., 2010. An overview of the Afrotropical Ommatiinae (Diptera : Asilidae) with a key to genera. Zootaxa, 2540(1), 1-47. https://doi.org/10.11646/zootaxa.2540.1.1
Scarbrough A.G. & Hill H., 2005. Pygommatius Scarbrough & Marascia, a valid ommatiine genus (Diptera: Asilidae) with new combinations and new species from the Philippines. Zootaxa, 1055(1), 1–22. https://doi.org/10.11646/zootaxa.1055.1.1
Séguy E. 1955. Diptères Diopsides africains nouveaux ou peu connus. Bulletin de l'Institut Français d'Afrique Noire (A), 17, 1102-1124.
Shelly T.E., 1985. Ecological comparaisons of robber fly species (Diptera-Asilidae) coexisting in a neotropical forest. Oecologia, 67, 57-70.
Steyskal G.C., 1972. A catalogue of species and key to the genera of the Family Diopsidae (Diptera: Acalyptratae). Stuttgarter Beiträge zur Naturkunde, 234, 1-20.
Tomasovic G., 2003. Smeryngolaphria bicolorala nouvelle espèce d’Asilidae de Madagascar (Diptera : Laphriinae, Laphriini). Notes fauniques de Gembloux, 51, 49-52.
Tomasovic G., 2008. Étude sur les espèces du genre Pegesimallus Loew, 1858 du Centre et Ouest Africain (Diptère : Asilidae). Bulletin de la Société royale belge d’Entomologie, 144, 144-156.
Tomasovic G., 2009. Première liste d’Asilidae du Congo Brazzaville (Réserve des Gorilles de Lésio-Louna) et description de trois nouvelles espèces. Bulletin de la Société royale belge d’Entomologie, 145, 129-136.
Tomasovic G., 2018. Contribution à la connaissance des Asilidae (Diptera) de la Côte d’Ivoire. Entomologie Faunistique-Faunistic Entomology, 71, 1-8. https://popups.uliege.be/2030-6318/index.php?id=4195
Tomasovic G. & Dekoninck W., 2014. Apport à la connaissance des Heligmonevra de l’Afrique Occidentale et description d’une nouvelle espèce (Diptera : Asilidae). Bulletin de la Société royale belge d’Entomologie, 150(2), 158-162.
Tomasovic G. & De Bakker D., 2010. Asilidae dans la canopée en Réserve Biosphère de Luki (Mayombe, Bas-Congo, République Démocratique du Congo) (Diptera: Brachycera). Bulletin de la Société royale belge d’Entomologie, 146(1), 53-61.
Tomasovic G. & Grootaert P., 2010. Asilidae (Diptera) from mangrove, an unusual habitat for robber flies (Southeast Asia, Singapore). Bulletin de la Société royale belge d’Entomologie,146(2), 151-156.
Tomasovic G., Constant J. & Grootaert P., 2020. Robber flies from mangroves in Hong Kong (Diptera: Asilidae). Belgian Journal of Entomology, 91, 1-22.
Vieira R., Camargo A., Pollet M. & Dikow T., 2019. Updated checklist of French Guianan Asilidae (Diptera) with a focus on the Mitaraka expedition. Zoosystema, 41(23), 1-24. https://doi.org/10.5252/zoosystema2019v41a23
(28 Réf)