Importance nutritionnelle du manioc et perspectives pour l’alimentation de base au Sénégal (synthèse bibliographique)
Institut de Technologie Alimentaire. Route des Pères Maristes. BP 2765. Dakar (Sénégal). E-mail : yunusdiallo@gmail.com
Institut de Technologie Alimentaire. Route des Pères Maristes. BP 2765. Dakar (Sénégal).
Université Cheikh Anta Diop. École Supérieure Polytechnique. Département Génie Chimique et Biologie Appliquée. BP 5085. Dakar (Sénégal).
Institut de Technologie Alimentaire. Route des Pères Maristes. BP 2765. Dakar (Sénégal).
Institut de Technologie Alimentaire. Route des Pères Maristes. BP 2765. Dakar (Sénégal).
Univ. Liège - Gembloux Agro-Bio Tech. Unité Analyses, Qualité, Risques. Laboratoire de Chimie Analytique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Univ. Liège - Gembloux Agro-Bio Tech. Unité Analyses, Qualité, Risques. Laboratoire de Chimie Analytique. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Reçu le 5 juillet 2012, accepté le 4 juin 2013
Résumé
Le manioc fait partie des principales plantes à racines amylacées cultivées dans le monde. En 2008, la production totale de manioc en Afrique de l’Ouest représentait 29 % de la production mondiale. Cependant, dans certains pays de cette région comme le Sénégal, le manioc n’a pas encore connu un réel développement dans l’alimentation de base de sa population. En effet, les potentialités d’utilisation alimentaire du manioc ne sont pas assez connues. Par ailleurs, la composition chimique et la toxicité des variétés locales consommées restent à déterminer. En 2004, le Gouvernement avait initié une vaste campagne d’intensification de la production nationale en manioc pour remédier au problème de sécurité alimentaire, car cette denrée constitue une importante source de calories et une intéressante option face aux céréales importées comme le riz et le blé. De nombreux produits dérivés du manioc sont connus dans la sous-région et dans les marchés internationaux mais au Sénégal, ces produits sont limités et, par conséquent, le niveau de consommation est très faible. Parfois, ils sont retrouvés dans certains restaurants où Sénégalais et autres Africains les consomment. L’objectif de cette étude est de montrer la valeur nutritionnelle et les potentialités de valorisation des racines de manioc pour l’alimentation de base au Sénégal.
Abstract
Nutritional importance of cassava and perspectives as a staple food in Senegal. A review. Cassava is one of the main plants and starchy roots grown in the world. In 2008, the total yield of cassava in West Africa represented 29% of the world production. However, in many West African countries such as Senegal, cassava is not used as a staple food. In fact, the processing techniques used for cassava are poorly known. In addition, the chemical composition of local cassava varieties has not yet been determined, nor has their toxicity been assessed. In 2004, showing an aggressive agricultural policy and revived interest, the Senegalese government launched a major program for intensifying the production of cassava for food security purposes. Cassava is an important source of calories and can be an interesting option for imported rice and wheat. Although many food products made from cassava are well known in the region, their use in the Senegalese diet is rare. Nevertheless, these cassava products are found as delicacies in some restaurants, and are consumed by the Senegalese and many other Africans. The objective of the present study is to demonstrate the nutritional value and the dietary possibilities of using cassava as a staple food in Senegal.
1. Introduction
1Le manioc (Manihot esculenta Crantz), plante à racines riches en amidon et originaire de l’Amérique du Sud (Celis, 1982), est devenu une culture importante sous les tropiques.
2Le manioc se prête à la polyculture, il supporte la sècheresse et les sols infertiles (Ceballos et al., 2006). Son aptitude à se conserver en terre deux à trois ans après sa maturation lui confère des caractéristiques intéressantes (Kehinde, 2006).
3Le manioc est consommé par plus d'un demi-milliard de personnes (Cock, 1985). Selon la FAO, environ 118 millions de tonnes de manioc ont été cultivés en Afrique en 2008, soit 52 % de la production mondiale. Il est reconnu comme réserve alimentaire en cas de famine (Ceballos et al., 2006). C’est une des sources de calories de l'alimentation humaine dans les régions tropicales (Macrae et al., 1993). À ce titre, le manioc est capable de relayer des cultures vivrières telles que le mil, le maïs et le sorgho. Malgré son importance nutritionnelle, il présente deux inconvénients majeurs qui limitent son utilisation en alimentation humaine : une toxicité liée à la présence de composés cyanogènes et une faible teneur en protéines comprise entre 1 et 5 % MS (Stupak et al., 2006). Les variétés de manioc sont réparties en deux groupes, douces et amères. Les variétés douces sont utilisées artisanalement pour l’alimentation humaine, tandis que les amères ne le sont qu’après transformation industrielle (Rwamudanga, 1988).
4En Afrique de l’Ouest, la racine de manioc est utilisée principalement dans l’alimentation humaine sous diverses formes artisanales et industrielles, elle est aussi employée pour l’alimentation du bétail. Plusieurs produits dérivés du manioc sont commercialisés, parmi lesquels le gari, l’attiéké, les cossettes, l’amidon, le tapioca, le fufu, la farine brute, etc.
5Au Sénégal, l’utilisation et la consommation du manioc, bien qu’habituellement limitées, se développent de plus en plus de nos jours sous l’influence d’autres modes de consommation venant de la sous-région.
2. Culture du manioc : cas du Sénégal
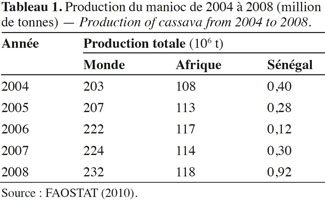
6Le manioc constitue un important aliment pour plus de 500 millions de personnes. C’est la cinquième production végétale alimentaire dans le monde après le maïs, le riz, le blé et la pomme de terre (Yéo, 2007). Le tableau 1 montre la production totale de manioc de 2004 à 2008 au niveau mondial, en Afrique et au Sénégal. En 2008, l’Afrique a assuré plus de la moitié (52 %) de la production annuelle mondiale dans laquelle la part du Sénégal est négligeable (0,4 %).
7Au Sénégal, la culture du manioc date d’avant l’indépendance (1960). Le manioc occupe une place relativement importante dans les activités agricoles puisqu’il participe pour 25 % de la quantité totale de légumes (Aïchatou, 2006). Selon les statistiques du Ministère de l’Agriculture, les résultats de la campagne agricole 2008/2009 révèlent que le manioc est cultivé principalement dans les régions de Thiès (78,2 %), Kaolack (7,2 %), Kolda (3,6 %), Fatick (3,4 %), Louga (2,9 %), Diourbel (1,8 %) et St Louis (1,2 %) et moins de 1 % dans le reste du pays. Plusieurs variétés ont été recensées. Elles sont soit des cultivars locaux comme Soya, Kombo 1 et Ordinaire ; soit des cultivars sélectionnés par la recherche et actuellement limités dans la région de Thiès comme Kombo 2, 30555, 30337, 30572 et 30786 (MAEH, 2004).
8En 2004, un accroissement de la production nationale de manioc de 120 % a été obtenu par rapport à la production de l’année 2003 qui était de 182 494 t. Ceci a été possible grâce à la mise en place d’un Programme Spécial de Relance de la Filière Manioc au Sénégal (PSRFMS) par Arrêté Ministériel – N°5737 MAEH du 09/07/2004 – du Gouvernement. Malgré les efforts d’intensification, une baisse notoire de la production en manioc a été observée durant les années 2005 et 2006 (Tableau 1). Elle a été liée à plusieurs facteurs, entre autres la rareté des pluies, le déficit de protection phytosanitaire des cultures, l’absence de technologies de conservation et de transformation post-récolte, l’insuffisance de débouchés qui, à la limite, a contribué à la forte réduction du nombre de producteurs. Pour résorber ce déficit, le Président de la République initia en avril 2008 la Grande Offensive Agricole pour la Nourriture et l’Abondance (GOANA). Ce vaste programme avait comme objectif global d’assurer une quantité suffisante en nourriture afin d’atteindre l’autonomie et la souveraineté alimentaire en s’appuyant sur les potentialités de chaque région. Parmi les objectifs spécifiques qui y sont déclinés, figure la production de trois millions de tonnes de racines de manioc. Des résultats satisfaisants ont été obtenus la première année avec une augmentation de la production de 198 % par rapport à l’année 2007 et de 84 % pour les surfaces emblavées. Comme l’indique le tableau 1, la production du manioc au Sénégal en 2008 était estimée à 0,92·106 t, soit 1,44 % de celle de l’Afrique de l’Ouest. Les rendements sont passés de 6,73 t·ha-1 en 2004 à 8,13 t·ha-1 en 2008 contre une moyenne mondiale de 12,44 t·ha-1 (FAOSTAT, 2010).
9Les fluctuations notées ces dernières années sur la production nationale montrent qu’il n’y a pas de contrainte agro-écologique majeure qui pourrait s’opposer à la diffusion géographique de cette culture résistante à la sècheresse, tolérante à la pauvreté chimique des sols et adaptée aux systèmes de culture traditionnels au Sénégal. Des terres arables sont disponibles à l’intérieur du pays (régions de Kolda, Ziguinchor, Diourbel, Matam, St Louis et Louga, etc.) et constituent un véritable manque à gagner pour cette filière du fait de l'intérêt croissant qui lui est porté comme culture contribuant à la sécurité alimentaire. À l’heure actuelle, il apparait que la transformation est un facteur limitant l’extension du manioc au Sénégal. En effet, outre les aspects quantitatifs liés à sa production, il importe d’envisager sa transformation qui reste la seule voie durable de préservation post-récolte et qui permet, en plus de la détoxification, la conversion du produit sous une forme stockable (Aryee et al., 2006).
10L’analyse de la situation actuelle des différents maillons de la filière, la connaissance de l’intérêt nutritionnel du manioc par les consommateurs, la maitrise des procédés technologiques de transformation post-récolte et la diversification des produits dérivés du manioc constituent, en perspectives, des voies de réponse à cette préoccupation majeure.
3. Valorisation post-récolte du manioc
11Le manioc est utilisé pour l'alimentation humaine et animale. Il sert de matière première dans les industries pour la production d’éthanol, de vinaigre, d’adhésifs, de textiles et en imprimerie.
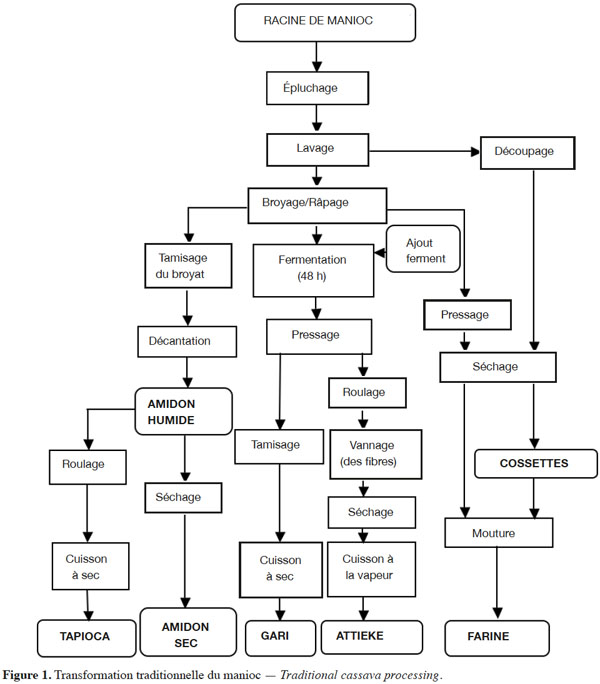
12Selon Lancaster et al. (1982), cette racine est consommée sous diverses formes : crue, cuite ou transformée. En Afrique, les produits dérivés de la transformation sont variés et diffèrent selon les zones : cossettes, farine brute, gari, tapioca, etc. D’aucuns sont fréquemment consommés dans des contrées plus que d’autres : c’est le cas de l’attiéké en Côte d’Ivoire, du gari au Bénin, du fufu au Ghana, du Chikwangue au Congo, de la farine au Nigéria. La figure 1 présente le processus de fabrication traditionelle de certains produits dérivés comme l’amidon, le tapioca, les cossettes, l’attiéké, le gari et la farine brute.
13Une étude diagnostic menée au Sénégal par Guèye (2009) permet de faire une analyse assez exhaustive de l’état de la filière manioc au Sénégal.
3.1. Situation de la transformation du manioc au Sénégal
14Transformation artisanale. Elle est essentiellement menée par des unités de tranformation plus ou moins spécialisées ou par des Groupements d’Intérêt Économique (GIE). Au moins huit structures sont identifiées dans le pays. La variété ‘Soya’ est la plus transformée suivie de la variété ‘Kombo 1’. Les produits dérivés du manioc les plus fréquemment produits sont l’attiéké, le gari, l’amidon et les cossettes. Seulement quelques rares unités produisent des beignets ou des produits pâtissiers à la demande.
15Attiéké. Au Sénégal, la description du mode de préparation de l’attiéké ne correspond pas du tout à celle traditionnellement fabriquée notamment en Côte d’Ivoire. Alors que l’attiéké authentique est fabriqué à partir de la râpure de manioc fermentée, roulée, séchée et cuite à la vapeur (Figure 1), la farine de manioc est séchée et ensuite cuite à la vapeur sans subir de fermentation préalable, une étape fondamentale qui influe grandement sur les caractéristiques organoleptiques.
16Gari. Les cossettes de manioc sont broyées pour obtenir une farine grossière qui est tamisée et le produit obtenu après cuisson est appelé gari. Le gari traditionnel s’obtient après râpage, pressage de la râpure, fermentation puis cuisson à sec et séchage (Figure 1).
17Amidon. L’amidon produit au sein des unités de transformation est décrit comme une bouillie préparée à partir de la farine de cossettes, alors que l’amidon authentique est obtenu directement après décantation du broyat des racines de manioc qui est ensuite séché et conditionné (Figure 1).
18Cossettes et farine de cossettes. Le traitement le plus largement répandu est l’épluchage, suivi d’un découpage sommaire, puis d’un lavage et d’un séchage solaire pendant 3 à 7 jours. Ces cossettes sont ensuite moulues en farine qui sera utilisée pour la fabrication de produits secondaires, tels les beignets et gâteaux, qui s’obtiennent par friture d’une pâte faite avec la farine mélangée à la farine de blé à des proportions allant respectivement de 30 à 75 %.
19Les produits à base de manioc issus de la transformation artisanale sont généralement conditionnés dans des sachets en plastique de diverses tailles, dans des jarres ou dans des bols et parfois stockés de 3 à 6 mois.
20Transformation semi-industrielle. La transformation semi-industrielle du manioc est très peu développée et se limite principalement aux activités du groupe SOPROKA (Société des Produits Kaftan) installée à Dakar et spécialisée dans la fabrication de « Gomme – Kaftan » servant à l’amidonnage des habits ; la Manufacture Africaine d’Amidonnerie du Sénégal (MAADAS) installée à Thiès produisant de l’amidon, du gari, de l’attiéké.
3.2. Situation de la commercialisation du manioc au Sénégal
21Commercialisation des racines fraiches de manioc. Le manioc frais doit être écoulé dans les 48 à 72 h qui suivent sa récolte, du fait de sa teneur élevée en eau favorable à la prolifération de micro-organismes.
22Dans les pratiques habituelles, les racines fraiches de manioc sont commercialisées sous deux formes :
23– vente directe à la parcelle de la production,
24– vente des racines fraiches dans les marchés ruraux et grands centres urbains à proximité des zones de production.
25Les prix peuvent osciller de 9 000 à 25 000 FCFA pour 70 à 80 kg. C’est en plein hivernage, au moment où le marché des légumes connait une forte pénurie, que les prix sont plus intéressants. Le manioc frais ne fait pas encore officiellement l’objet d’exportation ou de transaction commerciale et économique dans les marchés sous-régionaux et internationaux. Cependant, de faibles flux sont souvent observés vers les pays frontaliers, notamment la Mauritanie.
26Commercialisation des produits artisanaux transformés. La commercialisation des produits dérivés du manioc n’est pas encore très développée à cause de la faiblesse des capacités de production des unités de transformation. L’écoulement se fait en général à domicile, au marché local, lors des foires ou dans les centres urbains. La clientèle est majoritairement individuelle.
3.3. Situation de la consommation du manioc au Sénégal
27Au Sénégal, le manioc est peu consommé (environ 23 % par rapport à la moyenne des productions annuelles de 2004 à 2008). Il sert en grande partie comme légume d’accompagnement dans les plats de base et il constitue encore un très faible niveau de revenus pour les populations locales. Les produits issus de la transformation comme l’attiéké et le gari entrent timidement dans les habitudes alimentaires des Sénégalais. En effet, les transformations artisanale et semi-industrielle n’absorbent respectivement que 0,60 % et 9 % par rapport à la moyenne des productions annuelles de 2004 à 2008. La part la plus importante du manioc produit est donc vouée à l’alimentation du bétail.
28Parmi les raisons qui limitent la consommation du manioc, il y a, entre autres, les contraintes liées à la transformation (pénibilité des travaux, difficulté d’approvisionnement, prix élevés des racines fraiches, déficit de matériel adéquat), à la conservation (emballage, infestation) et à la commercialisation (méconnaissance des produits et de leur valeur nutritionnelle, concurrence des produits à base de manioc importés).
3.4. Organisation de la filière du manioc au Sénégal
29L’analyse de la chaine de valeur du manioc au Sénégal montre clairement que les activités des différents maillons de la filière (producteurs, transformateurs, distributeurs ou commerçants) ne sont pas suffisamment coordonnées entre elles.
30Au niveau des zones de production, des regroupements existent sous forme de collèges dans le but de bénéficier de l’appui financier des pouvoirs publics ou de bailleurs de fonds. Il y a donc nécessité de pouvoir regrouper les divers intervenants au sein d’un cadre interprofessionnel d’envergure nationale pour assurer un développement durable de cette spéculation.
4. Principaux constituants chimiques du manioc
31La racine, partie la plus exploitée, est essentiellement riche en glucides avec de faibles teneurs en matières grasses. Ces teneurs varient en fonction de la variété, de la localité, de l’âge de la plante récoltée et des conditions environnementales (Balagapolan et al., 1988) (Tableau 2).
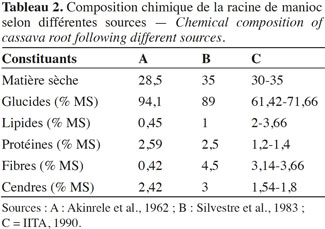
32Selon Okezie et al. (1982), la teneur en eau des racines varie entre 51 et 71 % MF ; celle des sucres, entre 30 et 35 % MS et les protéines entre 0,6 et 2,6 % MS. Ces auteurs ont noté une faible quantité de vitamines et de minéraux et précisent que la cellulose et l’hémicellulose constituent moins de 7 % MS. L’amidon est le constituant majeur des hydrates de carbone avec des teneurs comprises entre 64 et 87 % MS, l’une des caractéristiques de l’amidon de manioc est sa faible teneur en amylose : environ 17 % MS, comparée aux amidons de pomme de terre (22 % MS) et de maïs (21 % MS). Les protéines du manioc sont riches en arginine et faibles en certains acides aminés essentiels tels que la méthionine, la lysine, le tryptophane, la phénylalanine et la tyrosine (Falade et al., 2010).
33L’apport nutritif du manioc est donc considérable : il est riche en calories et peut être très utile pendant les périodes de soudure. Cependant, il a été démontré que les racines présentent une certaine toxicité liée à l’occurrence de composés cyanogénétiques, facteurs anti-nutritionnels qui viennent s’ajouter à la faible teneur du manioc en protéines, en vitamines et minéraux. Toutefois, cette toxicité peut être atténuée, voire même éliminée, dans les produits finis prêts à la consommation.
5. Composés cyanogénétiques et leur toxicité
34Le manioc contient deux glucosides cyanogénétiques : la linamarine (93 à 97 %) et une faible quantité de lotaustraline (3 à 7 %) (Cumbana et al., 2007).
5.1. Biosynthèse et dégradation des composés cyanogènes
35Selon Fokunang et al. (2001), la linamarine est synthétisée dans les pétioles des jeunes feuilles, accumulée dans les vacuoles des cellules foliaires et véhiculée des feuilles via le phloème aux racines. La synthèse des glucosides et leur stockage dans les organes sont des processus naturels dans la plante (Nzigamasabo et al., 2006). Les glucosides cyanogénétiques et les enzymes nécessaires pour leur dégradation sont tous présents séparément dans la plante (McMahon et al., 1995).
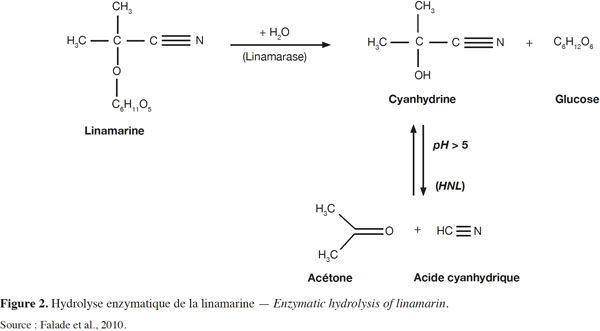
36Lorsque les tissus du manioc sont endommagés et les structures cellulaires dérangées, linamarine et lotaustraline entrent en contact respectivement avec la linamarase et la β-glucosidase, enzymes qui les dégradent en glucose et en cyanhydrine. L’activité de la linamarase est optimale à pH = 6-7 et à une température de 55 °C (Fokunang et al., 2001). Quand le pH est voisin de 5, l’hydroxy nitrile lyase (HNL) catalyse la dégradation de la cyanhydrine en acétone et en acide cyanhydrique (HCN), qui est volatil et très toxique (Janos, 2000 ; Kimaryo et al., 2000). Cette réaction peut avoir lieu spontanément lorsque les températures sont supérieures à 35 °C et à pH > 4 (White et al., 1994). La figure 2 montre le processus de dégradation enzymatique de la linamarine. Les produits issus de cette dégradation seraient responsables d’une certaine toxicité.
5.2. Toxicité des composés cyanogénétiques
37La teneur en composés cyanogénétiques varie avec l’organe de la plante, l’âge, la variété et les conditions environnementales comme le sol, l’humidité et la température (Nzigamasabo et al., 2006). Il a été prouvé que le transfert des génotypes de manioc d’une localité à une autre peut modifier la teneur en composés cyanogènes des racines à cause du changement climatique et des caractéristiques du sol (IITA, 1993). Au Nigéria, Bokanga et al. (1994) ont pu observer cette différence sur une même variété.
38Selon le taux de libération de l’acide cyanhydrique sur des racines fraiches épluchées, les variétés de manioc peuvent être classées comme suit :
39– variétés « inoffensives » : moins de 50 mg HCN·kg-1 ;
40– variétés modérément « toxiques » : entre 50 à 100 mg HCN·kg-1 ;
41– variétés fortement « toxiques » : plus de 100 mg HCN·kg-1 (Kobawila et al., 2005).
42Les glucosides cyanogénétiques, en tant que tels, ne sont pas toxiques, mais une fois ingérés par l’homme, ils subissent une décomposition en acide cyanhydrique par les enzymes de la flore intestinale (Ouegnin, 1988). La dose de 1 mg HCN·kg-1 de poids vif est considérée comme susceptible d’entrainer des intoxications aigües chez l’homme (Silvestre et al., 1983). D’autres auteurs comme Shibamoto et al. (1993) ont situé la dose létale minimale entre 0,5 et 3,5 mg HCN·kg-1 de poids corporel. Chez les animaux, la dose létale est de 1 mg HCN·kg-1 de poids vif. Néanmoins, les animaux polygastriques sont capables d’ingérer des doses 3 à 4 fois plus élevées sans danger (Silvestre et al., 1983).
43La teneur en acide cyanhydrique fixée par la FAO doit être inférieure ou au plus égale à 10 mg HCN·kg-1 de produit (Yéo, 2007). Wilson (1973) conclut que la toxicité due au manioc est surtout dangereuse lorsqu’il y a un contexte naturel de carence en protéines, ce qui a été confirmé par Jones (1998). En effet, le soufre qui intervient dans les réactions de synthèse des protéines est présent dans les acides aminés tels que méthionine et cystéine. Il joue un rôle important dans les réactions d’oxydoréduction lors de la respiration cellulaire. Le soufre se lie aux ions cyanures pour donner du thiocyanate, une forme de détoxification suivant la réaction : 8CN- + S8 → 8SCN-.
44Par ailleurs, l’amertume constatée dans certaines variétés de manioc ne serait pas seulement liée à la présence de composés cyanogénétiques. Selon King et al. (1995), il existe plusieurs composés dont l’IAG (Isopropyl–β-D-Apiofuranosyl–(1-6)–β-D-Glucopyranoside) qui contribuent davantage à l’amertume du manioc, contrairement à la linamarine.
45Des études nutritionnelles sur les variétés de manioc cultivées au Sénégal auraient permis une meilleure classification des écotypes suivant la teneur en composés cyanogénétiques. Néanmoins, Guede (2011) a pu obtenir sur des racines de certaines variétés des teneurs allant de 104 à 271 mg·kg-1 HCN (MF).
5.3. Pathologies liées aux composés cyanogénétiques et traitements
46La consommation régulière de manioc est à l’origine de plusieurs troubles pathologiques dus à la présence des produits de dégradation des composés cyanogénétiques (Tylleskär et al., 1992). Sont notamment cités : le goître thyroïdien, le nanisme et la neuropathie tropicale ataxique (Kobawila et al., 2005). Les individus atteints de neuropathie ont une faible teneur en soufre dans leur sang et une concentration élevée en thiocyanates (Bennett et al., 1987). Osuntokun (1981) a montré que l’ingestion du manioc avec une carence en iode est un facteur étiologique du goître endémique. En outre, une forte consommation de cyanure provenant de la farine de manioc provoque une maladie appelée Konzo. Celle-ci consiste en une paralysie irréversible des jambes chez les enfants et les femmes en âge de procréer, qui se produit dans de nombreux pays d'Afrique australe, orientale et centrale (Essers et al., 1992). D’après Cardoso et al. (2005), cette maladie n'a pas été signalée en Afrique de l'Ouest probablement parce que le gari et les autres produits transformés issus du manioc renferment moins de cyanure.
47Les ions cyanures – CN- – se lient à l’ion ferrique du cytochrome-oxydase, enzyme mitochondriale responsable des oxydations cellulaires chez les êtres vivants aérobies (Friedman, 1980) et provoquent l’inhibition de l’enzyme. Il s’ensuit une hypoxie cytotoxique qui entraine dysfonctionnement et mort cellulaire (Gruhnert et al., 1994).
48L’intoxication au cyanure est traitée par administration d’amyle nitrite (Akanji et al., 1990) qui facilite la respiration cellulaire. Les études de Vick et al. (1991) montrent que l’usage de nitrite de sodium par voie intraveineuse, de diméthylaminophénol et d’hydrochlorure d’hydroxylamine par voie intramusculaire et d’amyle nitrite par inhalation sont efficaces pour surmonter la dose létale de cyanure. La détoxification du cyanure est aussi facilitée par l’administration de thiosulfate nécessaire à la formation en thiocyanates : CN- + S2O32- → SCN- + SO32- (Fokunang et al., 2001).
6. Qualité des produits transformés
6.1. Qualité biochimique et nutritionnelle
49La nécessité de détoxifier constitue l’une des préoccupations majeures de tout procédé de transformation du manioc tant pour l’alimentation humaine qu’animale.
50Le séchage à des températures de 40 °C, l’ébullition, la fermentation, le grillage (Padmaja, 1995) et le stockage (Mahungu et al., 1987) entrainent une baisse significative de la teneur initiale en glucosides cyanogénétiques contenus dans le manioc. Par ailleurs, le rouissage est une opération unitaire importante pour la détoxification du manioc. Il consiste à faire immerger des racines fraiches de manioc dans de l’eau pendant 3 à 6 jours. Il se produit une fermentation au cours de laquelle des activités microbiennes se combinent à l’action d’enzymes pour ramollir les racines, dégrader les composés cyanogénétiques et conférer aux produits finis leurs gouts caractéristiques (Ampe et al., 1992).
51L’acide cyanhydrique est soluble dans l’eau et se volatilise dans l’air lorsque la température est supérieure à 28 °C. Delange et al. (1982) constatent une perte durant le transport et l'entreposage des racines liée au contact entre enzyme et substrat dû notamment aux « blessures » causées aux racines. Cependant, d’après Cardoso et al. (2005), il y a encore une rétention de 12 à 33 % de cyanure dans la farine de manioc produite dans l'Est, le Sud et en Afrique centrale. Pour le gari produit en Afrique occidentale et la farinha dans le Centre et le Sud de l'Amérique, les travaux de Dufour (1994) et Oke (1994) situent la rétention de cyanure entre 1,8 et 2,4 %. Bradbury (2006) a décrit une méthode simple qui consiste à mouiller la farine avant sa cuisson pour en réduire considérablement la teneur en cyanure.
6.2. Qualité microbiologique
52Darboux et al. (2004) ont décelé la présence de plusieurs moisissures appartenant principalement aux genres Aspergillus, Fusarium et Mucor. Leurs travaux ont révélé aussi une influence de l’emballage sur leur prolifération. Darman et al. (2007) ont relevé un taux élevé de moisissures dans le gari et dans les cossettes de manioc. Il est rapporté par Moorthy et al. (1998) que Corynebacterium sp. et Geotricum candidum sont responsables de l’acidité et de la saveur lors de la production de gari. Okafor (1977) conclut que Leuconostoc est le germe le plus fréquent dans le gari. Par ailleurs, des micro-organismes aérobies mésophiles (jusqu’à 5,6 * 106 cfu·g-1 de poids à sec) sont retrouvés dans la pâte de racines de manioc fermentée (Bobolo). Kastner et al. (2007) citent les bactéries lactiques (jusqu'à 1011 cfu·g-1), les bacilles et levures (toutes deux jusqu'à 105 cfu·g-1) dans la gamme de flore microbienne naturelle qui se développe au cours de la transformation du manioc en attiéké. Saccharomyces cerevisiae, Lactobacillus plantarum, Lactobacillus brevis, Streptococcus faecalis et Escherichia coli apparaissent importants dans la fermentation du fufu et Bacillus sp., Klebsiella sp., Corynebacterium sp., Candida sp., Lactobacillus sp. sont observés dans la production du lafun (Moorthy et al., 1998).
53La fermentation des racines de manioc est de type lactique (pH 3,8) avec Lactobacillus sp. comme germe dominant de la microflore. Certains germes, tels que les bactéries lactiques, sont résistants aux forts taux de cyanure, 200 à 800 µg·g-1 (MF) (Kobawila et al., 2005). Leurs actions influencent grandement l’aspect organoleptique du produit fini et la fermentation permet la détoxification par hydrolyse des glucosides cyanogénétiques.
7. Perspectives pour la filière manioc au Sénégal
54Comme mentionné au § 2, la production annuelle de manioc augmente de plus en plus au Sénégal, compte tenu des différents programmes d’appui mis en place : PSRFM, GOANA, le plan Retour Vers l’Agriculture (REVA) et aussi le financement de projets de recherche par des bailleurs de fonds nationaux et internationaux. Malgré cela, la consommation reste très faible par rapport aux autres pays du Golfe du Bénin. La quantité de racines disponibles peine à être commercialisée et les producteurs sont obligés de les laisser sous terre après leur phase de maturité.
55L’insuffisance d’unités de transformation spécialisées, l’absence de matériels de transformation adéquats, la mise au point de divers produits à partir du manioc, la connaissance de la valeur alimentaire du manioc, la faible durée de conservation post-récolte des racines et la déficience des savoir-faire technologiques domestiques constituent autant de contraintes qui n’ont pas particulièrement été satisfaites par les programmes de développement des pouvoirs publics.
56En guise de solution, des actions sont à entreprendre, à savoir la sensibilisation et la formation des transformateurs, l’augmentation de la capacité des unités de production par la disponibilité d’équipements adéquats, la sélection de cultivars améliorés aussi bien sur le plan génétique que chimique.
57Considérant les nombreuses possibilités de transformation alimentaire des racines, la mise au point de nouveaux produits à base de manioc et répondant aux habitudes culinaires des Sénégalais telles que le « Cere », le « ciakry », le « Arraw », le « Mbouraké » entre autres, constituent des voies pour optimiser la consommation de cette denrée. En effet, ces produits roulés à base de céréales (mil et maïs) et très prisés par les Sénégalais pourraient faire l’objet d’incorporation avec du manioc. De même, la production de farine destinée à la panification soutenue par des études d’aptitudes technologiques et sensorielles est à envisager dans le but de promouvoir la production de pains composés à base de farine mixte blé-manioc.
58Les variétés de manioc cultivées au Sénégal, surtout celles couramment consommées, n’ont pas fait, à l’heure actuelle, l’objet de caractérisations chimique et toxicologique poussées. Ces analyses sont nécessaires pour l’évaluation de la qualité nutritionnelle et sanitaire du manioc transformé.
8. Conclusion
59Avec la fluctuation des denrées de première nécessité et le déficit vivrier chronique, une nouvelle orientation de la politique de consommation au Sénégal est à envisager. Les habitudes alimentaires des ménages au Sénégal restent généralement basées sur les céréales comme le riz, le blé et le mil dont une part importante est importée. Certes, la production de manioc reste faible, mais elle pourrait constituer une intéressante option face aux céréales importées par la promotion de produits dérivés de qualité et destinés à l’alimentation de base. Il est important de noter que c’est par la transformation, maillon important de la chaine de valeur des produits agricoles, que le manioc pourra contribuer quelque peu à l’atteinte de la sécurité alimentaire des populations.
60Remerciements
61Les auteurs remercient tout particulièrement le FNRAA (Fonds National de Recherches Agricoles et Agro-alimentaires), le coordonnateur national des producteurs de manioc du Sénégal et l’Unité Analyses, Qualité, Risques, Laboratoire de Chimie Analytique de Gembloux Agro-Bio Tech qui ont rendu possible la recherche sur le manioc et sa valorisation.
Bibliographie
Aïchatou S.S.N., 2006. Étude comparative de « clones » de manioc (Manihot esculenta Crantz) selon leurs caractères agronomiques et leurs sensibilités aux ravageurs et maladies en zone sahélienne des Niayes, Sénégal. Mémoire DEA : FST/ISE, Université Cheikh Anta Diop de Dakar (Sénégal).
Akanji A.O., Adeyefa I., Charles-Davies M. & Osotimehin B.O., 1990. Plasma glucose and thiocyanate responses to different mixed cassava meals in non-diabetic Nigerians. Eur. J. Clinic. Nutr., 44, 71-77.
Akinrele I.A., Cook A.S. & Holgate R.A., 1962. The manufacture of gari from cassava in Nigeria. In: Proceedings of the first international congress of food and science technology, September 18-21, 1962, London. New York, USA; London; Paris: Gordon and Breach Science Publishers, 633-644.
Ampe F. & Brauman A., 1992. Le rouissage du manioc : une fermentation traditionnelle dévoilée. Biofutur, 114, 36-37.
Aryee F.N.A., Oduro I., Ellis W.O. & Afuakwa J.J., 2006. The physicochemical properties of flour samples from the roots of 31 varieties of cassava. Food Control, 17, 916-922.
Balagapolan C., Padmaja G., Nanda S.K. & Moorthy S.N., 1988. Cassava nutrition and toxicity. In: Hillocks R.J., Tresh J.M. & Belloti A.C. Cassava in food, feed and industry. Boca Raton, FL, USA: CRC Press, 13-36.
Bennett F., Morgan O., Golden M.H. & Stennett-Dawkins M., 1987. Plasma thiocyanate and free radicals in Jamaican neuropathy. West Indian Med. J., 36, 163-165.
Bokanga M., Ekanayake I.J., Dixon A.G.O. & Porto M.C.M., 1994. Genotype-environment interactions for cyanogenic potential in cassava. Acta Hortic., 375, 131-139.
Bradbury J.H., 2006. Simple wetting method to reduce cyanogen content of cassava flour. J. Food Compos. Anal., 19, 388-393.
Cardoso A.P. et al., 2005. Processing of cassava roots to remove cyanogens. J. Food Compos. Anal., 18, 451-460.
Ceballos H. et al., 2006. Variation in crude protein content in cassava (Manihot esculenta Crantz) roots. J. Food Compos. Anal., 19, 589-593.
Celis F., 1982. Manuel de phytotechnie des plantes à racines et tubercules amylacés. Ibadan, Nigeria : IITA.
Cock J.H., 1985. Cassava: new potential for a neglected crop. Boulder, CO, USA: Westview Press.
Cumbana A., Mirione E., Cliff J. & Bradbury J.H., 2007. Reduction of cyanide content of cassava flour in Mozambique by the wetting method. Food Chem., 101, 894-897.
Darboux J.G. & Ahounou J.L., 2004. Stockage des cossettes de manioc : tests comparatifs sur les emballages et structure de stockage. In : Fandohan P., Koudandé D., Houssou P. & Megnanglo M., éds. Actes de l’Atelier scientifique post-récolte PADSA/PTAA, aout 2003, Bohicon, Bénin.
Darman R.D., Ngang J.J.E. & Etoa F.X., 2007. Qualité nutritive, toxicologique et hygiénique de certains produits dérivés du manioc consommés au Cameroun. In : Amani G. et al., eds. Actes du 1er Atelier international sur les potentialités à la transformation du manioc en Afrique de l’Ouest, 4-7 juin 2007, Abidjan, Côte d’Ivoire, 223-227.
Delange F., Iteke F.B. & Ermans A.M., 1982. Nutritional factors involved in the goitrogenic action of Cassava. Ottawa, ON: IDRC.
Dufour D.L., 1994. Cassava in Amazonia: lessons in utilization and safety from native peoples. Acta Hortic., 375, 175-182.
Essers A.J., Alsen P. & Rosling H., 1992. Insufficient processing of cassava induced acute intoxications and the paralyctic disease Konzo in a rural area of Mozambique. Ecol. Food Nutr., 27, 17-27.
Falade K.O. & Akingbala J.O., 2010. Utilization of cassava for food. Food Rev. Int., 27(1), 51-83.
FAOSTAT, 2010. http://faostat.fao.org/site/339/default.aspx, (1/10/2013).
Fokunang C.N. et al., 2001. Cyanogenic potential in food crops and its implication in cassava (Manihot esculenta Crantz) production. Pak. J. Biol. Sci., 4(7), 926-930.
Friedman P.A., 1980. Common poisons. In: Isselbacher K.J. et al., eds. Harrison’s principles of internal medicine. 9th ed. London: McGraw-Hill International Student Edition, 953-965.
Gruhnert C., Biehl B. & Selmar D., 1994. Compartmentation of cyanogenic glucosides and their degrading enzymes. Planta, 195, 36-42.
Guede S.S., 2011. Mise au point d’une méthode pour le dosage des composés cyanogénétiques des principales variétés de manioc du Sénégal et de leurs produits dérivés. Mémoire : Master complémentaire en Sciences et Technologie des Aliments, Univ. Liège - Gembloux Agro-Bio Tech (Belgique).
Guèye M.T., 2009. Valorisation du manioc au Sénégal par la mise au point de produits transformés et de méthodes de conservation adaptées. Rapport Annuel. Projet FNRAA-Manioc. Dakar : Institut de Technologie Alimentaire (ITA).
IITA, 1990. Cassava in tropical Africa. A reference manual. Ibadan, Nigeria: IITA.
IITA, 1993. Archival Report (1989-1993). Part 1. Cassava breeding, cytogenetics and histology. Vol. 2. Germplasm enhancement. Crop Improvement Division. TRIP (Tuber Root Improvement Program). Ibadan, Nigeria: IITA.
Janos V., 2000. Plant cyanogenic glycosides. Toxicon, 38, 11-36.
Jones D.A., 1998. Why are so many food plants cyanogenic? Phytochemistry, 47(2), 155-162.
Kastner S. et al., 2007. Les microbes dans la fermentation du manioc – vers l'amélioration de la qualité et de la sécurité de l'attiéké. In : Amani G. et al., eds. Actes du 1er Atelier international sur les potentialités à la transformation du manioc en Afrique de l’Ouest, 4-7 juin 2007, Abidjan, Côte d’Ivoire, 252-255.
Kehinde A.T., 2006. Utilization potentials of cassava in Nigeria: the domestic and industrial products. Food Rev. Int., 22(1), 29-42.
Kimaryo V.M., Massawe G.A., Olasupo N.A. & Holzapfel W.H., 2000. The use of a starter culture in the fermentation of cassava for the production of “kivunde” a traditional Tanzanian food product. Int. J. Food Microbiol., 56, 179-190.
King N.L.R. & Bradbury J.H., 1995. Bitterness of cassava: identification of a new apiosyl glucoside and other compounds that affect its bitter taste. J. Sci. Food Agric., 68(2), 223-230.
Kobawila S.C. et al., 2005. Reduction of the cyanide content during fermentation of cassava roots and leaves to produce bikedi and ntoba mbodi, two food products from Congo. Afr. J. Biotechnol., 4(7), 689-696.
Lancaster P.N., Ingram J.S., Lin H.Y. & Coursey D.G., 1982. Traditional cassava-based foods: survey of processing techniques. Econ. Bot., 36, 12-45.
Macrae R., Robinson R.I.C. & Sadler M.J., 1993. Encyclopaedia of food science, food technology and nutrition. Vol. 1. New York, USA: Academic Press.
MAEH (Ministère de l’Agriculture, de l’Élevage et de l’Hydraulique), 2004. Projet de relance de la filière manioc au Sénégal. Dakar : Direction de l’Agriculture.
Mahungu N.M., Yamaguchi Y., Alamazan A.M. & Hahn S.K., 1987. Production of cyanide during processing of cassava into some traditional African foods. J. Food Agric., 1, 11-15.
McMahon J.M., White W.L.B. & Sayre R.T., 1995. Cyanogenesis in cassava (Manihot esculenta Crantz). J. Exp. Bot., 46, 731-141.
Moorthy S.N. & Mathew G., 1998. Cassava fermentation and associated changes in physicochemical and functional properties. Crit. Rev. Food Sci. Nutr., 38(2), 73-121.
Nzigamasabo A. & Zhou H.M., 2006. Traditional cassava foods in Burundi — A review. Food Rev. Int., 22(1), 1-27.
Okafor N., 1977. Micro-organisms associated with cassava fermentation for garri production. J. Appl. Microbiol., 42, 279-284.
Oke O.L., 1994. Eliminating cyanogens from cassava through processing: technology and tradition. Acta Hortic., 375, 163-174.
Okezie B.O. & Kosikowski F.V., 1982. Cassava as a food. Crit. Rev. Food Sci. Nutr., 17, 259-275.
Osuntokun B.O., 1981. Cassava diet, chronic cyanide intoxication and neuropathy in the Nigerian Africans. World Rev. Nutr. Dietetics, 36, 141-173.
Ouegnin E.A., 1988. Contribution à l’étude de l’acide cyanhydrique dans un produit de transformation du manioc : « l’Attiéké ». Thèse de doctorat en pharmacie : Université Cheikh Anta Diop de Dakar (Sénégal).
Padmaja G., 1995. Cyanide detoxification in cassava for food and feed uses. Crit. Rev. Food Sci. Nutr., 35, 299-339.
Rwamudanga E., 1988. Effets des traitements technologiques sur quelques propriétés chimiques du manioc. Mémoire : Université du Burundi, Bujumbura (Burundi).
Shibamoto T. & Bjeldanes L.F., 1993. Introduction to food toxicology. New York, London, Toronto: Academic Press Inc.
Silvestre P. & Arraudeau M., 1983. Le manioc. Paris : Maisonneuve & Larose ; Paris : ACCT.
Stupak M., Vanderschuren H., Gruissem W. & Zhang P., 2006. Biotechnological approaches to cassava protein improvement. Trends Food Sci. Technol., 17, 634-641.
Tylleskär T. et al., 1992. Cassava cyanogens and konzo, an upper motoneuron disease found in Africa. Lancet, 339, 208-211.
Vick J.A. & Froehlich H., 1991. Treatment of cyanide poisoning. Mil Med., 156(7), 330-339.
Wilson J., 1973. Cyanide and human disease. In: Chronic cassava toxicity. Proceedings of an interdisciplinary workshop, 29-30 January 1973, London, England. Ottawa: IDRC, 121-125.
White W.L.B., McMahon J.M. & Sayre R.T., 1994. Regulation of cyanogenesis in cassava. Acta Hortic., 375, 69-78.
Yéo G., 2007. Potentialités à la transformation du manioc en Afrique de l’Ouest. In : Amani G. et al., éds. Actes du 1er Atelier international sur les potentialités à la transformation du manioc en Afrique de l’Ouest, 4-7 juin 2007, Abidjan, Côte d’Ivoire, 48-79.

