Changements texturaux et biochimiques des fruits du bananier au cours de la maturation. Leur influence sur la préservation de la qualité du fruit et la maîtrise de la maturation
Gembloux Agricultural University – FUSAGx. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique) – Centre africain de Recherche sur les Bananes et Plantains (CARBAP). B.P. 832. CAM-Douala (Cameroun). E-mail : guythappi@yahoo.fr ou happiemaga.t@fsagx.ac.be
Gembloux Agricultural University – FUSAGx. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Gembloux Agricultural University – FUSAGx. Unité de Chimie biologique industrielle. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Reçu le 15 mai 2007, accepté le 13 novembre 2007
Résumé
La meilleure préservation de la qualité initiale des fruits du bananier après récolte nécessite de comprendre leur processus de maturation et de sénescence. La maturation est un phénomène irréversible, coordonné, génétiquement programmé et impliquant une série de changements biochimiques, physiologiques et organoleptiques. Le ramollissement de la texture du fruit (pulpe) lors de la maturation conduit à des effets néfastes pour le stockage. Ce processus est influencé par l’éthylène, le dioxyde de carbone, la température et l’oxygène. L’amidon, les pectines, la cellulose et les hémicelluloses constituent les classes majeures de polysaccharides de la paroi cellulaire qui subissent des modifications lors de la maturation. Ces modifications sont attribuées à l’action des enzymes.
Abstract
Textural and biochemical changes of the banana trees fruits during maturation. Their influence on the fruit quality safeguarding and maturation control. The best conservation of the initial quality of the banana trees fruits after harvest requires a full understanding of their process of maturation and senescence. Maturation is an irreversible phenomenon, highly coordinated, genetically programmed and involving a series of physiological, biochemical and organoleptic changes. Textural softening during ripening leads to adverse effects and spoilage upon storage. This process is influenced by ethylene, carbon dioxide, temperature and oxygen. The major classes of cell wall polysaccharides that undergo modifications during ripening are starch, pectins, cellulose and hemicelluloses. These modifications are allotted to the action of enzymes.
1. Introduction
1Les bananes (musa AAA, AA), les plantains (musa AAB) et les autres bananes à cuire (musa AAB, ABB) constituent l’une des principales ressources alimentaires dans le monde. Ces cultures occupent le 4e rang mondial des plus importantes denrées alimentaires après le riz, le blé et le lait (INIBAP, 2002 ; FAO, 2002). Ainsi, elles jouent un rôle socio-économique important pour les pays en développement des zones tropicales et subtropicales, notamment dans les pays d’Afrique de l’Est, du Centre et de l’Ouest, du Sud-Est Asiatique, de l’Amérique Centrale et du Sud et des Caraïbes (Frison et al., 1998). La production mondiale avoisine 106 millions de tonnes par an pour une superficie cultivée de 10 millions d’ha (FAO, 2004), dont 14 % sont destinés à l’exportation, le reste étant consacré à la consommation locale ou à la transformation industrielle (Lescot, 1999). L’Afrique sub-saharienne fournit plus du tiers de la production mondiale de bananes et de bananes plantains, avec près de 7 millions de tonnes provenant de l’Afrique de l’Ouest et du Centre. Elle contribue pour environ 70 % aux disponibilités énergétiques alimentaires fournies par les plantains et les autres bananes à cuire dans le monde.
2En Afrique, les principaux producteurs sont l’Ouganda et le Cameroun (FAO, 2004). Dans ce dernier pays, la production de bananes et plantains représente la deuxième source économique agricole du pays après le bois.
3Au Cameroun, l’introduction de nouvelles variétés et l’amélioration des techniques culturales ont contribué à l’accroissement des rendements et à une augmentation de la production du plantain. Cette production est estimée à 2,25 millions de tonnes (FAO, 2002). Ces bananes se classent en deux principales catégories : les bananes desserts qui se mangent généralement comme fruit de dessert après maturation ; les plantains et les autres bananes à cuire qui se mangent généralement après cuisson ou friture.
4Plusieurs travaux ont été effectués sur la valorisation de la pulpe des bananes et plantains (Kayisu, 1981 ; Lii et al., 1982 ; Ling et al., 1982 ; Chiang et al., 1987 ; Bello-Perez et al., 1998 ; Bello-Perez et al. , 1999 ; Bello-Perez et al., 2000). Cette valorisation passe par la connaissance des changements métaboliques qui surviennent au cours de la maturation des fruits. La meilleure compréhension de ces mécanismes permettrait non seulement la préservation de la qualité initiale des fruits du bananier après récolte, mais aussi une maîtrise du processus de maturation. Cet article a pour but de donner un aperçu général des changements texturaux et biochimiques impliqués dans la maturation de la pulpe des fruits du bananier cités dans la littérature.
2. La maturation des fruits du bananier
5Les fruits constituent un élément important de caractérisation du bananier. Ainsi, ceux-ci se distinguent les uns des autres par leur forme, leur section transversale, leur longueur, leur apex, par la maturité et la couleur de leur pulpe et la présence des graines. Ils sont récoltés à maturité physiologique optimale ; stade à partir duquel l’acquisition de la compétence à répondre à l’éthylène et le synthétiser de façon autocatalytique se produit.
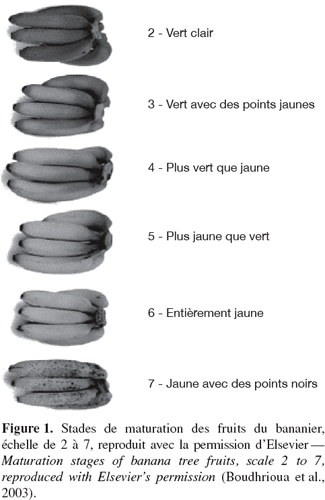
6Les stades de maturation des bananes et des plantains couramment comestibles sont déterminés à partir de différentes caractéristiques du fruit : la couleur de la peau et de la pulpe, la fermeté de la pulpe, l’extrait sec soluble, le taux d’humidité et la teneur en matière sèche. Von Loesecke (1950) a classifié la maturation de ces fruits en huit stades liés à la couleur de la peau. Généralement dans le commerce sept stades de maturation sont déterminés visuellement (Li et al., 1997) (Figure 1). Cette couleur provient des pigments localisés dans le cytoplasme ou les vacuoles des cellules (Tucker et al., 1987 ; Lizada, 1993). Ces fruits sont climactériques car leur maturation s’accompagne d’une augmentation de la respiration associée à une brusque stimulation de la synthèse d’éthylène (Gamage et al., 1999) ; l’éthylène émis par le fruit stimule sa propre production (autocatalyse) (Johnson et al., 1997).
7La maturation des fruits correspond à un ensemble de changements biochimiques et physiologiques conduisant à l’état de maturité et conférant au fruit ses caractéristiques organoleptiques (Brady, 1987). Elle peut être modulée par les facteurs de l’environnement. Au-delà de l’état de maturité, le fruit entre dans une période de sénescence conduisant à la désorganisation cellulaire et à la mort. Les changements biochimiques sont nombreux : accroissement intense de la production d’éthylène, de la respiration et de l’émission de composés organiques volatils, hydrolyse de l’amidon et diminution des acides organiques, synthèse des pigments, régression de la chlorophylle et solubilisation des composés pectiques (Grierson et al., 1981 ; Selvaraj et al., 1989 ; Lizada, 1993). Ces changements biochimiques subis par le fruit sont perceptibles au niveau cellulaire. Il s’agit des modifications des membranes qui aboutissent à une augmentation de la perméabilité, à une fuite accrue de solutés et à la décompartimentation cellulaire (Tucker et al., 1987 ; Redgwell et al., 1997). Au cours de la maturation et de la sénescence, ces membranes deviennent perméables aux ions et aux molécules organiques (Tucker et al., 1987).
8Au cours de la maturation, on observe aussi une augmentation de la teneur en sucre qui se produit suite à la dégradation de l’amidon sous l’action des amylases, une diminution des acides (acides citrique et malique) qui sont utilisés dans les combustions cellulaires ou transformée en sucre par décarboxylation, la synthèse d’arôme due à une activité croissante d’enzymes telles que les estérases capables de former des esters de l’alcool isoamylique (acétate d’isoamyle) (Brady, 1987).
3. Les principaux facteurs influençant le processus de maturation des fruits du bananier
9La température, l’oxygène, le dioxyde de carbone (CO2) et l’éthylène sont des facteurs qui influencent le processus de maturation des fruits du bananier.
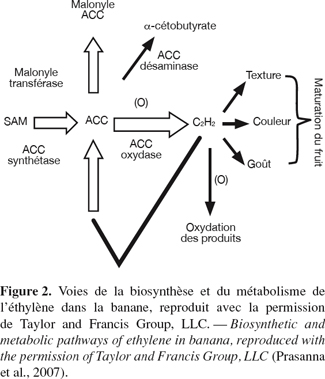
10L’éthylène est l’hormone qui initie l’ensemble des processus intervenant dans la maturation des fruits (Johnson et al., 1997). Les différentes étapes de la biosynthèse de l’éthylène ont été élucidées dans la banane et d'autres fruits comme les pommes, les avocats et les tomates (Yang et al., 1984 ; Kende, 1993). La première étape correspond à la conversion de la S-adénosylméthionine (SAM) en acide 1-aminocyclopropane-1 carboxylique (ACC) par l’enzyme ACC synthétase (Figure 2). Au début de la maturation, l’expression des multiples gènes de l’enzyme ACC synthétase est activée, ayant pour résultat la plus grande production de l’ACC. Dans la plupart des cas, c’est l’activité de l’ACC synthétase qui détermine le taux de biosynthèse de l’éthylène. L’ACC est alors oxydée en éthylène par l’ACC oxydase. La tomate a été le premier fruit climactérique pour lequel une approche du contrôle de la maturation par transgenèse a été menée. Cette approche a consisté en l’inhibition de la production d’éthylène en appliquant la stratégie des ARN antisens de l’ACC synthétase (Oeller et al., 1991) et de l’ACC oxydase (Hamilton et al., 1990). Les fruits obtenus présentent un ralentissement plus ou moins important de la maturation qui est réversible par application d’éthylène exogène (Hamilton et al., 1990 ; Oeller et al., 1991). La désamination de l’ACC en α-cétobutyrate par l’expression de l’enzyme ACC désaminase inhibe aussi la formation de l’éthylène et la maturation du fruit (Klee et al., 1991).
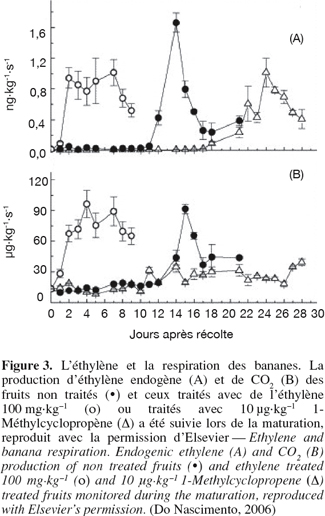
11Do Nascimento et al. (2006) ont montré que les fruits (bananes) qui ont été exposés à l'éthylène (T = 20 °C) ont atteint la phase climactérique en 2 jours après le traitement, alors que les fruits non traités (T = 20 °C) prenaient 12 jours pour voir leurs caractéristiques de production d'éthylène et du taux de CO2 s’accroître (Figure 3). Les taux élevés de CO2 sont des inhibiteurs de l’action de l’éthylène. Par ailleurs, le pic climactérique est supprimé sous un haut taux de CO2. Salmien et al. (1975) ont trouvé que la phosphofructokinase, une enzyme régulatrice importante de la glycolyse, est activée pendant la maturation de la banane. L’activité enzymatique diminue en stockant le fruit dans une atmosphère de 10 % en CO2 (Kerbel et al., 1988). Ces résultats indiquent une relation étroite entre l’activé de cette enzyme et le pic climactérique. Liu et al. (2003, 2004) ont montré que l’activation du NADP-dépendant isocitrate dehydrogenase (NADP-IDH) correspond au pic climactérique de la banane verte traitée avec du propylène dont la structure chimique est proche de l’éthylène. Cependant, cette activité enzymatique est fortement supprimée avec l’exposition du fruit au CO2. Les études ont montré que les basses températures prolongent la durée de survie des fruits et que le froid a un rôle important dans le ralentissement du métabolisme (Choehom et al., 2004 ; Trakulnaleumsai et al., 2006).
4. Changement de la texture au cours de la maturation des fruits du bananier
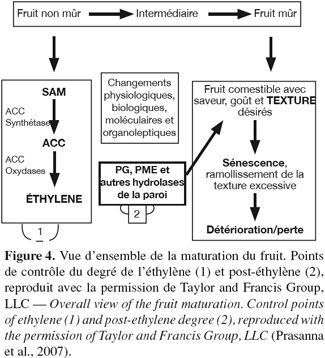
12La maturation des fruits est associée aux altérations texturales qui sont prononcées dans les fruits climactériques. Le changement textural est l’événement majeur dans le ramollissement du fruit, qui est le résultat de la dégradation enzymatique de la structure des polysaccharides de stockage (Hulme, 1971 ; Grierson et al., 1981 ; Bartley et al., 1982 ; Tucker et al., 1987). Une vue d’ensemble de la maturation du fruit en se référant tout particulièrement au ramollissement textural est schématiquement représentée à la figure 4.
13La texture du fruit est influencée par plusieurs facteurs tels que l’intégrité structurale de la paroi cellulaire primaire et de la lamelle moyenne, l’accumulation des polysaccharides de stockage et la pression produite dans les cellules par effet osmotique (Jackman et al., 1995). Le changement de la pression et la dégradation de l’amidon influencent le degré de ramollissement du fruit (Grierson et al., 1981 ; Brady, 1987 ; Tucker et al., 1987). L’amidon est le polysaccharide le plus abondant dans la banane. Son hydrolyse enzymatique entraîne une modification prononcée de la structure cellulaire.
14Les pectines, la cellulose et les hémicelluloses constituent les classes majeures des polysaccharides de la paroi cellulaire qui subissent des modifications lors de la maturation. Dans les fruits, la paroi cellulaire est complètement modifiée par solubilisation, déestérification et dépolymérisation. Cette solubilisation est accompagnée par une perte excessive de sucres neutres et d’acide galacturonique, suivi par la solubilisation des résidus de sucres restant et des oligosaccharides (Voragen et al., 1995).
5. Evolution des hydrates de carbone au cours de la maturation des fruits du bananier
15L’amidon est le composant le plus important de la pulpe des fruits du bananier à l’état vert de maturation. La composition des bananes desserts, des plantains et des autres bananes à cuire change de manière importante au cours de la maturation. Madamba et al. (1977) ont étudié le métabolisme des hydrates de carbone dans le fruit à deux stades de maturité du bananier (Musa sapientum Lakatan). Leurs résultats indiquent une variation de concentration du glucose, du fructose, du saccharose et de l’amidon lors de la maturité du bananier (Figure 5).
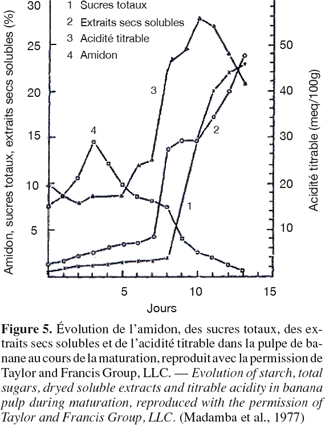
16La teneur en amidon des bananes desserts varie en moyenne entre 70 % et 80 % dans la période pré-climactérique (correspondant à la non dépolymérisation de l’amidon) à moins d'1 % à la fin de la période climactérique. Par contre, les sucres, principalement le saccharose, s'accumulent à plus de 10 % par rapport à la matière fraîche du fruit. Le total des sucres solubles peut atteindre 16 % ou plus (par rapport à la matière fraîche) à la fin de la période climactérique, indiquant ainsi la vitesse élevée de conversion (Cordenunsi et al., 1995). Les amylases interviennent dans l’hydrolyse de l’amidon mais elles ne sont probablement pas liées à la synthèse du saccharose. La conversion de l’amidon en saccharose, au cours de la maturation de la banane dessert, implique plusieurs enzymes et plus d’une voie de synthèse. L’importance de cette transformation est connue en fonction de la physiologie du fruit mais les mécanismes impliqués sont peu connus.
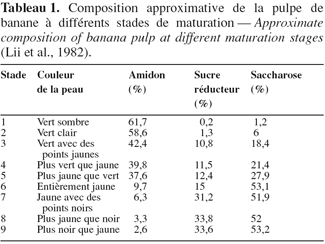
17Lii et al. (1982) ont montré qu’au cours de la maturation de la banane dessert, les teneurs en amidon, en sucres réducteurs et en saccharose changent du stade 1 de maturation (61,7 % ; 0,2 % et 1,2 %, respectivement) au stade 9 de maturation (2,6 % ; 33,6 % et 53,2 % respectivement) (Tableau 1). Terra et al. (1983) ont suivi, au cours de la maturation de la banane (Musa acuminata), les concentrations en amidon, en saccharose, en glucose et en fructose ainsi que les activités de plusieurs enzymes impliquées dans la synthèse du saccharose. L’amidon se dégrade alors que la teneur en saccharose augmente avec accumulation du glucose et du fructose. Ces résultats ont été confirmés par Adisa et al. (1987) ; par ailleurs, la teneur en cellulose reste constante au cours de la maturation. L’activité de l’UDP-glucose pyrophosphorylase reste constante, tandis que les activités de la sucrose synthase et de l’invertase augmentent. Ces changements observés au niveau des sucres et des enzymes ont montré que la transformation de l'amidon en saccharose, par l'intermédiaire du glucose 1-phosphate et l’UDP-glucose, pourrait être le mécanisme de la dégradation de l'amidon au cours de la maturation.
18Garcia et al. (1988) ont détecté les activités de trois α-amylases, quatre β-amylases et l’α-1,4- et α-1,6-glucosidase à tous les stades de maturation du fruit. Ils ont observé que ces activités augmentent de manière significative quand une grande partie de l’amidon a été dégradée. Konishi et al. (1992) ont purifié et caractérisé partiellement un acide α-glucosidase et deux isoformes de l’α-glucosidase à partir de la pulpe de banane (stade vert). L’α-glucosidase acide serait une maltase typique tandis que les formes iso de cette enzyme sont 50 fois moins actives sur le maltose. Ces auteurs ont conclu que l’α-glucosidase acide serait l’enzyme responsable de l’hydrolyse du maltose et les malto-oligosaccharides formés par l’action combinée des α- et β-amylases. Les traces de maltose ont été trouvées dans la pulpe de banane au cours de la maturation. Dans le même ordre d’idée, Prabha et al. (1998) ont montré que la concentration en glucose dans les hydrolysats des polysaccharides hydrosolubles et celle en xylose des hydrolysats des fractions d’hémicelluloses diminuent de manière significative, alors que diverses hydrolases des hydrates de carbone telles que les xylanases, les laminarinases, les α-mannosidases, les β-galactosidases, les amylases, les cellulases et les hémicellulases augmentent au cours de la maturation de la banane.
19Un groupe de chercheurs brésiliens a étudié les changements de l’activité des enzymes sucrose synthase (SS) et sucrose phosphate synthase (SPS) et des hydrates de carbone au cours du développement et du mûrissement de la banane (Cordenunsi et al., 1995 ; Do Nascimento et al., 1997 ; Do Nascimento et al., 2000). La teneur en amidon, la vitesse de respiration, l’activité du SS et SPS dans l’extrait brut et dans les préparations partiellement purifiées ont été suivies dans le fruit mûrissant sur le bananier et dans le fruit mûrissant après récolte. Au cours du développement du fruit, la SPS est présente avec un degré d’activité faible, alors que l’activité de la SS est élevée. Elle reste constante pendant la phase de synthèse de l’amidon et elle diminue ensuite avec la dégradation de celui-ci. Les résultats ont prouvé qu’au cours de la maturation du fruit, l’activité de la SS est presque nulle, alors que l’activité de la SPS augmente jusqu'à la disparition de l’amidon et de l'accumulation de sucre. Le processus est lent dans le fruit mûrissant sur le bananier (concentration finale en saccharose 6 %, 5 et 33 unités pour la SS, et la SPS, respectivement) par rapport au fruit mûri après récolte (concentration finale en saccharose 12 %, activité nulle pour la SS et 50 unités pour la SPS).
20Rossetto et al. (2003) ont rapporté que les gibbérellines jouent un rôle dans le processus de conversion de l’amidon en saccharose dans la pulpe de banane, renforçant l’idée selon laquelle cette voie métabolique est régulée par plusieurs composants dépendant de l'équilibre entre plusieurs signaux hormonaux et métaboliques. Le processus de maturation de la banane est déclenché par l’éthylène. L’acide indole-3-acétique semble jouer un rôle dans le métabolisme des hydrates de carbone dans le fruit vert (M. acuminata, AAA group, cv. Nanicao) en retardant la dégradation de l’amidon, en affectant probablement l’activité des enzymes hydrolytiques telles que la β-amylase (Purgatto et al., 2001 ; Do Nascimento et al., 2006).
21La disparition de la réserve en amidon au cours du mûrissement de la banane semble être relativement rapide en raison des activités de plusieurs enzymes agissant simultanément (Marriott et al., 1981 ; Mao et al., 1981 ; Gomes et al., 1981 ; Glass et al., 1982 ; Cordenunsi et al., 1995 ; Prabha et al., 1998).
22Des travaux similaires ont été menés sur le plantain et autres bananes à cuire. Goswami et al. (1996) ont étudié les aspects chimiques et biochimiques à cinq stades du développement de la banane à cuire « Kachkal » (musa ABB). Les résultats obtenus indiquent une variation des constituants chimiques et des activités enzymatiques (la phosphatase acide, α-glucane phosphorylase et polyphénol oxidase). La teneur en amidon et l’activité de la glucane phosphorylase augmentent lors du développement du régime. Pendant cette période, le total des sucres solubles et l’acide phosphatase diminuent, le rapport amylose amylopectine reste constant. Une corrélation positive a été observée entre la teneur en amidon et l’activité phosphorylase. Gomes Areas et al. (1981) ont observé une tendance inverse du comportement de ces deux enzymes (phosphorylase et phosphatase) dans la banane mûre où la dégradation de l’amidon est le phénomène principal lié à la maturation. Des résultats similaires ont été observés sur quelques cultivars de banane plantain (musa AAB) (Collin et al., 1991 ; Ngalani et al., 1998).
23Des études très récentes sur l’évolution des hydrates de carbone au cours de la maturation des peaux des fruits du bananier ont été menées (Happi Emaga et al., 2007a). L’amidon se dégrade alors que la teneur en glucose et en fructose augmente au cours de la maturation.
6. Evolution des substances pectiques au cours de la croissance et de la maturation
24Les pectines sont des composants de la paroi cellulaire primaire et de la lamelle moyenne contribuant à la texture du fruit. Dans la pulpe de banane, les teneurs en pectine varient de 0,7 % à 1,2 % par rapport à la matière fraîche (Nwanekezi et al., 1994). La pectine joue un rôle important dans la consistance du fruit et dans les changements structuraux lors de la maturation et le stockage. Le ramollissement du tissu est attribué à la dégradation enzymatique et à la solubilisation de la protopectine (Sakai et al., 1993). Très peu de travaux ont été effectués sur l’évolution des substances pectiques dans la pulpe des bananes, des plantains et des autres bananes à cuire. C’est pour cette raison que cet aspect est développé en s’appuyant sur des travaux antérieurs effectués sur d’autres fruits.
25Plusieurs études ont été réalisées sur l’évolution des substances pectiques au cours de la croissance et de la maturation. Des changements en proportion et en caractéristiques (chimique et physique) des substances pectiques ont été montrés dans plusieurs fruits (Kertesz, 1951). Lors de la maturation, la perte progressive en rigidité est le résultat de la solubilisation progressive des protopectines dans la paroi cellulaire pour former la pectine et d’autres produits (Grierson et al., 1981 ; John et al., 1986 ; Sakai et al., 1993). La solubilisation suivie par la dépolymérisation et la déestérification des polysaccharides pectiques est le changement apparent se produisant pendant la maturation de plusieurs fruits comme la poire (Ben-Arie et al., 1979), la pomme (McCollum et al., 1989 ; Ranwala et al., 1992), la fraise (Huber, 1984 ; Nogata et al., 1993), le kiwi (Redgwell et al., 1992), l'abricot (Femenia et al., 1998), le melon (Rose et al., 1998), la pêche (Hegde et al., 1998), l’olive (Jimenez et al., 2001), les peaux de banane (Happi Emaga et al., 2007b).
26Des études effectuées sur la goyave (Psidium gwajava L.) ont démontré que la teneur en substances pectiques varie avec le stade de croissance, la saison et le cultivar. En passant du fruit vert au fruit mûr, la teneur en pectine augmente. Il en est de même pour la teneur en pectine soluble dans l’eau et la protopectine. Ce phénomène est attribué à l’action des polygalacturonases agissant avec d’autres enzymes telles que les pectines méthylestérases (Marcellin et al., 1990).
27Une étude similaire a été menée sur d’autres matrices. Silacci et al. (1990) ont rapporté une diminution de la quantité de substances pectiques du raisin au cours de la maturité. De plus, au cours de la phase de ramollissement du mésocarpe du raisin, la dépolymérisation des molécules de pectines est observée (Yakushiji et al., 2001). L'évolution des substances pectiques chez les dattes en croissance a été mise en exergue. La teneur en pectine décroît avec la maturation des fruits, toutefois cette baisse de teneur n’a pas semblé affecter la texture (Myhara et al., 2000). Ainsi, à partir du stade « kimri » (stade de maturation vert) au stade « kalâl » (stade de maturation jaune), les teneurs en pectine des dattes décroissent (Alhooti et al., 1997). La teneur en acide galacturonique décroît avec le ramollissement de la fraise (Inari et al., 1997). Au cours de la maturation du haricot vert (Derksen et al., 1999) et de la tomate « cherry » (Paull et al., 1999), les polymères pectiques sont dégradés, alors que l’accumulation de l’homogalacturonane soluble continue pendant la sénescence ; avec une augmentation de la quantité de pectines ioniquement complexées aux dépens de pectines solubles (Stolle-Smits et al., 1999 ). La perte de la masse moléculaire est observée pour la papaye (Paull et al., 1999) et la mangue (Yashoda et al., 2005), avec pour celle-ci des pertes en galactose, arabinose et mannose. Ainsi, le ramollissement des fruits au cours de la maturité dépendrait de la dégradation et de la dépolymérisation des polysaccharides pectiques par les enzymes hydrolysant les pectines (Inari et al., 2000). Toutes les modifications constatées au cours de la maturation et du vieillissement font que les pectines extraites des fruits mûrs ont un faible degré d’estérification, un faible poids moléculaire et une teneur en sucre neutre élevée comparativement aux pectines extraites des fruits non mûrs (Huber et al., 1986).
7. Conclusion
28Cette synthèse bibliographique a permis de mettre en évidence la complexité des mécanismes métaboliques ayant lieu au cours de la maturation des fruits du bananier. Ces phénomènes sont étroitement liés surtout aux aspects cellulaires, aux facteurs externes tels que l’éthylène, le CO2, la température et l’oxygène. Il se dégage clairement que les hydrates de carbone et les substances pectiques évoluent au cours de la maturité, cette évolution est liée à des enzymes spécifiques. Par ailleurs, l’évolution des substances pectiques dépend du type de paroi cellulaire. Pour compléter ce travail, il serait intéressant de développer la notion de stress oxydatif post-récolte, de perte d’intégrité membranaire due à la peroxydation lipidique ou de l’évolution de l’arôme.
29Remerciements
30Les auteurs remercient la Coopération Universitaire pour le Développement (CUD) pour son financement.
Bibliographie
Adisa V.A. & Okey E.N., 1987. Carbohydrate and protein composition of banana pulp and peel as influenced by ripening and mold contamination. Food Chem., 25, 85-91.
Alhooti S., Sidhu J.S. & Qabazard H., 1997. Physicochemical characteristics of five date fruit cultivars grown in the United Arab Emirates. Plant Foods Hum. Nutr., 50, 101-113.
Bartley I.M. & Knee M., 1982. The chemistry of textural changes in fruit during storage. Food Chem., 9, 47-58.
Bello-Perez L.A., Pano de Leon Y., Agama-Acevo E. & Paredes-Lopez O., 1998. Isolation and partial characterization of amaranth and banana starches. Starch/Stärke, 50, 409-413.
Bello-Perez L.A., Agama-Acevedo E., Sanchez-Hermandez L. & Paredes-Lopez O., 1999. Isolation and partial characterization of banana starches. J. Agric. Food Chem., 4, 854-857.
Bello-Perez L.A. et al., 2000. Some structural, physico-chemical and functional studies of banana starches isolated from two varieties growing in Guerrero, Mexico. Starch/Stärke, 52, 68-73.
Ben-Arie R., Sonego L. & Frankel C., 1979. Changes in pectic substances in ripening pears. J. Am. Soc. Hortic. Sci., 104, 500-505.
Brady C.J., 1987. Fruit ripening. Annu. Rev. Plant Physiol., 38, 155-178.
Chiang Chu W.C. & Chu C.L., 1987. A pilot scale study for banana starch production. Starch/Stärke, 39, 5-8.
Choehom R., Ketsa S. & van Doorn W.G., 2004. Senescent spoting of banana peel is inhibited by modified atmosphere packaging. Postharvest Biol. Technol., 31, 167-175.
Collin M.N. & Dalnic R., 1991. Evolution de quelques critères physico-chimiques de la banane plantain (cultivar Orishele) au cours de la maturation. Fruits, 46, 13-17.
Cordenunsi B.R. & Lajolo F.M., 1995. Starch breakdown during banana ripening: sucrose synthase and sucrose phosphate synthase. J. Agric. Food Chem., 43(2), 347-351.
Derksen, Alphons G. & Voragen J., 1999. Changes in cell wall polysaccharides of green bean pods during development. Plant Physiol., 121, 363-372.
Do Nascimento J.R.O., Cordenunsi B.R. & Lajolo F.M., 1997. Alcocer, banana sucrose-phosphate synthase gene expression during fruit ripening. Planta, 203, 283-288.
Do Nascimento J.R.O., Cordenunsi B.R. & Lajolo F.M., 2000. Sucrose synthase activity and expression during development and ripening in bananas. J. Plant Physiol., 156, 605-611.
Do Nascimento J.R.O. et al., 2006. Beta-amylase expression and starch degradation during banana ripening. Postharvest Biol. Technol., 40, 41-47.
FAO, 2002. FAOSTAT statistics database agriculture. Roma: FAO.
FAO, 2004. FAOSTAT statistics database agriculture. Roma: FAO.
Femenia A., Sanchez E.S., Simal S. & Rosello C., 1998. Developmental and ripening-related effects on the cell wall of apricots (Prunus armeniaca) fruit. J. Sci. Food Agric., 77, 487-493.
Frison E.A. & Sharrock S., 1998. The economic, social and nutritional importance of banana in the world. In: Picq C., Fouré E. & Frison E.A., eds. Bananas and food security. International symposium, Douala, Cameroon, November 10-14, 1998. Montpellier, France: INIBAP, 21-35.
Gamage T.V. & Rehman M.S., 1999. Post-harvest handling of foods of plant origin. In: Rehman M.S., ed. Handbook of food preservation. New York: Marcel Dekker Inc., 11-46.
Garcia E. & Lajolo F.M., 1988. Starch transformation during banana ripening: the amylase and glucosidase behaviour. J. Food Sci., 53, 1181-1186.
Glass R.W. & Rand A.G., 1982. Alginate immobilization of banana pulp enzymes for starch hydrolysis and sucrose interconversion. J. Food Sci., 47, 1836-1839.
Gomes Areas J.A. & Lajolo F.M., 1981. Starch transformation during banana ripening: I—the phosphorylase and phosphatase behavior in Musa acuminata. J. Food Biochem., 5, 19-37.
Goswami B. & Borthakur A., 1996. Chemical and biochemical aspects of developing culinary banana (Musa ABB) " Kachkal ". Food Chem., 55, 169-172.
Grierson D., Tucker G.A. & Robertson N.G., 1981. The molecular biology of ripening. In: Friend J. & Rhodes M.J.C., eds. Recent advances in the biochemistry of fruits and vegetables. London: Academic Press, 149-160.
Hamilton A.J., Lycett G.W. & Grierson D., 1990. Antisense gene that inhibits synthesis of the hormone ethylene in transgenic plants. Nature, 346, 284-287.
Happi Emaga T. et al., 2007a. Effects of the stage of maturation and varieties on the chemical composition of banana and plantain peels. Food Chem., 103, 590-600.
Happi Emaga T. et al., 2007b. Dietary fibre components and pectin chemical features of peels during ripening in banana and plantain varieties. Bioresource Technol., in press.
Hegde D.J. & Maness N.O., 1998. Changes in apparent molecular mass of pectin and hemicellulose extracts during peach softening. J. Am. Soc. Hortic. Sci., 123, 445-456.
Huber D.J., 1984. Strawberry fruit softening: the potential roles of polyuronides and hemicelluloses. J. Food Sci., 49, 1310-1315.
Huber D.J. & Lee J.H., 1986. Comparative analysis of pectins from pericarp and locular gel in developing tomato fruit. In: Fishman M. & Jen J., eds. Chemistry and functions of pectins. Washington: American Chemical Society, 141-156.
Hulme A.C., 1971. The mango. In: Hulme A.C., ed. The biochemistry of fruit and their products. Vol 2. New York: Academic Press, 233-254.
Inari T. & Takeuchi T., 1997. Changes in pectic substances during the ripening of strawberry fruit. J. Jpn Soc. Food Sci. Technol., 44, 319-324.
Inari T., Yamauchi R., Kato K. & Takeuchi T., 2000. Purification and some properties of pectinesterase from fruits of a miniature-fruited red type tomato. Food Sci. Technol. Res., 6, 54-58.
INIBAP (International Network for the Improvement of Banana And Plantain), 2002. Net working banana and plantain: INIBAP Annual Report 2001. Montpellier, France: INIBAP.
Jackman R.L. & Stanley D.W., 1995. Perspectives in the textural evaluation of plant foods. Trends Food Sci. Technol., 6, 187-194.
Jimenez A. et al., 2001. Olive fruit cell wall: degradation of pectic polysaccharides during ripening. J. Agric. Food Chem., 49, 409-415.
John M.A. & Dey P.M., 1986. Postharvest changes in fruit cell. Adv. Food Res., 30, 139-193.
Johnson G.I., Sharp J.L. & Oosthuyse S.A., 1997. Postharvest technology and quarantine treatments. In: Litz R.E., ed. The mango: botany, production and uses. Wallingford, UK: CAB International, 447-507.
Kayisu K. & Hood L.F., 1981. Characterization of starch and fiber of banana fruit. J. Food Sci., 46, 1885-1890.
Kende H., 1993. Ethylene biosynthesis. Annu. Rev. Plant Physiol. Plant Mol. Biol., 44, 283-307.
Kerbel E.L., Kader A.A. & Romani R.J., 1988. Effects of elevated CO2 concentrations on glycolysis in intact " Bartlett " pear fruit. Plant Physiol., 86, 1205-1209.
Kertesz Z.I., 1951. The pectin substances. New York, USA: Interscience Publishers Inc.
Klee H.J. et al., 1991. Control of ethylene synthesis by expression of a bacterial enzyme in transgenic tomato plants. The Plants Cell, 3, 1187-1193.
Konishi Y., Kitazato S. & Nakatani N., 1992. Partial purification and characterization of acid and neutral β-glucosidase from pre-climacteric banana pulp tissues. Biosci. Biotechnol. Biochem., 56, 2046-2051.
Lescot T., 1999. Banane : production, commerce et variété. FruiTrop, 63, 13-16.
Li M., Slaughte D.C. & Thompson J.F., 1997. Optical chlorophyll sensing system for banana ripening. Postharvest Biol. Technol., 12, 273-283.
Lii C.Y., Chang S.M. & Young Y.L., 1982. Investigation of the physical and chemical properties of banana starches. J. Food Sci., 47, 1493-1497.
Ling L.H., Osman E.M., Fernandes J.B. & Reilly P.J., 1982. Physical properties of starch from Cavendish banana fruit. Starch/Stärke, 34, 184-188.
Liu S. et al., 2003. Changes of NADP linked isocitrate dehydrogenase activity during postharvest ripening in banana fruit [in Japanese with English abstract]. J. Jpn Soc. Food Sci. Technol., 72, 352-356.
Liu S. et al., 2004. Effects of CO2 on respiratory metabolism in ripening banana fruit. Postharvest Biol. Technol., 33, 27-34.
Lizada C., 1993. Mango. In: Seymour G.B., Taylor J.E. & Tucker G.A., eds. Biochemistry of fruit ripening. London: Chapman and Hall, 255-271.
Madamba L.S.P., Baes A.U. & Mendoza D.B., 1977. Effect of maturity on some biochemical changes during ripening of banana (Musa sapientum L. cv. Lakatan). Food Chem., 2, 177-183.
Mao W.W. & Kinsella J.E., 1981. Amylase activity in banana fruit: properties and changes in activity with ripening. J. Food Sci., 46, 1400-1403.
Marcellin O., Mourgues J. & Talmann A., 1990. Les polyosides de la goyave (Psidium guajava L.). Evolution au cours de la croissance et incidences technologiques liées à l’obtention de purées et de jus. Fruits, 45(5), 511-520.
Marriott J., Robinson M. & Karikari S.K., 1981. Starch and sugar transformation during the ripening of plantains and bananas. J. Sci. Food Agric., 32, 1021-1026.
McCollum A.J., Huber D.J. & Cantliffe D.J., 1989. Modification of polyronides and hemicellulose during muskmelon fruit softening. Physiol. Plant., 76, 303-308.
Myhara R.M., Al-Alawi A., Karkarlas J. & Taylor M.S., 2000. Sensory and textural changes in maturing omani dates. J. Sci. Food Agric., 80, 2181-2185.
Ngalani J.A. & Tchango Tchango J., 1998. Cooking qualities and physicochemical changes during ripening in some banana and plantain hybrids and cultivars. Acta Hortic., 490, 571-576.
Nogata Y., Ohta H. & Voragen A.G.J., 1993. Polygalacturonase in strawberry fruit. Phytochemistry, 34, 617-620.
Nwanekezi E.C., Alawubu O.C.G. & Mkpolulu C.C.M., 1994. Characterization of pectic substances from selected tropical fruits. J. Food Sci. Technol., 31, 159-161.
Oeller P.W. et al., 1991. Reversible inhibition of tomato fruit senescence by antisense RNA. Science, 254, 437-439.
Paull R.E., Gross K. & Qiu Y., 1999. Changes in papaya cell walls during fruit ripening. Postharvest Biol. Technol., 16, 79-89.
Prabha T.N. & Bhagyalakshmi N., 1998. Carbohydrate metabolism in ripening banana fruit. Phytochemistry, 48, 915-919.
Prasanna V., Prabha T.N. & Tharananathan R.N., 2007. Fruit ripening phenomena - an overview. Crit. Rev. Food Sci. Nutr., 47, 1-19.
Purgatto E., Lajolo F.M., Do Nascimento O.J.R. & Cordenunsi B.R., 2001. Inhibition of α-amylase activity, starch degradation and sucrose formation by indole-3-acetic acid during banana ripening. Planta, 212, 823-828.
Ranwala A.P., Suematsu C. & Masuda H., 1992. The role of β-galactosidase in the modification of cell wall components during muskmelon fruit ripening. Plant Physiol., 100, 1318-1325.
Redgwell R.J., Melton L.D. & Brach D.J., 1992. Cell wall dissolution in kiwifruit (Actinidia deliciosa). Solubilization of pectic polymer. Plant Physiol., 98, 71-81.
Redgwell R.J. et al., 1997. In vivo and in vitro swelling of cell walls during fruit ripening. Planta, 203, 162-173.
Rose J.K.C., Hadfield K.A., Labavitch J.M. & Bennett A.B., 1998. Temporal sequence of cell wall disassembly in rapidly ripening melon fruit. Plant Physiol., 117, 345-361.
Rossetto M.R.M. et al., 2003. Effects of gibberellic acid on sucrose accumulation and sucrose biosynthesizing enzymes activity during banana ripening. Plant Growth Regul., 41, 207-214.
Sakai T., Sakamato T., Hallaert J. & Vandamme E.J., 1993. Pectin, pectinase and protopectinase: production, properties and application. Adv. Appl. Microbiol., 39, 213-294.
Salmien S.O. & Yong R.E., 1975. The control properties of phosphofructokinase in relation to the respiratory climacteric in banana fruit. Plant Physiol., 55, 45-50.
Selvaraj Y., Kumar R. & Pal D.K., 1989. Changes in sugars, organic acids, amino acids, lipid constituents and aroma characteristics of ripening mango (Mangifera indica L.) fruit. J. Food Sci. Technol., 26, 308-313.
Silacci M.W. & Morrison J.C., 1990. Changes in pectin content of Cabernet sauvignon grape berries during maturation. Am. J. Enol. Vitic., 41, 111-115.
Stolle-Smits T. et al., 1999. Changes in cell wall polysaccharides of green bean pods during development. Plant Physiol., 121, 363.
Terra N.N., Garcia E. & Lajolo F.M., 1983. Starch-sugar transformation during banana ripening: the behaviour of UDP glucose pyrophosphorylase, sucrose synthetase and invertase. J. Food Sci., 48, 1097-1100.
Trakulnaleumsai C., Ketsa S. & Van Doorn W.G., 2006. Temperature effects on peel spotting in sucrier banana fruit. Postharvest Biol. Technol., 39, 285-290.
Tucker G.A. & Grierson D., 1987. Fruit ripening. In: Davies D.D., ed. The biochemistry of plants. A comprehensive treatise, vol. 12, Physiology of metabolism. London: Academic Press, 265-319.
Von Loesecke, 1950. Chemical changes during ripening bananas. Chem. Physiol. Technol., 4, 67-118.
Voragen A.G.J. et al., 1995. Food polysaccharides and their application. In: Stephen A.M., ed. Food Science and Technology series. New York: Marcel Dekker.
Yakushiji H., Sakurai N. & Morinaga K., 2001. Changes in cell-wall polysaccharides from the mesocarp of grape berries. Physiol. Plant, 111, 188-195.
Yang S.F. & Hoffman N.E., 1984. Ethylene biosynthesis and its regulation in higher plants. Annu. Rev. Plant Physiol., 35, 155-189.
Yashoda H.M., Prabha T.N. & Tharanathan R.N., 2005. Mango ripening-chemical and structural characterization of pectic and hemicellulosic polysaccharides. Carbohydr. Res., 340, 1335–1342.

