Activité antifongique des huiles essentielles de Thymus bleicherianus Pomel et Thymus capitatus (L.) Hoffm. & Link contre les champignons de pourriture du bois d'œuvre
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc) – Faculté des Sciences. Laboratoire de Botanique. MA-10040 Rabat (Maroc)
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc). E-mail : badrsat@yahoo.fr
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Institut national des Plantes médicinales et aromatiques. BP 7048. MA-30007 Fès-Ezohour. (Maroc).
Faculté des Sciences. Laboratoire de Botanique. MA-10040 Rabat (Maroc).
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Centre de Recherche forestière. BP 763. Agdal. MA-10050 Rabat (Maroc).
Reçu le 29 novembre 2007, accepté le 11 mars 2008
Résumé
Les huiles essentielles et leurs constituants ont une longue histoire comme agents antimicrobiens, cependant leur utilisation comme préservateurs du bois d'œuvre a été rarement rapportée. Ce travail porte sur l'étude de l'activité antifongique des huiles essentielles de deux plantes aromatiques et médicinales de la flore marocaine vis-à-vis de quatre champignons de pourriture du bois d'œuvre, dans le but de rechercher de nouveaux produits bioactifs naturels. Les compositions chimiques des huiles essentielles isolées par hydrodistillation des parties aériennes de Thymus bleicherianus Pomel et Thymus capitatus (L.) Hoffm. & Link ont été analysées par CG et CG-SM. Les constituants majeurs de l'huile de T. bleicherianus sont l'α-terpinène (42,2 %) et le thymol (23,9 %). Le carvacrol (70,92 %) est le composé prédominant de l'essence de T. capitatus. Les concentrations minimales inhibitrices des huiles essentielles ajoutées, à des concentrations prédéfinies, à l'extrait de malt gélosé, ont été déterminées par un test de screening avec la méthode de dilution dans l'agar. Les huiles faisant l'objet de l'étude ont montré une forte activité antifongique contre tous les champignons testés.
Abstract
Antifungal activity of the Thymus bleicherianus Pomel and Thymus capitatus (L.) Hoffm. & Link essential oils against wood-decay fungi. Essential oils and their constituents have a long history of applications as antimicrobial agents, but their use as wood preservatives has rarely been reported. This study deals with the antifungal activity of two medicinal and aromatic plants essential oils of the Moroccan flora against four wood-decay fungi, in order to find new bioactive natural products. The chemical composition of essential oils extracted by hydrodistillation from the aerial parts of Thymus bleicherianus Pomel and Thymus capitatus (L.) Hoffm. & Link was analyzed by GC and GC-MS. The major components of T. bleicherianus oil were α-terpinene (42.2%) and thymol (23.9%). Carvacrol (70.92%) was the predominant constituent in the essence of T. capitatus. Minimal inhibitory concentrations of the essential oils added to malt agar medium in defined concentrations were determined by a screening test with the agar dilution method. The oils, object of the survey, showed a strong antifungal activity against all tested fungi.
1. Introduction
1Les champignons de pourriture blanche et de pourriture brune qui décomposent le bois d'œuvre ont un impact économique majeur sur les essences commerciales des zones tempérée et tropicale et sur les produits transformés.
2Parmi ces champignons de pourriture brune du bois d'œuvre, il y a Coniophora puteana (Schumacher ex Fries) Karsten, Gloeophyllum trabeum (Persoon ex Fries) Murril et Poria placenta (Fries) Cooke sensu J. Eriksson. Ces espèces fongiques provoquent la dégradation de la cellulose et l'hémicellulose des parois cellulaires, cependant la lignine est non digérée ou, dans certains cas, elle est déméthylée, oxydée ou faiblement dépolymérisée (Green et al., 1997).
3Coriolus versicolor (L.) Quélet est l'un des basidiomycètes les plus communs dans l'altération du bois d'œuvre. Champignon de pourriture blanche, il cause la dégradation aussi bien de la lignine que de la cellulose et de l'hémicellulose (Dumonceaux et al., 1998 ; Tanaka et al., 1999). Il produit diverses enzymes fongiques extracellulaires dont la laccase, la peroxydase et la cellobiose déshydrogénase qui sont les plus importantes dans le processus lignocellulotique (Archibald et al., 1997).
4Les ventes semestrielles du bois d'œuvre au marché international sont estimées à plus de six milliards de dollars US. Ce secteur est dominé par le bois traité aux benzimidazoles, au chromate acide de cuivre (CCA), à l'arséniate de cuivre chromé (ACC) et à l'arséniate de cuivre et zinc (ACZA), des fongicides dont l'usage est de plus en plus dénoncé en raison de leur grande toxicité (Deferera et al., 2000). En plus, un sérieux problème se pose sur l'efficacité de ces produits chimiques et qui consiste au développement de la résistance par les champignons pathogènes (Deferera et al., 2000). Pour cela, le développement de nouveaux produits de protection du bois d'œuvre ayant pour principes actifs des biomolécules naturellement présentes dans les plantes aromatiques et médicinales peut s'inscrire comme une solution écologique à un coût moindre (Haluk et al., 1998). Ceci est d'autant plus encouragé que certaines substances naturelles telles que les thujaplicines (tropolones) ont déjà démontré leur forte activité fongicide contre des champignons de pourriture du bois d'œuvre (Haluk et al., 1998).
5Les huiles essentielles de nombreuses plantes sont devenues populaires ces dernières années et leurs principes bioactifs ont conquis récemment plusieurs secteurs industriels (Ismaiel et al., 1990 ; Paster et al., 1990 ; Mahmoud, 1994 ; Adam et al., 1998 ; Basilico et al., 1999 ; Cosentino et al., 1999 ; Cowan, 1999 ; Hammer et al., 1999 ; Marino et al., 1999). Cependant, malgré leurs larges spectres d'applications comme agents antimicrobiens, leur utilisation comme préservateurs du bois d'œuvre contre les champignons de pourriture reste rarement étudiée.
6Le genre Thymus regroupe un grand nombre d'espèces, sous-espèces et variétés de plantes sauvages. Plusieurs de ces espèces sont caractéristiques de l'aire méditerranéenne. Elles sont utilisées à l'état frais ou sec comme plantes culinaires. Leurs huiles essentielles sont largement utilisées dans la médecine alternative grâce à leurs propriétés antiseptiques, antispasmodiques et antimicrobiennes (Van Den Broucke et al., 1981 ; Panizzi et al., 1993).
7Thymus bleicherianus Pomel est une espèce de l'Afrique du Nord. Elle est endémique du Maroc et de l'Algérie. Au Maroc, cette espèce se développe dans l'étage thermo-méditerranéen, dans les bioclimats semi-aride et subhumide tempérés et chauds. On la rencontre dans les régions de Méknès et Oujda (Forêt de Tafogalt), respectivement au Centre et à l'Est du Maroc. Thymus capitatus (L.) Hoffm. & Link est une espèce du bassin méditerranéen. Au Maroc, on la rencontre au Sud et à l'Ouest de la ville de Tétouan (Nord du Maroc), dans le bioclimat tempéré ; elle se développe dans l'étage de végétation thermo-méditerranéen (Benabid, 2000).
8Les huiles essentielles de T. capitatus de différentes origines ont déjà fait l'objet de plusieurs études (Jahandiez et al., 1934). L'essence de cette plante est largement utilisée dans les industries de parfumerie, de cosmétologie, alimentaire et pharmaceutique (Satil et al., 2002). Cette espèce est utilisée aussi en médecine traditionnelle contre de nombreuses maladies (Tabata et al., 1988). Cependant, à notre connaissance, aucune étude n'a été réalisée auparavant sur les huiles de T. bleicherianus.
9Le but de ce travail est :
10– la caractérisation de la composition chimique des huiles essentielles de T. bleicherianus et T. capitatus,
11– l'étude de l'activité antifongique des huiles essentielles de ces deux espèces vis-à-vis de quatre souches de champignons responsables de la pourriture du bois d'œuvre.
2. Matériel et méthodes
2.1. Matériel
12Matériel végétal. Les échantillons de la partie aérienne (tiges, feuilles et fleurs) de T. bleicherianus et T. capitatus ont été récoltés au mois de juin (2006), respectivement dans les régions de Méknès (Centre du Maroc) et Tétouan (Nord du Maroc). Ces deux espèces ont été identifiées par Aafi A., botaniste au Centre de Recherche forestière, Rabat, Maroc.
13Matériel fongique. Les quatre champignons utilisés dans ce travail sont des espèces fongiques responsables des pourritures brune et blanche du bois, ils ont été choisis pour les dégâts considérables qu'ils causent aux bois d'œuvre et produits dérivés :
14– Gloeophyllum trabeum (Persoon ex Fries) Murril
15– Poria placenta (Fries) Cooke sensu J. Eriksson
16– Coniophora puteana (Schumacher ex Fries) Karsten
17– Coriolus versicolor (L.) Quélet.
18Ces quatre souches fongiques appartiennent à la collection de la mycothèque du Laboratoire de Microbiologie du Centre de Recherche forestière, Rabat, Maroc. Elles sont régulièrement entretenues par repiquage sur le milieu nutritif PDA (Potato Dextrose Agar).
2.2. Méthodes
19Extraction des huiles essentielles. L'extraction des huiles essentielles a été effectuée par hydrodistillation dans un appareil de type Clevenger. Trois distillations ont été réalisées par ébullition pendant 1 h 30 de 200 g de matériel végétal frais avec 1 l d'eau dans un ballon de 2 l surmonté d'une colonne de 60 cm de longueur reliée à un réfrigérant. Le rendement en huile essentielle a été déterminé par rapport à la matière sèche, évaluée à partir de 3 échantillons de 30 g séchés durant 48 heures à l'étuve à 60 °C. L'huile essentielle a été stockée à 4 °C à l'obscurité en présence de sulfate de sodium anhydre. Elle est diluée dans du méthanol (1/20, v/v) avant de procéder aux analyses CG et CG/SM.
20Analyse chromatographique. Les analyses chromatographiques ont été effectuées sur un chromatographe en phase gazeuse à régulation électronique de pression de type Hewlett Packard (série HP 6890), équipé d'une colonne capillaire HP-5 (30 m x 0,25 mm) avec une épaisseur du film de 0,25 μm, d'un détecteur FID réglé à 260 °C et alimenté par un mélange de gaz H2/Air et un injecteur split-splitless réglé à 275 °C. Le mode d'injection est split (rapport de fuite : 1/50). Le gaz utilisé est l'azote avec un débit de 1,7 ml.min-1. La température de la colonne est programmée de 50 à 250 °C à raison de 4 °C.min-1. L'appareil est piloté par un système informatique de type « HP ChemStation », gérant le fonctionnement de l'appareil et permettant de suivre l'évolution des analyses chromatographiques.
21L'identification des constituants a été réalisée en se basant sur leurs indices de Kováts (IK) et sur la chromatographie en phase gazeuse couplée à la spectrométrie de masse (CG-SM). Cette dernière est réalisée sur un chromatographe en phase gazeuse de type Hewlett-Packard (série HP 6890) couplé avec un spectromètre de masse (série HP 5973). La fragmentation est effectuée par impact électronique à 70 eV. La colonne utilisée est une colonne capillaire HP-5MS (30 m x 0,25 mm), l'épaisseur du film est de 0,25 μm. La température de la colonne est programmée de 50 à 250 °C à raison de 4 °C.min-1. Le gaz vecteur est l'hélium dont le débit est fixé à 1,5 ml.min-1. Le mode d'injection est du mode split (rapport de fuite : 1/70). L'appareil est relié à un système informatique gérant une bibliothèque de spectre de masse NIST 98.
2.3. Procédure microbiologique
22Les concentrations minimales inhibitrices (CMI) des huiles essentielles ont été déterminées selon la méthode rapportée par Remmal et al. (1993) et Satrani et al. (2001). Du fait de la non miscibilité des huiles essentielles à l'eau et donc au milieu de culture, la mise en émulsion a été réalisée grâce à une solution d'agar à 0,2 % afin de favoriser le contact germe/composé. Des dilutions sont préparées au 1/10e, 1/25e, 1/50e, 1/100e, 1/200e, 1/300e et 1/500e dans cette solution d'agar. Dans des tubes à essais contenant chacun 13,5 ml de milieu gélosé à l'extrait de malt (2 %), stérilisés à l'autoclave (20 min à 121 °C) et refroidis à 45 °C, on ajoute 1,5 ml de chacune des dilutions de façon à obtenir les concentrations finales de 1/100, 1/250, 1/500, 1/1.000, 1/2.000, 1/3.000 et 1/5.000 (v/v). Puis on agite convenablement les tubes avant de les verser dans des boîtes de Petri. Des témoins, contenant le milieu de culture et la solution d'agar à 0,2 % seule, sont également préparés.
23L'ensemencement se fait par dépôt de fragments de 1 cm2 de diamètre, prélevés à partir de la périphérie d'un tapis mycélien et provenant d'une culture de 7 j dans l'extrait de malt. L'incubation se fait à l'obscurité pendant 7 j à 25 °C. Chaque essai est répété trois fois.
3. Résultats et discussion
3.1. Composition chimique
24Les rendements moyens en huiles essentielles ont été calculés en fonction de la matière végétale sèche de la partie aérienne de la plante. Les échantillons de T. capitatus ont fourni un taux d'environ 2,05 % relativement plus élevé que celui obtenu à partir de T. bleicherianus et qui est de 1,75 %.
25Les analyses chromatographiques des huiles essentielles ont permis d'identifier 14 composés qui représentent environ 98,1 % pour T. capitatus, contre 26 composés (98,6 %) pour T. bleicherianus (Tableau 1).
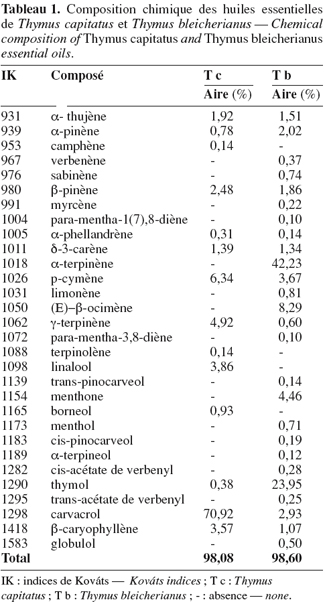
26L'huile essentielle de T. capitatus du Maroc est composée principalement par le carvacrol (70,92 %), accompagné d'autres constituants à des teneurs relativement faibles : p-cymène (6,34 %), γ-terpinène (4,92 %), linalool (3,86 %), β-caryophyllène (3,57 %) et β-pinène (2,48 %), totalisant environ 92,10 %. Cette composition chimique est sensiblement analogue à celle d'une huile essentielle originaire de Tunisie constituée majoritairement par le carvacrol (62-83 %), le p-cymène (5-17 %), le γ-terpinène (2-14 %) et le β-caryophyllène (1-4 %), en fonction de la localisation et de la période de végétation (Bounatirou et al., 2007). L'huile essentielle de T. capitatus de Grèce est plus riche en carvacrol avec un taux supérieur à 80 % (Karpouhtsis et al., 1998). De même, l'essence de T. capitatus de Turquie est dominée par le carvacrol mais avec seulement 35,6 % suivi du thymol (18,6 %), du p-cymène (21 %) et du γ-terpinène (12,3 %) (Goren et al., 2003). Cependant, les principaux constituants de l'huile de T. capitatus de Sardaigne sont le thymol (29,3 %) et le p-cymène (26,4 %) ; le carvacrol ne représente que 10,8 % de cette essence (Cosentino et al., 1999).
27On note aussi que l'huile essentielle de Thymus revolutus Celak., analysée par Karaman et al. (2001), présente qualitativement le même profil chimique que celui de T. capitatus du Maroc.
28L'huile essentielle de T. bleicherianus est caractérisée par sa richesse en α-terpinène (42,23 %) et en thymol (23,95 %). D'autres composés sont aussi identifiés mais à des teneurs moins importantes : β-ocymène (8,29 %), menthone (4,46 %), p-cymène (3,67 %), carvacrol (2,93 %) et α-pinène (2,02 %). L'ensemble de ces constituants participe au mélange à concurrence de 87,60 %.
29La composition chimique de l'huile de T. bleicherianus est différente de celle de T. capitatus. En effet, le carvacrol, composé principal de l'huile de T. capitatus, est présent dans l'essence de T. bleicherianus avec un faible taux d'environ 2,9 %. En plus, la teneur du thymol dans l'huile de T. capitatus n'est que de 0,38 % alors qu'elle représente environ 24 % de l'essence de T. bleicherianus. D'un autre côté, l'α-terpinène est totalement absent de l'huile de T. capitatus alors que c'est le constituant majeur de celle de T. bleicherianus. Ceci montre que les huiles essentielles du genre Thymus ne sont pas toujours dominées par le thymol ou le carvacrol. En effet, les huiles essentielles de Thymus satureoides et Thymus hyemalis Lange sont dominées respectivement par le bornéol (26,40 %) et le p-cymène (41,39 %) (Bouhdid et al., 2006 ; Jordan et al., 2006).
30Généralement, la composition chimique des huiles essentielles des thyms dépend de plusieurs facteurs tels que l'espèce, l'origine, le stade phénologique, les influences environnementales et le patrimoine génétique (Senatore, 1996 ; Kokkini et al., 1997 ; Boira et al., 1998 ; Russo et al., 1998 ; Thompson et al., 2003 ; Karousou et al., 2005).
3.2. Activité antimicrobienne des huiles essentielles
31Les résultats de l'activité antifongique des huiles essentielles de T. capitatus et T. bleicherianus sont résumés dans le tableau 2.
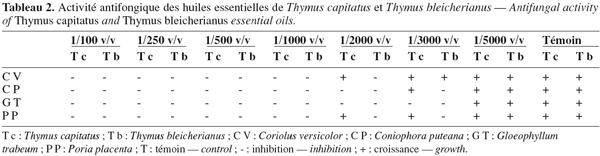
32L'huile essentielle de T. capitatus a exercé une importante activité inhibitrice vis-à-vis des champignons de pourriture du bois d'œuvre. Ainsi, Gloeophyllum trabeum s'est montré le plus sensible, il a été inhibé à partir de la concentration minimale de 1/3.000 v/v. La concentration de 1/2.000 v/v a été suffisante pour arrêter la croissance de Coniophora puteana. Coriolus versicolor et Poria placenta ont résisté jusqu'à la concentration en huile de 1/1.000 v/v.
33Les champignons de pourriture du bois d'œuvre ont montré une grande sensibilité à l'huile essentielle de T. bleicherianus. Les trois souches fongiques G. trabeum, C. puteana et P. placenta ont toutes été inhibées à partir de la même concentration minimale de 1/3.000 v/v, à l'exception de C. versicolor qui a manifesté une résistance jusqu'à la concentration de 1/2.000 v/v.
34On remarque que C. versicolor s'est montré un peu plus résistant aux deux huiles essentielles testées par rapport aux autres espèces fongiques. Ceci peut être attribué au fait que ce champignon produit de la laccase et d'autres enzymes extracellulaires qui catalysent l'oxydation des composés phénoliques et conduit à leur inactivation (Banci, 1997 ; Mester et al., 2000).
35En général, les deux huiles de T. capitatus et T. bleicherianus ont exercé une forte activité fongicide contre tous les champignons de pourriture du bois d'œuvre testés. Ceci est dû à leurs profils chimiques riches respectivement en carvacrol (environ 71 %) et en thymol (environ 24 %). Nos résultats corroborent ceux d'autres recherches qui ont démontré que le thymol et le carvacrol sont parmi les composés des huiles essentielles les plus actifs contre les champignons. En effet, Karmen et al. (2003) ont testé 22 composés purs issus d'huiles essentielles sur C. versicolor et C. puteana et ils ont montré que le thymol et le carvacrol sont les plus actifs contre ces deux champignons d'altération du bois (CMI = 1,25 mmol.l-1). Beaucoup de travaux ont souligné l'efficacité antifongique des phénols terpéniques et plus particulièrement celle du thymol et/ou du carvacrol (Crespo et al., 1990 ; Cosentino et al., 1999 ; Arras et al., 2001 ; Chebli et al., 2003 ; Hammer et al., 2003 ; Pepeljnjak et al., 2003). Ces deux molécules possèdent un très large spectre d'activité antimicrobien et ils sont naturellement présents dans les essences de la plupart des espèces de thym et d'origan (Crespo et al., 1990 ; Scora et al., 1998 ; Cosentino et al., 1999 ; Bounatirou et al., 2007).
36Le mécanisme de la toxicité des phénols envers les champignons est basé sur l'inactivation des enzymes fongiques qui contiennent le groupement SH dans leur site actif (Farag et al., 1989 ; Celimene et al., 1999 ; Cowan, 1999). Les terpènes phénoliques agissent aussi en se fixant sur les groupes amine et hydroxylamine des protéines membranaires microbiennes provoquant l'altération de la perméabilité et la fuite des constituants intracellulaires (Juven et al., 1994 ; Ultee et al., 1999 ; Knowles et al., 2005 ; Lopez-Malo et al., 2005).
37Cependant, on note que l'huile essentielle de T. bleicherianus est dotée d'une activité fongicide légèrement supérieure à celle de T. capitatus. Ceci peut être attribué au fait que l'huile de T. bleicherianus compte parmi ses principaux constituants le thymol alors que T. capitatus est dominée par le carvacrol. En effet, Dorman et al. (2000) ont testé un grand nombre de constituants purs des huiles essentielles contre 25 genres différents de bactéries et ils ont démontré que le thymol est le composé qui possède le plus large spectre d'activité antibactérienne suivi du carvacrol et de l'α-terpineol. Ces mêmes auteurs ont expliqué la différence de l'efficacité antimicrobienne observée entre le thymol et le carvacrol par la position du groupement hydroxyle sur la structure phénolique des deux molécules.
38L'efficacité antifongique de l'essence de T. bleicherianus par rapport à celle de T. capitatus peut être due aussi à l'activité synergique entre le thymol et le carvacrol. Ces composés sont présents dans l'huile de T. bleicherianus avec des taux respectifs d'environ 24 % et 2,9 % alors que la teneur en thymol dans l'essence de T. capitatus est très faible (environ 0,4 %). La synergie entre ces deux phénols a été constatée dans plusieurs études (Crespo et al., 1990 ; Didry et al., 1993 ; Deferera et al., 2000).
39Selon ces observations, on peut spéculer que la forte activité antifongique observée chez les huiles essentielles des deux thyms peut être attribuée seulement au thymol et au carvacrol, comme elle peut être le résultat de synergies entre les différents constituants de ces huiles.
4. Conclusion
40Les champignons responsables des pourritures brune et blanche du bois d'œuvre pèsent lourd sur l'industrie du fait des dégâts considérables qu'ils causent au bois en service et pendant le stockage. Les pesticides, utilisés dans la préservation du bois contre les agents de détérioration, sont souvent nocifs pour l'environnement. Le secteur de l'industrie du bois d'œuvre souffre de cette image. L'utilisation de formulations volatiles à base de plantes aromatiques et médicinales peut présenter de nombreux avantages par rapport aux produits de synthèses actuels. En effet, les huiles essentielles sont faiblement toxiques pour l'environnement et peuvent avoir une activité biocide plus élevée.
41L'analyse qualitative et quantitative des huiles essentielles de T. capitatus et T. bleicherianus a permis d'identifier respectivement 14 et 26 constituants. L'huile de T. capitatus du Maroc est dominée par le carvacrol (70,92 %) alors que l'essence de T. bleicherianus est plus riche en α-terpinène (42,2 %) et en thymol (23,9 %).
42Les huiles essentielles des deux espèces ont montré, in vitro, une forte activité antifongique contre tous les champignons de pourriture du bois d'œuvre testés. Ce grand pouvoir bioactif observé chez les deux huiles est attribué principalement à leurs teneurs élevées en phénols terpéniques (carvacrol et thymol).
43D'après ces résultats, on peut penser que les huiles essentielles de ces deux espèces de thym méritent une étude plus approfondie pour exploiter leurs propriétés antifongiques dans le domaine de la préservation du bois d'œuvre à l'échelle industrielle.
Bibliographie
Adam K. et al., 1998. Antifungal activities of Origanum vulgaris subsp. Hirtus, Mentha spicata, Lavandula angustifolia, and Salvia fruticosa essential oils against human pathogenic fungi. J. Agric. Food Chem., 46, 1739-1745.
Archibald F.S. et al., 1997. Kraft pulp bleaching and delignification by Trametes versicolor. J. Biotechnol., 53, 215-236.
Arras G. & Usai M., 2001. Fungitoxic activity of twelve essential oils against four postharvest Citrus pathogens: chemical analysis of Thymus capitatus (L.) oil and its effect in subatmospheric pressure conditions. J. Food Prot., 64, 1025-1029.
Banci L., 1997. Structural properties of peroxidases. J. Biotechnol., 53, 253-263.
Basilico M.Z. & Basilico J.C., 1999. Inhibitory effects of some spice essential oils on Aspergillus ochraceus NRRL 3174 growth and ochratoxin A production. Lett. Appl. Microbiol., 29, 238-241.
Benabid A., 2000. Flore et écosystèmes du Maroc. Evaluation et préservation de la biodiversité. Paris : Edition Ibis Press, 159-161.
Boira H. & Blanquer A., 1998. Environmental factors affecting chemical variability of essential oils in Thymus piperella L. Biochem. Syst. Ecol., 26, 811-822.
Bouhdid S. et al., 2006. Thymus essential oils: chemical composition and in vitro antioxidant and antibacterial activities. In: Congrès International de Biochimie, 9-12 mai 2006, Agadir, Maroc.
Bounatirou S. et al., 2007. Chemical composition, antioxidant and antibacterial activities of the essential oils isolated from Tunisian Thymus capitatus Hoffm. & Link. Food Chem., 105, 146-155.
Celimene C.C., Micales J.A., Ferge L. & Young R.A., 1999. Efficacy of pinosylvins against white-rot and brown-rot fungi. Holzforschung, 53, 491-497.
Chebli B., Achouri M., Idrissi Hassani L.M. & Hmamouchi M., 2003. Chemical composition and antifungal activity of essential oils of seven Moroccan Labiatae against Botrytis cinerea Pers: Fr. J. Ethnopharmacology, 89, 165-169.
Cosentino S. et al., 1999. In vitro antimicrobial activity and chemical composition of Sardinian Thymus essential oils. Lett. Appl. Microbiol., 29(2), 130-135.
Cowan M.M., 1999. Plant products as antimicrobial agents. Clin. Microbiol. Rev., 12, 564-582.
Crespo M.E., Jimenez J., Gomis E. & Navarro C., 1990. Antimicrobial activity of the essential oil of Thymus serpylloides subspecies gadorensis. Microbios, 61, 181-184.
Deferera D.J., Ziogas B.N. & Polissiou M.G., 2000. GC-MS Analysis of essential oil from some Greek aromatic plants and their fungi toxicity on Penicillium digitatum. J. Agric. Food Chem., 48(6), 2576-2581.
Didry N., Dubreuil L. & Pinkas M., 1993. Antimicrobial activity of thymol, carvacrol and cinnamaldehyde alone or in combination. Pharmazie, 48, 301-304.
Dorman H.J.D. & Deans S.G., 2000. Antimicrobial agents from plants: antimicrobial activity of plant volatile oils. J. Appl. Microbiol., 88, 308-316
Dumonceaux T.J. et al., 1998. Cloning and sequencing of a gene encoding cellobiose dehydrogenase from Trametes versicolor. Gene, 210, 211-219.
Farag R.S., Daw Z.Y., Hewedi F.M. & El-Baroly G.S.A., 1989. Antimicrobial activity of some Egyptian spice essential oils. J. Food Prot., 52, 665-667.
Goren A.C. et al., 2003. Analysis of essential oil of Coridothymus capitatus (L.) and its antibacterial and antifungal activity. Z. Naturforsch., 58, 687-690.
Green F. & Highley T.L., 1997. Mechanism of brown-rot decay: paradigm or paradox. Int. Biodeterior. Biodegradation, 39, 113-124.
Haluk J.P. & Roussel C., 1998. Durabilité naturelle du Red cedar et application des biotechnologies végétales dans le domaine de la préservation du bois. In : Communication 2e Journées Scientifiques Bois-Forêt, 1998, Épinal, France.
Haluk J.P & Roussel C., 2000. Caractérisation et origine des tropolones responsables de la durabilité naturelle des Cupressacées. Application potentielle en préservation du bois. Ann. Forest Sci., 57, 819-829.
Hammer K.A., Carson C.F. & Riley T.V., 1999. Antimicrobial activity of essential oils and other plant extracts. J. Appl. Microbiol., 1(86), 985-990.
Hammer K.A., Carson C.F. & Riley T.V., 2003. Antifungal activity of the components of Melaleuca alternifolia (tea tree) oil. J. Appl. Microbiol., 95, 853-860.
Ismaiel A. & Pierson M.D., 1990. Inhibition of growth and germination of C. botulinum 33A, 40B, and 1623E by essential oil of spices. J. Food Sci., 55, 1676-1678.
Jahandiez E. & Maire R., 1934. Catalogue des plantes du Maroc. Tome III. Paris : Edition Lechevalier.
Jordan M.J. et al., 2006. Seasonal variation of Thymus hyemalis Lange and Spanish Thymus vulgaris L. essential oils composition. Ind. Crops Prod., 24, 253-263.
Juven B.J., Kanner J., Schved F. & Weisslovicz H., 1994. Factors that can interact with the antibacterial action of thyme essential oil and its active constituents. J. Appl. Bacteriol., 76, 626-631.
Karaman S., Digrak M., Ravid U.A. & Ilcim A., 2001. Antibacterial and antifungal activity of the essential oils of Thymus revolutus Celak. from Turkey. J. Ethnopharmacology, 76, 183-186.
Karmen V., Bojana B., Vrtacnik M. & Pohleven F., 2003. Effect of the antifungal activity of oxygenated aromatic essential oil compounds on the white-rot Trametes versicolor and the brown-rot Coniophora puteana. Int. Biodeterior. Biodegradation, 51, 51-59.
Karousou R., Koureas D.N. & Kokkini S., 2005. Essential oil composition is related to the natural habitats: Coridothymus capitatus and Satureja thymbra in NATURA 2000 sites of Crete. Phytochemistry, 66, 2668-2673.
Karpouhtsis I. et al., 1998. Insecticidal and genotoxic activities of oregano essential oils. J. Agric. Food Chem., 46, 1111-1115.
Knowles J.R., Roller S., Murray D.B. & Naidu A.S., 2005. Antimicrobial action of carvacrol at different stages of dual-species biofilm development by Staphylococcus aureus and Salmonella enterica Serovar Typhimurium. Appl. Environ. Microbiol., 71, 797-803.
Kokkini S. et al., 1997. Autumn essential oils of Greek oregano. Phytochemistry, 44, 883-886.
Lopez-Malo A., Alzamora S.M. & Palou E., 2005. Aspergillus flavus growth in the presence of chemical preservatives and naturally occurring antimicrobial compounds. Int. J. Food Microbiol., 99, 119-128.
Mahmoud A.L.E., 1994. Antifungal action and anti aflatoxigenic properties of some essential oil constituents. Lett. Appl. Microbiol., 19, 110-113.
Marino M., Bersani C. & Comi G., 1999. Antimicrobial activity of the essential oils of Thymus vulgaris L. measured using a bioimpedometric method. J. Food Prod., 62, 1017-1023.
Mester T. & Tien M., 2000. Oxidation mechanism of ligninolytic enzymes involved in the degradation of environmental pollutants. Int. Biodeterior. Biodegradation, 46, 51-59.
Panizzi L., Flamini G., Cioni P.L. & Morelli I., 1993. Composition and antimicrobial activity of essential oils of four mediterranean Lamiaceae. J. Ethnopharmacology, 39, 167-170.
Paster N. et al., 1990. Inhibitory effect of oregano and thyme essential oils on moulds and foodborne bacteria. Lett. Appl. Microbiol., 11, 33-37.
Pepeljnjak S., Kosalec I., Kalodera Z. & Kustrak D., 2003. Natural antimycotics from Croatian plants. In: Rai M.K. & Rai R., eds. Plant-derived antimycotics. Binghampton, NY, USA: The Haworth Press, 49-81.
Remmal A. et al., 1993. Improved method for determination of antimicrobial activity of essential oils in agar medium. J. Essent. Oils Res., 5(2), 179-184.
Russo M., Galletti G., Bocchini P. & Garnacini A., 1998. Essential oil chemical of composition of wild populations of Italian origano spice (Origanum vulgare ssp. Hirtum Link): a preliminary evaluation of their use in chemotaxonomy by cluster analysis. J. Agric. Food Chem., 46, 3741-3746.
Satil F., Dirmenci T. & Tumen G., 2002. Natural situation of commercial Satureja species in Turkey. In: 16th National Congress of Biology, September 1-7, Malatya, Turkey.
Satrani B. et al., 2001. Composition chimique et activité antimicrobienne des huiles essentielles de Satureja calaminthe et Satureja alpina du Maroc. Ann. Falsif. Expert. Chim., 94(956), 241-250.
Scora K.M. & Scora R.W., 1998. Effect of volatiles on mycelium growth of Penicillium digitatum, P. italicum, and P. ulaiense. J. Basic Microbiol., 38, 405-413.
Senatore F., 1996. Influence of harvesting time on yield and composition of the essential oil of a thyme (Thymus pulegioides L.) growing wild in Campania (southern Italy). J. Agric. Food Chem., 44, 1327-1332.
Tabata M., Honda G. & Sezik E., 1988. A report on traditional medicine and medicinal plants in Turkey. Kyoto, Japan: Kyoto University, Faculty of Pharmaceutical Sciences.
Tanaka H., Itakura S. & Enoki A., 1999. Hydroxyl radical generation by an extracellular low-molecular-weight substance and phenol oxidase activity during wood degradation by the white rot basidiomycete Trametes versicolor. J. Biotechnol., 75, 57-70.
Thompson J.D. et al., 2003. Qualitative and quantitative variation in monoterpene co-occurrence and composition in the essential oil of Thymus vulgaris CHEMOTYPES. J. Chem. Ecol., 29(4), 859-880.
Ultee A., Kets E.P.W. & Smid E.J., 1999. Mechanisms of action of carvacrol on the food-borne pathogen Bacillus cereus. Appl. Environ. Microbiol., 65, 4606-4610.
Van Den Broucke C.O. & Lemli J.A., 1981. Pharmacological and chemical investigation of thyme liquid extracts. Planta Medica, 41, 129-135.

