La quinoa en Bolivie : une culture ancestrale devenue culture de rente " bio-équitable "
Institut de Recherche pour le Développement (IRD). Avenue Hernando Siles, 5290. BOL-La Paz (Bolivie).
Institut de Recherche pour le Développement (IRD). Avenue Hernando Siles, 5290. BOL-La Paz (Bolivie) – Gembloux Agricultural University – FUSAGx. Unité Sol, Écologie, Territoire. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Institut de Recherche pour le Développement (IRD). Unité de Recherche 060. Climat et Fonctionnement des Agro-écosystèmes (UR CLIFA). CNRS/CEFE (Centre d'Écologie Fonctionnelle et Évolutive). F-34293 Montpellier cédex 05 (France). E-mail : thierry.winkel@ird.fr
Reçu le 14 mars 2008, accepté le 3 juin 2008
Résumé
Cet article présente une synthèse bibliographique des travaux concernant la physiologie et la diversité génétique de la quinoa (Chenopodium quinoa Willd.). Cette culture d'origine andine connaît depuis une quinzaine d'années un grand succès commercial dans les filières de l'alimentation " bio " et équitable. Sélectionnée et cultivée depuis des millénaires sur les hauts plateaux andins, la quinoa présente une tolérance remarquable aux contraintes environnementales, en particulier à la sécheresse et au gel. Les connaissances encore fragmentaires sur sa physiologie indiquent une résistance élevée des plantes au froid et une bonne capacité de récupération photosynthétique après les périodes de stress hydrique. En conditions de culture au champ, la diversité génétique des populations locales et les pratiques agricoles contribuent aussi significativement à l'adaptation de la quinoa aux aléas climatiques.
Abstract
Quinoa in Bolivia: an ancestral crop changed to a cash crop with " organic fair-trade " labeling. This paper presents a review of the litterature on the physiology and diversity of quinoa (Chenopodium quinoa Willd.). Since about 15 years, this Andean crop experiences a great commercial success in the organic and fair-trade food networks. Selected and cultivated for thousands of years in the Andean highlands, quinoa shows a remarkable tolerance to environmental stresses, particularly to drought and cold. The present knowledges on quinoa physiology, though fragmentary, show a high cold resistance of the plants, and the capacity to recover high photosynthetic activity after drought. Under field conditions, the genetic diversity in local landraces and the crop practices also contribute notably to the adaptation of quinoa to climatic hazards.
1. Introduction
1Domestiquée il y a 7.000 ans environ dans les Andes, où elle est devenue un aliment de base des populations locales, la quinoa (Chenopodium quinoa Willd.)1 est un bon exemple d'espèce cultivée, longtemps négligée par la recherche agronomique et que ses hautes qualités nutritionnelles ont récemment fait apprécier très au-delà de sa région d'origine (National Research Council, 1989 ; Brack Egg, 2003). Depuis une quinzaine d'années, en Amérique du Nord, au Japon et en Europe, les filières d'alimentation diététique et " bio " font la promotion de sa haute teneur en protéines, sa composition équilibrée en acides aminés, son contenu élevé en minéraux essentiels, lipides, antioxydants et vitamines, et son absence de gluten (Chauhan et al., 1992 ; Repo-Carrasco et al., 1999 ; Ng et al., 2007). Consommée sous forme de grains complets, de farine, de flocons ou de graines soufflées, la quinoa n'est pourtant pas considérée comme une céréale en tant que telle puisqu'elle appartient à la famille des Chénopodiacées et non à celle des Poacées. On la qualifie donc parfois de " pseudo-céréale ".
2Cultivée dans des milieux aussi divers que le littoral du Pacifique, l'Altiplano central ou les vallées subtropicales des Andes, et maintenant disséminée à travers plus de cinquante pays dans le monde, la quinoa reste néanmoins emblématique des hauts plateaux de Bolivie, d'Equateur et du Pérou. Entre 3.000 et 4.000 m d'altitude, sous des climats arides, froids et venteux, sur des sols pauvres, parfois salins, cette espèce s'est diversifiée en plusieurs dizaines de variétés locales. Sa rusticité et ses qualités nutritionnelles exceptionnelles justifient d'étudier son fonctionnement biologique, et notamment ses mécanismes d'adaptation aux stress multiples, et souvent simultanés, que sont le gel, la sécheresse et les fortes radiations solaires. La compréhension des bases biologiques de cette rusticité peut orienter l'amélioration de la quinoa elle-même, mais aussi d'autres productions végétales vers la recherche d'une réduction des besoins en intrants et d'une plus grande tolérance à des conditions écologiques extrêmes (Wilson, 1988b).
3La synthèse bibliographique présentée ici commence par situer le cadre physique dans lequel a été domestiquée et sélectionnée la quinoa, en insistant sur sa dimension climatique. Les caractéristiques botaniques, physiologiques et génétiques de l'espèce sont ensuite passées en revue, exposant notamment les bases biologiques de sa tolérance aux contraintes du milieu. Les aspects agronomiques et alimentaires sont également mentionnés. Enfin, les implications de la diversité des cultures de quinoa pour l'adaptation au climat et l'amélioration des ressources génétiques sont discutées.
2. Un milieu montagnard soumis à de fortes contraintes climatiques
2.1. Situation géographique et généralités
4La Bolivie occupe la partie centrale occidentale de l'Amérique du Sud (Figure 1). Comprise entre 9°38' et 22°53' de latitude sud, et 57°30' et 69°40' de longitude ouest, elle couvre à la fois des biomes tropicaux, subtropicaux et tempérés. Sa superficie est de 1.098.581 km² et sa population s'élève à 8.600.000 habitants (INE, 2002). Son indice de développement humain est de 0,58 sur une échelle de 0 à 1 (PNUD, 2004). C'est la valeur la plus basse de l'Amérique méridionale.
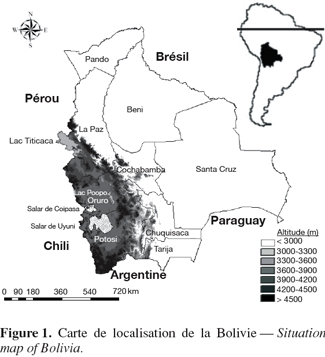
5Occupant tout l'ouest du pays, l'Altiplano couvre environ 191.000 km² et s'étend sur 900 km du nord au sud avec une largeur d'environ 200 kilomètres. C'est un système endoréique, constitué d'une série de plateaux dont les altitudes vont de 3.400 à 4.100 m, et que bordent des cordillères dont les sommets avoisinent les 6.000 m (Figure 2). L'Altiplano est subdivisé en trois régions : Nord, Centre et Sud. Chacune compte une vaste dépression : le lac Titicaca au nord, le lac Poopó au centre et les lacs salés (" salares ") de Coipasa et d'Uyuni au sud. L'aridité et le risque de gel suivent un gradient croissant vers le sud, avec des précipitations moyennes annuelles passant de 850 mm au bord du lac Titicaca à 150 mm au sud du salar d'Uyuni.

6Ces hauts plateaux arides et froids, qui hébergent plus du quart de la population rurale de Bolivie, sont depuis l'époque pré-colombienne l'une des plus importantes régions agricoles du pays (Vacher, 1998). Leurs systèmes de production traditionnellement adaptés à la haute montagne démontrent aujourd'hui une forte capacité à répondre aux mutations économiques du changement global. La quinoa en donne certainement l'exemple le plus manifeste.
7Cependant, les contraintes climatiques et pédologiques (Orsag, 1989 ; 1992 ; FAO, 1997) sont fortes et limitent les rendements agricoles à des niveaux très bas : typiquement 650 kg.ha-1 pour la quinoa, alors que des rendements de 6.000 kg.ha-1 sont atteints pour la pomme de terre (FAO, 2008). L'utilisation d'intrants chimiques, trop coûteux pour les producteurs locaux, est exceptionnelle et la production reste largement tournée vers l'autoconsommation. Les productions agricoles sont originaires des Andes (pommes de terre amères et douces, autres tubercules et racines andines, quinoa, kañahua, élevage de lamas et alpacas) ou ont été introduites avec la conquête espagnole (fève, orge, avoine, bovins, ovins, volailles, porcins, etc.).
2.2. Risques climatiques
8L'Altiplano se situe dans la région subtropicale et tempérée de terres hautes selon la classification des zones de vie de Holdridge (Montes de Oca, 1997). Son climat se caractérise par :
9– une saison humide d'été austral (octobre à avril) correspondant à la période de culture et une saison sèche d'hiver austral (mai à octobre),
10– une radiation ultra-violette intense et une radiation globale élevée conduisant à une forte évapotranspiration potentielle (Vacher, 1989 ; Geerts et al., 2006),
11– de fortes amplitudes thermiques journalières, de 15 à 20 °C en moyenne mais pouvant atteindre jusqu'à 50 °C dans la même journée (enregistré à Uyuni en août 1946),
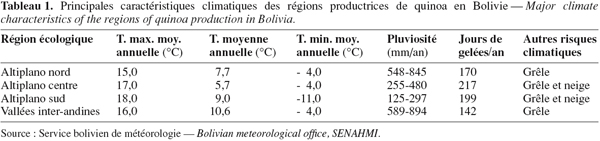
12– des risques permanents de gel et de grêle pendant la saison de culture (Tableau 1).
13Les contraintes climatiques particulières aux hauts plateaux andins ont été étudiées par de nombreux auteurs au Pérou et en Bolivie (voir en particulier Frère et al., 1978 ; Morlon, 1992). Les risques climatiques les plus importants sont les gelées radiatives présentes pratiquement tout au long de l'année et les sécheresses et les grêles survenant à n'importe quel moment du cycle agricole (Vacher, 1989 ; Le Tacon et al., 1992 ; Du Portal, 1993 ; Michel, 1997 ; François et al., 1999 ; Garcia, 2003 ; Geerts, 2004 ; Geerts et al., 2006).
14Les trois principaux facteurs influençant le début, la durée et l'intensité de la saison des pluies sont le déplacement de la Zone de Convergence Inter Tropicale (ITCZ), la présence du lac Titicaca et l'oscillation méridionale d'El Niño (ENSO). Le phénomène ENSO, à l'origine d'une forte variabilité inter-annuelle des précipitations et de l'évapotranspiration, constitue un risque important pour la production végétale (Vuille, 1999 ; Garreaud et al., 2003). Les connaissances locales sur le climat intègrent en partie ce phénomène dans diverses pratiques ancestrales de prévision du temps (Orlove et al., 2000).
15Les dégâts causés aux cultures par les gelées sont mentionnés dans les textes historiques depuis l'époque coloniale (Cieza de Leon, 1553, cité par Vacher, 1998). La fréquence de cet événement climatique et ses conséquences font peser un risque permanent sur la production agricole. Les gelées nocturnes sur l'Altiplano sont provoquées principalement par un bilan radiatif négatif au niveau du sol et des organes végétaux (Vacher, 1989 ; Lhomme et al., 2002). Elles sont très fréquentes de mai à septembre puis diminuent à partir du mois d'octobre, permettant les semis. Aux mois d'avril et mai (époque de récolte), les gelées nocturnes redeviennent un risque important. Il faut cependant signaler que, si la fréquence des gelées est minimale en milieu de cycle cultural, c'est en revanche à cette période que leur impact sur les plantes en cours de floraison est maximal.
3. La quinoa : une culture rustique à haute valeur nutritive
3.1. Origine et distribution géographique
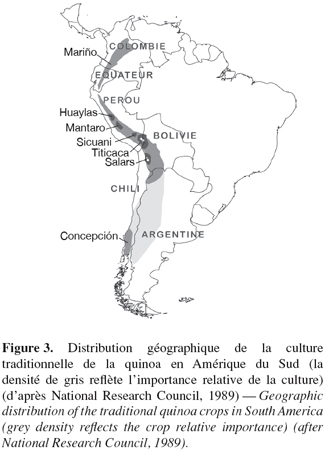
16" Quinoa " est un mot d'origine quechua désignant une plante annuelle à feuilles triangulaires et panicules composées. Selon les traces archéologiques découvertes dans les grottes d'Ayacucho au Pérou, cette Chénopodiacée aurait été domestiquée il y a 6.400 à 7.800 ans (Brack Egg, 2003). Elle est cultivée et consommée depuis des siècles par les populations indigènes de Colombie, Équateur, Pérou, Bolivie et Chili (Gandarillas, 1979a) (Figure 3).
17Grâce à ces générations d'agriculteurs, le matériel génétique de cette espèce, comme celui d'autres espèces locales apparentées (Chenopodium pallidicaule Aellen, Chenopodium quinoa ssp. melanospermum Hunz.), a pu être conservé par ce que l'on pourrait appeler un système spontané de conservation in situ (Tapia, 2002). Depuis une quinzaine d'années et principalement en Bolivie, la quinoa est aussi devenue l'objet d'une culture d'exportation à destination des pays du Nord (Europe, États-Unis, Canada, Japon) à la recherche d'aliments à haute valeur nutritive et certifiés " agriculture biologique " (Laguna et al., 2006). L'acclimatation de cette culture aux pays nordiques a été tentée mais elle s'est heurtée à la sensibilité de la plupart des variétés au photopériodisme (la quinoa ne fleurit généralement pas en jours longs) et au mildiou (dont le traitement chimique ôterait le bénéfice du label " bio ") (Jacobsen et al., 1993 ; Jacobsen, 1997). Par ailleurs, les variétés potentiellement transférables au nord sont de qualité médiocre (grains petits et irréguliers) et d'un coût de production élevé en comparaison des produits obtenus dans les pays andins.
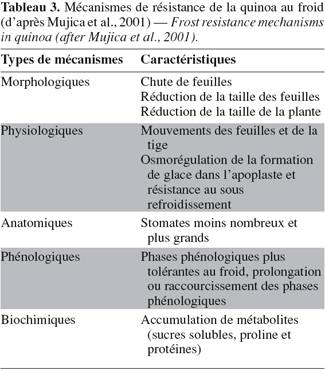
18En Bolivie, la quinoa est cultivée sur les trois sous-régions de l'Altiplano (Nord, Centre et Sud) ainsi que dans les vallées inter-andines des départements de Cochabamba et de Potosi (Tableau 1). Deux zones présentent une importance particulière pour cette culture : les alentours du lac Titicaca, où la diversité variétale est très importante, et la région située autour des salars d'Uyuni et de Coipasa (zone intersalar et Nor Lipez), où la production est largement orientée vers le marché d'exportation.
3.2. Description botanique
19La quinoa (C. quinoa) est une dicotylédone herbacée, autogame, annuelle, de la famille des Chénopodiacées. Dans des conditions optimales de température et d'humidité, les grains germent en une dizaine d'heures environ (Bois et al., 2006) et, au champ, les cotylédons apparaissent généralement vers le 7e jour après l'émergence. La croissance racinaire est en rapport étroit avec celle de la partie aérienne, et des plantes exceptionnelles atteignant 1,70 m de hauteur ont développé des racines de 1,50 m (Tapia et al., 1979 ; Izquierdo et al., 2001). Plus communément, la tige a une taille comprise entre 0,5 et 1,5 m selon la variété et les conditions de croissance, les quinoas des vallées ou des zones protégées et fertiles étant plus grandes que celles qui poussent au-delà de 4.000 m ou dans les zones arides et froides (Gandarillas, 1979b ; Caceres, 1993 ; Mujica et al., 1999). Selon le développement de la ramification, on trouve des plantes avec une tige principale développée dominant quelques tiges latérales très courtes dans les écotypes de l'Altiplano, ou des plantes à tiges multiples de tailles comparables dans les écotypes des vallées, avec toutes les variantes intermédiaires entre ces deux types. Le développement de l'architecture de la plante peut être partiellement modifié par la densité de semis de la culture. La tige, cylindrique au niveau du collet et anguleuse plus haut, contient une moelle de texture tendre chez les jeunes plantes, devenant spongieuse et creuse à maturité, avec une écorce ferme et compacte, dont la résistance à la grêle semble dépendre de la variété. La couleur de la tige est caractéristique de la variété : verte, orangée, rouge foncé ou pourpre, uniforme ou tachetée.
20Les feuilles d'une même plante sont nettement polymorphes, celles de la tige principale étant plus longues que celles des ramifications. Les feuilles, alternes, ont un limbe en forme de losange, de triangle ou lancéolé, plat ou onduleux, charnu et tendre (celles de jeunes plantes se consomment comme légume). Le nombre de dents ou de lobes des feuilles serait une caractéristique variétale, les feuilles des quinoas de Bolivie et du sud du Pérou comptant peu de dents (Tapia et al., 1979). La couleur prédominante de la plante est verte mais chez les plantes adultes, les couleurs de base sont rouge, pourpre et vert, selon le génotype.
21L'endroit et l'envers des jeunes feuilles ainsi que les tiges et les jeunes inflorescences sont couverts de minuscules vésicules qui sont des excroissances épidermiques de forme sphérique et de couleur blanche, pourpre ou rouge, riches en oxalate de calcium et en pigments divers (Figure 4). Certains auteurs ont supposé que ces vésicules salines jouaient un rôle dans l'adaptation de la plante à la sécheresse (Gandarillas, 1982 ; Dizès et al., 1992) mais jusqu'à ce jour, aucune preuve n'a pu être apportée. Les travaux récents de Bois et al. (2006) ont montré qu'elles n'avaient pas non plus de rôle protecteur vis-à-vis du gel. L'hypothèse la plus vraisemblable est que ces vésicules, par leur densité, leur forme sphérique et leur contenu en pigments, ont un rôle de protection des jeunes organes contre le rayonnement solaire, très intense sur les hauts plateaux andins.

22La quinoa présente des fleurs hermaphrodites disposées en inflorescences en grappes, considérées comme de faux épis (panicules). Dans l'étape reproductrice du cycle de la quinoa, l'inflorescence est terminale et de longueur variable. Il en existe deux types principaux : glomériforme et amaranthiforme et, selon Gandarillas (1968), le type glomériforme serait la forme ancestrale ayant donné le second type par mutation. Les fleurs incomplètes (apétales) et très petites (3 mm au maximum) peuvent être hermaphrodites en position apicale, ou pistillaires dans la région inférieure de la panicule, dans des proportions diverses selon la variété (Tapia et al., 1979 ; Izquierdo et al., 2001). En général, la quinoa est une espèce autogame, avec environ 10 % de pollinisation croisée (Rea, 1969). Cependant, dans quelques variétés, l'allogamie atteint jusqu'à 80 %, ce qui est expliqué par la rareté des fleurs pistillaires (Izquierdo et al., 2001). Les descendants de deux générations d'autofécondation complète ont montré la même vigueur et productivité que leurs parents, c'est pourquoi l'on considère que ce type de reproduction n'affecte pas la culture et permet l'utilisation de techniques basées sur les plantes autogames pour l'amélioration génétique (Tapia et al., 1979 ; Izquierdo et al., 2001).
23Le fruit est un akène, de forme cylindrique à lenticulaire, dans lequel l'embryon périphérique entoure le périsperme central (tissus de réserve) et se trouve couvert par le péricarpe et deux assises tégumentaires (Prego et al., 1998). Le péricarpe contient de la saponine en plus ou moins grande quantité et, bien que chez certaines variétés (formes cultivées), il soit séparé facilement, dans d'autres (formes sauvages), il reste difficile à éliminer. La combinaison des couleurs du péricarpe et du tégument de la graine donne la vaste gamme de couleurs que peuvent présenter les panicules. Il existe trois formes de grain : conique, cylindrique et ellipsoïde. Les bords du grain sont d'une grande valeur taxonomique, car ils sont communément marqués chez les formes cultivées, et plus arrondis chez les sauvages (Tapia et al., 1979 ; Izquierdo et al., 2001 ; Bruno, 2006).
24La quinoa montre une grande variabilité morphologique, concernant aussi bien les feuilles que les panicules et les graines (Tapia et al., 1979 ; Pinto, 2002). Les caractères morphologiques du port de la plante (ramification), de la forme de l'inflorescence (amaranthiforme ou glomériforme), de la feuille et du grain sont les plus constants pour sa classification taxonomique. En revanche, la hauteur de la plante, comme sa couleur et celle du grain, sont des caractéristiques beaucoup plus variables et, par conséquent, sont moins fiables pour la classification de variétés (Tapia et al., 1979).
3.3. Physiologie de la quinoa
25L'ample distribution géographique de la quinoa témoigne de la grande faculté d'adaptation de l'espèce puisqu'on peut en cultiver divers écotypes depuis le niveau de la mer au Chili, jusqu'à plus de 4.000 m d'altitude sur l'Altiplano boliviano-péruvien, sous des climats allant du froid aride jusqu'au tropical humide (Figures 2 et 3). L'espèce est tolérante à diverses contraintes abiotiques comme la sécheresse, les radiations UV, le gel et la salinité des sols, ce qui en a fait une espèce candidate pour les tests de culture en station orbitale (Schlick et al., 1996).
26La quinoa est une plante de type C3, parfois considérée à tort comme peu efficace dans la fixation du carbone (Tapia et al., 1979). Au contraire, sous des températures modérées à froides comme celles de l'Altiplano bolivien, la photosynthèse de type C3 s'avère plus efficace que celle de type C4, les plantes C4 ne pouvant pas maintenir des niveaux de Rubisco aussi élevés que des plantes C3, ce qui limite leurs capacités photosynthétiques (Cabido et al., 1997 ; Kubien et al., 2004).
27Comparant différentes variétés de quinoa de l'Altiplano central, Bois et al. (2006) ont constaté leur survie jusqu'à - 4 °C, un seuil de tolérance proche de celui d'un cultivar sensible des vallées du Pérou étudié par Jacobsen et al. (2005). Dans cette dernière étude, les plantes de quinoa au stade 12 feuilles soumises à - 4 °C pendant 4 heures avaient un taux de survie de 70 % dans le cas du cultivar originaire de la vallée, et jusqu'à 90 % pour la forme provenant de l'Altiplano. Les divergences observées entre ces études réalisées en serre suggèrent une interaction possible de l'humidité de l'air dans la tolérance au gel et plaident pour la réalisation d'expériences écophysiologiques in situ.
28La fonction des vésicules riches en oxalate de calcium et en pigments présentes à la surface des jeunes feuilles et des inflorescences n'est pas encore éclaircie, mais on suppose qu'elles protègent la plante de l'excès de radiation solaire et l'aident à résister à la sécheresse en intervenant dans les relations hydriques ou en formant un microclimat autour des feuilles (Tapia et al., 1979 ; Mujica et al., 1999 ; Izquierdo et al., 2001 ; Bois et al., 2006).
29Si l'humidité du sol diminue trop, la plante arrête sa croissance, la tige devient fibreuse et le système radiculaire se fortifie, permettant à la plante de résister jusqu'à trois mois de sécheresse. Dans ces mêmes conditions, le développement de la plante devient plus asynchrone, une partie de la panicule produisant des grains, tandis que d'autres fleurs continuent à se former ou entrent en anthèse (Mujica et al., 1999). La quantité d'eau requise par la plante dans l'Altiplano central de Bolivie est approximativement de 385 mm pour 5 mois et demi de vie physiologique (Tapia et al., 1979). Cette quantité correspond plus ou moins aux précipitations de la période d'été, ce qui démontre que la quinoa est adaptée au régime moyen des pluies dans cette zone.
30Résistance à la sécheresse. Bien que la quinoa présente divers mécanismes de résistance au stress hydrique, la sécheresse reste un des facteurs les plus courants de baisse des rendements en grain, même si des sécheresses modérées en début de cycle peuvent avoir un effet positif d'endurcissement des plantes (Bosque et al., 2003). La résistance à la sécheresse met en jeu différents mécanismes morphologiques, anatomiques, phénologiques et biochimiques énumérés dans le tableau 2.

31Jacobsen et al. (1998) ainsi que Jensen et al. (2000) signalent que la résistance de la quinoa à la sécheresse est liée à des valeurs généralement basses de potentiel osmotique plutôt qu'à une véritable capacité d'ajustement de ce potentiel en réponse à un stress hydrique donné. La conductance stomatique ne montre pas non plus de sensibilité particulière au stress hydrique. En revanche, des valeurs élevées de photosynthèse nette et de surface spécifique des jeunes feuilles favoriserait la vigueur des plantes et l'absorption rapide de l'eau du sol en début de cycle et, par conséquent, une meilleure tolérance aux sécheresses ultérieures (Jensen et al., 2000). Face au stress hydrique, la quinoa montre un bon maintien de ses capacités photochimiques, ce qui explique la récupération rapide et complète de l'activité physiologique dès que l'alimentation en eau redevient normale (Bosque et al., 2003 ; Winkel et al., 2002). Ces capacités de récupération rapides constatées en conditions contrôlées corroborent les observations faites au champ sur la résistance des cultures de quinoa, en particulier en début de cycle.
32Résistance au froid. Le tableau 3 présente quelques-uns des mécanismes de résistance au froid rencontrés chez la quinoa.
33Une teneur élevée en sucres solubles confère une tolérance supplémentaire au gel par un abaissement significatif de la température de congélation et de la température moyenne létale (Jacobsen et al., 2005). Si l'on compare la sensibilité au gel à différentes phases de croissance, la quinoa apparaît plus vulnérable pendant la floraison, qui est également l'étape la plus sensible au stress hydrique. La température moyenne adéquate pour la culture de la quinoa se situe autour de 15-20 °C. On a cependant observé qu'avec des températures moyennes de 10 °C, la culture se développe parfaitement. À des températures supérieures à 38 °C, les fleurs avortent, et les stigmates et les étamines meurent (National Research Council, 1989). Pour les températures basses, les phases de pré-floraison et de floraison sont sensibles et ne peuvent résister que jusqu'à - 3 °C (Canahua et al., 1979).
34Les paramètres thermophysiologiques de la quinoa, mesurés en conditions contrôlées par Bois et al. (2006), donnent une température de base pour la germination nettement inférieure à celle de la plupart des cultures (2 °C contre 10 °C environ pour le maïs), ce qui indique une bonne adaptation au climat froid de l'Altiplano dès les premiers stades de développement. Les mêmes auteurs ont prouvé qu'au stade végétatif (15 à 18 feuilles environ), aucune plante de quinoa ne pouvait survivre après 4 heures passées à - 6 °C, mais qu'aucun effet sérieux n'était observé à - 4 °C. Les exothermes de feuilles ont confirmé que la nucléation de glace se produit entre - 5 et - 6 °C. Le faible contenu en eau de la feuille contribue à retarder la congélation, mais les vésicules foliaires ne semblent jouer, elles, aucun rôle, ni protecteur ni néfaste, vis-à-vis de la congélation des feuilles. L'absence de relation entre la sensibilité variétale et l'origine géographique des cultivars soutient l'idée que les agriculteurs andins s'accommodent des risques de gel par une diversité de cultivars plutôt qu'en adoptant une forme localement adaptée.
35Néanmoins, Jacobsen et al. (2005 ; 2007) ont démontré qu'un écotype résistant de quinoa (Witulla) avait accumulé 11 % de sucres solubles de plus que le génotype sensible (Quillahuaman), ce qui signifierait que les sucres solubles joueraient un rôle d'osmorégulateurs, en évitant la sortie de l'eau de l'intérieur de la cellule lorsque le liquide apoplastique gèle. Cette différence de réaction physiologique face au gel semble être une réponse adaptative puisqu'elle est en relation avec l'origine géographique des écotypes, Witulla provenant des hauts plateaux froids et Quillahuaman, des vallées plus tempérées.
36La photopériode est un autre facteur important pour le développement chez beaucoup d'espèces, affectant notamment le développement floral. L'inhibition de croissance des grains observée par Bertero et al. (1999) sous l'effet combiné d'une température élevée (28 °C) et de jours longs (16 h) explique en partie pourquoi les génotypes andins de quinoa s'adaptent mal dans les pays de haute latitude, alors que ceux d'origine chilienne sont aptes à produire dans ces régions (Jacobsen et al., 1993 ; Jacobsen, 1997).
37Tolérance à la salinité. La zone de plus grande production de quinoa dans le monde correspond à la région des salars de l'Altiplano sud de Bolivie, où les sols présentent une grande concentration de sels, principalement de chlorure de sodium. Dans cette région, et en année climatique favorable, les techniques traditionnelles non intensives permettent d'obtenir en moyenne 1 t.ha-1 de quinoa de bonne qualité, ce qui indique que la quinoa tolère la présence de sel dans le sol.
38Six à sept jours après l'ensemencement, les graines de génotypes tolérants au sel germent à plus de 75 % à des concentrations salines de 0,6 M de NaCl (57 mS.cm-1), ce qui indiquerait que le sel ne provoque pas la mort de l'embryon mais retarde seulement les mécanismes physiologiques et biochimiques impliqués dans l'étape initiale de la germination (Mujica et al., 2001). Des différences significatives de tolérance au sel existent entre cultivars. Pour la plupart d'entre eux, la production est plus élevée dans des conditions modérément salines que dans des conditions non salines, ce qui fait de la quinoa un halophyte facultatif (Bosque et al., 2003).
39Phénologie de la quinoa. Selon Tapia et al. (1979), le cycle de croissance de la quinoa peut être différencié en cinq périodes :
40– du semis à l'émergence, 11-57 jours,
41– de l'émergence à l'apparition de la première paire de feuilles, 5-9 jours,
42– de la première paire de feuilles à l'apparition des panicules, 45-56 jours,
43– des panicules à la floraison, 11-31 jours,
44– de la floraison à la maturation, 60-109 jours.
45Différents auteurs ont proposé des échelles pour décrire le développement phénologique de la quinoa. Espindola (1986) considère les phases phénologiques suivantes :
46– émergence,
47– deux feuilles véritables,
48– quatre feuilles véritables,
49– six feuilles véritables,
50– ramification,
51– début de formation de la panicule,
52– formation de la panicule,
53– début de la floraison,
54– floraison ou anthèse,
55– grain laiteux,
56– grain pâteux,
57– maturité physiologique.
58D'autre part, Espindola (1992) distingue 9 étapes morpho-anatomiques pour la quinoa, qui sont :
59– étape d'émergence,
60– étape cotylédonaire,
61– étape des 2 feuilles de base,
62– étape de 5 feuilles alternes (différenciation paniculaire),
63– étape de 13 feuilles alternes (pré-émergence paniculaire),
64– étape d'émergence de la panicule,
65– étape de floraison,
66– étape de grain laiteux,
67– étape de grain pâteux,
68– étape de grain dur (maturité physiologique).
69Évaluant en Angleterre 294 accessions de quinoa, Risi et al. (1989) ont trouvé des différences significatives à tous les stades de développement, la période entre le stade de deux feuilles véritables et la formation de la panicule durant entre 41 et 89 jours, celle de la formation de la panicule à l'anthèse variant de 7 à 53 jours et la période de l'anthèse à la maturité physiologique durant entre 65 et 137 jours. Les travaux de Jacobsen (1998) comparant cinq lignées de quinoa pendant trois saisons de culture en Europe du Nord ont montré que les durées totales de cycle dépendent non seulement de la lignée mais aussi de l'année de culture, du type de quinoa (les quinoas fourragères sont plus précoces que les quinoas à grains) et de la localisation (les cycles sont globalement plus précoces au Danemark qu'au Pérou) (Jacobsen et al., 1993). Rojas (1998), testant 1.512 accessions de quinoa dans les conditions de l'Altiplano bolivien, observe un temps moyen pour la maturité physiologique allant de 119 à 209 jours.
3.4. Génétique et diversité de la quinoa
70La quinoa a été domestiquée dans les Andes il y a 5.000 à 7.000 ans (Brack Egg, 2003) et soumise à un processus d'amélioration de plusieurs de ses caractéristiques dans une vaste gamme d'environnements, allant des hauts plateaux semi-arides aux vallées tropicales et au littoral du Pacifique. La quinoa cultivée présente ainsi une grande variabilité génétique qui se traduit par une diversité de couleur des tiges, des inflorescences et des graines, de forme et de taille des inflorescences (Figure 5), de teneur en protéines, de contenu en saponine et dans la présence ou non de cristaux d'oxalate de calcium sur les feuilles.

71La quantification des chromosomes de divers cultivars de Chenopodium quinoa de Bolivie, Pérou et Chili donne un nombre de 36 chromosomes somatiques, constitués de deux lots diploïdes de 2x = 4n, avec n = 9 chromosomes, faisant de la quinoa une espèce allotétraploïde (Catacora, 1977 ; Gandarillas, 1979b ; Tapia et al., 1979 ; Wilson, 1988a, b, c ; Izquierdo et al., 2001). L'origine génétique de la quinoa reste controversée et plusieurs hypothèses ont été formulées. Après avoir envisagé la possibilité d'une origine nord-américaine (Wilson, 1976, cité par Mujica et al., 2001), Wilson (1990) considère que la quinoa proviendrait de Chenopodium hircinum Schrad., une espèce sauvage également tétraploïde, présente dans les terres basses de la région andine. Cet ancêtre tétraploïde proviendrait à son tour d'espèces diploïdes communes dans les Andes comme Chenopodium carnosolum Moq., Chenopodium pallidicaule Aellen ou Chenopodium petiolare Kunth.
72Une forme sauvage de la quinoa, C. quinoa ssp. melanospermun Huntz., largement répandue aux abords des cultures, serait issue de la dé-domestication (échappée de culture) de la forme cultivée. Elle est également tétraploïde et n'en diffère que par la couleur des graines, noires au lieu de blanches (Wilson, 1988c ; 1990).
73Les résultats de différents croisements montrent que la quinoa présente une hérédité monogénique avec allélisme multiple pour la couleur rouge des feuilles, cette dernière dominant sur le pourpre et le vert, et le pourpre dominant le vert. La présence de couleur au niveau des aisselles des feuilles est un caractère dominant (Tapia et al., 1979 ; Izquierdo et al., 2001). Concernant la forme de l'inflorescence, on observe une ségrégation de 3 glomériformes pour 1 amaranthiforme. La stérilité mâle est nucléocytoplasmique, avec une descendance de 3 fertiles et 1 stérile dans le croisement avec une plante fertile mâle (Izquierdo et al., 2001).
74L'hérédité de la couleur des graines suit un processus différent chez les graines noires, marrons, jaunes et blanches. Les croisements effectués montrent, par les proportions de couleurs dans la génération F2, une hérédité complémentaire pour ce caractère de coloration des graines. La couleur noire (ancestrale et sauvage) est dominante sur les autres, avec deux séries allélomorphiques complémentaires et indépendantes : celle des grains marrons (" cafés " en espagnol) de type " C " avec les allèles C, cc et c et celle des grains jaunes (" amarillos " en espagnol) " A " avec les allèles A, ac, acc, a et probablement ar, dont la combinaison des deux allèles dominants à chacun des loci A-C- donne des graines noires, tandis que les autres combinaisons se traduisent par des couleurs différentes (marron, jaune, blanc, etc.). Les graines blanches sont l'expression de l'homozygotie récessive pour les deux séries alléliques, ce qui rend plus facile leur sélection dans l'amélioration (Tapia et al., 1979). Par ailleurs, on a observé chez la quinoa une ségrégation spontanée de graines noires et blanches à partir de graines blanches en conditions naturelles. Ceci peut être dû à des croisements spontanés avec des variétés sauvages, mais il existe également des indices suggérant l'intervention d'éléments génétiques sauteurs (ou transposons) (Izquierdo et al., 2001).
75Les ressources génétiques des espèces de Chenopodium apparentées à la quinoa offrent une série de caractéristiques potentiellement utiles pour l'amélioration de la culture. Ainsi, C. carnosolum est une source génétique pour la précocité et la rusticité, C. petiolare, C. hircinum et Chenopodium berlandieri Moq. subsp. nuttalliae (Saff.) H.D.Wilson & Heiser hébergent des gènes résistants au mildiou (Peronospora farinosa (Fr.) Fr.) (Bonifacio, 2001). Gandarillas (1984) considère que la tolérance de la quinoa à l'excès de sels vient de C. carnosolum qui pousse dans des zones de forte concentration saline, la résistance au froid viendrait de C. pallidicaule qui croît aux très hautes altitudes, et la morphologie de la quinoa viendrait de C. petiolare. Plusieurs banques de gènes conservent de nombreuses accessions (Tableau 4).

3.5. Techniques culturales
76Le travail cultural pour la production de la quinoa est généralement limité à la préparation du terrain, au semis, au contrôle des maladies, des parasites et, plus rarement, des mauvaises herbes et à la récolte.
77Dans l'Altiplano nord ou central, la quinoa est une culture de rotation qui ne nécessite pas de préparation spécifique du terrain pour le semis car, suite à la récolte de la pomme de terre, le sol est suffisamment meuble. Dans l'Altiplano sud, la rotation est rare et les cycles de culture de la quinoa alternent avec des périodes de jachère plus ou moins longues : de plus de dix ans autrefois, elles sont souvent passées à deux ou trois ans seulement depuis que la production s'est intensifiée. Dans le sud semi-aride, le labour préparatoire intervient au milieu de la saison des pluies précédant le semis avec l'objectif d'emmagasiner dans le sol les précipitations reçues jusqu'à la saison de culture suivante. La préparation de la première mise en culture se fait au moyen de charrues à versoir et à disques ou, dans les endroits accidentés, à l'aide de charrues jointes ou même de simples houes. En terrain plat, viennent ensuite l'ameublissement et l'émottage du sol avec des herses croisées ou à disques. Le nivellement peut être réalisé au moyen de barres de fer ou de grosses planches. Étant donné la petite taille des graines et les fortes hétérogénéités d'humidité et de compaction du lit de semence, cette opération de nivellement est importante pour la réussite de la levée, et reste une difficulté majeure pour l'agriculture mécanisée dans les Andes.
78Les semis ont habituellement lieu durant les mois d'août et de septembre mais peuvent être retardés jusqu'à début décembre avec certaines variétés de cycle très court (90 jours). Cette activité diffère selon que le système de culture utilise des outils traditionnels ou des machines agricoles. La manière de semer varie aussi selon les régions de production, se faisant par poquets (hoyos) dans les régions méridionales arides et sur des sillons (surcos) ou à la volée dans les régions mieux arrosées de l'Altiplano central et nord et les vallées inter-andines. La densité de semis est de 10 à 15 kg.ha-1 de graines. Les agriculteurs cherchent à éviter les risques de destruction de leurs plantes en diversifiant les écotypes qu'ils sèment dans différentes parcelles (et même au sein de la même parcelle !). Néanmoins, dans l'Altiplano sud, la production commerciale tend à uniformiser les variétés semées et à concentrer et étendre les zones de culture.
79La fertilisation organique ou minérale des parcelles de quinoa est peu pratiquée. En rotation avec la pomme de terre, la quinoa se satisfait de l'engrais organique résiduel de la culture précédente. Cependant, des études récentes ont montré que les rendements bénéficiaient d'une fertilisation azotée adéquate (Alegria et al., 1999). Dans la production d'exportation de l'Altiplano sud, les normes de certification biologique proscrivent la fertilisation minérale et recommandent l'incorporation de fumier lors du semis (Félix, 2008). Mais cette pratique est rendue problématique par le déclin de l'élevage lié à l'expansion de la frontière agricole. Concernant les autres minéraux et l'eau, la quinoa a des besoins faibles en calcium et potassium et peut très bien s'adapter à des sols sablonneux ou argileux. Elle est en revanche sensible à l'excès d'humidité et préfèrera donc un sol limoneux doté d'un bon drainage sur des pentes modérées. Elle tolère aussi une large gamme de pH du sol, depuis les sols alcalins de la région des salars boliviens (pH 9) jusqu'aux sols acides (pH 4,5) de la région de Cajamarca (Pérou). Il existe des génotypes adéquats pour chacune des conditions extrêmes de pH (Mujica, 1979).
80La quinoa est affectée par des facteurs biotiques comme les maladies et les insectes qui réduisent considérablement le rendement et la qualité du produit. Les insectes observés sur la quinoa cultivée dans l'Altiplano sont : les " ticonas " qui correspondent au groupe complexe des noctuidés (Copitarsia turbata Herrich-Schäffer, Feltia experta Walker et Spodoptera sp.) et la mite de la quinoa sous forme de chenilles et de larves appelées " kcona kconas " (Eurysacca melanocampta Meyric ou Scrobipalpula sp.) (Ortiz et al., 2001). Le contrôle des insectes par voie chimique ou naturelle (pièges, bio-insecticides) est une pratique assez courante dans l'Altiplano sud mais rare dans l'Altiplano central et nord. La prolifération de parasites semble avoir été facilitée par la mécanisation et l'extension de la monoculture de la quinoa. Les recommandations de contrôle intégré des parasites préconisent l'utilisation d'extraits naturels de plantes et de bio-insecticides. Des études sont aussi menées avec le concours d'agriculteurs locaux pour déterminer les méthodes les plus adéquates de contrôle biologique, comme par exemple les pièges nocturnes lumineux ou les phéromones. Sur le plan proprement pathologique, la maladie la plus importante de la quinoa est le mildiou provoqué par le champignon Peronospora farinosa. Il cause des dommages aux feuilles, provoquant une réduction de la photosynthèse et, par conséquent, une perte de rendement. Bonifacio (1997) rapporte que la maladie provoque le nanisme et la défoliation prématurée, lesquels se traduisent par des chutes de rendement allant de 10 à 30 %. Seuls des traitements chimiques préventifs sont connus mais restent peu appliqués du fait de leur coût élevé pour les producteurs andins. Ces traitements ne sont pas utilisés dans les zones de production biologique du sud de l'Altiplano, d'ailleurs très rarement affectées du fait de leur climat nettement plus aride.
81La récolte commence généralement vers la fin du mois d'avril et le travail peut s'étaler sur deux mois car la maturité des plantes au sein du terroir n'est pas uniforme. Les plantes à maturité sont coupées ou arrachées, mises en gerbes regroupées ou non par variété (selon la quantité, le temps et la main-d'œuvre disponibles) et laissées à sécher sur les parcelles pendant 30 à 45 jours. Le battage s'effectue de façon rudimentaire, soit mécaniquement (passage sous les roues de tracteurs ou de camions) soit de manière traditionnelle (fléaux ou animaux), dans les deux cas sur une bâche de toile ou de plastique pour éviter que les grains ne se dispersent sur le sol (Figure 6). Les rendements sont très variables et globalement faibles : en culture traditionnelle réussie, ils vont de 400 à 1.200 kg.ha-1.

3.6. Valeur alimentaire et sous-produits
82Les feuilles de quinoa sont mangées comme des épinards et les graines très abondantes et petites, comme chez le riz, sont consommées de différentes manières. La quinoa a un potentiel nutritif important. Elle se caractérise par une teneur élevée en protéines : 14 à 21 %, contre 7 à 12 % chez la plupart des céréales (blé, riz, maïs, orge, etc.) (Ayala et al., 2001 ; Bhargava et al., 2006). Cependant, son principal intérêt nutritif réside dans sa composition équilibrée et complète en aminoacides essentiels (la lysine fait généralement défaut dans les céréales), comparable à celle du lait et supérieure à celle du blé et d'autres céréales (Chauhan et al., 1992 ; Koziol, 1992 ; Ng et al., 2007). En outre, elle offre un contenu en minéraux très supérieur à celui des céréales classiques, en particulier en phosphore, magnésium, potassium et fer. Enfin, des études récentes indiquent que la quinoa est une excellente source de vitamines, d'antioxydants et d'acides gras (Dini et al., 2004 ; Ng et al., 2007). Il n'est donc pas surprenant que la FAO ait choisi la quinoa comme une des cultures destinées à garantir la sécurité alimentaire, particulièrement pour les habitants des Andes qui l'ont historiquement cultivée, et qu'aux USA, en Europe occidentale et au Japon, la quinoa soit commercialisée comme un aliment à haute valeur nutritive (Galwey, 1993).
83Les saponines, substances antinutritives qui sont présentes dans les grains et les jeunes feuilles, sont éliminées par lavage ou frottement (Chauhan et al., 1992). Après avoir fait l'objet d'une sélection négative par les améliorateurs (Jacobsen, 1997 ; Mastebroek et al., 2000 ; Ward, 2000), les saponines sont devenues un sous-produit recherché par l'industrie cosmétique et des perspectives existent aussi pour les utiliser comme pesticides naturels (San Martin et al., 2007).
4. Conclusion : agrobiodiversité, stratégies paysannes et amélioration génétique de la quinoa
84La quinoa est, avec la pomme de terre, la culture traditionnelle des hauts plateaux andins et toutes deux présentent une grande diversité tant à l'échelle régionale que locale. Malgré son intérêt alimentaire et commercial et son adaptation remarquable à des conditions de sol et de climat extrêmes, la quinoa reste peu étudiée, aussi bien sous ses aspects de fonctionnement agrophysiologique et agronomique, que de diversité biogéographique. Les pommes de terre andines ont suscité beaucoup plus d'intérêt de la part des chercheurs, probablement parce qu'elles représentent une source potentielle d'amélioration génétique pour une culture devenue commune dans les pays du Nord. Concernant le thème de l'agrobiodiversité andine, les travaux de Zimmerer (1991, 1996, 1998) sur la biogéographie des pommes de terre du Pérou sont certainement les plus importants à ce jour, en particulier parce qu'ils remettent en cause le principe d'adaptation étroite qui prévalait jusqu'ici pour expliquer la diversité considérable des variétés locales et des écotypes rencontrés au Pérou et dans les pays voisins. Cet auteur suggère que les variétés locales ne sont pas des formes spécialisées, étroitement adaptées à leur région d'origine mais au contraire des entités génétiquement ouvertes ayant de larges aptitudes écologiques. Selon Morlon (1992) et Vacher et al. (1998), la dispersion des risques et la complémentarité des ressources sont deux aspects de la stratégie de subsistance mise en œuvre dans les systèmes agricoles andins, stratégie qui se traduit par de fréquents mélanges de variétés ou d'associations de cultures au sein d'une même parcelle ou d'un même terroir.
85En Bolivie, si les exportations de quinoa s'élèvent à 5 millions de dollars annuels (FDTA, 2002), 78 % de la production nationale reste destinée à l'autoconsommation. L'activité de production de la quinoa concerne environ 50.000 petits producteurs vivant en majorité dans l'Altiplano sud, c'est-à-dire dans la région la plus déshéritée du pays, à des altitudes supérieures à 3.500 m, sur des sols marginaux et sous des conditions climatiques sévères. Il s'agit en général d'agriculteurs disposant de moyens de production très limités et qui, pour cette raison, font un usage stratégique des faibles ressources productives qu'ils possèdent : force de travail, terre et semences. Les semences de quinoa et la connaissance qu'en ont les producteurs sont vitales pour la survie des agriculteurs et de leurs familles. Des programmes de conservation et d'amélioration in situ commencent à se mettre en place en Bolivie avec l'appui d'ONG et d'associations de producteurs.
86Du point de vue des phytogénéticiens, la diversité des quinoas boliviennes forme un vaste pool de gènes dans lequel ils peuvent rechercher les caractéristiques adéquates pour développer de nouvelles semences de qualité, ainsi que pour garantir le processus de co-évolution de l'espèce dans son contexte socio-environnemental propre. Mais la diversité génétique de la quinoa est menacée par des processus aussi divers que l'accroissement du commerce international, l'émigration rurale, les transformations culturelles et l'introduction de technologies de production inadaptées. C'est pourquoi il est fondamental pour la Bolivie, pays qui partage avec le Pérou le centre d'origine de cette espèce et qui, probablement, en abrite encore la plus grande biodiversité connue, de connaître l'état de cette diversité dans le contexte des agro-écosystèmes et des communautés de producteurs qui l'ont développée et entretenue jusqu'à aujourd'hui.
87Remerciements
88Ce travail a bénéficié des appuis financiers du Département Soutien & Formation (DSF) et de l'Unité " Climat et Fonctionnement des Agro-écosystèmes " (UR 060) de l'IRD (France) et de l'Unité " Sol, Ecologie et Territoire " de la Faculté des Sciences agronomiques de Gembloux (Belgique). Les auteurs remercient Jean-Pierre Ratte (CNRS/CEFE, Montpellier) pour l'élaboration des figures.
Bibliographie
Alegria S., Espindola G. & Jacobsen S.E., 1999. Fertilización nitrogenada de la quinoa en dos épocas y dos espaciamientos de siembra en el Altiplano. In: Jacobsen S.E. & Mujica A., eds. Primer curso internacional sobre fisiología de la resistencia a sequía en quinua (Chenopodium quinoa Willd.). Lima: CIP-CGIAR (Centro Internacional de la Papa).
Ayala G., Ortega L. & Moron C., 2001. Quinua (Chenopodium quinoa Willd.): Valor nutritivo y usos de la quinua. In: Izquierdo Fernández J.I. et al., eds. Cultivos Andinos. [CD-ROM]. Santiago: FAO.
Bertero H.D., King R.W. & Hall A.J., 1999. Photoperiod-sensitive development phases in quinoa (Chenopodium quinoa Willd.). Field Crops Res., 60, 231-243.
Bhargava A., Shukla S. & Ohri D., 2006. Chenopodium quinoa: an Indian perspective. Ind. Crops Prod., 23, 73-87.
Bois J.F. et al., 2006. Response of some Andean cultivars of quinoa (Chenopodium quinoa Willd.) to temperature: effects on germination, phenology, growth and freezing. Eur. J. Agron., 25, 299-308.
Bonifacio A., 1997. Mejoramiento de la quinua para resistencia a factores adversos en Bolivia. In: Danial D., ed. Primer Taller de PREDUZA en resistencia duradera en cultivos altos en la zona andina. Quito: Proyecto de Resistencia Duradera en la Zona Andina (PREDUZA), 75-78.
Bonifacio A., 2001. Recursos genéticos, etnobotánica y distribución geográfica. In: Mujica A., Jacobsen S.E., Izquierdo J. & Marathee J.P., eds. Primer taller internacional sobre quinoa. 2001. Cultivos Andinos. [CD-ROM]. Santiago: FAO, UNA-Puno, CIP.
Bosque S.H., Lemeur R., Van Damme P. & Jacobsen S.E., 2003. Ecophysiological analysis of drought and salinity stress of quinoa (Chenopodium quinoa Willd.). Food Rev. Int., 19, 111-119.
Brack Egg A., 2003. Perú: diez mil años de domesticación. Lima: Editorial Bruño.
Bruno M.C., 2006. A morphological approach to documenting the domestication of Chenopodium in the Andes. In: Zeder M.A., Emshwiller E., Smith B.D. & Bradley D.G., eds. Documenting domestication: new archaeological and genetic paradigms. Berkeley, USA: University of California Press, 32-45.
Cabido M., Ateca N., Astegiano M. & Antón A., 1997. Distribution of C3 and C4 grasses along an altitudinal gradient in Central Argentina. J. Biogeogr., 24, 197-204.
Caceres E., 1993. Cultivos Andinos. Oruro, Bolivia: Impreso Felipe Moya.
Canahua A. & Rea J., 1979. Quinuas resistentes a heladas. In: Actas del II Congreso Internacional de Cultivos Andinos, junio 4-8, 1979. Riobamba, Ecuador: IICA, 14-35.
Catacora G.A., 1977. Determinación del cariotipo de 05 líneas de quinua (Chenopodium quinoa Willd.). Thesis: Universidad Nacional del Altiplano, Puno (Perú).
Chauhan G.S., Eskin N.A.M. & Tkachuk R., 1992. Nutrients and antinutrients in quinoa seed. Cereal Chem., 69, 85-88.
Cieza de Leon P., 1553. Crónica del Perú. Tomo 1. 2nd edition. Lima: Academia Nacional de Historia.
Dini I., Tenore G.C. & Dini A., 2004. Phenolic constituents of Kancolla seeds. Food Chem., 84, 163-168.
Dizès J. & Bonifacio A., 1992. Estudio en microscopia electrónica de la morfología de los órganos de la quinoa (Chenopodium quinoa Willd.) y de la cañihua (Chenopodium pallidicaule A.) en relación con la resistencia a la sequía. In: Morales D. & Vacher J.J., eds. Actas del VII Congreso Internacional sobre Cultivos Andinos. La Paz: IBTA/ORSTOM/CIID, 69-74.
Du Portal D., 1993. Études des gelées sur l'Altiplano bolivien. Thèse : ENSA, Montpellier (France).
Espindola G., 1986. Respuestas fisiológicas, morfológicas y agronómicas de la quinoa al déficit hídrico. Thesis: Colegio de Post-graduados, Universitad Chapingo (Mexico).
Espindola G., 1992. Proyecto de fortalecimiento y modernización. IBTA-BM. In: Informe Anual 1992. Programa quinoa. La Paz: Estación Experimental de Patacamaya, 37-42.
FAO (Food and Agriculture Organization), 1997. Digital soil map of the world and derived soil properties. [CD-ROM]. Roma: FAO.
FAO (Food and Agriculture Organization), 2008. Statistiques agricoles mondiales. Production des cultures, http://faostat.fao.org, (29/02/08).
FDTA (Fundación para el Desarrollo Tecnológico agropecuario del Altiplano), 2002. Prospección de demandas de la cadena productiva de la quinua en Bolivia. Oruro, Bolivia: Editorial FDTA.
Félix D., 2008. Culture durable du quinoa en Bolivie : pratiques individuelles et règles communautaires. Lyon, France : VSF-CICDA-Ruralter.
Figueroa H., Barriga P. & Rojas W., 2002. Multivariate analysis of genetic diversity of Bolivian quinoa germplasm. Not. Recursos Fitogenéticos, 122, 16-23.
François C., Bosseno R., Vacher J.J. & Seguin B., 1999. Frost risk mapping derived from satellite and surface data over the Bolivian Altiplano. Agric. Forest Meteorol., 95, 113-137.
Frère M., Rea J. & Rijks J.Q., 1978. Estudio agroclimatológico de la zona andina. Nota Técnica n°161. Proyecto Interinstitucional FAO/UNESCO/OMM. Roma: Organización Meteorológica Mundial (OMM).
Galwey N.W., 1993. The potential of quinoa as a multi-purpose crop for agricultural diversification: a review. Ind. Crops Prod., 1, 101-106.
Gandarillas H., 1968. Caracteres botánicos más importantes para la clasificación de la quinua. In: Universidad Nacional Técnica del Altiplano, ed. Anales de la Primera convención de Quenopodiáceas quinoa – cañahua. Puno, Perú: Universidad Nacional Técnica del Altiplano, 41-49.
Gandarillas H., 1979a. La quinua (Chenopodium quinoa Willd.): Botánica. In: Tapia M.E. et al., eds. La Quinua y la Kañiwa cultivos andinos. Bogota: CIID-IICA, 20-44.
Gandarillas H., 1979b. La quinua (Chenopodium quinoa Willd.): Genética y origen. In: Tapia M.E. et al., eds. La Quinua y la Kañiwa cultivos andinos. Bogota: CIID-IICA, 45-64.
Gandarillas H., 1982. El cultivo de la quinua. La Paz: Ministerio de Asuntos Campesinos y Agropecuarios, Instituto Boliviano de Tecnología Agropecuaria, Centro internacional de investigaciones para el desarrollo.
Gandarillas H., 1984. Obtención experimental de Chenopodium quinoa Willd. La Paz: Ministerio de Asuntos Campesinos y Agropecuarios, Instituto Boliviano de Tecnología Agropecuaria.
Garcia M., 2003. Agroclimatic study and drought resistance analysis of quinoa for an irrigation strategy in the Bolivian Altiplano. Thesis: Faculty of Agriculture and Applied Biological Sciences, K.U. Leuven (Belgium).
Garreaud R., Vuille M. & Clement A.C., 2003. The climate of the Altiplano: observed current conditions and mechanisms of past changes. Palaeogeogr. Palaeoclimatol. Palaeoecol., 194, 5-22.
Geerts S., 2004. Quinoa production in the Bolivian Altiplano: climatic constraints and modelling of water productivity. Thesis: Katholieke Universiteit Leuven (Belgium).
Geerts S. et al., 2006. Agro-climatic suitability mapping for crop production in the Bolivian Altiplano: A case study for quinoa. Agric. Forest Meteorol., 139, 399-412.
INE (Instituto Nacional de Estadística), 2002. Anuario Estadístico 2002. La Paz: Ministerio de Hacienda, Republica de Bolivia.
Izquierdo Fernández J.I. et al., 2001. Cultivos andinos, Version 1.0. [CD-ROM]. Santiago: FAO, http://www.rlc.fao/org/es/agricultura/pubs.html.
Jacobsen S.E., 1997. Adaptation of quinoa (Chenopodium quinoa) to Northern European agriculture: studies on developmental pattern. Euphytica, 96, 41-48.
Jacobsen S.E., 1998. Developmental stability of quinoa under European conditions. Ind. Crops Prod., 7, 169-174.
Jacobsen S.E. & Stølen O., 1993. Quinoa: morphology, phenology and prospects for its production as a new crop in Europe. Eur. J. Agron., 2, 19-29.
Jacobsen S.E. et al., 2005. Plant responses of quinoa (Chenopodium quinoa Willd.) to frost at various phenological stages. Eur. J. Agron., 22, 131-139.
Jacobsen S.E. et al., 2007. Frost resistance mechanisms in quinoa (Chenopodium quinoa Willd.). Eur. J. Agron., 26, 471-475.
Jensen C.R. et al., 2000. Leaf gas exchange and water relation characteristics of field quinoa (Chenopodium quinoa Willd.) during soil drying. Eur. J. Agron., 13, 11-25.
Koziol M.J., 1992. Chemical composition and nutritional evaluation of quinoa (Chenopodium quinoa Willd). J. Food Compos. Anal., 5, 35-68.
Kubien D.S. & Sage R.F., 2004. Low-temperature photosynthetic performance of a C4 grass and a co-occurring C3 grass native to high latitudes. Plant Cell Environ., 27, 907-916.
Laguna P., Cáceres Z. & Carimentrand A., 2006. Del altiplano sur boliviano hasta el mercado global: coordinación y estructuras de gobernancia en la cadena de valor de la quinua orgánica y del comercio justo. Agroalimentaria, 22, 65-76.
Le Tacon P., Vacher J.J., Eldin M. & Imaña E., 1992. Los riesgos de helada en el Altiplano boliviano. In: Morales D. & Vacher J.J., eds. Actas del VII congreso internacional sobre cultivos andinos, 4-8 Feb. 1992. La Paz: ORSTOM, 287-291.
Lhomme J.P. & Vacher J.J., 2002. Modelling nocturnal heat dynamics and frost mitigation in raised field systems of the Andean Altiplano. Agric. Forest Meteorol., 112, 179-193.
Mastebroek H.D., Limburg H., Gilles T. & Marvin H.J.P., 2000. Occurrence of sapogenins in leaves and seeds of quinoa (Chenopodium quinoa Willd). J. Sci. Food Agric., 80, 152-156.
Michel T., 1997. Zonificación agroclimática de los riesgos de sequía en el altiplano paceño utilizando modelos de simulación. La Paz: Facultad de Agronomía, UMSA.
Montes de Oca I., 1997. Geografía y recursos naturales de Bolivia. 3ra edición. La Paz: Edobol.
Morlon P., éd., 1992. Comprendre l'agriculture paysanne dans les Andes Centrales. Paris: INRA.
Mujica A., 1979. Practicas agronómicas. In: Tapia M.E. et al., eds. La Quinua y la Kañiwa cultivos andinos. Bogota: CIID-IICA, 91-92.
Mujica A. & Jacobsen S.E., 1999. Resistencia de la quinua a la sequía y otros factores abióticos adversos y su mejoramiento. In: I Curso Internacional sobre Fisiología de la Resistencia a Sequía en Quinua (Chenopodium quinoa Willd.). Lima: CIP-DANIDA, 25-38.
Mujica A., Jacobsen S.E., Izquierdo J. & Marathée J.P., eds, 2001. Quinua (Chenopodium quinoa Willd.): ancestral cultivo andino, alimento del presente y futuro. In: Izquierdo Fernández J.I. et al., eds. Cultivos Andinos. [CD-ROM]. Santiago: FAO.
National Research Council, 1989. Lost crops of the Incas: little-known plants of the Andes with promise for worldwide cultivation. Washington, DC, USA: National Academy Press, 149-161.
Ng S.C., Anderson A., Coker J. & Ondrus M., 2007. Characterization of lipid oxidation products in quinoa (Chenopodium quinoa). Food Chem., 101, 185-192.
Orlove B.S., Chiang J.C.H. & Cane M.A., 2000. Forecasting Andean rainfall and crop yield from the influence of El Niño on Pleiades visibility. Nature, 403, 8-71.
Orsag V., 1989. Determinación de las variaciones de almacenamiento de agua en un suelo Typic Palergid del Altiplano Central con ayuda de técnicas nucleares. Ecol. Bolivia, 13.
Orsag V., 1992. Perspectivas del manejo de suelos en el Altiplano central como alternativa para mejorar su régimen hídrico. In: Morales D. & Vacher J.J., eds. Actas del VII congreso internacional sobre cultivos andinos, 4-8 febrero 1992. La Paz: Orstom, 303-310.
Ortiz R., Castro A. & Danielsen S., 2001. Quinua (Chenopodium quinoa Willd.): plagas y enfermedades. In: Izquierdo Fernández J.I. et al., eds. Cultivos andinos. [CD-ROM]. Santiago: FAO.
Pinto M.V., 2002. Análisis de la variabilidad genética del germoplasma de quinua (Chenopodium quinoa Willd.) circundante al lago Titicaca. Thesis: Facultad de Agronomía, Universidad mayor de San Andrés, La Paz (Bolivia).
PNUD (Programa de las Naciones Unidas para el Desarrollo), 2004. Indice de desarrollo humano en los Municipios de Bolivia. Informe Nacional de Desarrollo Humano 2004. La Paz: Editorial Plural.
Prego I., Maldonado S. & Otegui M., 1998. Seed structure and localization of reserves in Chenopodium quinoa. Ann. Bot., 82, 481-488.
Rea J., 1969. Morfología de la quinua. In: Observaciones sobre la biología floral y estudios de saponinas en Chenopodium quinoa Willd. Serie Técnica n°3. La Paz: Ministerio de Agricultura, Departamento de Experimentación, 15-17.
Repo-Carrasco R., Espinoza C. & Jacobsen S.E., 1999. Valor nutricional y usos de la quinua (Chenopodium quinoa) y de la kañiwa (Chenopodium pallidicaule). In: Izquierdo Fernández J.I. et al., eds. Cultivos andinos. [CD-ROM]. Santiago: FAO.
Risi C. & Galwey N.W., 1989. The pattern of genetic diversity in the Andean grain crop quinoa (Chenopodium quinoa Willd.). I. Associations between characteristics. Euphytica, 41, 147-162.
Rojas W., 1998. Análisis de la diversidad genética del germoplasma de quinua (Chenopodium quinoa Willd.) de Bolivia, mediante métodos multivariados. Thesis: Escuela de Graduados, Universidad Austral de Chile, Valdivia (Chile).
San Martin R., Ndjoko K. & Hostettmann K., 2007. Novel molluscicide against Pomacea canaliculata based on quinoa (Chenopodium quinoa) saponins. Crop Prot., 27, 310-319.
Schlick G. & Bubenheim D.L., 1996. Quinoa: candidate crop for NASA's controlled ecological life support systems. In: Janick J., ed. Progress in New Crops. Alexandria, USA: ASHS Press, 632-640.
Tapia M.E., 2002. Cultivos andinos subexplotados y su aporte a la alimentación. In: Izquierdo Fernández J.I. et al., eds. Cultivos andinos. [CD-ROM]. Santiago: FAO.
Tapia M.E. et al., 1979. La quinua y la kañiwa: cultivos andinos. Serie Libros y Materiales Educativos 49. Bogota: IICA, CIID.
Vacher J.J., 1989. Los riesgos de la helada en el Altiplano boliviano. La Paz: ORSTOM - SENAMHI.
Vacher J.J., 1998. Reponses of two main Andean crops, quinoa (Chenopodium quinoa Willd.) and papa amarga (Solanum juzepczukii Buk.) to drought on the Bolivian Altiplano: significance of local adaptation. Agric. Ecosystems Environ., 68, 99-108.
Vacher J.J., Del Castillo C., Dizès J. & Bosseno R., 1998. Une pratique paysanne face aux risques de sécheresse sur l'Altiplano bolivien : l'utilisation d'une biodiversité de Solanum. In: Biarnes A., éd. La conduite du champ cultivé. Point de vue d'agronomes. Paris: ORSTOM, 55-74.
Vuille M., 1999. Atmospheric circulation over the Bolivian Altiplano during dry and wet periods and extreme phases of the southern oscillation. Int. J. Climatol., 19, 1579-1600.
Ward S.M., 2000. Response to selection for reduced grain saponin content in quinoa (Chenopodium quinoa Willd.). Field Crops Res., 68,157-163.
Wilson H.D., 1976. A biosystematic study of Chenopods and related species. Thesis: Indiana University (USA).
Wilson H.D., 1988a. Allozyme variation and morphological relationship of Chenopodium hircinum (s.l.). Syst. Bot., 13, 215-228.
Wilson H.D., 1988b. Quinua biosystematics. I: Domesticated populations. Econ. Bot., 42, 461-477.
Wilson H.D., 1988c. Quinua biosystematics. II: Free-living populations. Econ. Bot., 42, 478-494.
Wilson H.D., 1990. Quinua and relatives (Chenopodium sect. Chenopodium subsect. cellulata). Econ. Bot., 44, 92-110
Winkel T., Méthy M. & Thénot F., 2002. Radiation-use efficiency, chlorophyll fluorescence and reflectance indices, associated with ontogenic changes in water-limited Chenopodium quinoa leaves. Photosynthetica, 40, 227-232.
Zimmerer K.S., 1991. The regional biogeography of native potato cultivars in highland Peru. J. Biogeogr., 18, 165-178.
Zimmerer K.S., 1996. Changing fortunes: biodiversity and peasant livelihood in the Peruvian Andes. Berkeley, USA: University of California Press.
Zimmerer K.S., 1998. The ecogeography of Andean potatoes: versatility in farm regions and fields can aid sustainable development. Bioscience, 48, 445-454.

