Parasites gastro-intestinaux d'antilopes et de buffles (Syncerus caffer brachyceros) du ranch de gibier de Nazinga au Burkina Faso
Université polytechnique de Bobo-Dioulasso. Institut du Développement rural. 01 BP 3770. BF-Ouagadougou 01 (Burkina Faso). E-mail : belemamg@hotmail.fr
Université polytechnique de Bobo-Dioulasso. Institut du Développement rural. 01 BP 3770. BF-Ouagadougou 01 (Burkina Faso).
Reçu le 27 octobre 2008, accepté le 18 mai 2009
Résumé
Des enquêtes parasitologiques menées sur les tubes digestifs d'antilopes [hippotragues (Hippotragus equinus koba), bubales (Alcelaphus buselaphus major), cobes defassa (Kobus ellipsiprymnus defassa), ourébis (Ourebia ourebi quadriscopa)] et de buffles (Syncerus caffer brachyceros) du ranch de gibier de Nazinga au Burkina Faso ont permis d'identifier les parasites gastro-intestinaux, de calculer leur prévalence et d'évaluer leur charge parasitaire. Neuf espèces de nématodes et trois espèces de cestodes ont été retrouvées. Les femelles et les larves du genre Cooperia n'ont pas pu être identifiées jusqu'au niveau de l'espèce et ont été regroupées dans le genre Cooperia spp. Ainsi, pour les nématodes, les espèces suivantes ont été identifiées : Haemonchus contortus, Trichostrongylus axei, Cooperia curticei, Cooperia spatulata, Skrjabinema sp., Trichostrongylus colubriformis, Trichuris ovis, Bunostomum phlebotomum et Oesophagostomum sp. Les cestodes, quant à eux, étaient représentés par les espèces suivantes : Moniezia expansa, Avitellina centripunctata et Stilesia globipunctata. Nous avons noté également la présence de parasites dont la recherche n'a pas été faite systématiquement : Setaria labiato-papillosa dans la cavité abdominale et des paramphistomes dans le rumen. Malgré la présence de ces parasites sur les antilopes et les buffles examinés, ces derniers présentaient de bons rendements carcasses (47,5 à 54,7 %), attestant d'un bon état physique.
Abstract
Gastro-intestinal parasites of antelopes and buffalos (Syncerus caffer brachyceros) from the Nazinga game ranch in Burkina Faso. Parasitological survey done on the digestive tracts of antelopes [roans (Hippotragus equinus koba), hartebeests (Alcelaphus buselaphus major), defassa waterbucks (Kobus ellipsiprymnus defassa), oribis (Ourebia ourebi quadriscopa)] and buffalos (Syncerus caffer brachyceros) from the Nazinga game ranch in Burkina Faso allowed the identification of gastro-intestinal parasites and the estimation of their prevalence and load. Nine different nematode species and three cestode species were found. Females and larvae of Cooperia were not identified up to the species level and were recognized as Cooperia spp. The nematode species found were: Haemonchus contortus, Trichostrongylus axei, Cooperia curticei, Cooperia spatulata, Skrjabinema sp., Trichostrongylus colubriformis, Trichuris ovis, Bunostomum phlebotomum, and Oesophagostomum sp. Cestodes' species were: Moniezia expansa, Avitellina centripunctata, and Stilesia globipunctata. It was also noted without a thorough investigation the presence of Setaria labiato-papillosa in the abdominal cavity and paramphistomes in the rumen. In spite of the presence of parasites on the antelopes and buffalos, their killing out percentages (47.5 to 54.7%) indicated a good physical status.
1. Introduction
1La faune sauvage fait partie, selon Kidmo (1989), du patrimoine national au même titre que les forêts et les rivières. Chaque pays se doit donc de protéger sa faune. Elle est une ressource naturelle renouvelable et représente pour l'homme une source d'intérêts très diversifiés (alimentaire, économique, culturel, touristique, scientifique et médicinal). Dans de nombreuses régions du monde et particulièrement en Afrique, la chasse fournit une part importante de la quantité de viande consommée, si ce n'est pas la totalité dans certaines zones très reculées. Le Burkina Faso occupe une place particulière en Afrique de l'Ouest en matière de faune. Presque toutes les espèces classiques de la zone soudanienne y sont représentées. Ainsi, on dénombre 147 espèces de mammifères, 497 espèces d'oiseaux et de nombreuses espèces de reptiles (Chardonnet et al., 1995).
2L'organisation et l'aménagement des ranchs qui sont les principales préoccupations des autorités deviennent insuffisants de nos jours si les problèmes pathologiques des animaux qui y vivent ne sont pas toujours pris en compte. En effet, l'infestation des animaux sauvages par des helminthes, des protozoaires et des arthropodes peuvent être à l'origine de pertes économiques importantes sans compter les effets probables sur la santé humaine. C'est dans cette optique que nous nous sommes proposés d'apporter une contribution à la connaissance des pathologies des animaux sauvages au Burkina Faso.
3Avant d'étudier les effets pathologiques spécifiques du parasitisme gastro-intestinal sur la productivité des animaux sauvages, il a été jugé nécessaire de conduire cette étude pour identifier, au niveau des espèces animales vivant sur le ranch, ces espèces de parasites, connaitre leurs localisations dans le tractus digestif et si possible évaluer les prévalences et charges parasitaires associées.
2. Matériel et méthodes
2.1. Site et animaux d'étude
4L'étude a été menée dans le ranch de gibier de Nazinga, d'une superficie de 940 km2 et situé dans le centre-sud du Burkina Faso, à 200 km de Ouagadougou, la capitale. Son climat, selon Guinko (1984), est de type sud-soudanien avec une précipitation moyenne annuelle de 965 mm de pluie, entre mai et octobre, et des températures moyennes maximale et minimale de respectivement 34 °C et 22 °C.
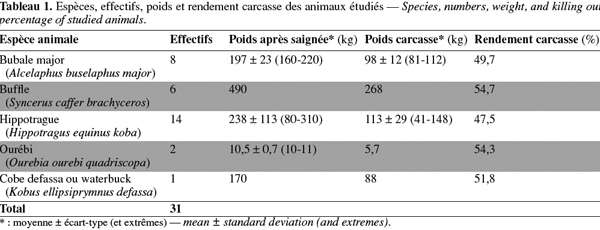
5Les animaux étudiés ont été abattus par des chasseurs entre 2000 et 2005 lors de six campagnes de chasse se déroulant au Burkina Faso entre décembre et mai. Les espèces et effectifs des animaux étudiés de même que leur poids à la saignée, leur poids carcasse et le calcul des rendements carcasses sont présentés dans le tableau 1.
2.2. Echantillonnage
6Les parasites identifiés et énumérés ont été récoltés à partir d'échantillons des contenus des différentes parties du tube digestif : la caillette, l'intestin grêle et le gros intestin. Six à douze heures après l'abattage par balle, les animaux ont été transportés à l'abattoir du ranch où se sont fait l'éviscération et l'isolement des différentes parties du tube digestif par sections entre des doubles ligatures réalisées à l'aide de fils solides de coton. Les graisses et les mésentères au niveau des viscères ont été dégarnis au maximum. La caillette a été ouverte longitudinalement et son contenu versé dans un seau en plastique gradué, conformément à la méthodologie déjà décrite par Belem et al. (2001). Dans le même seau gradué et sous un fin jet d'eau du robinet, la muqueuse de la caillette a été soigneusement rincée. L'ensemble des liquides diluant le contenu de la caillette dans le seau a été porté à 5 l, puis a été correctement homogénéisé avant que ne soit prélevé un aliquot de 500 ml (environ 10 % du volume total) dans une bouteille bien étiquetée. Du formol en quantité suffisante pour atteindre la concentration de 10 % a été ajouté dans chaque bouteille qui a été ainsi conservée à température ambiante jusqu'au moment de l'observation à la loupe binoculaire pour la récupération des parasites. Entre deux échantillons, tout le matériel utilisé a été soigneusement rincé à l'eau du robinet et au savon. L'intestin grêle et le gros intestin ont été traités séparément mais de la même manière que la caillette.
2.3. Récolte, identification et énumération des parasites
7Avant son utilisation pour la récolte des parasites au laboratoire, l'aliquot a été filtré à travers un tamis de 38 µm sous un jet d'eau du robinet pour concentrer le volume à examiner et diminuer la forte odeur de formol lors de l'utilisation de la loupe binoculaire. Versée en petites quantités dans une boite de Petri marquée par des grilles, l'aliquot a été entièrement observé sous la loupe binoculaire et tout élément parasitaire récupéré de nouveau dans du formol à 10 %. Ensuite, les larves et les adultes des parasites ont été transférés entre lames et lamelles dans quelques gouttes de lactophénol et gardés à l'abri de la poussière jusqu'à leur identification et énumération.
8L'identification des parasites a été faite à l'aide d'un microscope équipé d'un oculaire micrométrique et d'objectifs calibrés à l'aide d'un micromètre objet (Belem et al., 2001). Une ressource bibliographique abondante de clés de détermination et de description a été utilisée pour l'identification, dont entre autres les documents suivants : Euzeby 1961 ; 1963 ; 1966 ; Anonymous, 1974 ; Soulsby, 1982 ; Georgi et al., 1990.
3. Résultats
3.1. Espèces de parasites retrouvées sur les animaux étudiés
9Au total, neuf espèces de nématodes et trois espèces de cestodes ont été identifiées. Les femelles et les larves du genre Cooperia (Ransom, 1907) n'ont pas été identifiées jusqu'au niveau de l'espèce, par conséquent, elles ont été regroupées dans la catégorie Cooperia spp. Ainsi pour les nématodes, les espèces suivantes ont été retrouvées : Haemonchus contortus (Rudolphi, 1803), Trichostrongylus axei (Cobbold, 1879), Cooperia curticei (Raillet, 1893), Cooperia spatulata (Baylis, 1938), Skrjabinema sp. (Wereschajin, 1926), Trichostrongylus colubriformis (Giles, 1892), Trichuris ovis (Abildgaard, 1795), Bunostomum phlebotomum (Railliet, 1900) et Oesophagostomum sp. (Molin, 1861). Les cestodes identifiés étaient Moniezia expansa (Rudolphi, 1810), Avitellina centripunctata (Rivolta, 1874) et Stilesia globipunctata (Rivolta, 1874).
10Nous avons noté également la présence de parasites dont la recherche n'a pas été faite systématiquement : Setaria labiato-papillosa (Alissandrini, 1838) dans la cavité abdominale d'un buffle, de deux hippotragues et des deux ourébis et des paramphistomes dans le rumen d'un bubale, de deux hippotragues et du cobe defassa.
3.2. Prévalences et degrés d'infestation des parasites de la caillette par espèce animale
11Au vu des résultats présentés dans le tableau 2, il ressort que H. contortus et T. axei étaient les seules espèces de parasites trouvées dans les caillettes des animaux examinés du ranch de gibier de Nazinga. Des larves et des adultes d'H. contortus étaient présents, alors que les parasites T. axei n'étaient qu'au stade adulte et uniquement sur les bubales et les hippotragues. Au cours de la période d'étude, de janvier à mai, les bubales étaient infestés à 87,5 % d'H. contortus et à 12,5 % de T. axei. Les hippotragues étaient également infestés à 87,5 % d'H. contortus mais à 7,14 % de T. axei. Les buffles n'étaient infestés que d'H. contortus et cela à 50 %. Les deux ourébis examinés ne présentaient que des larves d'Haemonchus dans leur caillette. Le seul cobe defassa (waterbuck) examiné était également parasité par les Haemonchus.
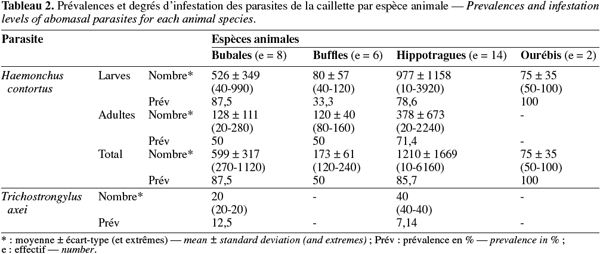
12En relation avec les charges parasitaires, les hippotragues ont eu les degrés d'infestation par Haemonchus les plus élevés (1 210 ± 1 669), suivis des bubales (599 ± 317), du cobe defassa (le seul examiné a hébergé 400 parasites), des buffles (173 ± 61) et enfin des ourébis (75 ± 35). T. axei, qui n'a été retrouvé que dans les caillettes des hippotragues et des bubales, a présenté un faible degré d'infestation. A l'exception des buffles et du cobe defassa, les larves d'Haemonchus étaient toujours plus nombreuses que leurs adultes sur les autres espèces animales examinées.
3.3. Prévalences et degrés d'infestation des parasites de l'intestin grêle par espèce animale
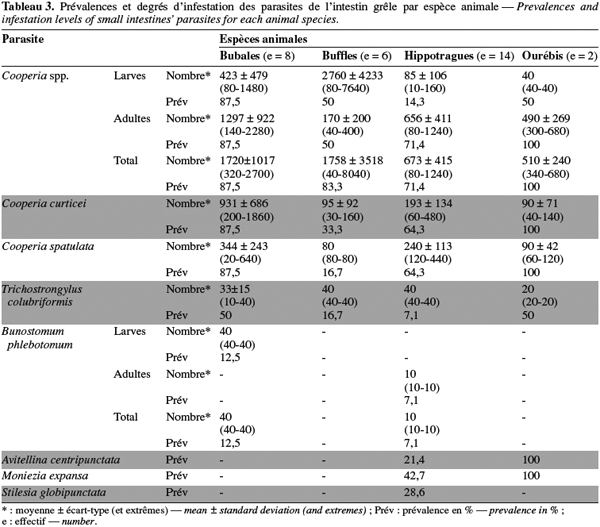
13Le tableau 3 montre les prévalences et les degrés d'infestation des parasites récoltés dans l'intestin grêle des antilopes et des buffles. Les hippotragues puis les ourébis ont eu les plus grandes diversités parasitaires, suivis par ordre décroissant des bubales, des buffles et du cobe defassa. Au niveau des hippotragues, les espèces suivantes de parasites ont été retrouvées : Cooperia spp. (larves : 14,3 %, adultes : 71,4 % et total : 71,4 %), C. curticei mâles (64,3 %), C. spatulata mâles (64,3 %), T. colubriformis (7,1 %), B. phlebotomum (uniquement des adultes : 7,1 %), A. centripunctata (21,4 %), M. expansa (42,7 %) et S. globipunctata (28,6 %). Chez les ourébis, les mêmes espèces de parasites ont été récoltées à l'exception de B. phlebotomum et S. globipunctata qui étaient absents. Les bubales ont présenté les espèces de parasites suivantes : Cooperia spp. (87,5 %), C. curticei mâles (87,5 %), C. spatulata mâles (87,5 %), T. colubriformis (50 %) et B. phlebotomum (uniquement des larves : 12,5 %). Les buffles, quant à eux, étaient infestés au niveau de l'intestin grêle par Cooperia spp. (83,3 %), C. curticei mâles (33,3 %), C. spatulata mâles (16,7 %) et T. colubriformis (16,7 %). Aucun cestode n'a été retrouvé chez les bubales, les buffles et le cobe defassa, aucun Bunostomum chez les ourébis et aucun T. colubriformis chez le cobe defassa. Le cobe defassa n'avait que des Cooperia spp., C. curticei et C. spatulata dans son intestin grêle.
14Eu égard à la charge des espèces de parasites dans l'intestin grêle des antilopes et buffles examinés, pour les adultes Cooperia, les bubales (1 297 ± 922) suivis des hippotragues (656 ± 411) ont eu les degrés d'infestation les plus élevés. Pour les larves Cooperia par contre, les buffles ont présenté le degré d'infestation le plus élevé (2 760 ± 4 233). Sur l'ensemble des antilopes, les ourébis sont les moins infestés par le genre Cooperia avec un degré moyen d'infestation de 510 ± 240 parasites par animal. Les Trichostrongylus, par contre, étaient présents en petit nombre sur tous les animaux examinés, sauf chez le cobe defassa qui n'en avait pas.
3.4. Prévalences et degrés d'infestation des parasites du gros intestin par espèce animale
15Les gros intestins des hippotragues étaient les seuls à héberger deux types différents de parasites : Skrjabinema sp. (larves : 7,1 % ; adultes : 35,7 % et total : 35,7 %) et T. ovis (uniquement adultes : 35,7 %). Les bubales n'ont eu que des Skrjabinema sp. (larves : 37,5 % ; adultes : 37,5 % et total : 50 %) ; les buffles que des larves d'Oesophagostomum sp. (33 %) et les ourébis que des adultes de Skrjabinema sp. (50 %) (Tableau 4). Le cobe defassa examiné n'a eu aucun parasite dans le gros intestin.
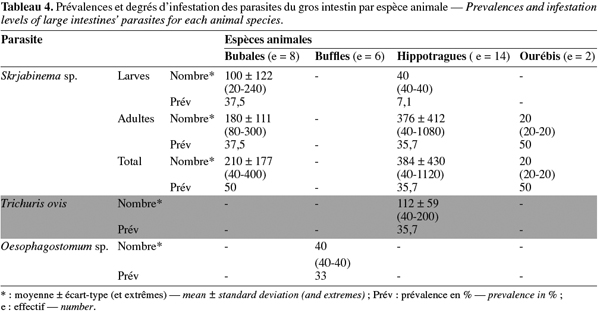
16Sur les hippotragues, les degrés moyens les plus élevés ont été observés pour Skrjabinema (384 ± 430) ; de plus, ils étaient les seuls à être infestés par Trichuris à un degré moyen de 112 ± 59. Les bubales ont présenté pour leur seul parasite, Skrjabinema sp., un degré moyen d'infestation de 210 ± 177. De même, un seul ourébi sur les deux examinés n'a hébergé dans son gros intestin que 20 parasites du genre Skrjabinema sp. Les larves d'Oesophagostomum sp. n'ont été retrouvées que sur les buffles à la quantité de 40 parasites en moyenne par animal.
4. Discussion
17Il est important de noter que la procédure de collecte des parasites, impliquant l'utilisation de tamis de 38 µm pour les ouvertures des mèches et d'une loupe binoculaire, a permis une récupération totale de tous les helminthes présents au niveau des contenus des parties du tube digestif analysées. Toutefois, les parasites des trois premières poches de l'estomac chez les ruminants (réseau, rumen et feuillet), de même que ceux de la cavité péritonéale, n'ont fait l'objet que d'une évaluation qualitative par des observations in situ. Lors de cette étude, nous avons récolté dans les différentes parties du tube digestif des antilopes et des buffles, douze espèces de parasites parmi lesquelles on comptait neuf nématodes et trois cestodes, ce qui atteste d'une grande diversité au niveau de la faune parasitaire de ces animaux du ranch de gibier de Nazinga. Les annexes des tubes digestifs, tels que le foie et les mésentères, n'ont pas fait l'objet d'examen parasitologique. Malgré la présence de ces parasites sur les antilopes et les buffles, le rendement carcasse des animaux examinés (Tableau 1) attestait d'une manière générale d'un bon état physique des animaux comme Mattioli et al. (1998) l'ont déjà trouvé en 1998 sur les animaux du même ranch.
18Des études similaires réalisées sur les antilopes et les buffles dans d'autres régions de l'Afrique, particulièrement en Afrique centrale et en Afrique du Sud, ont révélé également la présence de la majorité des parasites retrouvés dans la présente étude. En effet, des auteurs tels que Graber et al. (1964 ; 1979) ont signalé la présence en Afrique centrale (Tchad, Cameroun, République Centrafricaine) de M. expansa chez le buffle ; A. centripunctata chez le bubale, le buffle et l'hippotrague ; S. globipunctata chez l'ourébi, le cobe defassa (waterbuck) et l'hippotrague. Selon ces auteurs, en Afrique centrale, le téniasis intestinal des herbivores sauvages touche en moyenne 20 % des animaux. Ils ont trouvé plus précisément des prévalences de 21 % au Tchad et de 16,16 % en République centrafricaine. Ces auteurs ont aussi signalé que le téniasis intestinal touchait faiblement les bubales. D'une manière similaire, notre étude a révélé que les hippotragues ont des prévalences de 21,4 % pour Avitellina , 28,6 % pour Stilesia et 42,7 % pour Moniezia. Les buffles et les bubales avaient des prévalences nulles pour les cestodes. Pareillement, les mêmes auteurs ont signalé également la présence de Haemonchus sp. dans la caillette du buffle et du cobe defassa, de Bunostomum dentatum dans l'intestin grêle du cobe defassa et de l'hippotrague. Boomker et al. (1984) ont retrouvé chez l'ourébi en Afrique du Sud T. colubriformis et Cooperia yoshidai (Mönnig, 1939). Les mêmes types de parasites ont été retrouvés sur les mêmes hôtes dans la présente étude.
19D'une manière globale, il peut être retenu que, dans le ranch de gibier de Nazinga, l'infestation des antilopes et des buffles par les parasites gastro-intestinaux était la règle. Les animaux étudiés ont même surtout présenté des associations parasitaires. Malheureusement dans notre étude, le nombre limité de mois examinés (janvier à mai), de même que les faibles effectifs d'animaux abattus, n'ont pas permis d'évaluer complètement les variations saisonnières des prévalences autant que des degrés d'infestation parasitaires. Toutefois, les degrés d'infestation, de même que les prévalences parasitaires calculés dans cette étude, étaient assez importants et suggéreraient que des études soient poursuivies pour évaluer l'impact pathologique de ces parasites sur la productivité de ces animaux sauvages. Par ailleurs, si des luttes antiparasitaires devaient être envisagées contre les helminthes des animaux sauvages du ranch, l'étude a montré clairement la nécessité d'avoir recours à des produits à large spectre, compte tenu des polyinfestations constatées.
20Remerciements
21Les auteurs du présent travail remercient très sincèrement la Fondation Internationale pour la Science (FIS) pour son assistance financière à travers la bourse n°B/2358-3, sans laquelle ce travail n’aurait pas été réalisé.
Bibliographie
Anonymous, 1974. CIH keys to the nematode parasites of vertebrates. n°1 à 10. St Albans, England: Commonwealth Agricultural Bureaux (CAB).
Belem A.M.G., Ouédraogo O.P. & Bessin R., 2001. Gastro-intestinal nematodes and cestodes of cattle in Burkina Faso. Biotechnol. Agron. Soc. Environ., 5(1), 17-21.
Boomker J., Keep M.E., Flamand J.R. & Horak I.G., 1984. The Helminths of various antelope species from Natal. Onderstepoort J. Vet. Res., 51, 253-256.
Chardonnet P. et al., 1995. Faune sauvage africaine : la ressource oubliée. I : Synthèse. II : Monographies. Bruxelles ; Luxembourg : Office des publications officielles des communautés.
Euzeby J., 1961. Les maladies vermineuses des animaux domestiques et leurs incidences sur la pathologie humaine. I : Maladies dues aux Némathelminthes. Fascicule 1. Paris : Vigot Frères.
Euzeby J., 1963. Les maladies vermineuses des animaux domestiques et leurs incidences sur la pathologie humaine. I : Maladies dues aux Némathelminthes. Fascicule 2. Paris : Vigot Frères.
Euzeby J., 1966. Les maladies vermineuses des animaux domestiques et leurs incidences sur la pathologie humaine. II : Maladies dues aux Plathelminthes. Fascicule 1 : Cestodes. Paris : Vigot Frères.
Georgi J.R. & Georgi M.E., 1990. Parasitology for veterinarians. 5th ed. Philadelphia, PA, USA: W.B. Saunders Company.
Graber M. et al., 1964. Les Helminthes de quelques Artiodactyles sauvages appartenant aux familles des Bovidés et Suidés. Ces mammifères en République du Tchad et en R.C.A. sont-ils des réservoirs de parasites pour les animaux domestiques vivant à leur contact ? Rev. Elev. Méd. Vét. Pays Trop., 17(3), 377-420.
Graber M. & Thal J., 1979. Anoplocéphalides parasites de l'intestin et des canaux biliaires des herbivores sauvages d'Afrique Centrale. Rev. Elev. Méd. Vét. Pays Trop., 32(4), 371-378.
Guinko S., 1984. Végétation de la Haute-Volta. I. Thèse de doctorat es sciences : Université de Bordeaux III (France).
Kidmo M., 1989. Contribution à l'étude du Parc National Waza (Cameroun). Evolution récente et perspectives d'avenir. Thèse de doctorat en médecine vétérinaire : Université de Dakar (Sénégal).
Mattioli R.C., Belem A.M.G., Ki-Zerbo A. & Thiry E.E., 1998. Liveweight and killing out percentage of some wild animal species of the Nazinga Game Ranch (Burkina Faso) infested by tse-tse flies. Trop. Anim. Health Prod., 30, 137-140.
Soulsby E.J.L., 1982. Helminths, arthropods and protozoa of domesticated animals. London: Baillière and Tindall.

