- Startpagina tijdschrift
- Volume 15 (2011)
- numéro 3
- Exclusion du chlorure et inclusion du sodium : deux mécanismes concomitants de tolérance à la salinité chez la vigne sauvage Vitis vinifera subsp. sylvestris (var. 'Séjnène')
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Exclusion du chlorure et inclusion du sodium : deux mécanismes concomitants de tolérance à la salinité chez la vigne sauvage Vitis vinifera subsp. sylvestris (var. 'Séjnène')

Nota's van de redactie
Reçu le 8 juin 2010, accepté le 16 novembre 2010
Résumé
Afin de sélectionner et d'identifier des génotypes de vigne tolérant la salinité, nous avons analysé et évalué, en guise de prospection préliminaire, le comportement d'un écotype sauvage 'Séjnène' vis-à-vis d'une contrainte saline. À cet effet, des plants homogènes, obtenus par bouturage, sont cultivés en pots remplis de sable inerte et irrigués avec une solution nutritive additionnée de 100 mM NaCl. Les cultures sont conduites en serre vitrée contrôlée. Au terme de 75 jours de traitement, les mesures ont porté sur les paramètres physiologiques liés à la croissance et le contenu des différents organes en éléments minéraux (Na+, Cl-, K+, Mg2+ et Ca2+). Les résultats obtenus montrent que chez 'Séjnène', la tolérance à la salinité est étroitement liée à sa vigueur et que les mécanismes physiologiques de tolérance reposent sur son aptitude à maintenir l'activité photosynthétique malgré le stress et sa capacité d'accumulation et de stockage du sodium au niveau de la partie aérienne (particulièrement au niveau des feuilles âgées). L'exclusion des chlorures, tout en restreignant leur accumulation, l'ajustement osmotique, via l'accumulation foliaire de potassium, ainsi que la signalisation du stress et la protection des composés cellulaires à travers le calcium foliaire, sont des mécanismes de tolérance additionnels.
Abstract
Chloride exclusion and sodium inclusion: two concomitant mechanisms of salt tolerance in Vitis vinifera subsp. sylvestris (var. 'Séjnène') wild type grapevine. In order to select and identify grapevine genotypes tolerant to salinity, we analyzed and evaluated, in a preliminary attempt, the behavior of 'Séjnène' wildtype against salt constraint. In this respect, homogen plants obtained from cutting were cultivated in pots filled with sandy soil and irrigated with nutritive solution added with 100 mM NaCl. Cultures were conducted under controlled greenhouse. After 75 days of treatment, measures were realized on the physiological parameters related to plant growth and mineral content (Na+, Cl-, K+, Mg2+ and Ca2+) of the different organs. Our results showed that for 'Séjnène', salinity tolerance is tightly related to its vigor, and the physiological mechanisms of salt tolerance are based on its ability to maintain the photosynthetic activity despite of the stress and its capacity to accumulate and store the sodium in the upper part of the plant (especially in the old basal leaves). Chloride exclusion with restriction to its entry and uptake, osmotic adjustment via leaf potassium accumulation, salt stress signalization and cellular protection of components through leaf calcium accumulation represent additional mechanisms of salt tolerance.
Inhoudstafel
1. Introduction
1La plupart des porte-greffes utilisés actuellement dans les vignobles tunisiens sont issus de croisements interspécifiques entre un petit nombre d'espèces du genre Vitis. Ils ont été, à une très grande majorité, sélectionnés et introduits par les colons français à la fin du 19e siècle pour répondre au problème du phylloxéra (Ollat et al., 2003) et en raison de leur bonne vigueur, sans trop accorder d'importance à leur efficacité vis-à-vis des conditions pédoclimatiques et contraintes environnementales locales, en particulier la salinité. Or, il s'est avéré que beaucoup d'entre eux sont sensibles à la salinité, particulièrement le 41B, le SO4 et le 1103P (Hamrouni et al., 2008). A priori, le porte-greffe 41B (V. vinifera x V. berlandieri) est très déconseillé dans les zones où le sol présente une forte salinité. Par contre, le porte-greffe 1103 Paulsen (V. berlandieri x V. rupestris) est utilisé dans les sols salés. Il est connu pour sa grande vigueur et son bon comportement dans les sols argilo-calcaires à sous-sols frais et humide. En effet, le 1103P possède une bonne résistance au calcaire actif (35 % de calcaire actif), mais il est également résistant aux nématodes endoparasites (Gokbayrak et al., 2007). Enfin, le porte-greffe SO4 (V. berlandieri x V. riparia) est conseillé pour les sols présentant une salinité moyenne (0,4 ‰ de sel dans le sol), bien qu'affichant une faible tolérance au calcaire (17 à 18 % de calcaire actif) et résiste bien aux nématodes endoparasites Meloidogyne arenaria et M. incognita (Champagnol, 1984 ; Carbonneau, 1985). Il semble que lors de leur introduction dans les vignobles, le comportement et les aptitudes des porte-greffes face aux contraintes abiotiques du milieu, particulièrement la salinité, n'ont fait l'objet d'aucune considération et demeurent le plus souvent des caractéristiques vagues ou inconnues. Ils s'avèrent donc inefficaces dans ce genre de situation et contrainte. Malheureusement, force est de constater qu'au niveau des principales régions viticoles, la salinité des sols et des eaux d'irrigation s'accroît de façon frénétique et inquiétante (Ennabli, 1995 ; Hachicha, 2007). En effet, en Tunisie, les sols affectés par la salinité couvrent 1,5 million ha, soit environ 10 % de la surface totale du pays, ce qui est énorme ; d'autant plus que l'aridité du climat, les pratiques culturales mal adaptées et la mauvaise qualité des eaux d'irrigation amplifient et s'ajoutent à ce phénomène de salinisation. L'approche biologique, qui repose principalement sur l'exploration de la variabilité de la réponse au sel des espèces, permettrait d'identifier des plantes tolérantes au stress salin et contribuerait, par conséquent, à l'amélioration de la productivité ainsi qu'à une meilleure valorisation des zones salinisées. La présente étude s'inscrit dans le cadre de recherche et de sélection de porte-greffes tolérant la salinité, notamment par prospection dans le compartiment de la vigne sauvage. En effet, les vignes sauvages, prospérant dans des conditions environnementales généralement rustiques, pourraient constituer des génotypes intéressants en contenant un réservoir de caractères susceptibles de fournir un phénotype de tolérance et d'adaptation à la salinité. Nous avons par conséquent procédé à l'évaluation du comportement et du degré de tolérance d'un écotype sauvage de vigne (Vitis sylvestris) (Pottier-Alapetite, 1979) provenant de la région de Séjnène vis-à-vis de la salinité. Notre approche vise à analyser sa valeur et son comportement intrinsèque face à la salinité, en ce sens qu'il sera étudié de manière isolée, en dehors de son interaction avec les greffons ou scions. L'essai expérimental sous serre a été effectué afin de nous rapprocher au maximum des conditions réelles de plein champ, mais également car il existe actuellement de plus en plus de viticulteurs qui plantent leur vigne sous serre. Par ailleurs, le travail dans une serre permet de contrôler les différents facteurs environnementaux (température, lumière, humidité, etc.) et de faire varier un seul facteur (en l'occurrence, la salinité) pour pouvoir analyser son réel impact sur le développement des cultures.
2. Matériel et méthodes
2.1. Conduite des cultures
2Provenance et préparation du matériel végétal. Des rameaux lignifiés aux bourgeons dormants ont été prélevés sur des ceps de vigne (Vitis vinifera subsp. sylvestris) (Pottier-Alapetite, 1979) en dormance (novembre-décembre), issus de la région du nord-ouest tunisien, Séjnène. Ensuite, ceux-ci sont débités en fragments ligneux portant deux bourgeons. Après éborgnage, les boutures sont trempées à leur base dans de l'exubérone (AIB commercial) afin de favoriser la rhizogenèse, paraffinées et repiquées dans des cagettes remplies de sable qui sont ensuite mises dans une chambre climatique (température 28 °C ; photopériode 16 h et humidité relative 80 %). Au bout de deux semaines, les boutures commencent à débourrer et à développer leur système racinaire. Après enracinement des boutures, les jeunes plants ont été repiqués individuellement dans des pots en plastique de 2 l contenant du sable inerte, lavé avec de l'acide sulfurique concentré et rincé plusieurs fois avec de l'eau distillée. Après une période d'acclimatation de deux semaines, les boutures enracinées sont irriguées avec une solution nutritive enrichie en NaCl (100 mM). Le sel est apporté progressivement dans le milieu nutritif à raison de 25 mM NaCl tous les 15 jours. L'essai sous serre a duré 75 jours (Figure 1). Les cultures sont conduites dans une serre vitrée sous éclairage naturel, mais avec un éclairement d'appoint. La température moyenne et l'humidité relative sont respectivement de 25 ± 2 °C et 70 ± 5 % et la photopériode est de 16 h.
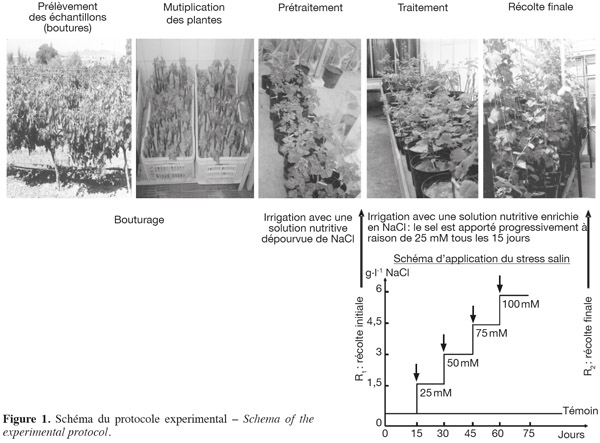
3Suivi phytosanitaire. La vigne étant sensible à de nombreux agents pathogènes, nous avons établi par conséquent un calendrier de traitement phytosanitaire tout au long de l'essai afin d'éviter le problème de confusion des symptômes des maladies cryptogamiques et ceux dus au traitement salin. Les produits de traitement sont choisis de telle sorte qu'ils ne portent pas de résidus de sels minéraux qui peuvent influencer l'analyse minérale par la suite.
2.2. Traitement salin
4Les irrigations sont réalisées tous les deux jours avec une solution nutritive dont la composition en macroéléments est faite selon la formule de Long Ashton (Hewitt, 1952) additionnée de NaCl (100 mM). La solution nutritive contient également du fer apporté sous forme de complexe EDTA-K-Fe préparé d'après la formule de Jacobson (1951). Les oligo-éléments ajoutés à la solution nutritive sont ceux proposés par Arnon & Hoagland (1940). Deux semaines après le repiquage des boutures enracinées, le traitement salin est appliqué progressivement en ajoutant 25 mM NaCl tous les 15 jours jusqu'à atteindre 100 mM. Les volumes de solution nutritive apportés sont calculés à 70 % de la capacité au champ et sont suffisants pour provoquer un léger drainage et lessivage.
2.3. Paramètres analysés
5Suivi des cultures. L'aspect morphologique des plantes a fait l'objet d'observations régulières depuis le début de la culture jusqu'à la récolte finale. Il a été en particulier tenu compte de la formation de nouveaux organes et de l'apparition des symptômes de toxicité. L'objectif étant de repérer l'impact du sel sur l'état des organes photosynthétiques et de noter les modifications qui seraient impliquées dans la tolérance au sel.
6Mesure de la production de biomasse. Deux récoltes sont réalisées : la première a pour objectif de caractériser l'état des plantes au début des traitements, c'est la récolte de départ. La seconde a lieu à la fin des traitements, après 2 mois de culture. À la récolte, les plantes sont séparées en parties aériennes (feuilles et tiges) et en racines. Les racines sont rincées dans trois bains successifs d'eau glacée puis épongées et séchées avec du papier filtre. Les différents organes sont rapidement mis dans des sachets en papier aluminium préalablement tarés puis pesés avant et après dessiccation à 60 °C pendant 48 h pour en déterminer les masses en matières fraiche et sèche.
7Évaluation de la surface foliaire et nombre de feuilles. Vu le nombre élevé des feuilles de toute la plante, la surface foliaire est déterminée uniquement pour quatre feuilles prélevées de façon aléatoire à chaque niveau de la plante (basal, médian et apical), à l'aide d'un planimètre (Area Meter, type LI-3000A, LI-COR).
8Détermination de la teneur en chlorophylle. La détermination de la quantité de chlorophylle est réalisée sur des feuilles fraiches prélevées sur les plants à la récolte finale.
9Détermination de la teneur en eau. La teneur en eau (%) est déterminée par la différence entre la matière fraiche (MF) et la matière sèche (MS), par rapport à la MF.
10Détermination de la nutrition minérale. Afin d'analyser le comportement de transport et de stockage des ions au niveau de la plante, nous avons déterminé les concentrations des ions minéraux (sodium, chlore, potassium, calcium et magnésium) au niveau des différents organes (racine, tige et feuille).
2.4. Méthodes d'analyse
11Croissance moyenne relative. La quantité de matière sèche produite au cours d'un traitement donné dépend de la taille initiale des plantes et de leur activité de croissance au cours de cette période. La croissance moyenne relative est la production de matière sèche par unité de temps et par unité de biomasse. Elle est exprimée en J-1 et calculée selon la formule suivante (Hunt, 1990) :
12CMR = (LnMSf – LnMSi)
13(∆t)
14avec Ln : logarithme népérien ; MSf : masse de matière sèche (de la plante entière ou de l'organe) à la récolte finale, exprimée en mg ; MSi : masse de matière sèche (de la plante entière ou de l'organe) à la récolte initiale, exprimée en mg ; ∆t : durée du traitement en jours.
15Indice de sensibilité. Il est obtenu en ramenant l'écart entre la production de matière sèche des plantes cultivées en présence de NaCl et celle des plantes témoins par rapport à ces dernières, selon la formule suivante (Slama, 1982) :
16IS = 100 x (∆MSNaCl - ∆MStémoin)
17 ∆MStémoin
18avec ∆MSNaCl : variation de la production de la matière sèche sur milieu salé ; ∆MStémoin : variation de la production de la matière sèche sur milieu témoin.
19Détermination de la quantité de chlorophylle. Les échantillons utilisés sont des feuilles fraiches prélevées sur les différents génotypes testés à la récolte finale. Les feuilles sont fixées dans l'azote liquide puis imbibées avec de l'acétone (100 %) refroidi et l'ensemble est mixé par le biais d'un polytron jusqu'à l'obtention d'un résidu très fin permettant ainsi l'extraction des pigments chlorophylliens, solubles dans les solvants organiques tels que l'acétone (Dali et al., 1992). Une première centrifugation de 3 000 tours.min-1 est entreprise pendant 10 min. Une fois terminée, le surnageant est récupéré dans un Erlenmeyer et stocké dans le congélateur. Quant au culot, on lui ajoute de l'acétone (80 %) refroidi pour être mixé de nouveau puis centrifugé une deuxième fois dans les mêmes conditions que précédemment. Le surnageant ainsi obtenu est mélangé avec le premier afin de déterminer le volume d'acétone ayant servi pour l'extraction. Pour la détermination de la teneur en chlorophylle, 1 ml du surnageant est ajouté à 9 ml d'acétone à 80 %. Le mélange est introduit dans le spectrophotomètre pour être observé à une longueur d'onde égale à 652 nm (Arnon, 1941 ; Bruinsma, 1961). Le zéro du spectrophotomètre est ajusté par une solution d'acétone à 80 %. L'évaluation de la teneur en chlorophylle se fait selon la formule suivante :
20Teneur en chlorophylle totale (mg.g-1) = vol. d'acétone (ml) x valeur de la lecture x 10
21poids de l'extrait sec (g)
22Analyse minérale
23Extraction des ions. Après dessiccation, les échantillons (feuilles, tiges et racines) sont réduits en poudre fine au moyen d'un broyeur à billes (type Dangoumeau). Le broyage assure une homogénéité des échantillons qui feront l'objet des différentes analyses. Des quantités connues de poudre végétale préalablement desséchée à l'étuve sont mises dans les piluliers en présence d'un volume connu d'acide nitrique 0,5 %. Le rapport matière sèche / volume est de 20 mg de MS pour 50 ml d'acide. Les piluliers hermétiquement fermés pour éviter la concentration des extraits par évaporation sont agités périodiquement 4 à 5 fois par jour. Les extraits sont ensuite filtrés sur papier filtre sans cendre et donc prêts pour le dosage des éléments minéraux.
24Dosage des cations. Les cations K+, Ca2+, Na+ et Mg2+ sont dosés par absorption atomique (Perkin Elmer Atomic absorption spectrometer 3110).
25Dosage du chlorure. Le Cl- est dosé sur les mêmes extraits nitriques, en présence d'un tampon acétique (acide acétique 10 %, acide nitrique 0,1N) et de gélatine, à l'aide d'un chloridomètre digital (type Haake Büchler) selon le principe de titration colorimétrique avec détection de fin de réaction potentiométrique. Des aliquots de 10 µl d'une solution étalon à 100 meq.l-1 sont utilisés pour l'étalonnage de l'appareil. À 0,5 ml de chaque extrait de l'échantillon, on ajoute 2,5 ml d'acide nitrique 0,1N, 1 ml de tampon acétique et 4 gouttes de la solution de gélatine. La lecture est faite par rapport à une dizaine de témoins où le filtrat est remplacé par de l'eau distillée. Les lectures sont données en meq Cl-.ml-1.
26Sélectivité K+/Na+. Les plantes absorbent puis transportent dans leurs parties aériennes une certaine quantité de potassium indispensable à la croissance. Étant donné l'excès de sodium par rapport au potassium dans le milieu, les plantes doivent maintenir une sélectivité K+/Na+ au niveau de leur système d'absorption, de transport et d'accumulation. La sélectivité est alors définie par Abdelly (1997) :
27SK+/Na+ = S1 / S2
28S1 = ∆QK / (∆QK + ∆QNa)
29S2 = [K+] / ([K+] + [Na+])
30avec ∆Q : quantité de l'élément accumulée dans la partie de la plante au cours de la période du traitement exprimée en meq ; [---] : concentration de l'élément dans le milieu de culture exprimée en meq.ml-1.
2.5. Analyses statistiques
31Le programme « Statistical Analysis System » (SAS, 1988) a été utilisé pour réaliser toutes les analyses de la variance, la comparaison des moyennes entre l'échantillon témoin et l'échantillon traité pour chaque paramètre analysé.
3. Résultats
3.1. Croissance
32Chez la vigne, la vigueur est le signe d'une intensité de métabolisme et s'exprime par une vitesse de croissance élevée des rameaux (en longueur et en diamètre) et par une fertilité accrue des bourgeons, ce qui se traduit par une allocation élevée d'assimilats à la partie aérienne (Ollat et al., 2003). Selon Champagnol (1984), l'expression végétative peut être évaluée par la quantité totale de matière sèche accumulée dans les parties végétatives de la plante (racines, tronc, rameaux, feuilles) et la vigueur est définie comme cette quantité divisée par le nombre de rameaux (poids moyen des sarments). Nous considérons dans nos travaux que la vigueur d'un plant de vigne est définie, de manière simplifiée, par sa production de matière sèche. Or, la masse de matière sèche totale produite dans les conditions témoins est de 36 g et la partie racinaire représente presque le tiers de la MS totale (Tableau 1). Cette production remarquable de MS, particulièrement la proportion de MS produite par le système racinaire, est synonyme d'une vigueur considérable de cet écotype sauvage. Bien que nous ayons appliqué le traitement salin de 100 mM NaCl durant un mois, aucun effet significatif sur la production de matière sèche totale ne fut observé. Cependant, au niveau racinaire, la production de MS est réduite de 30 %. La partie racinaire est ainsi plus sensible à la salinité que la partie aérienne. Concernant la CMR, celle-ci diminue seulement de 44 % suite à l'application de la contrainte saline. Ainsi, la vigueur transmise par le système racinaire permet à l'écotype sauvage 'Séjnène' de préserver la croissance pondérale de la plante entière en sacrifiant la croissance de la partie racinaire au profit de l'appareil végétatif aérien responsable de la photosynthèse dont les produits seraient distribués de façon optimale pour assurer la survie de la plante (Rubinigg et al., 2004 ; Munns, 2005). L'énergie dépensée pour la vigueur de croissance serait très probablement déviée vers les mécanismes de tolérance lors d'un stress salin. Il semble donc exister une corrélation positive entre le niveau de tolérance de l'écotype de vigne sauvage 'Séjnène' et sa vigueur propre.
3.2. Surface foliaire et nombre de feuilles
33Au terme d'un mois de traitement salin, nous avons noté l'apparition de nécroses apicales et marginales ainsi que de chloroses sous forme de taches entre les nervures de quelques feuilles âgées. Ces symptômes foliaires tardifs et peu sévères seraient indicateurs, a priori, d'un caractère de tolérance et d'aptitude à détoxifier les ions nocifs. Le nombre de feuilles total par plante ne varie pas de manière significative et reste plus ou moins stable aux alentours de 50, indépendamment du stress (Tableau 1). Il en est de même pour la surface moyenne d'une feuille ainsi que la surface foliaire totale (Tableau 1). Ainsi, l'écotype sauvage 'Séjnène' résiste à la salinité en conservant son appareil végétatif plus ou moins intact, ce qui préserve sa capacité photosynthétique.
3.3. Teneurs en chlorophylle
34Les teneurs en chlorophylle totale et par feuille ne sont pas modifiées par l'application du traitement salin chez 'Séjnène' (Tableau 1). Celles-ci restent constantes, ce qui permet à la plante de conserver une activité photosynthétique normale et donc de maintenir sa croissance malgré le stress.
3.4. Teneur en eau
35On remarque également que le traitement salin n'a pas causé une réduction significative de la teneur en eau (Tableau 1). Ce contrôle de l'hydratation révèle une bonne aptitude d'ajustement du potentiel osmotique chez 'Séjnène'.
3.5. Nutrition minérale
36Sodium. L'application du stress salin entraine une augmentation significative des teneurs en sodium dans tous les organes des plantes stressées par rapport aux témoins (Tableau 2). Les feuilles atteignent une teneur en sodium de 960 µmol.g-1 MS, la tige, 900 µmol.g-1 MS, alors que les racines présentent une teneur de 665 µM.g-1 MS et 'Séjnène' semble ainsi, d'après le développement végétatif (vigueur) et l'aspect des plants (symptômes de chlorose absents ou peu apparents), être encore capable de tolérer le NaCl et de l'accumuler dans ses tissus. Un comportement de type « includer » est donc affiché et adopté par 'Séjnène'. Cette stratégie se traduit par de très fortes teneurs en sodium enregistrées au niveau de la partie aérienne et particulièrement les feuilles où elles sont multipliées par un facteur 4 entre témoin et traité, et seulement par 3 au niveau de la tige. Notons que ces concentrations ne font que doubler au niveau des racines suite à l'application du stress salin. Les feuilles les plus âgées présentent une surcharge en Na+, contrairement aux feuilles jeunes (Tableau 4) et cela forme un gradient décroissant d'accumulation du sodium des feuilles âgées basales vers les feuilles plus jeunes apicales. Les tableaux 2 et 3 mettent en évidence la capacité d'accumulation du sodium de chaque organe de la plante et il apparait que le caractère de tolérance est étroitement lié à la capacité d'accumulation du sodium particulièrement dans la partie aérienne composée des feuilles et de la tige qui représente un organe rigide et persistant lors de la phase de dormance hivernale au cours de laquelle la vigne perd ses feuilles. La partie aérienne de 'Séjnène' représente 75 % de la capacité d'accumulation du sodium de la plante entière. Les quantités de sodium accumulé dans la partie aérienne de 'Séjnène' ont triplé entre le témoin et le traité.
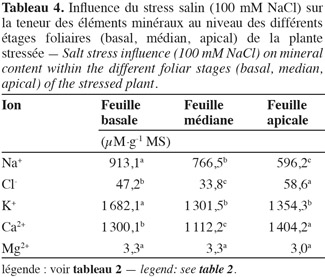
37Chlorure. L'application du stress salin engendre une augmentation très significative des teneurs en chlore dans tous les organes de la plante. Toutefois, il est important de remarquer que ces teneurs sont nettement en deçà de celles obtenues pour le sodium. En effet, celles-ci ne dépassent guère 40 µmol.g-1 MS, alors que celles de sodium peuvent atteindre 960 µmol.g-1 MS pour les plants traités, soit presque 25 fois plus (Tableau 2). Pourtant selon Greenway et al. (1980), les ions chlorures sont beaucoup plus vite absorbés par les plantes que les ions sodium. L'analyse minérale a aussi révélé que l'accumulation du chlore varie en fonction de l'organe. La teneur des racines en chlore est significativement plus élevée que celle des deux autres parties. Le chlore est donc écarté et éloigné le plus possible des parties aériennes de la plante. Ainsi, contrairement au sodium, le chlore est principalement accumulé au niveau des racines. L'écotype sauvage 'Séjnène' adopte donc un comportement d'exclusion de la partie aérienne des ions chlorures toxiques. En termes de quantités accumulées au cours du stress (Tableau 3), les chlorures ne dépassent pas 700 µmoles dans toute la plante, alors que les ions sodium avaient atteint 21,5 mmoles, soit 31 fois plus. Il n'y a pas d'accumulation préférentielle des chlorures au niveau des feuilles âgées basales, comme nous l'avons constaté pour le sodium (Tableau 4) et il semble ainsi que la régulation de la distribution des chlorures, après leur absorption et pénétration dans les tissus, ne soit pas aussi efficace que celle du sodium.
38Potassium. Au niveau des feuilles, les teneurs en potassium augmentent suite au stress salin (Tableau 2). Cela semble être un comportement de réajustement osmotique (surtout après l'invasion des ions sodium) qui, par conséquent, assure la survie des plants. Au niveau de la tige et des racines, les teneurs en potassium sont amoindries par rapport aux témoins. La plante adsorbe et véhicule le maximum de potassium vers les feuilles, ce qui satisfait les besoins osmotiques. Il semble que c'est surtout au niveau des feuilles que la plante rétablit l'équilibre de son potentiel osmotique via l'ion potassium et atténue ainsi le stress osmotique engendré par NaCl. La capacité de la plante à pomper le potassium de la solution nutritive, puis de le véhiculer vers les feuilles, représente une stratégie d'adaptation au stress salin via la régulation osmotique par l'ion potassium.
39Calcium. Au niveau des tiges et racines de la plante, l'accumulation du calcium ne semble pas être modifiée par le stress salin de manière significative, même si une diminution est observée (Tableau 2). Cependant, au niveau des feuilles, les concentrations de calcium augmentent suite à l'application du stress salin. Nous avons constaté également l'accumulation de quantités élevées de calcium au niveau des feuilles, particulièrement apicales et jeunes.
40Magnésium. Bien qu'une baisse des concentrations de magnésium ait été enregistrée au niveau des feuilles et des racines, il ne semble pas que cet élément soit un critère capital quant à l'adaptation des plantes au stress salin. Les quantités accumulées ne reflètent pas non plus un aspect particulier de la tolérance à la salinité.
41Rapport K/Na. Le rapport K/Na affiche une tendance générale à la baisse, particulièrement au niveau de la partie aérienne de la plante. Cette baisse est particulièrement remarquable au niveau des feuilles. Dans les conditions normales (plants témoins), ce rapport est plus élevé au niveau des feuilles que de la tige et des racines. En effet, le potassium est très sollicité au niveau du compartiment aérien pour la réalisation des métabolismes cellulaires où il est généralement employé comme cofacteur dans les réactions enzymatiques et biochimiques. Vraisemblablement, en présence de sel, les plantes transportent dans leurs feuilles des quantités en Na+ plus importantes qu'en K+ en raison de l'excès de NaCl dans le milieu (100 mM), par rapport à la disponibilité du potassium de la solution Long Ashton (seulement 6 mM).
4. Discussion
4.1. Croissance
42Il est clairement établi par une multitude de travaux que la salinité se traduit par une réduction de croissance chez la vigne (Downton, 1977a ; Downton, 1977b ; Al-Saidi et al., 1984 ; Downton, 1985 ; Kishore et al., 1985 ; Maas, 1986 ; Charbaji et al., 1988 ; Walker, 1994 ; Walker et al., 1997 ; Alexander et al., 2003 ; Walker et al., 2003 ; Charbaji et al., 2004). Cet effet peut être lié à des perturbations de concentrations des régulateurs de croissance (acide abscissique et cytokinines) (Termaat et al., 1985 ; Kuiper et al., 1990), mais aussi à une réduction de la capacité photosynthétique suite à une diminution de la conductance stomatique du CO2 induite par la contrainte saline (Walker et al., 1981 ; Santiago et al., 2000). Chez Citrus aurantium, cette réduction de croissance serait principalement due à l'effet osmotique de la salinité (Ruiz et al., 2001). D'après Walker et al. (1981), une perte de turgescence serait responsable d'une diminution de la capacité photosynthétique et, par conséquent, de la croissance. Par contre, pour le bigaradier, la diminution de la turgescence n'est pas la cause de la réduction de la croissance (Fernandez-Ballester et al., 1998). Ceci concorde avec nos résultats puisque les plants traités ont présenté un bon ajustement osmotique, l'hydratation des plants ayant toujours été maintenue sensiblement égale à celle des témoins. Ainsi, on peut exclure que l'effet inhibiteur de NaCl sur leur croissance passe par une perturbation de leur alimentation en eau. Chez 'Séjnène', la partie racinaire est plus affectée par la salinité que la partie aérienne. Ainsi, la plante semble s'adapter au stress salin en réduisant en premier lieu son système racinaire préservant la partie aérienne devant maintenir et assurer la production de photosynthétats. En effet, chez les porte-greffes de vigne, les racines semblent constituer le premier et principal lieu où se déroulent les mécanismes d'ajustement et de régulation de croissance afin de pouvoir faire face au stress (Sharp et al., 1979 ; Rubinigg et al., 2004). Cette différence de sensibilité entre les organes d'absorption et les organes photosynthétiques est caractéristique des glycophytes (Brugnoli et al., 1992 ; Bernstein et al., 1993). Pourtant, chez la variété ' Sultanine ' non greffée, et sous stress salin, la production de la matière sèche diminue plus dans les tiges qu'au niveau des racines (réduction de 50 % du rapport racines/tiges). Aussi la teneur en eau diminue chez cette variété de vigne de 4 % à une dose de 100 mM NaCl (Downton, 1985). Bouaouina et al. (2000) ont montré que chez le blé dur, la croissance végétative de la variété ' Razzak ' est fortement déprimée par les concentrations en NaCl égales ou supérieures à 50 mM et que l'effet dépressif du sel concerne plus les organes aériens que les racines, particulièrement les feuilles jeunes en croissance. Chez certaines glycophytes, des concentrations élevées en NaCl altèrent la distribution de matière sèche en faveur des racines (Brugnoli et al., 1992 ; Chartzoulakis, 2005). La résistance du système racinaire au stress salin peut être due à une diminution de l'allocation du carbone pour la croissance foliaire au profit de la croissance racinaire (Brugnoli et al., 1992), or ce n'est pas ce qu'on observe chez l'écotype sauvage 'Séjnène'. Au niveau physiologique, l'arrêt de croissance peut être considéré comme un moyen de préserver les carbohydrates pour le métabolisme et le développement durable, et de constituer des réserves énergétiques nécessaires à la reprise de croissance suite à la levée du stress (Bartels et al., 2005). C'est le cas, par exemple, constaté au niveau des cellules méristématiques de la zone apicale des racines du maïs qui accumulent des quantités élevées d'hexoses pour ajuster le potentiel osmotique (Sharp et al., 1990). La fourniture d'éléments minéraux par les racines pourrait également être proportionnelle à la demande de la partie aérienne sans différence entre génotypes (Ollat et al., 2003). Il pourrait ainsi exister une variabilité génétique pour l'efficience d'utilisation des minéraux, comme le montrent Stanley-Grant et al. (1996) pour le phosphore. Ces différences pourraient correspondre à des besoins énergétiques variables (Ollat et al., 2003). Walker et al. (2002) ont montré que, chez la vigne, la tolérance à la salinité peut être influencée par la distribution des racines et peut impliquer la contribution d'exclusion de chlorure. La réponse immédiate du stress salin est aussi exprimée par une réduction de la surface foliaire (Wang et al., 2000) et une diminution des matières fraiche et sèche au niveau des feuilles, mais aussi au niveau des tiges et racines (Dinar et al., 1999 ; Chartzoulakis et al., 2000 ; Hernandez et al., 2000). La diminution de croissance végétative, exprimée que ce soit par la réduction du nombre de feuilles ou bien de la surface foliaire, représente généralement la première réponse des glycophytes exposées au stress salin (Munns et al., 1986). Or l'écotype 'Séjnène' semble réagir autrement. En effet, le nombre de feuilles total ainsi que la surface moyenne d'une feuille de vigne semblent être des paramètres stables, même en conditions salines. Par conséquent, la réduction de la surface foliaire ne constitue pas, chez cet écotype sauvage, une forme d'adaptation à la salinité, car même si la diminution de la surface foliaire et du nombre de feuilles total tendent à minimiser les pertes d'eau par transpiration, elles peuvent paradoxalement provoquer une diminution du rendement à cause de la réduction de la capacité photosynthétique (Bidinger et al., 1989). La réduction des teneurs en chlorophylle, associée à l'augmentation de la résistance stomatique, va entrainer une diminution de l'activité photosynthétique (Walker et al., 1981 ; Downton et al., 1990). En effet, différents auteurs insistent sur le fait que la réduction de l'activité photosynthétique, suite à un stress environnemental, ne se manifeste pas de manière directe mais principalement via la réduction de la conductance stomatique et/ou de la pression partielle de CO2 intracellulaire (Flanagan et al., 1989 ; Robinson et al., 1989 ; Sharkey et al., 1989 ; Downton et al., 1990).
4.2. Nutrition minérale
43En conditions de stress salin, l'écotype 'Séjnène' absorbe et transporte Na+ dans ses organes aériens. Cette accumulation préférentielle de sodium au niveau de la partie aérienne de la plante, ou comportement dit includer, est une stratégie de tolérance qui implique nécessairement l'intervention d'un mécanisme de compartimentation vacuolaire du sodium. Ce dernier est assuré par un antiport vacuolaire de type NHX (Blumwald, 2000 ; Blumwald et al., 2000) et dont un ADNc a été récemment identifié et caractérisé chez la vigne cultivée (Vitis vinifera) par Hanana et al. (2007 ; 2009). Le sodium est toxique lorsqu'il est présent à de fortes concentrations au niveau du cytoplasme des cellules foliaires, car il inhibe les réactions enzymatiques, sauf s'il est compartimenté au niveau des vacuoles de ces cellules (Blumwald, 2000 ; Blumwald et al., 2000). Donc un génotype tolérant, comme le cas de 'Séjnène', va afficher des concentrations élevées de sodium dans les feuilles, sachant qu'il procède à sa compartimentation dans la vacuole pour protéger le cytoplasme de sa toxicité (Blumwald, 2000 ; Storey et al., 2003 ; Hanana et al., 2007) alors que, dans le cas d'un génotype sensible, ce dernier aurait tendance à exclure le sodium dans les cellules des tissus de la tige et des racines où il y a peu de réactions enzymatiques vitales pour la plante. Les niveaux de concentration en sodium obtenus semblent signifier qu'il y a d'abord accumulation du sodium dans les parties aériennes, puis lorsque cela atteint les doses toxiques, le compartiment racinaire semble prendre le relais et contribuer à son tour à la tolérance. On ne peut savoir quel organe (racine, tige ou feuille) est en premier lieu chargé et rempli de sodium, les deux mécanismes de stockage de sodium, successivement ou simultanément, seraient probables. Une étude tenant compte de la cinétique et de la dynamique d'accumulation du sodium dans les différents organes serait nécessaire afin de confirmer l'une ou l'autre hypothèse. Une étude intéressante dans ce sens a montré que l'arrosage par un système de « mist irrigation » de la partie végétative ne modifiait pas les concentrations des ions Na+, Cl- et K+ dans la partie racinaire (Stevens et al., 1996). Il semblerait ainsi que ces ions n'aient pas migré dans le sens descendant, toutefois ce mécanisme pourrait être déficient chez certains génotypes de vigne (variété et porte-greffe). On ne peut exclure totalement cette hypothèse de recirculation du sodium car en effet, cela a été démontré chez le piment via le phloème (Blom-Zandstra, 2000). Par ailleurs, beaucoup de glycophytes ont une capacité de compartimentation vacuolaire limitée, et de ce fait tendent à refaire véhiculer le sodium en excès des feuilles vers les racines. Ce transport de sodium de la partie aérienne vers la partie racinaire est probablement assuré par les transporteurs SOS1 et HKT1 chez Arabidopsis et le blé via le phloème (Shi et al., 2002 ; Berthomieu et al., 2003). Troncoso et al. (1999), en étudiant in vitro le comportement des porte-greffes de vigne vis-à-vis de la salinité, ont constaté que les génotypes tolérants accumulaient nettement plus de sodium que les sensibles en condition de stress salin. Le même comportement a été observé par Downton (1977a) sur des vignes cultivées en plein champ. Paradoxalement, Ream et al. (1976), Arbabzadeh et al. (1987) et Garcia et al. (1993) ont rapporté que ce sont les variétés tolérantes qui accumulent le moins de sodium. Cette différence de comportement s'expliquerait probablement par le fait qu'il s'agit de porte-greffes (V. sylvestris, V. berlandieri x V. rupestris ou x V. riparia) dans un cas et de variétés (V. vinifera) pour l'autre et donc pas les mêmes espèces, mais aussi parce que les conditions d'expérimentation sont différentes (in vitro, sous serre ou en plein champ). Par ailleurs, il est connu que les porte-greffes hybrides issus de croisement avec un parent V. riparia, tels que le SO4 (V. berlandieri x V. riparia) ou le 101-14 MG (V. riparia x V. rupestris) présentent une grande sensibilité au chlorure de sodium (Lafon et al., 1961 ; Hamrouni, 2009). La partie aérienne de 'Séjnène' constitue ainsi un compartiment capital à préserver afin d'assurer une adaptation au stress salin. Or, celui-ci n'affecte pas la croissance de sa partie aérienne suite au stress salin (cf 4.1. croissance). En effet, nous avons démontré précédemment que le stress salin affecte la croissance racinaire des plants. Et cet écotype sauvage n'utilise pas vraiment le compartiment racinaire comme le lieu de stockage du sodium, mais plutôt la partie aérienne dont la croissance ne subit pas de réduction significative. Ainsi, le maintien et la conservation d'une certaine masse végétale aérienne va constituer un moyen très efficace pour stocker le sodium toxique et réaliser ainsi une sorte de dilution de cet ion toxique. D'où le rôle prédominant et capital de la vigueur initiale de l'écotype 'Séjnène' dans son adaptation au stress salin. L'exclusion des chlorures hors de la partie aérienne et vers la partie racinaire par l'écotype sauvage 'Séjnène' laisse supposer que le chlore représente pour la vigne un élément fortement toxique, mais aussi que la plante ne possède pas la capacité nécessaire à effectuer sa compartimentation vacuolaire au niveau des cellules des tissus foliaires. Or, le mécanisme de compartimentation des ions chlorures à l'intérieur de la vacuole a été démontré et mis en évidence par Hechenberger et al. (1996) suite à l'identification des canaux chlorures CLC. Les teneurs en chlorures des différents étages foliaires (basal, médian et apical) ne diffèrent pas de manière significative. Pourtant, cette accumulation préférentielle de chlorures au niveau des feuilles âgées basales a été observée chez deux porte-greffes de rosier Rosa chinensis ' Major ' et R. rubiginosa (Wahomea et al., 2001). Le transport des ions chlorures vers la partie aérienne est contrôlé par les racines (Downton, 1977a ; Läuchli, 1984). Par ailleurs, l'exclusion des chlorures semble dépendre d'un seul gène (Abel et al., 1964 ; Sykes, 1987), ce qui suggère que ce phénomène serait réalisé par un mécanisme physiologique unique. Toutefois, peu d'informations sont disponibles quant au mécanisme proprement dit, sauf que cela pourrait impliquer la restriction de l'absorption des chlorures et leur compartimentation vacuolaire au niveau des racines (Läuchli, 1984 ; Storey et al., 2003). Cette forte accumulation de chlorures a été aussi observée par Bernstein et al. (1969), Groot et al. (1973) et Troncoso et al. (1999), contrairement à ce qui a été décrit par Arbabzadeh et al. (1987) et Walker (1994). Les analyses de la tolérance à la salinité de porte-greffes de vigne cultivés in vitro ont montré que le porte-greffe tolérant Ramsey accumulait plus de chlorures que les autres (Barlass et al., 1981). C'est donc en raison de leur aptitude à restreindre l'entrée et l'accumulation des chlorures au sein des tissus végétaux que l'idée d'améliorer la tolérance à la salinité des vignes en utilisant des porte-greffes a été soulevée par Sauer (1968), Bernstein et al. (1969) et Downton (1977a). Sykes (1992) a projeté et envisagé d'utiliser les porte-greffes dans des programmes d'hybridation et de croisement afin d'améliorer l'aptitude à exclure les chlorures tout en conservant les caractères liés à la fructification et au rendement de la vigne. En Australie (Vignoble de CSIRO, Victoria), le génotype Vitis berlandieri a été utilisé dans un programme de croisement en raison de son aptitude à réaliser l'exclusion des ions chlorures (Downton, 1977a ; Downton, 1977b ; Antcliff et al., 1983). Nos résultats confirment le fait que les racines de vigne servent de compartimentation et d'accumulation des ions chlorures (Downton, 1977a ; Downton, 1977b ; Storey et al., 2003). Depuis longtemps, Thomas (1934), Woodham (1956) et Ehlig (1960) ont démontré et mis en évidence la corrélation entre les teneurs en chlorures des tissus et la sévérité des symptômes sur les feuilles de vigne. Toutefois, selon Prior et al. (1992), les symptômes de toxicité observés chez la vigne semblaient plutôt être liés à la température plus qu'à une teneur particulière de chlore dans les feuilles, et la diminution des rendements était liée à la réduction de l'activité photosynthétique, cette dernière étant corrélée négativement à la teneur en chlorures des tissus foliaires. Alexander et al. (1968) et Downton (1977a) ont noté que les réductions sévères de croissance apparaissaient avant les symptômes foliaires de toxicité. Barlass et al. (1981) lient l'inhibition de croissance de la vigne sous stress salin à l'ion chlorure, sans exclure la possibilité d'un effet osmotique. On constate de manière très nette que sous stress salin, l'écotype sauvage de vigne accumule beaucoup plus de sodium dans ses organes que de chlore. Cela démontre qu'il possède une meilleure capacité de régulation de transport et de restriction de stockage que pour le sodium (Garcia-Legaz et al., 2008), tel qu'il a été déjà décrit pour d'autres espèces (Romero et al., 1997 ; Garcia-Legaz et al., 2005), quoique le phénomène contraire ait été également observé (Picchioni et al., 1990 ; Sykes, 1992). Par ailleurs, la toxicité de NaCl est fréquemment associée à des teneurs foliaires élevées en Cl- (Walker et al., 1997), de 0,113 à 0,197 méq.g-1 MS selon White et al. (2003), mais elle peut aussi résulter de l'accumulation excessive de Na+ [> 0,131 méq.g-1 MS selon Maas (1986)] (Fernandez-Ballester et al., 1998). Or, il est démontré que les espèces d'agrumes les moins tolérantes sont celles qui accumulent le plus de Cl- dans leurs feuilles (Chapman et al., 1968). Ainsi, l'intensité des dégâts foliaires, l'abscission et la photosynthèse chez les porte-greffes sont associées aux teneurs en Cl- (Banuls et al., 1990) et aucune corrélation statistique ni de relation simple ne relient la teneur foliaire en sodium et les effets négatifs de la salinité (Romero-Aranda et al., 1998). Concernant le sodium et à l'opposé des chlorures, d'autres études ont montré que Na+ est beaucoup plus responsable de la réduction des échanges gazeux et du taux d'assimilation de CO2 et donc de la croissance (Loyd et al., 1990). En 1989, Ruhl et al. ont réussi à mettre en évidence l'existence de deux mécanismes principaux d'absorption de potassium au sein des porte-greffes de vigne. Le premier est à forte affinité pour le potassium, il devient saturé lorsque le milieu extérieur atteint une concentration proche de 1 mmol.l-1. Le second, à faible affinité pour le potassium, intervient surtout pour l'absorption de potassium lorsque celui-ci est très concentré dans le milieu (Paranychianakis et al., 2006). Il semble que chez 'Séjnène', l'absorption de potassium soit assurée par les deux mécanismes conjointement. À l'interface racine/sol, l'excès de Na+ peut limiter l'approvisionnement de la plante en macroéléments essentiels, tels que K+. Une composante de la tolérance à la salinité sera donc l'efficacité avec laquelle K+ est absorbé et utilisé pour les besoins métaboliques et la régulation osmotique. L'efficacité d'absorption et d'utilisation du potassium, qui agit comme osmoticum, est donc capitale dans l'adaptation au stress salin. Les quantités de potassium accumulées peuvent donc être indicatrices du comportement de tolérance/sensibilité des vignes. En effet, les génotypes tolérants seraient capables d'accumuler de grandes quantités de potassium, particulièrement dans les parties aériennes (Hamrouni, 2009). L'efficacité d'absorption et d'utilisation du potassium, qui agit comme osmoticum, est donc capitale dans l'adaptation au stress salin. L'analyse in vitro de la tolérance à la salinité des porte-greffes de vigne, effectuée par Troncoso et al. (1999), a montré que les teneurs en potassium dans les tissus évoluaient de façon inversement proportionnelle aux concentrations de NaCl. Cependant, les porte-greffes tolérants ont affiché des teneurs supérieures à celles des sensibles. Comme pour le potassium, l'analyse in vitro de la tolérance à la salinité des porte-greffes de vigne, effectuée par Troncoso et al. (1999), a montré que les teneurs en calcium dans les tissus évoluaient de façon inversement proportionnelle aux concentrations de NaCl, et que les porte-greffes tolérants ont affiché des teneurs supérieures à celles des sensibles. L'accumulation de calcium constatée au niveau des tissus foliaires serait probablement liée à son rôle dans les mécanismes de signalisation et d'adaptation au stress, mais aussi dans la protection des membranes et structures cellulaires (Cramer, 2002). Il a été précédemment observé que les plantes exposées au NaCl absorbent de grandes quantités de sodium, contrairement au potassium dont l'absorption est significativement réduite (Asharaf et al., 2004). Cette situation résulte essentiellement de l'exportation sélective du sodium vers la partie aérienne via le xylème (Lessani et al., 1978 ; Tester et al., 2003). La compétition entre le sodium et le potassium est également bien connue (Cramer et al., 1985 ; Cerda et al., 1995 ; Garcia-Sanchez et al., 2002 ; Duran et al., 2004), suggérant que le mécanisme d'absorption de ces deux ions est similaire (Schroeder et al., 1994 ; Maathuis et al., 1999 ; Tozlu et al., 1999 ; Apse et al., 2007).
5. Conclusion
44Ainsi, d'après nos analyses, il s'avère que le degré de tolérance de l'écotype de vigne sauvage 'Séjnène' est lié à son niveau de vigueur. Par ailleurs, la production de MS, le nombre de feuilles et, à un degré moindre, la surface foliaire et les teneurs en chlorophylle et en eau, sont des paramètres très sensibles à la salinité et peuvent, par conséquent, servir comme marqueurs de tolérance ou de sensibilité à la salinité. Il existe toutefois des contradictions dans la bibliographie concernant la tolérance à la salinité des porte-greffes de vigne (Antcliff et al., 1983 ; Arbabzadeh et al., 1987) ainsi que l'accumulation de sels au niveau des tissus, probablement en raison de facteurs additionnels relatifs au dispositif expérimental (Paranychianakis et al., 2005). Le comportement de tolérance à la salinité est donc, d'après notre étude, intimement lié à la vigueur du génotype (maintien de la croissance et de l'activité photosynthétique) ainsi qu'à son aptitude à accumuler le sodium au niveau de la partie aérienne (feuilles et tige), et plus spécifiquement au niveau des feuilles âgées (comportement dit includer vis-à-vis du sodium), à restreindre l'entrée et le stockage des chlorures au niveau des tissus végétaux (comportement excluder vis-à-vis des chlorures), et à sa capacité de transférer et accumuler le potassium au niveau des feuilles pour réaliser l'ajustement osmotique, mais aussi, en premier lieu, à faire intervenir les mécanismes de signalisation de stress et de protection cellulaire via l'augmentation des teneurs en calcium au niveau des feuilles (surtout les feuilles apicales jeunes).
Bibliographie
Abdelly C., 1997. Mécanismes d'une association de luzernes spontanées et de halophytes pérennes en bordure de sebkha. Thèse de doctorat d'État Es-Sciences naturelles : Université Tunis II, Faculté des Sciences de Tunis (Tunisie).
Abel G.H. & Mackenzie A.J., 1964. Salt tolerance of soybean varieties (Glycine max L. Merill) during germination and later growth. Crop Sci., 4, 157-161.
Alexander D.McE. & Woodham R.C., 1968. Relative tolerance of rooted cuttings of four vinifera varieties to sodium chloride. Aust. J. Exp. Agric. Animal Husb., 8, 461-465.
Alexander F. & Heaney A., 2003. Potential impact of saline irrigation water on the grape industry in the Murray Darlin basin. Final report to the grape and wine research and development corporation. GWRDC project number: BAE 02/04. Canberra: Australian Bureau of Agricultural and Resource Economics.
Al-Saidi I.H. & Alawi B.J., 1984. Effect of different concentrations of NaCl and CaCl2 on growth, dry weight and mineral element of some grape cultivars (Vitis vinifera L.). Am. Agric. Sci., 29, 971-988.
Antcliff A.J., Newnam H.P. & Barrett H.C., 1983. Variation in chloride accumulation in some American species of grapevines. Vitis, 22, 357-362.
Apse M. & Blumwald E., 2007. Na+ transport in plants. FEBS Lett., 581, 2247-2254.
Arbabzadeh F. & Dutt G., 1987. Salt tolerance of grape rootstocks, under greenhouse conditions. Am. J. Enol. Vitic., 38, 95-101.
Arnon D.I., 1941. Coppere enzymes in isolated chloroplasts: polyphenoloxydase in Beta vulgaris. Plant Physiol., 24, 1-15.
Arnon D.I. & Hoagland D.R., 1940. Crop production in artificial solutions and soils with special reference to factors influencing yield and absorption of inorganic nutrients. Soil Sci., 50, 463-471.
Asharaf M. & Akhtar N., 2004. Influence of salt stress on growth, ion accumulation and seed oil content in sweet fennel. Biol. Plant., 48, 461-464.
Banuls J., Legaz F. & Primo Millo E., 1990. Effects of salinity on uptake and distribution of chloride and sodium in some Citrus scion-rootstock combinations. J. Hortic. Sci., 65, 715-724.
Barlass M. & Skene K.G.M., 1981. Relative NaCl tolerances of grapevine cultivars and hybrids in vitro. Z. Pflanzenphysiol., 102, 147-161.
Bartels D. & Sunkar R., 2005. Drought and salt tolerance in plants. Crit. Rev. Plant Sci., 24, 23-58.
Bernstein L., Ehlig C.F. & Clark R.A., 1969. Effect of grape rootstocks on chloride accumulation in leaves. J. Am. Soc. Hortic. Sci., 94, 584-590.
Bernstein N., Läuchli A. & Silk W.K., 1993. Kinetics and dynamics of sorghum (Sorghum bicolor L.) leaf development at various Na/Ca salinities. I. Elongation and growth. Plant Physiol., 103, 1107-1114.
Berthomieu P., Conéjéro G., Nublat A. & Brackenbury W.J., 2003. Functional analysis of AtHKT1 in Arabidopsis shows that Na+ recirculation by the phloem is crucial for salt tolerance. EMBO J., 22, 2004-2014.
Bidinger F.R. & Witcombe J.R., 1989. Evaluation of specific drought avoidance traits as selection criteria. In: Baker F.W.G., ed. Drought resistance in cereals. Theory and Practice. Paris: ICSU Press, 151-164.
Blom-Zandstra M., 2000. Sodium transport and distribution in sweet pepper during and after salt stress. ISHS Acta Horticulturae 511. In: XXV International Horticultural Congress, Part 1: culture techniques with special emphasis on environmental implications - Nutrient management.
Blumwald E., 2000. Sodium transport and salt tolerance in plants. Curr. Opin. Cell Biol., 12, 431-434.
Blumwald E., Aharon G.S. & Apse M.P., 2000. Sodium transport in plant cells. Biochim. Biophys. Acta, 1465, 140-151.
Bouaouina S., Zid E. & Hajji M., 2000. Tolérance à la salinité, transports ioniques et fluorescence chlorophyllienne chez le blé dur (Triticum turgidum L.). In: Royo C., Nachit M.M., Di Fonzo N. & Araus J.L., éds. L'amélioration du blé dur dans la région méditerranéenne : nouveaux défis. Zaragoza : CIHEAM-IAMZ, 239-243.
Brugnoli E. & Björkman O., 1992. Growth of cotton under continuous salinity stress: influence on allocation pattern, stomatal and non-stomatal components and dissipation of excess light energy. Planta, 187, 335-347.
Bruinsma J., 1961. Comment on the spectrophotometric determination of chlorophyll. Biochim. Biophys. Acta, 52, 576-578.
Carbonneau A., 1985. The early selection of grapevine rootstocks for resistance to drought conditions. Am. J. Enol. Vitic., 36, 195-198.
Cerda A., Pardines J., Botella M.A. & Martinez V., 1995. Effect of K on growth, water relations and the inorganic and organic salute contents for two maize cultivars grown under saline conditions. J. Plant Nutr., 18, 839-852.
Champagnol F., 1984. Éléments de physiologie de la vigne et de viticulture générale. Saint-Gély-du-Fesc, France : François Champagnol.
Chapman H.D., Reuther W., Batchelor L.D. & Weber H.J., 1968. The mineral nutrition of Citrus. In: Reuther W., ed. The Citrus industry. Vol. 2. Berkeley, USA: University of California, 127-289.
Charbaji T., Garcia M. & Fallot J., 1988. Effet du chlorure de sodium sur la croissance de la vigne en culture hydroponique et sur la répartition des deux éléments constitutifs de ce sel. Agrochimica, 37, 418-429.
Charbaji T. & Ayyoubi Z., 2004. Differential growth of some grapevine varieties in Syria in response to salt in vitro. In Vitro Cell. Dev. Biol. Plant, 40, 221-224.
Chartzoulakis K.S., 2005. Salinity and olive: growth, salt tolerance, photosynthesis and yield. Agric. Water Manage., 78, 108-121.
Chartzoulakis K. & Klapaki G., 2000. Response of two greenhouse pepper hybrids to NaCl salinity during different growth stages. Sci. Hortic., 86, 247-260.
Cramer G.R., 2002. Sodium-calcium interactions under salinity stress. In: Läuchli A. & Lüttge U., eds. Salinity. Environment-Plants-Molecules. Dordrecht, The Netherlands: Kluwer Academic Publishers, 205-227.
Cramer G.R., Läuchli A. & Polito V.S., 1985. Displacement of Ca2+ by Na+ from the plasmalemma of root cells. A primary response to salt stress. Plant Physiol., 79, 207-211.
Dali N., Michaud D. & Yelle S., 1992. Evidence for the involment of sucrose phosphate, synthase in the pathway of sugar accumulation in sucrose-accumulating tomato-fruits. Plant Physiol., 99, 434-438.
Dinar A., Ebert H.M. & Lüdders G., 1999. Growth, chloropyll content, photosynthesis and water relations in guava (Psidium guajava L.) under salinity and different nitrogen supply. Gartenbau Wiss., 64, 54-59.
Downton W.J.S., 1977a. Influence of rootstocks on the accumulation of chloride, sodium and potassium in grapevines. Aust. J. Agric. Res., 28, 879-889.
Downton W.J.S., 1977b. Chloride accumulation in different species of grapevine. Sci. Hortic., 7, 249-253.
Downton W.J.S., 1985. Growth and mineral composition of the Sultana grapevines as influenced by salinity rootstock. Aust. J. Agric. Res., 36, 425-434.
Downton W.J.S., Loveys B.R. & Grant W.J.R., 1990. Salinity effects on the stomatal behaviour of grapevine. New Phytol., 116, 499-503.
Duran V.H., Martinez-Raya A., Aguilar J. & Franco D., 2004. Impact of salinity on macro- and micronutrient uptake in mango (Mangifera indica L. cv. 'Osteen') with different rootstocks. Span. J. Agric. Res., 2, 121-133.
Ehlig C.F., 1960. Effects of salinity on four varieties of table grapes grown in sand culture. Proc. Am. Soc. Hortic., 76, 323-350.
Ennabli N., 1995. L'irrigation en Tunisie. Tunis : INAT – DGREF.
Fernandez-Ballester G., Vicente M., Dionisio R. & Antonio C., 1998. Change in inorganic solutes in Citrus growing under saline stresses. J. Plant Nutr., 21, 2497-2514.
Flanagan L.B. & Jefferies R.L., 1989. Effect of increased salinity of carbon dioxide assimilation, oxygen evolution and the isotopic ratio values of leaves of Plantago maritima L. developed at low and high sodium chloride. Planta, 178, 377-384.
Garcia M. & Charbaji T., 1993. Effect of sodium chloride salinity on cation equilibria in grapevine. J. Plant Nutr., 16, 2225-2237.
Garcia-Legaz M.F. et al., 2005. Effects of salinity and rootstock on growth, water relations, nutrition and gas exchange of loquat. J. Hortic. Sci., 80, 199-203.
Garcia-Legaz M.F. et al., 2008. Physiological behaviour of loquat and anger rootstocks in relation to salinity and calcium addition. J. Plant Physiol., 165, 1049-1060.
Garcia-Sanchez F., Jifon J.L., Carvajal M. & Syvertsen J.P., 2002. Gas exchange, chlorophyll and nutrient contents in relation to Na+ and Cl- accumulation in 'Sunburst' mandarin grafted on different rootstocks. Plant Sci., 162, 705-712.
Gokbayrak Z., Soylemezoglu G., Akkurt M. & Celik H., 2007. Determination of grafting compatibility of grapevine with electrophoretic methods. Sci. Hortic., 113, 343-352.
Greenway H. & Munns R., 1980. Mechanisms of salt tolerance in non-halophytes. Annu. Rev. Plant Physiol., 31, 149-190.
Groot J. & Alexander D.M., 1973. Response of six grapevine cultivars to a range of chloride concentrations. Am. J. Enol. Vitic., 24, 65-68.
Hachicha M., 2007. Les sols salés et leur mise en valeur en Tunisie. Sécheresse, 18, 45-50.
Hamrouni L., 2009. Évaluation de la tolérance au sel chez la vigne en Tunisie. Thèse de doctorat : Faculté des Sciences de Tunis (Tunisie).
Hamrouni L., Ben Abdallah F., Abdelly C. & Ghorbel A., 2008. La culture in vitro : un moyen rapide et efficace pour sélectionner des génotypes de vigne tolérant la salinité. C.R. Biol., 331, 152-163.
Hanana M. et al., 2007. A grape berry (Vitis vinifera L.) cation/proton antiporter is associated with berry ripening. Plant Cell Physiol., 48, 804-811.
Hanana M., Cagnac O., Mliki A. & Blumwald E., 2009. Modèle topologique de la structure d'un antiport vacuolaire de type NHX chez la vigne cultivée (Vitis vinifera). Botany, 87, 339-347.
Hechenberger M. et al., 1996. A family of putative chloride channels from Arabidopsis and functional complementation of a yeast strain with a CLC gene disruption. J. Biol. Chem., 271, 33632-33638.
Hernández J.A., Jiménez A., Mullineaux P. & Sevilla F., 2000. Tolerance of pea (Pisum sativum L.) to long-term salt stress is associated with induction of antioxidant defences. Plant Cell Environ., 23, 853-862.
Hewitt E.J., 1952. Sand and water culture methods used in the study of plant nutrition. Commonwealth Agricultural Bureau Technical communication, No. 22. Maidstone, Kent, UK: Commonwealth Bureau of Horticulture and Plantation Crops, East Malling.
Hunt R., 1990. Basic growth analysis: plant growth analysis for beginners. London: Unwin Hyman.
Jacobson L., 1951. Maintenance of iron supply in nutrient solutions by a single addition of ferric potassium ethylenediamine tetraacetate. Plant Physiol., 26, 411-413.
Kishore D.K., Pandey R.M. & Singh R., 1985. Effect of salt stress on growth characteristics of Perlette grapevines. Prog. Hortic., 17, 289-297.
Kuiper D., Schuit D. & Kuiper J.C., 1990. Actual cytokinin concentrations in plant tissue as an indicator for salt resistance in cereal. Plant Soil, 123, 243-245.
Lafon J., Couillaud P. & Hude P., 1961. Maladies et parasites de la vigne. Vol. 2. Paris : Baillère et Fils.
Läuchli A., 1984. Salt exclusion: an adaptation of legumes for crops and pastures under saline conditions. In: Staples R.C. & Toennienssen G.A., eds. Salinity tolerance in plants. Strategies for crop improvement. New York, USA: Wiley, 171-187.
Lessani H. & Marschner H., 1978. Relation between salt tolerance and long distance transport of sodium and chloride in various crop species. Aust. J. Plant Physiol., 5, 27-37.
Loyd J., Kriedemann P.E. & Aspinall D., 1990. Contrast between Citrus species in response to salinisation: an analysis of photosynthesis and water relations for different rootstock-scion combinations. Physiol. Plant., 78, 236-246.
Maas E.V., 1986. Salt tolerance of plants. Appl. Agric. Res., 1, 12-26.
Maathuis F.J.M. & Amtmann A., 1999. K+ nutrition and Na+ toxicity: the basis of cellular K+/Na+ ratios. Ann. Bot., 84, 123-133.
Munns R., 2005. Genes and salt tolerance: bringing them together. New Phytol., 167, 645-663.
Munns R. & Termaat A., 1986. Whole-plant responses to salinity. Aust. J. Plant Physiol., 13, 143-160.
Ollat N. et al., 2003. La vigueur conférée par le porte-greffe : hypothèses et pistes de recherches. Bull. OIV, 76, 581-595.
Paranychianakis N.V. & Chartzoulakis K.S., 2005. Irrigation with saline water in Mediterranean region: from physiology to management practices. Agric. Ecosyst. Environ., 106, 171-187.
Paranychianakis N.V., Nikolantonakis M., Spanakis Y. & Angelakis A.N., 2006. The effect of recycled water on the nutrient status of Soultanina grapevines grafted on different rootstocks. Agric. Water Manage., 81, 185-198.
Picchioni G.A., Miyamoto S. & Storey J.B., 1990. Salt effects on growth and ion uptake of pistachio rootstock seedlings. J. Am. Soc. Hortic. Sci., 115, 647-653.
Pottier-Alapetite G., 1979. Flore de la Tunisie. Angiospermes dicotylédones. Apétales-dialypétales. Tunis : Imprimerie officielle de la République tunisienne.
Prior L.D., Grieve A.M. & Cullis B.R., 1992. Sodium chloride and soil texture interactions in irrigated field grown sultana grapevines. II. Plant mineral content, growth and physiology. Aust. J. Agric. Res., 43, 1067-1083.
Ream C.L. & Furr J.R., 1976. Salt tolerance of some citrus species, relatives, and hybrids tested as rootstocks. J. Am. Soc. Hortic. Sci., 101, 265-267.
Robinson S.P., Downton W.J.S. & Loveys B.R., 1989. Stress effects on photosynthesis. In: Proceedings of the 22th Yamada Conference, Plant water relations and growth under stress, Osaka. Tokyo : Yamada Science Foundation and My K.K., 109-116.
Romero L., Belakbir A., Ragala L. & Ruiz J.M., 1997. Response of plant yield and leaf pigments to saline conditions: effectiveness of different rootstocks in melon plants (Cucumis melo L.). Soil Sci. Plant Nutr., 43, 855-862.
Romero-Aranda R. et al., 1998. Physiological and anatomical disturbances induced by chloride salts in sensitive and tolerant Citrus: beneficial and detrimental effects of cations. Plant Cell Environ., 21, 1243-1253.
Rubinigg M., Wenisch J., Elzenga J.T.M. & Stulen I., 2004. NaCl salinity affects lateral root development in Plantago maritima. Funct. Plant Biol., 31, 775-780.
Ruhl E.H. et al., 1989. Effect of rootstocks in berry weight, pH, mineral content and organic concentrations of grape juice of some grape varieties. Aust. J. Exp. Agric., 28, 199-205.
Ruiz-Medrano R., Xoconostle C. & Lucas W.J., 2001. The phloem as a conduit for inter-organ communication. Curr. Opin. Plant Biol., 4, 202-209.
Santiago L.S. et al., 2000. Morphological and physiological responses of hawaiian Hibiscus tiliaceus populations to light and salinity. Int. J. Plant Sci., 161, 99-106.
SAS Institute, Inc., 1988. SAS/GRAPH User's Guide, Release 6.03 Edition. Cary, NC, USA: SAS Institute Inc.
Sauer M.R., 1968. Effects of vine rootstock on chloride concentration in Sultana scions. Vitis, 7, 223-226.
Schroeder J.I., Ward J.M. & Gassmann W., 1994. Perspectives on the physiology and structure of inward-rectifying K+ channels in higher plant: biophysical implications for K+ uptake. Annu. Rev. Biophys. Biomol. Struct., 23, 441-471.
Sharkey T.D. & Seemann J.R., 1989. Mild water stress effects on carbon-reduction-cycle intermediates, RuBP carboxylase activity, and spatial homogeneity of photosynthesis in leaves. Plant Physiol., 89, 1060-1065.
Sharp R.E. & Davies W.J., 1979. Solute regulation and growth by roots and shoots of water stressed maize plants. Planta, 147, 43-49.
Sharp R.E., Hsiao T.C. & Silk W.K., 1990. Growth of maize primary root at low water potentials. Plant Physiol., 93, 1337-1346.
Shi S., Quintero F.J., Pardo J.M. & Zhu J.-K., 2002. The putative plasma membrane Na+/H+ antiporter SOS1 controls long-distance Na+ transport in plants. Plant Cell, 14, 465-477.
Slama F., 1982. Effet du chlorure de sodium sur la croissance et la nutrition minérale : étude comparative de six espèces cultivées. Thèse de doctorat d'État : Faculté des Sciences de Tunis (Tunisie).
Stanley Grant R. & Matthews M.A., 1996. The influence of phosphorus availaibility and rootstock on root system characteristics, phosphorus uptake, phosphorus partitioning, and growth efficiency. Am. J. Enol. Vitic., 47, 403-409.
Stevens R.M., Harvey G. & Davies G., 1996. Separating the effects of foliar and root salt uptake on growth and mineral composition of four grapevine cultivars on their own roots and on Ramsey rootstock. J. Am. Soc. Hortic. Sci., 121, 569-575.
Storey R., Schachtman D.P. & Thomas M.R., 2003. Root structure and cellular chloride, sodium and potassium distribution in salinized grapevines. Plant Cell Environ., 26, 789-800.
Sykes S.R., 1987. Variation in chloride accumulation in hybrids and backcrosses of Vitis berlandieri and Vitis vinifera under glasshouse conditions. Am. J. Enol. Vitic., 38, 313-320.
Sykes S.R., 1992. The inheritance of salt exclusion in woody perennial fruit species. Plant Soil, 146, 123-129.
Termaat A., Passioura J.B. & Munns R., 1985. Shoot turgor does not limit shoot growth of NaCl-affected wheat and barley. Plant Physiol., 77, 869-872.
Tester M. & Davenport R.J., 2003. Na+ transport and Na+ tolerance in higher plants. Ann. Bot., 91, 503-527.
Thomas J.E., 1934. The diagnostic value of the chlorine content of the vine leaf. J. Counc. Sci. Ind. Res. Aust., 7, 29-38.
Tozlu I., Guy C.L. & Moor G.A., 1999. QTL analysis of Na+ and Cl- accumulation related traits in an intergeneric BC1 progeny of Citrus and Poncirus under saline and non-saline environments. Genome, 42, 692-705.
Troncoso A., Matte C., Cantos M. & Lavee S., 1999. Evaluation of salt tolerance of in vitro-grown grapevine rootstock varieties. Vitis, 38, 55-60.
Wahomea P.K., Jeschb H.H. & Grittnerb I., 2001. Mechanisms of salt stress tolerance in two rose rootstocks: Rosa chinensis 'Major' and R. rubiginosa. Sci. Hortic., 87, 207-216.
Walker R.R., 1994. Grapevine responses to salinity. Bull. OIV, 67, 634-661.
Walker R.R., Torokfalvy E., Scott N.S. & Kriedemann P.E., 1981. An analysis of photosynthetic response to salt treatment in Vitis vinifera. Aust. J. Plant Physiol., 8, 359-374.
Walker R.R., Blackmore D.H., Clingleffer P.R. & Iacono F., 1997. Effect of salinity and Ramsey rootstock on ion concentration and carbon dioxide assimilation in leaves of drip-irrigated, filed-grown grapevines (Vitis vinifera L. cv 'Sultana'). Aust. J. Grape Wine Res., 3, 66-74.
Walker R.R., Blackmore D.H., Clingeleffer P.R. & Correll R.L., 2002. Rootstock effects on salt tolerance of irrigated field-grown grapevines (Vitis vinifera L. cv. 'Sultana') I. Yield and vigour inter-relationships. Aust. J. Grape Wine Res., 8, 3-15.
Walker R.R. et al., 2003. Salinity effects on vines and wines. Bull. OIV, 76, 201-227.
Wang Y. & Nil N., 2000. Changes in chlorophyll, ribulose biphosphate carboxylase oxygenase, glycine betaine content, photosynthesis and transpiration in Amaranthus tricolor leaves during salt stress. J. Hortic. Sci. Biotechnol., 75, 623-627.
White P.J. & Broadley M.R., 2003. Calcium in plants. Ann. Bot., 92, 487-511.
Woodham R.C., 1956. The chloride status of the irrigated sultana vine and its relation to vine health. Aust. J. Agric. Res., 7, 414-427.
Om dit artikel te citeren:
Over : Lamia Hamrouni
Institut National de Recherches en Génie Rural, Eaux et Forêts. Laboratoire d'Écologie et d'Amélioration sylvo-pastorale. BP 10. TN-2080 Ariana (Tunisie).
Over : Mohsen Hanana
Centre de Biotechnologie de Borj-Cédria. Laboratoire de Physiologie moléculaire des Plantes. BP 901. TN-2050 Hammam-lif (Tunisie). E-mail : punto80@yahoo.com
Over : Chédly Abdelly
Centre de Biotechnologie de Borj-Cédria. Laboratoire des Plantes extrêmophiles. BP 901. TN-2050 Hammam-lif (Tunisie).
Over : Abdelwahed Ghorbel
Centre de Biotechnologie de Borj-Cédria. Laboratoire de Physiologie moléculaire des Plantes. BP 901. TN-2050 Hammam-lif (Tunisie).






