- Startpagina tijdschrift
- volume 16 (2012)
- numéro 4
- La forêt de tapia, écosystème endémique de Madagascar : écologie, fonctions, causes de dégradation et de transformation (synthèse bibliographique)
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
La forêt de tapia, écosystème endémique de Madagascar : écologie, fonctions, causes de dégradation et de transformation (synthèse bibliographique)

Nota's van de redactie
Reçu le 21 septembre 2011, accepté le 12 octobre 2012
Résumé
Cet article constitue une synthèse sur la forêt de tapia (Uapaca bojeri Baill.) de Madagascar en vue de présenter son importance dans le développement de la communauté riveraine via l’amélioration des revenus par ménage. La forêt de tapia est une formation « socio-naturelle », à strate arborée quasi monospécifique et endémique de Madagascar. Elle est localisée uniquement dans les hautes terres malgaches. À part les fonctions écosystémiques, la forêt de tapia abrite différentes ressources naturelles, entre autres les produits forestiers non ligneux et ligneux, qui jouent un rôle important dans l’économie locale informelle. Toutefois, cette formation végétale est menacée par la destruction humaine à travers les feux de brousse, la production de bois de chauffe et de charbon de bois, l’extension de l’agriculture et l’envahissement par des espèces exotiques de reboisement. Subséquemment, la gestion durable et la protection de cette forêt sont essentielles afin que les populations riveraines puissent en profiter de génération en génération.
Abstract
Tapia forest, endemic ecosystem to Madagascar: ecology, functions, causes of degradation and transformation: a review. This article presents an overview of the tapia forest (Uapaca bojeri Baill.) in Madagascar in order to emphasize its importance for the development of the local population through improving household incomes. The tapia forest is a “socio-natural” formation, quasi-monospecific with regard to the tree stratum and endemic to Madagascar. It is only located in the highlands of Madagascar. Alongside its ecosystem functions, the tapia forest hosts various resources, including non-timber forest products as well as timber itself, all of which play an important role in the informal local economy. However, the tapia ecosystem is threatened by human destruction through bush fires, production of firewood and charcoal, agriculture expansion, and by invasion of exotic species introduced for the purposes of reforestation. Subsequently, the sustainable management and protection of the tapia forest is essential in order to enable local populations to reap its benefits across several generations.
Inhoudstafel
1. Introduction
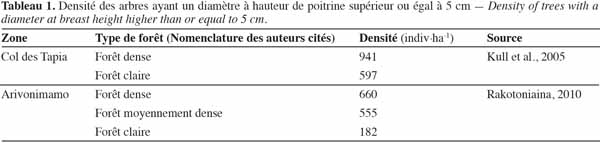
1L’ile de Madagascar, située à environ 400 km à l’est de l’Afrique continentale, présente une superficie de 587 000 km2 (Green et al., 2004). Elle constitue un véritable hotspot par son étonnante biodiversité et les menaces pesant sur elle (Myers et al., 2000). Plus de 12 000 espèces végétales y sont répertoriées, dont le degré d’endémisme a été estimé à des valeurs comprises entre 82 et 90 % (Gautier et al., 2003 ; Minten et al., 2003 ; Groupe des Spécialistes des Plantes de Madagascar, 2011). En outre, le taux d’endémisme de la faune est également élevé : 51 % pour les oiseaux (Hawkins et al., 2003), 90 % pour les mammifères (Garbutt, 1999), plus de 90 % pour les reptiles (Raxworthy, 2003) et 99 % pour les amphibiens (Glaw et al., 2003). Cependant, la superficie des forêts naturelles malgaches qui abritent la majorité de ces espèces, continue de décroître à cause de défrichement et/ou de la pratique de cultures itinérantes sur brûlis, des feux de brousse, de l’exploitation minière, de la production de bois d’énergie et de l’exploitation illégale de bois de construction (Barrett, 1999 ; McConnell, 2002 ; Blanc-Pamard et al., 2003 ; Styger et al., 2007). Selon Harper et al. (2007), le taux de déforestation annuel de la Grande Ile a été de 0,3 % de 1950 à 1970, de 1,7 % entre 1970 et 1990, et de 0,9 % à partir de 1990 jusqu’en 2000. Ce taux était de 0,3 % entre 2000 et 2005 (FAO, 2009).
2Dans les hautes terres centrales de Madagascar, les forêts naturelles sont rares et la forêt de tapia fait partie de ces rares exceptions (Barale, 2010), notamment grâce à sa résistance au feu (Léandri, 1957). La quantité et la qualité des produits forestiers de la forêt de tapia, comprenant les soies sauvages, les fruits comestibles, les champignons comestibles et le bois de chauffage, jouent un rôle important dans l'économie locale (Kull et al., 2005 ; Razafimanantsoa et al., 2012). De ce fait, la forte dépendance des communautés riveraines de la forêt a engendré des pressions et des menaces sur l’écosystème en question (Randrianarisoa et al., 2008). Les forêts de tapia ont perdu, au cours des dernières décennies, une proportion importante de leur superficie. Cette observation ne correspond pas à celles de Kull (2002), Kull (2003) et Kull et al. (2005) mentionnant la stabilité, voire l’augmentation, de la densité et de la couverture forestière de tapia, mais se base sur une analyse de photographies aériennes entre les années 1950 et 1990. Les bois de tapia sont des témoins dégradés de la forêt dense sclérophylle, réduite à l'unique espèce arborée Uapaca bojeri (Gade, 1985). En effet, avant l’intervention humaine, cette dernière n'était qu'une essence parmi les diverses essences qui composent la forêt dense sclérophylle (Gade, 1985) et leurs caractéristiques suggèrent que les feux réguliers favorisent sa dominance. Autrement dit, cette formation végétale est maintenue par les actions humaines (Kull et al., 2005), ce qui explique sa stabilité, voire localement l’augmentation de sa superficie. Cependant, Rajoelison et al. (2009) ont souligné la déforestation des forêts de tapia dans certaines régions de Madagascar entre 1990 et 2005. Pour les régions d’Itasy et d’Amoron’i Mania, les taux de déforestations annuels de la forêt de tapia sont respectivement de 3,26 % et 3,77 % entre 1990 et 2000, et de 7,41 % et 4,02 % entre 2000 et 2005 (Rajoelison et al., 2009), alors que celui de la Grande Ile, au cours de ces mêmes années, est de 0,3 % (FAO, 2009). Il est à noter que pour la région d’Itasy, les forêts de tapia représentent les derniers vestiges de la végétation forestière originelle (Barale, 2010). Nous tenons à mettre l’accent sur « végétation forestière originelle » car certains types de végétations herbeuses de marécage et de savane sont vraisemblablement aussi originelles (Bond et al., 2008).
3Bien que l’hypothèse de régression de la superficie forestière de tapia mérite d’être approfondie (Kull, 2002 ; Kull, 2003 ; Kull et al., 2005), la dégradation et la déforestation de la forêt de tapia demeurent une préoccupation majeure vu sa particularité et son importance. Dans ce cadre, cette contribution a l’ambition de synthétiser les informations concernant cet écosystème propre à Madagascar, dans le but d’affirmer la nécessité de sa gestion durable au profit de la population locale. L’approche principale a consisté en une compilation bibliographique, validée par des visites sur le terrain afin d’avoir une meilleure analyse de l’écosystème en question.
2. Localisation des forêts de tapia
4Selon Koechlin et al. (1974), la plus grande partie de la zone des pentes occidentales a été boisée en forêt de transition entre les forêts humides de l'est et les forêts sèches de l'ouest, et les forêts de tapia ont été limitées à des zones de sol peu nutritif ou de sol rocheux. De même, Burney (1997) a montré que la végétation ancienne des hautes terres malgaches est caractérisée par une mosaïque dynamique, avec des zones de savane arborée, de forêt rupicole et humide et de forêt sclérophylle.
5Les forêts de tapia sont les plus xérophytiques des forêts sempervirentes de Madagascar. Elles se localisent sur les pentes occidentales des hautes terres malgaches, où la saison sèche dure de 5 à 7 mois, avec une température moyenne annuelle oscillant entre 17 et 22 °C (Kull et al., 2005). Plus précisément, elles occupent les zones caractérisées par une altitude variant de 800 m à 1 600 m et par une précipitation moyenne annuelle comprise entre 900 mm et 1 400 mm (Gade, 1985). Les sites préférentiels présentent une orientation préservée de l’action des vents dominants du Sud-Est (Perrier de la Bâthie, 1921). Des conditions climatiques particulières ont été observées. Ainsi, Vignal (1963) a mentionné que la forte gelée du 18 au 22 aout 1956 a entrainé des dépérissements de tapia, en se basant sur une hypothèse émise par Aubréville (1957) suivant laquelle ces dépérissements avaient pour origine la présence de masses d’air froid dans les vallées. Ce phénomène se manifeste par le dessèchement des cimes et la présence de gourmands sur les branches les plus basses, ainsi que sur les rejets de souche.
6Les zones occupées par la forêt de tapia sont formées par des sites d'éboulis granitique, gneissique ou quartzitique, ou sur sol brut d'érosion (sols squelettiques à la roche mère, fragmentés sur place ou transportés sur une faible distance) (Koechlin et al., 1974). La superficie occupée par cette formation est estimée à 131 900 ha (Moat et al., 2007). Selon Kull et al. (2005), l'aire de sa distribution est divisée en quatre zones principales :
7– Imamo, formé par les districts d’Arivonimamo et de Miarinarivo,
8– Col des Tapia, se trouvant entre les districts d’Antsirabe et d’Ambositra,
9– Itremo, regroupant Ambatofinandrahana et la chaine d'Itremo,
10– Isalo, près de Ranohira (Figure 1).
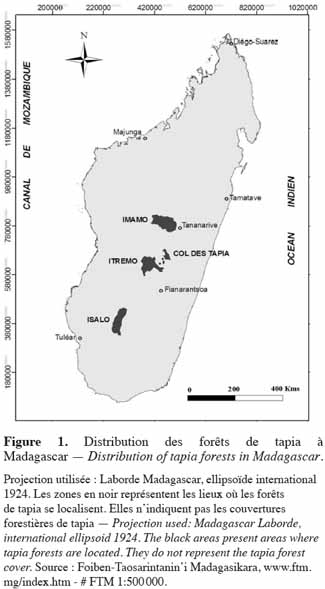
11Quelques lambeaux de tapia peuvent encore être observés entre la zone d’Itremo et le Col des Tapia.
3. Écologie de la forêt de tapia
3.1. La forêt de tapia
12Les peuplements de tapia sont des formations très ouvertes, qui sont parcourues fréquemment par les feux de brousse (Vignal, 1963), se présentant sous forme d’une forêt claire ou savane boisée (Rakoto-Ramiarantsoa, 1995). Selon la classification des formations végétales effectuée par Malaisse (1982), la savane boisée et la forêt claire se caractérisent respectivement par des surfaces terrières comprises entre 5 et 15 m2·ha-1 et entre 15 et 25 m2·ha-1. En effet, la quasi-totalité des forêts sclérophylles des hautes terres malgaches a fait l’objet de passages de feu et ne se présente plus alors que sous l’aspect de forêts claires : une strate arborée d’essences forestières clairsemées (Koechlin et al., 1974). Le couvert est principalement composé d’Uapaca bojeri, qui offre une grande résistance au feu par rapport aux autres espèces (Gade, 1985 ; Kull et al., 2005). En effet, son épaisse écorce, ses feuilles difficilement inflammables et sa capacité de se régénérer par rejet des souches forment des caractères typiques des arbres pyrophytes (Campbell, 1996). Cette caractéristique pyrophyte d’Uapaca bojeri mérite d’être confirmée car elle n’est pas encore prouvée scientifiquement (Figure 2).

13Uapaca bojeri se maintient souvent comme espèce dominante de la forêt, longtemps après que les autres espèces qui lui étaient associées aient disparu. Parmi ces dernières, celles qu’on trouve le plus fréquemment sont trois espèces de Sarcolaenaceae, à savoir Leptolaena pauciflora Baker, Leptolaena bojeriana (Baill.) Cavaco et Sarcolaena oblongifolia F.Gérard. Les autres espèces associées comprennent Asteropeia densiflora Baker (Asteropeiaceae), Agauria salicifolia (Lam.) Oliv. (Ericaceae), Weinmannia spp. (Cunoniaceae), Dodonaea madagascarensis Radlk. (Sapindaceae), Faurea forficulifera Baker (Proteaceae), Brachylaena microphylla Humbert (Asteraceae), Rhus taratana (Baker) H.Perrier (Anacardiaceae), Protorhus buxifolia H.Perrier (Anacardiaceae), Schefflera bojeri (Seem.) R.Vig. (Araliaceae), Alberta spp. (Rubiaceae) et Enterospermum spp. (Rubiaceae) (White, 1986).
14La forêt de tapia est une formation végétale sclérophylle, endémique et de taille réduite (Kull et al., 2005), en apparence similaire à la forêt de chêne-liège (Quercus suber L.) du bassin méditerranéen (White, 1986). Elle se présente sous forme d’une futaie et se caractérise par deux strates principales : une strate supérieure, formée de petits arbres tortueux, bas branchus et une strate inférieure, avec des arbustes et plantes suffrutescentes (Direction des Eaux et Forêts, 1996). Les espèces de sous-bois y sont très variées, telles Aphloia theiformis (Vahl) Benn. (Aploiaceae), Leptolaena sp. (Sarcolaenaceae), Erica sp. (Ericaceae), Aristida multicaulis Baker (Poaceae), Helichrysum gymnocephalum (DC.) Humb. (Asteraceae), Psiadia altissima (DC.) Drake (Asteraceae), Schefflera bojeri (Seem.) R.Vig. (Araliaceae) (Kull et al., 2005 ; Rakotoniaina, 2010).
15Le tableau 1 donne un ordre d’idées de la densité des individus ayant un diamètre à hauteur de poitrine supérieur ou égal à 5 cm dans la forêt de tapia.
3.2. Le tapia ou Uapaca bojeri
16Le genre afro-malgache Uapaca a été établi en 1858 par Baillon pour deux espèces malgaches. Il se distingue aisément au sein de la famille des Euphorbiaceae, telle que comprise au 20e siècle, par son port pachycaule, sa texture foliaire ainsi que par son capitule mâle globuleux et involucré. Les fleurs femelles sont également involucrées, mais solitaires ; les stigmates fréquemment laciniés peuvent enrober l’ovaire (Radcliffe-Smith, 1993). Ce genre relève aujourd’hui, selon le système APG III (Angiosperm Phylogeny Group III system), de la famille des Phyllanthaceae. Il comprend une soixantaine d’espèces distribuées en Afrique occidentale, orientale et australe ainsi qu’à Madagascar, où 12 espèces endémiques sont reconnues (Léandri, 1957 ; Kull et al., 2005). Aucune révision récente des espèces malgaches n’a été effectuée. Leur identification repose sur divers caractères, à savoir la longueur du fruit (18 à 20 mm), la présence ou l’absence d’un faux-pédoncule à la base du fruit, la texture du fruit (lisse ou à peine granuleux, verruqueux à verruculeux), ainsi que la présence éventuelle de côtes longitudinales sur le fruit, la forme du fruit, le pédoncule du fruit (longueur, articulation), le pétiole de la feuille, la morphologie du limbe, ainsi que le nombre de nervures secondaires, la présence ou l’absence de racines adventives à la base du tronc, la nature de l’écorce, enfin la sociabilité du taxon (pieds isolés ou en peuplements) (Léandri, 1957).
17Trois espèces malgaches sont bien connues des populations et possèdent des noms vernaculaires propres ; il s’agit de Uapaca thouarsii Baill. ou voampaka, Uapaca densifolia Baker ou paka et Uapaca bojeri Baill.
18Uapaca thouarsii est un arbre de 10 à 20 m de hauteur, à cône de racines adventives partant de la base du tronc. Les feuilles sont cireuses-visqueuses, à pétiole de 2 à 4 cm de long, renflé et coudé vers le sommet. Cette essence est observée dans les forêts humides sempervirentes.
19Uapaca densifolia est un petit arbre de 6 à 10 m de hauteur, à racines adventives, à feuilles subsessiles à brièvement pétiolées, étroites, pouvant atteindre 6 à 8,5 cm de long et 3 cm de large.
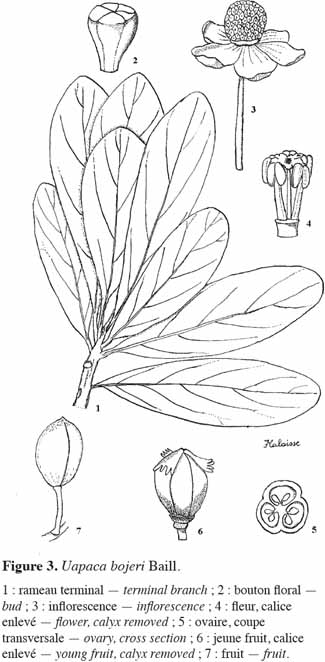
20Appelée localement sous divers noms, à savoir hazondandy (merina, betsileo, ancien), tapia (merina, betsileo, bara), voampaka (betsileo), voantapia (betsileo), U. bojeri peut atteindre 9 à 12 m de hauteur. C’est une essence sempervirente, sclérophylle, héliophile (Koechlin et al., 1974) et pyrophyte (Gade, 1985). Elle ne possède pas de racine adventive et croît en peuplements. Sa cime présente un aspect sphérique, rappelant quelque peu celle de l’olivier (Vignal, 1963). À l’état isolé, le fût est vertical, mais la plupart des arbres présentent des fûts tortueux. L’écorce du tronc est très épaisse (1,5 à 2 cm) et crevassée. Le tronc peut atteindre 60 cm de diamètre à hauteur de poitrine (Kull et al., 2005). Les feuilles sont alternes, subsessiles ou à pétiole atteignant 1 cm ; à l’extrémité des rameaux, elles sont dressées et disposées en spirales serrées (Cabannis et al., 1969). Le limbe est simple, entier, obovale-spatulé, coriace, vert foncé au-dessus, plus clair en dessous, de plus ou moins 9 x 4 cm, longuement atténué à la base. Il est parfois couvert de glandes crevant à maturité et laissant sur le sec un dépôt pruineux-résineux (Léandri, 1957). Les nervures secondaires sont peu saillantes. Les inflorescences mâles sont axillaires, leur pédoncule peut atteindre 2 cm de long ; la fleur est sous-tendue par 6 à 8 bractées, les externes ovales, les internes orbiculaires ; le calice est à lobes courts. Les inflorescences femelles sont subsessiles, à ovaire à 3 loges. Le style est bi- ou trifurqué. Les fruits sont des drupes obovoïdes, oblongues, arrondies, à côtes plus ou moins saillantes, de 20-30 x 18-20 mm. Les drupes sont vertes ou jaunes sur l’arbre ; elles deviennent brunes lorsqu’elles sont mûres et tombent au sol. Les sépales sont plus ou moins ciliés sous le fruit. Les graines atteignent 18 mm de long (Figure 3).
4. Multifonctionnalité de la forêt de tapia
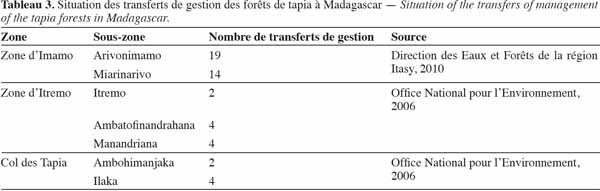
21Les espaces forestiers ont des fonctions multiples : ils peuvent être source de revenus (production de bois et de produits forestiers non ligneux) ; ils jouent également des rôles socio-culturels et écosystémiques. La forêt de tapia contribue à environ 7 % de l'économie monétaire locale (Kull et al., 2005). Il convient de noter que les observations formulées ci-dessous par Blanc-Pamard et al. (2003) et Minten et al. (2003) portent sur les forêts de Madagascar en général et non uniquement sur les forêts de tapia.
4.1. Le bois de tapia
22L’utilisation de bois comme source d’énergie domestique est très courante dans les zones rurales malgaches. En effet, plus de 70 % du total de la consommation en énergie de la Grande Ile est assurée par les ligneux (Intercoopération, 2009), mais essentiellement par des essences de reboisement telles que l’eucalyptus. L’usage de bois de tapia comme source d’énergie domestique (bois de chauffe, charbon de bois) est fréquent dans la région riveraine. Pour le Col des Tapia, 92 % des familles se procurent au moins une partie de leur bois de chauffage dans la forêt de tapia (Kull et al., 2005). La commercialisation du bois de chauffe est relativement faible, environ 86 % des ménages collectent eux-mêmes leur bois de chauffe. Il semble par contre que le charbon de bois est principalement destiné à la commercialisation dans certaines regions, étant donné qu’il est plus dense et plus facile à transporter que le bois de chauffe (Minten et al., 2003). De plus, ce combustible est mieux adapté aux contraintes de la cuisine urbaine malgache avec la généralisation du réchaud à charbon (fatapera) (Blanc-Pamard et al., 2003).
23L’exploitation de la forêt à Madagascar est essentiellement destinée à couvrir les usages domestiques (Minten et al., 2003). Dans certaines régions, les populations qui vivent à proximité de ces formations utilisent aussi le bois de tapia comme matériel de construction pour leur maison (échelles, piliers de véranda), comme matériel et accessoire d’usage quotidien (pilon, rambaramba [sorte de brouette]) ainsi que pour les poteaux de clôture des bétails (Intercoopération, 2009).
4.2. Les vers à soie sauvage
24La sériciculture malgache repose sur deux types de ver : les vers à soie domestiques qui sont nourris à partir des feuilles de mûriers et les vers à soie sauvages qui prolifèrent sur des arbres, notamment le tapia (Vestalys et al., 2008). En effet, le tapia constitue à la fois la plante-hôte et le biotope du ver à soie landibe ou Borocera cajani (Boisduval) (Gade, 1985).
25Les vers à soie sont des insectes à métamorphoses complètes (holométaboles) : de l’œuf à l’insecte parfait, ils passent par l’état de larve ou chenille, celui de chrysalide ou nymphe à l’intérieur du cocon et enfin le stade imago ou papillon (Costa, 2004). Le papillon femelle pond en une seule fois de 350 à 750 œufs et meurt. La chenille présente cinq stades larvaires où sa taille passe d’environ 8 mm (stade 1) à 120 mm de long (stade 5), en 51 à 77 jours. Le nombre de générations est de 2 à 3 selon les conditions climatiques et, par conséquent, il varie d’une région à une autre (Rakotoniaina, 2010). Dans les régions centrales malgaches, on peut avoir deux générations dans l’année : une génération en saison chaude issue des œufs qui éclosent vers le mois de novembre, la récolte des cocons ayant lieu vers les mois de février-mars, et une génération en saison froide qui débute vers mi-février et/ou au début mars permettant une récolte vers les mois de juillet-aout.
26L’exploitation de la soie sauvage remonte à une période bien antérieure à celle de l’introduction du bombyx du mûrier (Costa, 2004). La valorisation de la première ressource comprend un ensemble de stades allant de la collecte de cocons de vers à soie sauvages, passant par une transformation artisanale, jusqu’à la commercialisation aux niveaux national et international (Razafindrakoto, 2007). La filière soie sauvage fait partie des activités complémentaires génératrices de revenus non négligeables pour les riverains des forêts de tapia à Madagascar (Rakotoniaina, 2010). Si la soie est traditionnellement utilisée pour le tissage des linceuls (ou lambamena), de vêtements d’apparat des nobles, de nombreux stylistes de mode œuvrent de nos jours pour la valorisation de cette matière, notamment dans des créations destinées à l’exportation (Razafindrakoto, 2007), telles écharpes, nappes de table et dessus de lit (Vestalys et al., 2008). La majorité de la soie commercialisée vient de la zone d'Isalo ; la zone d'Itremo y contribue aussi, mais la production de landibe en zone d'Imamo a baissé depuis 1960 (Razafintsalama et al., 1999).
4.3. Autres produits forestiers non ligneux
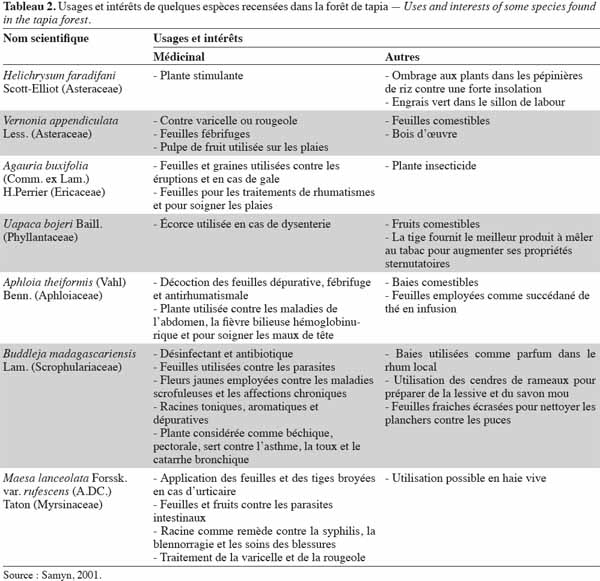
27Les forêts peuvent produire une variété de produits autres que le bois utiles aux populations (Minten et al., 2003). Le tapia produit de grandes quantités de petits fruits juteux qui sont commercialisés depuis plus de 200 ans (Kull et al., 2005). Les fruits de tapia sont destinés également à la fabrication de boissons alcoolisées et l’écorce de l’arbre est utilisée dans le cas de dysenterie (Cabannis et al., 1969). Par ailleurs, la forêt de tapia abrite également des champignons comestibles, notamment des Cantharellus spp. et des Russula spp., deux genres ectomycorhiziens. Sur le plan faunistique, des hérissons tels que Echinops telfairi (Martin), Setifer setosus (Schreber) et des tenrecs notamment Tenrec ecaudatus (Schreber) peuvent y être trouvés et sont chassés pour leur viande, ainsi que des lépidoptères comme l’espèce Antherina suraka (Boisduval) dont les chenilles sont collectées, consommées et quelquefois commercialisées (Kull et al., 2005). Le tableau 2 nous renseigne sur les usages et les intérêts apportés par les différentes plantes rencontrées dans la forêt de tapia.
4.4. Fonctions écosystémiques
28Les forêts de tapia ont des fonctions écosystémiques importantes (Rabetaliana et al., 2003). Elles contribuent à la protection du sol contre l’érosion, au maintien de l’environnement à proximité des cultures et des habitations, à la régulation du cycle de l’eau par le phénomène de rétention et d’évapotranspiration (Rajoelison et al., 2009). La forêt de tapia forme également un habitat préférentiel pour certains animaux (hérissons, vers à soie). Uapaca bojeri constitue la principale plante nourricière des vers à soie sauvages (Gade, 1985).
29D’un point de vue global, les forêts tropicales contiennent 37 % du carbone des forêts mondiales (Lescuyer et al., 1999). Faisant partie de la forêt tropicale, la forêt de tapia contribue donc à ralentir ou atténuer le réchauffement climatique. Cette argumentation est valable lorsque l’on accepte l’hypothèse que les forêts de tapia diminuent en superficie. Les forêts permettent de séquestrer le carbone dans leur biomasse végétale puis dans le sol. La biomasse épigée de la forêt de tapia est estimée à 20 t·ha-1 correspondant à 10 t·ha-1 de stock de carbone (Rajoelison et al., 2009).
4.5. Fonctions socio-culturelles
30Les forêts de tapia jouent également des rôles socio-culturels. Elles constituent des lieux de récréation pour les populations riveraines, pour les touristes ou les différents acteurs de développement qui travaillent dans la zone. Une croyance villageoise se rattache aussi à la forêt de tapia, la cueillette des fruits sur pied demeure un tabou, on ne peut récolter que ceux tombés sur la terre (Kull et al., 2005). Selon les croyances locales, si on cueille les fruits encore sur l’arbre, un malheur va frapper le village, comme par exemple une chute de grêle conduisant à la destruction des cultures.
5. Facteurs de transformation et de dégradation
31À Madagascar, les causes de la déforestation sont multiples, telles la pratique de l’agriculture sur brûlis (Barrett, 1999), la conversion de la forêt en pâturage (McConnell, 2002), la surexploitation des bois via la production de charbon de bois, les collectes excessives des produits forestiers non ligneux, enfin les problèmes fonciers. Ces causes sont étroitement liées à la pression démographique (McConnell, 2002), ainsi qu’à la pauvreté (Zeller et al., 1999).
32Le feu de brousse constitue un des facteurs de dégradation des massifs de tapia (Rabarison et al., 2010). Bien que les arbres tolèrent le feu, les feux répétés peuvent les détruire et dégradent la capacité de régénération des tapia (Gade, 1996). Les hautes terres malgaches font partie des zones les plus touchées par ces feux de brousse (Otsuka et al., 2003). Les feux ont des rôles importants dans la vie des paysans (Kull, 2003; Kull, 2004). Ils sont utilisés pour le nettoiement des terrains de culture. Les feux assurent également la présence de l’herbe, évitant ainsi l’assèchement du pâturage. En effet, les feux de brousse de la saison sèche détruisent les plantes ligneuses, exposent le sol au soleil et fertilisent les nouvelles pousses d’herbe lorsque les pluies arrivent. Cependant, le renouvellement du pâturage et le défrichement ou le nettoyage de parcelles de culture non contrôlés (absence de pare-feux) constituent l’origine des feux de brousse (Minten et al., 2003). Ils peuvent également provenir des meules de charbon de bois mal surveillées (Otuska et al., 2003). Dans certains cas, les voleurs de zébus (appelés localement dahalo) utilisent les feux pour se protéger contre la population qui se lance à leur poursuite ou, à l’inverse, la population met les feux aux forêts car ces feux leur permettent de mieux apercevoir les dahalo et, par voie de conséquence, les aident à se protéger contre leurs attaques (Minten et al., 2003).
33La surexploitation du bois de chauffage fait partie des causes de dégradation de la forêt de tapia (Intercoopération, 2009). La technique de production repose sur une carbonisation lente des bois alignés et mis en tas, la meule étant complètement recouverte de paille et de terre. Elle exige donc l'abattage d'arbres, ce qui entraine une réduction de la couverture ligneuse. L’importance de la production de charbon de tapia dépend de plusieurs facteurs, notamment la praticabilité des pistes, la distance du lieu de production au marché d’écoulement des produits, et l’existence d’autres plantations forestières (Intercoopération, 2009). En effet, le tapia se substitue aux espèces de reboisement à croissance rapide, telles que l’Eucalyptus sp. (Carrière et al., 2007).
34En tout état de cause, cette activité rémunératrice repose sur l'assurance d'un débouché car la demande urbaine est importante. Les besoins énergétiques pour la cuisson domestique des Malgaches sont couverts à plus de 97 % par le bois d’énergie, les urbains utilisant essentiellement le charbon de bois d’eucalyptus (Blanc-Pamard et al., 2003).
35À Madagascar, l’agriculture représente l’activité principale des populations rurales dont 73,5 % vivent encore en dessous du seuil de pauvreté (Ramohavelo, 2009). Avec une pression démographique accrue, une saturation foncière des terres les plus fertiles, les espaces forestiers sont menacés d’être convertis en superficies agricoles (Blanc-Pamard et al., 2003). Cette situation est également observée dans les forêts de tapia. Les communautés riveraines des forêts de tapia ne disposent que de très peu de terrains agricoles, aussi bien dans les bas-fonds que sur les versants (Randrianarisoa et al., 2008). Les terrains forestiers de tapia convertis sont affectés aux cultures de manioc, de haricot, de maïs, d’ananas, etc. (Intercoopération, 2009).
36Actuellement, l’envahissement par les espèces introduites comme Pinus sp. et Eucalyptus sp. constitue une autre menace sur la forêt de tapia (Kull et al., 2005). La plantation d’eucalyptus et de pin dans les espaces vides dans la forêt de tapia marque le début de la conquête des terrains cultivables (Intercoopération, 2009 ; Kull et al., 2012). Le choix de ces deux espèces repose sur le fait qu’elles présentent une haute capacité d’adaptation à différentes conditions bioclimatiques (Chaix et al., 2001). En effet, les eucalyptus et les pins peuvent être plantés sur ces savanes, qui sont en abondance sur les hautes terres malgaches (Trouve et al., 1996). Ces plantations satisfont aux enjeux de production de bois de chauffage (Chaix et al., 2001). Cependant, ces espèces introduites, de tempérament héliophile à croissance rapide (Carrière et al., 2007), ont la capacité de changer les micro-habitats, y compris la qualité du sol, pouvant défavoriser les espèces endémiques, notamment le tapia (Kull et al., 2005).
6. Gestion communautaire de la forêt de tapia
37Face à la dégradation continuelle des ressources, les stratégies politiques forestières malgaches cherchent à proposer un aménagement multifonctionnel des espaces forestiers qui combine la conservation de la biodiversité et l’amélioration des conditions de vie des populations locales (Buttoud, 1995 ; Ramohavelo, 2009). De ce fait, deux dispositifs de gestion des ressources forestières sont aujourd’hui présents à Madagascar : les contrats dits GELOSE (GEstion LOcale SEcurisée) et les contrats dits GCF (Gestion Contractuelle des Forêts).
38Les contrats GELOSE sont établis selon la loi 96-025 dite loi GELOSE, qui régit tous les contrats de transfert de gestion des ressources naturelles renouvelables à Madagascar. L’objectif d’un transfert de gestion est de « permettre la participation effective des populations rurales à la conservation durable des ressources naturelles renouvelables […] comprises dans les limites de leur terroir » (République de Madagascar, 1996). Il s’agit d’un processus dans lequel la gestion (exploitation et préservation) des ressources naturelles d’une propriété domaniale est transférée de l’administration des Eaux et Forêts à une association locale dénommée Communauté locale de Base (COBA) ou Vondron’ Olona Ifotony regroupant les exploitants des ressources naturelles (République de Madagascar, 2002). Le contrat GELOSE est tripartite : la COBA, la collectivité territoriale décentralisée (la commune) et le service technique des Eaux et Forêts sont les signataires du contrat. Le contrat est composé de plusieurs éléments : le contrat de transfert de gestion en lui-même, le plan d'aménagement et de gestion simplifié, le cahier des charges de la gestion des ressources, le statut de la COBA et le dina qui lie les membres de la COBA et qui régit le transfert de gestion. Ces documents doivent tous être approuvés avant que le contrat puisse être agréé par l'État (Randrianarison et al., 2010).
39La deuxième catégorie de contrats repose sur le décret GCF. Ce décret (2001/122) a été élaboré de 1999 à 2001 (Observatoire National de l’Environnement et du Secteur forestier, 2010). La loi GELOSE présentait des modes opérationnels complexes, notamment l’obligation d’utiliser un médiateur environnemental ou de faire suivre le transfert de gestion par une opération de sécurisation foncière, et il convenait de la simplifier. Le décret GCF est la traduction de ces réflexions propres au secteur forestier. Il reprend une partie des processus règlementaires GELOSE tout en les simplifiant.
40Les forêts de tapia sont depuis longtemps officiellement déclarées comme propriété de l'État (Kull et al., 2005). Mais après l’apparition de la loi GELOSE en 1996, ainsi que du décret GCF, la gestion de la majorité des forêts de tapia a été transférée à la COBA (Tableau 3).
41Il est à noter que la forêt de tapia de l’Isalo fait partie intégrante du Parc National de l’Isalo. De ce fait, sa gestion ne sera pas transférée aux communautés locales de base.
7. Conclusion
42La forêt de tapia, dominée par U. bojeri, est une formation végétale sclérophylle, endémique à Madagascar. Elle représente les derniers vestiges de la végétation forestière primaire des hautes terres malgaches. La quantité et la qualité des produits forestiers de tapia, notamment la soie sauvage, les fruits comestibles, les champignons et le bois de chauffe, jouent un rôle principal et important dans l'économie locale par l’apport de revenus d’appoint dans les ménages. La forêt de tapia joue également des rôles écosystémiques. Cependant, des pressions et des menaces anthropiques pèsent actuellement sur cette formation végétale, dues aux feux de brousse, à la production illicite de bois de chauffe, à la collecte excessive d’autres produits forestiers non ligneux et à l’envahissement des espèces exotiques de reboisement. Cette anthropisation peut mettre en péril la continuité et le maintien des rôles que tient la forêt de tapia : la survie et la reproduction des espèces qu’elle renferme ne seront plus assurées. De ce fait, la gestion et la protection de la forêt de tapia sont d’intérêts primordiaux. Cette gestion, qui peut être participative avec la communauté locale, doit se baser sur une exploitation rationnelle de la forêt. Cette dernière peut conduire d’une part à l’amélioration du bien-être de la population riveraine de la forêt (par exemple, à travers la redynamisation de la filière soie) et d’autre part, à la conservation de la biodiversité (telle le ver à soie endémique de Madagascar).
Bibliographie
Aubréville A., 1957. Accord à Yangambi sur la nomenclature des types africains de végétation. Bois For. Trop., 51, 23-27.
Baillon H., 1958. Étude générale du groupe des Euphorbiacées. Paris : V. Masson.
Barale C., 2010. Madagascar : protection et reboisement de tapia dans la région d’Itasy. Paris : Planète Urgence, http://www.infosdelaplanete.org, (03/08/2010).
Barrett C.B., 1999. Stochastic food prices and slash-and-burn agriculture. Environ. Dev. Econ., 4(2), 161-176.
Blanc-Pamard C. & Rakoto Ramiarantsoa H., 2003. Madagascar : les enjeux environnementaux. In : Lesourd M. L’Afrique. Vulnérabilité et défis. Nantes, France : Éditions du Temps, 354-376.
Bond W.J., Silander Jr. J.A., Ranaivonasy J. & Ratsirarson J., 2008. The antiquity of Madagascar's grasslands and the rise of C4 grassy biomes. J. Biogeogr., 35, 1743-1758.
Burney D.A., 1997. Theories and facts regarding Holocene environmental change before and after human colonization. In: Patterson B.D. & Goodman S.M., eds. Natural and human induced change in Madagascar. Washington: Smithsonian Press, 75-89.
Buttoud G., 1995. La forêt et l’État en Afrique sèche et à Madagascar. Paris : Karthala.
Cabannis Y., Chabouis L. & Chabouis F., 1969. Végétaux et groupements végétaux de Madagascar et des Madascareignes. Vol I. Antananarivo : Bureau pour le Développement de la Production Agricole (BDPA).
Campbell B., 1996. The Miombo in transition: woodlands and welfare in Africa. Bogor, Indonesia: Center for International Forestry Research.
Carrière S.M. & Randriambanona H., 2007. Biodiversité introduite et autochtone : antagonisme ou complémentarité ? Le cas de l’eucalyptus à Madagascar. Bois For. Trop., s292(2), 5-21.
Chaix G. & Ramamonjisoa L., 2001. Production de semences pour les reboisements malgaches. Bois For. Trop., 269(3), 49-63.
Costa, 2004. Manuel technique de sériciculture. Vol. 2 : Élevage des vers à soie. Programme soie. Antananarivo : ONUDI Madagascar.
Direction des Eaux et Forêts, 1996. Inventaire écologique forestier national. Rapport. République de Madagascar. Antananarivo : Direction des Eaux et Forêts.
Direction des Eaux et Forêts de la région Itasy, 2010. Rapport de travail 2010. Miarinarivo, Madagascar : Direction des Eaux et Forêts de la région Itasy.
FAO, 2009. Situation des forêts du monde 2009. Rome : FAO.
Gade D.W., 1985. Savanna woodland, fire, protein and silk in highland Madagascar. J. Ethnobiol., 5(2), 109-122.
Gade D.W., 1996. Deforestation and its effects in highlands Madagascar. Mt Res. Dev., 16(2), 101-116.
Garbutt N., 1999. Mammals of Madagascar. NewHaven, CT, USA: Yale University Press.
Gautier L. & Goodman S.M., 2003. Introduction to the flora of Madagascar. In: Goodman S.M. & Benstead J.P., eds. The natural history of Madagascar. Chicago, IL, USA: University of Chicago Press, 229-250.
Glaw F. & Vences M., 2003. Introduction to amphibians. In: Goodman S.M. & Benstead J.P., eds. The natural history of Madagascar. Chicago, IL, USA: University of Chicago Press, 883-898.
Green G.M. & Sussman R.W., 2004. Deforestation history of the eastern rain forests of Madagascar from satellites images. Science, 248(4952), 212-215.
Groupe des Spécialistes des Plantes de Madagascar, 2011. Liste rouge des plantes vasculaires endémiques de Madagascar. Antananarivo : Groupe des Spécialistes des Plantes de Madagascar.
Harper G.J. et al., 2007. Fifty years of deforestation and forest fragmentation in Madagascar. Environ. Conserv., 34(4), 325-333.
Hawkins A.F.A. & Goodman S.M., 2003. Introduction to the birds. In: Goodman S.M. & Benstead J.P., eds. The natural history of Madagascar. Chicago, IL, USA: University of Chicago Press, 1019-1044.
Intercoopération, 2009. Ligne de référence, site tapia Itasy, aspect socio-économique. Antananarivo : Projet REDD-FORECA/ Intercoopération.
Koechlin J., Guillaumet J. & Morat P., 1974. Flore et végétation de Madagascar. Vaduz : Ed. J. Cramer.
Kull A.C., 2002. Madagascar’s burning issue : the persistent conflict over fire. Environment, 44(3), 8-19.
Kull C.A., 2003. Uapaca woodlands. In: Goodman S.M. & Benstead J.P., eds. The natural history of Madagascar. Chicago, IL, USA: University of Chicago Press, 393-398.
Kull C.A., 2004. Isle of fire: the political ecology of landscape burning in Madagascar. Chicago, IL, USA: University of Chicago Press.
Kull C.A., Ratsirarson J. & Randriamboavonjy G., 2005. Les forêts de tapia des hautes terres malgaches. Terre Malgache, 24(2), 22-58.
Kull C.A. et al., 2012. The introduced flora of Madagascar. Biol. Invasions, 14, 875-888.
Léandri J., 1957. Sur quelques témoins de la végétation primitive du versant occidental des hauts plateaux malgaches (partie centrale). Bull. Jardin Bot. État Bruxelles, 27(2), 209-216.
Lescuyer G. & Locatelli B., 1999. Rôle et valeur des forêts tropicales dans le changement climatique. Bois For. Trop., 260(2), 5-17.
Malaisse F., 1982. Comparison of the woody structure in a regressive Zambezian succession: dry evergreen forest – open forest – wooded savana (Luiswishi, Shaba, Zaire). Geo-Eco-Trop, 6(4), 309-350.
McConnell, 2002. Madagascar: emerald isle or paradise lost? Environment, 44(8), 10-22.
Minten B. & Moser C., 2003. Forêts : usages et menaces sur une ressource. In : Minten B., Randrianarisoa J.-C. & Randrianarison L., éds. Agriculture, pauvreté rurale et politiques économiques à Madagascar. Ithaca, NY, USA: Cornell University.
Moat J. & Smith P., 2007. Atlas de la végétation de Madagascar. Kew, UK: Royal Botanic Gardens.
Myers N. et al., 2000. Biodiversity hotspots for conservation priorities. Nature, 403(6772), 853-858.
Observatoire National de l’Environnement et du Secteur Forestier, 2010. Loi forestière et texte d’application. Antananarivo : ONESF, http://www.osf.mg/loi-application.php (28/11/2011).
Office National pour l’Environnement, 2006. Profil environnemental de la région Amoron’i Mania. ONE/MO/DOC/31/AIM. Antananarivo : Office National pour l’Environnement.
Otsuka M., Razafimahatratra M. & Andrianandrasana, 2003. Manuel sur la lutte contre les feux de vegetation : compilation du savoir-faire actuel. Antananarivo : Ministère de l’Environnement, des Eaux et Forêts & Agence japonaise de Coopération Internationale.
Perrier de la Bâthie H., 1921. La végétation malgache. Ann. Musée Colonial Marseille, Sér.3, 9, 1-266.
Rabarison H., Rajeriarison C., Birkinshaw C. & Lowry P., 2010. Résilience des plantules de tapia (Uapaca bojeri) et de quelques espèces ligneuses associées face au feu, en vue de leur réintroduction et du renforcement des populations menacées dans le massif d’Ibity. Poster pour le Colloque National d’Écologie Scientifique 2010, 2-4 septembre 2010, Corum, Montpellier, France, http://www.ecologie2010.fr/gescolloque/lesactes/resume.php?ids=168, (10/08/2010).
Rabetaliana H., Bertrand A., Razafimamonjy N. & Rabemananjara E., 2003. Dynamique des forêts naturelles de montagne à Madagascar. Bois For. Trop., 276(2), 59-72.
Radcliffe-Smith A., 1993. Notes on African Euphorbiaceae XXIX: Uapaca. Kew Bull., 48(3), 611-617.
Rajoelison L.G. et al., 2009. Inventaire de biomasse dans les forêts de tapia. Régions Itasy (Miarinarivo) et Amoron’i mania (Ambatofinandrahana)-Madagascar. Rapport final. Antananarivo : Projet FORECA/REDD.
Rakoto-Ramiarantsoa H., 1995. Clair de la terre, œil de l’eau : paysanneries et recompositions des campagnes en Imerina (Madagascar). Thèse de doctorat : Université Paris X-Nanterre (France).
Rakotoniaina N.S., 2010. Vers une démarche de gestion durable des ressources de la forêt sclérophylle de moyenne altitude d’Arivonimamo II-Madagascar. Thèse de doctorat : École Supérieure des Sciences Agronomiques, Université d’Antananarivo (Madagascar).
Ramohavelo D.C., 2009. Stratégies villageoises pour la gestion des paysages forestiers du Menabe Central, Madagascar. Thèse de doctorat : Faculté Environnement naturel, architectural et construit, École Polytechnique Fédérale de Lausanne (Suisse).
Randrianarisoa A., Raharinaivosoa E. & Kollf H.H., 2008. Des effets de la gestion forestière par les communautés locales de base à Madagascar : cas d’Arivonimamo et de Merikanjaka dans les hautes terres malgaches. In : Atelier sur la décentralisation et la gouvernance forestière, 8-11 avril 2008, Durban, Afrique du Sud. Durban, Afrique du Sud : International Convention Center.
Randrianarison M. & Karpe P., 2010. Le contrat comme outil de gestion des ressources forestières. TALOHA, 19, http://www.taloha.info/document.php?id=887, (28/11/2011).
Raxworthy C.J., 2003. Introduction to the reptiles. In: Goodman S.M. & Benstead J.P., eds. The natural history of Madagascar. Chicago, IL, USA: University of Chicago Press, 934-949.
Razafimanantsoa T.M. et al., 2012. Silk moths in Madagascar: a review of the biology, uses and challenges related to Borocera cajani (Vinson, 1863) (Lepidoptera: Lasiocampidae). Biotechnol. Agron. Soc. Environ., 16(2), 269-276.
Razafindrakoto T.E., 2007. La valorisation des ressources naturelles pour le développement local. In : Madagascar face aux enjeux du developpement durable. Paris : Karthala, 259-276.
Razafintsalama A.S. & Gautschi M., 1999. Étude des structures socio-organisationnelles des villages pour l'identification et la formalisation d'un organe de gestion, dans le processus de transfert de gestion de la forêt de tapia (Uapaca bojeri) dans la région d'Arivonimamo. Rapport final de stage. Antananarivo : Intercoopération, Projet FDP, ESSA/Forêts ; Zurich, Suisse : EPF.
République de Madagascar, 1996. Loi n°96/025 du 30 septembre 1996 relative à la gestion locale des ressources renouvelables. Antananarivo : Ministère de l’Environnement, des Eaux et Forêts, http://www.droit-afrique.com/images/textes/Madagascar/Mada-Loi gestion ressources naturelles renouvelables.pdf, (28/11/2011).
République de Madagascar, 2002. Loi forestière et textes d’applications. Antananarivo : Ministère de l’Environnement, des Eaux et Forêts.
Samyn J.M., 2001. Plantes utiles des hautes terres de Madagascar II. Saint-Denis, Ile de la Réunion : Petit-Jean (Ed.).
Styger E. et al., 2007. Influence of slash-and-burn farming practices on fallow succession and land degradation in the rainforest region of Madagascar. Agric. Ecosyst. Environ., 119, 257-269.
Trouve C., Mariotti A., Schwartz D. & Guillet B., 1996. Soil organic carbon dynamics under eucalyptus and pinus planted on savannas in the Congo. Soil Biol. Biochem., 26(2), 287-295.
Vestalys H. & Andrianarivelo A.M.S., 2008. Analyse de la filière soie dans les régions Analamanga, Itasy et Haute Matsiatra. Programme de soutien aux pôles de micro-entreprises rurales et aux économies régionales (PROSPERER). Antananarivo : Ministère de l’Agriculture, de l’Élevage et de la Pêche.
Vignal Z., 1963. Les phénomènes de météorologie dynamique et la disparition des formations forestières malgaches d’altitude. Bois For. Trop., 89, 31-35.
White F., 1986. La végétation de l’Afrique : mémoire accompagnant la carte de végétation de l’Afrique. Vol. 20. Paris : Unesco/AETFAT/UNESCO/UNSO.
Zeller M. et al., 1999. Rural development in Madagascar: Quo vadis? Towards a better understanding of the critical triangle between economic growth, poverty alleviation and environmental sustainability. Q. J. Int. Agric., 2.
Om dit artikel te citeren:
Over : Olivia Lovanirina Rakotondrasoa
Université d’Antananarivo. École Supérieure des Sciences Agronomiques. Département des Eaux et Forêts. BP 175. Antananarivo (Madagascar). E-mail : olivia.rakotondrasoa@yahoo.fr
Over : François Malaisse
Univ. Liège - Gembloux Agro-Bio Tech. Unité Biodiversité et Paysage. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Over : Gabrielle Lalanirina Rajoelison
Université d’Antananarivo. École Supérieure des Sciences Agronomiques. Département des Eaux et Forêts. BP 175. Antananarivo (Madagascar).
Over : Tsiresy Maminiaina Razafimanantsoa
Université d’Antananarivo. Faculté des Sciences. Département de Biologie, Écologie et Conservation animales. BP 906. Antananarivo (Madagascar).
Over : Misha Ratsimba Rabearisoa
Université d’Antananarivo. École Supérieure des Sciences Agronomiques. Département des Eaux et Forêts. BP 175. Antananarivo (Madagascar).
Over : Bruno Salomon Ramamonjisoa
Université d’Antananarivo. École Supérieure des Sciences Agronomiques. Département des Eaux et Forêts. BP 175. Antananarivo (Madagascar).
Over : Noromalala Raminosoa
Université d’Antananarivo. Faculté des Sciences. Département de Biologie animale. BP 906. Antananarivo (Madagascar).
Over : François J. Verheggen
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Over : Marc Poncelet
Univ. Liège. Institut des Sciences humaines et sociales. Place du XX Août, 7. B-4000 Liège (Belgique).
Over : Éric Haubruge
Univ. Liège - Gembloux Agro-Bio Tech. Unité d’Entomologie fonctionnelle et évolutive. Passage des Déportés, 2. B-5030 Gembloux (Belgique).
Over : Jan Bogaert
Univ. Liège - Gembloux Agro-Bio Tech. Unité Biodiversité et Paysage. Passage des Déportés, 2. B-5030 Gembloux (Belgique).






