- Startpagina tijdschrift
- Volume 18 (2014)
- Numéro 1
- Synthèse bibliographique de l’influence du procédé d’extraction et de purification sur les caractéristiques et les propriétés d’une gomme de caroube
Weergave(s): 0 (0 ULiège)
Download(s): 0 (0 ULiège)
Synthèse bibliographique de l’influence du procédé d’extraction et de purification sur les caractéristiques et les propriétés d’une gomme de caroube

Nota's van de redactie
Reçu le 8 février 2013, accepté le 20 aout 2013
Résumé
Le caroubier est une essence cultivée pour ses graines dans le bassin méditerranéen. Ces graines contiennent un endosperme riche en galactomannanes très prisé, notamment par l’industrie agro-alimentaire, pour ses propriétés texturantes. Après récolte, les graines subissent une décutilation et une dégermination. Les endospermes ainsi nettoyés sont ensuite broyés pour donner la gomme de caroube brute. L’étape de purification consiste en une solubilisation de la farine et une précipitation des galactomannanes. Cette étape influence particulièrement les caractéristiques de la gomme obtenue. La température de solubilisation est le paramètre qui impacte le plus sur les caractéristiques finales du produit. Elle permet, selon qu’elle soit faible ou élevée, de sélectionner des galactomannanes de caractéristiques structurales différentes, qui présenteront de ce fait des propriétés physiques fort différentes en solutions aqueuses.
Abstract
Review of the influence of the extraction and purification process on the characteristics and properties of locust bean gum. The carob tree is a species cultivated for its seeds in Mediterranean countries. These seeds contain an endosperm rich in galactomannans, which are used by the food industry for their texturing properties. After harvesting, the seeds pass through a decutilation and a degermination process. Cleaned endosperms are then milled to give crude locust bean gum. The purification step consists of solubilization of the flour followed by precipitation of the galactomannans. Purification influences the characteristics of the resulting gum. The solubilization temperature is the parameter that has the greatest effect on the final characteristics of the product. Depending on whether the solubilization temperature is hot or cold, galactomannans with different structural characteristics (and thus with very different physical properties in aqueous solutions) will be selected.
Inhoudstafel
1. Introduction
1Le caroubier ou Ceratonia siliqua L., de la famille des Caesalpiniaceae, est un arbuste dioïque à feuilles persistantes et de croissance lente (Biner et al., 2007 ; Bouzouita et al., 2007). C’est une essence thermophile cultivée en climat méditerranéen, mais originaire des pays arabes (Petit et al., 1995). On le retrouve dans la région méditerranéenne, principalement en Espagne, en Italie, en Grèce, au Portugal et au Maroc (Biner et al., 2007 ; Dakia et al., 2008). Le caroubier présente une bonne résistance à la sècheresse, mais est sensible au froid (Biner et al., 2007). Il peut atteindre une taille allant de 8 à 15 m et vivre jusqu’à 500 ans. Cette essence est souvent utilisée pour lutter contre la déforestation et la désertification, en limitant l’érosion des sols (Correia et al., 2005). Les petites fleurs rouges du caroubier fleurissent à partir de septembre jusqu’au mois de novembre (Dakia, 2003). Ce sont elles qui, après fécondation, vont donner naissance aux fruits appelés gousses. Celles-ci contiennent les graines de caroube qui sont utilisées pour produire de la gomme de caroube. Cet additif est fort recherché dans l’industrie agro-alimentaire – notamment pour ses propriétés texturantes (Avallone et al., 1997) – ainsi que dans le secteur pharmaceutique (Prajapati et al., 2013).
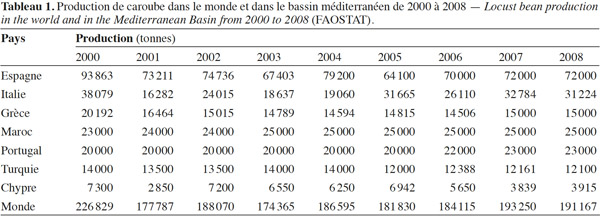
2En termes de surface cultivée, la culture du caroubier représente un peu plus de 100 000 ha (102 939 ha en 2008) à travers le monde. L’Espagne, le Maroc et le Portugal possèdent les surfaces cultivées les plus importantes, de l’ordre de 60 000, 12 000 et 10 000 ha respectivement. Le tableau 1 présente la production de caroube dans le monde et pour le bassin méditerranéen de ces dernières années. On estime à plus de 15 000 t la production mondiale annuelle de gomme de caroube (Dakia et al., 2008).
2. La composition de la caroube
3La gousse du caroubier, nommée caroube, est une gousse indéhiscente de 10 à 30 cm de longueur sur quelques centimètres de largeur. À maturité, la caroube change de couleur et devient brune. Ses composants majeurs sont la pulpe et les graines contenues dans les logettes de la gousse (Simon, 2010).
4La composition de la pulpe de caroube dépend de la variété, du climat et des techniques de cultures. Toutefois, on peut avancer que la pulpe de caroube représente 90 % de la masse du fruit. Elle est riche en tanins et en sucres, dont le saccharose représente 65 à 75 % des sucres totaux. Les taux de protéines et de lipides sont faibles (Petit et al., 1995). Les principales applications de la pulpe de caroube sont l’alimentation animale et humaine en tant que substitut du cacao (Biner et al., 2007). Elle présente l’avantage d’être exempte de théobromine et de caféine, contrairement au cacao qui en contient des quantités importantes (Yousif et al., 2000). Dans de nombreux pays arabes, une boisson consommée lors du Ramadan est fabriquée à partir de caroube (Yousif et al., 2000). La pulpe de caroube est souvent consommée sous forme de poudre (Dakia et al., 2007). Dans les pays occidentaux, celle-ci est produite par égrenage, concassage, broyage et torréfaction des gousses de caroube (Yousif et al., 2000).
5Les graines constituent environ 10 % de la masse de la gousse de caroube (Petit et al., 1995 ; Bouzouita et al., 2007). Leur nombre varie généralement entre 10 et 15. Les graines de caroube ont longtemps été employées comme unité de mesure des diamants et des pierres précieuses, un carat correspondant à la masse d’une graine de caroube, soit environ 200 mg (Dakia et al., 2003).
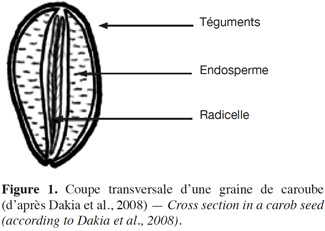
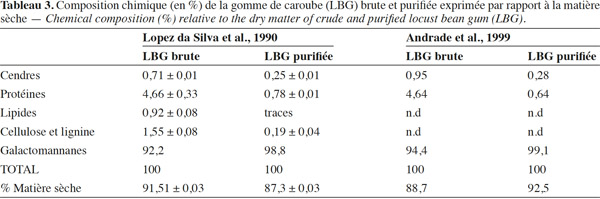
6Les graines de caroube (Figure 1) sont constituées de trois éléments : les téguments, la radicelle et l’endosperme. Les téguments sont une enveloppe résistante de couleur brune (Dakia et al., 2007 ; Dakia et al., 2008). Cette coque représente 30 à 35 % du poids sec de la graine (Neukom, 1988). Au centre de la graine se trouve une radicelle (ou embryon). Elle représente entre 15 et 30 % du poids sec de la graine (Neukom, 1988). Celle-ci possède une valeur énergétique élevée due à son taux important de protéines principalement solubles dans l’eau et de lipides majoritairement insaturés. Elle est employée pour la nutrition du bétail et comme aliment diététique (Dakia et al., 2007). La radicelle contient également un certain nombre d’enzymes susceptibles de s’attaquer à l’endosperme lors, par exemple, d’un processus de germination (Dea et al., 1975) : les endo-1,4-β-mannanases, les α-galactosidases, les β-mannosidases.
7L’endosperme se trouve entre les téguments et la radicelle. Il représente 40 à 50 % du poids de la graine et constitue la matière de base utilisée dans la fabrication de la gomme de caroube (Neukom, 1988). Il s’agit de polysaccharides de réserve que l’on retrouve dans l’endosperme translucide de nombreuses graines de plantes légumineuses dont celles de caroube. Ces polysaccharides sont appelés galactomannanes (Daas et al., 2000). Les galactomannanes sont des hémicelluloses présentes dans le règne végétal. Ils sont produits en quantités variables notamment dans l’endosperme d’une grande proportion des graines de légumineuses (McCleary et al., 1974). Leur fonction est de servir de réserve de nourriture à l’embryon lors de la germination. Les galactomannanes sont constitués d’une chaine principale de résidus D-mannopyranoses liés en β-(1→4) sur laquelle se greffent des résidus D-galactopyranoses uniques grâce à une liaison de type α-(1→6) (Figure 2) (McCleary, 1980 ; Moreira et al., 2008). Le rapport mannose/galactose des galactomannanes et la distribution des résidus galactose le long de la chaine de mannose sont spécifiques de l’espèce végétale (McCleary, 1988). Ces deux éléments, ainsi que la longueur des chaines, vont permettre d’établir une distinction entre les différents types de galactomannanes.
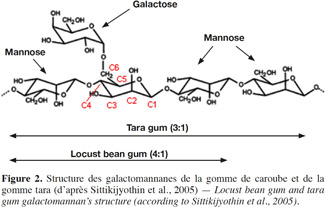
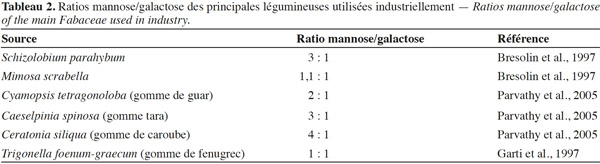
8Le rapport mannose/galactose (M/G) est généralement déterminé par une hydrolyse acide des galactomannanes, suivie d’une dérivatisation des monosaccharides obtenus en acétates d’alditols (Blakeney et al., 1983). Les dérivés sont ensuite analysés en chromatographie en phase gazeuse. Le rapport M/G peut varier de 10 à 1 en fonction de l’espèce végétale (Daas et al., 2000). Les galactomannanes de caroube possèdent un M/G de 4, alors que pour la gomme de guar et la gomme tara – deux autres gommes commercialement importantes – il est de 2 et 3 respectivement (Tableau 2) (Parvathy et al., 2005). On utilise également dans la littérature le degré de substitution en galactose (DSGal) à la place du rapport M/G. Il correspond à la masse de galactose divisée par la masse de mannose (DSGal = G/M = 1/(ratio M/G)). Le rapport M/G d’un galactomannane peut varier au sein des galactomannanes de caroube. Il est dépendant des conditions climatiques, de la composition du sol, de la variété et de l’âge de l’arbre (Dakia, 2009) et des conditions de culture (Bouzouita et al., 2007).
9Plus que le rapport M/G, la répartition des unités galactose va influencer considérablement les propriétés des galactomannanes en solution aqueuse. Différents types de répartition, existant dans la nature, ont été proposés dans la littérature : la disposition régulière, la disposition aléatoire et la disposition en blocs uniformes (Figure 3). Des intermédiaires entre ces trois structures « types » peuvent également exister (Dea et al., 1975). Des études complémentaires ont permis de définir plus précisément la structure des galactomannanes de caroube. Celles-ci ont été réalisées par dégradation alcaline (Baker et al., 1975), par oxydation au periodate (Painter et al., 1979), par résonance magnétique nucléaire du 13C (Grasdalen et al., 1980 ; Gidley et al., 1991 ; Izydorczyk et al., 1996), ainsi que par hydrolyse enzymatique suivie d’une simulation par ordinateur (McCleary et al., 1985 ; McCleary, 1991 ; Daas et al., 2000). Sur base de ces résultats, il apparait que la structure fine des galactomannanes de caroube serait constituée de zones « lisses » faiblement substituées et de zones « hérissées » beaucoup plus denses en galactoses latéraux, sans pour autant qu’ils soient systématiquement adjacents.

10La masse moléculaire est également un élément important à prendre en compte dans la caractérisation de la structure moléculaire d’un polysaccharide. Elle est en effet susceptible de modifier les propriétés physiques du polymère en solution. Les galactomannanes, comme beaucoup d’autres polysaccharides naturels, ont tendance à être polydispersés et, par conséquent, sont décrits par une masse moléculaire moyenne (Dea et al., 1975 ; Pollard et al., 2006a). La masse moléculaire moyenne en nombre (Mn) reprise généralement dans la littérature est située aux environs de 300 000 Daltons (Dea et al., 1975 ; McCleary et al., 1976).
3. Extraction, purification et composition de la gomme
11Les galactomannanes de caroube sont fort recherchés par l’industrie alimentaire pour leurs propriétés texturantes. Dans ce but, l’endosperme de la graine de caroube peut être extrait et broyé pour donner naissance à une poudre blanche commercialisée sous le nom de « gomme de caroube ». Le procédé d’extraction utilisé doit veiller à ne pas dégrader les galactomannanes afin que leurs propriétés technofonctionnelles demeurent intactes, tout en garantissant une certaine pureté à la gomme obtenue. Les enzymes résiduelles doivent également être dénaturées afin de ne pas hydrolyser les galactomannanes lors de leur mise en solution aqueuse.
12Les détails des techniques d’extraction et d’autres traitements de la gomme de caroube sont relativement confidentiels. On sait toutefois que les procédés d’extraction classiques des gommes naturelles ne peuvent être appliqués à la caroube à cause de l’extrême dureté de ses graines (Cui, 2001 ; Azero et al., 2002). Un procédé industriel général d’extraction et de purification adapté à la gomme de caroube à partir des gousses et plus spécifiquement des graines de caroube est proposé à la figure 4. Il comporte plusieurs grandes étapes.
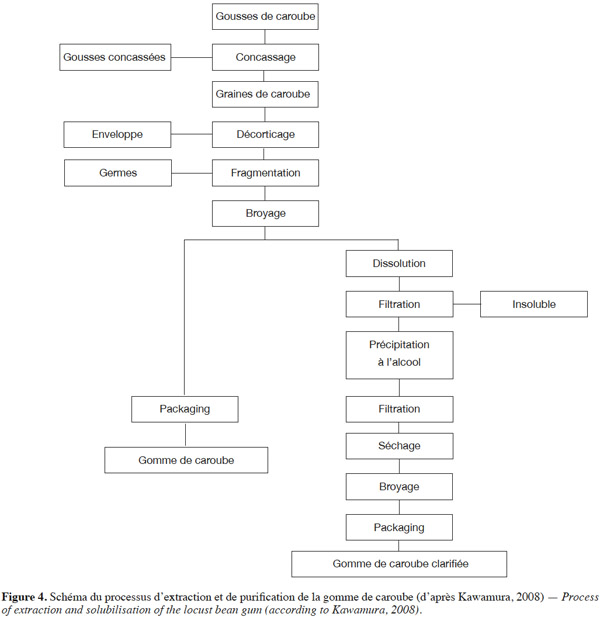
3.1. Étape 1 : la séparation des graines
13Dans un procédé classique, les cosses sont laissées à sécher pendant environ un mois. Elles sont ensuite écrasées dans les machines d’égrenage, qui sont habituellement des broyeurs à marteaux. Ces broyeurs-concasseurs sont assortis d’une série de tamis qui trient les morceaux cassés selon la taille. Les graines sont encore séparées des morceaux de cosses de même taille en soufflant de l’air dans le mélange (Dakia, 2003).
3.2. Étape 2 : l’élimination des téguments
14Une fois les graines récoltées, la séparation de l’endosperme constitue le traitement primaire de la production de gomme. Les principes de base du processus sont une décutilation et une dégermination. La mise en œuvre d’un tel protocole est difficile en raison de la solidité et de la dureté des téguments. Le processus de décutilation consiste à enlever les téguments. Pour ce faire, quatre techniques principales peuvent être utilisées : un traitement chimique, un traitement physique, un traitement mécanique et un traitement par trempage.
15Le traitement chimique consiste à carboniser les enveloppes coriaces à l’aide d’un traitement à l’acide sulfurique (Wielinga, 1990). Un lavage et un brossage permettent l’élimination des fragments restants. Ce processus permet l’obtention d’une gomme de caroube blanche et de haute viscosité (Kawamura, 2008). Toutefois, ce traitement entame et altère partiellement l’endosperme dans ses caractéristiques physiques et chimiques (Dakia, 2003). Le procédé physique repose sur l’éclatement plus ou moins complet de l’enveloppe par rôtissage (100 °C). Celle-ci se détache ensuite facilement du reste de la graine dans des machines abrasives (Wielinga, 1990). Yousif et al. (2000) recommandent un rôtissage de 60 min à 150 °C pour obtenir une gomme de bonne qualité. La gomme de caroube obtenue par rôtissage est toutefois un peu plus foncée (Kawamura, 2008). Les hautes températures altèrent cependant l’endosperme ainsi que l’embryon et entrainent une séparation difficile des constituants. Le traitement mécanique va séparer la coque du mucilage de la graine, en passant ces dernières à travers des broyeurs à marteaux ou autre décortiqueuse et appareil dégermeur. Dans ce cas, il est possible d’obtenir des mucilages purs et intacts, en empêchant les fractions de coques et de germes de se retrouver mélangées à l’endosperme (Dakia, 2003). Une autre technique consiste à soumettre des graines entières ou en morceaux à un trempage dans une solution aqueuse puis à une congélation (Hefti, 1953). La congélation du liquide absorbé augmente le volume des graines, entrainant un détachement substantiel des différents constituants, à tel point que la coque et l’embryon sont facilement enlevés par passage dans un séparateur mécanique.
3.3. Étape 3 : la dégermination
16L’étape suivante consistera en l’élimination du germe. Celui-ci est écrasé par broyage mécanique et éliminé principalement par tamisage. Il ne reste alors plus que les endospermes qui sont broyés en fines particules pour obtenir la gomme de caroube (Ind. Agricolas levantinas, 1954).
17Les rendements en endospermes, moulus et transformés en gomme de caroube, sont extrêmement variables et dépendent tant du procédé d’extraction utilisé que du cultivar ou des conditions de climat et de sol lors de la culture du caroubier (Dea et al., 1975). Généralement, il avoisine les 70 % en masse. Les contaminants principaux de cette méthode sont les arabinoxylanes, présents à moins de 3 %. Il est possible de les éliminer enzymatiquement (Dakia, 2003). Des protéines sont également présentes à raison de 2 %. La dégradation enzymatique des protéines est aussi utilisée pour la purification des galactomannanes. Brummer et al. (2003) ont utilisé la pronase pour réduire la teneur en protéines de 2,36 % à 0,57 % de la gomme de fenugrec, proche de la caroube. La gomme de caroube subit parfois des traitements industriels ultérieurs dans lesquels elle est modifiée chimiquement, physiquement ou mélangée à d’autres gommes pour donner un produit final avec des propriétés physiques et fonctionnelles améliorées ou une solubilité accrue (Dakia, 2003).
3.4. Étape 4 : la clarification
18Des traitements de purification (appelés également clarification) ont ensuite lieu dans le but d’éliminer les odeurs de la farine brute, les impuretés et les enzymes endogènes (Lopez da Silva et al., 1990). Pour ce faire, la gomme de caroube subit une clarification. Celle-ci réside en une solubilisation dans l’eau (Kawamura, 2008). Parfois, des solutions de soude diluées ou d’acide acétique à 1 % sont utilisées (Dea et al., 1975). Plus la température de solubilisation est élevée, plus la matière en solution est importante. Le rendement de purification sera donc amélioré en augmentant la température. Le matériel insoluble est ensuite éliminé à l’aide d’une étape de filtration (Kawamura, 2008) ou de centrifugation (Dea et al., 1975).
19Enfin, la gomme de caroube est précipitée soit à l’aide d’un non-solvant du polysaccharide (miscible à l’eau), soit par formation de complexes métalliques. Le précipité est récupéré par filtration, séché et broyé en fines particules. Cette dernière opération peut être répétée plusieurs fois selon le degré de pureté attendu (Dea et al., 1975). La gomme de caroube obtenue est dite clarifiée (extraite et purifiée) (Kawamura, 2008).
20La précipitation à l’éthanol est la plus largement utilisée (McCleary et al., 1974). La purification par précipitation à l’isopropanol, qui est peu utilisée dans les laboratoires, est une méthode de choix en génie des procédés industriels (Dea et al., 1975 ; Alves et al., 1999 ; Andrade et al., 1999 ; Azero et al., 2002). La précipitation au méthanol existe également (Rafique et al., 1950). Certains auteurs utilisent également la précipitation à l’aide des complexes de cuivre (Andrews et al., 1952 ; McCleary et al., 1974) ou de baryum (Kapoor, 1972) . Dans ces complexes, les ions cuivre et baryum établissent des interactions entre les groupes cis-hydroxyles des résidus de mannose (Lopez da Silva et al., 1990). Toutefois, les plus faibles masses moléculaires observées lors de ce type de purification pourraient s’expliquer par un clivage des chaines de molécules de la gomme. Cela aura un impact évident sur les propriétés finales du produit (Dea et al., 1975). De plus, cette méthode ne permet pas d’éliminer les arabinoxylanes, car ils précipitent (Dakia, 2003). Il existe enfin une précipitation dans du tampon borate à l’aide de bromure de cétyltriméthylammonium (cetavlon). Ici également, le groupement hydroxyle en position cis est essentiel pour la précipitation (Lopez da Silva et al., 1990).
21Les compositions de gommes de caroube brutes et clarifiées ont été investiguées par certains auteurs (Lopez da Silva et al., 1990 ; Andrade et al., 1999 ; Azero et al., 2002). Il ressort de leurs résultats (Tableau 3) que la gomme de caroube est principalement composée de galactomannanes (environ 93 %, déterminés par différence gravimétrique), de protéines (environ 4-5 %), de lipides (1 %) et de minéraux (1 %). La purification permet d’éliminer la cellulose, la lignine et les lipides, ainsi que de diminuer considérablement les quantités de minéraux et de protéines (Lopez da Silva et al., 1990).
4. Influence de la purification sur les propriétes de la gomme
4.1. La solubilisation
22Le point crucial du processus de clarification se situe lors des étapes de filtration ou de centrifugation. C’est à ce niveau que les matériaux solubles et insolubles seront séparés. La solubilité est donc le facteur clé qui permettra de sélectionner ou non des galactomannanes de caractéristiques données qui génèreront des gommes aux propriétés et aux applications différentes.
23La solubilité de la gomme de caroube n’est pas liée à une quelconque fusion de zones cristallines (Gidley et al., 1991). D’après Pollard et al. (2006b), la dissolution correspond principalement à une extraction polymère-solvant. Elle peut ainsi être représentée par le partitionnement thermodynamique des chaines de polymères entre la phase solide amorphe du polymère, gonflée par le solvant et la phase de solvant pure environnante. La solubilité des galactomannanes est liée aux caractéristiques structurales de la gomme de caroube. Le degré de substitution en galactose (DSGal) et la masse moléculaire (Mw) sont les principaux paramètres dont l’influence a été étudiée (Pollard et al., 2006a ; Pollard et al., 2007), mais la distribution des galactoses le long de la chaine semble également impacter la mise en solution.
24Sans les groupements latéraux présents à une certaine concentration, le polysaccharide isolé est instable en solution et va cristalliser ou précipiter (Pollard et al., 2007). En réalité, les zones non substituées en galactose des galactomannanes sont le siège d’interactions intra- et inter-moléculaires générées par la présence de ponts hydrogène entre ces zones conduisant, dans les cas extrêmes, à l’agrégation et à la précipitation (Brummer et al., 2003). Les galactomannanes avec un rapport M/G généralement en dessous de 2,5, tels que la gomme de guar (2) ou de fenugrec (1,1), sont considérés comme solubles dans des solutions aqueuses diluées ou semi-diluées et thermodynamiquement stables. Plus le degré de substitution en galactose est élevé, plus la solubilité dans l’eau des galactomannanes est augmentée. Pour certains auteurs, les résidus galactopyranoses représentent donc les parties hydrophiles du galactomannane (Kök et al., 1999 ; Moreira et al., 2008). Ils pourraient cependant également empêcher la formation de liaison coopérative entre les segments de mannoses libres. Les galactomannanes de rapport M/G intermédiaires à élevés (> 2,5) sont constitués de chaines qui affichent une solubilité partielle dépendant de la valeur exacte du rapport M/G (Pollard et al., 2006a). Les galactomannanes de caroube font partie de cette dernière catégorie et sont généralement considérés comme partiellement solubles (Richardson et al., 1999). Certains constituants se dissolvent donc directement dans de l’eau froide, mais une dissolution totale accompagnée d’une viscosité importante nécessitent une haute température et un long trempage (Pollard et al., 2006a) ou une forte agitation (Kök et al., 1999).
25La température de solubilisation, lors de la clarification, va donc influencer considérablement les caractéristiques de la gomme, en sélectionnant des galactomannanes plus ou moins riches en galactose.
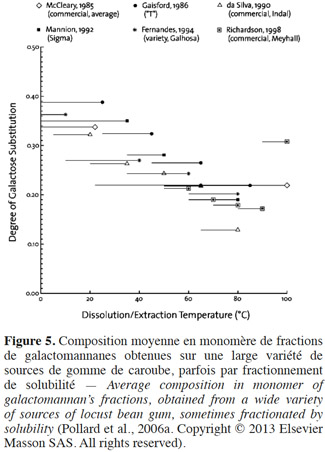
26D’après Pollard et al. (2007), approximativement la moitié – en masse – d’un échantillon de gomme de caroube brute est soluble à 5 °C, les autres constituants se solubilisent progressivement avec l’augmentation de la température. Plusieurs études montrent ainsi que le DSGal est inversement lié aux températures de fractionnement et de solubilisation (Figure 5). Les fractions solubilisées à des températures de plus en plus hautes contiennent de moins en moins de galactose (McCleary et al., 1985 ; Gaisford et al., 1986 ; Richardson et al., 1998). À l’inverse, les fractions solubles à froid sont donc celles qui contiennent le plus de galactose (Pollard et al., 2007).
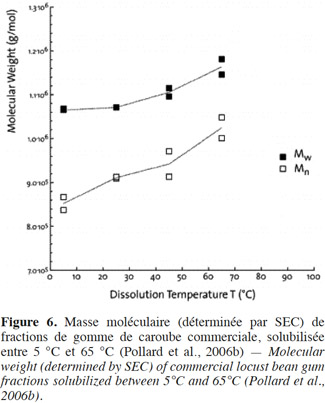
27Pollard et al. (2007) ont également constaté une tendance à obtenir de plus hauts poids moléculaires (Mw) lorsque la température de dissolution augmente, tel que mis en évidence par chromatographie d’exclusion stérique couplée à une triple détection (Figure 6). Les composants polysaccharidiques qui se dissolvent avec une augmentation progressive de la température possèdent des chaines de plus en plus longues, de l’ordre de 1 000 000 daltons. Ils fournissent donc une contribution positive à la masse moléculaire globale. Par conséquent, une gamme assez large de valeurs peut être observée, dans le même matériel, selon la température de dissolution (Pollard et al., 2007).
4.2. Le fractionnement
28Dès lors, les propriétés de solubilité de la gomme de caroube sont également utilisées pour la séparer en fractions de structures fines différentes (DSGal et Mw différents) (Gaisford et al., 1986 ; Izydorczyk et al., 1996 ; Pollard et al., 2006a). Deux techniques de fractionnement existent. La première se réalise de la même manière que l’étape de clarification d’un procédé industriel de purification de la gomme de caroube. La farine brute d’endosperme de caroube est dissoute à des températures données et rigoureusement contrôlées, puis les fractions solubles et insolubles à ces températures sont séparées par centrifugation. Enfin, le surnageant soluble est ensuite précipité par un volume d’éthanol afin de récupérer la fraction spécifique. Wielinga (1990) met toutefois en évidence le fait que le volume d’éthanol utilisé influence la composition de la fraction récoltée. En effet, pour une température de solubilisation donnée, un surnageant obtenu après centrifugation donnera une gomme contenant une proportion croissante de galactose au fur et à mesure que la quantité d’éthanol utilisée lors de la précipitation augmente. L’adjonction de grands volumes d’éthanol permet donc de précipiter une fraction plus soluble de la gomme (car plus riche en galactoses latéraux). La seconde, une technique par épuisement (soustractive), consiste à réextraire successivement le même échantillon dans des volumes d’eau de températures croissantes, pour générer les fractions suivantes, jusqu’à ce que plus aucune matière supplémentaire ne puisse être extraite (Pollard et al., 2006a). Elle donne également des fractions de caractéristiques plus marquées que dans le premier cas de fractionnement, car la matière récupérée correspond à celle possédant les caractéristiques structurales la rendant soluble dans une gamme étroite de température. En utilisant la première technique de fractionnement, une grande quantité de galactomannanes solubles à de plus basses températures vient enrichir la fraction concernée.
4.3. La relation structure-fonction
29Le choix d’une température de travail lors de la clarification ou du fractionnement influera donc considérablement sur la structure chimique de la gomme obtenue. Une température de dissolution plus importante permettra de produire une gomme, clarifiée ou fractionnée, non seulement avec un rendement plus important, mais aussi avec une plus grande proportion de galactomannanes longs et plus pauvres en galactose. Ces fractions seront les plus efficaces pour promouvoir la gélification et les interactions synergétiques avec d’autres biopolymères (Pollard et al., 2006a). Des compositions de gomme différentes, dues à des structures différentes, génèrent ainsi des propriétés physiques et fonctionnelles différentes en solution aqueuse (Gaisford et al., 1986 ; McCleary, 1988 ; Izydorczyk et al., 1996 ; Pollard et al., 2006a). De nombreuses études permettent d’établir un lien entre la structure – principalement la longueur des chaines et le rapport M/G – et les propriétés du galactomannane en solution.
30En effet, la viscosité intrinsèque d’une solution est proportionnelle à sa masse moléculaire moyenne (Richardson, 1998). Ainsi, plus un galactomannane possède de chaines longues, plus sa viscosité en solution est importante. Le comportement visqueux, bien que dépendant de la concentration, est également fortement influencé par le rapport M/G. Ainsi, des polysaccharides en possédant un faible présentent une viscosité peu importante (Dea et al., 1975 ; Doublier et al., 1981 ; Rizzo et al., 2004). L’étude de la viscoélasticité révèle aussi une influence de la structure du galactomannane sur les propriétés de la solution. Des chaines plus longues et moins substituées généreront plus rapidement un comportement élastique (Fernandez, 1994 ; Lazaridou et al., 2000). Enfin, des structures différentes de galactomannanes se comportent différemment lors de la formation de gels par association à d’autres polysaccharides tels que les κ-carraghénanes (Dea et al., 1975 ; Rochas et al., 1990), l’agarose (Dea et al., 1975) et – le modèle le plus étudié – le xanthane. Il a ainsi été démontré que le degré d’interaction avec le xanthane est inversement proportionnel au DSGal (Dea et al., 1977 ; McCleary et al., 1981). La tendance observée est la même lors de l’association aux κ-carraghénanes et à l’agarose. Ces comportements physiques résultent principalement des interactions intra-, inter-moléculaires et inter-polyholosidiques, favorisés par les zones pauvres en galactose (Dea et al., 1986).
5. Conclusion
31Le procédé industriel de fabrication et de purification de la gomme de caroube conditionne les caractéristiques de celle-ci et, par conséquent, ses potentialités d’applications. Dans ce procédé, la température de solubilisation des polysaccharides est le paramètre critique à contrôler.
32Une température relativement basse sélectionne des galactomannanes de faibles masses molaires et de contenu en galactose important. Ces fibres ont un caractère hydrophile plus marqué. A contrario, une température de travail plus importante permet de solubiliser des galactomannanes plus longs et très pauvres en galactose, qui apporteront leurs contributions aux caractéristiques globales de la gomme obtenue. Cette gomme possédera une masse moléculaire moyenne plus importante et un degré de substitution en galactose plus faible. Ces deux types de gomme présenteront des propriétés physiques différentes en solutions aqueuses. Les premières possèdent une viscosité plus faible mais immédiate (car solubles à faible température), tandis que les secondes présentent un comportement visqueux plus marqué mais nécessitent un chauffage préalable. Ces dernières sont également plus efficaces dans la formation de gels par association à d’autres polysaccharides, grâce aux possibilités d’interactions plus nombreuses qu’elles offrent de par leurs structures.
Bibliographie
Alves M.M., Antonov Yu A. & Gonçalves M., 1999. The effect of phase viscosity ratio on the rheology of liquid two phase gelatin-locust bean gum systems. Int. J. Biol. Macromol., 26(5), 333-336.
Andrade C., Azero E., Luciano L. & Gonçalves M., 1999. Solution properties of the galactomannans extracted from the seeds of Caesalpinia pulcherrima and Cassia javanica: comparison with locust bean gum. Int. J. Biol. Macromol., 26, 181-185.
Andrews P., Hough L. & Jones J., 1952. Mannose-containing polysaccharides. I. The galactomannans of lucerne and clover seeds. J. Am. Chem. Soc., 74, 4029-4032.
Avallone R., Plessi M., Baraldi M. & Monzani A., 1997. Determination of chemical composition of carob (Ceratonia siliqua): protein, fat, carbohydrates, and tannins. J. Food Compos. Anal., 10, 166-172.
Azero E.G. & Andrade C.T., 2002. Testing procedure for galactomannan purification. Polym. Test., 21, 551-556.
Baker C. & Whistler R., 1975. Distribution of D-galactosyl groups in guaran and locust-bean gum. Carbohydr. Res., 45, 237-243.
Biner B. et al., 2007. Sugar profiles of the pods of cultivated and wild types of carob bean (Ceratonia siliqua L.) in Turkey. Food Chem., 100, 1453-1455.
Blakeney A., Harris P., Henry R. & Stone B., 1983. A simple and rapid preparation of alditol acetates for monosaccharide analysis. Carbohydr. Res., 113, 291-299.
Bouzouita N. et al., 2007. The analysis of crude and purified locust bean gum: a comparison of samples from different carob tree populations in Tunisia. Food Chem., 101, 1508-1515.
Bresolin T. et al., 1997. Viscosimetric studies on xanthan and galactomannan systems. Carbohydr. Polym., 33, 131-138.
Brummer Y., Cui W. & Wang Q., 2003. Extraction, purification and physiochemical characterization of fenugreek gum. Food Hydrocolloids, 17, 229-236.
Correia P. & Martins-Loucao M., 2005. The use of macronutrients and water in marginal Mediterranean areas: the case of carob tree. Field Crops Res., 91, 1-6.
Cui S., 2001. Polysaccharide gum from agricultural products: processing, structures and fonctionality. Lancaster, PA, USA: Technomic Publishing Co.
Daas P., Schols H. & de Jongh H., 2000. On the galactosyl distribution of commercial galactomannans. Carbohydr. Res., 329, 609-619.
Dakia P., 2003. Extraction et caractérisation de la gomme de caroube (Ceratonia siliqua L.). Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Dakia P., Wathelet B. & Paquot M., 2007. Isolation and chemical evaluation of carob (Ceratonia siliqua L.) seed germ. Food Chem., 102, 1368-1374.
Dakia P. et al., 2008. Composition and physicochemical properties of locust bean gum extracted from whole seeds by acid and water dehuling pre-treatment. Food Hydrocolloids, 22, 807-818.
Dakia P., 2009. Propriétés chimiques et rhéologiques des polysaccharides de l’endosperme des graines de caroubier (Ceratonia siliqua L.). Thèse de doctorat : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Dea I. & Morrison A., 1975. Chemistry and interactions of seed galactomannans. Adv. Carbohydr. Chem. Biochem., 31, 241-312
Dea I. et al., 1977. Association of like and unlike polysaccharides: mechanism and specificity in galactomannans, interacting bacterial polysaccharides, and related systems. Carbohydr. Res., 57, 249-272.
Dea I., Clarck A. & McCleary B., 1986. Effect of the molecular fine structure of galactomannans on their interaction properties – the role of unsubstituted sides. Food Hydrocolloids, 1, 129-140.
Doublier J. & Launay B., 1981. Rheology of galactomannan solutions: a comparative study of guar gum and locust bean gum. J. Texture Stud., 12, 151-172.
FAOSTAT, http://faostat.fao.org/, (13/03/2010).
Fernandes P., 1994. Determination of the physical functionality of galactomannans in kappa-carrageenan/galactomannan mixed systems by periodate oxidation. Food Chem., 49, 367-371.
Gaisford S., Harding S., Mitchell J. & Bradley T., 1986. A comparison between the hot and cold water soluble fractions of two locust bean gum samples. Carbohydr. Polym., 6, 423-442.
Garti N. et al., 1997. Fenugreek galactomannans as food emulsifiers. Lebensm. Wiss. Technol., 30, 303-311.
Gidley M., McArthur A. & Underwood D., 1991. 13C NMR characterization of molecular structures in powders, hydrates and gels of galactomannans and glucomannans. Food Hydrocolloids, 5, 129-140.
Grasdalen H. & Painter T., 1980. NMR studies of composition and sequence in legume-seed galactomannans. Carbohydr. Res., 81, 59-66.
Hefti M., 1953. Process for the extraction of mucilages from seeds. UK Patent application GB19530014813 19530527. 1953-05-27.
Ind Agricolas Levantinas, 1954. Improvements relating to the treatment of carob beans. UK Patent application GB19540017447 19540614. 1954-06-14.
Izydorczyk M. & Biliaderis C., 1996. Grandient ammonium sulphate fractionation of galactomannans. Food Hydrocolloids, 10, 295-300.
Kapoor V., 1972. A galactomannan from the seeds of delonix regia. Phytochemistry, 11, 1129-1132.
Kawamura Y., 2008. Carob bean gum. Chemical and Technical Assessment for the 69th JECFA, http://www.fao.org/fileadmin/templates/agns/pdf/jecfa/cta/69/Carob_bean_gum.pdf, (08/05/12).
Kök M., Hill S. & Mitchell J., 1999. Viscosity of galactomannans during high temperature processing: influence of degradation and solubilisation. Food Hydrocolloids, 13, 535-542.
Lazaridou A., Biliaderis C. & Izydorczyk M., 2000. Structural characteristics and rheological properties of locust bean galactomannans: a comparison of samples from different carob tree populations. J. Sci. Food Agric., 81, 68-75.
Lopez da Silva J. & Gonçalves M., 1990. Studies on a purification method for locust bean gum by precipitation with isopropanol. Food Hydrocolloids, 4, 277-287.
McCleary B., 1980. Hydrolysis of galactomannans by α-D-galactosidase and β-D-mannanase. In: Marshall J.J., ed. Mechanisms of saccharide polymerization and depolymerisation. New York, USA: Academic Press, 285-300.
McCleary B., 1988. Guar and carob galactomannans. Methods Enzymol., 160, 523-527.
McCleary B., 1991. Enzymic analysis of the fine-structure of galactomannan. Methods Carbohydr. Chem., 10.
McCleary B. & Matheson N., 1974. Α-D-galactosidase activity and galactomannan and galactosylsucrose oligosaccharide depletion in germinating legume seeds. Phytochemistry, 13, 1747-1757.
McCleary B., Matheson N. & Small D., 1976. Galactomannans and galactoglucomannan in legume seed endosperms: structural requirements for β-mannanase hydrolysis. Phytochemistry, 15, 1111-1117.
McCleary B., Amado R., Waibel R. & Neukom H., 1981. Effect of galactose content on the solution and interaction properties of guar and carob galactomannans. Carbohydr. Res., 92, 269-285.
McCleary B., Clark A., Dea I. & Rees D., 1985. The fine structures of carob and guar galactomannans. Carbohydr. Res., 139, 237-260.
Moreira L. & Filho E., 2008. An overview of mannan structure and mannan degrading enzyme systems. Appl. Microbiol. Biotechnol., 79, 165-178.
Neukom H., 1988. Carob bean gum: properties and applications. In: Fito P. & Mulet A., eds. Proceedings of the II International Carob Symposium, 29 September-1 October 1987, Valencia, Spain, 551-555. Valencia, Spain: Generalitat Valenciana.
Painter T., Gonzalez J. & Hemmer P., 1979. The distribution of D-galactosyl groups in guaran and locust bean gum: new evidence from periodate oxidation. Carbohydr. Res., 69, 217-226.
Parvathy K., Susheelamma N., Tharanathan R. & Gaonkar A., 2005. A simple non-aqueous method for carboxymethylation of galactomannans. Carbohydr. Polym., 62, 137-141.
Petit M. & Pinilla J., 1995. Production and purification of a sugar syrup from carob pods. Lebensm. Wiss. Technol., 28, 145-152.
Pollard M. & Fischer P., 2006a. Partial aqueous solubility of low galactose-content galactomannans – What is the quantitative basis? Curr. Opin. Colloid Interface Sci., 11, 184-190.
Pollard M. et al., 2006b. Why are locust bean galactomannans partially soluble? In: Proceedings of the 4th International symposium on food rheology and structure, February 19-23, Zurich, Switzerland, 373-376.
Pollard M. et al., 2007. Investigation of equilibrium solubility of a carob galactomannan. Food Hydrocolloids, 21, 683-692.
Prajapati V. et al., 2013. Locust bean gum: a versatile biopolymer. Carbohydr. Polym., 94, 814-821.
Rafique C. & Smith F., 1950. The constitution of guar gum. J. Am. Chem. Soc., 72, 4634-4637.
Richardson P., Willmer J. & Foster T., 1998. Dilute properties of guar and locust bean gum in sucrose solutions. Food Hydrocolloids, 12, 339-348.
Richardson P. et al., 1999. Galactomannan gelation: a thermal and reological investigation analyzed using the cascade model. Macromolecule, 32, 1519-1527.
Rizzo V. et al., 2004. Rheological properties and sugar composition of locust bean gum from different carob varieties (Ceratonia siliqua L.). J. Agric. Food Chem., 52(26), 7925-7930.
Rochas C., Taravel F. & Turquois T., 1990. N.m.r. studies of synergistic kappa carrageenan-carob galactomannan gels. Int. J. Biol. Macromol., 12, 353-358.
Simon M., 2010. Production enzymatique d’oligosaccharides à partir de gomme de caroube. Mémoire : Faculté universitaire des Sciences agronomiques de Gembloux (Belgique).
Sittikijyothin W., Torres D. & Gonclaves M.P., 2005. Modelling the rheological behaviour of galactomannan aqueous solutions. Carbohydr. Polym., 59, 339-350.
Wielinga W., 1990. Production and application of seed gums. In: Phillips G.O., Wedlock D.J. & Williams P.A., eds. Proceedings of 5th International Conference, Gums and stabilisers for the food industry, July 1989, Wrexham, UK. Oxford, UK: IRL Press, 383-403.
Yousif A. & Alghzawi H., 2000. Processing and characterization of carob powder. Food Chem., 69, 283-287.






