- Accueil
- Volume 18 (2014)
- numéro 2
- Les levures et les bactéries lactiques impliquées dans les bières traditionnelles à base de sorgho produites en Afrique subsaharienne (synthèse bibliographique)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Les levures et les bactéries lactiques impliquées dans les bières traditionnelles à base de sorgho produites en Afrique subsaharienne (synthèse bibliographique)

Notes de la rédaction
Reçu le 3 aout 2013, accepté le 5 novembre 2013
Résumé
Les bières de sorgho produites en Afrique subsaharienne contribuent significativement au régime alimentaire des populations. Le procédé de production de la bière de sorgho reste cependant empirique et varie d’une région à une autre, conduisant à plusieurs types de bière de sorgho. Le processus de production comporte en outre plusieurs étapes dont la fermentation, qui comprend elle-même une fermentation lactique suivie d’une fermentation alcoolique qui sont non contrôlées. Cette revue résume l’état actuel des connaissances scientifiques sur les bactéries lactiques et les levures impliquées dans les bières de sorgho en Afrique subsaharienne et les essais de formulation de cultures starters à partir de ces dernières. La fermentation lactique dominée par les bactéries lactiques appartenant au genre Lactobacillus, principalement Lactobacillus plantarum et Lactobacillus fermentum, permet la production d’acides organiques, de composés aromatiques, la stimulation de la croissance des levures et l’inhibition des micro-organismes pathogènes. La fermentation alcoolique est dominée par l’espèce Saccharomyces cerevisiae à des proportions allant parfois jusqu’à 99 %, dont la principale fonction est de transformer les sucres fermentescibles en alcool et en gaz carbonique. Les souches de S. cerevisiae identifiées des différentes bières de sorgho présentent cependant des différences aux niveaux phénotypique et moléculaire d’avec l’espèce type S. cerevisiae CBS1171. Afin d’améliorer et de contrôler la production des bières de sorgho en Afrique subsaharienne et, plus spécialement, l’étape des fermentations (lactique et alcoolique), l'utilisation de cultures starters de levures et/ou de bactéries lactiques a été testée. Les bières obtenues à partir des essais d’inoculation avec ces starters ont présenté des caractéristiques organoleptiques et sensorielles comparables aux bières produites de façon traditionnelle.
Abstract
Yeast and lactic acid bacteria involved in traditional sorghum beer produced in sub-Saharan Africa. A review. Sorghum beer produced in sub-Saharan Africa contributes significantly to the diet of the population. The production process of sorghum beer, however, remains empirical and varies from one region to another, leading to several types of sorghum beer. Furthermore, the production process involves several steps, including a fermentation step composed of uncontrolled lactic and alcoholic fermentations. This review summarizes the current state of scientific knowledge on lactic acid bacteria and yeasts involved in sorghum beers in sub-Saharan Africa and their use as starter cultures. Lactic fermentation, which is mainly carried out by lactic acid bacteria belonging to the genus Lactobacillus, primarily Lactobacillus plantarum and Lactobacillus fermentum, allows the production of organic acids, aromatic compounds, yeast growth stimulation and the inhibition of pathogens. The alcoholic fermentation is dominated by Saccharomyces cerevisiae with proportions sometimes reaching up to 99%. The main function of S. cerevisiae is to transform fermentable sugars into alcohol and carbon dioxide. Strains of S. cerevisiae isolated from sorghum beers show phenotypic and molecular differences from the type species S. cerevisiae CBS1171. In order to improve and control sorghum beer production in sub-Saharan Africa, especially the fermentation stage (lactic and alcoholic fermentations), the use of starter cultures of yeast and/or lactic acid bacteria were tested. Beer obtained from inoculation tests with these starters showed organoleptic and sensory characteristics comparable to beer produced in the traditional way.
Table des matières
1. Introduction
1Dans la majorité des pays de l’Afrique subsaharienne où le sorgho est cultivé, il sert abondamment à faire de la bière. En Afrique du Sud par exemple, la plus grande partie de la récolte est maltée et sert à fabriquer des bières bantoues et cafres (FAO, 1995). Mais le procédé de fabrication ainsi que l’appellation de cette bière diffèrent selon les pays et les régions. Elle est connue notamment sous le nom de dolo au Burkina Faso, au Mali et au Sénégal, de tchapalo en Côte d’Ivoire, de tchoukoutou au Bénin, de pito au Ghana, de bili-bili au Tchad, de burukutu ou otika au Nigeria, de chibuki au Zimbabwe, de impéké au Burundi (Odunfa, 1985 ; Yao et al., 1995 ; N’da et al., 1996 ; Kayodé et al., 2005). Chaque pays, chaque région possède donc « sa » bière de sorgho.
2La production de la bière de sorgho revêt un caractère socio-économique remarquable puisqu’elle est abondamment utilisée au cours des cérémonies traditionnelles et constitue une importante source de revenus pour les femmes qui la produisent à l’échelle locale, en utilisant la technologie traditionnelle (Kayodé et al., 2005). Ce succès relatif de la bière de sorgho auprès des consommateurs serait le fait de son prix relativement bas, des vertus thérapeutiques qui lui sont attribuées et de l’amélioration du régime alimentaire de millions de personnes à laquelle elle contribue (van der Aa Kühle et al., 2001 ; Djè et al., 2008). Cependant, un certain nombre de contraintes freinent le développement de ce secteur d’activité. D’une part, la production reste strictement artisanale et donne un produit conservable pendant seulement quelques jours. D’autre part, le faible rendement de la production et les caractéristiques organoleptiques irrégulières de cette bière la rendent moins attrayante que la bière occidentale. Il est évident que toute amélioration de ces critères doit s’appuyer sur la connaissance des processus physiques, chimiques et microbiologiques qui entrent en jeu dans le procédé de fabrication.
3Les micro-organismes essentiels dans la production de la bière de sorgho sont les bactéries lactiques et les levures. Les bactéries lactiques interviennent au cours de l’étape d’aigrissement et acidifient le mout, créant ainsi des conditions favorables à la croissance des levures (Yao et al., 2009). Les levures, elles, réalisent la fermentation alcoolique qui est la dernière étape du procédé de production de cette bière traditionnelle. Elles déterminent ainsi de façon prépondérante les caractéristiques du produit fini. Plusieurs essais de fermentation avec des starters sélectionnés de bactéries lactiques et/ou de levures ont été menés dans le but de produire des bières stables et saines aux caractéristiques organoleptiques constantes. Cette synthèse a pour objectif de résumer les espèces de bactéries lactiques et de levures identifiées à ce jour dans les bières de sorgho produites en Afrique subsaharienne, ainsi que l’état d’avancement de leur utilisation en tant que starter.
2. Technologie de production des bières de sorgho
4Les procédés traditionnels de production des bières de sorgho sont longs, complexes et varient suivant les pays ou les régions (Figure 1). Ils reposent cependant sur les mêmes principes. Les trois grandes opérations sont le maltage, le brassage et la fermentation (Chevassus-Agnès et al., 1976 ; Sawadogo-Lingani et al., 2007).
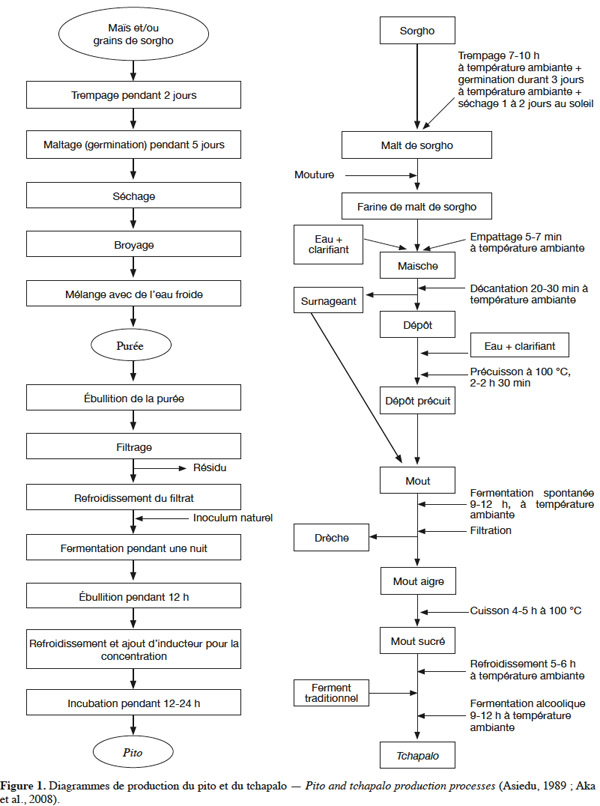
2.1. Le maltage
5Le maltage comprend trois phases qui sont le trempage, la germination et le séchage solaire. Il favorise le développement des enzymes amylolytiques qui, lors du brassage, vont permettre une dissolution des matières du grain dans l'eau et la transformation de l'amidon en sucres fermentescibles. Le maltage augmente aussi la solubilité dans l’eau des protéines, la teneur en lysine, en méthionine, en sucres solubles et la disponibilité du fer, du calcium, du phosphore (Bhise et al., 1988 ; Traoré et al., 2004). Par ailleurs, le grain change de couleur, le gout et les arômes caractéristiques se développent.
6Le trempage fournit au grain l’eau et l’oxygène nécessaires à la germination. La durée du trempage varie cependant d’un auteur à l’autre. Elle serait de 12 à 72 h selon Chevassus-Agnès et al. (1976), 10 à 12 h selon Yao et al. (1995), 5 à 25 h selon Traoré et al. (2004), 7 à 10 h selon Aka et al. (2008). À la fin du trempage, les grains sont retirés, égouttés, étalés au soleil et recouverts de sacs en jute ou placés dans des canaris ou sur une aire cimentée ou encore sur des sacs en plastique. Les grains sont aspergés par moment d’eau pour accélérer la germination et éviter une forte activité des champignons et moisissures. La germination durerait 96 h selon Chevassus-Agnès et al. (1976), 57 à 96 h selon Traoré et al. (2004) et 72 h selon Aka et al. (2008). Au cours de cette étape, se développent plusieurs enzymes qui soit provoquent la dégradation des parois cellulaires (cytase), soit hydrolysent les protéines (protéinases, peptidases), soit hydrolysent la phytine (phytase), soit dégradent l’amidon (α et β- amylases, α- glucosidases, glucanases, etc). La fin de la germination est caractérisée par l’apparition de plantules pouvant atteindre plusieurs cm de longueur. Les grains germés sont ensuite séchés au soleil durant 24 h selon Chevassus-Agnès et al. (1976), 32 à 82 h selon Traoré et al. (2004), 24 à 48 h selon Aka et al. (2008). Le séchage a pour but d’arrêter la germination et de déshydrater les grains. Les brasseuses procèdent souvent au dégermage. Selon Panasiuk et al. (1984), les radicelles et les pousses contiennent de très grandes quantités de dhurrine, un glucoside cyanogène qui, à l’hydrolyse, produit une toxine puissante connue sous différents noms : acide prussique, acide cyanhydrique (HCN) et cyanure.
7Les principaux critères utilisés par les brasseuses pour juger de la qualité de leur malt sont le gout du malt et la présence ou non de radicelles. Quant aux paramètres qui affectent la qualité du malt, ce sont essentiellement la période de maltage (saison sèche ou saison pluvieuse), la présence de résidus de pesticides sur les grains et l’âge des grains (Pale et al., 2010). Pour une meilleure qualité du malt, les chercheurs proposent de contrôler le maltage. Ainsi, Morall et al. (1986) proposent un trempage à 30 °C pendant 18 à 22 h afin d’obtenir une activité enzymatique optimale. Du fait que la température et la durée optimales de germination varient suivant les variétés de sorgho, Okafor et al. (1980) proposent une germination à 30 °C pendant 3 à 7 jours. En lieu et place du séchage au soleil, Ballogou et al. (2011) proposent un sécheur artisanal qui permettrait de sécher entre 45 et 50 °C pendant 12 h.
2.2. Le brassage
8C’est l’étape au cours de laquelle l’amidon et les protéines vont être hydrolysés en sucres fermentescibles et composés azotés par les enzymes (Alais et al., 1997). C’est aussi au cours de cette étape que sont observées les plus grandes variations dans les processus de production selon les groupes ethniques ou les régions. Le brassage correspond à la fabrication du mout. Pour ce faire, le malt est broyé et la farine obtenue est délayée dans de l’eau (25 kg dans 100 l d’eau) puis laissée à décanter. À cette étape, suivant les groupes ethniques, les brasseuses utilisent un agent gélatineux ou mucilagineux qui améliore la floculation et la filtration des matières insolubles en suspension (Chevassus-Agnès et al., 1976). Il est obtenu par broyage et macération dans l’eau de l’écorce de l’arbuste Anogeissuscarpus (N’da et al., 1996) ou de la tige d’Hibiscus esculentus (Asiedu, 1989). Certaines ethnies utilisent la sève de différents arbres, en particulier Triumfetta sp. (Chevassus-Agnès et al., 1976). Dans le cas de la bili-bili comme dans celui du tchapalo, le dépôt est précuit pendant 2 h à 2 h30 min et le mout obtenu après mélange du surnageant et du dépôt précuit est laissé reposer pendant 9 à 12 h, au cours desquelles il se produit une fermentation lactique naturelle. Après filtration, le filtrat aigre ou mout aigre subit une cuisson durant 5 à 6 h pour donner le mout sucré (Maoura et al., 2006 ; Aka et al., 2008). Si, dans la plupart des bières, la fermentation lactique est spontanée, ce n’est pas le cas du pito où elle est réalisée par ajout d’inoculum naturel (Figure 1). Aussi, le nombre d’étapes de cuisson varie de un à trois voire quatre suivant les procédés.
2.3. La fermentation
9Le mout obtenu après l’étape de brassage est refroidi soit en le laissant à l’air libre, soit par transvasements successifs. À ce mout est ajouté le ferment constitué essentiellement de levures qui initient la fermentation (N’guessan et al., 2010). Ce ferment sauvage est obtenu après la récupération et le séchage du fond de la cuve de fermentation à la fin de chaque cycle de production (Chevassus-Agnès et al., 1976 ; N’da et al., 1996). Dans certaines régions, ce sont des fibres végétales ayant servi de support aux levures lors d’une préparation qui sont séchées pour une prochaine production (Périsse et al., 1959). Selon Sefa-Dedehet al. (1999), une bière ancienne peut servir aussi de ferment. La durée de la fermentation varie selon les auteurs. Selon N’da et al. (1996), elle dure toute une nuit et prend fin avec la disparition de la mousse et des bulles de gaz. D’autres auteurs ont montré qu’elle dure 12 à 24 h (Chevassus-Agnès et al., 1976 ; Lyumugabe et al., 2010), 12 à 18 h (Yao et al., 1995 ; Glover et al., 2005), moins de 12 h (Maoura et al., 2006 ; Djè et al., 2008) et de 9 à 12 h (Aka et al., 2008).
10Selon les brasseuses, les paramètres qui affectent de façon prépondérante la qualité des bières sont la qualité du ferment utilisé pour réaliser la fermentation alcoolique, le procédé de production, les proportions des intrants (eau, malt, ferment de levures, agent mucilagineux) et la qualité du malt (Pale et al., 2010). Pour les consommateurs, le principal critère de qualité est le gout suivi de la teneur en alcool (Kayodé et al., 2005 ; Pale et al., 2010).
3. Les micro-organismes impliqués dans la production des bières de sorgho
11Les micro-organismes impliqués dans la production des bières de sorgho sont de deux types, à savoir les bactéries lactiques et les levures. Chacune de ces catégories de micro-organismes intervient à une étape cruciale du procédé de fabrication. Il s’agit de l’acidification ou fermentation spontanée par la production d’acides par les bactéries lactiques et de la fermentation alcoolique par la production d’alcool et de dioxyde de carbone par les levures.
3.1. Les espèces de bactéries lactiques isolées
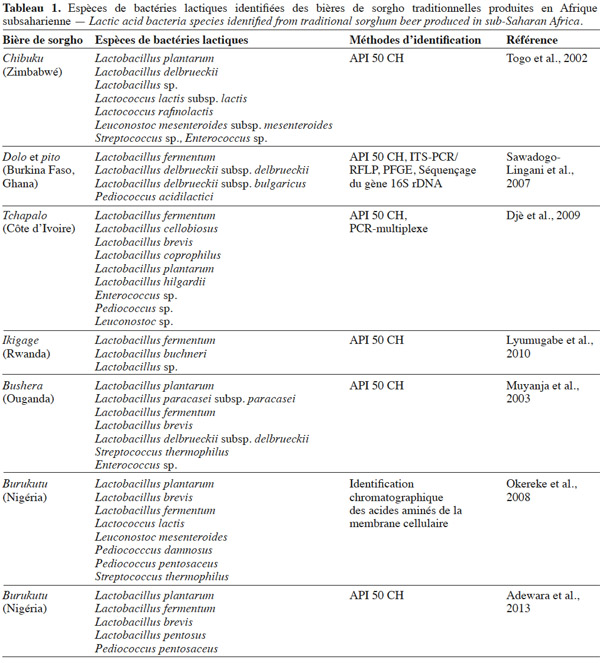
12Dans la production des bières de sorgho, les bactéries lactiques sont à l’origine de l’acidité du mout. Lactobacillus est le genre de bactéries lactiques communément rencontré dans les bières de sorgho. Mais d’autres genres tels que Lactococcus, Streptococcus, Enterococcus, Leuconostoc, Pediococcus ont été aussi isolés suivant les pays ou les régions (Tableau 1). Par ailleurs, les espèces de Lactobacillus isolées varient selon les auteurs. Ainsi, Togo et al. (2002) ont identifié les espèces Lactobacillus plantarum et Lactobacillus delbrueckii dans le chibuku. Sawadogo-Lingani et al. (2007) ont identifié dans le dolo et le pito Lactobacillus fermentum et Lb. delbrueckii, tandis que Djè et al. (2009) ont identifié Lb. fermentum, Lactobacillus cellobiosus, Lactobacillus brevis, Lactobacillus coprophilus, Lb. plantarum et Lactobacillus hilgardii du tchapalo (Tableau 1). L’espèce prépondérante dans ces bières traditionnelles est soit Lb. plantarum, soit Lb. fermentum. Toutes ces variations au niveau des bactéries lactiques pourraient être liées à la méthode d’identification ou aux ingrédients et ustensiles utilisés dans la préparation de la bière. En effet, Sawadogo-Lingani et al. (2010) ont identifié Lb. fermentum, Pediococcus acidilactici, Pediococcus pentosaceus, Weissella confusa, Lactococcus lactis et Enterococcus faecium sur les grains de sorgho, sur le malt et dans l’eau de trempage. Par ailleurs, les isolats identifiés comme Lb. delbrueckii par Sawadogo-Lingani et al. (2007) ont été ré-identifiés comme Lb. fermentum par Adimpong et al. (2012) sur la base de leur séquence nucléotidique au niveau de la région 16S rDNA. Aussi, par l’utilisation de galerie API 50 CH, Lyumugabe et al. (2010) ont identifié de l’ikigage, bière de sorgho rwandaise, les espèces Lb. fermentum, Lactobacillus buchneri, Lactobacillus sp., Muyanja et al. (2003) et Adewara et al. (2013) ont identifié respectivement du Bushera, bière de sorgho ougandaise et du Burukutu nigérian, plusieurs espèces de bactéries lactiques appartenant principalement aux genres Lactobacillus, Streptococcus, Enterococcus et Pediococcus. Par ailleurs, Okereke et al. (2008), par la méthode d’identification chromatographique des acides aminés sur la membrane cellulaire, ont identifié du Burukutu plusieurs espèces appartenant aux genres Lactobacillus, Lactococcus, Leuconostoc, Pediococccus et Streptococcus.
3.2. Les espèces de levures isolées
13Les levures interviennent spécifiquement au niveau de la fermentation alcoolique et ont été l’objet de nombreuses études (Sefa-Dedeh et al., 1999 ; van der Aa Kühle et al., 2001 ; Naumova et al., 2003 ; Glover et al., 2005 ; Maoura et al., 2005 ; Kayodé et al., 2011 ; N’guessan et al., 2011 ; Jimoh et al., 2012 ; Adewara et al., 2013 ; Greppi et al., 2013). Il ressort de ces différentes études que les bières renferment une diversité d’espèces de levures variant suivant les pays et les auteurs (Tableau 2). Cette variation de la composition des populations de levures responsables de la fermentation des bières de sorgho serait liée à la région et aux différences dans la technologie de production, incluant l’utilisation de différents ingrédients (van der Aa Kühle et al., 2001 ; Jespersen, 2003). Saccharomyces cerevisiae est l’espèce prépondérante, selon plusieurs auteurs, traduisant ainsi qu’il s’agit d’une fermentation alcoolique. Cependant, les pourcentages rapportés varient d’un auteur à l’autre. Les chiffres de 33-38 %, 55-90 %, 87,36 %, 99 % sont avancés par les différents auteurs pour les bières produites au Togo, au Ghana, en Côte d’Ivoire et au Burkina Faso respectivement (Konlani et al., 1996 ; Sefa-Dedeh et al., 1999 ; van der Aa Kühle et al., 2001 ; Naumova et al., 2003 ; Glover et al., 2005 ; Maoura et al., 2005 ; N’guessan et al., 2011).
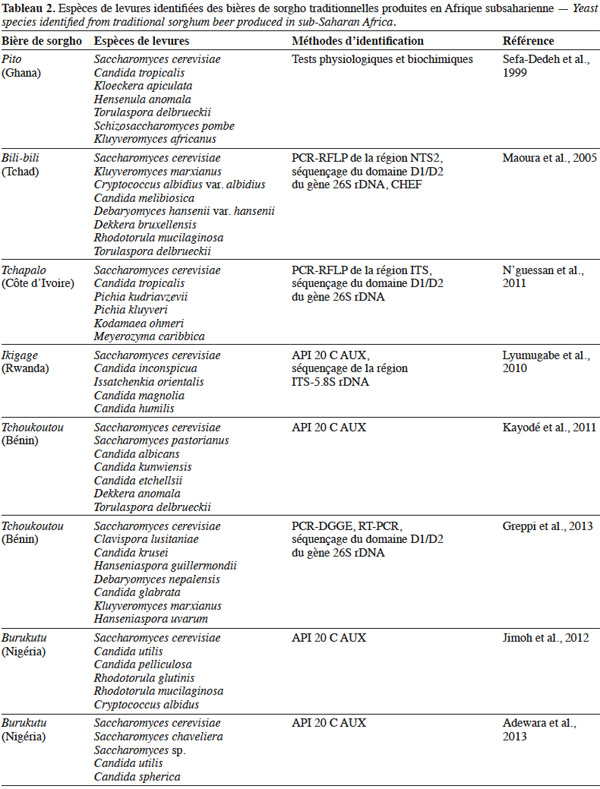
14Au niveau des espèces non-Saccharomyces, l’espèce dominante varie suivant l’origine géographique de la bière : Candida tropicalis dans le cas du pito et du tchapalo (Sefa-Dedeh et al., 1999 ; N’guessan et al., 2011), Clavis poralusitaniae dans le cas du tchoukoutou (Greppi et al., 2013), Candida inconspicua dans le ikigage (Lyumugabe et al., 2010) et Kluyveromyces marxianus dans la bili-bili (Maoura et al., 2005). Par ailleurs, les espèces non-Saccharomyces sont beaucoup présentes en début de fermentation. Elles initient donc la fermentation avant de laisser la place à S. cerevisiae. Greppi et al. (2013) ont ainsi montré que les espèces non-Saccharomyces représentent 95 % des isolats à 0 h de fermentation et seulement 5 % des isolats à 4 h de fermentation. Des résultats similaires ont été rapporté par N’guessan et al. (2011). Certaines espèces non-Saccharomyces sont isolées de façon sporadique au cours de la fermentation. C’est le cas de Kodamaea ohmeri, Pichia kudriavzevii et Pichia kluyveri dans le tchapalo (N’guessan et al., 2011) ou de Candida glabrata et Debaryomyces nepalensis dans le tchoukoutou (Greppi et al., 2013). Ces espèces sont donc considérées comme des contaminants.
4. Spécificité des souches de Saccharomyces cerevisiae isolées
15Majoritairement isolée et identifiée dans les bières de sorgho, l’espèce S. cerevisiae a fait l’objet de plusieurs études afin de discriminer les souches de cette espèce (van der Aa Kühle et al., 2001 ; Maoura et al., 2005 ; Kayodé et al., 2011 ; N’guessan et al., 2011). Ainsi, van der Aa Kühle et al. (2001) ont montré que 53 % des S. cerevisiae isolés du pito produit au Ghana et du dolo produit au Burkina Faso présentent un profil physiologique atypique. Ils ne peuvent assimiler que le glucose, le maltose et l’éthanol comme sources de carbone. Par ailleurs, le séquençage partiel du domaine D1/D2 de l’ADN codant la sous-unité ribosomique 26S (26S rDNA) ainsi que la recherche du gène MAL a confirmé la différence de certains des isolats de S. cerevisiae avec l’espèce type S. cerevisiae CBS1171. En effet, ces chercheurs ont trouvé trois nucléotides de différence au niveau du domaine séquencé et la présence d’un locus MAL non encore décrit à la position 950 kpb (kilopaire de bases) chez 40 % des S. cerevisiae isolés du pito.
16Naumova et al. (2003) ont aussi montré que les isolats de S. cerevisiae atypiques sur la base de leur profil d’assimilation des sources de carbone sont différents de l’espèce type au niveau moléculaire. Ainsi, ils ont rapporté trois nucléotides de différence par rapport à la souche type au niveau de la région ITS1 du rDNA. Par ailleurs, cette même région a présenté une particularité pour deux souches (souches A12 et D3). Ces souches portent une insertion de 7 à 14 thymines aux positions 28-39. Ces auteurs ont aussi souligné que les S. cerevisiae isolés du pito diffèrent de l’espèce type au niveau des gènes SUC et RTM. En effet, l’espèce type S. cerevisiae possède sept loci SUC, tandis que les souches isolées de la bière de sorgho n’en possèdent qu’un seul (SUC2). En outre, ces souches ne possèdent pas de gène RTM, ce qui suggère une origine génétique différente pour les S. cerevisiae d’origine africaine et d’origine européenne (Naumova et al., 2003). Glover et al. (2005), à partir du profil d’assimilation des sources de carbone, de l’analyse du gène mitochondrial COX 2 et du gène ACT1, ont confirmé que des souches aberrantes de S. cerevisiae sont largement présentes dans le pito au Ghana.
17Comme dans le pito, des souches de S. cerevisiae différentes aux niveaux physiologique et moléculaire ont été isolées de la bili-bili et du tchapalo. Dans la bili-bili, le caryotypage à partir de la technique CHEF (Contour Clamped Homogenous Electric Field) de 32 isolats identifiés comme S. cerevisiae a révélé que 65 % des isolats possèdent six chromosomes (I, VI, III, IX, V et VIII) plus petits que ceux de la souche de référence S. cerevisiae YNN295 (Maoura et al., 2005). En outre, les souches isolées de la bili-bili ne fermentent pas le maltose en présence de 2-désoxy-D-glucose, un analogue de glucose non métabolisable. Cependant, les souches industrielles de S. cerevisiae, dans les mêmes conditions, fermentent le maltose avec une production de gaz (Maoura et al., 2005). Dans le tchapalo, les souches de S. cerevisiae ont trois à quatre nucléotides de différence avec l’espèce type au niveau du domaine D1/D2 du 26S rDNA (N’guessan et al., 2011). Ces souches présentent aussi plusieurs insertions/délétions au niveau de l’intron le plus discriminant du gène ACT1.
18Même si les différences au niveau de la séquence nucléotidique des régions séquencées pouvaient être dues à des erreurs de séquençage, comme le pensent Naumova et al. (2003), les différences au niveau des gènes analysés montrent bien que les S. cerevisiae isolés des bières de sorgho produites en Afrique subsaharienne sont différents de l’espèce type. Une future révision de la taxonomie actuelle devrait donc prendre en compte une large sélection des souches provenant de tous les habitats (van der Aa Kühle et al., 2001).
5. Fermentations avec les starters sélectionnés
19L’utilisation des cultures starters dans les fermentations permet d’améliorer les conditions de fermentation et la qualité du produit à travers des activités métaboliques accélérées (acidification ou production d’alcool), des processus de fermentation améliorés et plus prévisibles, des caractères sensoriels désirés, une sécurité améliorée et des risques hygiéniques et toxicologiques réduits (Holzapfel, 1997). Aussi, plusieurs essais de production des bières de sorgho ont été réalisés avec différents starters sélectionnés afin de trouver le meilleur starter (Tableau 3). Ainsi, Sawadogo-Lingani et al. (2008) ont testé quatre souches de Lb. fermentum et une souche de S. cerevisiae dans une série de trois essais :
20– une production de dolo par une double fermentation lactique avec Lb. fermentum puis alcoolique avec S. cerevisiae ;
21– une production de dolo par une co-fermentation lactique et alcoolique avec Lb. fermentum + S. cerevisiae ;
22– une production de dolo en milieu réel par une double fermentation lactique puis alcoolique avec les mêmes souches que précédemment.
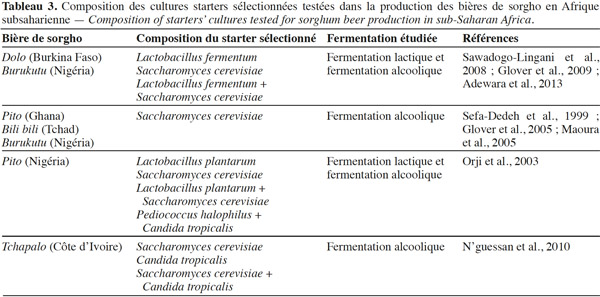
23Les résultats ont montré que les différents starters ont permis une réduction de la durée de la fermentation lactique (9 h au lieu de 12-16 h) et de la fermentation lactique + alcoolique (12 h au lieu de 21-48 h) dans le cas de la co-fermentation. Par ailleurs, l’analyse sensorielle a révélé que les dolos produits avec les starters sélectionnés ont présenté des caractéristiques organoleptiques et physico-chimiques comparables à celles du dolo traditionnel et ont été jugées acceptables par les dégustateurs. Pour une production améliorée du tchapalo, N’guessan et al. (2010) ont testé S. cerevisiae et Candida tropicalis en starter singulier et starter multiple à différentes proportions. Orji et al. (2003) ont testé Lb. plantarum, S. cerevisiae, Pediococcus halophilus et C. tropicalis à différentes combinaisons.
24Ces différentes études ont montré, pour la plupart, que les starters sélectionnés entrainent une réduction de la durée de fermentation ainsi qu’une amélioration du procédé de production des bières. De plus, ces starters sélectionnés conduisent à des bières de sorgho de caractéristiques physico-chimiques et sensorielles (pH, couleur, acidité titrable, taux d’alcool, gravité spécifique, gout, flaveur, etc.) comparables aux bières produites de façon traditionnelle (Sefa-Dedeh et al., 1999 ; Orji et al., 2003 ; Glover et al., 2005).
6. Conclusion
25Les levures, en particulier l’espèce S. cerevisiae, sont les micro-organismes majoritairement identifiés au cours de la fermentation de la majeure partie des bières de sorgho produites en Afrique. Leur principale fonction comprend la production d’alcool et secondairement la formation de polyalcools, d’acides organiques et d’une grande variété de composés volatils, de composés aromatiques ainsi que d’autres effets tels que l’amélioration de la qualité nutritionnelle, l’élaboration de la texture des bières et la dégradation des composés toxiques. Afin d’améliorer et de contrôler le processus de production et particulièrement l’étape de la fermentation alcoolique, des cultures starters sont de plus en plus utilisées. Cependant, la plupart de ces cultures starters sont introduites au cours de la fermentation sous la forme de suspensions microbiennes fraiches difficiles à conserver sur de longues périodes. Pour pallier à ce problème, l’utilisation de cultures starters séchées (lyophilisation, atomisation, séchage à lit fluidisé), actives et stables au cours de leur stockage, pourrait être une solution viable et durable.
Bibliographie
Adewara A.O. & Ogunbanwo S.T., 2013. Effects of processing variables on the production of “Burukutu”, a Nigerian fermented beverage. Nat. Sci., 11, 16-28.
Adimpong D.B. et al., 2012. Genotypic characterization and safety assessment of lactic acid bacteria from indigenous African fermented food products. BMC Microbiol., 12, 75-86.
Aka S. et al., 2008. Variabilité des propriétés physico-chimiques et dénombrement de la flore fermentaire du « tchapalo », une bière traditionnelle de sorgho en Côte d’Ivoire. Afr. Sci., 4(2), 274-286.
Alais C. & Linden G., 1997. Abrégé de biochimie alimentaire. 4e éd. Paris : Masson, 160-165.
Asiedu J.J., 1989. La transformation des produits agricoles en zone tropicale : approche technologique. Paris : Karthala ; Wageningen, Pays-Bas : CTA, 245-285.
Ballogou V.Y., Dossou J. & de Souza C.A., 2011. Controlled drying effect on the quality of sorghum malts used for the chakpalo production in Benin. Food Nutr. Sci., 2, 156-161.
Bhise V.J., Chavan J.K. & Kadam S.S., 1988. Effects of malting on proximate composition and in vitro protein digestibilities of grain sorghum. J. Food Sci. Technol., 25, 327-329.
Chevassus-Agnès S., Favier J.C. & Joseph A., 1976. Technologie traditionnelle et valeur nutritive des bières de sorgho du Cameroun. Cah. Nutr. Diet., 11, 89-104.
Djè K.M., N’guessan K.F., Djeni N.T. & Dadié A.T., 2008. Biochemical changes during alcoholic fermentation in the production of tchapalo, a traditional sorghum beer. Int. J. Food Eng., 4(7).
Djè K.M. et al., 2009. Predominant lactic acid bacteria involved in the spontaneous fermentation step of tchapalo process, a traditional sorghum beer of Côte d’Ivoire. Res. J. Biol. Sci., 4(7), 789-795.
FAO, 1995. Le sorgho et les mils dans la nutrition humaine. FAO Aliment et Nutrition, séries n°27. Rome : FAO.
Glover R.L.K., Abaidoo R.C., Jakobsen M. & Jespersen L., 2005. Biodiversity of Saccharomyces cerevisiae isolated from a survey of pito production sites in various parts of Ghana. Syst. Appl. Microbiol., 28, 755-761.
Glover R.L.K. et al., 2009. Utilization of Lactobacillus fermentum and Saccharomyces cerevisiae as starter cultures in the production of “dolo”. J. Appl. Biosci., 22, 1312-1319.
Greppi A. et al., 2013. Yeast dynamics during spontaneous fermentation of mawè and tchoukoutou, two traditional products from Benin. Int. J. Food Microbiol., 165, 200-207.
Holzapfel W.H., 1997. Use of starter cultures in fermentation on a household scale. Food Control, 8, 241-258.
Jespersen L., 2003. Occurrence and taxonomic characteristics of strains of Saccharomyces cerevisiae predominant in African indigenous fermented foods and beverages. FEMS Yeast Res., 3, 191-200.
Jimoh S.O., Ado S.A., Ameh J.B. & Whong C.M.Z., 2012. Characteristics and diversity of yeast in locally fermented beverages sold in Nigeria. World J. Eng. Pure Appl. Sci., 2, 40-44.
Kayodé A.P.P. et al., 2005. Quality of farmers varieties of sorghum and derived foods as perceived by consumers in Benin. Ecol. Food Nutr., 44, 271-294.
Kayodé A.P.P. et al., 2011. Diversity of yeasts involved in the fermentation of tchoukoutou, an opaque sorghum beer from Benin. Afr. J. Microbiol. Res., 5(18), 2737-2742.
Konlani S. et al., 1996. Isolation and physiological characterization of yeasts involved in sorghum beer production. Food Biotechnol., 10, 29-40.
Lyumugabe F., Kamaliza G., Bajyana E. & Thonart Ph., 2010. Microbiological and physico-chemical characteristic of Rwandese traditional beer “Ikigage”. Afr. J. Biotechnol., 9, 4241-4246.
Maoura N. et al., 2005. Identification and typing of the yeast strains isolated from bili bili, a traditional sorghum beer of Chad. Afr. J. Biotechnol., 4, 646-656.
Maoura N., Mbaiguinam M., Gaillardin C. & Pourquie J., 2006. Suivi technique, analytique et microbiologique de la “bili bili”, bière traditionnelle tchadienne. Afr. Sci., 2, 69-82.
Morrall P., Boyd H.K., Taylor J.R.N. & Van Der Walt W.H., 1986. Effect of germination time, temperature and moisture on malting of sorghum (Sorghum bicolor). J. Inst. Brew., 92, 439-445.
Muyanja C.M.B.K., Narvhus J.A., Treimo J. & Langsrud T., 2003. Isolation, characterisation and identification of lactic acid bacteria from bushera: a Ugandan traditional fermented beverage. Int. J. Food Microbiol., 80, 201-210.
N’da A.K. & Coulibaly S., 1996. Étude comparative de procédés traditionnels de préparation d’une bière locale appelée tchapalo. In : Actes de la 2e Journée annuelle de la SOACHIM, 29 juillet-3 aout 1996, Dakar, Sénégal, 40-46.
N’guessan F.K., N’Dri D.Y., Camara F. & Dje M.K., 2010. Saccharomyces cerevisiae and Candida tropicalis as starters cultures for the alcoholic fermentation of tchapalo, a traditional sorghum beer. World J. Microbiol. Biotechnol., 26, 693-699.
N’guessan K.F. et al., 2011. Identification of yeasts during alcoholic fermentation of tchapalo, a traditional sorghum beer from Côte d’Ivoire. Antonie van Leeuwenhoek, 99, 855-864.
Naumova E.S., Korshunova I.V., Jespersen L. & Naumov G.I., 2003. Molecular genetic identification of Saccharomyces sensu stricto strains from African sorghum beer. FEMS Yeast Res., 3, 177-184.
Odunfa S.A., 1985. African fermented foods. In: Wood B.J.B., ed. Microbiology of fermented foods. London; New York, USA: Elsevier Applied Science Publishers, 155-191.
Okafor N. & Aniche G.N., 1980. Brewing a lager beer from Nigerian sorghum. Brew. Distilling Int., 10, 32-35.
Okereke H.C. & Okereke J.I., 2008. Identification of lactic acid bacteria using cell wall amino acids. Niger. J. Microbiol., 22, 1719-1724.
Orji M.U., Mbata T.I., Aniche G.N. & Ahonkhai I., 2003. The use of starter cultures to produce “Pito”, a Nigerian fermented alcoholic beverage. World J. Microbiol. Biotechnol., 19, 733-736.
Pale S., Taonda S.J.-B., Bougouma B. & Mason S.C., 2010. Sorghum malt and traditional beer (Dolo) quality assessment in Burkina Faso. Ecol. Food Nutr., 49, 129-141.
Panasiuk O. & Bills D.P., 1984. Cyanide content of sorghum sprouts. J. Food Sci., 49, 791-793.
Périsse J., Adrian J., Rérat A. & Le Berre S., 1959. Bilan nutritif de la transformation du sorgho en bière ; préparation, composition, consommation d’une bière au Togo. Ann. Nutr. Alimentation, 13(1).
Sawadogo-Lingani H. et al., 2007. The biodiversity of predominant lactic acid bacteria in dolo and pito wort for the production of sorghum beer. J. Appl. Microbiol., 103, 765-777.
Sawadogo-Lingani H., Diawara B., Traoré A.S. & Jakobsen M., 2008. Utilisation de souches sélectionnées de Lactobacillus fermentum et un isolat de levure comme cultures starter dans la production du dolo, une boisson fermentée à base de sorgho. Sci. Tech., 2, 61-84.
Sawadogo-Lingani H. et al., 2010. Predominant lactic acid bacteria associated with the traditional malting of sorghum grains. Afr. J. Microbiol. Res., 4, 169-179.
Sefa-Dedeh S., Sanni A.I., Tetteh G. & Sakyi-Dawson E., 1999. Yeasts in the traditional brewing of pito in Ghana. World J. Microbiol. Biotechnol., 15, 593-597.
Togo C.A., Feresu S.B. & Mutukumira A.N., 2002. Identification of lactic acid bacteria isolated from opaque beer (chibuku) for potential use as a starter culture. J. Food Technol. Afr., 7(3), 93-97.
Traoré T. et al., 2004. Changes in nutrient composition, phytate and cyanide contents and a-amylase activity during cereal malting in small production units in Ouagadougou (Burkina Faso). Food Chem., 88, 105-114.
Van der Aa Kühle A. et al., 2001. Identification and characterization of Saccharomyces cerevisiae strains isolated from West African sorghum beer. Yeast, 18, 1069-1079.
Yao A.A., Egounlety M., Kouamé L.P. & Thonart Ph., 2009. Les bactéries lactiques dans les aliments ou boissons amylacés et fermentés de l’Afrique de l’Ouest : leur utilisation actuelle. Ann. Méd. Vét., 153, 54-65.
Yao A.K., Kadio N., Coulibaly A. & Agbo G.N., 1995. Production du “tchapalo” à partir du sorgho en Côte d’Ivoire. In : Menyonga J.M. et al., eds. Proceedings of the OUA⁄STRC-SAFGRAD regional symposium, Processing and industrial utilization of sorghum and related cereals in Africa. Ouagadougou: AUO/STRC-SAFGRAD, 55-60.






