- Accueil
- Volume 18 (2014)
- numéro 2
- Synthèse bibliographique : l’écologie larvaire des culicoïdes (Diptera : Ceratopogonidae)
Visualisation(s): 0 (0 ULiège)
Téléchargement(s): 0 (0 ULiège)
Synthèse bibliographique : l’écologie larvaire des culicoïdes (Diptera : Ceratopogonidae)

Notes de la rédaction
Reçu le 29 mai 2013, accepté le 12 novembre 2013
Résumé
Cet article présente une synthèse de l’écologie larvaire des culicoïdes (Diptera : Ceratopogonidae) en vue de rassembler les connaissances, souvent très parsemées, des sites d’oviposition et des habitats larvaires actuellement identifiés à travers le monde pour les principales espèces de culicoïdes. Ces moucherons piqueurs hématophages sont impliqués dans la transmission de divers parasites (protozoaires et filaires) et virus aux animaux. Le développement larvaire des culicoïdes est généralement optimal dans les substrats humides et riches en débris organiques divers. Cependant, chaque espèce présente ses propres exigences écologiques et se trouve par conséquent dans des micro-habitats spécifiques. Dans cette synthèse, les gites larvaires sont répartis en substrats aquatiques et semi-aquatiques d’eau douce et d’eau salée ou saumâtre, substrats terrestres et substrats anthropiques liés à l’élevage. Les gites larvaires de nombreuses espèces appartenant au genre Culicoides Latreille demeurent cependant encore méconnus. La connaissance de ces derniers et leur caractérisation sont pourtant essentielles pour permettre la mise au point de stratégies de lutte efficaces contre ces insectes vecteurs, permettant ainsi de renforcer la vaccination du bétail et les autres moyens de lutte mis en œuvre. Les habitats larvaires actuellement identifiés pourraient permettre d’orienter les investigations des recherches écologiques futures et les propositions de contrôle de ces moucherons vecteurs.
Abstract
Review: larval ecology of Culicoides biting midges (Diptera: Ceratopogonidae). This paper reviews the larval ecology of Culicoides Latreille (Diptera: Ceratopogonidae) in order to bring together knowledge, often very scattered, of breeding sites currently identified worldwide for the main species of Culicoides biting midges. These bloodsucking midges are involved in the transmission to animals of various parasites (protozoa and filarial worms) and viruses. Larval development of Culicoides is usually better in moist substrates rich in organic matter. Each species, however, has its own ecological requirements and therefore has its own specific microhabitat. In this review breeding sites are divided into aquatic and semi-aquatic freshwater substrates, salt or brackish water substrates, terrestrial substrates and anthropic substrates linked to breeding activity. The larval habitats of many species of the genus Culicoides, however, remain undiscovered. Knowledge of breeding sites and their characterization are essential in order to allow the development of effective control strategies against these vector insects, thus allowing the strengthening of livestock vaccination programs and other control methods. The study of currently identified breeding sites could help in guiding the direction of future ecological research investigations and in developing proposals to control these vector midges.
Table des matières
1. Introduction
1De nombreux arthropodes sont susceptibles de jouer un rôle dans la transmission de divers pathogènes responsables de maladies animales. Les Diptères hématophages constituent une part importante de ces vecteurs. Parmi ceux-ci se retrouvent les culicoïdes, qui sont des moucherons piqueurs dont la taille est comprise entre 1 et 4 mm, appartenant à la famille des Ceratopogonidae et au genre Culicoides Latreille (Du Toit, 1944). Ces moucherons hématophages sont impliqués dans la transmission de divers parasites et virus aux animaux (Mellor et al., 2000). Ils sont ainsi responsables de la transmission de protozoaires et filaires, mais aussi de plus de cinquante virus appartenant aux familles des Reoviridae, Bunyaviridae et Rhabdoviridae (Mellor et al., 2000) ; certains de ces virus présentent un intérêt en santé animale, tels que les virus Oropouche, de la Peste équine (PE), de la Fièvre Catarrhale Ovine (FCO) (Du Toit, 1944 ; Mellor et al., 1979) et plus récemment de la maladie de Schmallenberg (SB) (Hoffmann et al., 2012). Parmi près de 1 400 espèces de culicoïdes décrites à travers le monde (Borkent, 2012), seule une trentaine d’espèces jouent cependant le rôle de vecteur biologique des virus de la FCO et de SB (Mellor, 1990 ; Mellor et al., 2000 ; Mehlhorn et al., 2007 ; Meiswinkel et al., 2007 ; Balenghien et al., 2008 ; Carpenter et al., 2008 ; Dijkstra et al., 2008 ; De Regge et al., 2012 ; Rasmussen et al., 2012 ; Veronesi et al., 2013). Ces deux dernières maladies (FCO et SB), qui affectent les ruminants domestiques et sauvages, ont respectivement été signalées en Europe du Nord en 2006 (Thiry et al., 2006) et 2011 (Hoffmann et al., 2012) ; des pertes économiques considérables ont été enregistrées en cheptel ovin et bovin (Saegerman et al., 2008 ; Velthuis et al., 2010). Les piqûres de culicoïdes peuvent de plus être responsables de réactions d’hypersensibilité générant des allergies, telles que la dermatite estivale du cheval (Riek, 1954 ; Nakamura et al., 1956). L’abondance de ces moucherons peut finalement constituer une véritable nuisance, suite au désagrément causé par la piqûre des femelles. Leur présence peut donc gêner l’essor économique de certaines régions en entravant les activités agricoles et forestières, ainsi que le développement du tourisme (Hendry et al., 1988).
2Ces éléments justifient l’intérêt porté par le monde scientifique à l’étude des culicoïdes. De nombreux chercheurs se sont intéressés aux moucherons adultes (systématique, biologie, physiologie, etc.), mais bien moins aux larves. De nombreuses inconnues subsistent de ce fait encore sur ces dernières, en particulier leur identification spécifique et les habitats favorables au développement de nombreuses espèces. L’écologie larvaire constitue pourtant un élément fondamental au sein d’un système vectoriel, comme illustré à la figure 1. La connaissance des gites larvaires et leur caractérisation sont en effet indispensables pour aider à comprendre la distribution locale des espèces et permettre la mise au point de méthodes de lutte et d’assainissement (principalement mécanique et chimique) ciblées contre ces insectes vecteurs. Ces dernières viendraient ainsi en renfort de la vaccination du bétail, des moyens visant à limiter l’accès de ces moucherons piqueurs aux animaux d’élevage et des mesures visant à limiter les déplacements de ruminants.
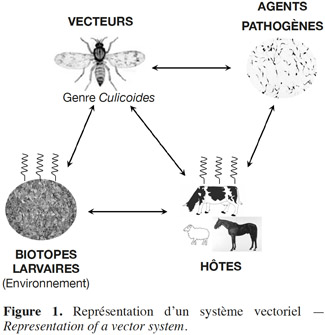
3Après quelques généralités sur les culicoïdes, cet article présente une synthèse des habitats larvaires actuellement identifiés à travers le monde pour ces moucherons piqueurs.
2. Culicoïdes
2.1. Cycle biologique
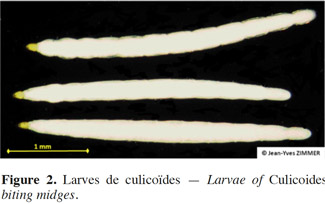
4Les culicoïdes femelles adultes sont généralement hématophages et prennent de ce fait un repas sanguin tous les 3-4 jours environ (Birley et al., 1982), nécessaire pour la maturation des œufs. La ponte survient 2 à 4 jours après la prise alimentaire. Les larves de culicoïdes sont vermiformes, de couleur claire et dépourvues de pseudopodes (Figure 2). Elles présentent une tête dominée par une capsule céphalique sclérifiée brun clair, un thorax constitué de trois segments et un abdomen formé de neuf segments. Elles se nourrissent de débris organiques divers ou sont prédatrices de nématodes, protozoaires, bactéries, champignons, algues, etc. voire même de leurs propres congénères (Kettle, 1962). Le développement larvaire, dont la durée dépend des conditions climatiques et des espèces (Chaker, 1983), passe par quatre stades. Les nymphes, mobiles mais peu actives, se caractérisent quant à elles par un céphalothorax portant deux trompettes respiratoires assurant leur respiration aérienne et un abdomen se terminant par deux tubercules coniques (Figure 3). Ces nymphes peuvent se présenter sous forme libre ou attachées à divers débris organiques. À l’émergence, les adultes sont d’abord clairs puis se colorent rapidement. Les imagos s’accouplent peu après l’éclosion, lors de vols nuptiaux ou au niveau du sol (Chaker, 1983).

5Le comportement trophique des femelles pourrait justifier le fait qu’on les rencontre principalement au niveau du sol, à proximité immédiate du bétail (Rieb, 1982). Les culicoïdes peuvent être plus abondants à l’intérieur des bâtiments d’élevage qu’à l’extérieur, lorsque les animaux sont présents dans l’étable ou la bergerie (Zimmer et al., 2008b ; Zimmer et al., 2009 ; Zimmer et al., 2014). Les mâles sont quant à eux généralement floricoles (Goetghebuer, 1952) : ils se nourrissent donc de nectar, de sucre et de pollen, ainsi que de liquides provenant de la décomposition de matières organiques (Chaker, 1983). De ce fait, les mâles semblent fréquenter préférentiellement la végétation et le sommet des arbres (Rieb, 1982 ; Kluiters et al., 2013).
2.2. Écologie des adultes
6De nature crépusculaire à nocturne, la plupart des espèces sont au repos au niveau de la végétation durant la journée et fréquentent alors la face inférieure des feuilles ou des herbes situées dans les zones ombragées. La survie, l’activité et la dispersion de ces moucherons piqueurs sont fortement influencées par les variables météorologiques telles que la température, l’humidité, l’agitation de l’air, la phase lunaire, etc. La température est sans doute l’élément majeur influençant leur comportement et leur survie, leur activité étant significative entre 13 °C et 35 °C, malgré certaines variations interspécifiques (Braverman et al., 1996). Une humidité élevée joue également un rôle important pour le développement et la survie des culicoïdes, principalement pour les stades larvaires, très sensibles à la dessication (Murray, 1991). La dispersion active des culicoïdes étant très limitée (Mellor et al., 2000), la direction et la force du vent assurent leur propagation par dispersion passive (Mellor et al., 1983 ; Braverman et al., 1996). Cette dispersion passive peut ainsi propager ces insectes vers de nouvelles régions et expliquer certaines épizooties constatées ces dernières années, telles que celle enregistrée en Espagne (Mellor et al., 1983). Notons finalement que leur activité est très limitée lors des phénomènes de pleine lune (Bishop et al., 2000).
7Généralement, deux générations sont observées par an : une principale au printemps et une, de moindre importance, en été (Rieb, 1982). Ce phénomène s’explique par la possibilité d’estivo-hibernation des larves issues de la génération de printemps. La phénologie des culicoïdes varie en fonction des espèces. Certaines espèces ont en effet une répartition plus large au cours de l’année, tandis que d’autres ne se rencontrent que peu de temps.
2.3. Écologie larvaire
8Le développement larvaire des culicoïdes est optimal au sein des milieux semi-aquatiques, principalement représentés par les substrats humides et riches en débris organiques divers (Goetghebuer, 1952 ; Chaker, 1983 ; Zimmer et al., 2008a). L’humidité et la nutrition sont en effet primordiales à la croissance et au développement des larves (Kettle, 1977). Elles sont retrouvées majoritairement au sein de la couche superficielle de ces habitats et plus précisément dans les cinq à six premiers centimètres de substrat (Blackwell et al., 1997 ; Uslu et al., 2006). La distribution et le mouvement des larves de culicoïdes sont donc souvent étroitement liés à la fluctuation du niveau de l’eau dans les sols, tel que suggéré par Kettle et al. (1959) pour Culicoides impunctatus Goetghebuer. Ces larves présentent de plus un phototropisme négatif lorsqu’elles sont repues et positif quand elles sont à jeun (Becker, 1958).
9Les gites larvaires sont particulièrement variés (Havelka, 1978 ; Mullen et al., 1988), chaque espèce présentant ses propres exigences écologiques et fréquentant par conséquent des micro-habitats spécifiques (Figure 4). Bien entendu, tout habitat larvaire renferme généralement une association d’espèces écologiquement proches (Zimmer et al., 2008a ; Zimmer et al., 2013c).

10Kettle et al. (1952) ont identifié six types d’habitats larvaires dans lesquels les différentes espèces de culicoïdes de Grande-Bretagne se répartissent. Ils considèrent ainsi :
11– les sols acides oligotrophes des tourbières fréquentés par C. impunctatus ;
12– les marais d’eau douce eutrophes dominés par Culicoides kibunensis Tokunaga et Culicoides pallidicornis Kieffer ;
13– les marais dont le niveau d’eau est situé au-dessus de la surface du sol fréquentés par Culicoides festivipennis Kieffer, Culicoides pulicaris (L.), Culicoides punctatus (Meigen) & Culicoides fascipennis (Staeger) ;
14– la boue dépourvue de végétation privilégiée par C. festivipennis mais également par Culicoides stigma (Meigen), Culicoides nubeculosus (Meigen), Culicoides riethi Kieffer et Culicoides circumscriptus Kieffer ;
15– les marais salants appréciés par Culicoides maritimus Kieffer, Culicoides halophilus (Kieffer), Culicoides salinarius (Kieffer) et C. circumscriptus ;
16– les bouses (d’origine bovine et équine) renfermant des larves de Culicoides chiopterus (Meigen) et Culicoides dewulfi Goetghebuer.
17Dans le cadre de cette synthèse bibliographique, les gites larvaires décrits ci-dessous seront cependant répartis au sein de quatre types d’habitats plus généraux :
18– les substrats aquatiques et semi-aquatiques d’eau douce qui englobent les étangs, mares, rives, fossés, rivières, canaux d’irrigation, flaques, marais, tourbières et tout autre substrat (partiellement) inondé par de l’eau douce ;
19– les substrats aquatiques et semi-aquatiques d’eau salée ou saumâtre réunissant les flaques et fossés d’eau salée, plages sablonneuses, mangroves, marais salants et tout autre substrat (partiellement) inondé par de l’eau salée ou saumâtre ;
20– les substrats terrestres correspondant aux substrats forestiers, des prairies et des cultures, trous d’arbres, souches et cactus en décomposition ;
21– les substrats anthropiques liés à l’élevage reprenant le fumier, l’ensilage, la paille, les bouses et les traces de passage des machines.
22Substrats aquatiques et semi-aquatiques d’eau douce. Foxi et al. (2010) ont tenté d’identifier les gites larvaires des espèces de culicoïdes présentes en Sardaigne, au sein d’une ferme de la région de Nurra incluant un étang permettant au bétail de se désaltérer. Ils ont observé que C. festivipennis fréquente les rives (couvertes ou non d’herbes) des étangs (comme observé précédemment par Kremer [1965]), Culicoides sahariensis Kieffer et C. circumscriptus se retrouvent par contre dans les boues collectées le long des rives dépourvues de végétation ; C. circumscriptus semble préférer les sols riches en matières organiques qui sont continuellement inondés, mais est cependant capable de s’adapter à une large gamme de conditions environnementales, justifiant ainsi sa présence au sein d’une grande variété d’habitats (Braverman et al., 1974 ; Uslu et al., 2007), tout comme Culicoides puncticollis (Becker), C. festivipennis et Culicoides imicola Kieffer ; cette dernière ciblant préférentiellement les substrats riches en matières organiques, saturés en eau et non inondés, alors que C. puncticollis préfère les milieux moins pollués en matières organiques (Braverman et al., 1974). Cette capacité d’adaptation à une très large gamme de gites larvaires humides (boues riches en matières organiques près des réservoirs d’eau, réserves d’eau de pluie, canaux d’irrigation ou des eaux usées, etc.) a également été observée en Turquie pour Culicoides gejgelensis Dzhafarov, Culicoides shaklawensis Khalaf et C. festivipennis (Uslu et al., 2007). Signalons toutefois que la préférence de C. festivipennis pour les zones humides gazonnées, ainsi que pour les grandes étendues de boues sans végétation situées en bordure des points d’eau pour le bétail a été montrée précédemment en Ukraine par Dubrovskaya (1980). Les espèces Culicoides jumineri Callot & Kremer, Culicoides cataneii Clastrier, Culicoides parroti Kieffer et Culicoides newsteadi Austen émergent quant à elles principalement d’une mare peu profonde couverte d’herbe ; ce gite larvaire avait déjà été identifié précédemment en Grande-Bretagne pour C. newsteadi (Kettle et al., 1952). Callot et al. (1969) ont d’autre part observé l’émergence de C. jumineri à partir d’échantillons de boue provenant des abords d’un canal d’irrigation en Tunisie. Pour C. cataneii, d’autres études soulignent sa préférence pour les milieux assez pauvres en matières organiques (Braverman et al., 1974) ou dans les substrats non pollués (Mellor et al., 1979). Les larves du groupe Culicoides schultzei Enderlein ont quant à elles été trouvées en Turquie dans des échantillons de boue riches en matières organiques, à proximité de réservoirs d’eau (Uslu et al., 2007). Ce dernier substrat était également fréquenté par les larves des espèces C. parroti, Culicoides subfasciipennis Kieffer et C. maritimus (Uslu et al., 2007). La boue localisée près de barrages a, quant à elle, révélé la présence de Culicoides odiatus Austen (Uslu et al., 2007). Dans cette dernière étude, un exemplaire de l’espèce C. salinarius a émergé de prélèvements réalisés au sein de canaux d’arrosage de jardin.
23Quelques larves d’espèces colombiennes (Culicoides iriartei Fox, Culicoides debilipalpis Lutz, Culicoides leoni Barbosa, Culicoides insignis Lutz, mais surtout Culicoides pachymerus Lutz, reconnue comme constituant un problème de santé publique dans les Andes colombiennes) affectionnent les substrats vaseux formés par les sources d’eau et l’accumulation constante d’eau de pluie (Carrasquilla et al., 2010). Aux États-Unis, les larves de C. insignis ont ainsi été récupérées dans les zones boueuses des pâturages, de même qu’au bord des étangs couverts de végétation (Kline et al., 1985). La boue des rizières d’Asie du Sud-Est abrite pour sa part Culicoides peregrinus Kieffer et Culicoides arakawae (Arakawa) (Howarth, 1985 ; Wirth et al., 1989). L’étude de l’habitat larvaire de plusieurs espèces australiennes connues pour s’attaquer au bétail a révélé que les espèces Culicoides marksi Lee & Reye et Culicoides victoriae Macfie se développent également en bordure des étangs (Lee et al., 1953). Ces deux dernières, ainsi que les espèces Culicoides austropalpalis Lee & Reye, Culicoides dycei Lee & Reye, Culicoides bunrooensis Lee & Reye et Culicoides multimaculatus Taylor ont de plus été observées au bord des eaux douces s’écoulant lentement (Dyce et al., 1965).
24L’espèce C. imicola (dont les pupes n’ont pas la capacité de remonter à la surface de l’eau lorsqu’elles sont immergées et finissent donc par se noyer lorsque le gite est inondé) est considérée par Nevill (1967) comme favorisant les habitats semi-humides, tels que la boue sèche issue des rives dépourvues de végétation d’un étang (Foxi et al., 2010), la boue partiellement couverte de végétation (Mellor et al., 1979) ou dénudée (Braverman et al., 1974 ; Lubega et al., 1976 ; Braverman, 1978). Meiswinkel et al. (2003) précisent d’autre part que cette espèce prédomine en Afrique du Sud dans les sols argileux organiquement enrichis et couverts ou non d’une végétation basse, dont la couche superficielle est capable de retenir l’humidité durant au moins sept jours afin de permettre un développement complet des larves.
25Les larves de C. pulicaris ont été observées dans les petites zones d’eau boueuse observées près des lacs, mares, tourbières et marais russes et français (Konurbayev, 1965 ; Kremer, 1965 ; Dzhafarov, 1976 ; Mirzaeva et al., 1976) et ont été prélevées en très faible quantité en Turquie dans des échantillons de boue humide présentant de la matière organique (Uslu et al., 2007). La vase des bords de mares et étangs semble également propice aux larves de Culicoides pictipennis (Staeger), Culicoides clastrieri Callot, Kremer & Deduit et Culicoides duddingstoni Kettle & Lawson en France (Kremer, 1965), C. peregrinus, Culicoides huffi Causey, Culicoides similis Carter, Ingram & Macfie, Culicoides palpisimilis Wirth & Hubert, Culicoides guttifer (Meijere), Culicoides flavescens Macfie et Culicoides oxystoma Kieffer en Asie du Sud-Est (Howarth, 1985 ; Wirth et al., 1989), C. nubeculosus et C. festivipennis en Belgique (Zimmer et al., 2013c). Les réservoirs d’eau stagnante et les marais présentant une végétation dense semblent aussi favorables aux membres du groupe Culicoides obsoletus (Meigen) (Dzhafarov, 1964 ; Dzhafarov, 1976) et à C. oxystoma (Wirth et al., 1989). La boue des bords de ruisseaux et rivières est fréquentée par Culicoides hegneri Causey, Culicoides calcaratus Wirth & Hubert, Culicoides kisangkini Howarth, Culicoides kamrupi Sen & Das Gupta, Culicoides geminus Macfie, Culicoides kepongensis Wirth & Hubert, Culicoides arenicola Howarth, C. oxystoma et C. huffi en Asie du Sud-Est (Howarth, 1985 ; Wirth et al., 1989) ; Culicoides longipennis Khalaf privilégie quant à elle le sable des cours d’eau (Kremer, 1965) et Culicoides pictilis Wirth & Hubert la boue du lit de la rivière (Wirth et al., 1989).
26Culicoides impunctatus est l’espèce dominante des tourbières humides et prairies marécageuses d’Europe du nord (Goetghebuer, 1952 ; Kettle, 1961 ; Kremer, 1965 ; Takken et al., 2008 ; Zimmer et al., 2013b) et d’une grande partie du Royaume-Uni (Hendry et al., 1988). Les larves de cette espèce se développent dans les sols humides des tourbières présentant une pente qui assure un flux constant d’eau, ainsi que dans les prairies acides voisines de ces tourbières (Kettle, 1961). Les zones plus humides de ces tourbières sont préférentiellement fréquentées par Culicoides albicans (Winnertz) et Culicoides heliophilus Edwards (Kremer, 1965), tandis que les prairies acides situées à plus grande distance de ces tourbières révèlent la présence de C. kibunensis et C. obsoletus (Kettle, 1961). Ces espèces se répartissent donc au sein d’un même milieu et peuvent ainsi cohabiter dans un même site de faible dimension, sans pour autant entrer en compétition. Culicoides impunctatus et Culicoides clintoni Boorman peuvent ainsi cohabiter au sein des sols des tourbières, cette dernière espèce favorisant les parties très humides (Kettle, 1961). Cette compétition peut par ailleurs être évitée par des espèces se développant à différentes profondeurs. Hill (1947) ainsi que Kettle et al. (1952) ont ainsi observé que les larves des espèces C. impunctatus, C. pallidicornis et C. obsoletus se concentrent en surface de leur gite (dans les 2,5 premiers centimètres), l’espèce C. kibunensis à moyenne profondeur, tandis que C. albicans et C. heliophilus se retrouvent à plus grande profondeur (en dessous de 5 cm). Les larves des espèces C. fascipennis, Culicoides grisescens Edwards et Culicoides segnis Campbell & Pelham-Clinton se développent également dans les sols des tourbières et les prairies marécageuses (Kremer, 1965), celles de Culicoides pseudoheliophilus Callot & Kremer favorisant les sous-bois marécageux (Kremer, 1965).
27Certaines espèces (Culicoides heliconiae Fox & Hoffman au Venezuela, de même que C. paraensis et Culicoides bayano Vitale, Wirth & Aitken au Panama) se retrouvent dans l’eau collectée par les broméliacées épiphytes (Fox et al., 1944 ; Vitale et al., 1981) et les bambous (Culicoides bambusicola Lutz au Brésil) (Lutz, 1913).
28Substrats aquatiques et semi-aquatiques d’eau salée ou saumâtre. La boue des marais côtiers du Brésil semble favorable au développement de quatre espèces, à savoir Culicoides maruim Lutz, Culicoides guyanensis Floch & Abonnenc, Culicoides reticulatus Lutz et C. insignis ; cette dernière espèce est connue comme étant l’une des plus nuisibles, les larves s’observant plus précisément dans les fossés inondés ou non par l’eau salée à marée haute (Raccurt et al., 1986), mais également dans les trous de crabes de cette même zone (Forratini et al., 1957). La boue recueillie au fond des terriers de crabes est également habitée par les larves de C. reticulatus au Brésil (Lutz, 1912), de Culicoides arubae Fox & Hoffman sur l’ile d’Aruba (Fox et al., 1944), de Culicoides wansoni Goetghebuer en République démocratique du Congo (Wanson, 1935) et présente également une densité larvaire généralement plus élevée pour l’espèce Culicoides belkini (Wirth & Arnaud) en Polynésie française (Lardeux et al., 1997). La densité larvaire de C. belkini en Polynésie française est généralement plus élevée dans les sédiments humides présentant une forte teneur en matière organique et une faible salinité (Lardeux et al., 1997). Selon les auteurs, cette espèce est cependant capable de se reproduire dans une grande variété de situations écologiques et présente, de ce fait, un fort potentiel de colonisation de nouveaux habitats. Les larves de C. guyanensis semblent privilégier la boue issue de fossés présentant une végétation pauvre, dans des endroits exposés au soleil tout au long de la journée, certains de ces fossés étant en contact avec de l’eau salée (Forratini et al., 1957). Culicoides phlebotomus (Williston) affectionne les faibles dépressions humides derrière les plages sablonneuses du Honduras, ainsi que l’eau de percolation à marée haute (Painter, 1926). Culicoides peliliouensis Tokunaga préfère les mangroves de l’intérieur des iles Carolines, non soumises à l’action des vagues (Dorsey, 1947). L’espèce Culicoides melleus (Coquillett) se développe dans le sable intertidal de la côte est de l’Amérique du Nord, en cherchant également une protection contre l’action des vagues (Jamnback et al., 1958 ; Jones, 1961). Culicoides canithorax Hoffman évolue parmi les hautes herbes dont la couche de boue est fine et les sols inondés par chaque marée haute (Jamnback et al., 1958).
29L’espèce C. circumscriptus fréquente les flaques d’eau des dunes de sable israéliennes (Braverman et al., 1974) et japonaises (Wirth et al., 1989). Selon une étude menée par Kremer et al. (1978) en Alsace (France), cette dernière espèce ainsi que C. riethi et C. salinarius constituent de bons indicateurs de pollution saline. Tout comme les trois espèces citées précédemment, les espèces C. nubeculosus, C. puncticollis, C. maritimus, C. halophilus Kieffer et Culicoides furens (Poey) semblent également halophiles (Edwards et al., 1939 ; Kremer, 1965 ; Chaker, 1983 ; Raccurt et al., 1986).
30Plusieurs auteurs se sont penchés sur l’espèce C. furens. Painter (1926) a mis en évidence son intérêt pour le sable et la vase des bords de mares du Honduras, ainsi que pour les mangroves dans une moindre mesure. Selon Myers (1935), ces larves semblent apprécier l’ombre des palétuviers des Bahamas, mais pas les zones dénudées ni l’ombre des salicornes. En Floride, ces larves sont dix fois plus nombreuses au bord de l’eau qu’au sein de la mangrove (Bidlingmayer, 1957). Culicoides furens fréquente également les zones ouvertes du canal de Panama, exposées au soleil et régulièrement inondées par les grandes vagues (Woke, 1954). Même si quelques gites larvaires ont été trouvés dans des zones ombragées de cette région, Carpenter (1951) observe que les substrats les plus prolifiques pour les culicoïdes sont localisés aux endroits exposés au soleil tout au long de la journée.
31En Alaska, on peut noter la présence de larves de l’espèce Culicoides tristriatulus Hoffman au sein des marais salants, qui sont presque inondés lors de chaque marée haute (Williams, 1951). Les marais salants localisés à proximité des mangroves semblent aussi favorables au développement des larves de Culicoides trinidadensis Hoffman au Panama (Woke, 1954). Les tapis d’algues flottantes dans les zones de marée en Australie semblent favorables au développement larvaire de Culicoides henryi Lee & Reye (Dyce et al., 1965).
32Substrats terrestres. La litière humide de nombreuses forêts boréales semble fréquentée par les larves des espèces C. pulicaris et Culicoides lupicaris Downes & Kettle (Mirzaeva et al., 1976), mais également par les membres du groupe C. obsoletus (Glushchenko et al., 2008). L’espèce C. obsoletus a d’autre part été obtenue à partir d’échantillons de sable, de tas de compost de feuilles et de trous d’arbres (Murray, 1957 ; Kremer, 1965). Remarquons que ces trous d’arbres constituent également les gites larvaires privilégiés pour les espèces Culicoides hoffmani Fox en Jamaïque (Linley et al., 1964), Culicoides borinqueni Fox & Hoffman, Culicoides eadsi Wirth & Blanton et Culicoides jamaicensis Edwards aux Caraïbes (Fox et al., 1944 ; Raccurt, 1984 ; Raccurt et al., 1986), Culicoides fagineus Edwards (Edwards et al., 1939 ; Dzhafarov, 1964 ; Kremer, 1965), Culicoides accraensis (Carter, Ingram & Macfie) en France (Kremer, 1965), Culicoides arboricola Root & Hoffman, Culicoides flukei Jones, Culicoides guttipennis (Coquillett), Culicoides luteovenus Root & Hoffman, Culicoides nanus Root & Hoffman et Culicoides villosipennis Root & Hoffman aux États-Unis (Wirth et al., 1959 ; Jones, 1961 ; Jamnback, 1965), Culicoides angularis Lee & Reye et Culicoides mackerrasi Lee & Reye en Australie (Dyce et al., 1965 ; Kettle et al., 1976), Culicoides annuliductus Vitale, Wirth & Aitken, C. bayano, Culicoides filiductus Vitale, Wirth & Aitken, Culicoides paraensis (Goeldi) et Culicoides lahillei Lutz au Panama (Vitale et al., 1981), ainsi que pour les espèces Culicoides parviscriptus Tokunaga, Culicoides dryadeus Wirth & Hubert, Culicoides macclurei Wirth & Hubert, Culicoides selangorensis Wirth & Hubert, Culicoides shermani Causey, Culicoides clavipalpis Mukerji, Culicoides innoxius Sen & Gupta et Culicoides lansangensis Howarth au Laos et en Malaisie (Howarth, 1985 ; Wirth et al., 1989) ; Chaker (1983) signale d’autre part que Culicoides semimaculatus Clastrier et C. truncorum constituent également des espèces fréquentant exclusivement les trous d’arbres, tout comme Culicoides begueti Clastrier (Kremer, 1965 ; Braverman et al., 1976) et Culicoides haranti Rioux, Descous & Pech (Rioux et al., 1959 ; Kremer, 1965). Plusieurs espèces d’Afrique de l’Ouest (Culicoides austeni Carter, Ingram & Macfie, Culicoides grahamii [Austen], Culicoides bedfordi Ingram & Macfie et Culicoides inornatipennis Ingram & Macfie) et d’Asie du Sud-Est (C. innoxius, C. parviscriptus, C. clavipalpis, Culicoides palpifer Gupta & Ghosh, Culicoides barnetti Wirth & Hubert et Culicoides jacobsoni Macfie) évoluent dans les souches et les tiges pourrissantes de bananiers (Hopkins, 1952 ; Howarth, 1985 ; Wirth et al., 1989). Ce substrat a également été observé comme étant favorable aux espèces C. filiductus et C. bayano au Panama (Vitale et al., 1981), C. borinqueni, Culicoides pusillus Lutz et Culicoides panamensis Barbosa en Haïti (Raccurt, 1984 ; Raccurt et al., 1986), ainsi que C. paraensis (principal vecteur du virus Oropouche) et Culicoides insinuatus Ortiz & Leon au Pérou (Mercer et al., 2003). Les adultes de cette dernière espèce émergent aussi à partir des débris accumulés à l’aisselle des feuilles de palmier et des agrumes en décomposition (Mercer et al., 2003), tandis que C. paraensis s’observe également dans les cabosses vides (Hoch et al., 1986) ou pourrissantes, au Trinidad (Williams, 1964). Les fruits pourrissants permettent le développement larvaire de quelques espèces d’Asie du Sud-Est : C. jacobsoni, Culicoides carpophilus Wirth & Hubert et Culicoides subpalpifer Wirth & Hubert (Wirth et al., 1989). Huit espèces du groupe Culicoides copiosus Root & Hoffman préfèrent se développer au sein de cactus pourrissants, aux États-Unis (Wirth et al., 1960), tandis que Culicoides scoticus Downes & Kettle et C. jacobsoni peuvent évoluer sur des champignons pourris (Buxton, 1960 ; Wirth et al., 1989). Les amas d’algues vertes et la terre sous-jacente semblent pour leur part très favorables aux larves de l’espèce C. festivipennis en Belgique (Zimmer et al., 2013c). L’espèce C. bayano s’observe quant à elle également dans les débris de feuilles (Vitale et al., 1981). Les larves du groupe C. schultzei évoluent entre les rangées de tomates (Muradov, 1965) et C. festivipennis dans la terre des prairies humides voire inondées (Zimmer et al., 2013c).
33Substrats anthropiques liés à l’élevage. Les exploitations agricoles génèrent des micro-habitats anthropiques ou directement liés à l’élevage, particulièrement favorables au développement larvaire des principaux vecteurs des virus de la FCO et de SB au Nord de l’Europe (Zimmer et al., 2008a ; Zimmer et al., 2013c). Les espèces C. obsoletus et C. scoticus sont ainsi abondantes dans les résidus d’ensilage de diverses natures (Zimmer et al., 2008a ; Zimmer et al., 2013a) ; C. scoticus a également été observée en France dans la boue d’ornières (Kremer, 1965) et C. obsoletus aux États-Unis dans de la paille contaminée par des matières fécales et dans des tas de fumier (Weinburgh et al., 1962). Les tas de fumier hébergent aussi les larves de l’espèce asiatique Culicoides orientalis Macfie (Wirth et al., 1989). L’association entre certaines larves du genre Culicoides et la contamination fécale est étroite et connue, en particulier pour les espèces présentant un intérêt médical ou vétérinaire, liées à des milieux à haute teneur en matière organique. Les espèces C. chiopterus et C. dewulfi fréquentent ainsi les bouses bovines (Kremer, 1965 ; Zimmer et al., 2008a ; Zimmer et al., 2013c), tout comme l’espèce australienne Culicoides brevitarsis Kieffer (Cannon et al., 1966 ; Campbell et al., 1976 ; Bishop et al., 1994). Bishop et al. (1996) ont montré que la ponte de C. brevitarsis est principalement réalisée dans la partie supérieure de la bouse, mais que les larves se déplacent verticalement au cours du temps de façon à privilégier les zones dont l’humidité est élevée. En Afrique du Sud, les larves de l’espèce Culicoides bolitinos Meiswinkel (dont l’intervention dans la transmission des virus de la FCO et de la PE a été démontrée [Meiswinkel et al., 2003]) se développent au sein des bouses de vaches, de buffles et de gnous (Meiswinkel et al., 2003). Les excréments d’éléphants sont pour leur part favorables au développement de C. kisangkini et Culicoides flavipunctatus Kitaoka au Laos (Howarth, 1985 ; Wirth et al., 1989). Selon Meiswinkel et al. (2003), les larves coprophiles se développent indépendamment de l’humidité du sol et de sa qualité. Plusieurs études visant à collecter des échantillons de substrat et à les incuber notent toutefois l’absence de larves de culicoïdes au sein de certaines bouses échantillonnées. L’explication avancée est que ce substrat a été préalablement pulvérisé par les agriculteurs avec des insecticides afin de prévenir la reproduction des mouches (Uslu et al., 2007). Jones (1961) ainsi que Kline et al. (1985) ont, d’autre part, montré que l’espèce Culicoides variipennis (Coquillett), vecteur du virus de la FCO aux États-Unis, fréquente la boue contaminée par des fèces, tout comme l'espèce qui transmet Onchocerca reticulata Diesing aux chevaux en Angleterre, C. nubeculosus (Downes, 1950). Remarquons que cette dernière espèce est parfois associée aux espèces C. riethi et C. puncticollis en Turquie, dans les habitats présentant de riches contenus organiques (Uslu et al., 2007). À Chypre, l’espèce C. circumscriptus marque sa préférence pour les flaques d’eau contaminées par des excréments (Mellor et al., 1979). Au Danemark, les deux espèces C. punctatus et C. pulicaris ont quant à elles émergé d’échantillons provenant d’un champ pâturé humide présentant du fumier (Kirkeby et al., 2009). Les larves de l’espèce C. imicola ont été identifiées en Sardaigne par Delrio et al. (2002) au sein de deux biotopes enrichis en effluents d’élevage : les zones boueuses provenant de fuites d’eau aux abreuvoirs et les sols saturés environnant les étangs.
34Un habitat favorable au développement larvaire des deux espèces constituant le complexe C. obsoletus/C. scoticus (considérés comme étant les vecteurs majeurs du virus de la FCO en Europe du Nord [Mehlhorn et al., 2007 ; Carpenter et al., 2008]) a même été identifié en Belgique à l’intérieur des bâtiments d’élevage : la bouse séchée collée aux murs d’une étable bovine et résultant de l’élimination partielle de la litière usagée (Zimmer et al., 2010). Cette observation suggère que ces moucherons piqueurs sont susceptibles de compléter leur cycle de vie dans les bâtiments d’élevage et pourrait donc expliquer la persistance du virus de la FCO d’année en année, malgré des hivers assez rigoureux. Notons que ce dernier gite larvaire a ultérieurement été confirmé en France par Ninio et al. (2011).
3. Conclusion et perspectives
35Les moucherons du genre Culicoides peuvent évoluer dans une large gamme de gites larvaires (Mullen et al., 1988). Les habitats permanents participent au maintien des populations de culicoïdes et alimentent ainsi les biotopes temporaires. Ces derniers, que l’on observe en grand nombre tout au long de l’année, interviennent dans l’accroissement de ces populations et favorisent leur dispersion (Braverman et al., 1974). Chacune des espèces de culicoïdes citées (ainsi que les nombreuses autres non abordées dans cet article) possède en effet sa propre gamme de micro-habitats répondant à ses besoins. Certaines espèces présentent de ce fait une plasticité dans l’utilisation de l’habitat, d’autres par contre sont écologiquement très exigeantes. Les gites larvaires énumérés ne constituent de ce fait qu’une synthèse des habitats actuellement connus pour les principales espèces de culicoïdes. Bien d’autres restent encore à découvrir et à caractériser, en particulier pour certaines régions du globe. Il est de ce fait primordial de s’inspirer des habitats larvaires actuellement identifiés afin d’orienter les futures recherches sur l’écologie des culicoïdes et ainsi mettre en évidence les gites larvaires des espèces présentant un intérêt médical ou vétérinaire, bien souvent encore trop méconnues. Les signaux chimiques impliqués dans la localisation des sites de ponte sont de plus peu connus et encore peu étudiés (González et al., 2013).
36Les gites larvaires de plusieurs espèces d’intérêt sont en effet des micro-habitats particuliers très localisés, dans lesquels les larves ont tendance à s’agréger. La mise en place de mesures d’assainissement (telles que l’élimination de la litière usagée, du fumier et des résidus alimentaires) couplée à des pratiques agricoles adaptées et à une bonne gestion des effluents d’élevage, voire une éventuelle application ciblée de larvicides, pourraient être efficaces et réalisables à moindre cout, tout en limitant les dommages causés à l’environnement. Ces mesures pourraient ainsi rendre possible le développement de stratégies de lutte contre les larves de culicoïdes afin de favoriser le contrôle des populations de vecteurs et ainsi renforcer les campagnes de vaccination (et autres méthodes) visant à lutter contre les principaux pathogènes que ces diptères sont capables de véhiculer et de transmettre. Cependant, cela nécessite la connaissance précise de l’écologie larvaire des principales espèces vectrices appartenant au genre Culicoides, la mise en évidence des caractéristiques physico-chimiques des micro-habitats fréquentés par les larves, la compréhension du comportement de ponte des femelles adultes et l’étude de la tolérance des larves aux variations des conditions au sein de leurs gites larvaires respectifs. Ces éléments renferment pourtant encore de nombreuses inconnues. La mise en évidence de la flore caractérisant ces gites larvaires pourrait de plus permettre l’identification aisée des sites favorables au développement de ces moucherons.
37Les modifications environnementales réalisées par l’homme dans certaines régions du globe, telles que l’extension des zones de pâturage ou d’habitat liée à l’intensification des pratiques agricoles, pourraient d’autre part favoriser la colonisation et l’abondance de certains insectes vecteurs de pathogènes, dont notamment quelques espèces de culicoïdes.
38En ce qui concerne les virus et parasites véhiculés par les culicoïdes, leur devenir est sans doute lié, de près ou de loin, à l’activité humaine et au réchauffement climatique (Wittmann et al., 2000). Ces phénomènes pourraient en effet augmenter l’aire de distribution et l’efficacité de transmission d’un vecteur actuel, ou encore favoriser l’acquisition de compétences vectorielles par d’autres espèces de culicoïdes. Le risque de voir apparaitre d’autres sérotypes, voire même des recombinaisons virales lorsque plusieurs sérotypes sont présents dans une même région, est également bien présent.
Bibliographie
Balenghien T. et al., 2008. Culicoides chiopterus: confirmation of its status as potential vector of bluetongue virus in Europe, http://www.promedmail.org, archive number 20080403.1222, (27/05/14).
Becker P., 1958. The behaviour of larvae of Culicoides circumscriptus Kieffer (Diptera: Ceratopogonidae) towards light stimuli as influenced by feeding, with observations on the feeding habits. Bull. Entomol. Res., 49, 785-802.
Bidlingmayer W.L., 1957. Studies on Culicoides furens at Vero Beach. Mosq. News, 17(4), 292-294.
Birley M.H. & Boormann J.P.T., 1982. Estimating the survival and biting rates of haematophagous insects with particular reference to Culicoides obsoletus group in Southern England. J. Anim. Ecol., 51, 135-148.
Bishop A.L. & McKenzie H.J., 1994. Overwintering of Culicoides spp. (Diptera: Ceratopogonidae) in the Hunter Valley, New South Wales. J. Aust. Entomol. Soc., 33, 159-163.
Bishop A.L., McKenzie H.J., Barchia I.M. & Harris A.M., 1996. Effect of temperature regimes on the development, survival and emergence of Culicoides brevitarsis Kieffer (Diptera: Ceratopogonidae) in bovine dung. Aust. J. Entomol., 35, 361-368.
Bishop A.L., McKenzie H.J., Barchia I.M. & Spohr L.J., 2000. Moon phase and other factors affecting light-trap catches of Culicoides brevitarsis Kieffer (Diptera, Ceratopogonidae). Aust. J. Entomol., 39, 29-32.
Blackwell A. & King F.C., 1997. Vertical distribution of Culicoides impunctatus larvae. Med. Vet. Entomol., 11, 45-48.
Borkent A., 2012. World species of biting midges (Diptera: Ceratopogonidae), http://wwx.inhs.illinois.edu/files/8413/4219/9566/CeratopogonidaeCatalog.pdf, (27.05.14).
Braverman Y., 1978. Characteristics of Culicoides (Diptera, Ceratopogonidae) breeding places near Salisbury, Rhodesia. Ecol. Entomol., 3, 163-170.
Braverman Y., Galun R.M. & Ziv M., 1974. Breeding sites of some Culicoides species (Diptera: Ceratopogonidae) in Israël. Mosq. News, 34(3), 303-308.
Braverman Y., Boorman J., Kremer M. & Delécolle J.-C., 1976. Faunistic list of Culicoides (Diptera, Ceratopogonidae) from Israel. Cah. Orstom Sér. Entomol. Méd. Parasitologie, 14(3), 179-185.
Braverman Y. & Chechik F., 1996. Air streams and the introduction of animal diseases borne on Culicoides (Diptera, Ceratopogonidae) into Israël. Rev. Sci. Techn. Off. Int. Épizootie, 15, 1037-1052.
Buxton P.A., 1960. British Diptera associated with fungi. III. Flies of all families reared from about 150 species of fungi. Entomol. Mon. Mag., 96, 61-94.
Callot J. & Kremer M., 1969. Description d’un Culicoides nouveau C. jumineri (Dipt. Cératopogonidé) trouvé en Tunisie. Bull. Soc. Pathol. Exot., 62, 1112-1118.
Campbell M.M. & Kettle D.S., 1976. Number of adult Culicoides brevitarsis Kieffer (Diptera: Ceratopogonidae) emerging from bovine dung exposed under different conditions in the field. Aust. J. Zool., 24, 75-85.
Cannon L.R.G. & Reye E.J., 1966. A larval habitat of the biting midge Culicoides brevitarsis Kieffer (Diptera: Ceratopogonidae). J. Entomol. Soc. Queensland, 5, 7-9.
Carpenter S.J., 1951. Studies of Culicoides in the Panama Canal Zone (Diptera, Heleidae). Mosq. News, 11(4), 202-208.
Carpenter S. et al., 2008. Experimental infection studies of UK Culicoides species midges with bluetongue virus serotypes 8 and 9. Vet. Rec., 163(20), 589-592.
Carrasquilla M.C. et al., 2010. Breeding sites of Culicoides pachymerus Lutz in the Magdalena River basin, Colombia. Mem. Inst. Oswaldo Cruz, 105(2), 216-219.
Chaker E., 1983. Contribution à l’étude de la morphologie et de la diagnose des larves de Culicoides (Diptera, Ceratopogonidae). Thèse de doctorat : Université Louis Pasteur de Strasbourg (France).
De Regge N. et al., 2012. Detection of Schmallenberg virus in different Culicoides spp. by real-time RT-PCR. Transboundary Emerging Dis., 59(6), 471-475.
Delrio G. et al., 2002. Osservazioni in Sardegna sulla dinamica di popolazione di Culicoides imicola Kieffer vettore della bluetongue. In: Delrio G. et al., eds. Atti XIX Congresso Nazionale Italiano di Entomologia, 10-15 June, 2002, Catania, Italia, 1089-1094.
Dijkstra E. et al., 2008. Culicoides chiopterus as a potential vector of bluetongue virus in Europe. Vet. Rec., 162, 422.
Dorsey C.K., 1947. Population and control studies of the Palau gnat on Peleliu, Western Caroline Islands. Econ. Entomol., 40, 805-814.
Downes J.A., 1950. Habits and life-cycle of Culicoides nubeculosus (Meigen). Nature, 166, 510-511.
Du Toit R.M., 1944. The transmission of blue-tongue and horse sickness by Culicoides. Onderstepoort J. Vet. Sci. Anim. Ind., 19, 7-16.
Dubrovskaya V.V., 1980. Breeding places of blood-sucking Ceratopogonidae in the steppe zone of the Ukraine. Med. Parazit., 49, 46-51.
Dzhafarov S.M., 1964. Blood-sucking midges (Diptera, Heleidae) of the Transcaucasus. Moscow: Akademija Nauk Azerbaidzanskoi SSR, Instituta Zoologicheskiy.
Dzhafarov S.M., 1976. Biting midges (Diptera: Heleidae) of Transcaucasus (morphology, biology, ecology, geographical distribution and harmfulness, control, fauna of the genera Culicoides, Leptoconops and Lasiohelea). Cairo: Franklin Book Programs.
Dyce A.L. & Murray M.D., 1965. Notes on the pupal behavior and collection of larvae and pupae of some Australian Culicoides (Diptera: Ceratopogonidae). Aust. J. Entomol., 5(1), 37-39.
Edwards F.W., Oldroyd M.A. & Smart J., 1939. Family Ceratopogonidae. In: Edwards F.W., Oldroyd M.A. & Smart J., eds. British blood-sucking flies. London: British Museum, 25-50.
Forratini O.P., Rabello E.X. & Pattoli D., 1957. A brief note on breeding places of Culicoides in Sao Vicente, Brazil. Mosq. News, 17(4), 312-313.
Fox I. & Hoffman W.A., 1944. New neotropical biting sandflies of the genus Culicoides (Diptera: Ceratopogonidae). P. R. J. Public Health Trop. Med., 20, 108-111.
Foxi C. & Delrio G., 2010. Larval habitats and seasonal abundance of Culicoides biting midges found in association with sheep in northern Sardinia, Italy. Med. Vet. Entomol., 24, 199-209.
Glushchenko N.P. & Mirzaeva A.G., 2008. Larval habitats and species composition of bloodsucking midges (Diptera: Ceratopogonidae) in mountain landscapes of South Siberia and the Russian Far East. Russ. Entomol. J., 17(1), 63-70.
Goetghebuer M., 1952. Le genre Culicoides (Diptères, Cératopogonidés) et ses représentants en Belgique. Biol. Jaarb., 19, 185-191.
González M. et al., 2013. A survey of Culicoides developmental sites on a farm in northern Spain, with a brief review of immature habitats of European species. Vet. Parasitol., 191, 81-93.
Havelka P., 1978. Ceratopogonidae. In: Illies J., ed. Limnofauna Europaea. Stuttgart, Deutschland: Gustav Fischer Verlag, 441-458.
Hendry G. & Godwin G., 1988. Biting midges in Scottish forestry: a costly irritant or a trivial nuisance? Scott. For., 42, 113-119.
Hill M.A., 1947. The life cycle and habits of Culicoides impunctatus Goetghebuer and Culicoides obsoletus Meigen, with some observations on the life cycle of Culicoides odibilis Austen, Culicoides pallidicornis Kieffer, Culicoides cubitalis Edwards and Culicoides chiopterus Meigen. Ann. Trop. Med. Parasitol., 41, 55-115.
Hoch A.L., Roberts D.R. & Pinheiro F., 1986. Breeding sites of Culicoides paraensis and options for control by environmental management. PAHO Bull., 20, 284-292.
Hoffmann B. et al., 2012. Novel Orthobunyavirus in cattle, Europe, 2011. Emerg. Infect. Dis., 18(9), 469-472.
Hopkins C.A., 1952. Notes on the biology of certain Culicoides studied in the British Cameroons, West Africa, together with observations on their possible role as vectors of Acanthocheilonema perstans. Ann. Trop. Med. Parasitol., 46, 165-172.
Howarth F.G., 1985. Biosystematics of the Culicoides of Laos (Diptera: Ceratopogonidae). Int. J. Entomol., 27, 1-96.
Jamnback H., 1965. The Culicoides of New York State. N. Y. State Mus. Sci. Serv. Bull., 399, 1-154.
Jamnback H. & Wall W.J., 1958. A sampling procedure for Culicoides melleus (Coq.) (Diptera: Heleidae) with observations on the life histories of two coastal Culicoides. Mosq. News, 18(2), 85-88.
Jones R.H., 1961. Observations on the larval habitats of some North American species of Culicoides. Ann. Entomol. Soc. Am., 54(5), 702-710.
Kettle D.S., 1961. A study of the association between moorland vegetation and breeding sites of Culicoides (Diptera, Ceratopogonidae). Bull. Entomol. Res., 52, 381-411.
Kettle D.S., 1962. The bionomics and control of Culicoides and Leptoconops (Diptera, Ceratopogonidae = Heleidae). Annu. Rev. Entomol., 7, 401-418.
Kettle D.S., 1977. Biology and bionomics of blood-sucking ceratopogonids. Annu. Rev. Entomol., 22, 33-51.
Kettle D.S. & Lawson J.W.H., 1952. The early stages of British biting midges Culicoides Latreille (Diptera: Ceratopogonidae) and allied genera. Bull. Entomol. Res., 43, 421-467.
Kettle D.S., Parish R.H. & Parish J., 1959. Further observations on the persistence of larvicides against Culicoides and a discussion on the interpretation of population changes in the untreated plots. Bull. Entomol. Res., 50, 63-80.
Kettle D.S. & Elson M.M., 1976. The immature stages of some Australian Culicoides Latreille (Diptera: Ceratopogonidae). J. Aust. Entomol. Soc., 15, 303-332.
Kirkeby C., Bodker R., Stockmarr A. & Enoe C., 2009. Association between land cover and Culicoides (Diptera: Ceratopogonidae) breeding sites on four Danish cattle farms. Entomol. Fenn., 20(4), 228-232.
Kline D.L. & Greiner E.C., 1985. Observations on larval habitats of suspected Culicoides vectors of bluetongue virus in Florida. Prog. Clin. Biol. Res., 178, 221-227.
Kluiters G. et al., 2013. Modelling the spatial distribution of Culicoides biting midges at the local scale. J. Appl. Ecol., 50, 232-242.
Konurbayev E.O., 1965. Biting midges (Diptera: Heleidae) of the Issyk-kul depression in Kirghizia. Entomol. Rev., 44, 75-78.
Kremer M., 1965. Contribution à l’étude du genre Culicoides Latreille particulièrement en France. Paris : Paul Lechevalier (Encyclopédie Entomologique Série A - XXXIX).
Kremer M., Rieb J.P. & Rebholtz C., 1978. Ecology of the ceratopogonids of the Alsace plain. I. The genus Culicoides in the humid soils of the Ried. Ann. Parasitol. Hum. Comparée, 53(1), 101-115.
Lardeux F.J.R. & Ottenwaelder T., 1997. Density of larval Culicoides belkini (Diptera: Ceratopogonidae) in relation to physicochemical variables in different habitats. J. Med. Entomol., 34(4), 387-395.
Lee D.J. & Reye E.J., 1953. Australasian Ceratopogonidae (Diptera, Nematocera). Part VI. Australian species of Culicoides. Proc. Linn. Soc. N.S.W., 77(5-6), 369-394.
Linley J.R. & Kettle D.S., 1964. A description of the larvae and pupae of Culicoides furens Poey, and Culicoides hoffmani Fox (Diptera, Ceratopogonidae). Ann. Mag. Nat. Hist., 7, 129-149.
Lubega R. & Khamala P.M., 1976. Larval habitats of common Culicoides Latreille (Diptera, Ceratopogonidae) in Kenya. Bull. Entomol. Res., 66, 421-425.
Lutz A., 1912. Contribuiçao para o estudo das “Ceratopogoninas” hematofagas encontradas no Brazil. Mem. Inst. Oswaldo Cruz, 4, 1-32.
Lutz A., 1913. Contribuicao para o estudo das Ceratopogoninas hematofagas do Brazil. Mem. Inst. Oswaldo Cruz, 5, 45-73.
Mehlhorn H. et al., 2007. First occurrence of Culicoides obsoletus-transmitted bluetongue virus epidemic in Central Europe. Parasitol. Res., 101, 219-228.
Meiswinkel R. & Paweska J.T., 2003. Evidence for a new field Culicoides vector of African horse sickness in South Africa. Prev. Vet. Med., 60, 243-253.
Meiswinkel R., Van Rijn P., Leijs P. & Goffredo M., 2007. Potential new Culicoides vector in northern Europe. Vet. Rec., 161, 564-565.
Mellor P.S., 1990. The replication of bluetongue virus in Culicoides vectors. Curr. Top. Microbiol. Immunol., 162, 143-161.
Mellor P.S. & Pitzolis G., 1979. Observations on breeding sites and light trap collections of Culicoides during an outbreak of bluetongue in Cyprus. Bull. Entomol. Res., 69, 229-234.
Mellor P.S., Boorman J.P.T., Wilkinson P.J. & Martinez-Gomez F., 1983. Potential vectors of bluetongue and African horse sickness viruses in Spain. Vet. Rec., 112(10), 229-230.
Mellor P.S., Booman J. & Baylis M., 2000. Culicoides biting midges: their role as arbovirus vectors. Annu. Rev. Entomol., 45, 307-340.
Mercer D.R., Spinelli G.R., Watts D.M. & Tesh R.B., 2003. Biting rates and developmental substrates for biting midges (Diptera: Ceratopogonidae) in Iquitos, Peru. J. Med. Entomol., 40(6), 807-812.
Mirzaeva A.G., Glushchenko N.P. & Zolotarenko G.S., 1976. Biogeographical-ecological groupings of blood-sucking ceratopogonids (Diptera, Ceratopogonidae) of Siberia. In: The fauna of Helminths and arthropods of Siberia (Faunagel’mintov I chlenistonogikh Sibiri). Trudy Biologicheskogo Instituta, SibirskoeOtdelenie, Akademiya Nauk SSSR, 277-290.
Mullen G.R. & Hribar L.J., 1988. Biology and feeding behavior of ceratopogonid larvae (Diptera: Ceratopogonidae) in North America. Bull. Soc. Vector Ecol., 13, 60-81.
Muradov S.M., 1965. The biting midges (Diptera: Heleidae) of Turkmenia, fauna and ecology. Entomol. Rev., 44, 70-74.
Murray W.S., 1957. Investigations on the bionomics of Culicoides obsoletus (Meigen) and other biting midges at Mount Solon, Virginia. Mosq. News, 17(2), 77-82.
Murray M.D., 1991. The seasonal abundance of female biting-midges, Culicoides brevitarsis (Diptera, Ceratopogonidae), in coastal southeastern Australia. Aust. J. Zool., 39, 333-342.
Myers J.G., 1935. The sandfly pest (Culicoides). Trop. Agric., 12, 71-73.
Nakamura R., Matsuhashi A., Yamashita N. & Yamamoto T., 1956. Studies on “Kasen” of horses in Hokkaido. III. Research on the actual state of the disease. Jpn. J. Vet. Res., 4, 81-88.
Nevill E.M., 1967. Biological studies on some South African Culicoides species (Diptera: Ceratopogonidae) and the morphology of their immature stages. PhD thesis: Pretoria University (South Africa).
Ninio C., Augot D., Dufour B. & Depaquit J., 2011. Emergence of Culicoides obsoletus from indoor and outdoor breeding sites. Vet. Parasitol., 183, 125-129.
Painter R.H., 1926. The biology, immature stages, and control of the sandflies (biting Ceratopogoninae) at Puerto Castilla, Honduras. Ann. Rep. Med. Dep. United Fruit Co., 15, 245-262.
Raccurt C.P., 1984. Contribution à l’étude des Culicoides (Diptera: Ceratopogonidae) de la République d’Haïti (Grandes Antilles). Port au Prince : Faculté de Médecine, Université d’État.
Raccurt C.P., Rebholtz C. & Delécolle J.-C., 1986. Culicoides haitiensis et Culicoides borinqueni en Haïti. 2. Notes écologiques et chorologiques (Dipt. Ceratopogonidae). Bull. Soc. Entomol. Fr., 91(3-4), 125-130.
Rasmussen L.D. et al., 2012. Culicoids as vectors of Schmallenberg virus. Emerg. Infect. Dis., 18(7), 1204-1206.
Rieb J.-P., 1982. Contribution à la connaissance de l’écologie et de la biologie des Cératopogonidés (Diptera, Nematocera). Thèse de doctorat : Université Louis Pasteur de Strasbourg (France).
Riek R.F., 1954. Studies on allergic dermatitis of the horse “Queensland Itch”. The etiology of the disease. Aust. J. Agric. Res., 5, 109-129.
Rioux J.A., Descous S. & Pech J., 1959. Un nouveau Cératopogonide arboricole : Culicoides haranti n. sp. (Diptera, Heleidae). Ann. Parasitol. Hum. Comparée, 34(3), 432-438.
Saegerman C. et al., 2008. Fièvre catarrhale ovine : l’Europe au carrefour de l’enzootie. Point Vet., 290, 41-47.
Takken W. et al., 2008. The phenology and population dynamics of Culicoides spp. in different ecosystems in The Netherlands. Prev. Vet. Med., 87, 41-54.
Thiry E. et al., 2006. Bluetongue in northern Europe. Vet. Rec., 159(10), 327.
Uslu U. & Dik B., 2006. Vertical distribution of Culicoides larvae and pupae. Med. Vet. Entomol., 20, 350-352.
Uslu U. & Dik B., 2007. Description of breeding sites of Culicoides species (Diptera: Ceratopogonidae) in Turkey. Parasite, 14, 173-177.
Velthuis A.G. et al., 2010. Financial consequences of the Dutch bluetongue serotype 8 epidemics of 2006 and 2007. Prev. Vet. Med., 93(4), 294-304.
Veronesi E. et al., 2013. Implicating Culicoides biting midges as vectors of Schmallenberg virus using semi-quantitative RT-PCR. PLoS ONE, 8(3), e57747, doi:10.1371/journal.pone.0057747.
Vitale G.C., Wirth W.W. & Aitken T.H.G., 1981. New species and records of Culicoides reared from arboreal habitats in Panama, with a synopsis of the debilipalpis Group (Diptera: Ceratopogonidae). Proc. Entomol. Soc. Washington, 83, 140-159.
Wanson M., 1935. Note sur les trous de crabes, gîtes larvaires. Ann. Soc. Belg. Méd. Trop., 15(4), 575-585.
Weinburgh H.B. & Pratt H.D., 1962. Culicoides, public health importance, biology, survey, and control. Atlanta, Ga, USA: U.S. Department of Health, Education and Welfare, Public Health Service, Communicable Disease Center.
Williams R.W., 1951. Observations on the bionomics of Culicoides tristriatulus Hoffman with notes on C. alaskensis Wirth and other species at Valdez, Alaska, summer 1949. Ann. Entomol. Soc. Am., 44, 173-183.
Williams R.W., 1964. Observations on habitats of Culicoides larvae in Trinidad, W.I. (Diptera: Ceratopogonidae). Ann. Entomol. Soc. Am., 57(4), 462-466.
Wirth W.W. & Blanton F.S., 1959. Biting midges of the genus Culicoides from Panama (Diptera: Heleidae). Proc. U.S. Nat. Mus., 109, 237-482.
Wirth W.W. & Hubert A.A., 1960. Ceratopogonidae (Diptera) reared from cacti with a review of the copiosus group of Culicoides. Ann. Entomol. Soc. Am., 53, 639-658.
Wirth W.W. & Hubert A.A., 1989. The Culicoides of Southeast Asia (Diptera: Ceratopogonidae). Mem. Am. Entomol. Inst., 44, 1-508.
Wittmann E.J. & Baylis M., 2000. Climate change: effects on Culicoides-transmitted viruses and implications for the UK. Vet. J., 160(2), 107-117.
Woke P., 1954. Observations on Central American biting midges (Diptera: Heleidae). Ann. Entomol. Soc. Am., 47, 61-74.
Zimmer J.-Y. et al., 2008a. Breeding sites of bluetongue vectors in northern Europe. Vet. Rec., 162(4), 131.
Zimmer J.-Y. et al., 2008b. Distribution of potential bluetongue vectors on Belgium farms. Vet. Rec., 162(21), 700.
Zimmer J.-Y., Losson B., Saegerman C. & Haubruge É., 2009. Écologie et distribution des espèces de Culicoides Latreille 1809 (Diptera: Ceratopogonidae) à proximité d’une exploitation bovine en Belgique. Ann. Soc. Entomol. Fr., 45(3), 393-400.
Zimmer J.-Y., Saegerman C., Losson B. & Haubruge É., 2010. Breeding sites of bluetongue virus vectors, Belgium. Emerg. Infect. Dis., 16(3), 575-576.
Zimmer J.-Y. et al., 2013a. Chemical composition of silage residues sustaining the larval development of the Culicoides obsoletus/Culicoides scoticus species (Diptera: Ceratopogonidae). Vet. Parasitol., 191, 197-201.
Zimmer J.-Y. et al., 2013b. Are bogs reservoirs for emerging disease vectors? Evaluation of Culicoides populations in the Hautes Fagnes Nature Reserve (Belgium). PLoS ONE, 8(6), e66893. doi: 10.1371/journal.pone.0066893.
Zimmer J.-Y. et al., 2013c. Breeding sites and species association of the main bluetongue and Schmallenberg virus vectors, the Culicoides species (Diptera: Ceratopogonidae), in northern Europe. Ann. Soc. Entomol. Fr., 49(3), 335-344.
Zimmer J.-Y. et al., 2014. Comparaison des populations de Culicoides Latreille 1809 (Diptera : Ceratopogonidae) présentes au sein d'une bergerie belge et d'une prairie ovine associée. Ann. Soc. Entomol. Fr., 49(4), 446-459.






